Expresie a lokalizácie kaspázy 1, superoxiddismutázy (D-mutázy) a kalretinínu v placente a bazálnej decidue pri preeklampsii
Caspase 1, Superoxiddismutase (D-mutase) and Calretinin Expression in the Placenta and in the Basal Decidua in Preeclampsia
Objective:
To determine new data related to the expression of caspase 1, superoxiddismutase and calretinin in the placenta and basal decidua in preeclampsia.
Material and methods:
Placental and basal decidua samples from 9 preeclamptic and 9 normotensive controls were analyzed using expressions of caspase 1, superoxiddismutase and calretinin assesed by immunohistochemistry.
Results:
Caspase 1 was expressed in placental syncythium in preeclampsia constantly, while in the control group the expression was weak or absent. In Langhans cells, in fetal sinusoidal capillary endothelia and in Hofbauer cells the expression was equal in both groups. Stronger expression was observed in stromal myofibroblasts in preeclampsia. In preeclampsia, expression of superoxiddismutase in syncythium, in Langhans cells and in decidual cells was weaker. Calretinin was not found in any placental structure. Sporadically, calretinin was expressed in the interstitial extravillous trophoblast cells, in decidual cells and in spiral arterioles in preeclampsia.
Conclusion:
The obtained morphological data correlating with some clinical and biochemical features contribute to understanding of the molecular background of preeclampsia etiopathogenesis.
Key words:
preeclampsia – placenta – basal decidua – caspase 1 – superoxiddismutase – calretinin
:
I. Jurkovič 1; A. Böör 1; P. Kočan 1; B. Murín 2
:
Ústav patológie a 2Klinika gynekológie a porodníctva Lekárskej fakulty Univerzity Pavla Jozefa Šafárika, Košice
1
:
Čes.-slov. Patol., 46, 2010, No. 1, p. 8-13
:
Original Article
Cieľ práce:
Získať poznatky o expresii kaspázy 1, superoxiddismutázy a kalretinínu v placente a bazálnej decidue pri preeklampsii.
Materiál a metodika:
Imunohistochemická štúdia s použitím komerčných protilátok proti kaspáze-1, superoxiddismutáze a kalretinínu v súbore 9 placent a vzoriek z bazálnej deciduy z gravidít komplikovaných preeklampsiou a 9 obdobných dvojíc tkaniva z gravidít normotenzných tehotných.
Výsledky:
Kaspáza 1 sa nachádzala pri preeklampsii v syncýciu placenty konštantne, zatiaľ čo v kontrolách bola slabá alebo chýbala. Približne rovnakú expresiu vykazovala v Langhansových bunkách, v jadrách endotelu fetálnych kapilár a v cytoplazme Hofbauerových buniek v obidvoch súboroch. Expresia v myofibroblastoch choriónovej strómy bola silnejšia v prípadoch preeklampsie.
Expresia superoxiddismutázy dosahovala v materiáloch z preeklampsie slabšiu úroveň v syncýciu, Langhansových bunkách ako aj v bunkách deciduy.
Kalretinín nevykázal expresiu v žiadnej štruktúre placenty. V bazálnej decidue z prípadov preeklampsie bol ojedinele prítomný v bunkách intersticiálneho extravilózneho trofoblastu, v deciduálnych bunkách a v špirálovitých artériách.
Záver:
Naše pozorovania sú morfologickým príspevkom do objasňovania molekulového pozadia etiopatogenézy preeklampsie a podporujú jej niektoré klinicko-biochemické rysy.
Kľúčové slová:
preeklampsia – placenta – bazálna decidua – kaspáza 1 – superoxiddismutáza – kalretinín
Spúšťacie mechanizmy preeklampsie, ktorá je celosvetovo hlavnou príčinou materskej a perinatálnej chorobnosti a úmrtnosti, nie sú napriek početným štúdiám dostatočne objasnené (24). Nevyjasnená ostáva zatiaľ aj otázka, prečo sa preeklampsia najčastejšie prejavuje u prvorodičiek (2, 8). Frekvencia jej výskytu v rozvinutých krajinách kolíše od 3 do 10 %.
V poslednom období sa rozvíja čoraz väčšie úsilie o objasnenie komplexných molekulových pomerov počas preeklampsie v kritickej oblasti spojenia placenty s bazálnou deciduou. Autori takýchto štúdií vyvinuli úsilie o topografickú definíciu a funkčnú interpretáciu vo vzťahu k jej etiopatogenéze. Toto je ale oblasť, v ktorej s prihliadnutím na aktuálny stav poznania pôsobí ešte stále veľké množstvo neznámych faktorov a vzťahov a je výzvou k ďalším štúdiám. S podobným zámerom sme uskutočnili aj naše študijné zámery, na ktoré sme použili imunohistochemickú detekciu troch molekúl v placente a bazálnej decidue v čase pôrodu u rodičiek s klinicky plne rozvinutou preeklampsiou.
Materiál a metóda
Na analýzu sme použili súbory 9 placent a 9 excízií z bazálnej deciduy, získanej Bumovou kyretou, pochádzajúcich z gravidít trvajúcich v priemere 31,2 týždňa a komplikovaných preeklampsiou. Kontrolný súbor tvorilo 9 placent a 9 excízií z bazálnej deciduy, získaných od normotenzných tehotných, rodiacich v porovnateľných časových obdobiach gravidity. Kontrolné materiály pochádzali od tehotných s diagnózami hroziacej ruptúry v jazve po jednom alebo viacerých cisárskych rezoch, rigidity pôrodných ciest u starých prvorodičiek, úzkej panvy, hroziacej intrauterínnej asfyxie a panvovej polohy plodu (positio pelvina) (tab. 1). Všetky materiály boli fixované formolom a zaliate do parafínu.
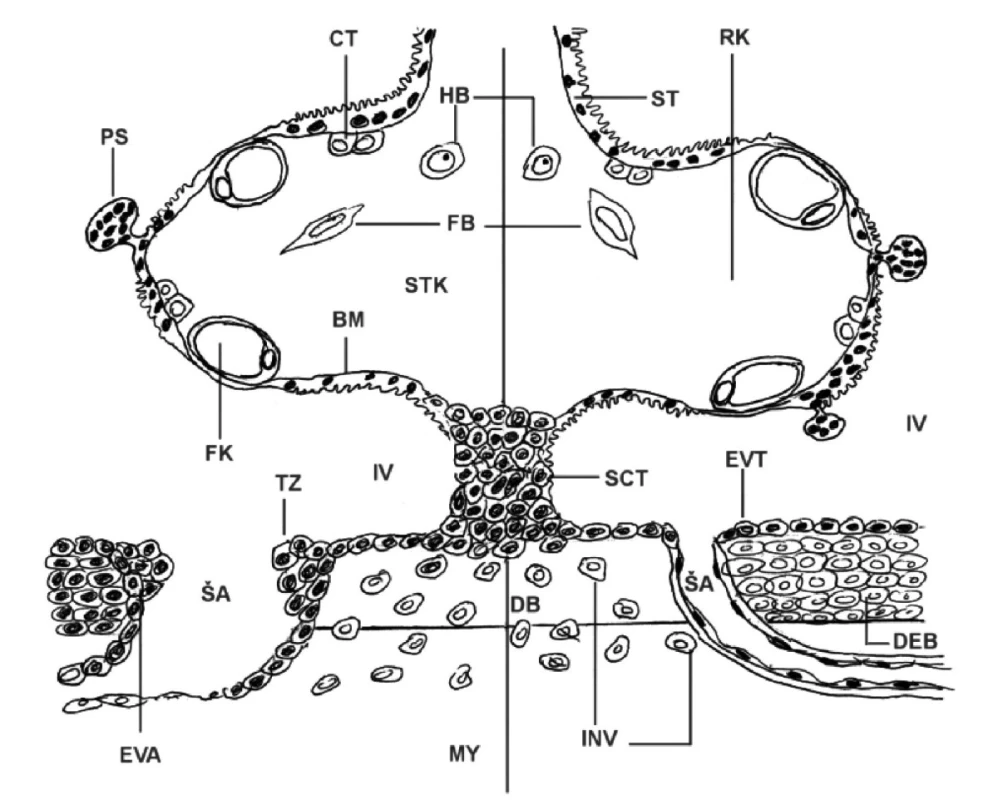
Pre zlepšenie názornosti v kritických štruktúrach placenty a bazálnej deciduy sme si pripravili v roku 2006 pre vlastnú potrebu schému, v ktorej sa dajú jednotlivé nálezy topograficky zaznamenať jednak pri preeklampsii a jednak (na porovnanie) aj v kontrolnom materiáli (obr. 1). Zistili sme, že v princípe rovnaký schématický obraz pre tie isté účely použili vo svojej štúdii nezávisle od nás Huppertz et al. (18).

Imunohistochemické vyšetrenia. Na analýzu vybraných molekúl sme použili výrobcom nariedenú králičiu polyklónovú protilátku proti kaspáze 1, výrobca Neomarkers, katalógové číslo RB-1608-R7, ďalej nariedenú monoklónovú protilátku proti superoxiddismutáze, výrobca Neomarkers, katalógové číslo MS-1754-R7, a králičiu polyklónovú protilátku proti kalretinínu, výrobca Biogenex, katalógové číslo PU 413-UP, v riedení 1 : 30. Ďalej bol použitý kit Ultratech HRP (Immunotech) a ako chromogén bol použitý aminoetylkarbazol firmy DAKO. Revitalizácia sa robila pomocou mikrovlnovej piecky. Rezy sme dofarbili hematoxylínom.
Výsledky imunohistochemických vyšetrení
Kaspáza 1
Placenta. V syncýciu placenty z preeklampsie bola expresia aktivovanej formy kaspázy 1 difúzne prítomná a dosahovala strednú až silnú expresiu v cytoplazme a v jadrách. V kontrolách bola expresia zreteľne slabšia alebo chýbala.V Langhansových bunkách vykazovala cytoplazmovú expresiu bez väčších rozdielov intenzity v obidvoch súboroch. Okrem toho sa zistila cytoplazmová expresia tiež v jadrách myofibroblastov choriónovej strómy, pričom bola častejšia a intenzívnejšia v placentách z preeklampsie. Expresiu kaspázy 1 sme zistili okrem toho aj v jadrách endotélií kapilár choriónových klkov a v cytoplazme Hofbauerových buniek.
Decidua basalis. V cytoplazme buniek intersticiálneho extravilózneho trofoblastu vykazovala kaspáza 1 stredné až vysoké hodnoty expresie v obidvoch súboroch. Pre malý počet nájdených špirálovitých artérií sa prítomnosť alebo chýbanie expresie kaspázy 1 v endovaskulárnom extravilóznom trofoblaste hodnotila ťažšie. V tých preparátoch, v ktorých sa našli špirálovité artérie, nachádzala sa expresia kaspázy 1 iba v preparátoch z preeklampsie. V kontrolných preparátoch bol nález negatívny.Deciduálne bunky vykazovali expresiu v cytoplazme v obidvoch súboroch. Intenzita expresie kaspázy 1 vykazovala trochu nižšie hodnoty v prípadoch z preeklampsie. Expresia kaspázy 1 sa nachádzala v obidvoch súboroch tiež v cytoplazme atrofických buniek endometriálnych žliazok.
Superoxiddismutáza (D-mutáza)
Placenta. Expresiu D-mutázy vo funkcii antioxidanta v jadrách, v cytoplazme alebo v obidvoch súčasne sme našli v syncýciu v kontrolnom súbore v 100 %, zatiaľ čo sa v súbore z preeklampsie vyskytovala podľa predpokladu len v 66 %.V cytoplazme buniek cytotrofoblastu sa expresia D-mutázy nachádzala v obidvoch súboroch, dosahujúc silnejšiu expresiu v kontrolnom materiáli.
S expresiou D-mutázy sme sa v obidvoch súboroch nestretli v stróme choriónových klkov, v Hofbauerových bunkách a v kapilárach.
Decidua basalis. Expresia D-mutázy sa zhodne nachádzala v cytoplazme buniek intersticiálneho extravilózneho trofoblastu v rozlične intenzívnej koncentrácii v obidvoch súboroch. Intenzita cytoplazmovej expresie D-mutázy v bunkách deciduy bola v porovnaní s jej prítomnosťou v kontrolnom súbore zreteľne slabšia.
Kalretinín
Placenta. V placentách z obidvoch súborov sme expresiu kalretinínu nezaznamenali v žiadnej zo sledovaných čiastkových štruktúr (amnion, väzivo choriónovej platničky, syncýcium choriónového stromu, cytotrofoblast klkov, stróma klkov, Hofbauerove bunky a fetálne kapiláry).
Decidua basalis. Sporadicky slabá expresia kalretinínu sa našla v cytoplazme buniek intersticiálneho extravilózneho trofoblastu v obidvoch súboroch. Jadrá endovaskulárneho extravilózneho trofoblastu exprimovali kalretitinín len v prípadoch z preeklampsie a v kontrolnom súbore sa našla expresia iba v cytoplazme ojedinelých deciduálnych buniek bazálnej deciduy ako aj v stenách špirálovitých artérií.
Diskusia
Z doterajších morfologických štúdií etiopatogenézy preeklampsie vyplynul rad dôkazov o tom, že škodliviny, zodpovedné za vznik generalizovanej dysfunkcie alebo aktivácie endotelu tehotných v situácii, charakterizovanej oslabením alebo vyčerpaním vrodenej antioxidačnej aktivity, vznikajú v dôsledku pretrvávajúceho hypoxického poškodenia vilózneho a extravilózneho trofoblastu už od nástupu placentácie, presnejšie v období prechodu od moruly do blastocysty (3, 6, 17, 19, 27, 37). Predpoklad, že konkrétnym miestom vzniku a odlučovania útržkov do materskej cirkulácie je syncyciotrofoblast klkov (tzv. apoptotic shedding) dokázali v prvom a treťom trimenóne experimentálne Huppertz et al. (20). Najlepším dôkazom správneho hodnotenia miesta vzniku škodlivín je fakt, že preeklampsia sa vždy skončí porodením placenty a vylúčením či odstránením bazálnej deciduy (18, 22, 41). Svedectvom o tom, že ľudský plod nie je miestom vzniku škodlivín vyvolávajúcich preeklampsiu je zistenie, že preeklampsia vzniká aj v bezplodovej molárnej tehotnosti. Dysfunkcia materského endotelu spôsobuje hlavné funkčné príznaky preeklampsie, ktorými sú progresívna hypertenzia, edémy, proteinúria, aktivácia hemostázy a funkčné poruchy pečene a obličiek tehotných žien. Súčasne je známe, že chorobný stav vzniká o to častejšie, čím je objem, resp. veľkosť placenty väčšia (11), napr. v rámci molárnej alebo viacpočetnej gravidity. Klinicky sa začína preeklampsia prejavovať ale najskôr až po 20. gestačnom týždni.
Biochemicky sa vyššie uvedené škodliviny definujú ako peroxidy lipidov a ich deriváty (39, 43). Pre kvantitatívne biochemické posúdenie preeklampsie sa považuje za najlepší laboratórny ukazovateľ 8-iso-prostaglandín F2αalebo produkt peroxidácie lipidov, dialdehyd malónu (3, 27, 44). Klinicky sa preeklampsia charakterizuje ako oxidačný stres (29, 30). Klinicko-laboratórne charakteristiky preeklampsie na rozdiel od morfologických nálezov sa dajú sledovať dynamicky.
Morfologicky sprevádza preeklampsiu na svetelnomikroskopickej úrovni nález neprítomnosti tzv. fyziologickej reštrukturalizácie špirálovitých artérií v bazálnej decidue a v myometriu, známej vo fyziologicky prebiehajúcich graviditách alebo v experimente. Ako synonymum termínu „reštrukturalizácia“ špirálovitých artérií možno použiť termíny remodelovanie, transformovanie, fyziologická konverzia, alterácia, pseudovaskulogenéza alebo modifikácia špirálovitých artérií (4, 9, 38). Následne sa v nich znižuje prietok a zvyšuje sa odpor, vzniká akútna ateróza napodobujúca do istej miery aterosklerózu a trombóza (spoločne označované ako deciduálna arteriolopátia). Tieto zmeny zrejme súvisia so súčasným zlyhávaním regulácie optimálnej hĺbky invázie („plytká invázia“) mimoklkového (extravilózneho) cytotrofoblastu v jej dvoch synchrónnych podobách – interšticiálnej a zasahujúcej do stien špirálovitých arteriol a artérií (34). Počas invázie sa stretávajú bunky trofoblastu s materskými stromálnymi a imunitnými bunkami deciduy. Patogeneticky možno uviesť v súvislosti s jeho abnormálnou hĺbkou invázie také fenomény, akými sú abnormálne zacielenie, resp. nasmerovanie trofoblastu, jeho adhézia, degradácia a odpútanie sa od extracelulárneho matrixu a následná invázia či migrácia do deciduy a do jej ciev pod vplyvom hlavného regulátora invázie – TGFß1, nerovnováhy medzi proteázami a ich inhibítormi a v dôsledku účinku ďalších signálov (14, 35). Prvá štúdia, riešiaca kvantitatívne aspekty invázie extravilózneho trofoblastu pomocou morfometrie s presvedčivými výsledkami pochádza od Naickera a spol. (32).
K ďalším morfologickým nálezom pri preeklampsii patria infarkty placenty, Tenneyove-Parkerove zmeny vo forme vystupňovaného počtu púčikov syncýcia, krvácania do bazálnej deciduy a s nimi súvisiaca tvorba retroplacentových hematómov. Ďalším nešpecifickým nálezom pri preeklampsii sú podľa Staneka (42) mikroskopické pseudocysty v chorióne. V syncýciotrofoblaste choriónových klkov sa štatisticky významne často nachádza zvýšený počet apoptotických jadier (2, 7, 20, 23). Pri cielenom vyšetrení myometria boli zaznamenané spazmy špirálovitých artérií, ku ktorým zrejme dochádza práve pre chýbanie ich reštrukturalizácie, a súvisí s pretrvávaním svaloviny špirálovitých artérii umožňujúcej ich uzáver (5). V časti prípadov preeklampsie zistili Goldenberg et al. (13) častejší výskyt laminárnych alebo difúznych leukocytoklastických nekróz bazálnej deciduy.
Zo zápalovej bunkovej populácie v bazálnej decidue dominujú unikátne CD56+ a CD16 - uterínne NK bunky (65–70 %), syntetizujúce a vysielajúce mnohé regulačné signály typu cytokínov, chemokínov a rastových faktorov v mieste implantácie plodového vajca. NK bunky najvýraznejšie zodpovedajú za reguláciu invázie trofoblastu a remodelovania špirálovitých artérií (10, 33). Ďalej sú prítomné monocyty/makrofágy (15–20 %) a malý počet T lymfocytov; je zaujímavé, že B lymfocyty v tejto oblasti prakticky úplne chýbajú (25). Počas invázie extravilózneho trofoblastu do deciduy a myometria vznikajú molekulové kontakty medzi NK bunkami na jednej strane a radom zápalových, imunitných a buniek reprezentujúcich strómu na strane druhej (21).
Mikroskopické zmeny postihnutých tkanív pri preeklampsii sa dajú analyzovať na rozdiel od klinických parametrov žiaľ iba jednorazovo alebo experimentálne. Takéto vyšetrenia sa robia spravidla v období klinicky už rozvinutej a často kritickej fázy preeklampsie.
V literatúre venovanej molekulovým charakteristikám pri preeklampsii sa nachádzajú zistenia o zmenách v expresii molekúl bunkovej adhézie (v anglickom origináli označované ako „cell adhesion molecules“, skrátene CAM). Chemicky ide o superrodinu imunoglobulínov (napr. ICAM-1,-2,-3, VCAM-1 a PECAM-1), a o integríny, selektíny a kadheríny.Expresia molekúl bunkovej adhézie ICAM, VCAM a PCAM bola popísaná pri preeklampsii v lievikovitých rozšíreniach terminálnej dráhy špirálovitých utero-deciduálnych arteriol a artérií (17). Iné študované úseky, resp. štruktúry expresiu nevykazovali. Expresia integrínov je abnormálna tiež pri preeklampsii.
V ďalších prácach bola analyzovaná expresia kysličníka dusného a syntázy NO, kysličníka uhoľnatého, vytváraného hemoxigenázou, metaloproteináz matrixu, p53, kadherínu-6 a kadherínu-11, HtrA1 a ďalších (12, 26). Laboratórne skúmali ďalší autori látky typu tromboxánu, prostaglandínu F2, angiotenzínu, endotelínu a renínu (40), ktoré majú v tejto oblasti vazokonstrikčné vlastnosti a vazodilatačne pôsobiace látky typu prostaglandínu E2 a I2. S expresiou syntázy (syntetázy) kysličníka dusného (eNOS) sa stretli Morris et al. (28) v materiáloch z preeklampsie v syncýciu placenty, v endoteli kapilár terminálnych choriónových klkov placenty a tiež v endoteli špirálovitých artérií bazálnej deciduy. Táto molekula za normálnych podmienok podmieňuje zhlukovanie trombocytov, adhéziu leukocytov, moduluje imúnne reakcie a v placente pôsobí ako dôležitý vazodilatátor. Pri interakcii so superoxidovým radikálom (O2-) vzniká závažný reaktívny peroxynitritový anión (ONOO-) (17). Hemooxygenáza-2 (HO-2) sa izolovane našla pri preeklampsii v interšticiálnom extrachóriovom trofoblaste (24).Metaloproteinázy (MMP) a ich viaceré prirodzené plazmové a tkanivové inhibítory (TIMP) sa nachádzali pri preeklampsii v bunkách interšticiálneho extrachoriónového trofoblastu, ako aj v deciduálnych bunkách. Na rozdiel od fyziologickej gravidity, kde ide o vyvážený stav medzi metaloproteinázami a ich inhibítormi v čase ortologickej invázie extravilózneho cytotrofoblastu bol popísaný oslabený invazívny potenciál nielen pri preeklampsii, ale aj pri včasných potratoch a pri fetálnej hypotrofii (24).
HLA-G (human leukocyte antigen G), ktorý vo fyziologicky prebiehajúcej gravidite sa exprimuje na invadujúcom extrachoriónovom cytotrofoblaste, čím chráni tieto bunky potrebné pre udržanie gravidity pred zničením NK bunkami a IL-2, vykazuje pri preeklampsii zníženú expresiu alebo chýba (24).
Tento krátky prehľad doteraz publikovaných údajov o expresii vybraných molekúl v placente a bazálnej decidue na jednej strane prehlbuje doterajšie poznatky o etiopatogenéze preeklampsie, ale na druhej strane svedčí o medzerách či nekomplexnosti poznania zložitých molekulových pomerov v kritickej oblasti dočasného spojenia placenty s bazálnou deciduou.
Kaspázu-1 ako základný člen skupiny iniciačných kaspáz a súčasne člen kaskádového komplexu ľudských kaspáz sme skúmali pre jej funkčnú príslušnosť ku apoptóze navodenej katalytickým účinkom a tiež pre jej schopnosť aktivovať bunky prirodzenej imunity. Apoptóza slúži na reguláciu počtu buniek počas pretrvávajúceho vývoja štruktúry a funkcie placenty a súčasne vďaka regulátorom apoptózy k zachovaniu homeostázy a tým aj jej trvale adekvátnej funkcie (15, 16, 36). Kaspázu-1 (interleukín 1ß konvertujúci enzým, ICE) sme použili z dvoch dôvodov: prvým z nich je dostupnosť komerčnej protilátky na testovanie jej expresie a druhým dôvodom bolo chýbanie podobných štúdií, ako sme sa o tom mohli presvedčiť z rešerše literatúry. Súčasne sme si boli vedomí, koľko nateraz neznámych detailov sa viaže k apoptotickému fenotypu bunkových zmien v oblasti kotvenia placenty, významných pre vznik a priebeh preeklampsie. V tejto lokalizácii má podľa Ajayiho et al. (1) vzťah expresia kaspázy 1 k migrácii a invázii extravilózneho trofoblastu. Apoptóza zabezpečuje počas celého antenatálneho vývoja človeka nesmierne množstvo úloh ešte pred vznikom embrya, v embryu a tiež v plode až do pôrodu (46, 47). Úloha kaspázy 1 je potrebná aj v príprave mechanizmu pôrodu. Ruka v ruke s týmito úlohami sa podieľa na zabezpečovaní funkcie a obnove trofoblastu placenty a extravilózneho cytotrofoblastu v kritickej zóne zakotvenia placenty. Jej imunohistochemická expresia predstavuje preto súčet viacerých fyziologických krokov či mechanizmov. Z týchto dôvodov zatiaľ nie je možné presnejšie resp. oddelene vymedziť úlohu kaspázy-1 pri preeklampsii priamo v tkanive.
Superoxiddismutáza sa v súvislosti s preeklampsiou očakávateľne využíva v boji s oxidačným stresom vo vystupňovanej miere a predstavuje marker oxidačného stresu (45). Preto je zrejmé, že jej aktivita sa v miestach jej účinku v placente a bazálnej decidue bude nachádzať v zníženom rozsahu v porovnaní s kontrolami, čo sa potvrdilo aj v našich nálezoch. Tento nález je zároveň v korelácii s nálezmi klinicko-biochemických analýz pri preeklampsii.
S opisom úlohy kalretinínu v placente a bazálnej decidue v ortologickej gravidite alebo pri preeklampsii sme sa v literatúre nestretli. V písomníctve sa s ním možno skôr stretnúť pri jeho charakterizovaní ako marker mezoteliómu (31). Preto aj naše pozorovania sporadickej a slabej expresie kalretinínu v jadrách intersticiálneho extravilózneho cytotrofoblastu a súčasne aj v ojedinelých bunkách bazálnej deciduy a v stenách špirálovitých artérií pri preeklampsii považujeme za doteraz neopísané zistenia, o význame ktorých sa vo vzťahu ku preeklampsii nevieme nateraz vyjadriť.
Názov a číslo grantu:VEGA 1/0506/03
Prof. MUDr. Ivan Jurkovič, CSc.
Rastislavova 43
041 90 Košice
Slovenská republika
Telefón: 00421 556 152 595
00421 556 152 592
E-mail: ivan.jurkovic@upjs.sk
Sources
1. Ajayi F., Kongoasa N., Gaffey T. et al.: Elevated expression of serine protease HtrA1 in preeclampsia and its role in trophoblast cell migration and invasion. Amer J Obstet Gynec 199, 2008, 557, e1–558, e10.
2. Allaire AD., Ballenger KA., Wells SR. et al.: Placental apoptosis in preeclampsia. Obstet Gynec. 96, 2000, s. 271–276.
3. Anastasakis E., Papantoniou N., Daskalakis G. et al.: Screening for preeclampsia by oxidative stress markers and uteroplacental blood flow. J Obstet Gynaecol 28, 2008, s. 285–289.
4. Ashley SV., Whitley SJ., Dash PR. et al.: Uterine spiral artery remodeling involves endothelial apoptosis induced by extravillous trophoblasts through Fas/FasL inteactions. Arterioscler Thromb Vasc Biol 25, 2005, s. 102–108.
5. Benirschke K., Kaufmann P.: Pathology of the Human Placenta, 3rd ed., Springer, New York 1996, s. 871.
6. Crocker I.: Gabor Than Award Lecture 2006: Pre-eclampsia and villous trophoblast turnover: Perspectives and possibilities. Placenta, Suppl. A, Trophoblast Research 21, 2007, s. 4–13.
7. DeFalco M., Penta R., Laforgia V. et al.: Apoptosis and human placenta: expression of proteins belonging to different apoptotic pathways during pregnancy. J Exp Clin Cancer Res 24, 2005, s. 25–33.
8. Dekker GA., Sibai BM.: Etiology and pathogenesis of preeclampsia: current concepts. Am J Obstet Gynecol 179, 1998, s. 1359–1375.
9. Dunk C., Petkovic L., Baczyk D. et al.: A novel in vitro model of trophoblast-mediated decidual blood vessel remodeling. Lab Invest 83, 2003, s. 1821–1828.
10. Easterbrook G., Hu Y., Dadelszen P.: The role of decidual natural killer cells in normal implantation and in the pathogenesis of preeclampsia. J Obstet Gynnaecol Can 30, 2008, s. 467–476.
11. Fox H.: Pathology of the Placenta, I. ed. Saunders, London 1978, s. 291.
12. Getsios S., Chen GT., Huang DT., et al.: Regulated expression of cadherin-11 in human extravillous cytotrophoblast undergoing aggregation and fusion in response to transforming growth factor-beta2. J Reprod Fertil 114, 1998, s. 357–363.
13. Goldenberg RL., Faye-Petersen O., Andrews WW., et al.: The Alabama preterm birth study: diffuse decidual leucocytoclastic necrosis of the decidua basalis, a placental lesion associated with preeclampsia, indicated preterm birth and decreased fetal growth. J Matern-Fetal Neonat Med 20, 2007, s. 391–395.
14. Goldman-Wohl D., Yagel S.: Regulation of trophoblast invasion: from normal implantation to preeclampsia. Mol Cell Endocrinol 187, 202 s. 233–238.
15. Gotsch F., Romero R., Chaiworapongsa TP. et al.: Evidence of the involvement of caspase-1 under physiologic and pathologic cellular stress during human pregnancy: a link between the inflammasome and parturition. J Matern Fetal Neonatal Med 21, 2008, s. 605–616.
16. Heazell AE., Lacey HA., Jones CJ.: Effects of oxygen on cell turnover and expression of regulators of apoptosis in human placental trophoblast. Placenta 29, 2008, s. 75–86.
17. Hubel CA.: Oxidative stress in the pathogenesis of preeclampsia. Proc Soc Exp Med Biol. 222, 1999, s. 222–235.
18. Huppertz B., Kingdom J., Camiqqia I., et al.: Hypoxia favours necrotic versus apoptotic shedding of placental syncyciotrophoblast into the maternal circulation. Placenta, 24, 2003, s. 181–190.
19. Huppertz B.: Placental villous trophoblast: the altered ballance between proliferation and apoptosis triggers pre-eclampsia. J Reprod Med Endocrinol 3, 2006, s.103–108.
20. Huppertz B., Kadyrov M., Kingdom JCV.: Apoptosis and its role in the preeclampsia. Am J Obstet Gynec 195, 2006, s. 29–39.
21. Kraus FT., Redline RW., Gersel DJ., et al.: Placental Pathology, AFIP, Washington, 2004, s. 321.
22. Levin RJ., Maynard SE., Qian C., et al.: Circulating angiogenic factors and the risk of preeclampsia. N Engl J Med 350, 2004, s. 672–683.
23. Levy E.: The role of apoptosis in preeclampsia. IMAJ 7, 2005, s. 178–181.
24. Lyall F.: Mechanisms regulating cytotrophoblast invasion in normal pregnancy and preeclampsia. Austr N Zealand Obstet Gynaec 46, 2006, s. 266–273.
25. Matthiesen L., Berg G., Ernerudh J., et al.: Immunology of preeclampsia. Chem Immunol Allergy 89, 2005, s. 49–61.
26. McCalman CD., Getsios S., et al.: Type 2 cadherins in the human endometrium and placenta: their putative roles in human implantation and placentation. Am J Reprod Immunol 39, 1998, s. 96–107.
27. Medrano Rodríguez JC., Yahuaca Mendoza P., Presno Bernal M., et al.: Oxidative stress level and placental histological changes during preeclampsia. Ginecol Obstet Mex 76, 2008, s. 319–326.
28. Morris LH., Sooranna SL., Learmont JG., et al.: Nitric oxid synthase activities in placental tissue from normotensive, preeclamptic and growth retarded pregnancies. Br J Obstet Gynaecol 102, 1995, s. 711–714.
29. Murín B., Lukačín Š.: Etiopatogenéza, rizikové faktory a klasifikácia preeklampsie. Gynekol prax 4, 2006, s. 8–12.
30. Murín B.: Úloha oxidačného stresu v etiopatogenéze preeklampsie. Slov Gynek Pôrod 15, 2008, s. 65–70.
31. Nagata S., Aishima S., Fukuzawa K. et al.: Adenomatoid tumour of the liver. J clin Pathol 61, 2008, s. 777–780.
32. Naicker T., Khedun SM., Moodley J., Pijnenborg R.: Quantitative analysis of trophoblast invasion in preeclampsia. Acta Obstet Gynec Scand 82, 2003, s. 722–729.
33. Ogura Y., Sutterwala FS., Flavell RA.: The inflammasome: first line of immune response to cell stress. Cell 126, 2006, s. 656–662.
34. Ranheim T., Staff AC., Henriksen T.: VEGF mRNA is unaltered in decidual and placental tissues in preeclampsia at delivery. Acta Obstet Gynec Scand 80, 2001, s. 93–98.
35. Salamonsen LA.: Role of proteases in implantation. Rev Reprod 4, 1999, s. 11–22.
36. Saleh M., Green DR.: Caspase-1 inflammasomes: choosing between death and taxis. Cell Death and Differentiation 14, 2007, s. 1559–1560.
37. Sedeek M., Gilbert JS., LaMarca BB. et al.: Role of reactive oxygen species in hypertension produced by reduced uterine perfusion in pregnant rats. Am J Hypertens 21, 2008, s. 1152–1156.
38. Selvaggi L., Ribatti D., Loverro G. et al.: Angiogenesis in pre-eclampsia. Eur J Obstet Gynec 59, 1995, s. 83–89.
39. Serdar Z., Gür E., Develiogýlu O. et al.: Placental and decidual lipid peroxidation and antioxidant defenses in preeclampsia. Lipid peroxidation in preeclampsia. Pathophysiology 9, 2002, s. 21–25.
40. Shah DM., Banu JM., Chirgwin JM., et al.: Reproductive tissue renin gene expression in preeclampsia. Hypert Pregn 19, 2000, s. 341–351.
41. Solomon CG., Seely EW.: Preeclampsia – searching for the cause. N Engl J Med 350, 2004, s. 641–642.
42. Stanek J.: Increased number of migratory trophoblastic cells in placental membranes with microscopic chorionic pseudocysts. Society for Pediatric Pathology. Spring Meeting, Denver Colorado, March 1–2, 2008.
43. Staff AC., Ranheim T., Khoury J., et al.: Increased contents of phospholipids, cholesterol, and lipid peroxides in decidua basalis in women with preeclampsia. Am J Obstet Gynec 180, 1999, s. 587–592.
44. Staff AC., Halvorsen B., Ranheim T., et al.: Elevated level of free 8-iso-prostanglandin F2α in the decidua basalis of women with preeclampsia. Am J Obstet Gynec 181, 1999, s. 1211–1215.
45. Wang Y., Walsh SW.: Increased superoxide generation is associated with decreased superoxide dismutase activity and mRNA expression in placental trophoblast cells in pre-eclampsia. Placenta 22, 2001, s. 206–212.
46. Watson RW., Rotstein OD., Parodo J., et al.: The IL-1 beta-converting enzyme (caspase-1) inhibits apoptosis of inflammatory neutrophils through activation of IL-1 beta. J Immunol 161, 1998, s. 957–962.
47. Yu HB., Finlay BB.: The caspase-1 inflammasome: a pilot study of innate immune response. Cell Host Microbe 4, 2008, s. 198–208.
Labels
Anatomical pathology Forensic medical examiner ToxicologyArticle was published in
Czecho-Slovak Pathology

2010 Issue 1
Most read in this issue
- Histopathological Classification of Idiopathic Interstitial Pneumonias
- Lymphoma of the Small Intestine
- Caspase 1, Superoxiddismutase (D-mutase) and Calretinin Expression in the Placenta and in the Basal Decidua in Preeclampsia
- Analysis of Bone Marrow Angiogenesis in Multiple Myeloma
