Karcinomy ovaria: současné diagnostické principy
Ovarian Carcinoma: Current Diagnostic Principles
Ovarian cancer is the most common cause of death from a gynecologic cancer. The most common types of ovarian cancer are carcinomas of surface epithelial-stromal origin. Ovarian carcinomas are a heterogeneous group of neoplasms. Based on proposed different pathways of tumorigenesis, these tumors are divided into two broad subgroups (type I and II) with different biologic behaviour, prognosis and response to therapy. Type I tumors include low-grade serous adenocarcinoma, low-grade endometrioid adenocarcinoma, mucinous adenocarcinoma, malignant Brenner tumor and some clear cell carcinomas. These tumors are low-grade neoplasms evolving from a defined precursor lesion. Type II tumors are high-grade neoplasms including undifferentiated carcinoma, high-grade serous adenocarcinoma, high-grade endometrioid adenocarcinoma, malignant mixed Müllerian tumor and probably some clear cell carcinomas. At present, the histological type of ovarian carcinoma has only limited impact on the management of these tumors. However, with progress towards the type-specific treatment of ovarian carcinoma, accurate histopathological diagnosis of ovarian carcinoma becomes increasingly important. In this review we summarize recent advances in the histopathological diagnosis of ovarian carcinoma. Moreover, we mention genetic changes in different types of ovarian carcinoma.
Key words:
ovarian carcinoma – classification – immunohistochemistry – genetics
Authors:
P. Dundr
Authors‘ workplace:
Ústav patologie 1. LF UK a VFN, Praha
Published in:
Čes.-slov. Patol., 46, 2010, No. 3, p. 53-61
Category:
Reviews Article
Overview
Maligní nádory ovaria jsou nejčastější příčinou úmrtí na gynekologické malignity. Většinu těchto nádorů představují karcinomy ze skupiny nádorů z povrchového epitelu a stromatu. Karcinomy ovaria jsou různorodou skupinou nádorů s odlišnou cestou tumorigeneze, na jejímž podkladě se vymezují dvě podskupiny (nádory I. a II. typu), s odlišným chováním, prognózou i reakcí na léčbu. Mezi nádory I. typu patří low grade serózní adenokarcinom, low grade endometroidní adenokarcinom, mucinózní adenokarcinom, maligní Brennerův nádor a část světlobuněčných adenokarcinomů. Jedná se o low grade nádory s definovanou prekurzorickou lézí. Nádory II. typu jsou high grade nádory zahrnující nediferencovaný karcinom, high grade serózní adenokarcinom, high grade endometroidní adenokarcinom, high grade karcinom z přechodních buněk, smíšený maligní mülleriánský nádor a zřejmě část světlobuněčných adenokarcinomů. V současné době histologický typ karcinomu ovaria zásadně neovlivňuje charakter léčby. V budoucnosti se však pravděpodobně bude stále více uplatňovat léčba odlišná pro jednotlivé histologické typy karcinomu ovaria a jejich přesná klasifikace v tomto ohledu získá zásadní význam. V našem článku podáváme přehled současné problematiky histopatologické diagnostiky karcinomů ovaria. Zmíněny jsou také genetické změny vyskytující se u jednotlivých typů nádorů.
Klíčová slova:
karcinom ovaria – klasifikace – imunohistochemie – genetika
Maligní nádory ovaria jsou nejčastější příčinou úmrtí na gynekologické malignity. Incidence těchto nádorů v ČR v roce 2006 byla 20,4/100 000 žen, mortalita 14,5/100 000 žen. Karcinomy ovaria jsou různorodá skupina nádorů na úrovni morfologické i genotypické. V Evropě a Severní Americe představují karcinomy neteratogenního původu spadající do skupiny nádorů z povrchového epitelu a stromatu asi 80–90 % maligních nádorů ovaria (37). Základní a nejčastější histologické typy těchto nádorů jsou serózní, endometroidní, mucinózní a světlobuněčný adenokarcinom. Poměrně vzácné jsou smíšené maligní mülleriánské nádory, maligní nádory z přechodního epitelu, smíšené karcinomy a skupina blíže nezařaditelných nádorů zahrnující nediferencovaný karcinom a blíže neklasifikovatelný adenokarcinom. Prognóza karcinomu ovaria závisí především na stadiu onemocnění a u pokročilých stadií na objemu reziduálního nádoru po operaci (3). Podle histologického typu lze vyčlenit dvě široké skupiny nádorů s odlišnou prognózou, cestou tumorigeneze a různými genetickými změnami (6, 14, 16, 33). Do I. skupiny nádorů s lepší prognózou patří low grade serózní adenokarcinom, low grade endometroidní adenokarcinom, mucinózní adenokarcinom, maligní Brennerův nádor a část světlobuněčných adenokarcinomů obvykle vznikajících na podkladě endometriózy či světlobuněčného borderline nádoru. Jedná se o nejspíše pomalu rostoucí nádory s definovanou prekurzorickou lézí, které v době diagnózy, i přes často velké rozměry, mohou být omezené na ovarium a jsou tedy diagnostikovány v časnějších stadiích. Do II. skupiny nádorů s horší prognózou patří nediferencovaný karcinom, high grade serózní adenokarcinom, high grade endometroidní adenokarcinom, high grade karcinom z přechodních buněk, smíšený maligní mülleriánský nádor a zřejmě část světlobuněčných adenokarcinomů. Tyto nádory obvykle nemají definované prekurzorické stadium (s výjimkou části high grade serózních adenokarcinomů vznikajících na podkladě high grade serózní intraepiteliální neoplazie/ serózního tubárního intraepiteliálního karcinomu v distální části děložní tuby), rostou rychle a časně diseminují.
V následujícím textu jsou probrány jednotlivé histologické typy karcinomů ovaria spadajících do skupiny nádorů z povrchového epitelu a stromatu na úrovni morfologie, imunofenotypu a genetických změn. Stručně je zmíněna problematika karcinomů ovaria teratogenního původu a karcinomů spadajících podle WHO klasifikace nádorů do skupiny různých („miscellaneous“) nádorů.
Serózní adenokarcinom
Serózní adenokarcinom je nejčastější histologický typ karcinomu ovaria. Všeobecně přijímaný a závazný systém pro grading těchto nádorů není v současné době k dispozici, nicméně dříve používaný třístupňový grading (34) se opouští a je využíván grading dvoustupňový, s rozdělením na low grade serózní adenokarcinomy (LGSC) a high grade serózní adenokarcinomy (HGSC) (21). Ukazuje se, že LGSC a HGSC jsou odlišné nádory s rozdílnou prognózou i genetickými změnami a rozlišení těchto dvou podtypů serózního adenokarcinomu má tedy zásadní význam (1).
High grade serózní adenokarcinom
HGSC představuje více než 95 % serózních adenokarcinomů. Jedná se o nádor často diagnostikovaný v pokročilých stadiích, bez jednoznačně definovaného prekurzoru. Část nádorů zřejmě vzniká z povrchového epitelu či epitelu inkluzních cyst (2). Poslední dobou se nicméně ukazuje, že pravděpodobně značná část serózních adenokarcinomů diagnostikovaných jako nádory ovaria vzniká primárně v děložní tubě na podkladě tzv. p53 signatur („podpisů“) a následně high grade serózní intraepiteliální neoplazie/serózního tubárního intraepiteliálního karcinomu (18). P53 signatury jsou definovány jako souvislé úseky alespoň dvanácti p53 pozitivních sekrečních buněk v tubárním epitelu jinak normálního vzhledu (či jde o epitel s redukcí ciliárních buněk). Sporadický výskyt p53 je v tubárním epitelu normální, důležité je tedy kvantitativní kritérium (10). Vzácně se p53 signatury vyskytují i v oblasti povrchového epitelu ovaria. High grade serózní intraepiteliální neoplazie/serózní tubární intraepiteliální karcinom ve většině případů exprimuje p53, stejně jako HGSC však může být p53 negativní a exprese p53 tedy pro tuto diagnózu není nutná (32).
Histopatologie
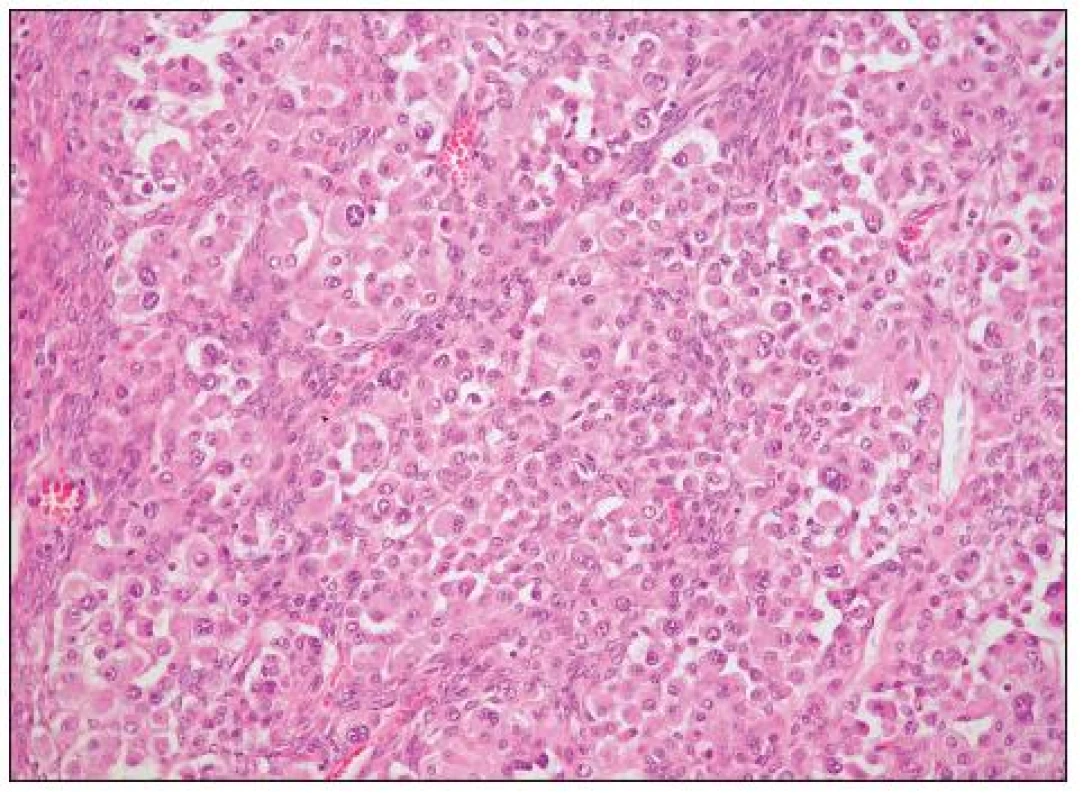
HGSC je architektonicky různorodý nádor, který může mít oblasti papilární (včetně mikropapilárních), kribriformní, solidní, solidně-alveolární a trabekulární (obr. 1, 2). Mohou se vyskytovat i oblasti glandulární úpravy a zvláště v těchto případech je obtížné odlišení od high grade endometroidního adenokarcinomu (některé HGSC jsou pravděpodobně diagnostikovány jako high grade endometroidní adenokarcinomy). Nádorové buňky jsou obvykle střední velikosti, s nepravidelnými jádry a četnými mitózami. Poměrně častý je výskyt jednotlivých bizarních jedno - či vícejaderných buněk. Množství cytoplazmy je variabilní, v některých případech je přítomna v malém množství a buňky mají vysoký N/C poměr, jindy je cytoplazma hojnější. Mohou se vyskytovat i buňky s vodojasnou cytoplazmou, jaderné rysy, architektonika i imunofenotyp jsou však obdobné jako v jiných oblastech nádoru a nejedná se tedy o složku světlobuněčného adenokarcinomu. Asi u 25 % nádorů se vyskytují psamomatózní tělíska. Vzácněji jsou přítomna eozinofilní tělíska jinak typická pro světlobuněčný adenokarcinom.
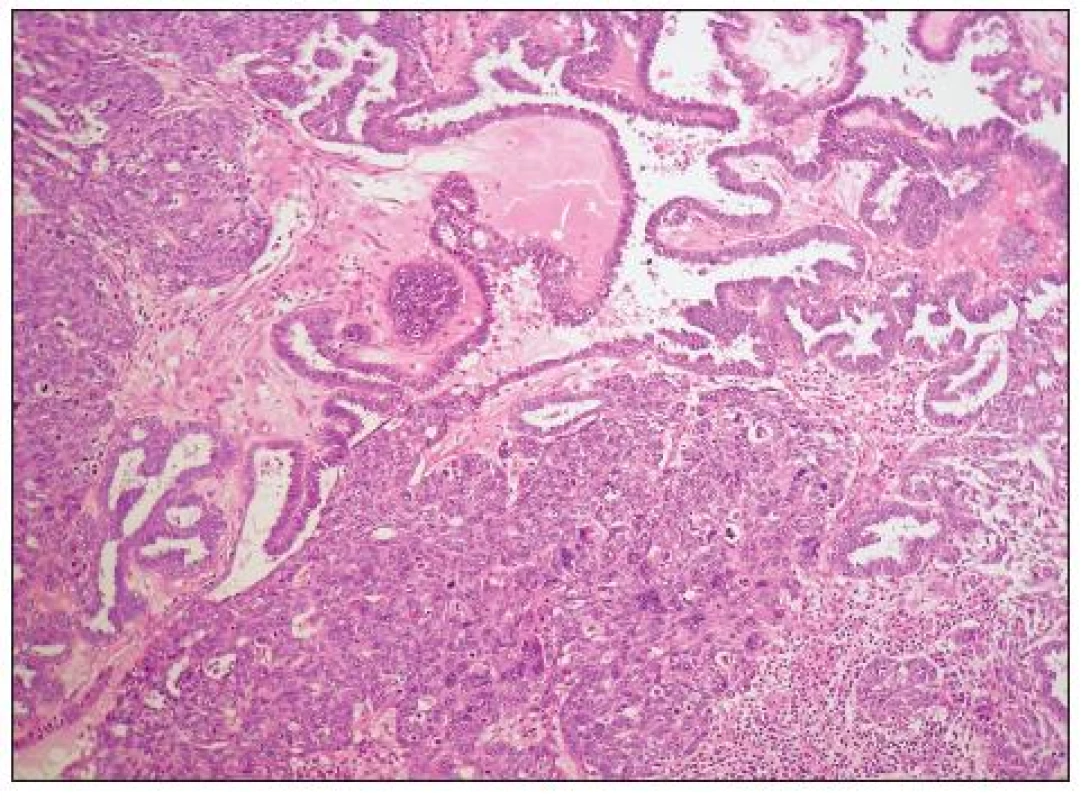
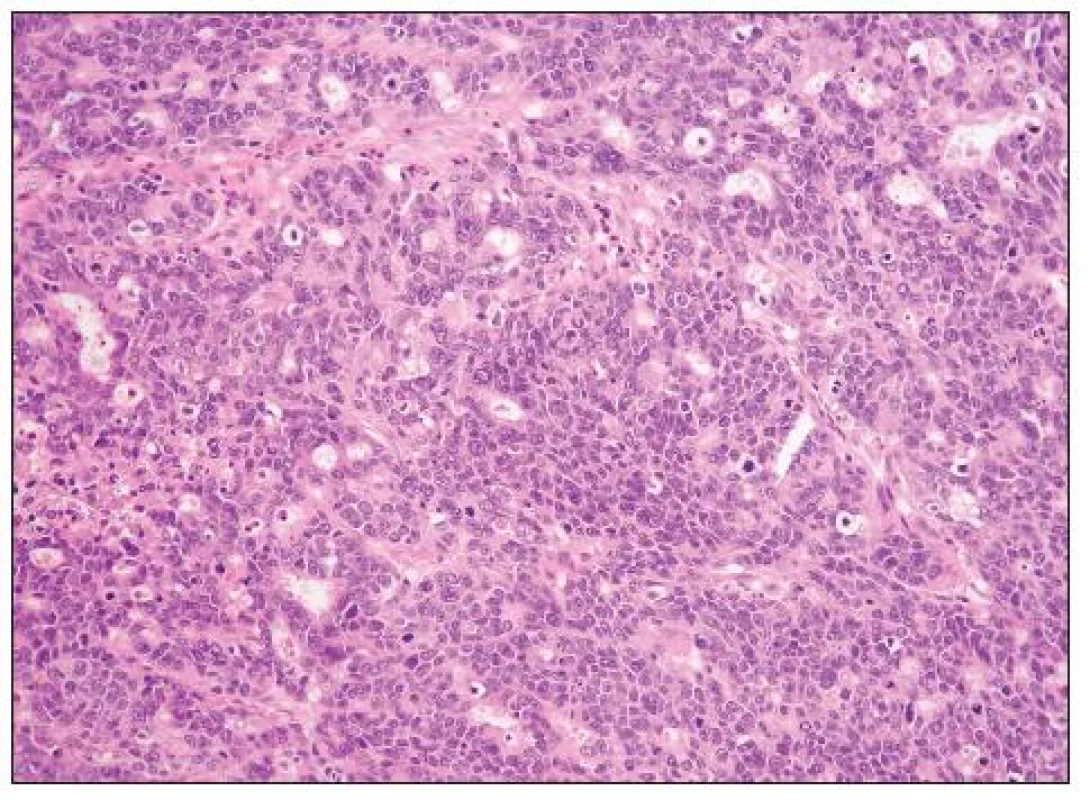
Grading: diagnóza HGSC je založena na hodnocení jaderných rysů a počtu mitóz. Jádra vykazují střední či výrazné atypie, s více než trojnásobnou variabilitou jejich velikosti. V případě nejednoznačných (hraničních) jaderných rysů lze jako pomocný faktor použít počet mitóz: > 12 mitóz/10 HPF podporuje diagnózu HGSC (21).
Genetické aberace
Část nádorů má vrozené či získané mutace BRCA1 či BRCA2 genu (32). U většiny nádorů je kromě toho přítomna mutace či delece TP53 (33).
Imunofenotyp
CK7/CK20: obvykle CK7+/CK20-. Vzácně
CK7+/CK20+.
ER/PR: asi 2/3 případů pozitivní. Rozsah
pozitivity je různý, může být pouze ložisková (42).
P53: většina případů jaderně pozitivní, asi
2/3 z nich difuzně (25).
WT1: většina případů (80–90 %) jaderně, často difuzně pozitivní (9).
Vimentin: může být pozitivní.
HNF1β:
< 5 % případů ložiskově jaderně pozitivní (13).
β-catenin: jaderně
negativní, může být snížená membránová exprese (29).
P16: většina nádorů silně intenzivně difuzně
pozitivní (26)
PAX8: většinou pozitivní (24)
Low grade serózní adenokarcinom
LGSC tvoří méně než 5 % serózních adenokarcinomů. Stejně jako HGSC je obvykle diagnostikován v pokročilých stadiích a prognóza je v těchto případech nepříznivá, celkově však jde o pomalu rostoucí nádor a délka přežití je výrazně lepší než u HGSC. LGSC pravděpodobně ve většině případů vzniká jako vícestupňový proces z benigního cystadenomu/adenofibromu přes serózní borderline nádor (S-BTO), mikropapilární S-BTO a mikropapilární S-BTO s mikroinvazí (4).
Histopatologie
Obvykle se jedná o mikropapilárně uspořádaný nádor, může však být přítomna běžná papilární, kribriformní či jiná úprava a mikropapilární architektonika není pro diagnózu LGSC nezbytná (obr. 3). Častý je výskyt psamomatózních tělísek a tzv. psamomakarcinom je obvykle variantou LGSC. Diagnóza se opírá o jaderné rysy; oproti HGSC jde o nádor tvořený buňkami s pravidelnými jádry, s menší než trojnásobnou variabilitou jejich velikosti. Mitózy jsou nečetné, v původním klasifikačním schématu udávány v počtu do 12/10 HPF, naprostá většina LGSC však nemá více něž 5 mitóz / 10 HPF (1, 21). V případě vzniku LGSC v mikropapilárním S-BTO je pro diagnózu invazivního karcinomu nezbytný rozsah invaze v ložisku > 10 mm2. Pokud je ložisko invaze menšího rozsahu (i v případě výskytu více menších invazivních ložisek – velikost jednotlivých ložisek se nesčítá), je nádor klasifikován jako mikropapilární S-BTO s mikroinvazí.
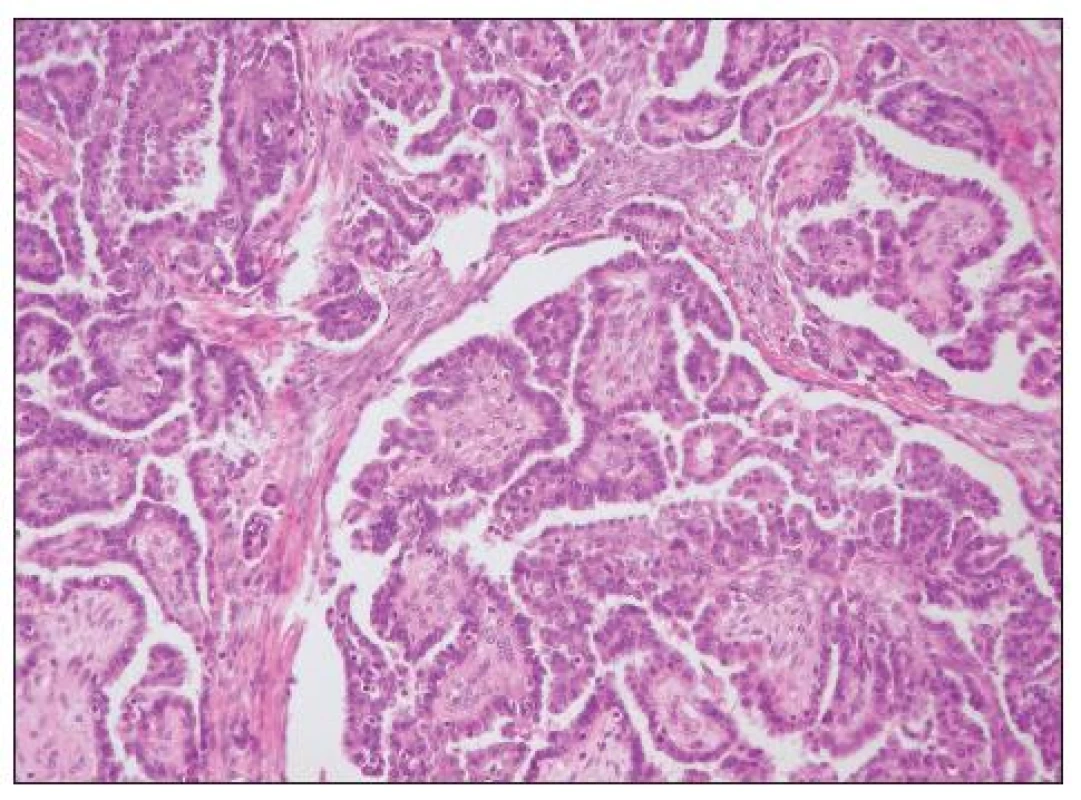
Genetické aberace
U většiny LGSC je přítomna mutace BRAF, KRAS či ERBB2 (35, 41). Oproti HGSC obvykle nejsou přítomny změny genů BRCA1, BRCA2 ani TP53.
Imunofenotyp
CK7/CK20: obvykle
CK7+/CK20-. Vzácně CK7+/CK20+.
ER/PR: většina nádorů
je ER+/PR+. Rozsah exprese je větší než u HGSC (42).
P53: může být ložisková
a velmi zřídka i difuzní jaderná pozitivita (25).
WT1: většina případů
difuzně jaderně pozitivní.
Vimentin: může být
pozitivní.
HNF1β:
negativní.
β-catenin: jaderně negativní, může být snížená membránová
exprese (29).
P16: většina nádorů
pozitivní, pouze menší část z nich difuzně (26).
PAX8: většinou
pozitivní.
Endometroidní adenokarcinom
Endometroidní adenokarcinom představuje asi 10 % ovariálních karcinomů a je udáván jako druhý (podle některých sestav až jako třetí – po světlobuněčném a serózním adenokarcinomu) nejčastější typ ovariálního karcinomu. Obvykle se jedná o low grade nádory, existují však i high grade endometroidní adenokarcinomy a podobně jako u serózních adenokarcinomů se můžeme setkat s vyčleněním low grade a high grade endometroidního adenokarcinomu jako odlišných jednotek s různou prognózou. Značná část nádorů souvisí s endometriózou a asi u 15–20 % se současně vyskytuje karcinom endometria. Část endometroidních adenokarcinomů vzniká v benigním či borderline endometroidním nádoru ovaria.
Histopatologie
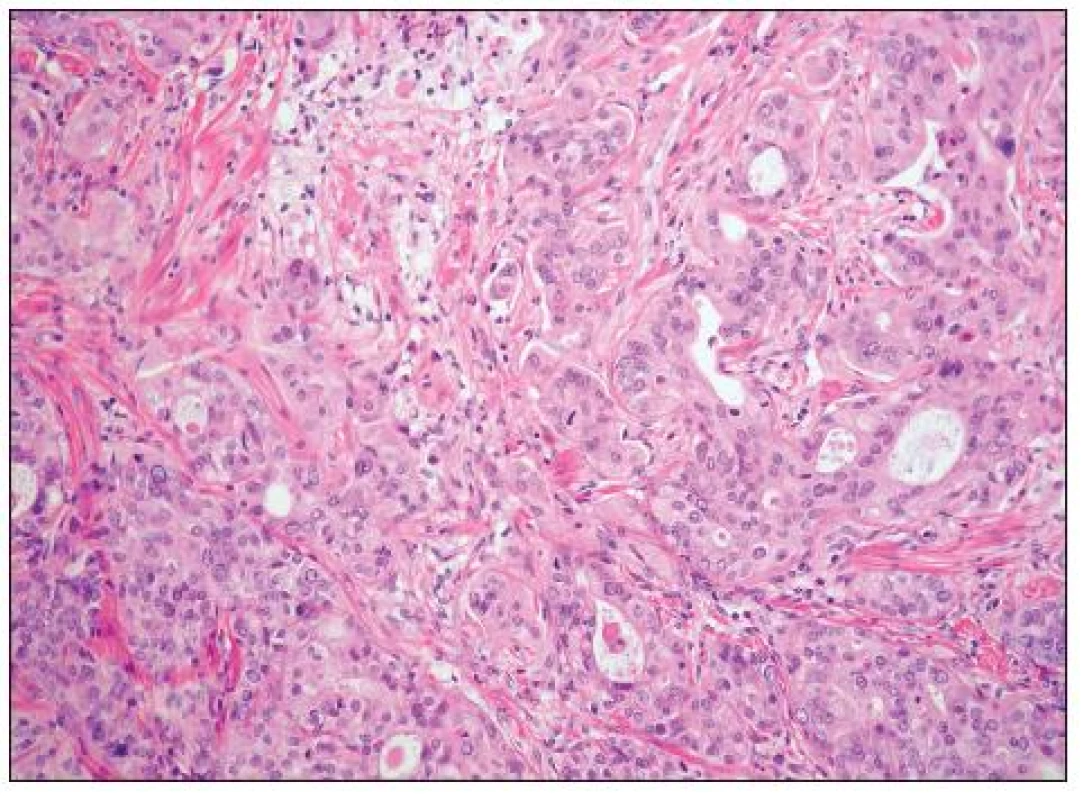
Jedná se o nádory obdobné morfologie jako endometroidní adenokarcinomy děložního těla. Obvykle jde o dobře diferencované adenokarcinomy glandulární a vzácněji kribriformní či viloglandulární úpravy (obr. 4). Nádorové buňky jsou většinou kubické či cylindrické, s eozinofilní/amfofilní cytoplazmou. Poměrně častá je přítomnost mucinózní a dlaždicobuněčné diferenciace (obr. 5). Vzácně se vyskytují buňky řasinkové, oxyfilní či buňky se sekrečními změnami (se světlou vodojasnou cytoplazmou). V případě přítomnosti buněk s vodojasnou cytoplazmou je nutno vyloučit složku světlobuněčného adenokarcinomu. Jaderné rysy těchto buněk, architektonika i imunofenotyp jsou však totožné jako v jiných (typických) oblastech endometroidního adenokarcinomu a odlišení od světlobuněčného adenokarcinomu tedy nebývá obtížné. Poměrně vzácný je výskyt oblastí připomínajících sex cord-like diferenciaci. High grade endometroidní adenokarcinomy oproti dobře diferencovaným nádorům mívají oblasti solidní úpravy s výraznými jadernými atypiemi a četnými mitózami. Odlišení těchto nádorů od high grade serózního adenokarcinomu či nediferencovaného karcinomu je obtížné. Obecně platí, že výskyt endometriózy, skvamózní diferenciace či oblastí vzhledu benigního/borderline endometroidního adenofibromu jsou rysy svědčící pro diagnózu endometroidního adenokarcinomu, nevyskytují se však u všech případů a ani nejsou zcela specifické. U sporných high grade karcinomů ovaria je vhodné provést imunohistochemickou analýzu, nicméně diferenciální diagnostika těchto dvou typů nádorů je problematická. Serózní adenokarcinom obvykle exprimuje p53 a WT1, variabilně vimentin; β-catenin bývá jaderně negativní (může být snížena jeho membránová exprese). High grade endometroidní adenokarcinom většinou exprimuje vimentin, často p53 a vzácně jaderně β-catenin (ten je často jaderně exprimován u low grade endometroidních adenokarcinomů). Exprese WT1 je u high grade endometroidních adenokarcinomů popisována v 0–33 % případů, což je nejspíše alespoň do určité míry dáno tím, že část HGSC glandulární úpravy je zřejmě mylně diagnostikována jako high grade endometroidní adenokarcinomy. Převládající názor je, že většina high grade karcinomů ovaria s expresí WT1, u kterých je diferenciálně diagnosticky zvažován high grade endometroidní adenokarcinom a HGSC představují HGSC. Neplatí však, že HGSC typického vzhledu musí vždy exprimovat WT1 (exprese je v různých sestavách udávána asi u 80–90 % těchto nádorů) – negativita WT1 tedy diagnózu HGSC nevylučuje (20).
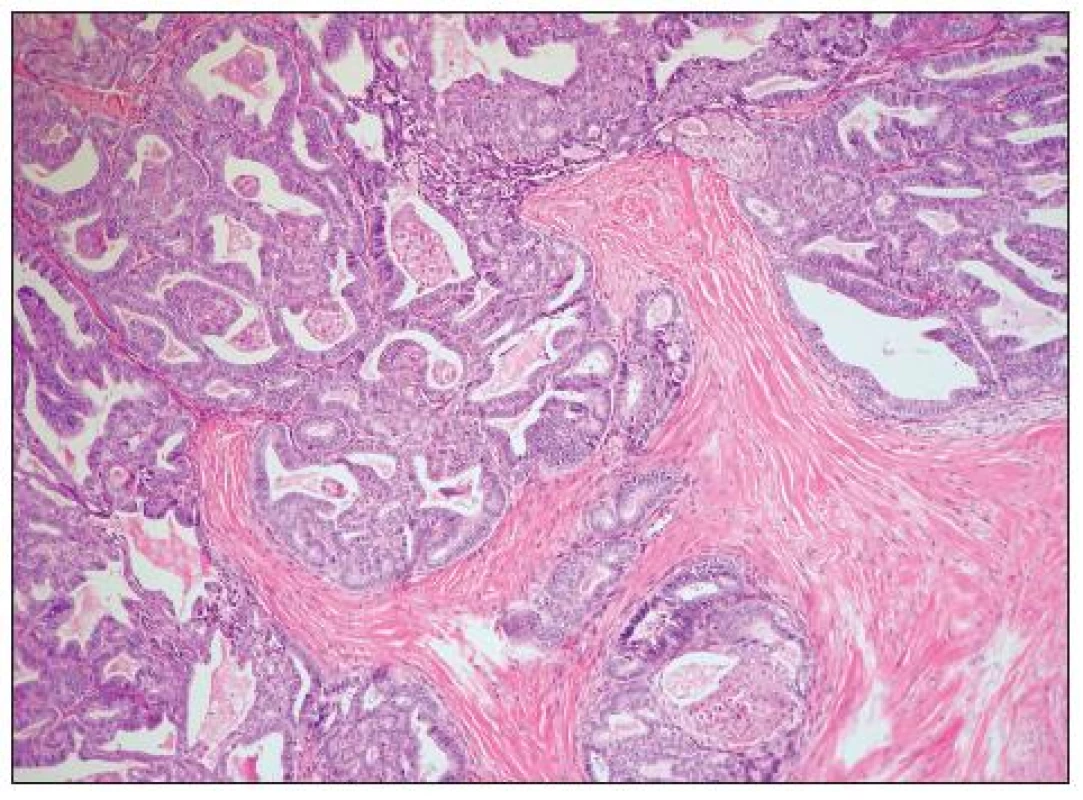
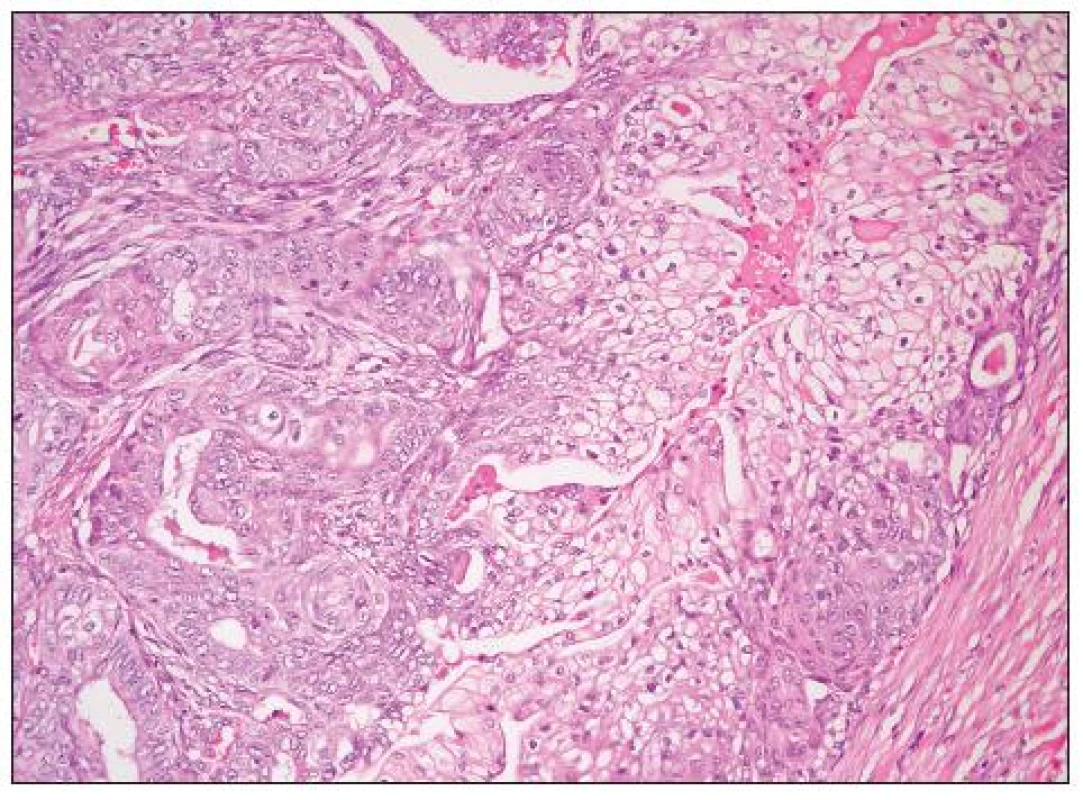
Grading endometroidních adenokarcinomů ovaria je obvykle na stejném principu jako FIGO grading nádorů těla děložního, kombinuje tedy architektonické a jaderné rysy. Stále častěji je však používán grading dvoustupňový s vyčleněním low grade a high grade varianty. Obecně se mezi low grade nádory řadí nádory FIGO grade 1 a mezi high grade nádory FIGO grade 2 a 3. Nicméně jednoznačná a závazná definice low grade/high grade varianty není v současné době stanovena.
Genetické aberace
Endometroidní adenokarcinomy jsou geneticky různorodé a podobně jako u serózních adenokarcinomů jsou přítomny rozdílné změny u low grade a high grade nádorů. U dobře diferencovaných nádorů snadno odlišitelných od HGSC se často vyskytují somatické mutace genu CTNNB1 (kódujícího β-catenin) a PTEN. U high grade karcinomů se vyskytuje mutace TP53, tyto nádory obvykle nemají mutaci CTNNB1 a PTEN a vykazují překryvné genetické změny s HGSC (od kterého jsou často obtížně odlišitelné i na morfologické úrovni) (6, 20).
Imunofenotyp
CK7/CK20: obvykle
CK7+/CK20-. Vzácně CK7+/CK20+.
ER/PR: většina nádorů
je ER+/PR+.
P53: může být fokální
a u high grade karcinomů i difuzní jaderná pozitivita (6, 25).
WT1: většina případů
negativní (24).
Vimentin: většinou
pozitivní.
HNF1β: většinou
pozitivní (43).
β-catenin: u případů s mutací CTNNB1 jaderně
(mutace tohoto genu vede k jaderné kumulaci β-cateninu – normálně je β-catenin přítomný v oblasti buněčné membrány)
i membránově pozitivní (může být snížená membránová exprese) (6).
P16: může být
pozitivní, obvykle pouze fokálně.
PAX8: většinou
pozitivní (24).
Světlobuněčný adenokarcinom
Světlobuněčný adenokarcinom představuje asi 10 % ovariálních karcinomů a je udáván jako třetí (podle některých sestav jako druhý – po serózním adenokarcinomu) nejčastější typ ovariálního karcinomu. Značná část těchto nádorů vzniká v souvislosti s endometriózou. U některých nádorů lze nalézt oblasti charakteru benigního či borderline světlobuněčného nádoru. Tyto nádory jsou obvykle řazeny mezi nádory I. typu (low grade nádory vznikající na podkladě definovaného prekurzoru), část světlobuněčných adenokarcinomů však zřejmě vzniká bez zjevného prekurzoru a je řazena mezi high grade karcinomy (nádory II. typu).
Histopatologie
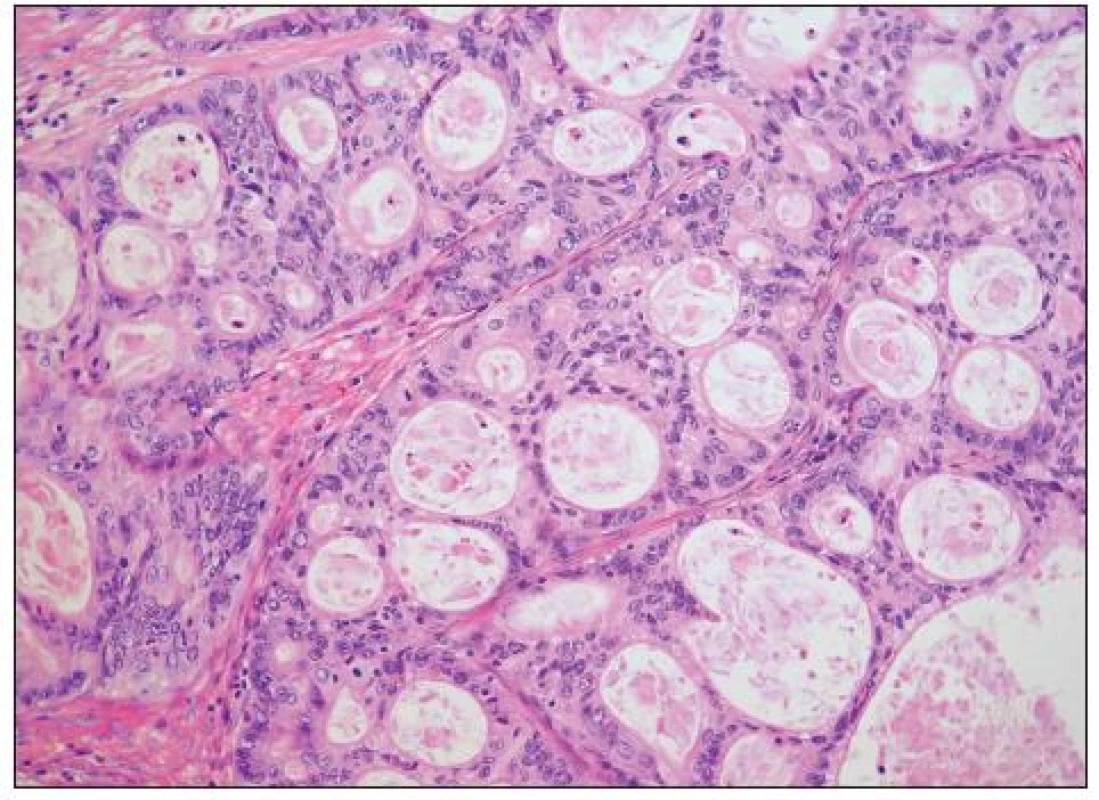
Architektonicky jde obvykle o různorodé nádory s oblastmi solidní, glandulární, tubulocystické (mikrocystické), adenofibromatózní a papilární úpravy (obr. 6, 7). Typickým rysem je hyalinizace stromatu papil (obr. 8). Nádorové buňky mohou mít poměrně pravidelná jádra bez výraznějších atypií, či je přítomen různý stupeň jaderných atypií až po pleomorfní velká jádra s prominentními jadérky. Buněčné hranice jsou dobře patrné. Cytoplazma je typicky objemnější, vodojasná, obsahující glykogen. Zvláště v tubulopapilárních oblastech je charakteristickým rysem výskyt buněk s cvočkovitými jádry („hobnail cells“). Dále se můžeme setkat s oploštělými buňkami s minimálním množstvím cytoplazmy, které obvykle vystýlají lumen cyst či lemují žlázky. Poměrně vzácná je oxyfilní varianta charakterizovaná buňkami s objemnou eozinofilní granulovanou cytoplazmou (obr. 9). Jako fokální nález v jinak typickém světlobuněčném adenokarcinomu je však výskyt těchto buněk poměrně častý. Ve většině nádorů se vyskytují PAS pozitivní eozinofilní cytoplazmatické inkluze.
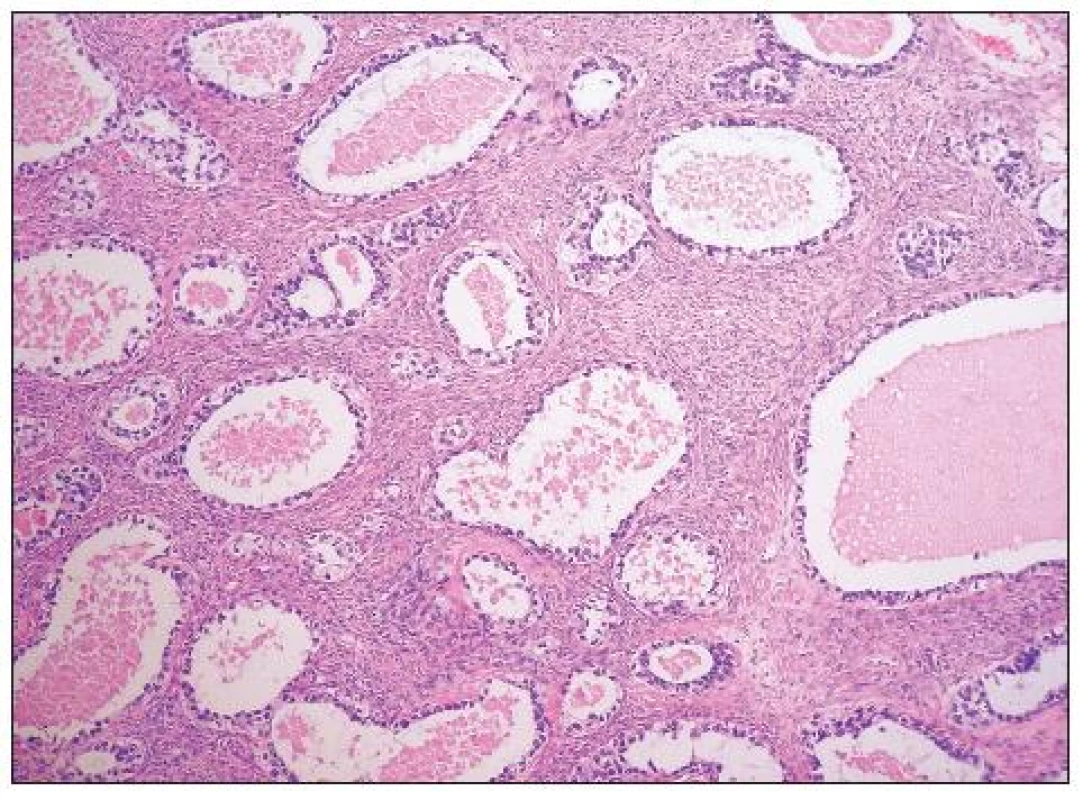
Grading se obvykle neprovádí; i přes výskyt nádorů s poměrně pravidelnými jádry a nízkým počtem mitóz jsou světlobuněčné adenokarcinomy většinou hodnoceny jako grade 3 (což je do určité míry v rozporu s tím, že část světlobuněčných adenokarcinomů spadá do I. skupiny nádorů ovaria definovaných jako low grade léze).
Genetické aberace
Častý je výskyt mutace genu PIK3CA kódujícího katalytickou podjednotku fosfatidylinozitol-3-kinázy. Vzácněji se vyskytuje mutace p53 a výjimečně i mutace jiných genů (KRAS, PTEN, CTNNB1, BRAF) (15).
Imunofenotyp
CK7/CK20: obvykle
CK7+/CK20-.
ER/PR: většinou
negativní.
P53: většinou
negativní.
WT1: většinou negativní.
Vimentin: některé
nádory pozitivní.
HNF1β: většinou
difuzně jaderně pozitivní (asi 80 % případů) (13, 43).
β-catenin: jaderně negativní, bývá snížená membránová
exprese (29).
P16: obvykle negativní či
fokálně pozitivní (27).
PAX8: většinou
pozitivní (24).
Mucinózní adenokarcinom
Mucinózní adenokarcinom představuje asi 3–4 % primárních karcinomů ovaria. Dříve udávané větší zastoupení těchto nádorů nejspíše souvisí se započítáním sekundárních (metastatických) nádorů ovaria, jejichž odlišení od primárních ovariálních nádorů je často obtížné. Prekurzorem invazivního mucinózního karcinomu je mucinózní borderline nádor ovaria, jehož struktury jsou v karcinomu často přítomné.
Histopatologie
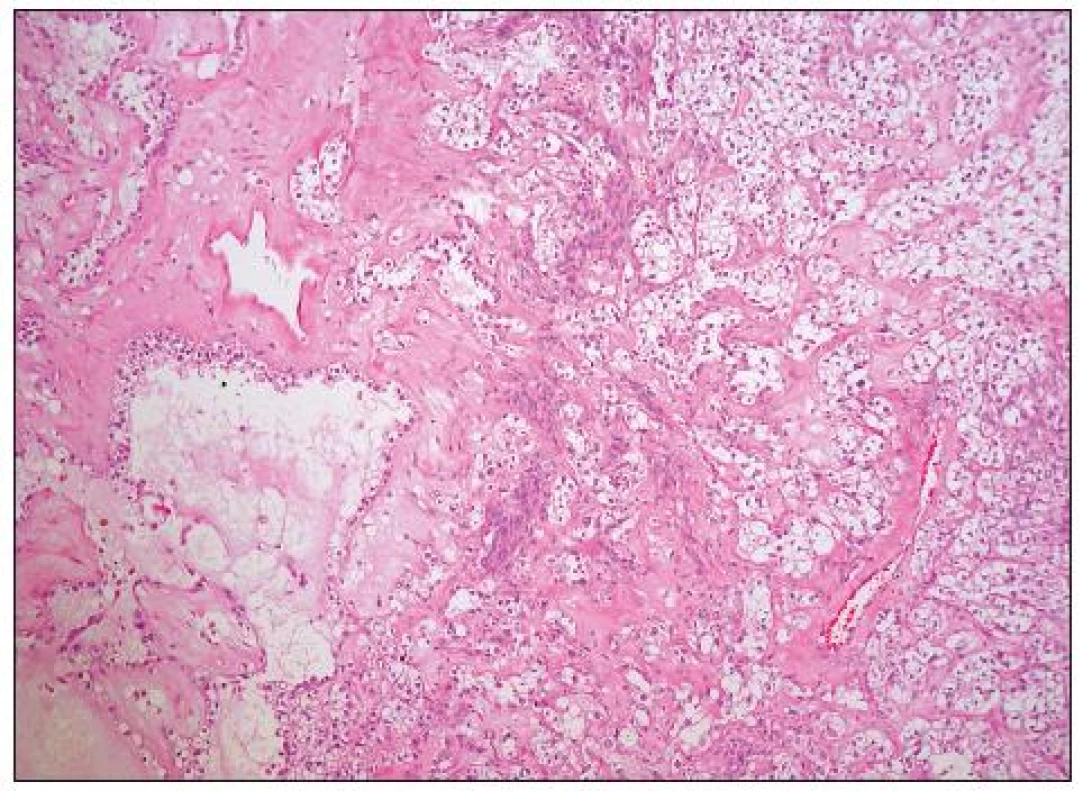
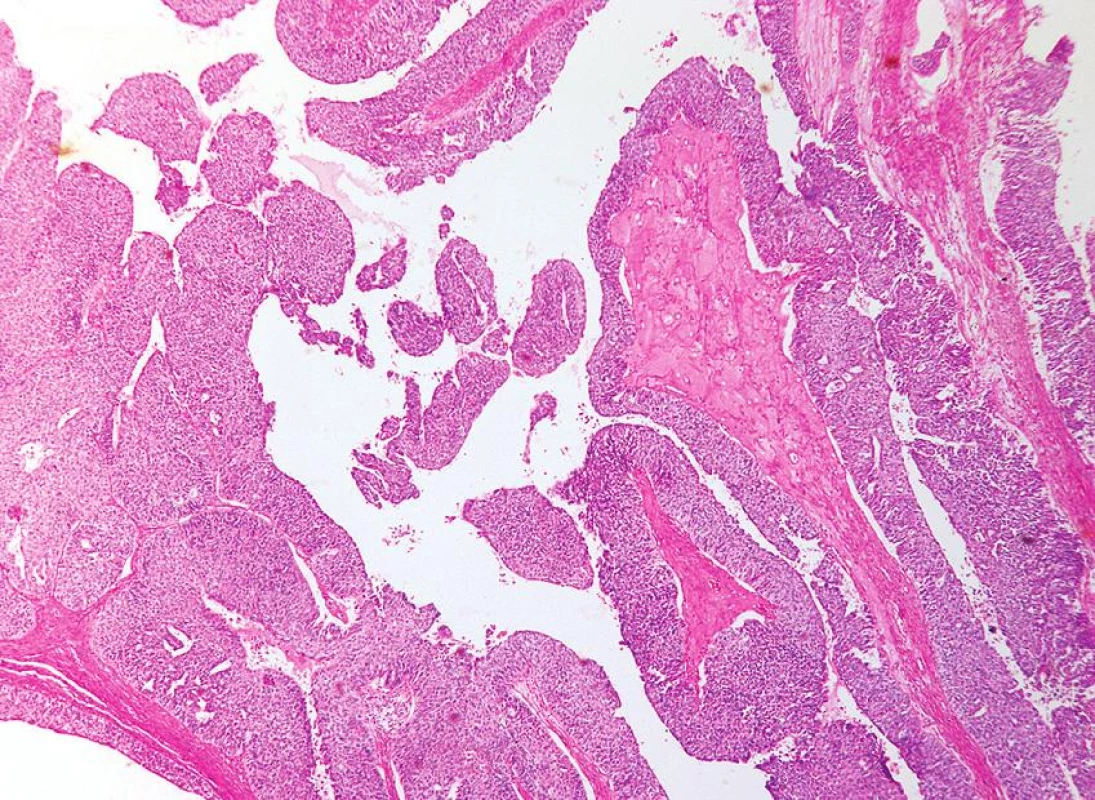
Charakteristickým rysem mucinózních nádorů ovaria je jejich různorodost. Často se vedle sebe vyskytují oblasti vzhledu benigního, borderline a maligního. Důležité je proto dostatečně rozsáhlé vyšetření (udáván je jeden řez na 1 cm průměru nádoru). Histologicky se vyčleňují (stejně jako u mucinózních borderline nádorů ovaria) nádory intestinálního typu a nádory endocervikálního typu (s mülleriánskou diferenciací). Endocervikální typ mucinózního adenokarcinomu je velmi vzácný. Papilárním uspořádáním nádor spíše připomíná nádory se serózní diferenciací, cytologicky se však jedná o buňky mucinózního typu. Mohou být přítomny oblasti borderline mucinózního nádoru endocervikálního typu. Častá je souvislost s endometriózou (8). Obvykle se jedná o nádory s dobrou prognózou diagnostikované v časných stadiích (12). Naprostou převahu mucinózních karcinomů ovaria tvoří karcinomy intestinálního typu, ve kterých se nicméně nemusí vyskytovat pohárkové buňky a značná část těchto nádorů spíše připomíná nádory žaludku, pankreatu či žlučníku a žlučových cest. Prstenčité buňky typické pro difuzní adenokarcinom mohou být přítomny, vyskytují se však vzácně a obvykle pouze fokálně a jejich přítomnost je vždy suspektní z metastatického procesu (obvykle jde o metastázy nádoru ze zažívacího traktu) (23). Pro diagnózu karcinomu je podle WHO klasifikace nádorů nutná přítomnost invaze v ložisku > 10 mm2 (někdo však jako kritérium pro diagnózu karcinomu hodnotí největší rozměr invazivního ložiska – obvykle je udávána hranice 5 mm, ale i 3 mm). Rozlišují se 2 typy invaze – infiltrativní a expanzivní. Infiltrativní invaze je v mucinózních karcinomech méně častá (obr. 10). Tento typ invaze je charakterizován infiltrací stromatu, s patrnou stromální reakcí. Mucinózní nádory jsou však často architektonicky komplexní a v případech bez patrné stromální reakce může být velmi obtížné odlišit invazivní a neinvazivní růst. Častějším typem invaze je invaze expanzivní, charakterizovaná komplexní papilární úpravou či těsným nakupením nádorových žlázek, s minimální přítomností či úplnou redukcí stromatu (obr. 11). Ukazuje se, že infiltrativní typ invaze je prognosticky nepříznivější a typ invaze by tedy měl být v bioptickém nálezu uveden (11). Vzácně v mucinózních nádorech ovaria (benigních, borderline i maligních) vznikají tzv. murální uzly, jejichž podkladem může být pseudosarkom, sarkom či anaplastický karcinom (28).
Diferenciálně diagnosticky je nejobtížnější odlišení primárních a metastatických mucinózních nádorů ovaria. Pro primární nádory svědčí přítomnost expanzivní invaze, komplexní papilární úprava nádoru, velikost > 10 cm, přítomnost mikroskopických cyst (obvykle > 2 mm), přítomnost nekrotického materiálu v lumen nádorových cyst a žlázek (dříve byl tento jev pokládán spíše za známku metastatického postižení) a přítomnost oblastí benigního vzhledu či charakteru borderline nádoru (tyto oblasti však mohou být i v metastatických nádorech ovaria, které někdy napodobují benigní či borderline nádory). Pro metastatický původ svědčí oboustranné postižení ovaria, přítomnost nádorových struktur na povrchu ovaria, infiltrativní stromální invaze, postižení hilu ovaria, uzlovitý růst nádoru (histologicky v podobě vícečetných ložisek nádoru oddělených nenádorovou tkání ovaria), disociace jednotlivých nádorových buněk, přítomnost prstenčitých buněk a angioinvaze (17).
Genetické aberace
U mucinózních karcinomů intestinálního typu je častý výskyt mutace KRAS. Může být přítomna amplifikace / overexprese HER2/neu (22).
Imunofenotyp (mucinózní karcinomy intestinálního typu)
CK7/CK20: většinou
CK7+/CK20+ (70–80 % případů), CK7+/CK20 - asi ve 20–30 % případů, CK7-/CK20+ vzácné (< 5 %) (36, 39).
ER/PR: negativní (38).
P53: většinou
negativní.
WT1: většinou
negativní.
Vimentin: většinou
negativní.
HNF1β: většinou
pozitivní.
β-catenin: jaderně negativní, bývá výrazná membránová
exprese (29).
P16: vzácně pozitivní,
obvykle fokálně, zcela výjimečně difuzně (40).
PAX8: většinou
negativní (24).
Maligní nádory z přechodního epitelu
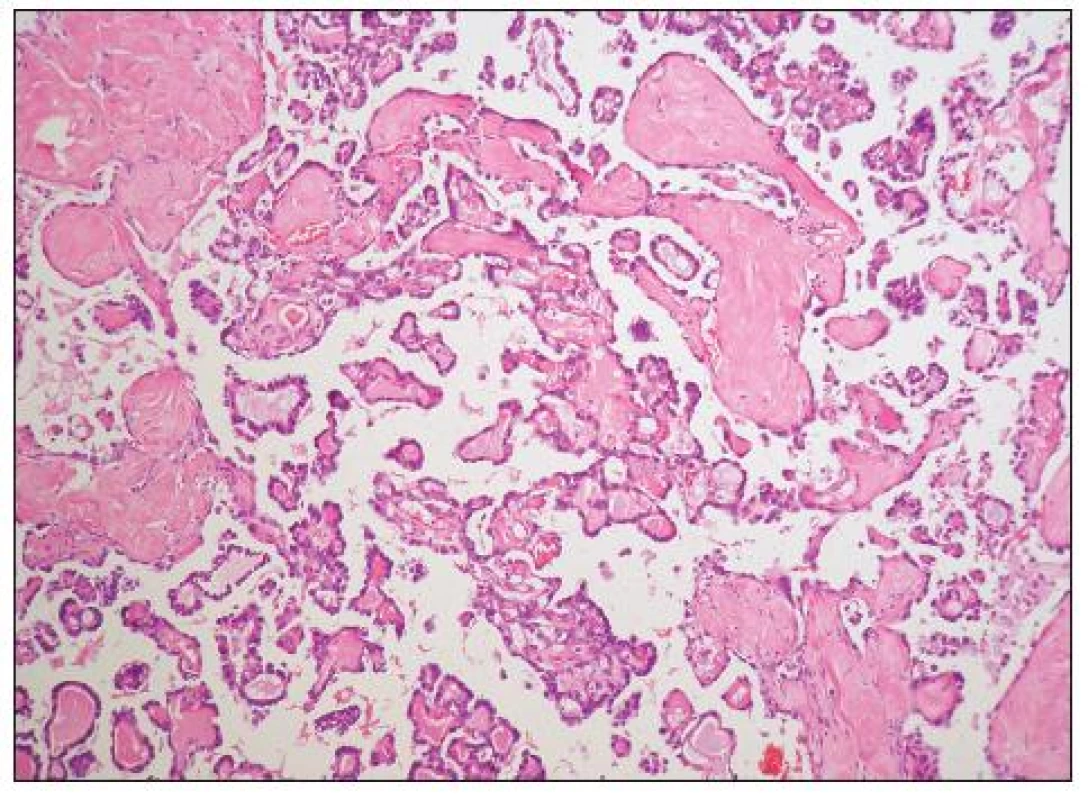
Maligní nádory z přechodního epitelu jsou v ovariu vzácné; udává se, že představují asi 1-2 % ovariálních karcinomů. Vyčleňuje se maligní Brennerův nádor a karcinom z přechodních buněk. Maligní Brennerův nádor je považován za low grade nádor. Histologicky je charakterizován kromě maligní složky i komponentou benigního/borderline Brennerova nádoru. Karcinomy z přechodních buněk obvykle představují high grade nádory. Jedná se o hůře definovanou skupinu nádorů, jejichž diagnostika je do určité míry sporná. Morfologicky tyto nádory napodobují uroteliální karcinomy močového měchýře či jiných oblastí vývodných cest močových (obr. 12), jejich imunofenotyp je však od uroteliálních karcinomů vývodných cest močových odlišný a je nejbližší seróznímu adenokarcinomu ovaria včetně časté exprese WT1 a p53 (7, 19). Tento fakt spolu s tím, že některé karcinomy z přechodního epitelu mají při recidivě či v metastázách podobu serózního adenokarcinomu vede část autorů k názoru, že jde přinejmenším v některých případech o serózní adenokarcinomy a nikoliv o karcinomy z přechodních buněk. Grading karcinomů z přechodních buněk je obvykle totožný jako u nádorů vývodných cest močových.
Genetické aberace
Genetické aberace vyskytující se u maligního Brennerova nádoru nejsou v současnosti přesně definovány. Může být přítomna mutace PIK3CA a naopak se nevyskytuje mutace TP53 typická pro high grade ovariální karcinomy (7). Karcinomy z přechodních buněk oproti tomu obvykle mají mutaci TP53.
Imunofenotyp
CK7/CK20: většinou
CK7+/CK20-.
ER/PR: mohou být
pozitivní.
P53: maligní Brennerův
nádor obvykle negativní; karcinomy z přechodních buněk obvykle silně
pozitivní.
WT1: karcinomy z přechodních
buněk často pozitivní.
Vimentin: může být
pozitivní.
HNF1β: není
známo.
β-catenin: není známo.
P16: maligní Brennerův
nádor obvykle negativní; karcinomy z přechodních buněk obvykle silná
exprese.
PAX8: není známo.
Smíšený maligní mülleriánský nádor (karcinosarkom)
Smíšený maligní mülleriánský nádor ovaria je vzácný; podle literárních údajů tvoří asi 1–5 % všech ovariálních malignit (5). Jedná se o high grade nádory, které nejspíše vznikají z povrchového epitelu a stromatu či z ložisek endometriózy. V současné době převládá názor, že se nejedná o pravé smíšené nádory, ale o high grade karcinomy s metaplastickou sarkomatózní komponentou (30). Diferenciace epitelové komponenty může být serózní, endometroidní či světlobuněčná. Může se však vyskytovat i složka nediferencovaného či dlaždicobuněčného karcinomu. Mezenchymální komponenta může být homologní (leiomyosarkom, fibrosarkom, nediferencovaný sarkom) či heterologní (např. rabdomyosarkom či chondrosarkom).
Smíšené karcinomy
Podle poslední WHO klasifikace nádorů ovaria jde o léze tvořené dvěma či více histologickými typy nádorů (serózní, mucinózní, endometroidní, světlobuněčný, maligní Brennerův nádor/ karcinom z přechodních buněk) (37). Sekundární komponenta má tvořit alespoň 10% objemu nádoru. Nejčastěji se vyskytuje smíšený endometroidní a světlobuněčný adenokarcinom, který často vzniká v endometrióze. Existence ostatních smíšených adenokarcinomů je do určité míry sporná. Obvykle jde o nádory s převažující komponentou serózní a minoritní složkou nádoru charakteru karcinomu endometroidního, světlobuněčného či z přechodních buněk. Výsledky imunohistochemických vyšetření však spíše nasvědčují tomu, že jde o serózní adenokarcinomy, v určitých oblastech morfologicky napodobující jiný typ nádoru (i v těchto oblastech však zůstává zachován imunofenotyp serózního adenokarcinomu) a nejde tedy o pravé smíšené nádory (13).
Nediferencované a blíže nezařaditelné karcinomy
Nediferencované karcinomy jsou podle klasifikace WHO karcinomy bez patrné diferenciace či s pouze ojedinělými ložisky diferenciace (37). Obecně převládá názor, že ve značné míře jde o high grade serózní adenokarcinomy a i v případě drobných ložisek zřetelné serózní diferenciace je tyto nádory lépe klasifikovat jako high grade serózní a nikoliv nediferencované karcinomy. Nicméně určitá malá skupina nádorů spadá do kategorie nediferencovaného karcinomu či do kategorie blíže neklasifikovatelného karcinomu. Blíže neklasifikovatelný karcinom je podle WHO klasifikace definován jako adenokarcinom, který má buď překryvné rysy různých histologických typů nádorů, nebo nevykazuje známky diferenciace k některému z definovaných typů karcinomů ovaria (37).
Karcinomy vznikající na podkladě teratomu
Jedná se o nádory vznikající obvykle ve zralém cystickém teratomu charakteru dermoidní cysty. Většinou jde o dlaždicobuněčné karcinomy následované adenokarcinomy. Popsány ale jsou i různé jiné typy karcinomů včetně malobuněčného karcinomu, bazaliomu, uroteliálního karcinomu a dalších.
Ostatní karcinomy
Dlaždicobuněčný karcinom: část případů vzniká na podkladě zralého teratomu (nejčastěji dermoidní cysty), zbylá část má pravděpodobně původ v povrchovém epitelu a stromatu. Do skupiny různých („miscellaneous“) nádorů podle WHO dále spadá malobuněčný karcinom (plicní typ), malobuněčný karcinom (hyperkalcemický typ), velkobuněčný neuroendokrinní karcinom, hepatoidní karcinom a adenoidně cystický karcinom.
Shrnutí
Serózní adenokarcinomy ovaria se dělí na low grade a high grade variantu, představující odlišné nádory s rozdílnou prognózou i genetickými aberacemi. Třístupňový grading serózních adenokarcinomů v tomto kontextu pozbývá význam.
Značná část serózních adenokarcinomů ovaria pravděpodobně primárně vzniká z děložní tuby, konkrétně z oblasti fimbrií, na podkladě high grade serózní intraepiteliální neoplazie / serózního tubárního intraepiteliálního karcinomu. Vzhledem k tomuto faktu je vhodné se obecně při bioptickém vyšetření adnex zaměřit na tuto obvykle opomíjenou oblast (případná přítomnost high grade serózní intraepiteliální neoplazie může souviset s mutací BRCA genu a znamenat zvýšené riziko vzniku karcinomu prsu či serózního adenokarcinomu v jiné oblasti vnitřního genitálu či pánevního peritonea).
Mucinózní adenokarcinomy s infiltrativní stromální invazí mají horší prognózu než nádory s expanzivní invazí – typ invaze by tedy měl být v bioptickém nálezu uveden.
Výskyt buněk s vodojasnou cytoplazmou nestačí pro diagnózu světlobuněčného adenokarcinomu či smíšeného adenokarcinomu se složkou světlobuněčného adenokarcinomu. Buňky s vodojasnou cytoplazmou se poměrně často vyskytují i v serózním a endometroidním adenokarcinomu a je nutno je hodnotit v kontextu celkové morfologie nádoru a případně výsledků imunohistochemických vyšetření.
Podobně jako u serózních adenokarcinomů se stále častěji používá vyčlenění low grade a high grade endometroidního adenokarcinomu jako samostatných variant. Obtížné je odlišení high grade endometroidního adenokarcinom od HGSC a část nádorů diagnostikovaných jako high grade endometroidní adenokarcinomy jsou nejspíše HGSC. Ve sporných případech je na místě provést imunohistochemické vyšetření, které ve značné části případů tyto nádory odliší.
Existence smíšených karcinomů ovaria (s výjimkou smíšeného endometroidního a světlobuněčného adenokarcinomu) je sporná a tyto nádory většinou představují high grade serózní adenokarcinomy s morfologicky neobvyklými oblastmi, které však zachovávají typický imunofenotyp.
Nediferencované karcinomy je v případě přítomnosti alespoň ojedinělých ložisek zřetelné serózní diferenciace lépe klasifikovat jako high grade serózní a nikoliv nediferencované karcinomy.
Závěr
Karcinomy ovaria představují heterogenní skupinu nádorů na úrovni morfologické i genotypické. V Evropě a Severní Americe představují asi 80-90 % maligních nádorů ovaria karcinomy neteratogenního původu spadající do skupiny nádorů z povrchového epitelu a stromatu (37). Ostatní typy karcinomů, ať už teratogenního či jiného původu, jsou vzácné. Patogeneze karcinomů ovaria není jasná, nicméně poslední dobou se zdá, že stejně jako u karcinomů děložního těla lze vyčlenit dvě široké skupiny karcinomů ovaria (typ I. a typ II.) s odlišnou cestou tumorigeneze a odlišnými genetickými aberacemi (6, 16, 33). Typ I. představují low grade karcinomy vznikající vícekrokovým procesem z prekurzorických benigních či borderline lézí. Do této skupiny patří low grade serózní adenokarcinom, mucinózní adenokarcinom, low grade endometroidní adenokarcinom, část světlobuněčných karcinomů a maligní Brennerův nádor. Typ II. jsou high grade nádory jejichž prekurzorické léze nejsou přesně definovány a zřejmě tedy vznikají de novo (s výjimkou části high grade serózních ovariálních karcinomů vznikajících v distální části děložní tuby na podkladě high grade serózní intraepiteliální neoplazie/ serózního tubárního intraepiteliálního karcinomu) (18). Tato skupina nádorů zahrnuje high grade serózní adenokarcinom, high grade endometroidní adenokarcinom, high grade karcinom z přechodních buněk, maligní smíšený mülleriánský nádor, nediferencovaný karcinom a zřejmě část světlobuněčných karcinomů (33). Na podkladě histologického typu nádoru lze poměrně přesně usuzovat na výskyt konkrétních genetických aberací (6, 31). V současné době histologický typ nádoru zásadně neovlivňuje charakter léčby a karcinomy ovaria jsou obvykle v první fázi léčeny kombinací platinových derivátů a taxanů. Odpověď některých typů nádorů jako např. světlobuněčného adenokarcinomu, mucinózního adenoakrcinomu a low grade serózního adenokarcinomu na tuto léčbu však není dobrá. V budoucnosti se pravděpodobně bude stále více uplatňovat léčba odlišná pro různé histologické typy karcinomů ovaria a individualizovaná léčba „šitá na míru“ konkrétním pacientům („tailored medicine“). Přesná klasifikace ovariálních nádorů proto získá zásadní význam.
Poděkování
Práce byla podpořena
Výzkumným záměrem MSM 0021620808.
Adresa pro korespondenci:
Doc. MUDr. Pavel Dundr, Ph.D.
Ústav patologie 1.LF UK a VFN
v Praze
Studničkova 2
128 00 Praha 2
e-mail: pdundr@seznam.cz
Sources
1. Ayhan, A., Kurman, R.J., Yemelyanova, A. et al.: Defining the cut point between low-grade and high-grade ovarian serous carcinomas: a clinicopathologic and molecular genetic analysis. Am. J. Surg. Pathol., 2009, 33 : 1220–1224.
2. Bowen, N.J., Walker, L.D., Matyunina, L.V. et al.: Gene expression profiling supports the hypothesis that human ovarian surface epithelia are multipotent and capable of serving as ovarian cancer initiating cells. BMC Med. Genomics, 2009, 2 : 71.
3. Bristow, R.E., Tomacruz, R.S., Armstrong, D.K., Trimble, E.L., Montz, F.J.: Survival effect of maximal cytoreductive surgery for advanced ovarian carcinoma during the platinum era: a meta-analysis. J. Clin. Oncol., 2002, 20 : 1248–1259.
4. Burks, R.T., Sherman, M.E., Kurman, R.J.: Micropapillary serous carcinoma of the ovary. A distinctive low-grade carcinoma related to serous borderline tumors. Am. J. Surg. Pathol., 1996, 20 : 1319–1330.
5. Cantrell, L.A., Van Le, L.: Carcinosarcoma of the ovary: a review. Obstet. Gynecol. Surv., 2009, 64 : 673–680.
6. Cho, K.R.: Ovarian cancer update: lessons from morphology, molecules, and mice. Arch. Pathol. Lab. Med., 2009, 133 : 1775–1781.
7. Cuatrecasas, M., Catasus, L., Palacios, J., Prat, J.: Transitional cell tumors of the ovary: a comparative clinicopathologic, immunohistochemical, and molecular genetic analysis of Brenner tumors and transitional cell carcinomas. Am. J. Surg. Pathol., 2009, 33 : 556–567.
8. Dubé, V., Roy, M., Plante, M., Renaud, M.C., Tźtu, B.: Mucinous ovarian tumors of Mullerian-type: an analysis of 17 cases including borderline tumors and intraepithelial, microinvasive, and invasive carcinomas. Int J Gynecol. Pathol., 2005, 24 : 138–146.
9. Euscher, E.D., Malpica, A., Deavers, M.T., Silva, E.G.: Differential expression of WT-1 in serous carcinomas in the peritoneum with or without associated serous carcinoma in endometrial polyps. Am. J. Surg. Pathol., 2005, 29 : 1074–1078.
10. Folkins, A.K., Jarboe, E.A., Saleemuddin, A. et al.: A candidate precursor to pelvic serous cancer (p53 signature) and its prevalence in ovaries and fallopian tubes from women with BRCA mutations. Gynecol. Oncol., 2008, 109 : 168–173.
11. Hart, W.R.: Mucinous tumors of the ovary: a review. Int. J. Gynecol. Pathol., 2005, 24 : 4-25.
12. Kikkawa, F., Kawai, M., Tamakoshi, K. et al.: Mucinous carcinoma of the ovary. Clinicopathologic analysis. Oncology, 1996, 53 : 303–307.
13. Köbel, M., Kalloger, S.E., Carrick, J. et al.: A limited panel of immunomarkers can reliably distinguish between clear cell and high-grade serous carcinoma of the ovary. Am. J. Surg. Pathol., 2009, 33 : 14–21.
14. Köbel, M., Kalloger, S.E., Santos, J.L., Huntsman, D.G., Gilks, C.B., Swenerton, K.D.: Tumor type and substage predict survival in stage I and II ovarian carcinoma: insights and implications. Gynecol. Oncol., 2010, 116 : 50–56.
15. Kuo, K.T., Mao, T.L., Jones, S. et al.: Frequent activating mutations of PIK3CA in ovarian clear cell carcinoma. Am. J. Pathol., 2009, 174 : 1597-1601.
16. Kurman, R.J., Shih, I.M.: The origin and pathogenesis of epithelial ovarian cancer: a proposed unifying theory. Am. J. Surg. Pathol., 2010, 34 : 433–443.
17. Lee, K.R., Young, R.H.: The distinction between primary and metastatic mucinous carcinomas of the ovary: gross and histologic findings in 50 cases. Am. J. Surg. Pathol., 2003, 27 : 281–292.
18. Levanon, K., Crum, C., Drapkin, R.: New insights into the pathogenesis of serous ovarian cancer and its clinical impact. J. Clin. Oncol., 2008, 26 : 5284–5293.
19. Logani, S., Oliva, E., Amin, M.B., Folpe, A.L., Cohen, C., Young, R.H.: Immunoprofile of ovarian tumors with putative transitional cell (urothelial) differentiation using novel urothelial markers: histogenetic and diagnostic implications. Am. J. Surg. Pathol., 2003, 27 : 1434–1441.
20. Madore, J., Ren, F., Filali-Mouhim, A. et al.: Characterization of the molecular differences between ovarian endometrioid carcinoma and ovarian serous carcinoma. J. Pathol., 2010, 220 : 392–400.
21. Malpica, A., Deavers, M.T., Lu, K. et al.: Grading ovarian serous carcinoma using a two-tier system. Am. J. Surg. Pathol., 2004, 28 : 496–504.
22. McAlpine, J.N., Wiegand, K.C., Vang, R. et al.: HER2 overexpression and amplification is present in a subset of ovarian mucinous carcinomas and can be targeted with trastuzumab therapy. BMC Cancer, 2009, 9 : 433.
23. McCluggage, W.G., Young, R.H.: Primary ovarian mucinous tumors with signet ring cells: report of 3 cases with discussion of so-called primary Krukenberg tumor. Am. J. Surg. Pathol., 2008, 32 : 1373–1379.
24. Nonaka, D., Chiriboga, L., Soslow, R.A.: Expression of pax8 as a useful marker in distinguishing ovarian carcinomas from mammary carcinomas. Am. J. Surg. Pathol., 2008, 32 : 1566–1571.
25. O’Neill, C.J., Deavers, M.T., Malpica, A., Foster, H., McCluggage, W.G.: An immunohistochemical comparison between low-grade and high-grade ovarian serous carcinomas: significantly higher expression of p53, MIB1, BCL2, HER-2/neu, and C-KIT in high-grade neoplasms. Am. J. Surg. Pathol., 2005, 29 : 1034–1041.
26. O’Neill, C.J., McBride, H.A., Connolly, L.E., Deavers, M.T., Malpica, A., McCluggage, W.G.: High-grade ovarian serous carcinoma exhibits significantly higher p16 expression than low-grade serous carcinoma and serous borderline tumour. Histopathology, 2007, 50 : 773–779.
27. Phillips, V., Kelly, P., McCluggage, W.G.: Increased p16 expression in high-grade serous and undifferentiated carcinoma compared with other morphologic types of ovarian carcinoma. Int. J. Gynecol. Pathol., 2009, 28 : 179–186.
28. Provenza, C., Young, R.H., Prat, J.: Anaplastic carcinoma in mucinous ovarian tumors: a clinicopathologic study of 34 cases emphasizing the crucial impact of stage on prognosis, their histologic spectrum, and overlap with sarcomalike mural nodules. Am. J. Surg. Pathol., 2008, 32 : 383–389.
29. Sarrió, D., Moreno-Bueno, G., Sánchez-Estévez, C. et al.: Expression of cadherins and catenins correlates with distinct histologic types of ovarian carcinomas. Hum. Pathol., 2006, 37 : 1042–1049.
30. Schipf, A., Mayr, D., Kirchner, T., Diebold, J.: Molecular genetic aberrations of ovarian and uterine carcinosarcomas – a CGH and FISH study. Virchows Arch., 2008, 452 : 259–268.
31. Shaw, P.A., McLaughlin, J.R., Zweemer, R.P. et al.: Histopathologic features of genetically determined ovarian cancer. Int. J. Gynecol. Pathol., 2002, 21 : 407–411.
32. Shaw, P.A., Rouzbahman, M., Pizer, E.S., Pintilie, M., Begley, H.: Candidate serous cancer precursors in fallopian tube epithelium of BRCA1/2 mutation carriers. Mod. Pathol., 2009, 22 : 1133–1138.
33. Shih, I.M., Kurman, R.J.: Ovarian tumorigenesis: a proposed model based on morphological and molecular genetic analysis. Am. J. Pathol., 2004, 164 : 1511–1518.
34. Shimizu, Y., Kamoi, S., Amada, S., Akiyama, F., Silverberg, S.G.: Toward the development of a universal grading system for ovarian epithelial carcinoma: testing of a proposed system in a series of 461 patients with uniform treatment and follow-up. Cancer, 1998, 82 : 893–901.
35. Singer, G., Oldt, R. 3rd, Cohen, Y. et al.: Mutations in BRAF and KRAS characterize the development of low-grade ovarian serous carcinoma. J. Natl. Cancer Inst., 2003, 95 : 484–486.
36. Tabrizi, A.D., Kalloger, S.E., Köbel, M. et al.: Primary ovarian mucinous carcinoma of intestinal type: significance of pattern of invasion and immunohistochemical expression profile in a series of 31 cases. Int. J. Gynecol. Pathol., 2010, 29 : 99–107.
37. Tavassoli, F.A., Devilee, P (Eds.): WHO Classification of Tumours: Tumours of the Breast and Female Genital Organs. 2003, IARC Press, Lyon.
38. Vang, R., Gown, A.M., Barry, T.S., Wheeler, D.T., Ronnett, B.M.: Immunohistochemistry for estrogen and progesterone receptors in the distinction of primary and metastatic mucinous tumors in the ovary: an analysis of 124 cases. Mod. Pathol., 2006, 19 : 97–105.
39. Vang, R., Gown, A.M., Barry, T.S. et al.: Cytokeratins 7 and 20 in primary and secondary mucinous tumors of the ovary: analysis of coordinate immunohistochemical expression profiles and staining distribution in 179 cases. Am. J. Surg. Pathol., 2006, 30 : 1130–1139.
40. Vang, R., Gown, A.M., Farinola, M. et al.: p16 expression in primary ovarian mucinous and endometrioid tumors and metastatic adenocarcinomas in the ovary: utility for identification of metastatic HPV-related endocervical adenocarcinomas. Am. J. Surg. Pathol., 2007, 31 : 653–663.
41. Vang, R., Shih, I.M., Kurman, R.J.: Ovarian low-grade and high-grade serous carcinoma: pathogenesis, clinicopathologic and molecular biologic features, and diagnostic problems. Adv. Anat. Pathol., 2009, 16 : 267–282.
42. Wong, K.K., Lu, K.H., Malpica, A. et al.: Significantly greater expression of ER, PR, and ECAD in advanced-stage low-grade ovarian serous carcinoma as revealed by immunohistochemical analysis. Int. J. Gynecol. Pathol., 2007, 26 : 404–409.
43. Yamamoto, S., Tsuda, H., Aida, S., Shimazaki, H., Tamai, S., Matsubara, O.: Immunohistochemical detection of hepatocyte nuclear factor 1beta in ovarian and endometrial clear-cell adenocarcinomas and nonneoplastic endometrium. Hum. Pathol., 2007, 38 : 1074–1080.
Labels
Anatomical pathology Forensic medical examiner ToxicologyArticle was published in
Czecho-Slovak Pathology

2010 Issue 3
-
All articles in this issue
- Karcinomy ovaria: současné diagnostické principy
- Falešně negativní PAP test? Cytopatolog v roli člena skupiny znalců při pozdní diagnóze cervikálního karcinomu
- Autoimunní pankreatitida s postižením žlučovodů a jater jako součást IgG4 pozitivního autoimunního onemocnění (IgG4-related autoimmune sclerosing disease). Kazuistika
- Autosomálně dominantní polycystóza ledvin u plodu se zdánlivě negativní rodinnou anamnézou – kazuistika
- Myxóm nervového púzdra (nerve sheath myxoma) so schwannómovou a perineurálnou diferenciáciou
- Czecho-Slovak Pathology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Karcinomy ovaria: současné diagnostické principy
- Autosomálně dominantní polycystóza ledvin u plodu se zdánlivě negativní rodinnou anamnézou – kazuistika
- Autoimunní pankreatitida s postižením žlučovodů a jater jako součást IgG4 pozitivního autoimunního onemocnění (IgG4-related autoimmune sclerosing disease). Kazuistika
- Falešně negativní PAP test? Cytopatolog v roli člena skupiny znalců při pozdní diagnóze cervikálního karcinomu
