Melanocytární pseudotumory
Melanocytic pseudotumors
Melanocytic lesions are one of the most difficult chapters of dermatopathology when you consider the number of entities, high frequency of excisions and serious consequences of a mistaken diagnosis. Melanocytic pseudotumours, benign lesions simulating melanoma, are its subgroup. At present, it is possible to designate 25 entities and situations. Spitzoid, combined, spindle cell and hyperpigmented lesions belong to the most common problems in the differential diagnosis. Not only histological but also clinical – dynamical and morphological – criteria ought to be taken into account for the maximally correct diagnosis. In heterogeneous lesions it is necessary, although difficult, to try to find the individual components of the lesion in sections. For this reason it is important to know the macroscopy of a particular lesion. In cases where it is impossible to make a reliable decision between benignity and malignancy it is necessary to choose the optimal therapeutic approach in collaboration with a clinical physician.
Keywords:
melanoma simulators – histology - borderline melanocytic lesions – diagnostic approach
:
L. Pock
:
Dermatohistopatologická laboratoř, Praha
:
Čes.-slov. Patol., 48, 2012, No. 3, p. 127-134
:
Reviews Article
Melanocytární léze patří s ohledem na rozsah problematiky, vysoký počet excizí a závažnost důsledků chybné diagnózy k nejobtížnějším kapitolám dermatopatologie. Jejich podskupinou jsou benigní léze napodobující melanom – melanocytární pseudotumory. V současné době lze takto označit 25 jednotek a stavů. K častějším diferenciálně diagnostickým okruhům patří léze spitzoidní, kombinované, vřetenobuněčné a hyperpigmentované. Pro dosažení maximální přesnosti diagnózy je nutno brát v úvahu nejen kritéria histologická, ale i klinická – dynamická a morfologická. U heterogenních lézí je obtížné, avšak nezbytné, snažit se o zachycení jednotlivých komponent v řezech – i pro tento účel je důležitá detailní znalost makroskopie dané léze. V případech, kde se nepodaří dospět ke spolehlivému rozhodnutí mezi benignitou a malignitou je nutné ve spolupráci s klinickým lékařem zvolit optimální postup terapie a dispenzarizace.
Klíčová slova:
simulátory melanomu – histologie – hraniční melanocytární léze – diagnostické postupy
Melanocyt je chameleon, který dovede vytvářet četné mimikry. V melanomu dovede napodobit melanocyt v melanocytárním névu (MN), ale i jiné buňky – fibroblasty, sebocyty, epitelové buňky, rhabdomyocyty, chondrocyty (1) a je schopen i oncocytární metaplázie (2). Co platí o melanocytu, platí i o lézích, které tvoří – MN dovede napodobit melanom a obráceně. To je bohatým zdrojem diagnostických rozpaků a někdy i omylů. Zásadní nesouhlas v histologické diagnóze obtížných melanocytárních lézí byl i mezi experty 25 % (3), u spitzoidních byl souhlas mezi experty jen ve 30 % (4). Je tedy zřejmé, že kromě pólových situací benignity a malignity existuje šedá zóna, kde je obtížné až nemožné diagnózu spolehlivě stanovit. Následující text shrnuje dnes známé simulátory melanomu, diagnostické postupy u některých z nich a poskytuje návod praktického přístupu k diferenciální diagnóze těchto lézí v rutinní praxi.
SIMULÁTORY MELANOMU
Melanocytární léze benigní napodobující různé typy melanomu shrnuje tabulka č. 1. V tomto článku se nelze věnovat pro značný rozsah podrobně všem uvedeným jednotkám, zaměřím se proto poznámkami na obtížnější diferenciálně diagnostické okruhy, které jsou vyjádřeny ve schématech 1 až 4. Jde o léze spitzoidní, kombinované, vřetenobuněčné a hyperpigmentované.
Spitzoidní léze
Spitzoidní léze (schéma č. 1) může být architekturou převážně intraepidermální nebo intradermální. V prvním případu je v diferenciální diagnóze povrchově se šířící, ve druhém nodulární melanom. Névus Spitzové vzniká do 20 let věku v 79 %, jen v 6 % u lidí starších 45 let (5,6), se vzrůstajícím věkem tedy klesá pravděpodobnost, že jde o névus Spitzové.
A. Malé zvětšení. Na melanom může ukazovat některý z následujících znaků – asymetrie, neostré laterální ohraničení, nesouměrnost v pigmentaci, velikosti i rozmístění hnízd melanocytů, expanze junkční složky za hranici složky dermální, hlubší průnik, melanin v hlubších partiích, neobvykle velká hnízda melanocytů ve větší hloubce koria a útlak okolí. B. Větší zvětšení. Melanocyty vřetenitého a/nebo epiteloidního typu jsou pleomorfní, avšak na rozdíl od melanomu všechny podobným způsobem, jádra jsou hypochromní. Mitózy mohou být u mladých pacientů dosti četné, jsou však omezeny na povrchní část léze a nejsou atypické. Varovný je počet mitóz vyšší než 2/mm2 (7). Kolem hnízd melanocytů a jednotlivých elementů jsou často retrakční štěrbiny, tyto jsou u melanomu vzácné (8). Pagetoidní šíření melanocytů v centru léze není neobvyklé, není však tak intenzivní jako u melanomu. Kaminova tělíska jsou u névu Spitzové obvykle početná a ve shlucích, zatímco u melanomu ojedinělá. HMB-45 je pozitivní v povrchních partiích (u melanomu spíše v celém rozsahu). Ki-67 je pozitivní v méně než 5 % melanocytů a jen povrchně, v melanomu je pozitivních jader více a v celém rozsahu léze, p53 je v névu Spitzové negativní, ale často pozitivní v nodulárním melanomu. U intraepidermální formy névu Spitzové jsou varovné oblasti výraznějšího pagetoidního šíření a proliferující hnízda melanocytů (7).
Desmoplastický névus Spitzové nemá téměř nikdy junkční složku, zatímco desmoplastický melanom ji má téměř vždy. HMB-45 a Melan-A jsou v něm pozitivní, zatímco v desmoplastickém melanomu téměř vždy negativní (9,10).
Pagetoidní névus Spitzové je jeho variantou v rané fázi vývoje, kdy je přítomna jen epidermální složka napodobující pagetoidní šíření melanocytů v in situ melanomu (11,12). Pacienty jsou děti a mladiství. V dolní polovině epidermis jsou jednotlivé zvětšené epiteloidní melanocyty, které jsou od okolních keratinocytů odděleny retrakčními štěrbinami. Pro melanom in situ svědčí dospělý věk, jemný melanin a mitotická aktivita.
„SPARK´S“ névus má cytologii névu Spitzové (SP) a architekturu Clarkova (ARK), neboli dysplastického, névu – napodobuje tak drobný melanom. Věkové rozmezí je široké, s průměrem 33 let. Klinicky je atypický ve tvaru a barvě, nemění se však, velikost je do 1 cm (13). Histologicky jde o lézi symetrickou, ostře ohraničenou, plochou. Vřetenité melanocyty jsou orientovány většinou paralelně s epidermis a častěji jsou spojeny s lamelární fibroplázií. Často jsou přítomna Kaminova tělíska.
STUMP (spitzoid tumor of uncertain malignant potential) je léze s atypiemi, pro které je odlišení od spitzoidního melanomu nespolehlivé až nemožné. Jde o podskupinu MELTUMP (viz níže). Z hlediska biologických vlastností pacienti s tímto typem léze mají celkově lepší prognózu než pacienti s melanomem. Mají sice často postižené sentinelové lymfatické uzliny – 47 % v nejpočetnější sestavě 67 pacientů (14) – pacienti však neumírají, mají méně četné rekurence a delší intervaly mezi nimi.
Jedná se o noduly podobné benignímu névu Spitzové nebo s nepravidelnou pigmentací, mohou se vyskytovat u dospělých i u dětí (15). Histologicky bývají spíše větší (i více než 1 cm), asymetrické, někdy s ulcerací, zasahají do hloubky. Okraje utlačují okolí, není přítomno vyzrávání, buněčnost je značná. Melanocyty jsou velké, pleomorfní, s prominujícími jadérky, četnými mitózami (více než 6/mm2) a s pagetoidním šířením v horní polovině epidermis. Kaminova tělíska jsou nečetná nebo chybějí. Pozitivita HMB-45 se směrem do hloubky STUMP snižuje, naproti tomu u melanomu je většinou difúzněji či nepravidelně pozitivní. Ki-67 je u STUMP pozitivní v 10 % a je v povrchních partiích. U melanomu je pozitivita Ki-67 vyšší (37 %) a je roztroušena v celé lézi (15).
Kombinované léze
Kombinované léze (schéma č. 2) mají v diferenciální diagnóze melanom sekundárně vzniklý v névu.
A. Malé zvětšení. Jde o léze dermoepidermální s převažující složkou dermální. Odlišný fenotyp skupiny melanocytů je většinou nápadný větším obsahem melaninu, vzácněji jej lze identifikovat až při větším zvětšení odlišnou cytomorfologií – bez zvýšené melaninogeneze. Klonální névus (obr. 1) je povrchnější než névus kombinovaný, má klonus morfologicky odlišných buněk většinou menší než je odlišná komponenta v kombinovaném névu. Klonus je ostře ohraničený, spíše při středu léze (16). Charakteristicky v původním névu vznikne tmavší šedomodré nebo modročerné ložisko v centru nebo excentricky, do 2 mm v průměru. Dermální komponenta u hluboko penetrujícího névu je typicky ostře ohraničená a ve fascikulární nebo plexiformní konfiguraci sestupuje do dolního koria, případně až do subcutis podél neurovaskulárních svazků a kožních adnex. Junkční komponenta je přítomna v 60 – 85 % (8). Praxe ukazuje, že ne vždy se podaří striktně oddělit hluboko penetrující névus od névu klonálního. Při srovnání velkého počtu těchto lézí byla zjištěna podskupina 19 % lézí, které se překrývají. Hluboko penetrující névus proniká do větší hloubky koria a má větší tendenci k šíření podle adnex, zatímco klonální névus je omezen na horní polovinu koria, má větší junkční komponentu a jeho součástí je standardní névus (17). Celulární modrý névus tvoří nodulární masu v rozsahu celého koria, někdy zasahuje i do subcutis. Tím je dosti blízký hluboko penetrujícímu névu, neobsahuje však junkční složku a má spíše méně melaninu. Proliferativní nodulus vzniká většinou v kongenitálních, někdy však i získaných MN, u dětí i v pozdějším věku a v dospělosti (18,19). Klinicky jde o černý uzlík do 1 cm, histologicky o ostře ohraničený nodulus odlišných melanocytů v dermální komponentě.
B. Větší zvětšení. Tmavší ložisko u klonálního névu koresponduje s poměrně ostře ohraničenou skupinou mírně atypických epiteloidních melanocytů s melanofágy v horní části koria. Melanocyty obsahují jemně zrnitý melanin. U kombinovaného névu (obr. 2) jde o výskyt dvou a více populací melanocytů v jedné lézi – nejčastěji standardní névocelulární a hluboko penetrující névus (20), avšak i névocelulární a modrý, méně i névus Spitzové (8). Obě komponenty jsou buď promíchané nebo ostře oddělené. Klinická manifestace kombinovaného névu je podobná jako u klonálního. Melanom lze odlišit pagetoidním šířením v epidermis, jaderným pleomorfismem, expanzivním růstem v dermis a mitózami. Hluboko penetrující névus je tvořen epiteloidními a vřetenitými melanocyty. Epiteloidní melanocyty jsou četnější v povrchnějších, vřetenité v nižších partiích. Bývá patrný mírný pleomorfismus a hyperchromázie jader. Celulární modrý névus je tvořen dvěma druhy melanocytů – většími vřetenitými, se světlou cytoplasmou a oválným jádrem bez výraznějšího jadérka a protaženými bipolárními či dendritickými melanocyty s jemným melaninem, které jsou stejné jako u modrého névu. Stroma je často sklerotické, příměs tvoří melanofágy. Často bývají přítomny i noduly nepigmentovaných světlých melanocytů obklopených denzním kolagenním vazivem. Maligní modrý névus se liší nekrózou, pleomorfismem jader a větším počtem mitóz. Mitózy melanocytů u všech výše uvedených névů nejsou přítomny nebo jsou ojedinělé, spíše v horní třetině léze (17). Melanocyty jsou HMB-45 pozitivní v klonu klonálního névu, hluboko penetrujícího névu a nejednou i v epiteloidní složce kombinovaného névu. Protože může být pozitivita i v melanomu, nelze ji použít jako odlišující kritérium. Proliferativní nodulus je tvořen většími epiteloidními nebo vřetenitými melanocyty s mírně pleomorfní jádrem, bez výrazného jadérka a s dosti hojnou cytoplasmou. Mitózy jsou řídké, méně než 1/mm2. Buněčnost nodulu je větší než okolního névu, vyzrávání do hloubky je zachováno. Sekundární melanom v névu je spojen s větším pleomorfismem jader melanocytů, mitotickou aktivitou, event. atypickými mitózami.Velmi vzácně vzniká sekundární melanom v intradermální části névu (21), pak je jeho rozvoj klinicky téměř nepostižitelný. Histologicky vyžaduje stejnou pozornost jako melanom névoidní, tj. identifikovat nodulární architekturu v jinak normálně stratifikovaném névu a v detailu pak mitózy a jaderné atypie.
Vřetenobuněčné léze
Vřetenobuněčné léze, hypo - nebo amelanotické (schéma č. 3) je nutno odlišit od desmoplastického melanomu.
A. Malé zvětšení. Desmoplastický melanom vzniká nejčastěji na hlavě a krku. Na rozdíl od benigních lézí sahá do větší hloubky, má nepravidelně uspořádanou junkční složku a výraznější infiltráty lymocytů kolem celé léze. O desmoplastickém névu Spitzové viz výše v lézích spitzoidních. Desmoplastický névus (obr. 3) vzniká u dospělých i u dětí, nejčastěji na končetinách (22). Histologicky je malý (do 4 mm), symetrický, většinou smíšený, méně často čistě intradermální, s malým množstvím melaninu nebo bez něj, spíše jen v horní polovině koria.
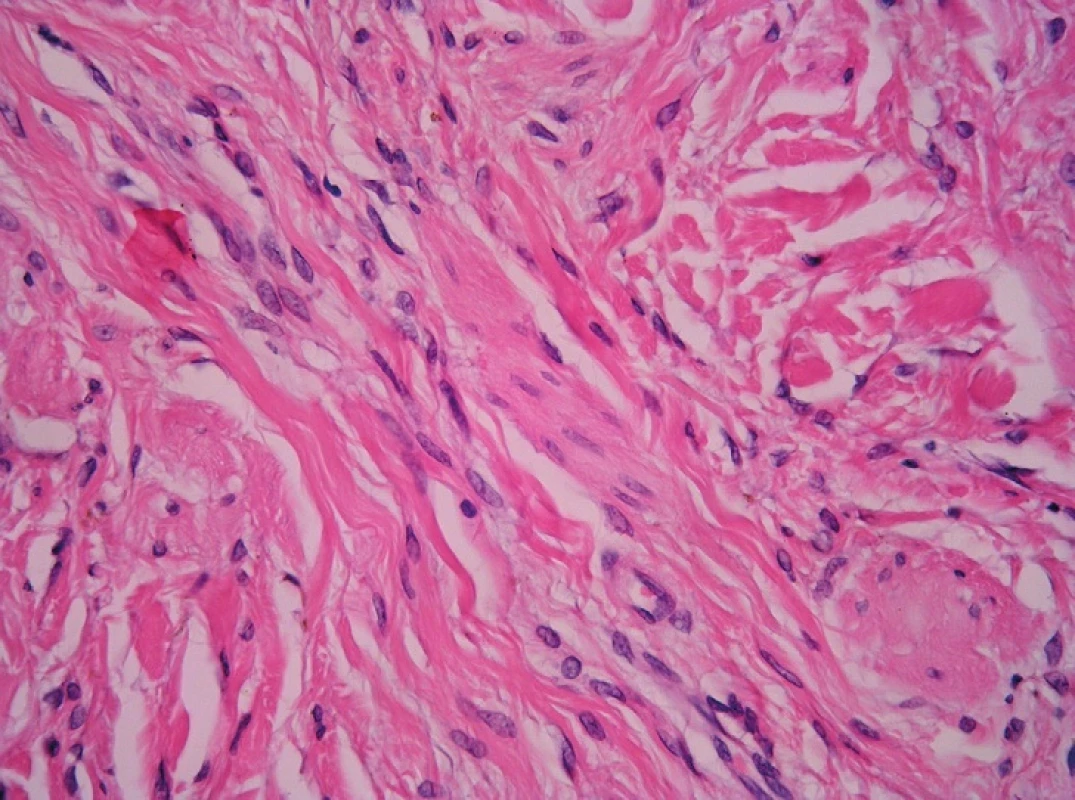
B. Větší zvětšení. U desmoplastického névu jsou melanocyty různého typu – névocyty typu A, B i C, dále dendritické a spitzoidní. Melanofágy nečetné nebo žádné, kolagenní stroma je většinou denzní, méně často jemně fibrilární až podobné neurofibromu. Mitotická aktivita je nulová nebo absolutně ojedinělá, vykazuje HMB-45 a Melan-A pozitivitu (23). Desmoplastický melanom má větší mitotickou aktivitu – nad 5 % (23), je HMB-45 negativní, Melan-A jen ve 3 % fokálně pozitivní (23). Odlišující znaky je nutno uvažovat v kontextu, neboť desmoplastický névus se může podobat desmoplastickému melanomu určitým stupněm atypií melanocytů a v obou může být exprese HMB-45 v povrchových partiích (24). Amelanotický modrý névus je variantou celkovou stavbou shodnou s modrým névem, avšak jen s malým nebo žádným melaninem. Melan-A je v něm pozitivní, jeho mitotická aktivita detekovaná Ki-67 je nulová. Amelanotický celulární modrý névus má stejnou stavbu i cytologický charakter jako celulární modrý névus, avšak bez melaninu. Vědět o této podjednotce je nutné pro odlišení od melanomu (především desmoplastického a od melanomu měkkých tkání) a vřetenobuněčných mesenchymálních tumorů (25). Nezralá jizva má řadu společných rysů s desmoplastickým melanomem – hypercelularitu, nodulární lymfoidní infiltráty, myxoidní stroma a atypická jádra (26). Melanom odliší melanocytární proliferace v epidermis nad lézí a pozitivita S100 a/nebo HMB-45. Důležitá je též klinická korelace a revize předchozí biopsie.
Hyperpigmentované léze
Hyperpigmentované léze (schéma č. 4) je nutno odlišit od pigment syntetizujícího melanomu a zregredovaného melanomu formou nodulární melanózy.
A. Malé zvětšení u této skupiny afekcí může do určité míry odlišit hluboko penetrující névus dosti charakteristickými, ostře ohraničenými protruzemi do hloubky, jinak však je důležitější cytologie. U ostatních jde o masivní infiltraci retikulárního koria silně pigmentovanými buňkami.
B. Větší zvětšení. Epiteloidní modrý névus (obr. 4) tvoří vyklenutá léze v retikulárním koriu neostrého ohraničení, která často sahá výrazně do dolního koria, případně i do subcutis s tendencí šířit se podél kožních adnex (27). Na rozdíl od modrého névu není patrná fibróza stromatu. Je tvořen dvěma druhy melanocytů a melanofágy. První typ melanocytů je globulární nebo dendritický, silně pigmentovaný, druhý polygonální, slabě pigmentovaný, s hojnou cytoplasmou. Obojí druh melanocytů má dosti zřetelná jadérka a je HMB-45 pozitivní. Není patrné vyzrávání. Navíc jsou přítomny melanofágy roztroušené v celé lézi. Pigment syntetizující melanom se liší cytologickými atypiemi, mitotickou aktivitou a proliferací v epidermis. Jak je uvedeno níže, některé případy však nelze odlišit a používá se pro ně ne všemi přijatý termín pigmentovaný epiteloidní melanocytom. Je to provizorní jednotka pro dermální melanocytární léze, u kterých nelze rozhodnout mezi pigment syntetizujícím melanomem a epiteloidním modrým névem (28). V prvním kroku je nutno imunohistologicky rozhodnout, zda jde o lézi primárně melanocytární nebo melanofagickou. V prvním případě jde o problém pigmentovaného epiteloidního melanocytomu, ve druhém o možnou kompletní regresi melanomu, ale event. i epitelového nádoru, např. pigmentovaného basaliomu (29). Pro posouzení cytomorfologie je nevyhnutelné vybělení melaninu použitím peroxidu vodíku. Antigeny pro imunohistologické vyšetření S100 proteinu, HMB-45 a CD68 tímto postupem nejsou postiženy (30). Věk vzniku je jakýkoliv, ale je patrná predilekce pro dětský až mladých dospělých, klinicky jde o černý nebo modročerný nodulus (28); na rozdíl od toho je zregredovaný melanom spíše plochý. Mikroskopicky jsou přítomny 3 typy melanocytů – 2 typy epiteloidních a vřetenité + 10% melanofágů (28). V diferenciální diagnóze je nutno odlišit celulární, epiteloidní a maligní modrý névus, hluboko penetrující névus a tumorální melanózu (31).
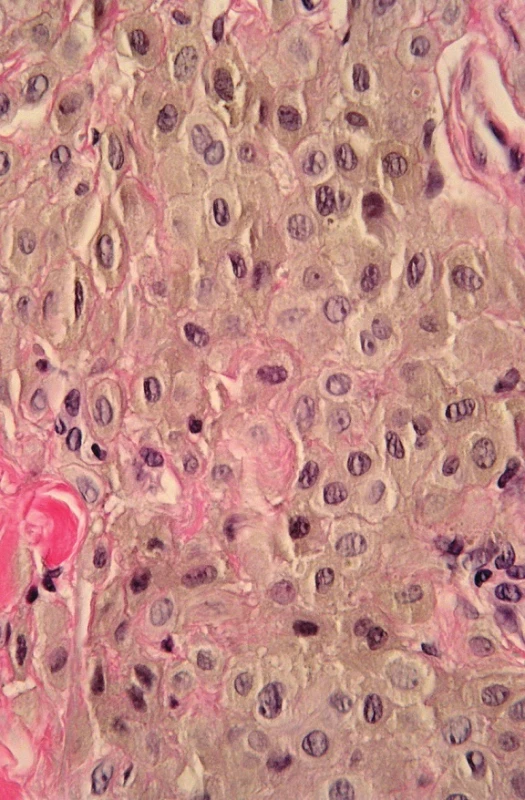
MELANOCYTÁRNÍ LÉZE S NEJISTÝMI BIOLOGICKÝMI VLASTNOSTMI
Některé melanocytární léze se přes veškeré úsilí nepodaří zařadit k névu nebo melanomu. Didakticky cenné jsou pro tyto případy dvě následující kategorie – SAMPUS a MELTUMP – naznačují vertikální rozměr a s ním spojenou prognózu v případě, že jde o melanom a tím i praktický terapeutický postup. Tyto kategorie nejsou běžně používány patology a nejsou v povědomí ani klinických lékařů, proto je nutné z hlediska bioptického vedle hesla připojit i stručný komentář.
SAMPUS (superficial atypical melanocytic proliferations of unknown significance)(obr. 5) jsou povrchní léze, které je obtížné odlišit od melanomu in situ nebo melanomu minimálně invazivního. Riziko metastáz je tedy malé (32). V rámci léze s rysy dysplastického junkčního nebo smíšeného névu, Reedova nebo povrchního névu Spitzové je fokálně lentiginózní proliferace melanocytů, mírné až střední atypie melanocytů, nepříliš intenzivní pagetoidní šíření a někdy subepidermální fibróza. Je nutné zajištění postupu jako u melanomu příslušného stupně vývoje, tedy většinou neširoká excize, případně reexcize s 0,5 – 1,0 cm nepostižených okrajů.
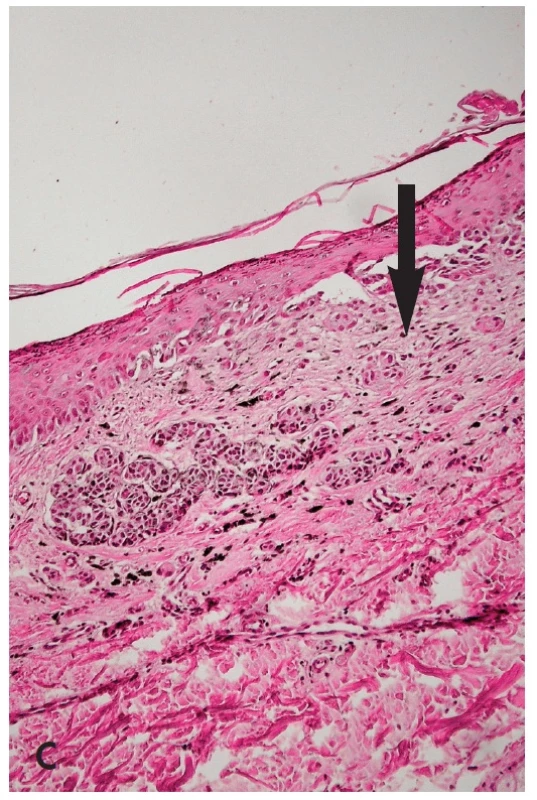
MELTUMP (melanocytic tumors of uncertain malignant potential) jsou nodulární léze sahající do větší hloubky koria, u kterých nelze s jistotou vyloučit nodulární melanom. Jejich význam spočívá v možnosti invazivního melanomu s rizikem metastáz. Patří sem různé léze s výraznou dermální komponentou – atypické léze podobné névu Spitzové, modrému névu, hluboko penetrujícímu névu a epiteloidní melanocytární proliferace (33). Histologicky jde o léze s epiteloidními a/nebo vřetenitými melanocyty s obvyklými atypickými rysy, jako jsou asymetrie, neostré laterální ohraničení, pagetoidní šíření, expanzivní růst, nepřítomnost vyzrávání, atypie melanocytů, mitózy i na bazi léze a zánětlivá reakce. Klinický lékař i pacient musí být poučeni o podstatě diagnostického problému a o tom, že další postupy, byť adekvátní diagnóze melanomu, neznamenají, že o melanom jde. (Re)excize musí být adekvátní k vertikálnímu rozměru jako u melanomu, k němu individuálně zvažovat i vyšetření sentinelové uzliny, nasazení terapie interferonem a dispenzarizaci pacienta (34).
PRAKTICKÉ POSTUPY U DIAGNOSTICKY OBTÍŽNÝCH MELANOCYTÁRNÍCH LÉZÍ
V případech, ve kterých nelze s jistotou rozhodnout mezi névem a melanomem lze doporučit následující postup.
A. Kritéria klinická. U diagnosticky nejistých lézí je nutno brát v úvahu kritéria nejen histologická, ale i klinická. Jde o dobu vzniku léze, změny velikosti, barvy a tvaru, které je nutno posuzovat podle míry souměrnosti, dermatoskopických znaků, ale i v klinickém kontextu rizikového typu kůže a jiných rizikových faktorů, jako na melanom pozitivní rodinné nebo osobní anamnézy, imunosupresivní terapie apod. Praxe ukazuje, že často nebývají atypie klinické na průvodce zaznamenány, a to i v případech, kdy jsou klinickému lékaři známy. Tehdy je zapotřebí snažit se získat je aktivně. Při neúplných klinických informacích může dojít k nezachycení rozhodujících částí léze v řezech a nezohlednění atypické dynamiky. Příkladem může být případ histologické diagnózy névu Spitzové stanovené na základě řezů z nodulární části heterogenní léze. Teprve při revizi bylo zjištěno, že existuje dermatoskopický obraz, který vedl k dodatečnému prokrájení ploché části léze, v níž byly zřetelné parametry povrchově se šířícího melanomu. Část nodulární byla jeho sekundárně nodulární částí se spitzoidními rysy.
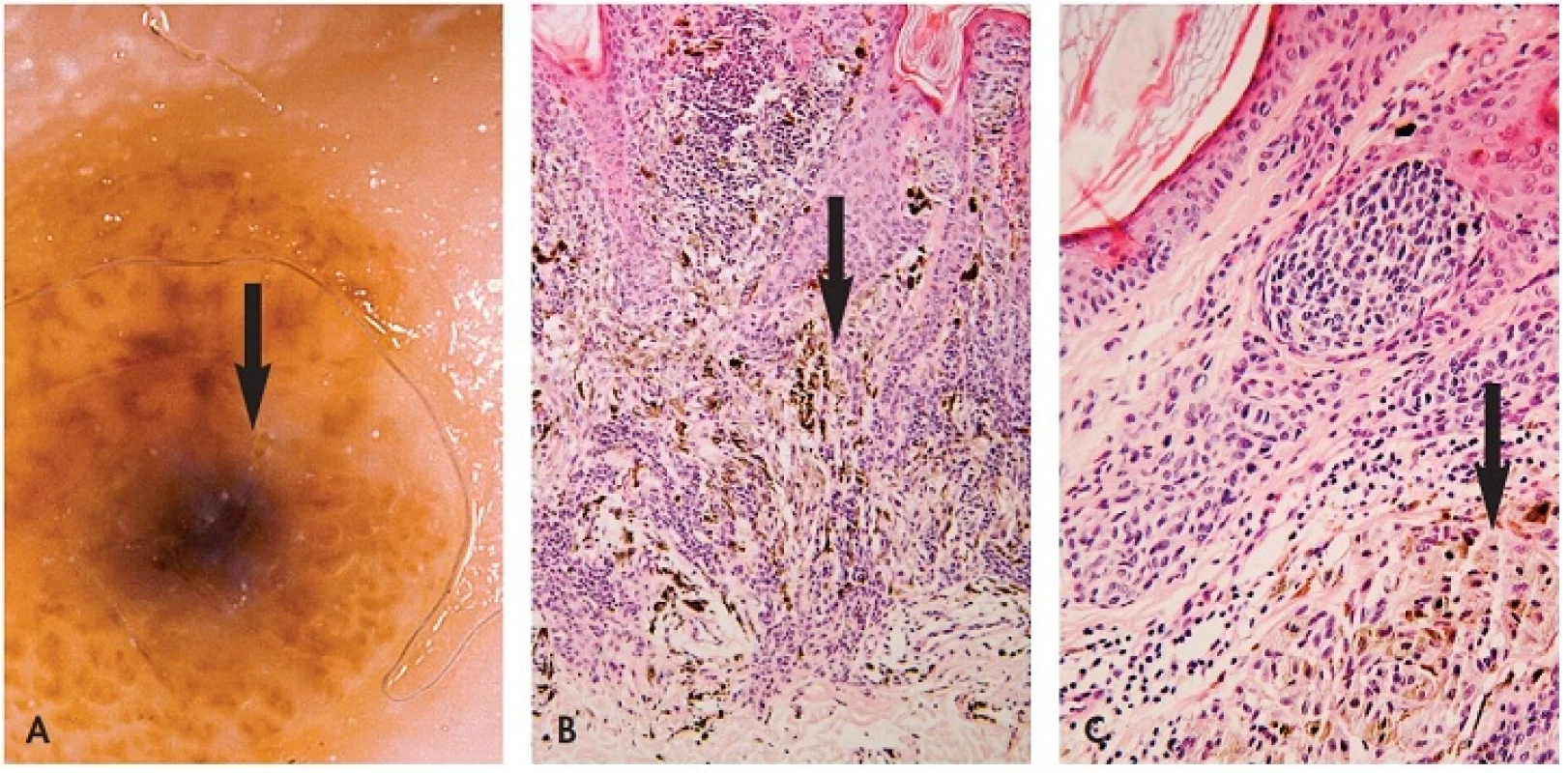
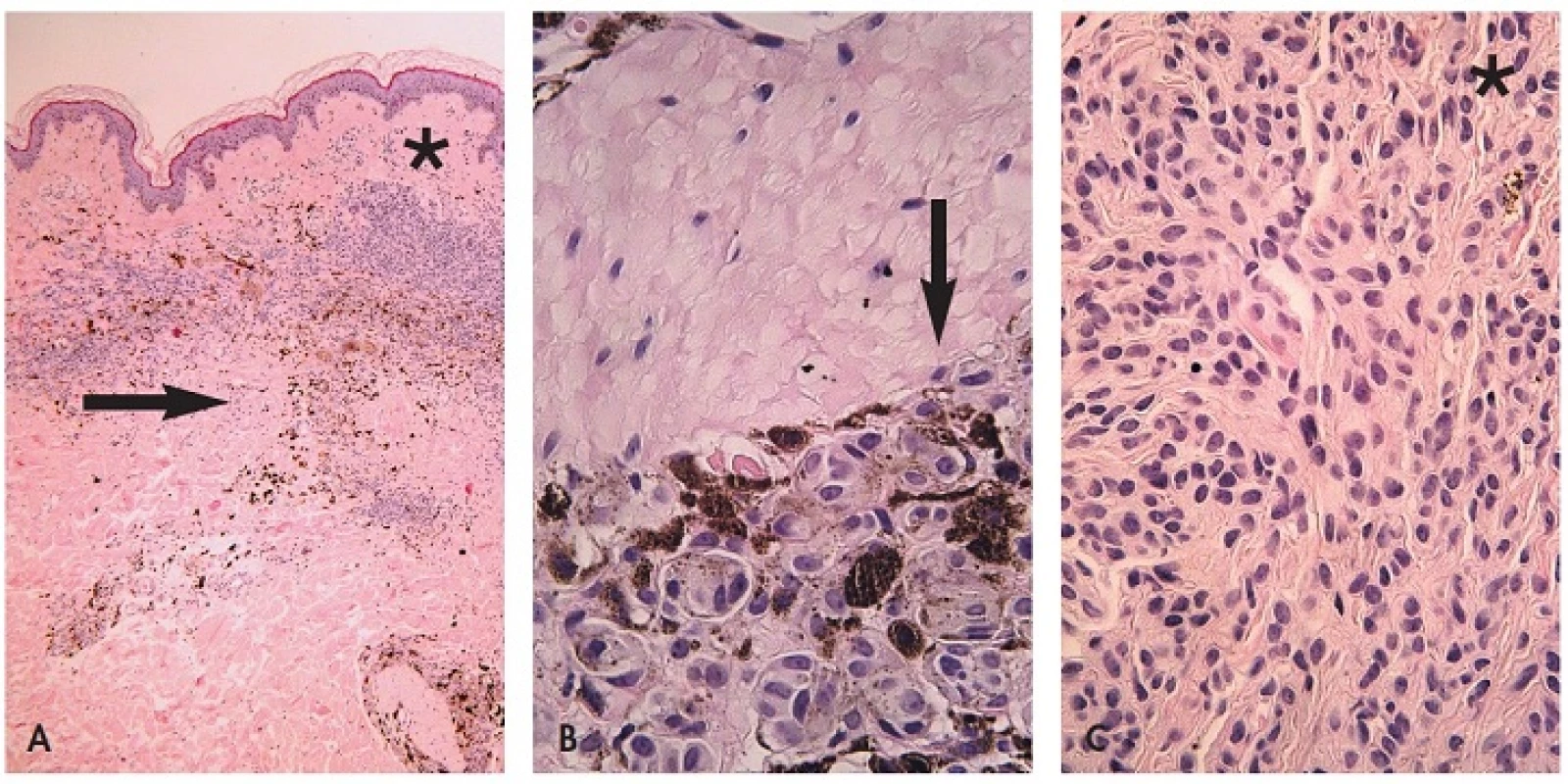
B. Makroskopické posouzení excidátu a přikrojení. U heterogenních lézí je nutné snažit se dostat do řezu atypická místa – depigmentace, hyperpigmentace a elevované části. Z hlediska makroskopického vzhledu léze in vivo i ex vivo jde o několik situací – „černá v hnědé“, “modrá v hnědé“ a “bílá v hnědé“ (35). V excidátu je možné je detailněji posuzovat i dermatoskopicky, neboť absence prokrvení zde většinou nehraje důležitou roli. Nejčastější je situace „černá v hnědé“ (obr. 6). Tyto změny jsou spojené většinou s fokálně zvýšenou melaninogenezí v junkční složce a transepidermální eliminací melaninu. Dysplázie je v 15 % a sekundární melanom v junkční složce MN vysvětluje jen 5 % těchto případů (36). „Modrá v hnědé“ má podklad v depozitu melaninu v retikulárním koriu. Může být projevem jedné ze 4 možností – klonální, kombinovaný névus, intradermální névus s výraznou pigmentací névocytů typu A a melanom v dermální úrovni MN (35). „Bílá v hnědé“ může znamenat jizvu po zranění MN, desmoplázii nebo regresi v névu nebo melanomu (obr. 5B,C - šipky). Ve všech těchto případech heterogenních lézí je nutno promyšleně provádět překrojení excidované tkáně tak, aby nedošlo k vykrájení kritických ložisek, ale aby byla v řezech zachycena. Protože nejvíce motivován v jejich zachycení je lékař, který bude provádět histologické hodnocení, měl by jejich překrojení provádět osobně.
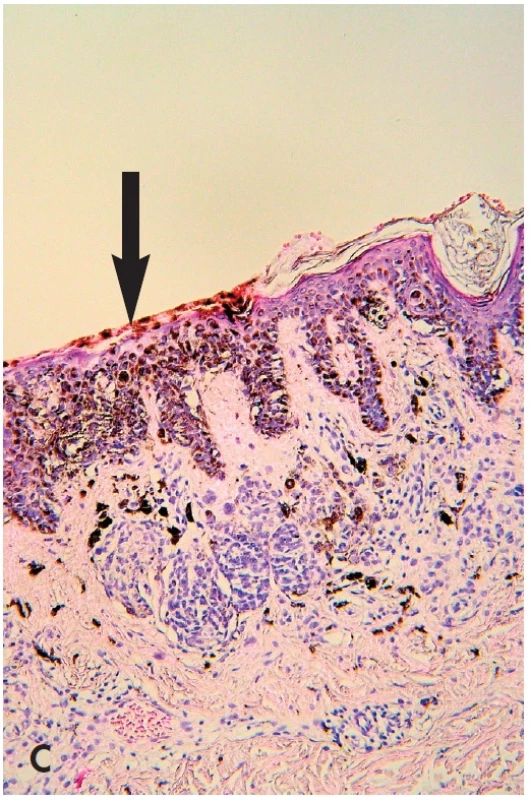
C. Histologické vyšetření. Každá jednotka simulátorů melanomu má svá specifická diagnostická kritéria, která zde nelze uvádět pro omezený rozsah článku, o části z nich jsem se zmínil výše.
ZÁVĚR
Posuzování atypických melanocytárních lézí sdílejících s melanomem určité rysy je obtížné. Znalost všech dosud známých podjednotek práci do určité míry usnadní (co má jméno, lze spíše diagnosticky uchopit). Na druhé straně v sobě skrývá riziko „poddiagnostikování“, proto je nutno uchovat si v nejistých případech dosti diagnostické skepse a zajistit dispenzarizaci pacienta. Bohužel, přes značný pokrok v kapitole melanocytárních lézí platí totéž, co o dvě generace histopatologů dříve – teprve dlouhodobé sledování a způsob smrti pacienta rozhodne o správnosti diagnózy ve sporných případech. Platí zde zlatá slova Cerroniho (37): “Moudrost spočívá v uvědomění si našich hranic: moudrost spočívá v pochopení, že jistota je iluze“.
Adresa pro korespondenci:
Doc. MUDr. Lumír Pock, CSc.
Dermatohistopatologická laboratoř
Mazurská 484, 181 00 Praha 8
e-mail: lumir.pock@volny.cz
Sources
1. Ackley CD, Prieto VG, Bentley RC, Horenstein MG, Seigler HF, Shea CR. Primary chondroid melanoma. J Cutan Pathol 2001; 28 : 482–485.
2. Jih DM, Morgan MB, Bass J, Tuthill R, Somach S. Oncocytic metaplasia occuring in a spectrum of melanocytic nevi. Am J Dermatopathol 2002; 24(6): 468–472.
3. Lodha S, Saggar S, Celebi JT, Sivers DN. Discordance in the diagnosis of difficult melanocytic neoplasm in the clinical settings. J Cutan Pathol 2008; 35(4): 349–352.
4. Barnhill RL, Argenyi ZB, From L, et al. Atypical Spitz nevi/tumors: lack of consensus for diagnosis, discrimination from melanoma, and prediction of outcome. Hum Pathol 1999; 30 : 513–520.
5. Coskey RJ, Mehregan A. Spindle cell nevi in adults and children. Arch Dermatol 1973; 108 : 535–536.
6. Requena C, Requena L, Kutzner H, et al. Spitz nevus: a clinicopathological study of 349 cases. Am J Dermatopathol 2009; 31 : 107–116.
7. Luo S, Sepehr A, Tsao H. Spitz nevi and other Spitzoid lesions. Part I. Background and diagnoses. J Am Acad Dermatol 2011; 65 : 1073–1084.
8. Luzur B, Bastian BC, Calonje E. Melanocytic nevi. In: Calonje E, Brenn T, Lazar A, McKee PH, eds. McKee’s Pathology of the skin with clinical correlations (4th ed). China, Elsevier Saunders; 2012 : 1151–1220.
9. Lazzaro B, Reebers A, Herlyn M, et al. Immunophenotyping of compound and Spitz nevi and vertical growth phase melanomas using a panel of monoclonal antibodies reactive in paraffin sections. J Invest Dermatol 1993; 100 : 313–317.
10. Bergman R, Azzam H, Sprecher E, et al. A comparative immunohistochemical study of MART-1 expression in Spitz nevi, ordinary melanocytic nevi, and malignant melanomas. J Am Acad Dermatol 2000; 42 : 496–500.
11. Choi JH, Sung KJ, Koh JK. Pigmented epithelioid cell nevus: a variant of Spitz nevus?. J Am Acad Dermatol 1993; 28 : 497–498.
12. LeBoit P. Spitz nevus: a look back and a look ahead. Adv Dermatol 2000; 10 : 81–108.
13. Ko CJ, McNiff M, Glusac J. Melanocytic nevi with features of Spitz nevi and Clark’s/dysplastic nevi („Spark’s nevi“). J Cutan Pathol 2009; 36 : 1063–1068.
14. Ludgate MW, Fullen DR, Lee J, et al. The atypical Spitz tumor of uncertain biologic potential: a series of 67 patients from a single institution. Cancer 2009; 115 : 631–641.
15. Tom WL, Hsu JW, Eichenfield LF, Fallon Friedlander S. Pediatric “STUMP“ lesions: Evaluation and management of difficult atypical Spitzoid lesions in children. J Am Acad Dermatol 2011; 64 : 559–572.
16. Ball NJ, Golitz LE. Melanocytic nevi with focal atypical epithelioid cell components: A review of seventy-three cases. J Am Acad Dermatol 1994; 30 (5): 724–729.
17. High WA, Alanen KW, Golitz LE. Is melanocytic nevus with focal atypical epithelioid components (clonal nevus) a superficial variant of deep penetrating nevus? J Am Acad Dermatol 2006; 55(3): 460–466.
18. Kiyohara T, Sawai T, Kumakiri M. Proliferative nodule in small congenital melanocytic naevus after childhood. Acta Derm Venereol 2011; 92 (1): 96–97.
19. Xu X, Belluci KSW, Elenitsas R, Elder DE. Cellular nodules in congenital pattern nevi. J Cutan Pathol 2004; 31 : 153–159.
20. Grunwald MH, Gat A, Amichai B. Pseudomelanoma after Solcoderm treatment. Melanoma Res 2006; 16 : 459–460.
21. Reed RJ. The histological variance of malignant melanoma: the interrelationship of histological subtype, neoplastic progression and biological behavior. Pathology 1985; 17 : 301–312.
22. Sherill AM, Crespo G, Prakash AV, Messina JL. Desmoplastic nevus: An entity distinct from Spitz nevus and blue nevus. Am J Dermatopathol 2011; 33 : 35–39.
23. Kucher C, Zhang PJ, Pasha T, et al. Expression of Melan-A and Ki-67 in desmoplastic melanoma and desmoplatic nevi. Am J Dermatopathol 2004; 26 : 452–457.
24. Harris GR, Shea CR, Horenstein MG, Reed JA, Burchette Jr. JL, Prieto VG. Desmoplastic (sclerotic) nevus. An underrecognized entity that resembles dermatofibroma and desmoplastic melanoma. Am J Surg Pathol 1999; 23(7): 786–794.
25. Zembowicz A, Granter SR, McKee PH,Mihm MC. Amelanotic cellular blue nevus. A hypopigmnted variant of the cellular blue nevus: clinicopathologic analysis of 20 cases. Am J Dermatopathol 2002; 26(11): 1493–1500.
26. Kanneishi NK, Cockerell CJ. Histologic differentiation of desmoplastic melanoma from cicatrices. Am J Dermatopathol 1998; 20(2): 128–134.
27. Groben PA, Harvell JD, White WL. Epithelioid blue nevus. Neoplasm sui generis or variation on a theme? Am J Dermatopathol 2000; 22(6): 473–488.
28. Zembowicz A, Carney JA, Mihm MC. Pigmented epithelioid melanocytoma A low grade melanocytic tumor with metastatic potential indistinguishable from animal-type melanoma and epitelioid blue nevus. Am J Surg Pathol 2004; 28 : 31–40.
29. Flax SH, Skelton HG, Smith KJ, Lupton GP. Nodular melanosis due to epithelial neoplasm. Am J Dermatopathol 1998; 20(2): 118–122.
30. Orchard GE, Calonje E. The effect of melanin bleaching on immunochistochemical staining in heavily pigmented melanocytic neoplasm. Am J Dermatopathol 1998; 20(4): 357–361.
31. Ward JR, Brady SP, Tada H, Levin NA. Pigmented epithelioid melanocytoma. Int J Derm 2006; 45 : 1403–1405.
32. Elder DE, Xu X. The approach to the patient with difficult melanocytic lesion. Pathology 2004; 36 : 428–434.
33. Cerroni L, Barnhill R, Elder D, et al. Melanocytic tumors of uncertain malignat potential. Results of a tutorial held at the XXIX Symposium of the International Society of Dermatopathology in Graz, October 2008. Am J Surg Pathol 2010; 34 : 314–326.
34. Luo S, Sepehr A, Tsao H. Spitz nevi and other Spitzoid lesions. Part II. Natural history and management. J Am Acad Dermatol 2011; 65 : 1087–1092.
35. Pock L, Fikrle T, Drlík L, Zloský P. Dermatoskopický atlas (2. vyd.). Phlebomedica: Praha: 2008.
36. Bolognia J, Lin A, Shapiro PE. The significance of eccentric foci of hyperpigmentation (small dark dots) within melanocytic nevi. Arch Dermatol 1994; 130 : 1013–1017.
37. Cerroni L. The illusion of certainty. Dermatopathol Practical Conceptual 2000; 6 : 87–92.
Labels
Anatomical pathology Forensic medical examiner ToxicologyArticle was published in
Czecho-Slovak Pathology

2012 Issue 3
-
All articles in this issue
- Melanocytic pseudotumors
- Differential diagnosis of the chronic pancreatitis and the pancreatic ductal adenocarcinoma
- Giant-cell lesions of bone and their differential diagnosis
- Pseudotumors of the testis and testicular adnexa
- Sarcomatoid (metaplastic) spindle cell carcinoma arising in a phylloid tumor with massive squamous metaplasia – a case report and review of the literature
- Primary vaginal squamous cell carcinoma arising in a squamous inclusion cyst: Case report
- Histopathological autoptic findings in 8 patients with pandemic influenza A (H1N1) pneumonia
- Immunoexpression of type-1 adiponectin receptor in the human intestine
- Czecho-Slovak Pathology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Giant-cell lesions of bone and their differential diagnosis
- Differential diagnosis of the chronic pancreatitis and the pancreatic ductal adenocarcinoma
- Sarcomatoid (metaplastic) spindle cell carcinoma arising in a phylloid tumor with massive squamous metaplasia – a case report and review of the literature
- Melanocytic pseudotumors











