Imunofenotypizace průtokovou cytometrií v patologii
Immunophenotypization by means of flow cytometry in pathology
Flow cytometry represents a modern analytical method useful for an assessment of selected cellular subpopulations in suspension (peripheral blood, aspirate of bone marrow, liquid fluid etc. and also in suspensions prepared from non-fixed solid tumors) in clinical and research laboratories. The method provides information on numerous surface or intracellular markers of the analyzed elements at the same time. The usage of fluorescent monoclonal antibodies against surface or intracellular antigens associated with specific type of cells (T-lymphocytes, B-lymphocytes etc.), with their developmental stage, or with monoclonality (for example antibodies against light chains of immunoglobulins), are the most valuable for the clinical practice.
The most important application of flow cytometry in pathology has remained in hematologic malignancies, where this fast and exact method provides, practically in a real time, crucial information for correct diagnosis as well as for the choice of optimal therapy, and subsequently for assessing the effect of the therapy.
Keywords:
flow cytometry – immunophenotypization – non-Hodgkin lymphomas
:
Petra Manďáková; Jarmila Čandová
:
Ústav patologie a molekulární medicíny, 2. LF UK a FN v Motole, Praha
:
Čes.-slov. Patol., 49, 2013, No. 4, p. 126-130
:
Review articles
Průtoková cytometrie je moderní analytická metoda používaná v klinických i výzkumných laboratořích k imunofenotypizaci vybraných buněčných subpopulací v suspenzi (periferní krve, aspirátu kostní dřeně, mozkomíšního moku atd., ale i buněčné suspenzi získané z nefixovaného solidního tumoru). Poskytuje současně informace o četných povrchových nebo intracelulárních znacích analyzovaných elementů. V klinické praxi k tomu využívá fluorescenčních monoklonálních protilátek proti povrchovým nebo intracelulárním antigenům, které jsou asociovány s určitým typem buněk (T-lymfocyty, B-lymfocyty, apod.), jejím vývojovým stádiem nebo monoklonalitou (např. lehké řetězce povrchových imunoglobulinů).
Pravděpodobně nejširšího využití dosáhla metoda v diagnostice hematologických malignit, kde právě rychlá a přesná diagnostika dává lékaři stěžejní informace ke správnému stanovení diagnózy a k výběru optimální léčby, následně lze takřka v reálném čase sledovat efekt léčby.
Klíčová slova:
průtoková cytometrie – imunofenotypizace – non-Hodgkinské lymfomy
Průtoková cytometrie je laboratorní metoda používaná pro měření různých parametrů buněk. Jedná se o bioanalytickou metodu, která spojuje principy fluorescenční mikroskopie a hematologického analyzátoru. Je využitelná v mnoha vědeckých disciplínách. Největší uplatnění však našla v medicíně a biologii.
S myšlenkou průtokové cytometrie nás seznamuje v roce 1934 Andrew Moldavan, ovšem jeho prototyp zařízení nebyl nikdy sestrojen. Průtoková cytometrie se zrodila v roce 1949 díky Wallace H. Coulteru, který zkonstruoval přístroj schopný počítat krevní buňky v proudícím roztoku. Na principu Coulterova counteru vyvinul Mack Fulwyler a Marvin Van Dilla z Los Alamos National Laboratory první průtokový cytometr, který separoval částice podle jejich velikosti (1-4). Tento přístroj byl posléze zdokonalen doplněním detektorů fluorescence a byl představen Leonardem Herzenbergem a jeho pracovní skupinou ze Stanfordské Univerzity jako první funkční FACS (flurescence-activated cell sorter) (3,5).
PRINCIP METODY
Termín „průtoková cytometrie“ je používán od roku 1976. Cytometrie umožňuje analyzovat v krátkém čase velký počet částic a cytometrická data dovolují statistické zhodnocení jednotlivých buněčných subpopulací zejména podle relativní buněčné velikosti, granularity a intenzity fluorescenčního signálu pro různé testované vlastnosti díky použití vybraných specifických fluorescenčně značených protilátek (6-13).
Průtoková cytometrie funguje na principu hydrodynamické fokusace. Jednotlivé buňky v izotonickém roztoku (nosná tekutina, tzv. sheat fluid) protékají velmi tenkou tryskou do silnější kapiláry, kterou nosná tekutina proudí. Buňky usměrněné do tenkého proudu postupují jedna za druhou průtokovou komůrkou, kde protínají nejčastěji laserový monochromatický světelný paprsek. Částice fyzikálně lomí, odrážejí a rozptylují laserové světlo procházející optickou soustavou, jejímiž základními prvky jsou filtry propouštějící světlo o definovaných vlnových délkách (band pass, short pass a long pass filtry). Jednotlivé signály jsou převedeny na elektrické impulzy a zesíleny fotonásobičem (obr. 1) (7).
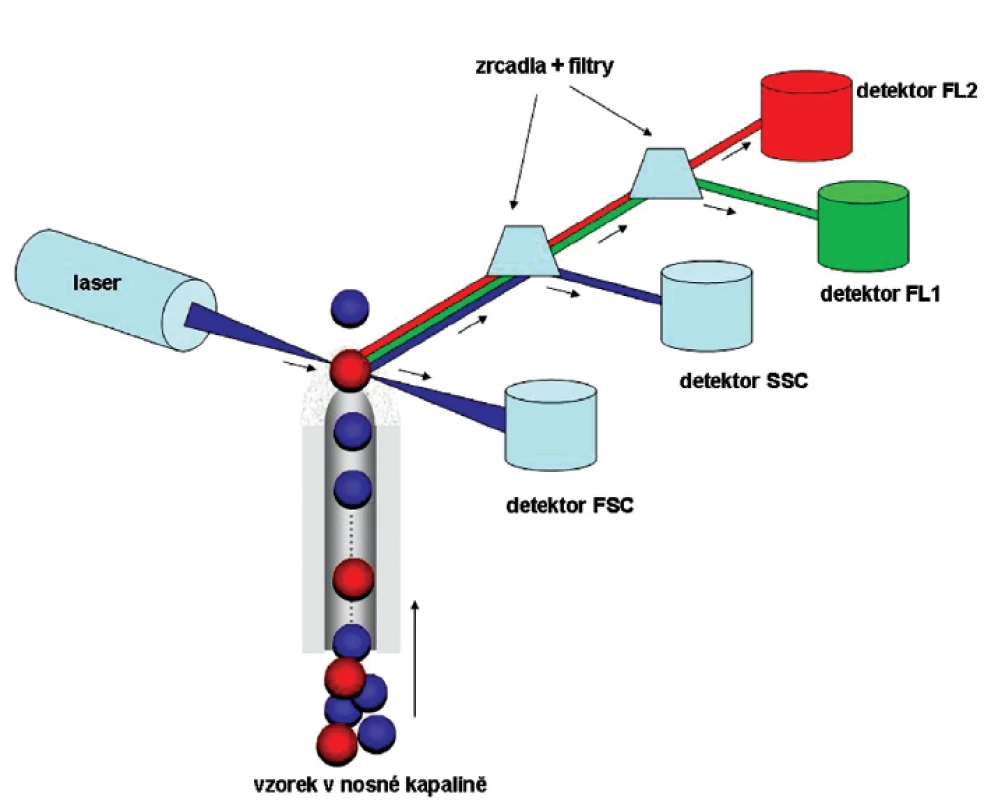
Měřenými parametry jsou zejména rozptyl světla v malém úhlu, tzv. „forward scatter“ (FSC – je přímo úměrný velikosti buněk) a rozptyl světla v úhlu 90°, tzv. „side scatter“ (SSC – je ovlivněn hlavně granularitou částic a členitostí buněčného jádra). Kromě těchto základních fyzikálních vlastností lze pomocí fluorescenčně značených protilátek rozlišovat buněčné subpopulace podle exprese povrchových i intracelulárních antigenů. Laserový paprsek excituje fluorochrom protilátky, tím je emitováno světlo o určité vlnové délce, které se skrz příslušné filtry optické soustavy dostává do příslušného detektoru fluorescence (obr. 1).
V současné době je na trhu k dispozici celá řada protilátek vhodných pro imunofenotypizaci průtokovou cytometrii. Jsou značené různými fluorochromy (např. námi nejčastěji používané: FITC, PE, PerCP-Cy5.5, PC7, APC, APC-Cy7, PB aj.), čímž je zaručena kombinovatelnost protilátek proti různým antigenům v jednom vzorku. Díky vícebarevnému značení je možné snáze posoudit případnou aberantní koexpresi vyšetřovaných znaků. Velkou výhodou multiparametrické průtokové cytometrie je možnost rozlišení i minoritních buněčných subpopulací.
Většina monoklonálních protilátek je zaměřena proti antigenům krevních buněk. Lze však imunofenotypizovat i nehematologické buňky. Cytometricky je rovněž možné zjišťovat přítomnost intracelulárních virů (např. HIV-1, CMV nebo EBV) (14-16), existují také monoklonální protilátky k identifikaci bakterií a parazitů (15).
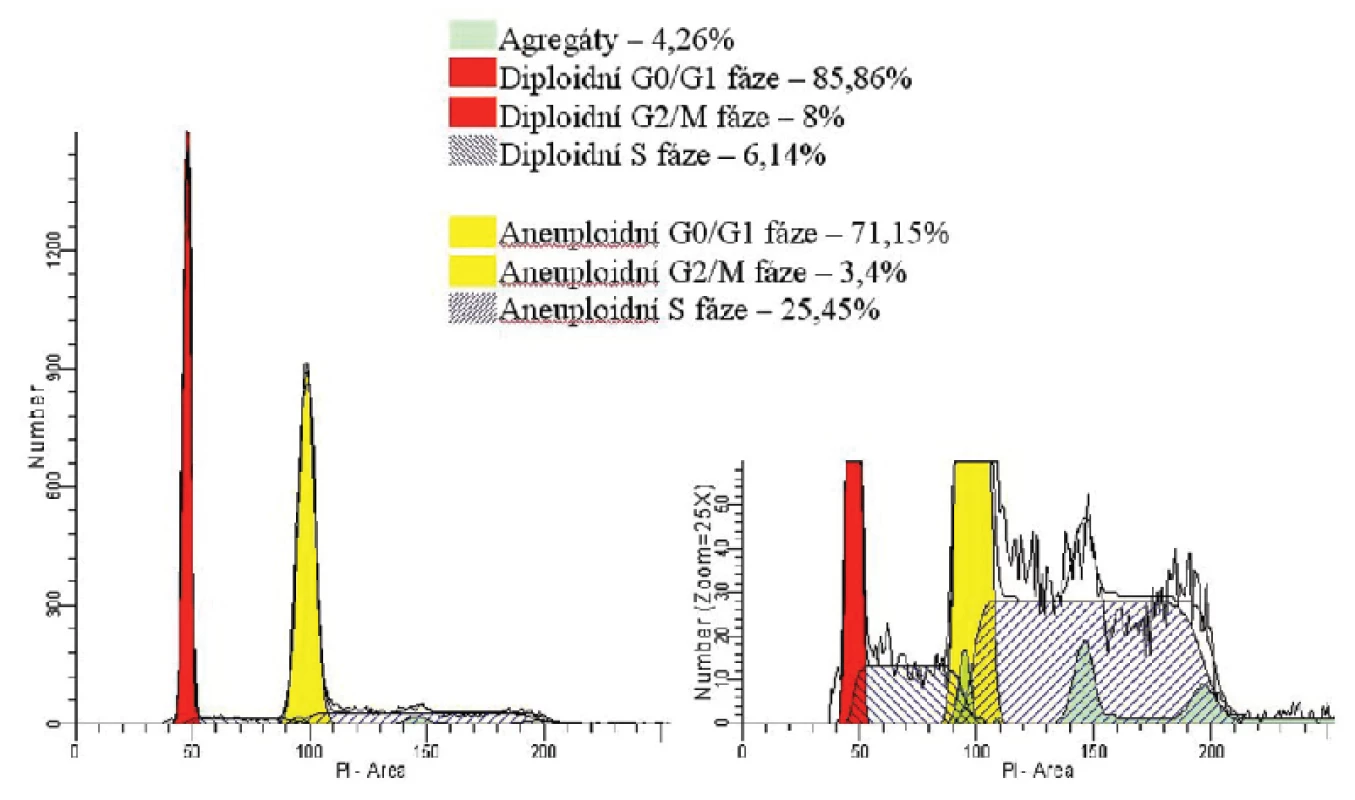
V diagnostice lymfoproliferativních onemocnění se s výhodou využívá také analýza DNA. Metoda je založená na schopnosti některých barviv vázat se stechiometricky na nukleové kyseliny (např. propidium jodid (PI), DAPI aj.). Buňky obarvené těmito barvivy po ozáření světlem o příslušné vlnové délce emitují světlo jiné vlnové délky. Pokud je barvivo podáno v nadbytku, je intenzita fluorescence jednotlivých buněk přímo úměrná obsahu DNA v buňce. Cytometrista díky ní rozpozná, zda jsou vyšetřované buňky diploidní nebo je přítomen určitý podíl buněk aneuploidních. Analýza DNA navíc umožňuje rozlišit podíl proliferujících buněk – ať už diploidních nebo aneuploidní frakce – tzn. buněk v S a G2/M fázi, čímž je metoda nápomocná v rozlišení nízce maligních a vysoce maligních procesů (obr. 2).
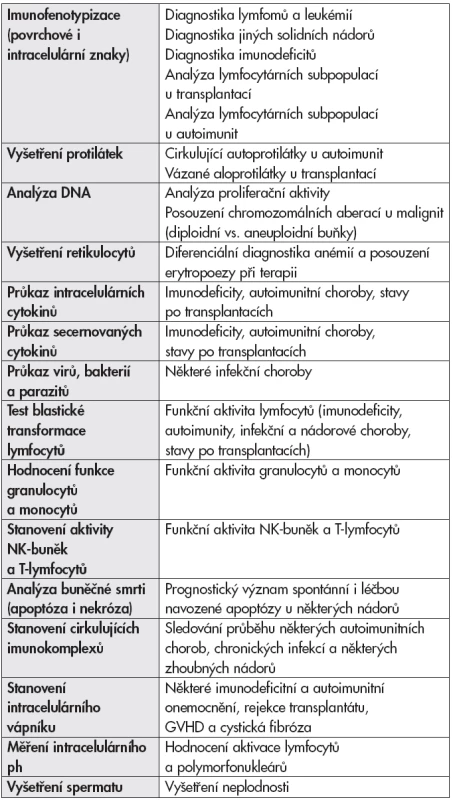
Z dalších možností uvádíme alespoň některé příklady uplatnění: stanovení funkční aktivity leukocytů, průkaz protilátek, analýza apoptózy, průkaz intracelulárních cytokinů nebo stanovení intracelulárního vápníku. Některé vyšetřovací postupy jsou rutinně využívány v klinických laboratořích, jiné nalézají své uplatnění především v laboratořích výzkumných (tab. 1).
VYŠETŘOVANÝ MATERIÁL
Metodou průtokové cytometrie lze imunofenotypizovat buňky v suspenzi. Nejčastěji bývá vyšetřována periferní krev, aspirát kostní dřeně, event. mozkomíšní mok a další buněčné suspenze. Je však velmi důležité vyšetřit také nativní bioptické vzorky solidního nádoru a stanovit imunofenotyp nádorových buněk. Poté je daleko snazší identifikovat i malé subpopulace nádorových buněk v rámci stagingu a restagingu. Nativní bioptický vzorek je neprodleně po odběru doručen do laboratoře a zpracován do buněčné suspenze buď mechanickou homogenizací nebo enzymatickým trávením.
CYTOMETRICKÁ DATA
Počítačové zpracování naměřených dat umožňuje získat imunofenotyp jednotlivých buněčných subpopulací. Výstupem měření jsou výsledky v grafické a číselné podobě. Ke grafickému zobrazení naměřených dat se používají jednak jednoparametrické histogramy, kde na ose x znázorňujeme intenzitu signálu a na ose y množství buněk (obr. 2) nebo dvouparametrické grafy – „dot-ploty“ – kdy na ose x je vynesena intenzita jednoho a na ose y intenzita druhého signálu. Množství buněk potom odpovídá hustotě zobrazených bodů v grafu, jelikož každý zobrazený bod v dot-plotu představuje změřenou buňku (obr. 3).
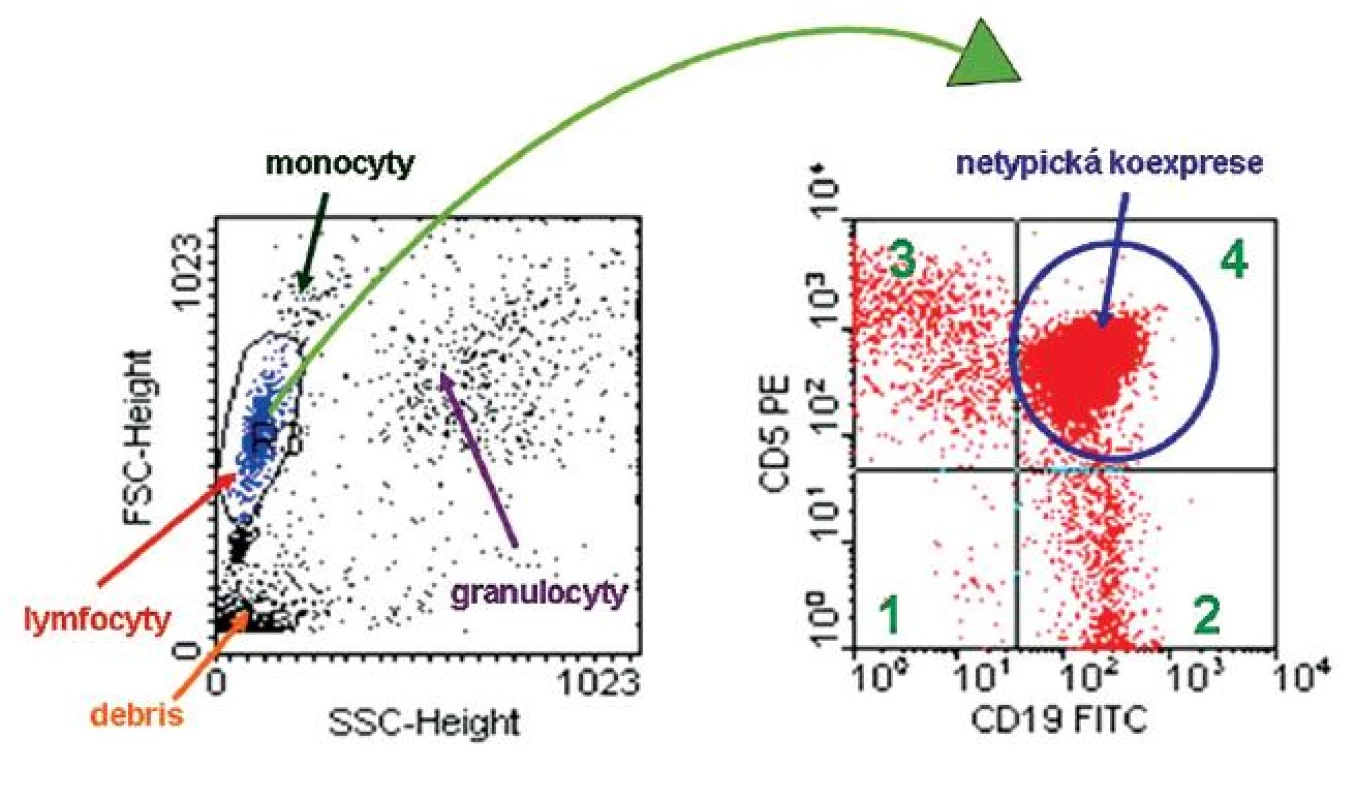
V dot-plotech můžeme zobrazit jednak buňky dle velikosti a granularity nebo podle intenzity fluorescenčního signálu, na základě čehož získáváme informace o přítomnosti či absenci vyšetřovaných antigenů. V rámci analýzy cytometrických dat je možné analyzovat vybrané buněčné subpopulace a jiné z analýzy „vypnout“. Proces vybírání buněčné subpopulace, kterou dále charakterizujeme z hlediska exprese námi testovaných znaků, označujeme „gatování“. Údaje získané měřením jsou archivovány v elektronické podobě.
VYUŽITÍ METODY V PATOLOGII
Imunofenotypizace hematologických malignit, která je nejhojněji využívanou analýzou průtokové cytometrie, je prováděna pod záštitou různých klinik, oddělení a ústavů. Komplexní diagnostika hematologických malignit zahrnuje širokou paletu vyšetření, které dohromady skládají informace vedoucí k identifikaci a klasifikaci onemocnění. Cílem vyšetření je zjistit maximum validních informací o expresi diagnosticky relevantních markerů.
Na našem pracovišti se nejčastěji setkáváme s diagnostikou non-Hodgkinských lymfomů. Pro diagnostiku Hodgkinských lymfomů není metoda průtokové cytometrie vhodným nástrojem, jelikož diagnostické buňky se ve tkáních nachází v minimálním množství a jsou při analýze snadno přehlédnutelné, event. se v buněčné suspenzi nevyskytují vůbec, díky limitaci metody při přípravě buněčné suspenze.
Non-Hodgkinské lymfomy jsou odvozené od B-lymfocytů, T-lymfocytů nebo vzácně z NK buněk (17). Každá skupina je představována řadou nozologických jednotek, jejichž hranice nejsou vždy ostře vyjádřeny, mnohá onemocnění se pak mohou transformovat a poté mění své biologické i klinické charakteristiky.
B-NHL
WHO klasifikace rozděluje B-NHL na lymfomy vycházející z prekurzorů B-řady a lymfomy vznikající ze zralých periferních B-lymfocytů. Jednotlivé B-NHL jsou dále do daných kategorií zařazeny na základě kombinace morfologických, imunofenotypických a molekulárně-genetických vlastností nádorových buněk současně s klinickými charakteristikami choroby. Na obr. 4 je znázorněn přehled nejčastějších typů B-NHL a základní zjednodušené schéma jejich imunofenotypizace pomocí FACS.
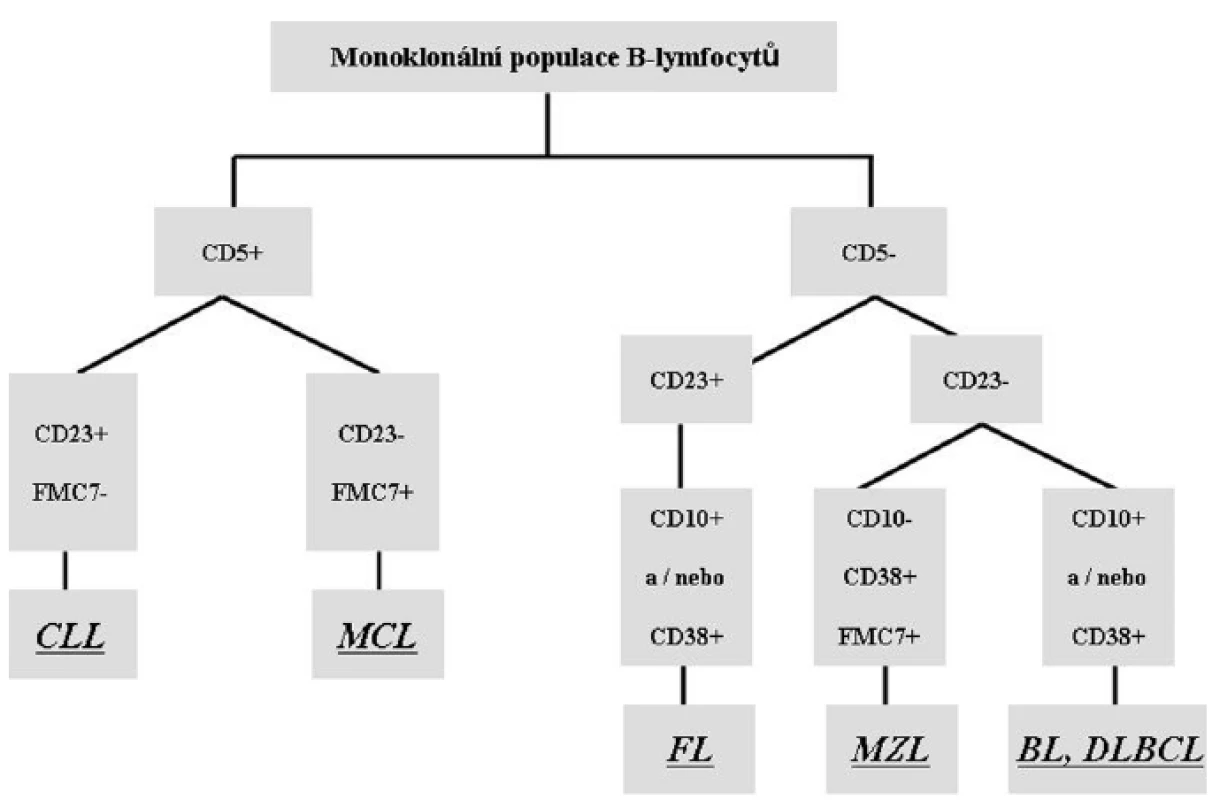
Cytometrická diagnostika B-NHL ze zralých B-lymfocytů se opírá zejména o průkaz monoklonální populace pomocí stanovení exprese lehkých povrchových řetězců imunoglobulinů kappa nebo lambda. Cytometrické vyšetření klonality vychází ze znalosti fyziologického poměru lehkých povrchových řetězců kappa a lambda, který je 3 : 2. Pokud je tento poměr signifikantně narušen, nález nasvědčuje přítomnosti klonální populace zralých B-lymfocytů. Pro diagnostiku B-NHL ze zralých B-lymfocytů je průtoková cytometrie vysoce spolehlivá a je účinným nástrojem pro rychlé stanovení diagnózy.
T/NK-NHL
Stejně jako B-NHL, vznikají i T/NK-NHL z prekurzorových a zralých T-lymfocytů event. NK buněk. V případě diagnostiky T/NK-NHL je však rozpoznání nádorových buněk komplikovanější a cytometrista se snaží nádorové buňky hledat podle případného aberantního imunofenotypu. Není však pravidlo, že by se nádorová buňka musela vyznačovat aberantní koexpresí vyšetřovaných znaků. Pro T/NK-NHL může být cytometrie vhodnou diagnostickou metodou právě v případě, že je zjištěna přítomnost aberantního imunofenotypu.
ZÁVĚR
V případě, že lékař-patolog disponuje metodou průtokové cytometrie, otevírají se mu nové možnosti diagnostiky. Na základě peroperačního vyšetření může indikovat potřebná vyšetření, tedy i imunofenotypizaci průtokovou cytometrií. Předností cytometrické analýzy je její rychlost. Již za dvě hodiny může znát první výsledek. I v případě, že z výsledků průtokové cytometrie nelze vždy jednoznačně určit diagnózu, její velký význam spočívá v tom, že může směrovat další kroky patologa ve vyšetřovacím postupu. Další její velkou výhodou je, že v případě průkazu přítomnosti nádorových buněk s určitým imunofenotypem (obr. 5), je průtoková cytometrie vhodným nástrojem při stagingu a restagingu onemocnění. Lze snáze identifikovat minoritní populace nádorových buněk, které by mohly být pod hranicí mikroskopické detekce.
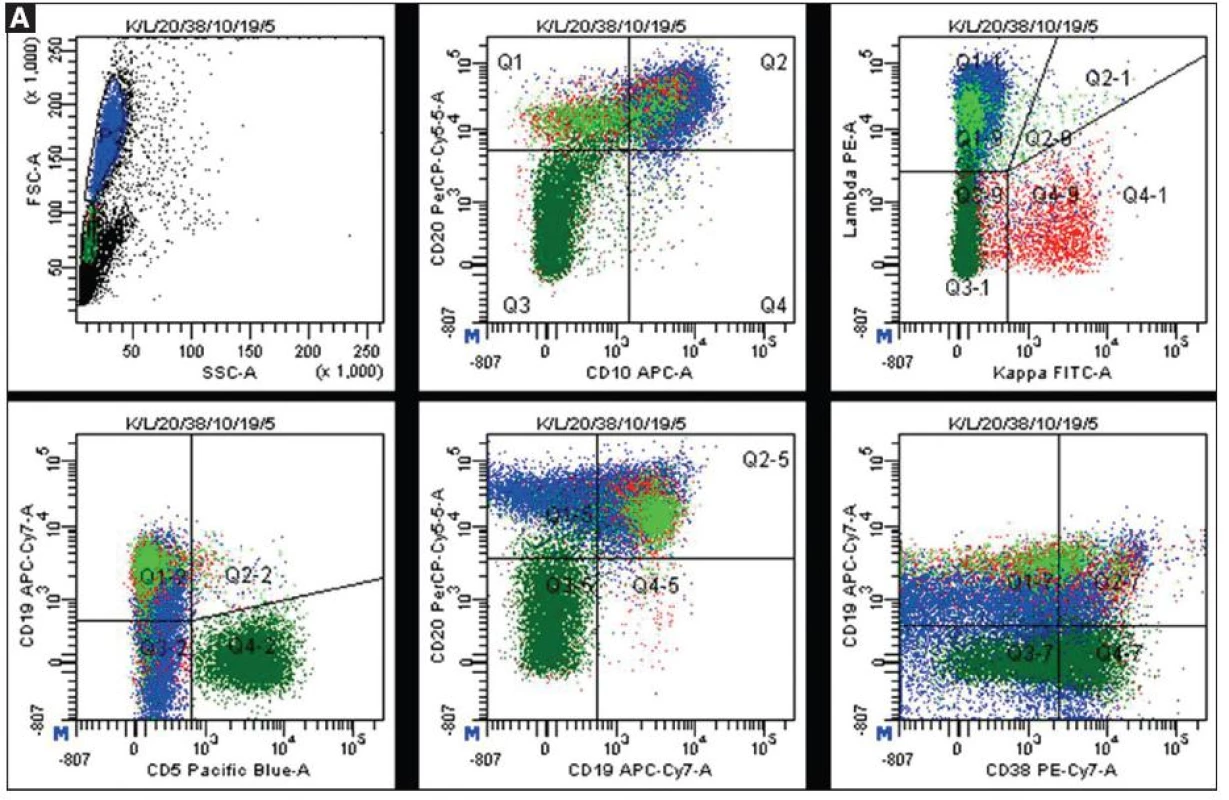

Každá vyšetřovací metoda má své výhody a své limitace (18,19). Pro určení správné diagnózy je na místě dostupné vyšetřovací metody kombinovat a interpretovat získané výsledky po vzájemné korelaci nálezů. Jelikož patolog dovede nejlépe posoudit reprezentativnost odběru pro konkrétní vyšetření, je vhodné doporučit spolupráci cytometristy s patologem při zajištění dělby vzorků.
PODĚKOVÁNÍ
Podpořeno projektem (Ministerstva zdravotnictví) koncepčního rozvoje výzkumné organizace 00064206 (FN MOTOL).
Adresa pro korespondenci:
RNDr. Petra Manďáková, Ph.D.
Ústav patologie a molekulární medicíny, 2. LF UK a FN v Motole
V Úvalu 84, Praha 5, 150 06
tel.: 2 2443 5658, 5644; fax: 2 2443 5620
e-mail: p.mandak@email.cz
Sources
1. Fulwyler MJ. Electronic separation of biological cells by volume. Science 1965; 150 : 910-911.
2. Robinson JP. Mack Fulwyler in his own words. Cytometry Part A 2005; 67A: 61-67.
3. Herzenberg LY. FACS innovation: a view from Stanford. Clin Invest Med 2004; 27 : 240-252.
4. Zuba-Surma EK, Kucia M, Abdel-Latif A, Lillard JW Jr., Ratajczak MZ. Folia Histochem Cytobiol 2007; 45 : 279-290.
5. Hulett HR, Bonner WA, Barrett J., Herzenberg LA. Cell sorting: automated separation of mammalian cells as a function of intracellular fluorescence. Science 1969; 166 : 747-749.
6. Shapiro HM. Multistation multiparameter flow cytometry: a critical review and rationale. Cytometry 1983; 3 : 227-243.
7. Shapiro HM. Practical flow cytometry. Alan R. Liss, Inc: New York; 1988.
8. Radcliff G, Jaroszeski MJ. Basics of flow cytometry. Methods Mol Biol 1998; 91 : 1-24.
9. Jaroszeski MJ, Radcliff G. Fundamentals of flow cytometry. Mol Biotechnol 1999; 11 : 37-53.
10. Maftah A, Huet O., Gallet PF, Fatinaud MH. Flow cytometryęs contribution to the measurement of cell functions. Biol Cell 1993; 78 : 85-93.
11. Stewart CC. Clinical applications of flow cytometry. Immunologic methods for measuring cell membrane and cytoplasmic antigens. Cancer 1992; 69 : 1543-1552.
12. Davey HM. Flow cytometric techniques for the detection of microorganisms. Methods Cell Sci 2002; 24 : 91-97.
13. Arora SK. Analysis of intracellular cytokines using flowcytometry. Methods Cell Sci 2002; 24 : 37-40.
14. Gadol N, Crutcher GJ, Busch MP. Detection of intracellular HIV in lymphocytes by flow cytometry. Cytometry 1994; 15 : 359-370.
15. Riley RS, Mahin EJ. Clinical applications of flow cytometry. ASCP: San Francisco; 1990.
16. Croudr J, Leitenberg D, Smith BR, Howe JG. Epstein-Barr virus suspension cell assay using in situ hybridization and flow cytometry. Cytometry 1997; 29 : 50-57.
17. Jaffe ES, Harris NL, Stein H, Vardiman JW. WHO classification of tumours; Pathology and genetics of tumours of hematopoietic and lymphoid tissue. IARC Press: Lyon; 2001 : 135-174.
18. Manďáková P, Campr V, Kodet R. Korelace výsledků průtokové cytometrie a morfologických nálezů v diagnostice maligních lymfomů z B buněk. Čas Lék Čes 2003; 142 : 651-655.
19. Manďáková P, Kortánková H, Machovcová A, Campr V. Imunofenotypizace kožních T-lymfomů. Čes-slov Derm 2006; 2 : 82-87.
Labels
Anatomical pathology Forensic medical examiner ToxicologyArticle was published in
Czecho-Slovak Pathology

2013 Issue 4
-
All articles in this issue
- Fluorescence in situ hybridization on histologic sections
- Laser capture microdissection and its practical applications
- Immunophenotypization by means of flow cytometry in pathology
- Minimal residual disease – detection possibilities in haematological and non-haematological malignancies
- How to improve the histopathological diagnosis of hepatocellular benign affections (adenoma versus focal nodular hyperplasia) in daily practice?
- Mucinous carcinoma (non-intestinal type) arising in the ovarian mature cystic teratoma - a case report
- Eosinophilic dysplasia of the cervix associated with HPV 6 infection – case report and review of the literature
- Czecho-Slovak Pathology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- How to improve the histopathological diagnosis of hepatocellular benign affections (adenoma versus focal nodular hyperplasia) in daily practice?
- Immunophenotypization by means of flow cytometry in pathology
- Minimal residual disease – detection possibilities in haematological and non-haematological malignancies
- Fluorescence in situ hybridization on histologic sections
