Komplexní přístup v diagnostice lymfomů v praktických příkladech
A complex diagnostic approach in lymphomas: practical aspect in short case reports
Complex laboratory investigation is necessary for the diagnosis and relevant classification of lymphomas. The classical histopathological morphology and cytology investigation is essential, but further investigations such as immunohistochemistry and fluorescence in situ hybridization are necessary. It is also important to employ flow cytometry as a method of investigation running synchronously or preceding the histopathological approach. Last but not least, the investigation of nucleic acids in lymphoma by molecular approaches is necessary and has become an everyday practice. Communication between pathologists and clinical colleagues (oncologists, hematologists, internal medicine specialists and radiologists) is very important. We demonstrate the necessity of a complex diagnostic approach to lymphomas and an appropriate interpretation of all laboratory investigations giving examples of eight patients with various types of lymphomas. In some cases, it is impossible to properly diagnose a lymphoma without molecular investigation. Occasionally, the results of the molecular investigation may be misleading and/or may be inaccurately interpreted, leading to an incorrect conclusion. For that reason, it is very important to incorporate all specialized laboratories and their teams under one roof (preferably that of pathology departments), enabling tight and daily cooperation between the specialists. This is the way to reach a precise diagnosis in a majority of cases, as well as how to comply with clinical expectations of properly classified lymphomas for a targeted therapy of patients.
Keywords:
lymphoma – immunohistochemistry – FISH – flow cytometry – PCR – complex diagnosis
:
Markéta Kalinová; Marcela Mrhalová; Lenka Krsková; Helena Jungbauerová; Alena Kalfusová; Petra Manďáková; Jarmila Čandová; Jan Soukup; Vít Campr; Roman Kodet
:
Lymfomová skupina, Ústav patologie a molekulární medicíny 2. LF UK a FN v Motole, Praha
:
Čes.-slov. Patol., 50, 2014, No. 3, p. 118-126
:
Reviews Article
Diagnostika a správná klasifikace lymfomů vyžaduje komplexní laboratorní přístup. Základem je klasické histopatologické, morfologické a cytologické vyšetření, na které navazuje imunohistochemický průkaz exprese proteinů, vyšetření metodami fluorescenční in situ hybridizace, a analýza nukleových kyselin molekulárními metodami. Mnohdy je výhodné, když se základním vyšetřením probíhá zároveň nebo mu předchází vyšetření pomocí průtokové cytometrie. Důležitá je také komunikace s klinickými spolupracovníky – onkology, hematology, internisty a zobrazovacími specialisty. Na příkladu osmi kazuistických případů chceme dokumentovat účelnost komplexního laboratorního přístupu v diagnostice lymfomů. V některých případech by bez specializovaných vyšetření nebyla správná diagnostika možná, někdy mohou být naopak některé dílčí výsledky zavádějící. Proto je vhodné, aby všechny speciální laboratoře zaměřené na hematopatologickou diagnostiku byly součástí jednoho pracoviště, tedy ústavu či oddělení patologie, a bylo tak možné jednotlivá vyšetření jednoduše a účelně propojit. Tímto přístupem je možné dospět k přesné diagnóze ve většině případů a tak vyhovět nárokům kladeným na správné zařazení lymfomů pro následnou terapii nemocných.
Klíčová slova:
lymfom – imunohistochemie – FISH – průtoková cytometrie – PCR – komplexní diagnostika
Diagnostika lymfomů se částečně vymyká z ostatních subspecializací v patologii. Původně malá skupina nádorů byla v průběhu několika desetiletí přesně charakterizována a zařazena v mezinárodně přijaté klasifikaci, a tím se v podstatě z několika rozpoznávaných onemocnění ještě v průběhu šedesátých let stala rozsáhlá skupina klinicko-patologických jednotek. Stále více se kromě běžných histopatologických metod zapojovala také specializovaná vyšetření, a diagnostika lymfomů není v dnešní době prakticky proveditelná bez široké palety vyšetření. Proto při každém bioptickém odběru lymfadenopatie je vhodné předpokládat, že by mohlo jít o lymfom, a přizpůsobit tomu zpracování materiálu.
Lymfomová skupina Ústavu patologie a molekulární medicíny 2. LF UK a FN v Motole Praha využívá při diagnostice lymfomů komplexní přístup, který zahrnuje klasické morfologické a cytologické vyšetření, metody imunohistochemické, vyšetření pomocí průtokové cytometrie, fluorescenční in situ hybridizace a molekulárních metod založených na analýze DNA, případně RNA. Za Lymfomovou skupinu chceme ukázat na zajímavé kazuistiky, které by bez komplexního přístupu bylo nesnadné, ne-li přímo nemožné, správně zařadit. Současně ukazujeme i případy, kde výsledky jednotlivých vyšetření navzájem nekorelovaly, a bylo obtížné dospět k jasnému závěru. Rádi bychom tak demonstrovali, že je vždy nutná uvážlivá interpretace výsledků vyšetření, prodiskutování jednotlivých nálezů na společných seminářích a že diagnostický výstup je nutné skládat jako „mozaiku výsledků laboratorních vyšetření“. Je tedy výhodné, pokud jsou jednotlivá specializovaná vyšetření prováděna přímo na pracovištích patologie, tak, jak je tomu na našem pracovišti.
Informace o doporučeném postupu při odběru a zpracování materiálu pro diagnostiku lymfomů jsou podrobně popsány v Diagnostických a léčebných postupech u nemocných s maligními lymfomy (www.lymphoma.cz). Schéma komplexního přístupu k vyšetřování lymfomů na Ústavu patologie a molekulární medicíny 2. LF UK a FN v Motole Praha je shrnuto na obrázku č. 1 (obr. 1).
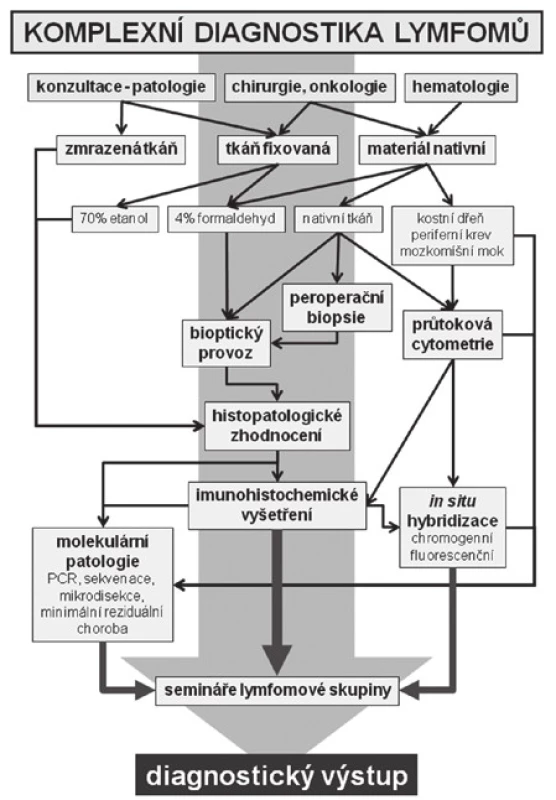
Protože mají následující kazuistiky ukázat komplexnost laboratorního přístupu při diagnostice lymfomů, neuvádíme v textu podrobnou specifikaci metod a vyšetřovacích postupů. Specializovaným vyšetřovacím metodám byla věnována předchozí čísla časopisu.
PACIENT 1
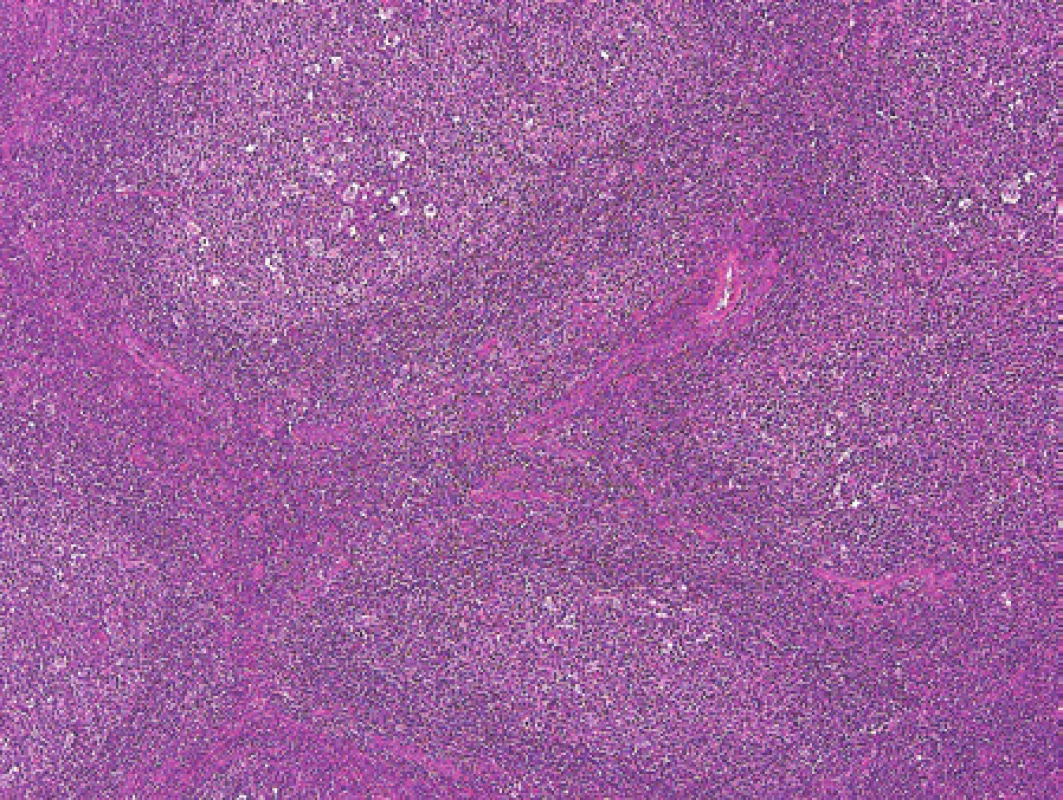
Chlapec ve stáří 15 let měl šest měsíců hmatné zduření vlevo na krku. Podstatou zduření byla zvětšená lymfatická uzlina. K histologickému vyšetření jsme obdrželi nativní krční uzlinu velikosti 25 x 18 x 11 mm. Mikroskopicky byla v celkově zachované strukturalizaci uzliny patrná extrémně vystupňovaná folikulární hyperplazie s kompresí parakortexu (obr. 2). Některé zvětšené folikuly s folikulolýzou, fragmentací zárodečných center i plášťů nabývaly až vzhledu progresivní transformace zárodečných center. V zárodečných centrech nepravidelných tvarů byly zastiženy centrocyty, hojně byly přítomné centroblasty s mitotickou aktivitou a dále makrofágy (obr. 3). Překvapením byl výsledek průtokové cytometrie (MUDr. E. Mejstříková, Ph.D., KDHO FN v Motole), která identifikovala asi 4 % suspektních klonálních buněk s fenotypem CD19+, kappa+, CD10+, CD71+, CD44-, CD27+, IgM+, TdT - a CD38+.
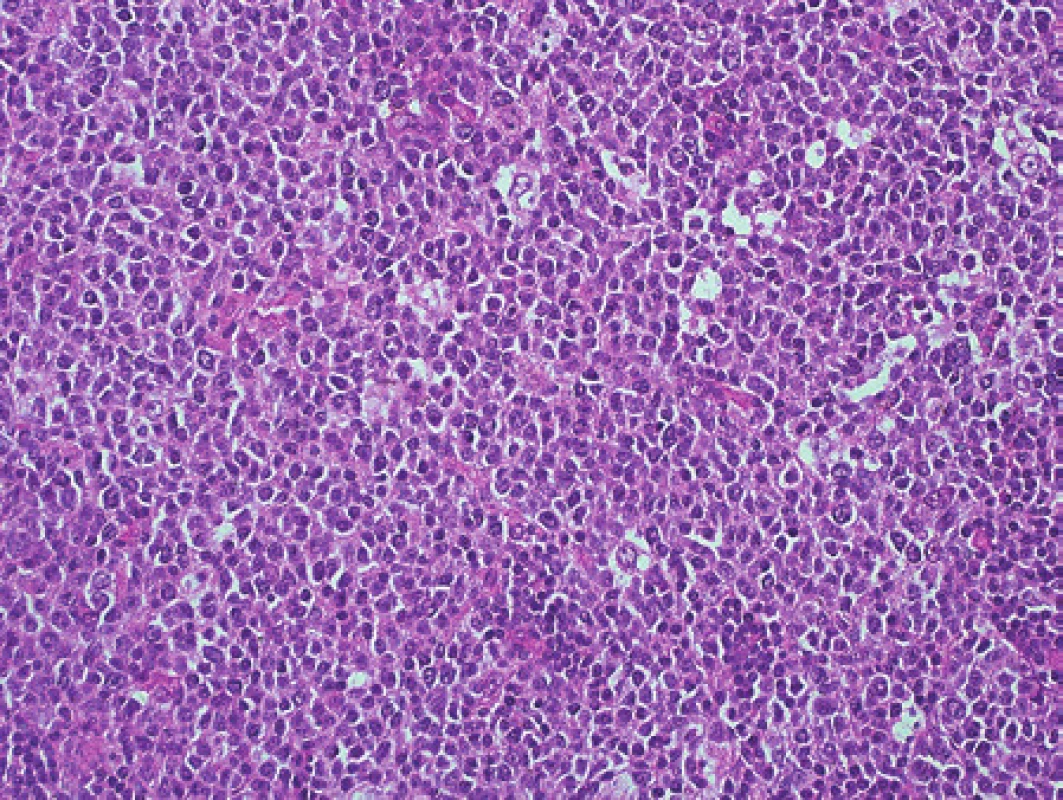
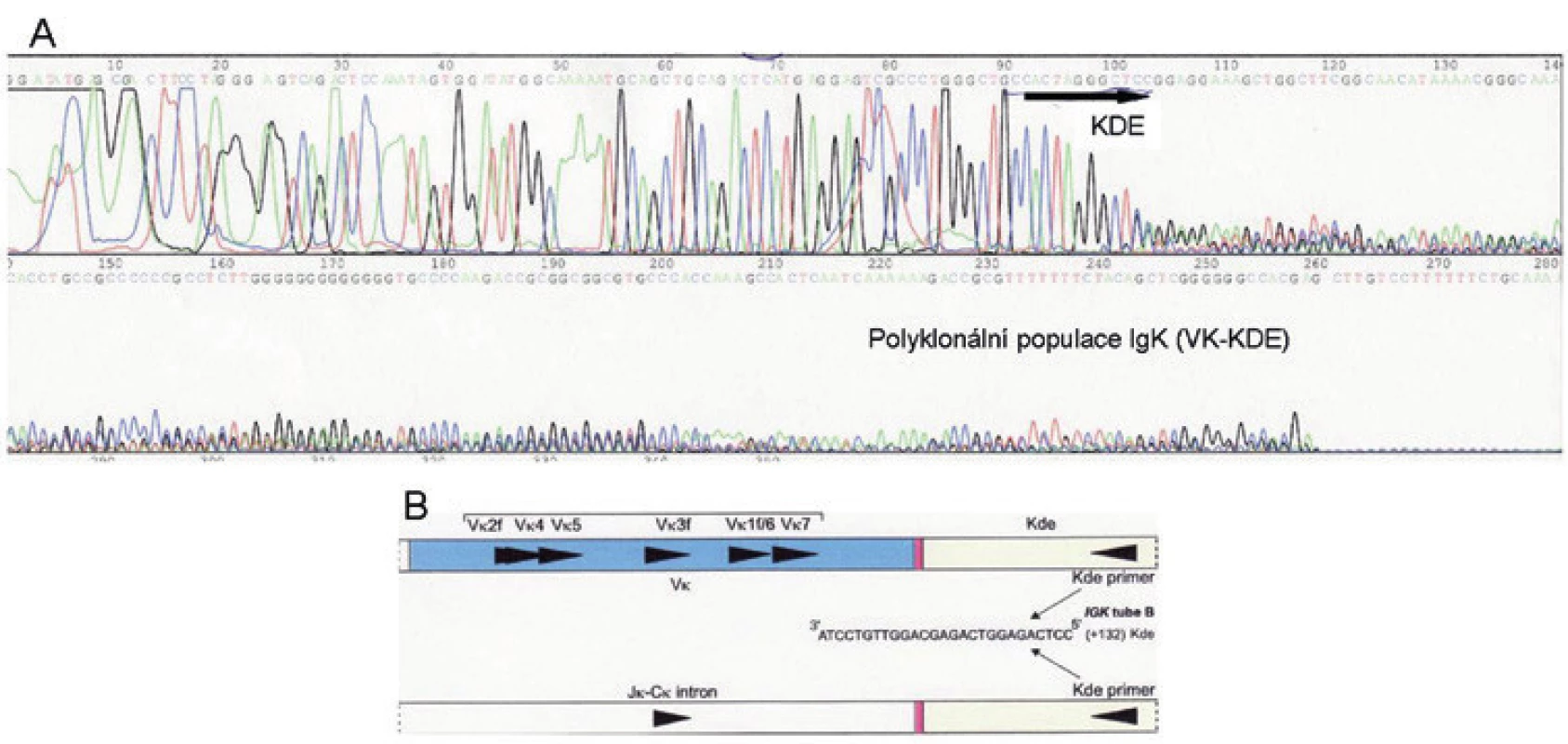
V imunohistochemickém vyšetření celkový obraz odpovídal vystupňované folikulární hyperplazii, místy s defektními sítěmi folikulárních dendritických buněk. V zárodečných centrech byly překvapivě hojné disperzní plazmatické buňky, popř. buňky plazmocytoidního vzhledu s expresí lehkých řetězců kappa, zatímco řetězce lambda byly zastiženy jen v ojedinělých buňkách (naznačená restrikce kappa). Dodatečně imunohistochemicky vyšetřená exprese LMP1 (EBV) byla negativní. Molekulární vyšetření metodou PCR ve vzorku krční uzliny identifikovalo pouze velmi slabý produkt IgK (VK-KDE), v IgH a IgL jsme klonální přestavbu neprokázali. Po sekvenační analýze produktu IgK jsme klonální přestavbu neprokázali, ukázalo se, že slabý produkt suspektní IgK klonální přestavby představoval směsnou sekvenci VK-KDE (obr. 4) (1). Chromogenní in situ hybridizace neprokázala klonální proliferaci kappa či lambda (mRNA pro lehké řetězce imunoglobulinů). Fluorescenční in situ hybridizace neprokázala přítomnost translokace t(8;14)(q24;q32), IGH/MYC, ani přítomnost zlomu v oblasti 8q24 (gen MYC), která by naznačovala existenci některé z variantních translokací s geny pro lehké řetězce imunoglobulinů.
Uzavření případu a komentář
Případ jsme uzavřeli jako reaktivní lymfadenopatii s extrémně vystupňovanou folikulární hyperplazií a s minoritní klonální subpopulací nejistého významu patrnou však pouze ve vyšetření průtokovou cytometrií, bez průkazu transformace v lymfom (2). V případě detekce slabé klonality omezené na IgK lokus (IgH a IgL bez klonální přestavby) je nutné vždy následně sekvenačně ověřit, zda se nejedná o polyklonální proces, díky limitované variabilitě přeskupovaných IgK segmentů. Pacient je v současné době (2 roky od diagnózy) pouze sledován bez dalšího rozvoje lymfadenopatie.
PACIENT 2
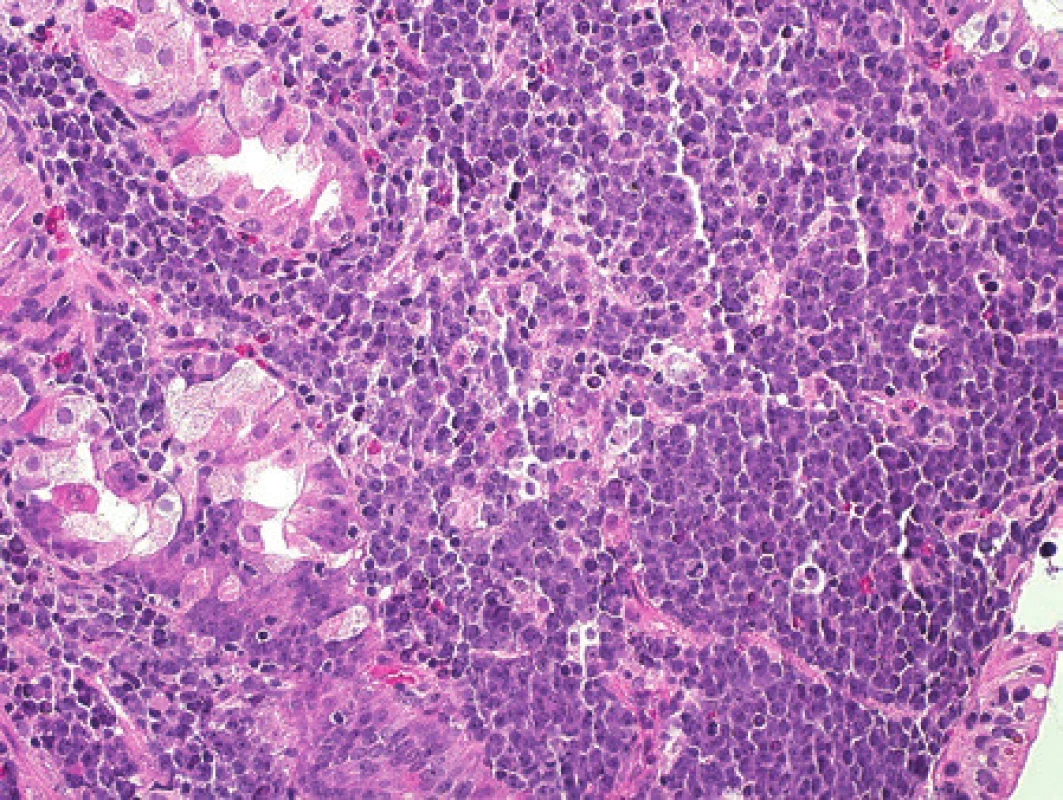
Muž ve věku 62 let byl indikován k bioptickému vyšetření pro objemnou expanzi v hilu sleziny. Ke konzultačnímu vyšetření jsme obdrželi dva parafinové bloky, jeden fixovaný ve 4% roztoku formaldehydu, druhý fixovaný 70% etanolem pro případná molekulární vyšetření. V materiálu fixovaném ve 4% roztoku formaldehydu byly drobné fragmenty uzliny s přilehlou tukovou tkání. Struktura lymfatické tkáně byla setřena prakticky difúzním patologickým procesem. Obrazu dominovaly menší až středně velké lymfocyty, méně četné byly disperzní velké buňky. Ty neměly znaky H/RS buněk. Mitotická aktivita byla nenápadná. Při imunohistochemickém vyšetření exprimovala většina lymfocytů molekuly CD3 a CD5, poměr exprese CD4:CD8 nepřesahoval 3 : 1. Velké buňky s méně než 10 % podílem na celkové buněčnosti měly imunofenotyp CD20+, PAX5+, BCL2+/-, CD10-, BCL6+, MUM1+, Ki-67+, negativní byl průkaz molekul CD23, CD30 a EBV (LMP1). Nebyly patrné ani reziduální sítě folikulárních dendritických buněk. Histologicky a imunohistochemicky jsme diagnostikovali velkobuněčný B lymfom bohatý na T lymfocyty a histiocyty (THRBCL). Molekulární vyšetření metodou PCR z etanolem fixovaného materiálu prokázalo klonální přestavbu Ig genů (IgH, IgK) a slabě detekovalo klonální přestavbu TCRbeta (obr. 5).
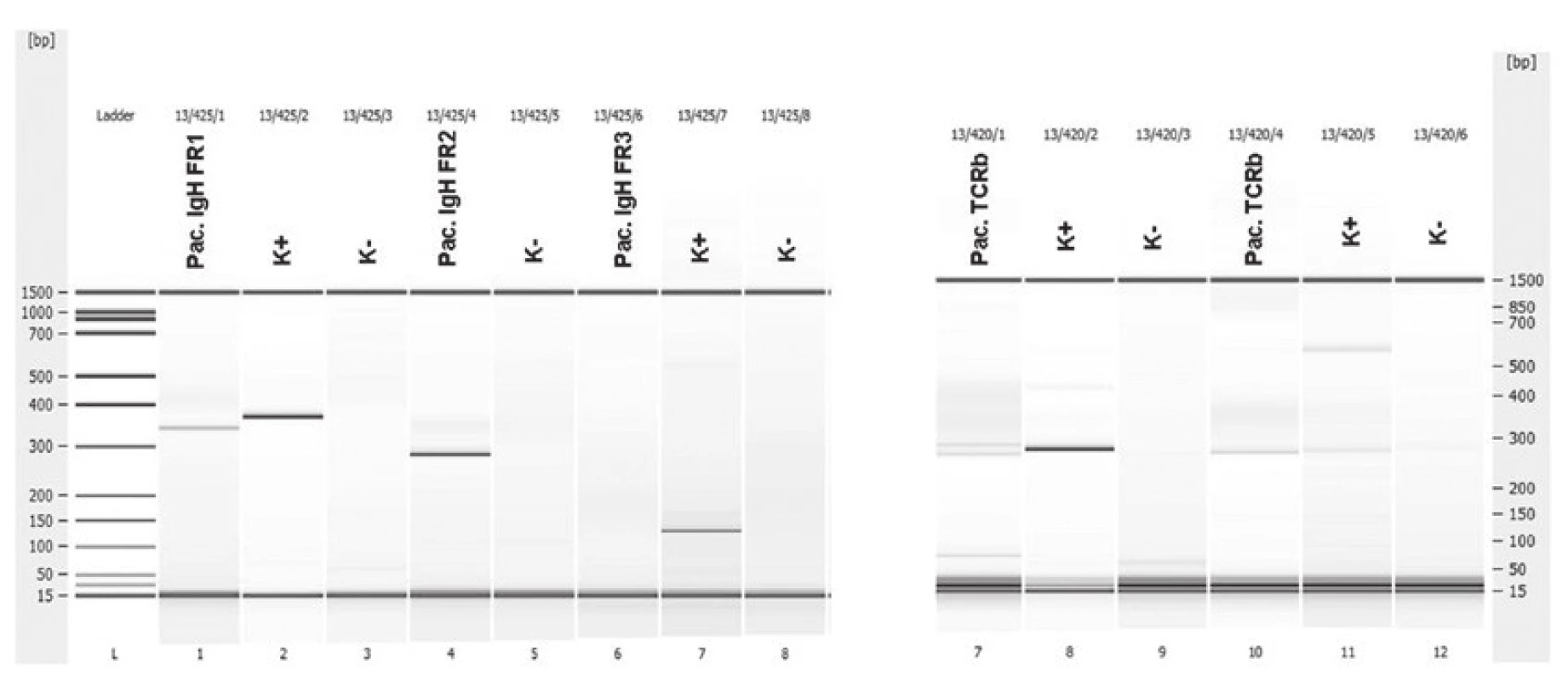
Uzavření případu a komentář
U pacienta s THRBCL jsme detekovali jak Ig, tak TCR klonalitu. Souběh přestaveb obou imunoreceptorových genů je neobvyklý, ale je známý. U některých lymfoblastických leukémií se běžně objevuje (3). Otázkou je, zda v popsaném případu jde o přítomnost TCR klonální přestavby v nádorových B buňkách, či zda jde o přestavbu v okolních T lymfocytech reaktivní povahy. Bez mikrodisekční analýzy jednotlivých skupin buněk se nelze k tomuto nálezu jednoznačně vyjádřit. Laserová mikrodisekce je technicky, časově a finančně náročné vyšetření. Proto nebylo v rutinním vyšetřovacím procesu indikováno, neboť by reálně nepřispělo k upřesnění diagnózy ani k cílenější léčbě pacienta. Podstatu choroby jsme identifikovali jak morfologickým tak molekulárním vyšetřením, i když jsme uvedenou otázku z praktických důvodů nedořešili.
PACIENT 3
Muž stáří 59 let, který měl v anamnéze dlaždicobuněčný karcinom skrota, byl vyšetřován pro široce přisedlý polypoidní nádor v horní části těla žaludku. Po opakovaných endoskopických biopsiích, ve kterých byla zastižena pouze sliznice, bylo přistoupeno k resekčnímu výkonu. Histologicky byl v proximálním resekčním okraji v gastroezofageální junkci v lamina muscularis peroperačně, i v následném definitivním vyšetření, zastižen drobný vřetenobuněčný uzel průměru 2 mm, charakteru gastrointestinálního stromálního tumoru (GIST). V resekátu žaludku jsme pak identifikovali prominující tužší tumor 72 x 36 x 36 mm krytý sliznicí. Na řezu byl nádor bledý, tužší a uzlovitě uspořádaný. Mikroskopicky měl vřetenobuněčný fascikulárně uspořádaný charakter s variabilně vyjádřeným kolagenním stromatem, bez nekróz. Nádorové buňky nevykazovaly výraznější atypie, mitotická aktivita nepřesahovala hodnotu 1/50 HPF. V těsném sousedství hlavní nádorové masy byla drobná satelitní ložiska obdobného vzhledu jako ve stěně jícnu. Nádor imunohistochemicky exprimoval cKIT (CD117), CD34, hladkosvalový aktin a v nečetných buňkách i S100 protein, proliferační index stanovený pomocí Ki-67 nedosáhl 2 %. V lymfadenektomickém materiálu z okolí žaludku bylo zastiženo dvanáct uzlin bez metastatického postižení. Základní struktura tkáně uzlin však byla kompletně setřena difúzně uspořádanou malobuněčnou populací, která se v malém rozsahu šířila i do perinodální tukové tkáně. Imunofenotyp lymfocytů byl CD20+, CD23+, CD5+ s proliferací méně než 10 % (Ki-67). Molekulární vyšetření v nádoru žaludku nedetekovalo mutaci genu KIT v exonech 11, 9, 13 a 17 ani genu PDGFRA v exonech 12, 14 a 18. Při následném hematologickém vyšetření indikovaném na základě morfologického nálezu v lymfatických uzlinách byla v trepanobiopsii kostní dřeně pacienta a v souběžném vyšetření průtokovou cytometrií jak ve dřeni (obr. 6), tak v periferní krvi prokázána B CLL CD38 - a ZAP70-.
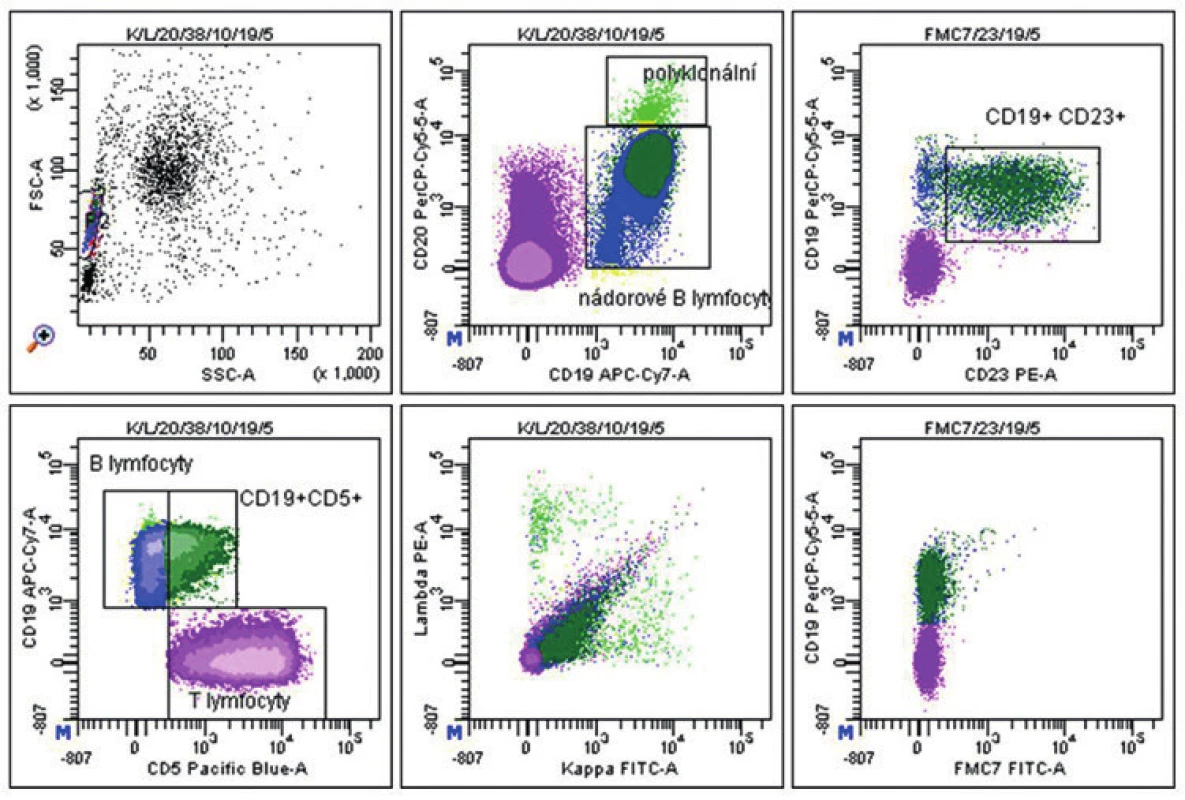
Uzavření případu a komentář
U pacienta byla postupně prokázána nádorová triplicita - dlaždicobuněčný karcinom skrota, v žaludku GIST průměru pod 10 cm, s mitotickou aktivitou do 5/50 HPF, se satelitními drobnými ložisky, bez postižení 12 lymfatických uzlin. V těchto uzlinách jsme však diagnostikovali B CLL/SLL. Bez pečlivého zhodnocení lymfoidní populace lymfatických uzlin by při domnělé nádorové duplicitě (karcinom a GIST) mohla nádorová infiltrace B lymfomem uniknout pozornosti a pacient by nebyl odpovídajícím způsobem sledován ani léčen.
PACIENT 4
Žena ve stáří 70 let byla indikována k exstirpaci uzliny pro generalizovanou lymfadenopatii a mírnou leukocytózu. K histologickému vyšetření byla nativně dodána zvětšená uzlina z pravého třísla. Ve zmrazeném řezu jsme nemohli vyloučit lymfom, blok proto zůstal zamrazen a část nativní uzliny jsme odebrali pro vyšetření průtokovou cytometrií v naší laboratoři. Průtoková cytometrie prokázala nečetné (do 5 % z celku) středně velké a větší B lymfocyty s imunofenotypem CD19+, CD20+, CD5-, CD10-, CD38 - bez průkazu klonální restrikce lehkých řetězců imunoglobulinů a malou subpopulaci T lymfocytů (cca 2 % z celku) s koexpresí molekul CD5+, CD10+ nejasného významu. V definitivním histologickém vyšetření byla struktura lymfatické uzliny se skleroticky rozšířeným pouzdrem částečně setřena. Folikuly byly rozvolněné a zvětšené, běžně s vymizením zárodečných center až k obrazu připomínajícímu progresivní transformaci zárodečných center (PTGC). Reziduální parakortex byl neovaskularizován. V celém rozsahu uzliny byla přítomna smíšená lymfoidní populace přestupující i do perinodální tkáně. Přítomny byly četné disperzní větší aktivované a mitoticky aktivní buňky, někdy charakteru imunoblastů a ojediněle připomínající Hodgkinovy buňky. Cíleně hledané diagnostické RS buňky ani LP buňky nebyly zastiženy. Nebyly přítomny granulomatozní změny, nekrotizace, hojnější eozinofily ani plazmatické buňky. Imunohistochemické vyšetření širokým panelem protilátek ilustrovalo již popsanou strukturu. Molekulární vyšetření metodou PCR neprokázalo klonální přestavby Ig genů (IgH, IgK) ani genů pro TCR. Při vyšetření chromogenní in situ hybridizací nebyla zastižena jaderná pozitivita EBER a neprokázali jsme tedy latentní EBV infekci. Nález jsme s rozpaky hodnotili jako atypickou polymorfní lymfoproliferaci EBV negativní, suspektní lymfom však nebyl přesvědčivě morfologicky ani molekulárně potvrzen. Klinikům jsme doporučili, aby při přetrvávání lymfadenopatie zvážili opakování odběru, opět se zajištěním nativní tkáně z jiné (i hůře dostupné) lokalizace, neboť inguinální uzliny obecně nejsou ideální pro subtypizaci lymfoproliferací pro běžný výskyt chronických reaktivních a regresivních změn.
V trepanobiopsii kostní dřeně ani v souběžně provedené průtokové cytometrii z periferní krve i z aspirátu kostní dřeně v rámci stážování nebyla prokázána lymfoproliferace ani jiný nádor.
Po měsíci průběhu choroby byla u pacientky patrná progrese. Byla exstirpována silně zvětšená lymfatická uzlina axily. Struktura lymfatické uzliny byla jak ve zmrazeném řezu, tak v definitivním vyšetření prakticky setřena lymfoproliferací. Jen naznačeně nodulárně uspořádaný proces již místy jevil tendenci k difúznímu splývání, folikuly ani splavy nebyly v přehledu patrné. Obrazu dominovaly infiltráty z disperzních a místy až plošně splývajících velkých polymorfních buněk převážně centroblastického charakteru s příměsí imunoblastů (obr. 7). Mitotická aktivita byla dobře patrná, zastiženy byly velmi nepravidelné vysloveně atypické mitotické figury. Imunohistochemicky stanovený imunofenotyp těchto nepochybně nádorových buněk byl CD20+, CD79α+, MUM1+, BCL2-, CD10-, BCL6-/+, průkaz CD23 ozřejmil pouze ojedinělé drobné roztříštěné sítě folikulárních dendritických buněk a proliferační aktivita stanovená pomocí Ki-67 přesahovala 90 % (obr. 8). Základní histologický i imunohistochemický obraz odpovídal DLBCL rozvíjejícímu se v terénu nodálního lymfomu z B buněk marginální zóny (NMZL). Průtoková cytometrie z uzliny však prokázala převážně středně velké až velké B lymfocyty (cca 23 % z „lymfo-gatu“), opět bez jednoznačného průkazu klonální restrikce povrchových i intracelulárních lehkých řetězců Ig. Molekulární vyšetření metodou PCR nedetekovalo klonální proliferaci B ani T buněk (IgH, IgK, IgL, TCRg, TCRd).
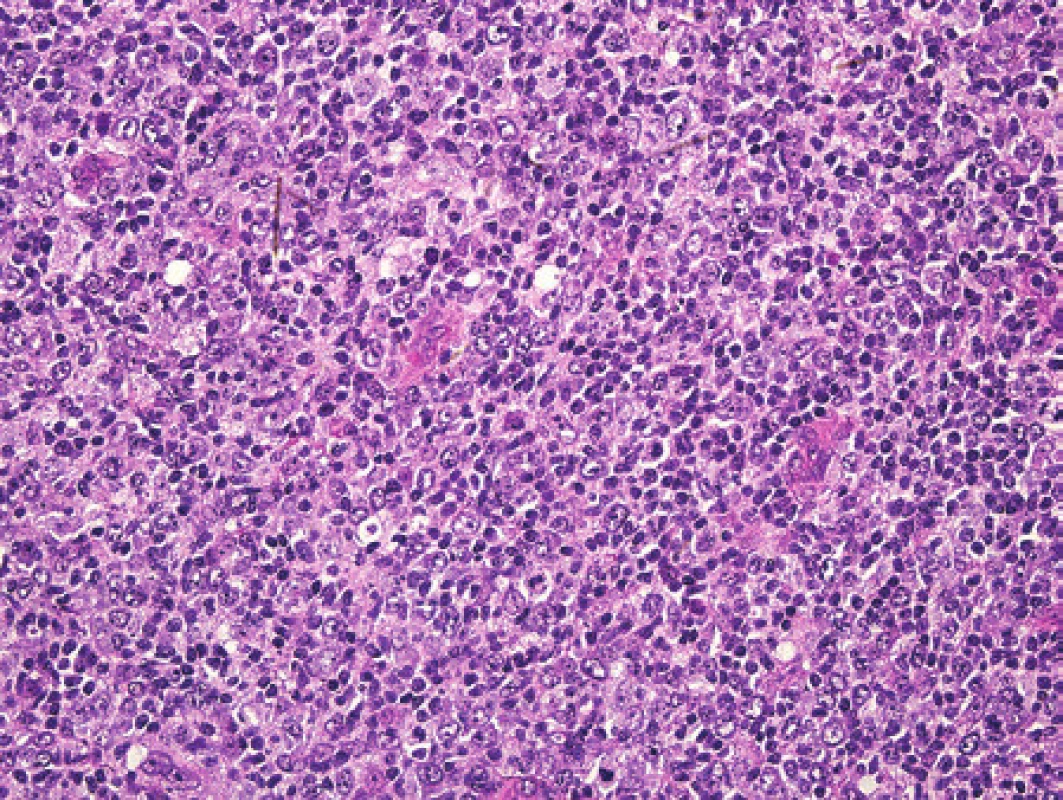
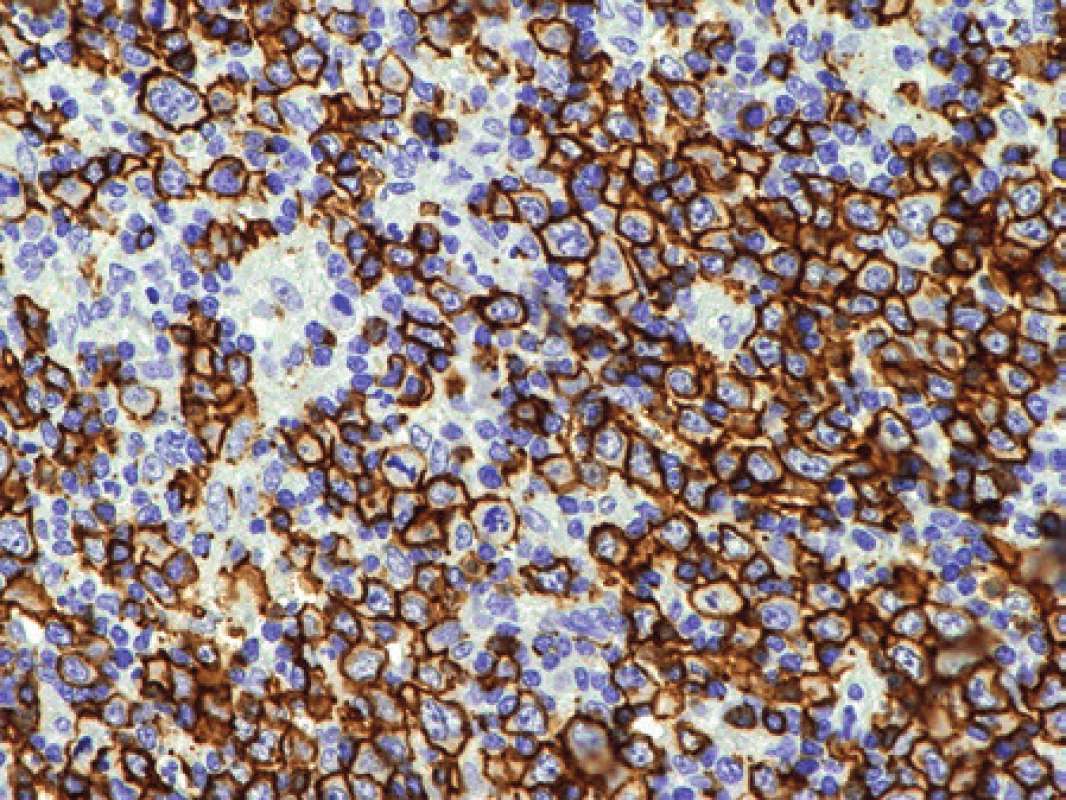
Uzavření případu a komentář
Diagnóza morfologicky nepochybně agresivního B lymfomu, který nejspíše odpovídal NMZL v transformaci do DLBCL, vyšetřeného z reprezentativního materiálu nebyla podpořena průkazem klonální populace ani v průtokové cytometrii ani extenzivním molekulárním vyšetřením. Pacientka zemřela po třech měsících od diagnózy na srdeční selhání. Při pitvě jsme prokázali přetrvávající generalizovanou lymfadenopatii s maximem v retroperitoneu a v podjaterní krajině (klinicky s obstrukcí žlučových cest a s ikterem). Uzliny byly prostoupeny výše popsaným velkobuněčným lymfomem. Na řešení případu byla zavádějící neprůkaznost klonality nádorové lymfoidní populace dvěmi nezávislými metodikami, která by bez správné interpretace morfologického a imunohistochemického vyšetření mohla vést k mylnému závěru benigního procesu. I když je tato situace neobvyklá, je třeba na ní upozornit právě proto, že výsledky vyšetření ilustrují, že žádná z metod nemá absolutní diagnostickou výpovědnost, zejména pokud je interpretována samostatně. V uvedeném případu byla morfologická diagnóza rozhodující, ale interpretace byla ztížena zavádějícími výsledky průtokové cytometrie a molekulární analýzy. Tato asynchronie ve výsledcích je vždy příčinou diagnostických rozpaků a pak je vhodné k diagnóze přistupovat hlavně z morfologického hlediska, pokud je toto přesvědčivé.
PACIENT 5
Muži ve věku 67 let se dva měsíce po implantaci totální endoprotézy pravého kolenního kloubu v místě jizvy vytvořila píštěl. Postupně, i přes antibiotickou terapii, přecházela do nehojícího se vředu. Zánětlivé markery neměl pacient zvýšeny, a proto byla indikována diagnostická excize. K dalšímu vyšetření jsme měli k dispozici pouze materiál fixovaný 4% roztokem formaldehydu. Histologicky se jednalo o excizi kůže a podkoží, která byla ve většině rozsahu prostoupena exulcerovaným lymfomem difúzně uspořádaným s akcentací perivaskulárně až s naznačeným angiocentrickým růstem, s fokální nekrotizací a prokrvácením. Maximum nádorové infiltrace bylo v rozšířených vazivových septech tukové tkáně subcutis, aniž by nádor destruktivně infiltroval adipocyty. Nádor dosahoval až k zachované epidermis a v malém rozsahu pronikal do junkce a do kožních adnex. Typický Pautrierův pseudoabsces jsme nezastihli. Nádorové buňky byly středně velké až velké atypické mononukleární elementy se světlejší cytoplazmou a s imunofenotypem stanoveným imunohistochemicky CD3+, CD45RO+, CD4+, CD30+, CD56+, cytotoxická granula+ (TIA1, granzyme B, perforin), CD5-, CD8-, CD20-, PAX5-, LMP1-, s proliferací podle průkazu Ki-67 přibližně 80 %. Nález byl tedy podezřelý z extranodálního NK/T lymfomu nasálního typu, ale jednalo se o velice netypickou lokalitu i projev onemocnění. Proto bylo přistoupeno k dalším vyšetřením. Vyšetření metodou chromogenní in situ hybridizace prokázalo v lymfoidním infiltrátu silnou jadernou pozitivitu EBER (obr. 9). Molekulární vyšetření metodou PCR nedetekovalo klonální přestavby genů pro TCR.
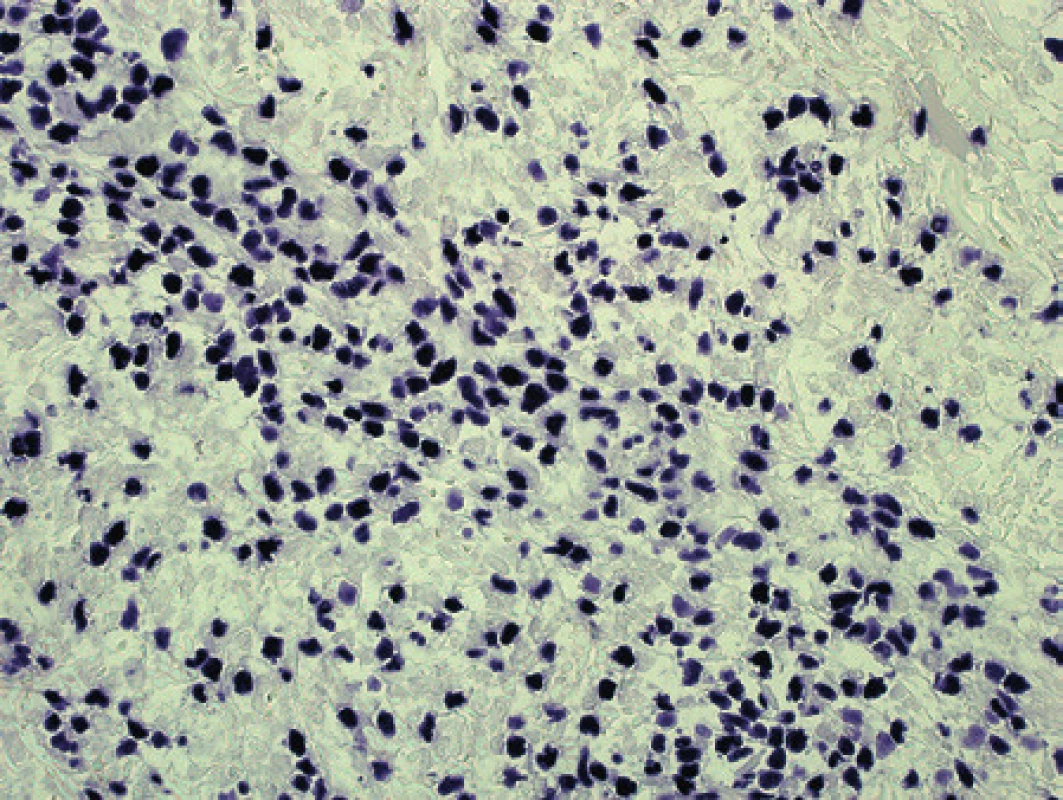
Uzavření případu a komentář
S ohledem na imunofenotyp a charakter růstu jsme případ uzavírali jako extranodální NK/T lymfom nasálního typu v neobvyklé lokalizaci v oblasti kolene a klinické souvislosti s předchozí operací (4). Bez průkazu genomu viru EBV metodou in situ hybridizace by nemohl být nález definitivně potvrzen.
PACIENT 6
Ke konzultačnímu vyšetření jsme obdrželi materiál fixovaný 4% roztokem formaldehydu od muže ve věku 37 let s rozsáhlým tumorem retroperitonea. Histologicky byl zastižen difúzně uspořádaný lymfom. Nádor byl tvořen středně velkými atypickými buňkami. Mitotická aktivita byla dobře patrná, obraz „hvězdného nebe“ se netvořil. Imunofenotyp nádorových buněk stanovený imunohistochemicky byl CD45+, CD20+, CD79α+, CD19+, BCL2+, CD10+, BCL6+, TdT-, CD23-, MUM1-, CD3-, CD5-, proliferační index stanovený pomocí Ki-67 přesahoval 95 %.
Histologickou diagnózu jsme uzavírali jako B lymfom vysokého stupně malignity s „GC-like“ imunofenotypem, blíže neurčený. I přes expresi molekuly BCL2 byl obraz vysoce suspektní pro Burkittův lymfom, a proto jsme indikovali vyšetření fluorescenční in situ hybridizací. Ta prokázala variantní translokaci MYC/lehké řetězce IG a zároveň translokaci IGH/BCL2 (obr. 10). V oblasti genu BCL6 nebyl zlom přítomen.
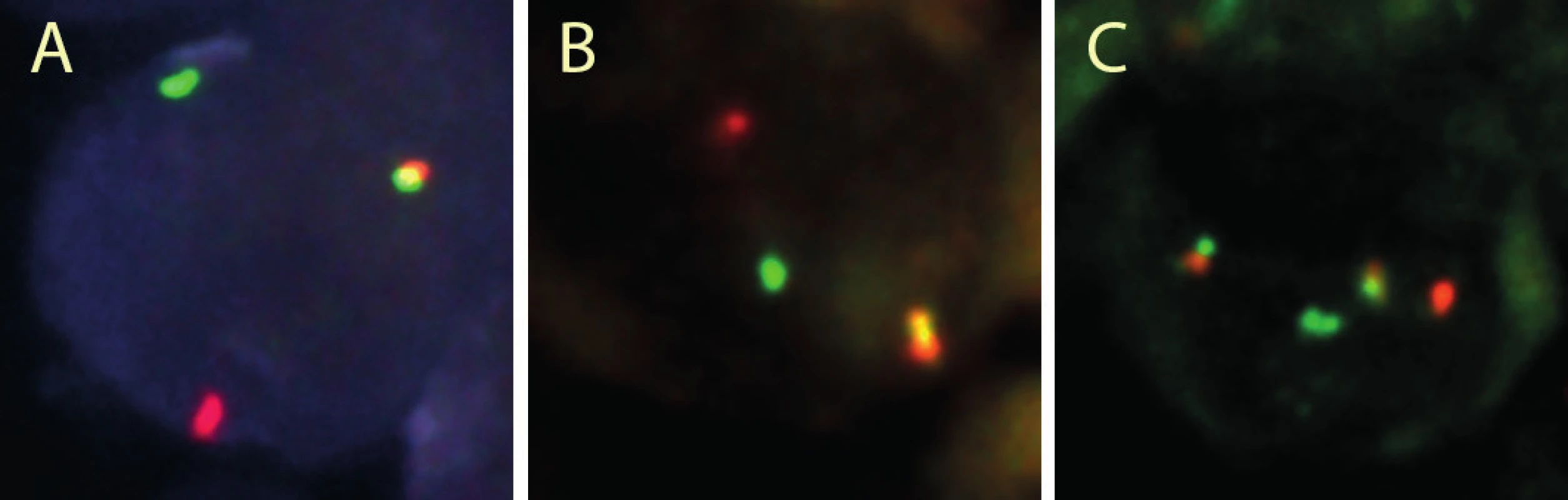
Uzavření případu a komentář
Nádor vzhledu Burkittova lymfomu s aberantní expresí BCL2 proteinu a s průkazem přestavby jak MYC tak i BCL2 genů odpovídá tzv. „double-hit“ lymfomu, který spadá do kategorie B lymfomu s rysy intermediálními mezi DLBCL a BL. Nepříznivá prognóza tohoto lymfomu byla potvrzena i u popisovaného případu, neboť pacient zemřel za méně než měsíc od diagnostického odběru za progrese onemocnění. Bez komplexního vyšetření pomocí FISH by nebylo možné daný proces klasifikovat jako „double-hit“ lymfom a vysvětlit aberantní expresi BCL2 proteinu. V tomto případě bylo onemocnění natolik agresivní, že terapie nemohla účinně zvrátit průběh. U některých pacientů je na základě FISH stanovení zlomu v genu MYC a současně zlomu v oblasti genu BCL2 nebo BCL6 možné aplikovat agresivnější terapii, která může průběh onemocnění zpomalit. V současné době se ukazuje i důležitost odlišit charakter „druhého hitu“, tedy je-li k přestavbě genu MYC přítomna přestavba genu BCL2, nebo genu BCL6 (5, 6).
PACIENT 7
Muži ve věku 64 let byl pro retroperitoneální lymfadenopatii proveden diagnostický odběr laparoskopickou cestou. V nativně dodaném materiálu bylo ve zmrazeném řezu vysloveno podezření na lymfom, blok zůstal zamrazen pro případná molekulární vyšetření. Průtoková cytometrie prokázala dvě klonální subpopulace B lymfocytů. Malé až středně velké buňky měly imunofenotyp CD19 (slabě až normálně)+, CD5-, CD38+, lambda+, CD20+, CD71-/+, CD79b+, CD10-, CD23-, FMC7-. Druhá subpopulace menších buněk vykazovala variabilní expresi molekul CD19, CD5+, CD23+/-, CD79b-, CD71-, FMC7-, asi 20 % z nich bylo CD19+, lambda (slabě)+ a 80 % bylo CD19 (slabě)+, kappa-, lambda-. V definitivním histologickém vyšetření byla struktura fragmentované uzliny setřena lymfomem přestupujícím i do perinodální tukové tkáně. Převážně nodulárně uspořádaný tumor byl tvořen středně velkými buňkami někdy s naznačenými centrocytoidními rysy, s mírnou mitotickou aktivitou a s imunofenotypem CD20+, CD23 - (jen reziduální sítě folikulárních dendritických buněk), CD10/BCL6-, CD5-, cyklin D1+, Ki-67+ (do 30 %). Mezi nádorovými uzly byla zastižena prakticky difúzní populace menších lymfocytů s imunofenotypem CD20+, CD23+, CD5+, cyklin D1-, CD10/BCL6 - s minimální proliferací.
V korelaci morfologie a průtokové cytometrie jsme diagnostikovali lymfomovou duplicitu s kolizí MCL a B CLL/SLL (7). Fluorescenční in situ hybridizace prokázala přítomnost translokace t(11;14)(q13;q32) CCND1/IGH. Extenzivní molekulární vyšetření metodou PCR nedetekovalo translokaci t(11;14) v hlavní zlomové oblasti MTC. Negativita nálezu je dána častou lokalizací zlomu v jiné části chromozomu, proto PCR vyšetření vždy kombinujeme s výše popsaným vyšetřením translokace metodou FISH (touto metodou jsou pokryta prakticky všechna místa zlomu v oblasti genu CCND1). Na úrovni mRNA jsme prokázali vysokou hladinu exprese cyklinu D1, která odpovídá overexpresi cyklinu D1 charakteristické pro MCL. Při screeningovém vyšetření B klonality jsme identifikovali biklonální přestavbu IgH i IgK. Z molekulárního hlediska je rozlišení klonálních přestaveb specifických pro každý lymfom bez mikrodisekční techniky nemožné. Pro určení jednotlivých typů přestaveb jsme provedli sekvenaci všech klonálních produktů (separace produktů v gelu) a analýzu získaných sekvencí. Abychom mohli identifikovat, které přestavby jsou specifické pro MCL a které pro B CLL/SLL, navrhli jsme nejprve specifické primery pro každou individuální přestavbu IgH i IgK. Následně jsme pomocí laserové mikrodisekce ze zmrazeného řezu disekovali CD23 pozitivní (CLL) a CD23 negativní (MCL) buňky (obr. 11). Z takto definovaných populací jsme izolovali DNA a amplifikovali pomocí specifických primerů pro jednotlivé separované klonální přestavby. Zjistili jsme, že IgH přestavba VH1/D6/JH6 a IgK přestavba INTRON/KDE je specifická v daném případě pro MCL a přestavba IgH VH4/D6/JH6 a IgK Vk2f/KDE pro B CLL/SLL.
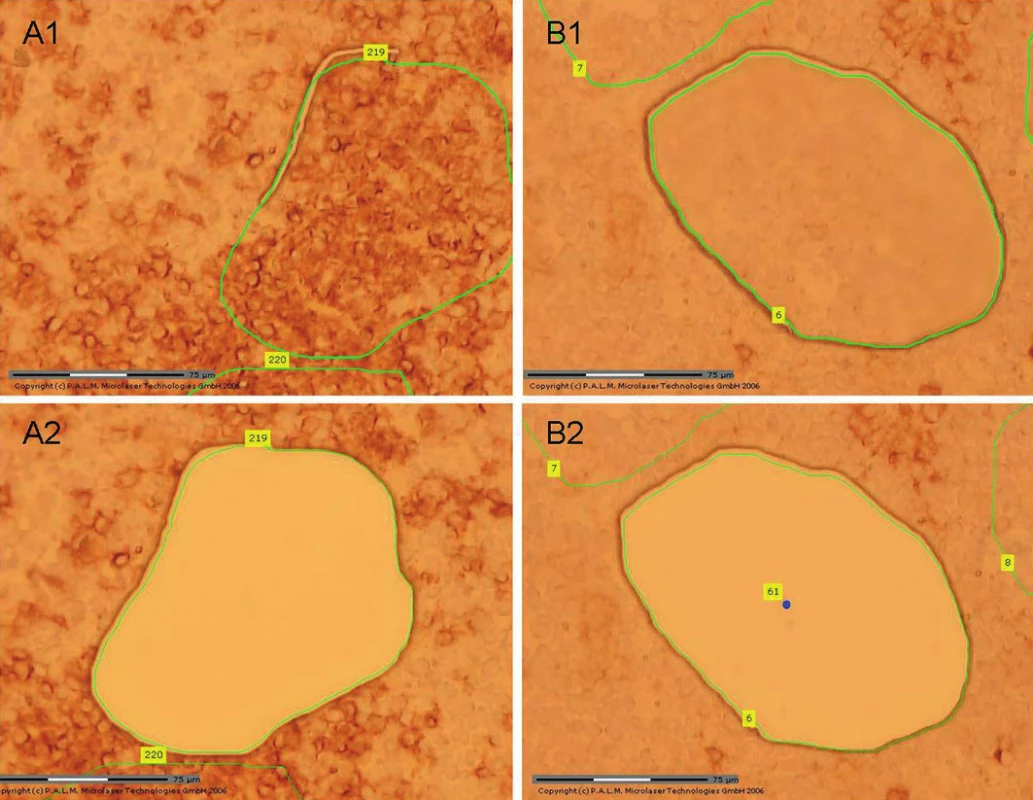
Uzavření případu a komentář
Diagnózu lymfomové duplicity s kolizí MCL a CLL (B CLL/SLL) ve vzorku uzliny jsme podpořili všemi dostupnými vyšetřeními. Pomocí sekvenace, následné laserové mikrodisekce a PCR analýzy jsme získali specifické markery jednotlivých nádorových subpopulací (pacient/lymfom specifický systém). Díky tomu lze u pacienta nyní separátně monitorovat obě nádorové populace s vysokou citlivostí (sledování tzv. minimální reziduální choroby). V tomto případě má tedy začlenění laserové mikrodisekce s následnou molekulární analýzou separovaných populací nádorových buněk zásadní význam pro identifikaci klonospecifických přestaveb imunoreceptorových genů a následné sledování pacienta.
PACIENT 8
Chlapec ve věku 17 let, který byl 18 měsíců po alogenní transplantaci kostní dřeně pro ALL, byl na základě suspektního izolovaného relapsu ALL v pankreatu indikován pro bioptický odběr (ve dřeni trvala remise). Pro ověření tohoto podezření byly odebrány drobné částky milimetrových rozměrů ze suspektního ložiska v pankreatu. V jedné částce, výrazně termicky poškozené, bylo přítomné ložisko lymfocytární celulizace. Jednalo se o smíšenou populaci B lymfocytů (CD19+, CD79α+) a T lymfocytů (CD3+, CD5+, CD45RO+). Tato populace byla negativní při průkazu TdT a CD10. Nádorová infiltrace charakteru ALL tedy nebyla v tomto odběru prokázána. Nebyla prokázána ani pozitivita EBV (LMP1-) ani EBER. Nález jsme interpretovali jako smíšený zánětlivý infiltrát tvořený směsnou populací zralých B a T lymfocytů. Dva měsíce po tomto odběru bylo chlapci bioptováno další suspektní ložisko z leukemické infiltrace žaludku. V jedné částce byla přítomna korporální žaludeční sliznice s ložiskovou intenzivní superficiální infiltrací lamina propria lymfoproliferací tvořenou středně velkými až velkými lymfocyty s nepravidelnými jádry a místy patrnými centrálními jadérky (obr. 12). Mitotická aktivita byla zvýšená, fokálně byly přítomny atypické mitózy. V druhé částce byly přítomné částečně zhmožděné úseky sliznice žaludečního typu s povrchovou erozí s neutrofily a fokálně tvorbou granulační tkáně v okolí. Lamina propria a muscularis mucosae byly difúzně infiltrované velkobuněčným lymfomem (imuhohistochemicky CD19+, CD20 slaběji+, CD79α+, CD10/BCL6+, MUM1-, CD3-, CD5-, TdT-, LMP1+). Na základě morfologického a imunohistochemického nálezu jsme diagnostikovali difúzní velkobuněčný B lymfom (DLBCL). Metodou chromogenní in situ hybridizace jsme zjistili jaderné EBER (latentní EBV infekce), přítomná byla silná jaderná pozitivita lymfoidních buněk v žaludeční sliznici. Vzhledem k tomuto nálezu a k anamnéze pacienta jsme nález upřesnili a zařadili jej jako monomorfní posttransplantační lymfoproliferativní onemocnění typu DLBCL. Metodou fluorescenční in situ hybridizace jsme v tomto materiálu následně detekovali přítomnost zlomu v oblasti 8q24, genu MYC, bez přítomnosti t(8;14)(q24;q32) IGH/MYC, přítomna byla variantní translokace MYC/lehké řetězce IG. Pro následnou molekulární analýzu jsme ve spolupráci s klinickými lékaři indikovali další odběr ze žaludku. Nález byl shodný s předchozím odběrem a odpovídal B lymfomu. Opětovně jsme v tomto odběru metodou FISH prokázali přítomnost zlomu v oblasti 8q24, gen MYC. Vzhledem k milimetrovým rozměrům odebraných částek však nebylo možné odlišit DLBCL a BL, navíc v rámci tzv. monomorfní posttransplantační nádorové lymfoproliferace. Zajímavé výsledky přineslo molekulární vyšetření. Ve vzorku biopsie žaludku jsme detekovali klonální přestavbu IgH. Následně jsme se rozhodli u pacienta vyšetřit původ nádorových buněk lymfomu v žaludku, a to zda je pacientův či dárce. Vyšetření jsme provedli pomocí šesti mikrosatelitních lokusů (THO, D11S1338, D11S1307, D2S123, D9S156 a D9S171) (8). K dispozici jsme měli vzorek DNA lymfomu žaludku, vzorek periferní krve pacienta před transplantací kostní dřeně a periferní krev po transplantaci, kde byl detekován kompletní dárcovský chimérizmus. Ve vzorku DNA izolovaném z lymfomu žaludku jsme detekovali dárcovský genotyp (přítomnost alel STR lokusů pacienta před transplantací kostní dřeně je v souhlasu s přítomností nenádorových buněk žaludku - morfologicky do 10 %). V souladu se zkušenostmi jiných autorů nález jednoznačně svědčil pro dárcovský původ PTLD (obr. 13) (9).
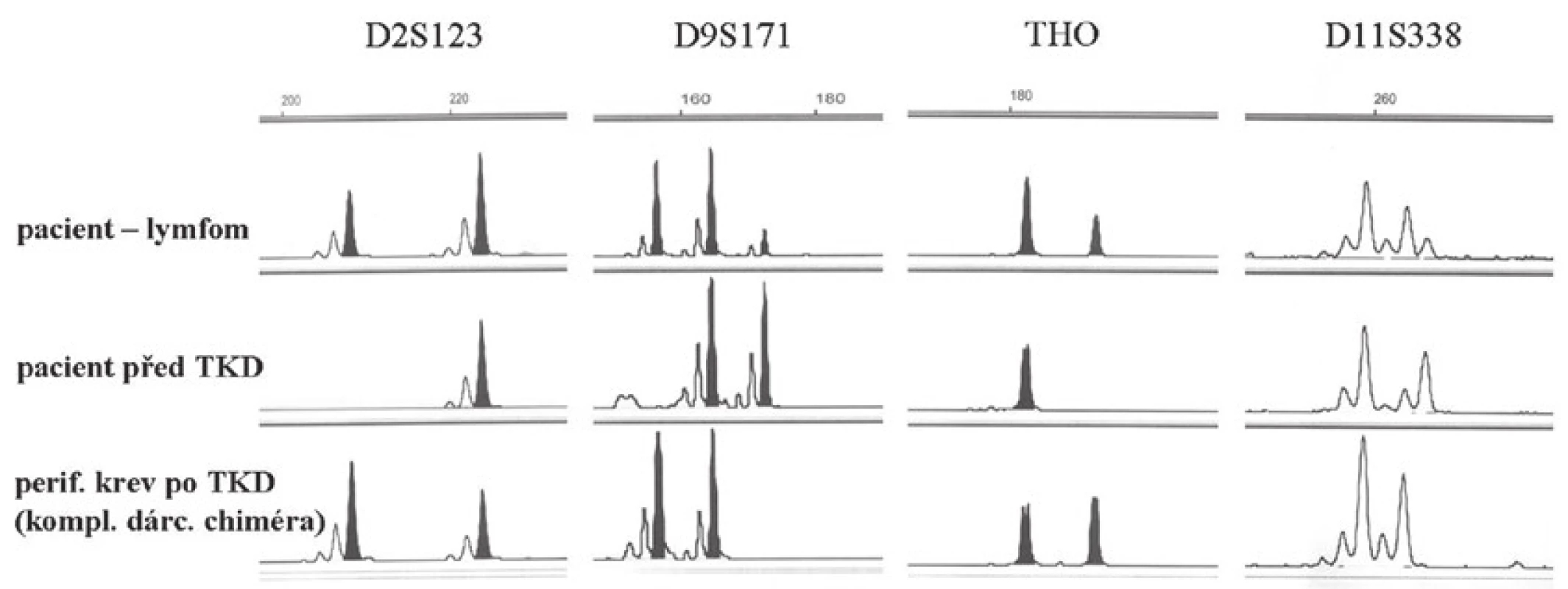
Uzavření případu a komentář
Imunofenotyp svědčil pro původ nádorových buněk ze zárodečných center (CD10+, BCL6+, MUM1-). Tento nález se může vyskytovat jak u DLBCL, tak u BL. Je však spolu s negativitou molekuly BCL2 a se zlomem v genu MYC častější u BL. Jak je známo, BL se také vyskytuje v terénu chronické EBV lymfoproliferace. Zjištěná slabší a kolísavá exprese molekuly CD20 by mohla souviset s předchozí terapií preparátem Mabthera. Nádor byl proliferačně silně aktivní a nejevil ve vyšetřeném rozsahu znaky rozpadu.
Chlapec v imunosuprimovaném terénu po transplantaci kostní dřeně pro ALL od HLA identického bratra rozvinul dárcovský B lymfom v terénu latentní EBV infekce. Bez podrobného molekulárního vyšetření by původ buněk lymfomu nebylo možné zjistit.
ZÁVĚR
Na uvedených modelových případech jsme se snažili demonstrovat nezbytnost komplexního přístupu v diagnostice lymfomů. Ilustrace na kazuistických případech jsme vybrali tak, aby zdůraznily nejen význam a nutnost začlenění molekulárních metod do rutinního vyšetření lymfomů, ale i z pohledu potřeby zachovat si vedle využití nových laboratorních metod také zdravý diagnostický nadhled při interpretaci komplikovaných nálezů. Bez spolupráce týmu patologů, molekulárních biologů, imunologů a ostatních odborníků na pracovištích patologie by diagnostika lymfomů u části nemocných byla obtížná nebo dokonce neproveditelná.
Poděkování
Podpořeno projektem (Ministerstva zdravotnictví) koncepčního rozvoje výzkumné organizace 00064203 (FN MOTOL) a OPPK CZ.2.16/3.1.00/24022.
SEZNAM ZKRATEK
ALK protein „anaplastic lymphoma kinase“
ALL akutní lymfoblastická leukémie
B CLL/SLL „B-cell chronic lymphocytic leukemia/small lymphocytic lymphoma“
BCL2 „B-Cell CLL/Lymphoma 2“
BCL6 „B-Cell CLL/Lymphoma 6“
BL Burkittův lymfom
CCND1 Gen kódující „Cyclin D1“
KIT „V-Kit Hardy-Zuckerman 4 Feline Sarcoma Viral Oncogene Homolog“
DLBCL „Diffuse large B-cell lymphoma“
EATL „Enteropathy Associated T cells Lymphoma“
EBER „Epstein-Barr virus (EBV) - encoded small RNAs“
EBV „Epstein-Barr virus“
FISH fluorescenční in situ hybridizace na interfázických jádrech
FMC7 protilátka, epitop molekuly CD20
GIST gastrointestinální stromální tumor
HPF „high-power field“
Ig imunoglobuliny
IHC imunohistochemické vyšetření exprese proteinů
KDE „kappa-deleting element“
LMP1 latentní membránový protein 1
LP buňky „lymphocyte predominant“ buňky
MCL „Mantle cell lymphoma“
MTC „major translocation cluster“
MUM1 „Mutated Melanoma-Associated Antigen“
MYC „v-myc avian myelocytomatosis viral oncogene homolog“
NMZL „Nodal Marginal Zone Lymphoma“
PAX5 „B-Cell Lineage Specific Activator paired box 5“
PCR polymerázová řetězová reakce
PDGFRA „Platelet-Derived Growth Factor Receptor, Alpha Polypeptide“
PTGC „Progressive transformation of germinal centres“
PTLD „Post-transplant lymphoproliferative disorder“
STR „short tandem repeat“
TCR „T-cell receptor“
TdT „Terminal deoxynucleotidyl transferase“
THRBCL „T-cell/histiocyte-rich large B-cell lymphoma“
ZAP70 „Zeta-Chain (TCR) Associated Protein Kinase 70kDa“
Adresa pro korespondenci:
Prof. MUDr. Roman Kodet, CSc.
Ústav patologie a molekulární medicíny
2. LF UK a FN v Motole, Praha
V Úvalu 84, 150 06 Praha 5 - Motol
email: roman.kodet@fnmotol.cz
Sources
1. van Dongen JJ, Langerak AW, Bruggemann M, et al. Design and standardization of PCR primers and protocols for detection of clonal immunoglobulin and T-cell receptor gene recombinations in suspect lymphoproliferations: report of the BIOMED-2 Concerted Action BMH4-CT98-3936. Leukemia 2003; 17(12): 2257-2317.
2. Nam-Cha SH, San-Millan B, Mollejo M, et al. Light-chain-restricted germinal centres in reactive lymphadenitis: report of eight cases. Histopathology 2008; 52(4): 436-444.
3. van der Velden VH, Szczepanski T, Wijkhuijs JM, et al. Age-related patterns of immunoglobulin and T-cell receptor gene rearrangements in precursor-B-ALL: implications for detection of minimal residual disease. Leukemia 2003; 17(9): 1834-1844.
4. Fried I, Artl M, Cota C, et al. Clinicopathologic and molecular features in cutaneous extranodal natural killer-/T-cell lymphoma, nasal type, with aggressive and indolent course. J Am Acad Dermatol 2014; 70(4): 716-723.
5. Kobayashi T, Tsutsumi Y, Sakamoto N, et al. Double-hit lymphomas constitute a highly aggressive subgroup in diffuse large B-cell lymphomas in the era of rituximab. Jpn J Clin Oncol 2012; 42(11): 1035-1042.
6. Pillai RK, Sathanoori M, Van Oss SB, Swerdlow SH. Double-hit B-cell lymphomas with BCL6 and MYC translocations are aggressive, frequently extranodal lymphomas distinct from BCL2 double-hit B-cell lymphomas. Am J Surg Pathol 2013; 37(3): 323-332.
7. Hoeller S, Zhou Y, Kanagal-Shamanna R, et al. Composite mantle cell lymphoma and chronic lymphocytic leukemia/small lymphocytic lymphoma: a clinicopathologic and molecular study. Hum Pathol 2013; 44(1): 110-121.
8. Krsková-Honzátková L, Čermák J, Sajdová J, et al. Microsatellite instability in hematological malignancies. Leuk Lymphoma 2002; 43(10): 1979-1986.
9. Hussein K, Tiede C, Maecker-Kolhoff B, Kreipe H. Posttransplant lymphoproliferative disorder in pediatric patients. Pathobiology 2013; 80(6): 289-296.
Labels
Anatomical pathology Forensic medical examiner ToxicologyArticle was published in
Czecho-Slovak Pathology

2014 Issue 3
-
All articles in this issue
- Extraintestinal oxyuriasis – report of three cases and review of literature
- Up-to-date experience with the international classification system Bethesda 2010 for thyroid fine-needle aspirate: a review
- A complex diagnostic approach in lymphomas: practical aspect in short case reports
- Molecular testing in malignant melanoma
- Soft tissue tumors - the view of the molecular biologist
- Intestinal metaplasia of the stomach and esophagus: an immunohistochemical study of 60 cases including comparison with normal and inflamed intestinal mucosa
- Myxoid variant of peritoneal epithelioid malignant mesothelioma. A case report
- Czecho-Slovak Pathology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Intestinal metaplasia of the stomach and esophagus: an immunohistochemical study of 60 cases including comparison with normal and inflamed intestinal mucosa
- Soft tissue tumors - the view of the molecular biologist
- Up-to-date experience with the international classification system Bethesda 2010 for thyroid fine-needle aspirate: a review
- A complex diagnostic approach in lymphomas: practical aspect in short case reports
