Infekce po transplantaci ledviny
Infections after kidney transplantation
Immunosuppressed kidney transplant recipients are at risk for a variety of infectious complications and more than half of them suffered from this complication in the early post-transplant period. Despite the fact that the long term risk of serious infectious complications in the early postoperative period decreased, remain the infection the most frequent cause of morbidity in the first 6 months after transplant. It is important to realize that the clinical manifestations of infection in the compromised host are variable and often atypical.
In the later period, infections that affect the kidney graft become clinically important, and some of them occur only in immunosuppressed patients. Here we will discuss polyomavirus nephropathy which represents the most important and most frequent viral disease of renal allografts.
Keywords:
polyomavirus nephropathy – kidney transplantation – infectious complications
:
Iva Svobodová 1; Eva Honsová 2
:
I. patologicko-anatomický ústav LF MU a FN u sv. Anny v Brně
1; Pracoviště klinické a transplantační patologie, Transplantcentrum IKEM, Praha
2
:
Čes.-slov. Patol., 51, 2015, No. 3, p. 120-122
:
Reviews Article
Pacienti po transplantaci ledviny jsou v riziku různých infekčních komplikací a více než polovina z nich se v časném potransplantačním období s nějakou infekční komplikací setká. Přesto, že se z dlouhodobého pohledu riziko závažných infekčních komplikací v časném pooperačním období snížilo, zůstávají infekce v prvních 6 měsících nejčastější příčinou morbidity. V pozdějším období se objevují infekce, které postihují štěp ledviny a některé z nich se vyskytují pouze u pacientů v imunosupresi. Mezi klinicky nejvýznamnější a nejčastější nejvýznamnější patří polyomavirová nefropatie.
Klíčová slova:
polyomavirová nefropatie – transplantace ledviny – infekční komplikace
Pacienti po transplantaci ledviny jsou v riziku různých infekčních komplikací a více než polovina z nich se v časném potransplantačním období s nějakou infekční komplikací setká. Přesto, že se z dlouhodobého pohledu riziko závažných infekčních komplikací v časném pooperačním období snížilo, zůstávají infekce v prvních 6 měsících nejčastější příčinou morbidity. Na rozvoji infekce se nepodílí jen imunosuprese, ale také stav dárce a především příjemce před transplantací (malnutrice, DM, vezikoureterální reflux nebo jiné anomálie močových cest, dlouhodobá dialýza atd.). Obecně časně po transplantaci hrají větší roli infekce mimo štěp (bakteriální infekce z operační rány, infekce doprovázející katétry, infekce močových cest, pneumonie a reaktivované herpetické infekce). V pozdějším období se objevují infekce, které postihují štěp ledviny a některé z nich se vyskytují pouze u pacientů v imunosupresi; mezi nejvýznamnější patří polyomavirová nefropatie.
POLYOMA-BK-VIRUS NEFROPATIE (PVN)
Polyomaviry jsou malé DNA viry, které infikují různorodá zvířata, včetně hlodavců, ptáků, ale i opic a lidí (1). Je známo 8 polyomavirů, které infikují člověka, a v transplantační medicíně jsou nejdůležitější JC a BK virus (2). Oba jsou pojmenovány podle iniciál pacientů, u kterých byly poprvé identifikovány. JC virus je znám jako původce progresivní multifokální leukoencefalopatie u imunosuprimovaných pacientů, především u dospělých s HIV infekcí.
BK virus je původce polyomavirové nefropatie (PVN), která představuje nejčastější virovou intersticiální nefritidu u příjemců transplantovaných ledvin. Jen velmi výjimečně se toto onemocnění objevuje v autologních ledvinách u příjemců jiných transplantovaných orgánů (3, 4). BK polyomavirus je ubikvitní, specificky evolučně adaptovaný k hostiteli a nemá žádný klinický význam u imunitně kompetentních jedinců. Vyvolává latentní infekci v dětství (> 90 % séropozitivních dětí ve věku 10 let) a přetrvává v urotelu a v epitelu kanálků ledviny s intermitentní reaktivací např. během gravidity. Onemocnění vyvolává jen u imunokomprimovaných pacientů. U transplantovaných pacientů byla PVN poprvé diagnostikovaná Mackeziem v r. 1978 (5). Bylo to daleko dříve, než se začaly používat imunosupresivní léky 3. generace, především tacrolimus a mycofenolát mofetil (MMF), po jejichž zavedení do klinické praxe se v mnoha centrech objevil „epidemický výskyt“ PVN, který je považován za komplikaci související s příliš intenzivní imunosupresí. V současnosti prevalence PVN se pohybuje od 1 - 10 %. V posledním desetiletí většina velkých center zaznamenává pokles případů PVN, díky protokolům udržující optimální hladiny imunosuprese. Přesto PVN představuje stále závažnou komplikaci s obtížnou léčbou, protože neexistuje žádná specifická virostatická terapie, která by dokázala polyomavirus eliminovat.
PVN je typicky diagnostikovaná mezi 10. - 14. měsícem po transplantaci a podle rozsahu poškození epitelu tubulů v době diagnózy pacient má nebo nemá dysfunkci štěpu. Ve většině center existuje screening PVN, který využívá cytologické detekce infikovaných buněk v moči (tzv. decoy cells) v kombinaci s PCR detekcí virové DNA (6). Obě metody svědčí o reaktivaci viru v urotelu, ale pokud nejsou v cytologii zastiženy válce/shluky infikovaných buněk (které jsou důsledkem odlitkových válců z kanálků ledviny) nelze s jistotou tvrdit, že pacient má PVN (7). Definitivní diagnóza vyžaduje bioptickou verifikaci s detekcí infikovaných buněk epitelu tubulů.
Histopatologická diagnóza PVN
Histopatologická diagnóza PVN stojí na identifikaci charakteristických jaderných virových inkluzí v epitelu různých etáží nefronu (obr. 1). Imunohistochemický průkaz potvrdí diagnózu (obr. 2). Infekce buněk epitelu vede k morfologii virově indukovaného akutního tubulárního poškození. Poškozené epitelie jsou uvolněny a dostávají se do lumin tubulů, tím se odkryje bazální membrána a dojde k projevům virově indukovaného akutního tubulárního poškození (nebo dřívější terminologií akutní tubulární nekrózy), což se v klinice projeví dysfunkcí štěpu. Podle stupně postižení se odlišují 3 stadia PVN (8). První stadium (A) představuje časnou fázi infekce, kdy jsou infikované buňky epitelu a v intersticiu je minimální zánětlivá reakce. Často jde o infekci zastiženou ve dřeni a tato forma má největší šanci na vyléčení. Druhé stadium (B) představuje plně vyvinuté onemocnění s denudací bazálních membrán, edémem a zánětem v intersticiu (virovou intersticiální nefritidou). Složení zánětlivého infiltrátu při virové infekci a při rejekci se neliší. U obou případů může být příměs polynukleárů s eozinofily (v závislosti na produkci cytokinů a typu Th odpovědi), stejně tak jako mohou být v infiltrátu četné plazmocyty nebo mohou dominovat CD3 pozitivní lymfocyty. Imunohistochemická detekce zánětlivých elementů tedy nepomůže v rozlišení rejekce a infekce. Panuje shoda, že rejekci při PVN lze spolehlivě diagnostikovat, pokud má cévní (arteriální) komponentu, glomerulitidu, transplantační glomerulopatii a nebo difúzně pozitivní průkaz C4d v peritubulárních kapilárách. Rozlišení intersticiální formy rejekce a zánětu doprovázejícího PVN není na základě histopatologie možné a podle některých studií jsou neodlišitelné i při použití molekulárně genetických metod. Třetí stádium (C) představuje pokročilé formy onemocnění s atrofickými tubuly a s fibrózou v intesticiu.
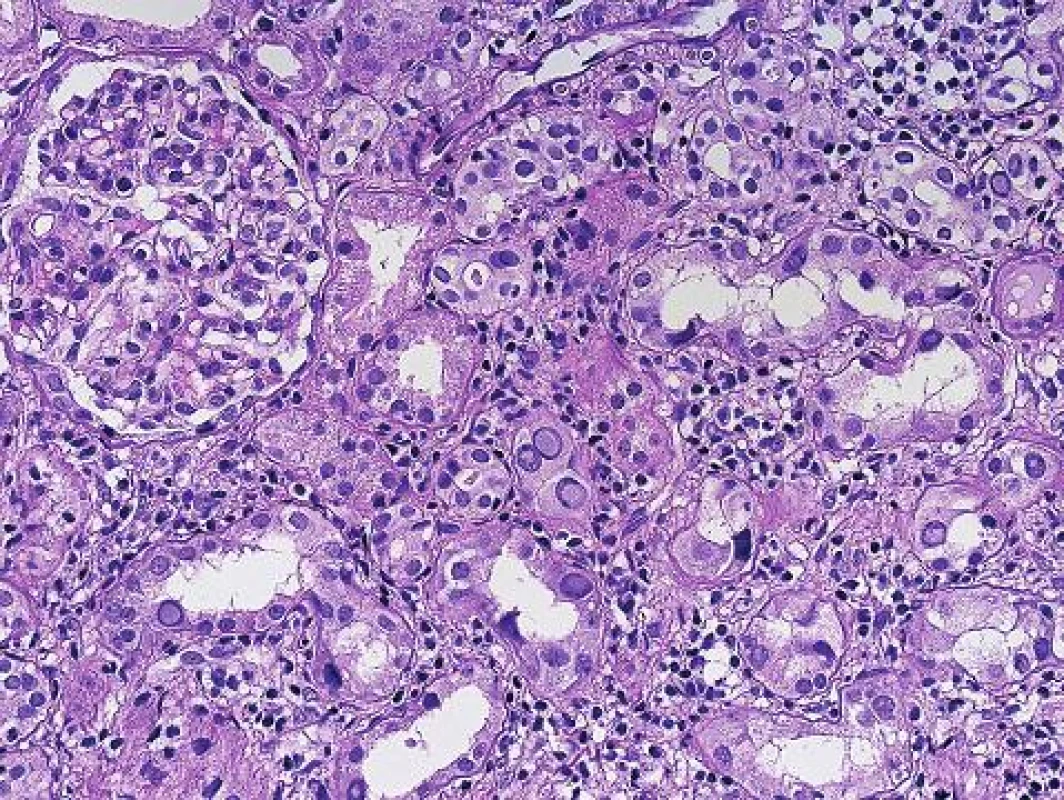
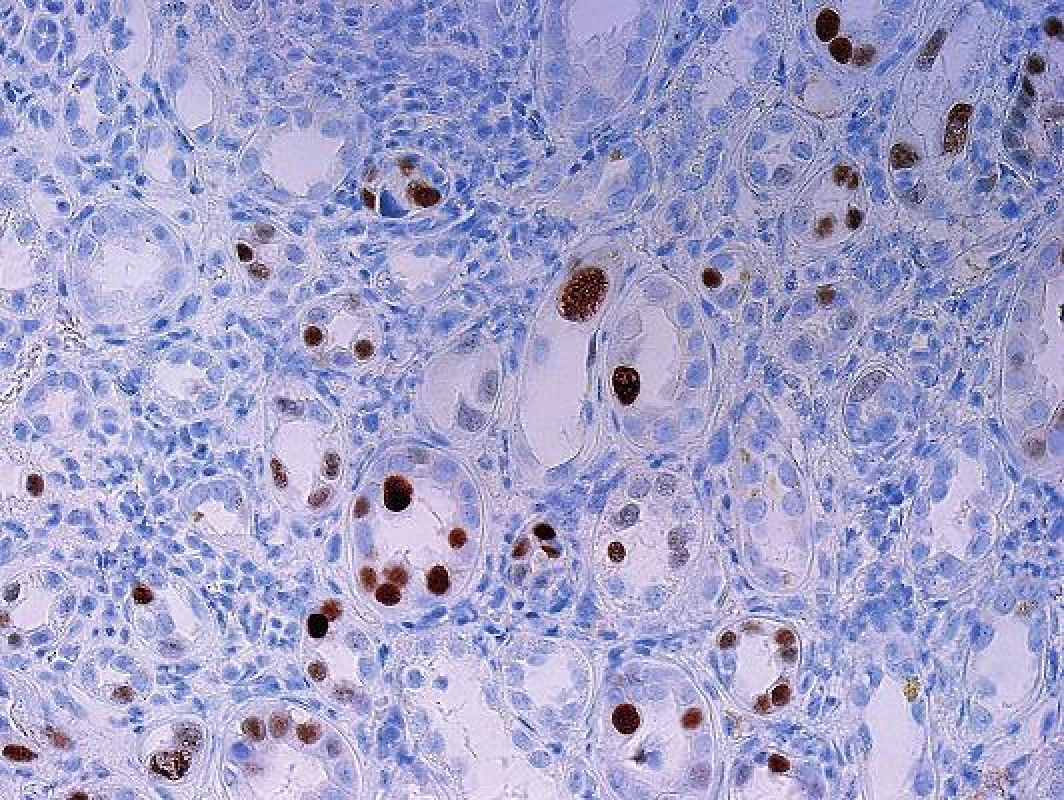
V případech pozdního rozsáhlého postižení není diagnóza komplikovaná a inkluze jsou dobře rozpoznatelné již na úrovni HE, takové nálezy jsou obvykle v graftektomiích, v selhaných štěpech. V běžné bioptické praxi je tomu ale jinak. Cílem je zastihnout, co nejčasnější postižení, které je pokud možno limitované pouze na epitel kanálků dřeně. V takových případech bývá ve vzorcích jen velmi malé množství infikovaných buněk, které navíc nemusí být optimálně zastiženy a jejichž jádra ani nemusí být zvětšená a lze je tedy bez verifikace imunohistochemickým průkazem velmi snadno minout (obr. 3). Protože v okolí bývá reaktivní zánětlivá celulizace, mohou být takové případy hodnoceny jako hraniční změny, na které klinik reaguje navýšením imunosuprese zvl. steroidů, to má za následek progresi infekce a těžké poškození štěpu. Podobné případy vedly k tomu, že ve většině center se imunohistochemický průkaz polyomaviru provádí rutinně ze všech biopsií ledvinných štěpů v období delším než 3 měsíce po transplantaci. Pro PVN je typická fokální distribuce infekce, která se šíří jednotlivými nefrony, což v praxi znamená, že jsou vedle sebe tubuly s infekcí a tubuly nepostižené. Ne vždy musí být proto postižené tubuly v biopsii zastiženy. To někdy způsobuje potíže v klinické interpretaci morfologie, protože to, že v první biopsii je PVN a v následující není, rozhodně neznamená, že infekce byla vyléčena.
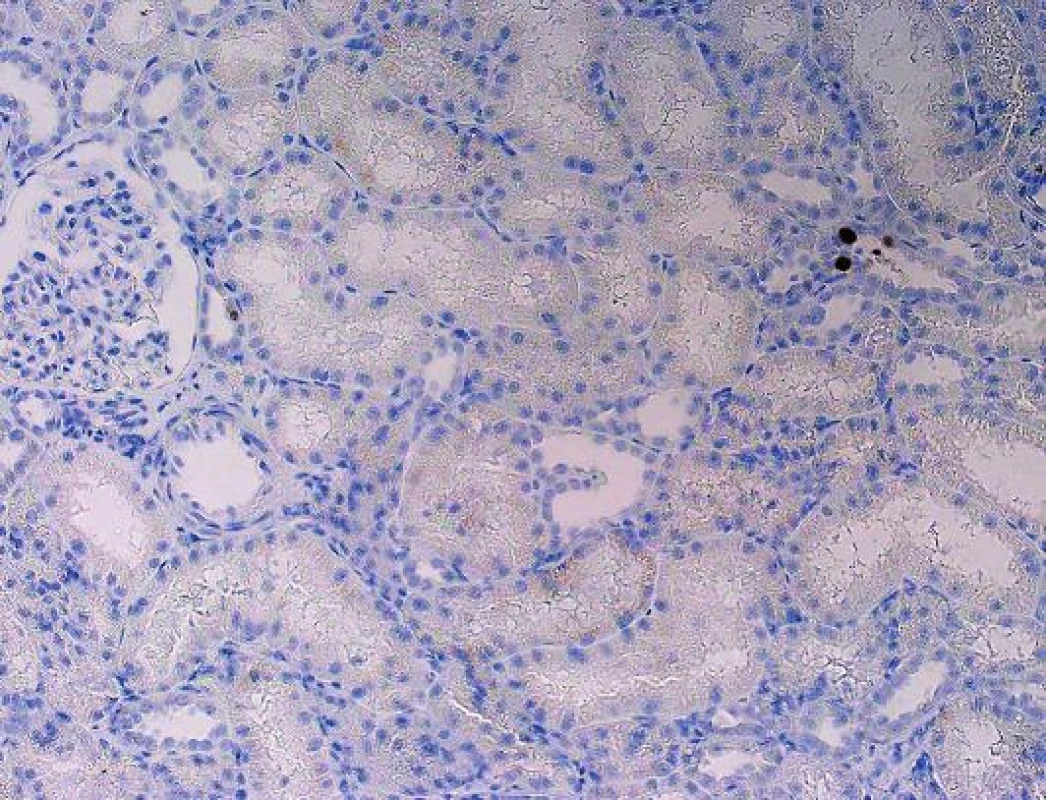
Polyomavirová infekce obvykle negeneralizuje, jsou popsané zcela výjimečné případy systémového postižení (9).
CYTOMEGALOVIRUS (CMV) NEFROPATIE
Cytomegalovirus je jedním z nejběžnějších patogenů postihujících pacienty po transplantacích solidních orgánů. V případě transplantací ledvin, příjemci mají profylaktickou léčbu, jejíž délka a výběr preparátů se v jednotlivých centrech liší. Shoda je v tom, že CMV-séronegativní příjemci, kteří obdrží štěp od CMV-séropozitivního dárce, musí být profylakticky léčeni.
Postižení ledvin je velmi raritní a pohybuje se o řád níž než počet případů s polyomavirovou infekcí. CMV má spíše než k tubulárnímu epitelu afinitu k endotelu (podobně jako v jiných lokalizacích např. v GIT). Inkluze jsou jaderné a současně cytoplasmatické a typicky velmi fokální (obr. 4). I v případě CMV infekce lze diagnózu ověřit imunohistochemickým průkazem. Počet postižených buněk je obvykle mnohem nižší než v případě PVN.
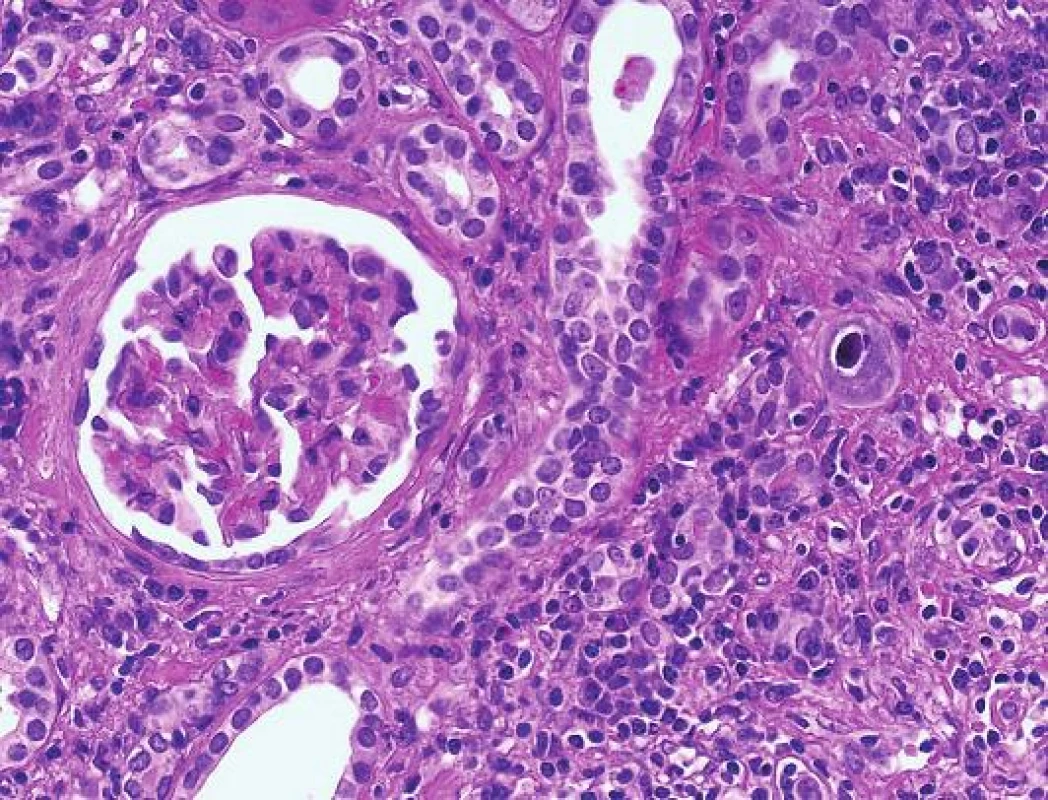
ADENOVIRUS
Adenovirová infekce štěpu ledviny představuje velmi raritní komplikaci, která se projeví tubulointersticiálním zánětem s nekrózami a hemoragiemi. V zánětlivé celulizace je často významná příměs polynukleárů, v tubulárním epitelu jsou virové inkluze. Diseminovaná infekce ohrožuje pacienta na životě.
PYELONEFRITIDA
Patogeneze akutní bakteriální pyelonefritidy je totožná jako v autologních orgánech. Typickým morfologickým znakem jsou tubuly s polynukleáry v luminech. V biopsiích štěpů se pyelonefritida vyskytuje výjimečně, obvykle tehdy, kdy je z klinického pohledu časně po transplantaci obtížné odlišit pyelonefritidu a rejekci. V diagnostice musí být patolog opatrný a zvažovat i jiné běžné důvody pro akumulaci malého množství polynukleárů ve tkáni, hlavně chirurgické manipulace při operaci nebo revizi, po kterých jsou drobné kolekce polynukleárů ve tkáni přítomné vždy.
EPSTEIN BARR VIRUS (EBV)
EBV představuje samostatnou a velmi důležitou problematiku po transplantacích solidních orgánů. Klíčovou roli hraje při rozvoji potransplantační lymfoproliferace (PTLD), která je součástí spektra projevů EBV infekce. Pacienti po transplantaci mohou mít klasickou infekční mononukleózu, polyklonální proliferaci nebo lymfom. PTLD se může objevit ve štěpu i mimo něj v jiných orgánech (např. v GIT). Většina PTLD je původem příjemce, jen výjimečně jsou prokazovány PTLD lymfocytů dárce, které byly omezeny na štěp. Diagnostika PTLD a lymfomů vyžaduje imunofenotypizaci a využití molekulárně genetických metod pro určení klonality a patří do rukou hematopatologa.
ZÁVĚR
Přes rozvoj nových diagnostických metod v oblasti transplantací ledvin stále platí, že všechny hlavní příčiny, které poškozují štěp (od tubulárního poškození, přes rejekci po rekurenci původního onemocnění), využívají biopsii jako diagnostický zlatý standard. Totéž platí pro PVN, kde biopsie nejen verifikuje infekci, ale současně určuje stádium, hodnotí rozsah fibrózy a dodává i potenciální jiné příčiny, které mohou ovlivňovat dysfunkci štěpu. I když se během posledních desetiletí zlepšilo přežívání štěpů s PVN a také došlo ke snížení incidence této choroby, stále máme před sebou více otázek než odpovědí. Především by naši pacienti ocenili lepší znalost rizikových faktorů vývoje PVN, což by bylo předpokladem cílené prevence. Stejně tak stále čekáme na účinnou antivirovou terapii, která by dokázala stabilizovat či lépe vyléčit i případy s infekcí v kanálcích kůry.
PROHLÁŠENÍ
Autor práce prohlašuje, že v souvislosti s tématem, vznikem a publikací tohoto článku není ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou. Toto prohlášení se týká i všech spoluautorů.
Adresa pro korespondenci:
Doc. MUDr. Eva Honsová, Ph.D.
Pracoviště klinické a transplantační patologie
Transplantcentrum IKEM
Vídeňská 1958/9, 140 21 Praha 4
e-mail: eva.honsova@ikem.cz
Sources
1. Hirsch HH, Steiger J. Polyomavirus BK. Lancet Infect Dis 2003; 3 : 611-623.
2. Jiang M, Abend J, Johnson S et al. The role of polyomaviruses in human disease. Virology 2009; 20 : 266-273.
3. Ducharme-Smith A, Katz BZ, Bobrowski AE et al. Prevalence of BK polyomavirus infection and association with renal dysfunction in pediatric heart transplant recipients. J Heart Lung Transplant 2015; 34(2): 222-226.
4. Aksenova M, Tsetlina V, Gutovskaya E et al. BK virus nephropathy in a pediatric patient after hematopoietic stem cell transplantation. Pediatr Transplant 2015; 19(1): E29-32.
5. Mackenzie EF, Poulding JM, Harrison PR et al. Human polyoma virus (HPV) - a significant pathogen in renal transplantation. Proc Eur Dial Transplant Assoc 1978; 15 : 352-360.
6. Bechert Ch, Schnadig V, Payne D, Dong J. Monitoring of BK viral load in renal allograft recipients by Real – time PCR assays. Am J Clin Pathol 2010; 133 : 242-250.
7. Singh HK, Reisner H, Derebail VK et al. Polyomavirus nephropathy: quantitative urinary polyomavirus-haufen testing accurately predicts the degree of intrarenal viral disease. Transplantation 2015; 99(3): 609-615.
8. Drachenberg C, Hirsch HH, Ramos E et al. Polyomavirus disease in renal transplantation: Review of Pathological findings and diagnostic methods. Hum Pathol 2005; 36 : 1245-1255.
9. Petrogiannis-Haliotis T, Sakoulas G, Kirby J, et al. BK-related polyomavirus vasculopathy in a renal-transplant recipient. N Engl J Med 2001; 345 : 1250-1255.
Labels
Anatomical pathology Forensic medical examiner ToxicologyArticle was published in
Czecho-Slovak Pathology

2015 Issue 3
-
All articles in this issue
- Tubulointerstitial rejection of renal allografts
- Antibody-mediated rejection of renal allograft and the update Banff classification 2013
- Infections after kidney transplantation
- Neuroendocrine tumor of the breast - metastasis or primary breast carcinoma? Case report
- Melanocytic matricoma - a case report
- WHAT IS YOUR DIAGNOSIS? Answer
- What si your diagnosis?
- Shadow cell differentiation in endometrioid carcinomas of the uterus. Its frequent occurrence and beta-catenin expression
- Pyloric gland adenoma: a histologic, immunohistochemical and molecular genetic study of 23 cases
- Czecho-Slovak Pathology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Pyloric gland adenoma: a histologic, immunohistochemical and molecular genetic study of 23 cases
- Infections after kidney transplantation
- Neuroendocrine tumor of the breast - metastasis or primary breast carcinoma? Case report
- Antibody-mediated rejection of renal allograft and the update Banff classification 2013
