Chirurgické techniky orgánových transplantací
Surgical techniques of organ transplants
The list of surgical procedures of solid organ transplantations appears very interesting and colorful, even with overlap among techniques. Liver transplantation is a life-saving procedure in a majority of cases, the liver can be transplanted as a full or partial graft. The liver graft can be split for two recipients; it can also be reduced for a small recipient if splitting is not indicated. Kidney transplantation is the most common solid organ transplant procedure, the majority of kidney grafts come from brain-dead donors whereas the number of live donor transplants is increasing, also thanks to paired donation and blood group incompatible transplantation methods. The small bowel and multivisceral transplantation are rare procedures; they serve selected patients with short bowel syndrome, some patients with retroperitoneal tumors or with extensive visceral thrombosis. Solid organ transplants are well established treatment methods with good and proven outcomes. A majority of patients can return to a normal life after their transplants.
Keywords:
liver transplantation – kidney transplantation – surgery
:
Jiří Froněk
:
Klinika transplantační chirurgie, Transplantcentrum IKEM, Praha
:
Čes.-slov. Patol., 51, 2015, No. 4, p. 187-192
:
Reviews Article
Přehled chirurgických technik orgánových transplantací představuje velmi pestrý soubor chirurgických výkonů, které se navzájem mezi sebou mnohdy překrývají nebo na sebe navazují. Transplantace jater je ve většině případů život zachraňujícím výkonem, lze transplantovat celá játra nebo jejich část. Játra lze rozdělit na dvě části nebo jen zmenšit resekcí. Transplantace ledviny je nejčastější transplantací, většina ledvin je od dárců se smrtí mozku, stoupá počet transplantací ledvin od žijících dárců včetně párových výměn a transplantací přes inkompatibilitu v krevní skupině. Transplantace střeva a multiviscerální transplantace patří mezi raritní výkony, jsou léčebnou metodou pro nemocné se syndromem krátkého střeva, případně jiné diagnózy včetně některých nádorů retroperitonea a mnohočetné viscerální trombózy. Orgánové transplantace jsou dnes samozřejmou součástí klinické praxe, jejich úspěšnost je vysoká. Většina nemocných se po transplantaci vrací zpět do normálního života.
Klíčová slova:
transplantace jater – transplantace ledviny – chirurgie
TRANSPLANTACE JATER
Transplantace jater patří mezi takzvané ortotopické transplantace. To znamená, že játra jsou transplantována do své obvyklé anatomické lokalizace. Transplantujeme buď celá játra nebo jejich část. Příjemcem může být chronicky čekající nemocný z čekací listiny nebo pacient s akutním jaterním selháním, dospělý nebo dítě. Většina dospělých je transplantována celými játry, naopak většina dětí je transplantována částí jater - tzv. parciálním štěpem.
Transplantace začíná odběrem jater. Jen správně provedený odběr jater je zárukou úspěšné transplantace. Druhou fází transplantace je úprava odebraných jater nebo jejich části mimo tělo dárce - tzv. „bench surgery“ nebo také „back table“. Třetí fáze transplantace spočívá v odstranění nemocných jater nebo jejich části u příjemce, této fázi se také říká explantace. Až poslední čtvrtá fáze je vlastní transplantace (implantace).
1. Odběr jater
Při odběru jater je třeba brát v úvahu, aby štěp jater velikostí odpovídal původním játrům příjemce a aby všechny jejich struktury měly správnou délku a kvalitu (viz článek „Morfologie chirurgických komplikací“ v tomto čísle časopisu). Posouzení makroskopického vzhledu a klinická vyšetření jater při odběru jsou zásadní pro finální rozhodnutí o tom, zda játra odebrat k transplantaci a kterému příjemci z čekací listiny je transplantovat. Odběr jater provádí zkušený transplantační chirurg. Celá játra odebírá ve většině případů odběrový tým transplantcentra, který jede na odběr kamkoliv v rámci ČR. V případě odběru parciálního štěpu je naopak zemřelý dárce transportován do transplantačního centra. Je tomu tak proto, že resekce jater ve smyslu redukce nebo rozdělení (splitu) je prováděna v těle dárce - in vivo. Rozdělení nebo redukci lze provést i ex vivo, ale takové výkony mají významně vyšší výskyt komplikací.
Transplantace jater od žijícího dárce je ve srovnání například s transplantací ledviny od žijícího dárce výkon raritní. V minulosti byly v ČR provedeny dvě transplantace jater od žijícího dárce, mezi lety 2004 a 2012 nebyl proveden žádný výkon. Od roku 2012 jsme provedli další dva úspěšné výkony tohoto typu. Ve všech čtyřech případech bylo příjemcem malé dítě, ve všech případech byl odebrán a transplantován levý laterální segment jater (segment II + III). Od roku 2012 nabízíme všem dětským příjemcům respektive jejich příbuzným tuto variantu transplantace. Transplantace jater od žijícího dárce u dospělého příjemce je výkon enormně složitý, dosud jsme takový neprovedli, ve většině případů je transplantován pravý lalok, výjimečně levý.
V České republice je většina odběrů respektive transplantací jater prováděna od zemřelého dárce. Po stanovení smrti mozku dle platných zákonných norem je dárce indikován k multiorgánovému odběru. Až na jedinou výjimku (dárce se smrtí oběhu) byly všechny odběry jater v ČR provedeny od dárce se smrtí mozku.
Odběr celých jater. Chirurgická technika odběru jater spočívá v následujících krocích: Po otevření dutiny břišní je laparotomie doplněna o sternotomii. Následuje vyšetření všech orgánů dutiny břišní tak, abychom například nepřehlédli případnou malignitu nebo jinou patologii, která by mohla negativně ovlivnit osud příjemců orgánů. Následuje preparace jater. Játra je nutné uvolnit ze závěsů, vyšetřit oba laloky, makroskopicky zhodnotit kvalitu parenchymu, míru případné steatózy (viz článek Role patologa v programu transplantace jater). V hilu jater následuje sub-serózní cholecystektomie, preparace jaterní tepny, společného žlučovodu a portální žíly. Po preparaci ostatních orgánů a kanylaci aorty a dolní duté žíly, následuje preparace hrudních orgánů hrudními týmy. Po dokončení preparace a po naložení svorek je spuštěna perfuze chladným konzervačním roztokem. Cílem perfuze je nahrazení veškeré krve v odebraných orgánech konzervačním roztokem. Po dokončení perfuze, jsou orgány včetně jater odebrány a jsou baleny, označeny a připravené k transportu, játra případně ihned přesunuta k transplantaci na vedlejším operačním sále.
Parciální štěpy jater. Transplantace části jater - tzv. parciálním štěpem představuje možnost, jak zkrátit dobu čekání na transplantaci pro některé příjemce. V některých případech je takový výkon život zachraňující, zejména u dětí, dospělých malého vzrůstu a především v případech fulminantního jaterního selhání. Jako parciální štěp lze použít k transplantaci levý laterální segment, levý lalok nebo pravý lalok. Parciální štěp lze získat redukcí nebo rozdělením jater (split).
Redukce jater znamená jejich zmenšení chirurgickou technikou tak, abychom mohli transplantovat příjemce, pro kterého by celá játra byla příliš velká. Redukce jater má některé výhody, především lze ošetřit malého příjemce, lze redukovat i játra „horší“ kvality a výkon nemá věkový limit. Současně existují i nevýhody vyplývající z redukce, kterými je to, že ošetřit lze jen jednoho příjemce a dále možný vyšší výskyt cévních a zejména biliárních komplikací, a to zejména u štěpů redukovaných „ex vivo“.
Redukce jater in vivo znamená v podstatě resekci jater zemřelého dárce. Provádí se resekce pravého laloku jater. Redukovat jinak než ve smyslu zachování levého laloku nedává smysl, jen levý lalok lze transplantovat příjemci, který má významně nižší váhu než dárce. Po ligaci pravostranné jaterní tepny, portální žíly a jaterní žíly (v případě anomálií jejich zohlednění a ošetření) je provedena s pomocí ultrazvukového drtiče tkání, klipů a opichů resekce pravého laloku jater. Poté je ponechán levý lalok in situ až do konce odběru. Levý lalok je pak transplantován ortotopicky příjemci. Redukovat lze játra bez přísných kritérií pro dárce, nejstarší redukovaný štěp byl od dárce starého 77 let.
Redukce jater ex vivo provádíme jen v případech, kdy nelze provést redukci technikou in vivo. Resekce ex vivo s sebou přináší větší riziko krvácení i biliárních komplikací. Takovou resekci provádíme v chladném konzervačním roztoku, pravostranné struktury proplachujeme methylenovou modří, resekci provádíme s užitím stejné techniky i přístrojů a nástrojů.
Split jater znamená rozdělení jater od zemřelého dárce na dvě části s plánem transplantace dvou příjemců. Existují dvě techniky split, první je tzv. klasický split, druhou split na levý a pravý lalok. Podobně jako předchozí technika i rozdělení jater pro dva příjemce s sebou přináší některé výhody (kterými je hlavně možnost ošetření dvou příjemců), ale má také některé nevýhody, mezi které patří to, že nelze splitovat játra horší kvality, nelze splitovat játra od dárce se smrtí oběhu, technika má rizika vyššího výskytu cévních a zejména biliárních komplikací (zejména u štěpů splitovaných „ex vivo“).
Rozdělit (splitovat) lze jen játra od dárce splňující následující kritéria: věk do 40 let, váha do 90 kg, jaterní testy zvýšené maximálně na 3-násobek normy, méně než 5 dnů umělé plicní ventilace a dárce se smrtí mozku.
Podobně jako u redukce jater i v případě rozdělení jater na dvě části technikou split se ve všech případech snažíme o rozdělení v těle dárce - in situ. Důvody jsou stejné jako u redukce, zejména pak riziko krvácení po reperfuzi a transplantaci a také vyšší výskyt biliárních komplikací.
Klasický split znamená rozdělení jater na levý laterální segment, tedy segment II a III, který transplantujeme dítěti. Zbylá část jater je pro dospělého příjemce. Po ozřejmění kvality jater a anatomických anomálií dělíme játra technikou resekce na dvě části, část levého laloku (SII+SIII) s ponecháním levé portální žíly a levé jaterní tepny, levé jaterní žíly, zbytek jater s ponecháním pravostranných struktur respektive střední jaterní žíly. Pokud je levý laterální segment transplantován velmi malému dítěti, lze jej ještě více dodatečně zmenšit resekcí části SII nebo SIII, případně obou.
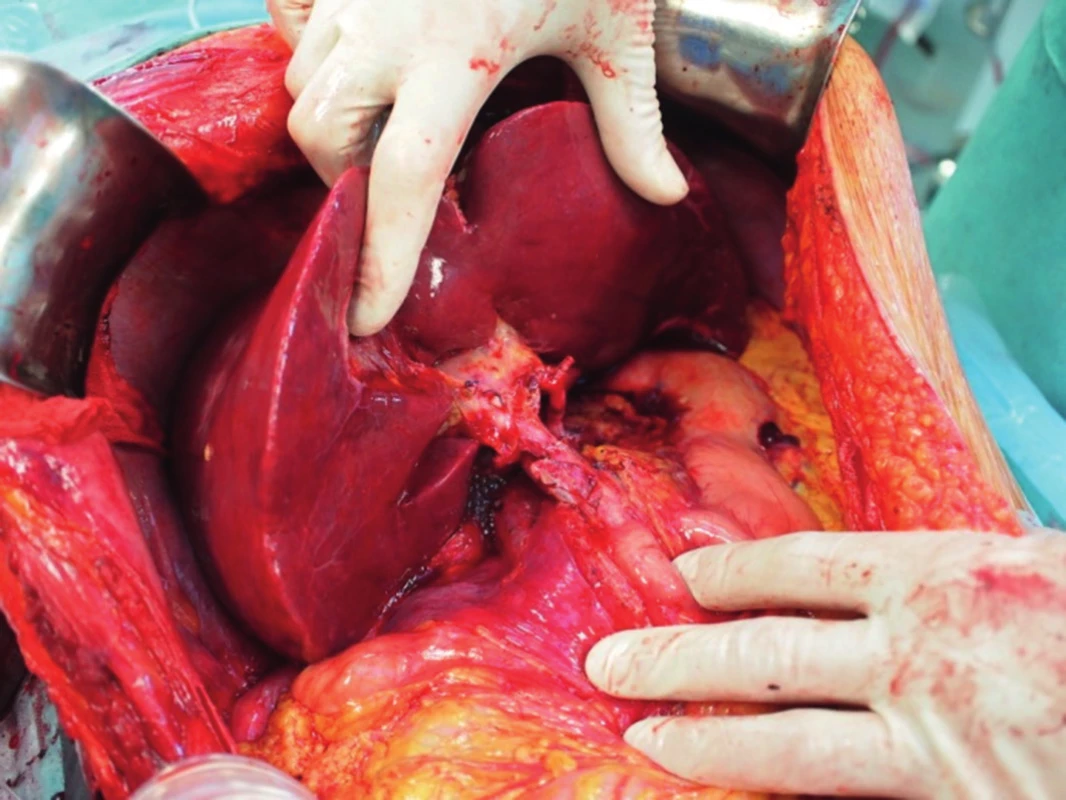
„Full left/full right“ split je rozdělení jater na levý a pravý lalok, což patří mezi technicky nejobtížnější operace v transplantační chirurgii (obr. 1, 2). Stejně jako u klasického splitu hodnotíme kvalitu jater a případné cévní anomálie, poté technikou resekce dělíme játra na pravý a levý lalok. Problémem je, kde ponechat střední jaterní žílu. Pokud ji ponecháme jako součást levého laloku, je nutné provést bypassy na žílu drénující segment V a VIII, jinak by tyto byly bez výtoku. Bypassy šijeme po vyjmutí jater ex vivo, bypass propojí žílu uvedených dvou segmentů a dolní dutou žílu. Střední jaterní žílu lze též ponechat vpravo, v takovém případě je nutné žilním bypassem drénovat segmenty IVa a IVb. Segment dolní duté žíly zůstává vždy s levým lalokem, pravý lalok je anastomozován na dolní dutou žílu pravou jaterní žilou nebo pravou a střední. Technikou „full left/full right“ split můžeme transplantovat dva dospělé, nebo větší dítě a dospělého. Je zejména vhodná pro dva dospělé menšího vzrůstu, kteří obvykle čekají na transplantaci déle. Touto technikou jsme také ošetřili dva nemocné s fulminantním jaterním selháním, kteří byli indikováni ve stejnou dobu (Jednalo se o manžele otrávené houbami).
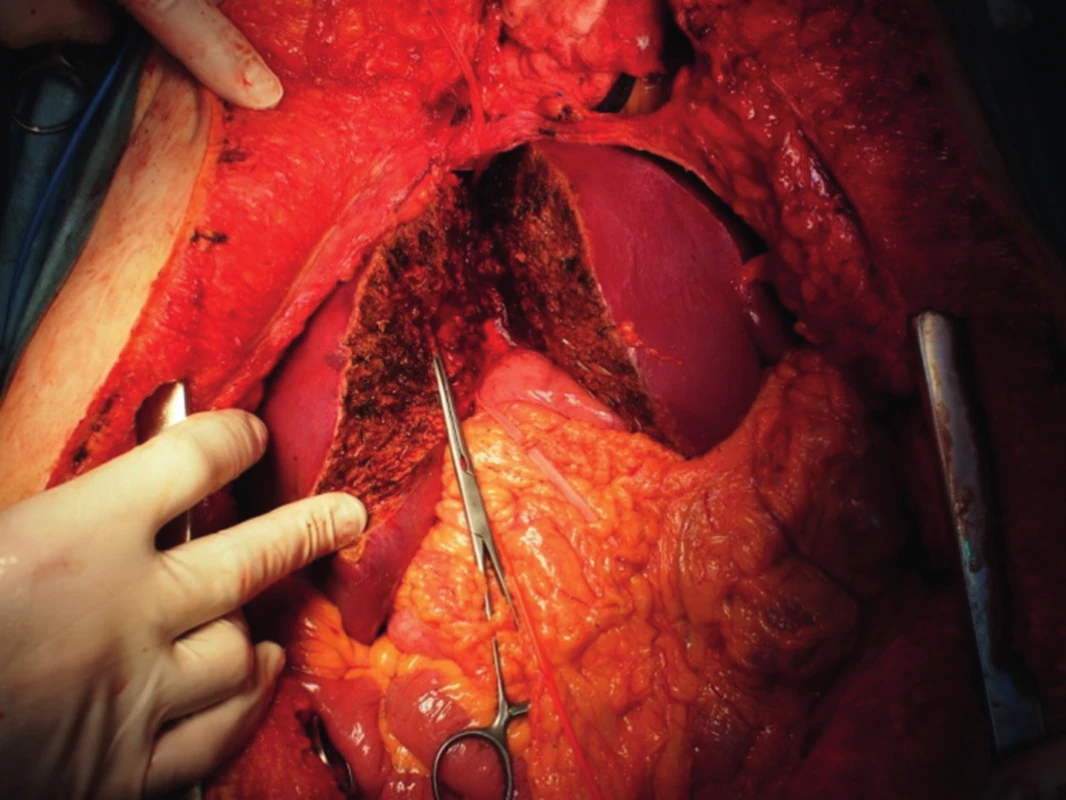
2. Úprava odebraných jater ex vivo
Odebraná játra nebo jejich část je třeba upravit tak, aby po vložení do dutiny břišní příjemce byla velikostí odpovídající, aby všechny jejich struktury měly správnou délku a kvalitu, v případě splitu nebo redukce tak, aby resekční plocha nekrvácela, případně nevytvářela žlučový leak. Po odběru jsou játra vložena do mísy s chladným konzervačním roztokem a ledovou tříští. Kontrolujeme všechny cévní struktury, žlučovod, případně resekční plochu. Všechny žilní a tepenné větve je třeba adekvátně ošetřit tak, aby po reperfuzi nekrvácely. Pokud je třeba, provádíme ještě cévní či biliární rekonstrukce. Dolní dutou žílu respektive její retrohepatický segment ve většině případů na obou koncích slepě uzavíráme, tu pak šijeme příjemci na jeho dutou žílu side-to-side. Jaterní tepnu ponecháváme s terčem aorty respektive odstupem truncus celiacus. Portální žílu ponecháváme co nejdelší, její distální část je však součástí štěpu slinivky břišní. U jater od žijícího dárce jsou všechny struktury „krátké“. Na to je třeba myslet při explantaci ve smyslu zachování co nejdelších struktur příjemce.
3. Explantace jater příjemce
Explantace nemocných jater příjemce je mnohdy nejtěžší částí operace. Většina nemocných je indikovaná pro chronické jaterní selhání s portální hypertenzí případně s trombózou porty, s množstvím kolaterál, často mohutným ascitem a navíc s významnou poruchou koagulace. Obtížná bývá i explantace obrovských polycystických jater, zejména pro omezenou manévrovací schopnost v operačním poli. Explantaci je třeba provést co nejrychleji, s co nejmenší krevní ztrátou a se zachováním všech struktur nutných k následné transplantaci. Po skončení explantace jater je dutina břišní připravena k vložení transplantátu. Operační pole představuje „prázdnou“ dutinu po explantovaných játrech se stěnou dolní duté žíly, aorty, pahýly porty a hepatické arterie, přešitými pahýly jaterních žil.
4. Transplantace jater
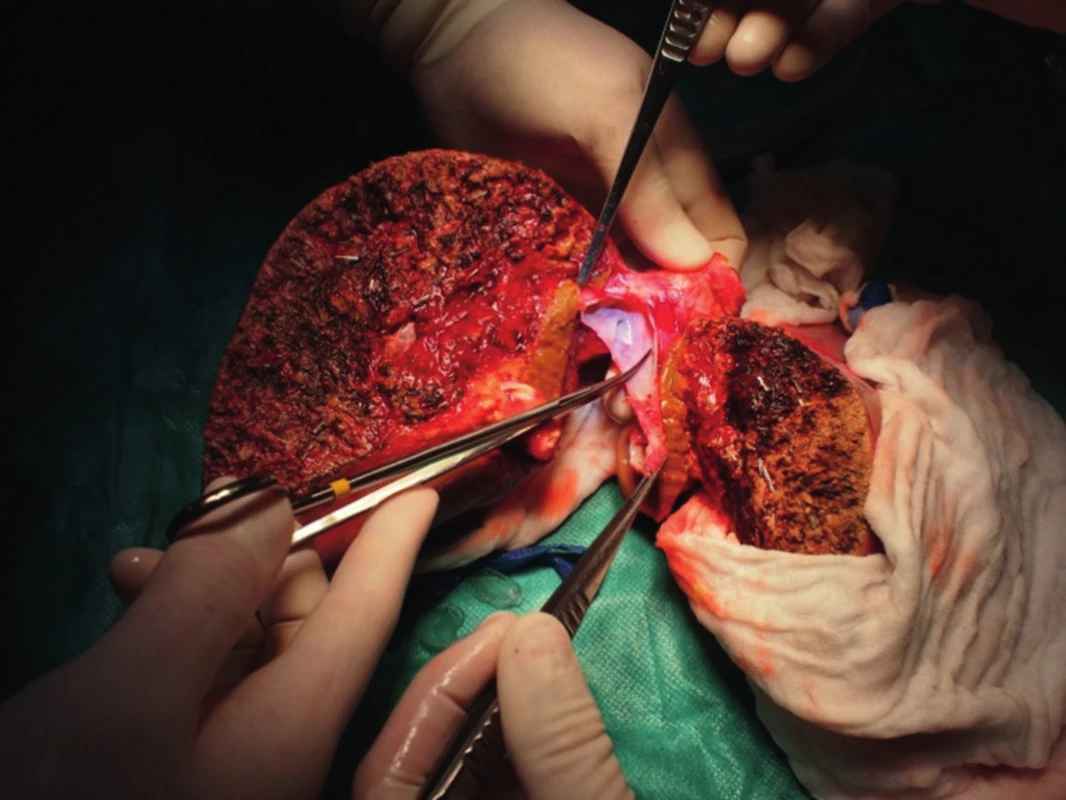
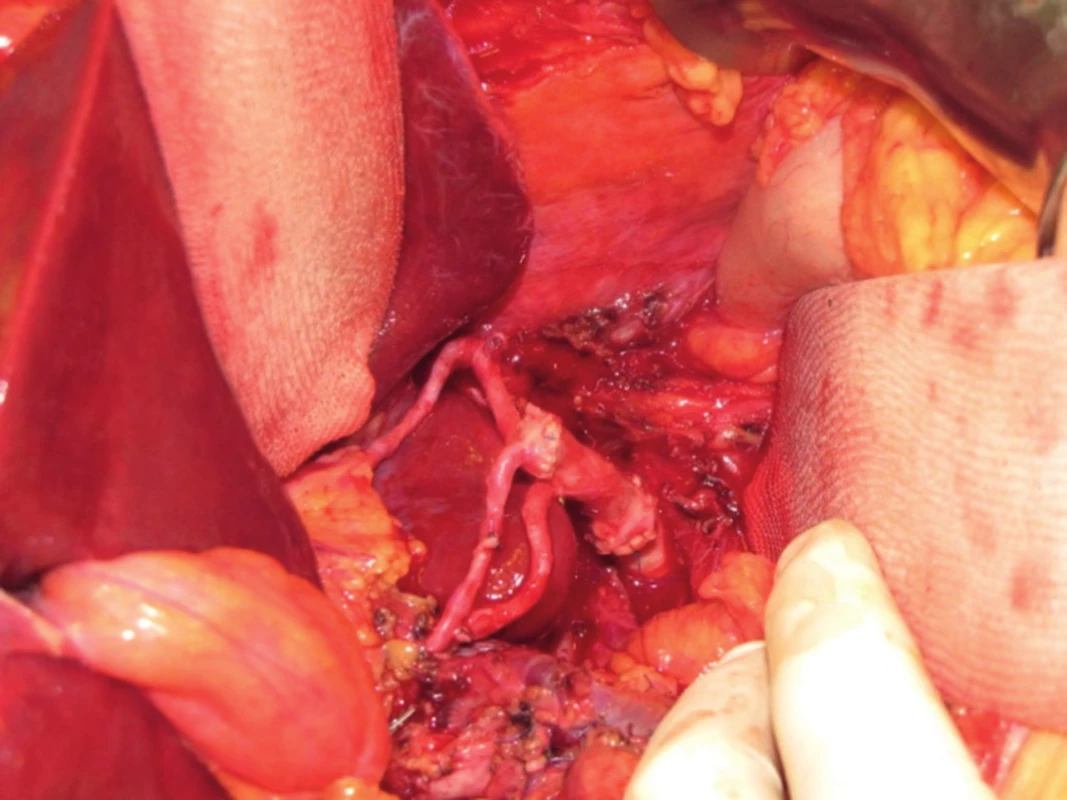
Po vložení jater do dutiny břišní nejprve anastomozujeme dolní dutou žílu, obvykle stranou ke straně na dolní dutou žílu příjemce (obr. 3). V případě pravého laloku jater po splitu pro dva dospělé příjemce nebo transplantaci pravého laloku jater od žijícího dárce anastomozujeme pravou jaterní žílu štěpu na dolní dutou žílu příjemce. V případě levého laterálního segmentu po redukci splitu nebo do žijícího dárce našíváme levou jaterní žílu do širokého ústí, které vzniká po protětí ústí levé a střední jaterní žíly příjemce. Druhým krokem je anastomoza portální žíly. Tu šijeme vždy koncem ke konci, v případě celých jater kmen na kmen, v případě parciálních štěpů kmen nebo konce unilaterální porty na kmen u příjemce (obr. 4). Po puštění svorek následuje tzv. reperfuze. Toto je proces, kdy veškerý konzervační roztok v játrech je nahrazen krví příjemce, játra opět zrůžoví. Po hemodynamické stabilizaci příjemce kontrolujeme průchodnost cévních spojení, případně krvácení z resekční plochy jater. Následuje tepenná anastomóza, včetně případných rekonstrukcí větví tepenných anomálií (obr. 5). Jaterní tepna nesmí být ani příliš dlouhá, jinak hrozí zalomení a případná trombóza, ani příliš krátká. Spojku šijeme buď ve větvení, nebo šijeme dvě šikmo nastřižené tepny k sobě koncem ke konci. Poslední anastomózou je žlučovod. Ten šijeme buď koncem ke konci na vlastní žlučovod příjemce, někdy se zajištěním letmým stentem. V některých případech je třeba konstruovat hepatikojejunoanastomozu na exkludovanou kličku jejuna.
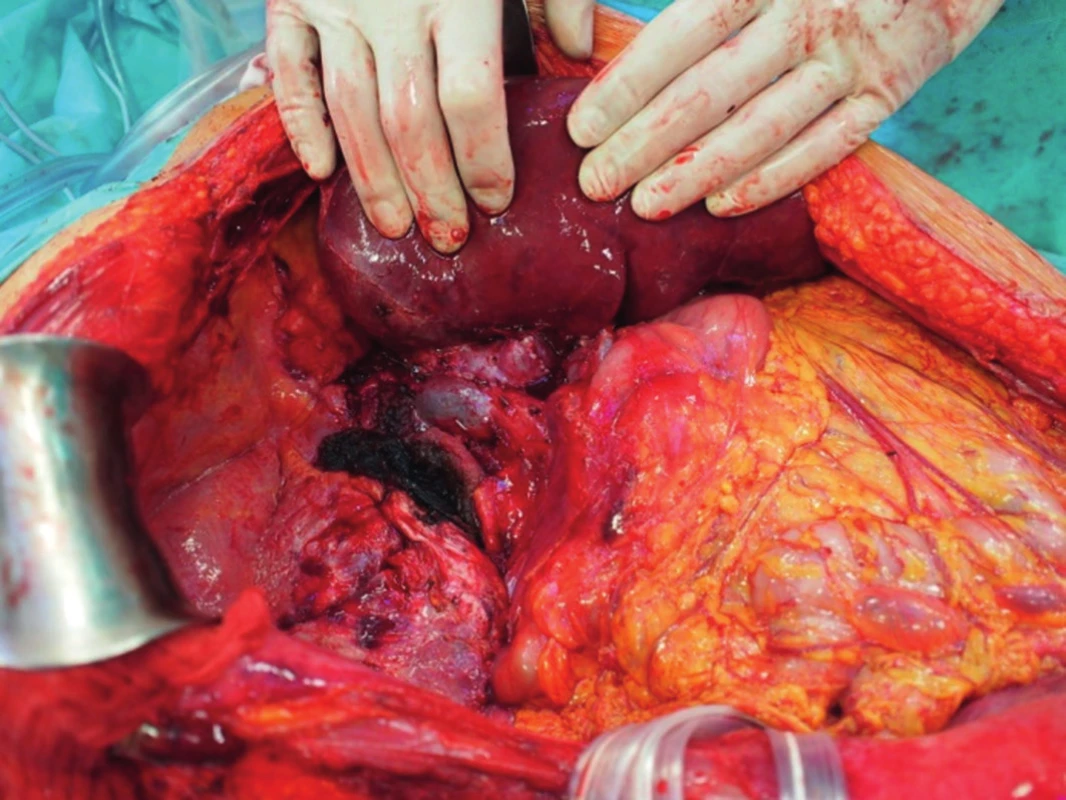
Po kontrole hemostázy a biliární sekrece vkládáme do okolí jater 3 kapilární drény, provádíme tzv. postreperfuzní jehlovou biopsii štěpu a poté uzavíráme dutinu břišní po anatomických vrstvách (obr. 6). Máme-li pochybnosti o vitalitě jater nebo se nám nedaří dostatečně kontrolovat krvácení, obkládáme transplantovaná játra rouškami a dutinu břišní uzavíráme provizorně. Definitivní uzávěr následuje za 24 - 48 hodin po transplantaci (1-3).
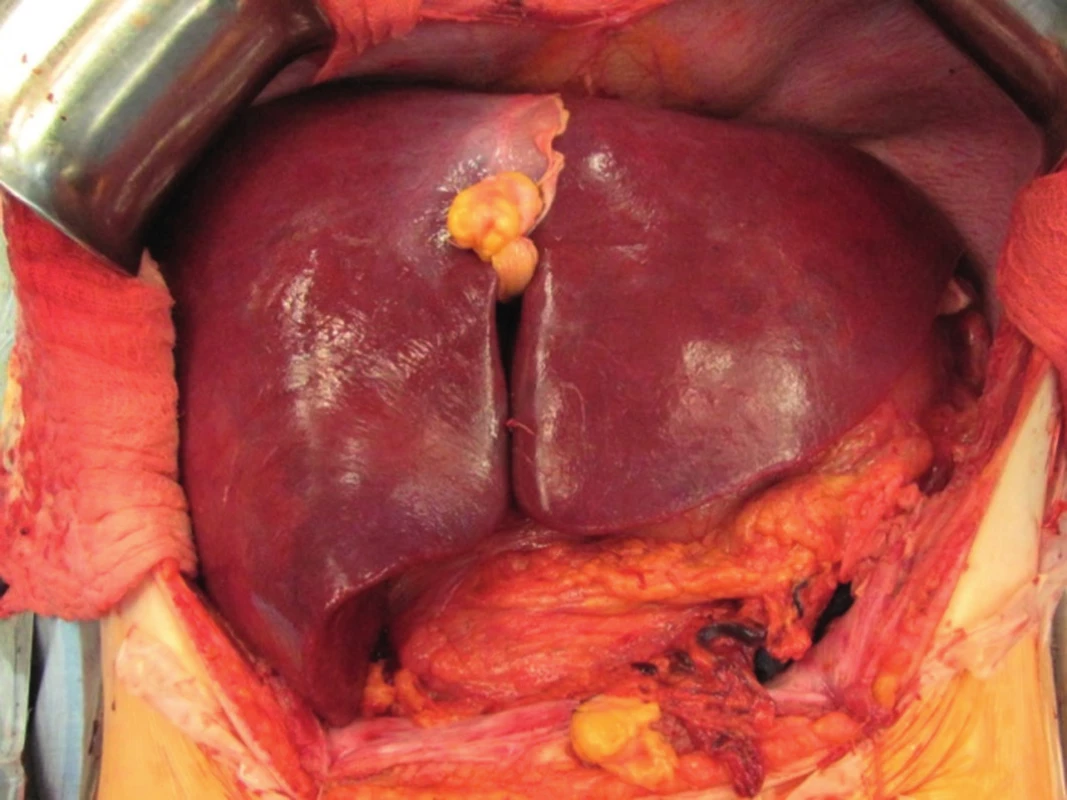
TRANSPLANTACE LEDVINY
Transplantace ledviny přináší příjemci ve většině případů lepší kvalitu života a dvakrát delší přežití ve srovnání s dialýzou. Za život zachraňující výkon lze transplantaci ledviny považovat jen v případě, kdy jsou zcela vyčerpány cévní přístupy k dialýze. Transplantace ledviny je obvykle považována za „standardní“ výkon. Dalo by se tedy předpokládat, že jsou si jednotlivé výkony navzájem významně podobné, bez ohledu na to, který chirurg je provádí, respektive na kterém pracovišti je nemocný transplantován. Ale i zde, stejně jako jinde v medicíně platí, že dělají-li dva totéž, není to vždy totéž. I u takto „standardních“ výkonů existují různé techniky jednotlivých postupů a také zde hraje nemalou roli zkušenost týmu. Odběr ledvin k transplantaci je prvním krokem k úspěšné transplantaci. Samotná transplantace může být doplněna i jinými souvisejícími výkony, pokud je to v konkrétním případě nutné.
1. Odběr ledviny
Odběr ledviny k transplantaci lze provést od zemřelého dárce, se smrtí mozku nebo oběhu, nebo od dárce žijícího. K provedení odběru vyjíždí odběrový tým do referující nemocnice nebo je dárce transportován do transplantačního centra k provedení odběru.
Odběr ledviny od zemřelého dárce. Po provedení zákonem daných vyšetření ke stanovení smrti mozku je dárce transportován na operační sál. Ledviny k transplantacím lze odebrat buď jako izolovaný odběr ledvin nebo jako součást odběru více orgánů. Odběr ledviny od zemřelého dárce je v dnešní době ve většině případů součástí multiorgánového odběru. Většina multiorgánových odběrů včetně odběrů ledvin v ČR je realizována od dárců se smrtí mozku. Odběr ledviny od zemřelého dárce se smrtí mozku je komplexní chirurgický výkon, který smí provádět jen plně erudovaný transplantační chirurg. Chirurgickým přístupem je řez od jugula k symfýze spolu se sternotomií, abdominální tým preparuje orgány pod bránicí, týmy hrudní preparují srdce a plíce. Po preparaci pánevních cév a aorty s dolní dutou žilou nad bifurkací kanylujeme tepenné řečiště k provedení perfuze, do dolní duté žíly naopak zavádíme kanylu k odvádění krve, která je během perfuze nahrazena konzervačním roztokem. Následuje preparace jednotlivých orgánů od okolních struktur, verifikace případných cévních anomálií, preparace cévních struktur. Orgány, které nebudou odebrány a tedy ani perfundovány z vaskulárního řečiště exkludujeme - jejich cévy podvazujeme. Po zástavě srdeční spouštíme perfuzi chladným konzervačním roztokem, odebírané orgány včetně ledvin se postupně odbarvují, po skončení perfuze, která je dána objemem konzervačního roztoku, následuje ektomie všech orgánů včetně ledvin. Ledviny odebíráme z retroperitonea postupně tak, abychom zachovali jejich vaskulární stopku i ureter v dostatečné délce a kvalitě. Po vynětí ledvin z těla dárce tyto, až na malý ostrůvek v oblasti pánvičky, zcela zbavíme tuku. Ledvina je tak menší, také můžeme najít případné ložiskové léze včetně suspektních malignit. Pokud takovou lézi najdeme, je odeslána k peroperačnímu bioptickému vyšetření. Po uvedených úpravách jsou ledviny dle daných pravidel zabaleny a vloženy do boxu s ledovou tříští, kde „čekají“ až do transplantace.
Odběr ledviny od zemřelého dárce se smrtí oběhu je v ČR výkonem raritním. Dosud jsme v IKEM takových odběrů provedli 6 a následně pak 12 transplantací. Odběr se liší především v rychlosti provedení. Kanylace je do minuty, následuje perfuze s větším objemem roztoku, po vyjmutí ledvin ještě případně následuje další perfuze ex vivo (4).
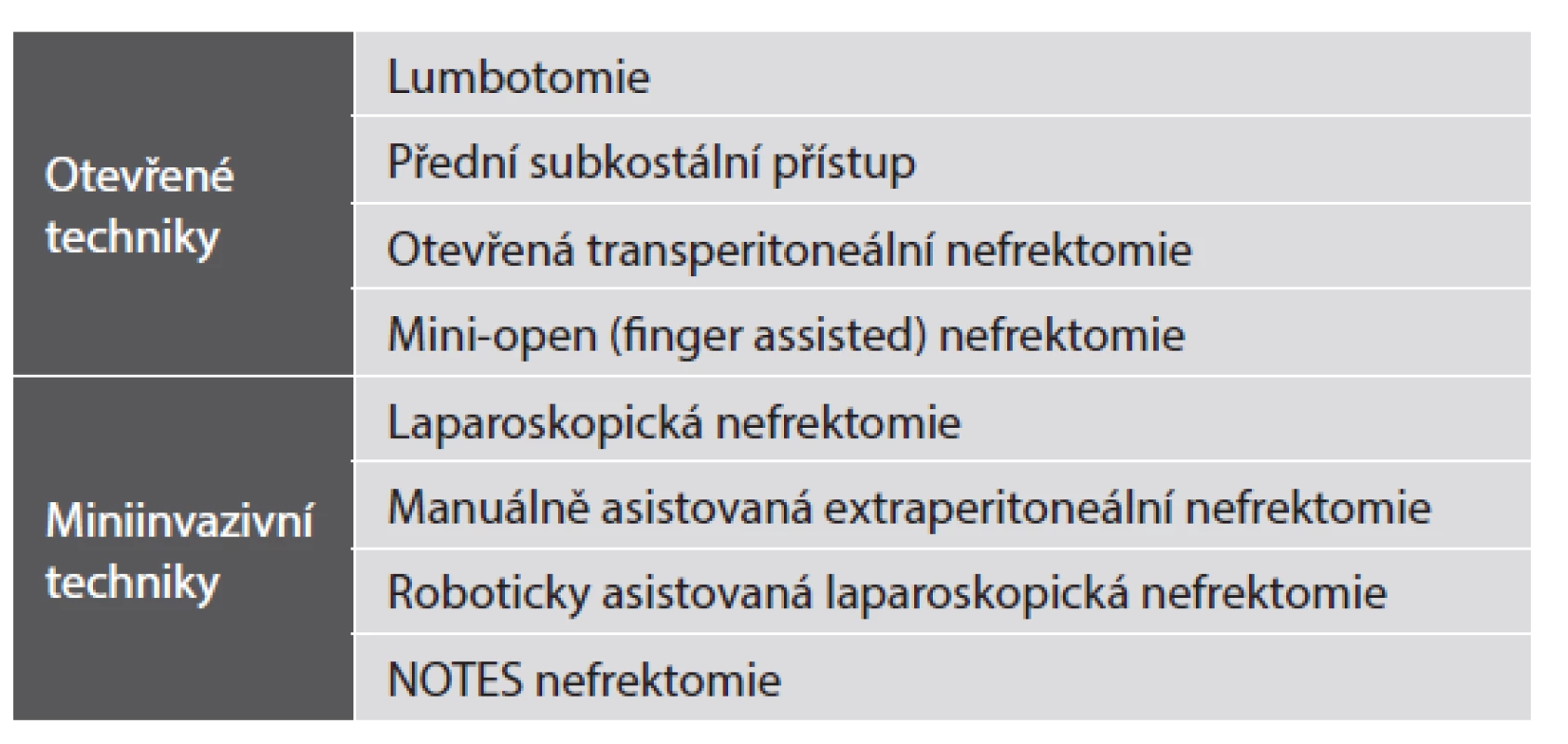
Odběr ledviny od žijícího dárce je neobvyklý chirurgický výkon. Operujeme zdravého člověka, který z medicínského pohledu žádnou operaci nepotřebuje. Tento fakt s sebou nese některé další neobvyklé situace. Nefrektomie se počítá mezi velké operační zákroky a většina velkých operačních výkonů je zatížena rizikem komplikací. Tato rizika jsou vyvážena přínosem, např. odstranění maligního nádoru ledviny. Rizika u dárcovské nefrektomie nelze ničím vyvážit. U nefrektomie každý dárce automaticky a současně logicky předpokládá, že bude do dvou dnů doma z nemocnice, záhy zpět v práci a v normálním životě. Tlak na chirurga je tak obrovský. Jakákoliv byť sebemenší komplikace je brána jako „ohromný“ neúspěch. V případě úspěchu je „tým, který vše provedl“ překvapivě veliký. V případě neúspěchu je chirurg zcela osamocený. Právě z těchto důvodů řada chirurgů u nás, ale zejména v zahraničí odmítá operovat žijící dárce. Při úspěšném výkonu jsou chirurgická rizika pro dárce krátkodobá a závisí na zkušenosti chirurga a zvolené technice nefrektomie. Dlouhodobá rizika závisí na zkušenosti týmu a užitém protokolu vyšetření před případnou kontra/indikací. Dárcovskou nefrektomii lze provést celou řadou technik, které jsou uvedeny v tabulce č. 1.
Anatomické variety vaskulární i močové nejsou a nesmějí být kontraindikací. S nadsázkou lze říci, že lze odebrat jakoukoliv ledvinu a tu pak úspěšně transplantovat. Případná kontraindikace na základě anatomie ledviny je tak obvykle projevem nechuti operovat žijícího dárce nebo nezkušenosti chirurga. Výsledky transplantací ledvin s jednoduchou a komplexní anatomií jsou stejné. Je třeba zdůraznit, že nefrektomie musí být v první řadě bezpečná pro dárce, dále šetrná k ledvině a úspěšně a bezpečně proveditelná při všech možných anatomických varietách. Autor sdělení považuje za metodu volby manuálně asistovanou retroperitoneoskopii. Tato metoda zahrnuje všechna pozitiva, která jsou prospěšná pro žijícího dárce a současně i pro ledvinu určenou k transplantaci. Technika byla poprvé popsána Wadströmem v roce 2002 (5). Autor textu provedl těchto výkonů více než 500, historicky první nefrektomii touto technikou v České Republice v lednu 2003, dále pak v UK v lednu 2005 a v několika dalších zemích světa v letech následujících. Uvedená technika je z řady důvodů nejbezpečnější ze všech technik uvedených v tab. 1 a to jak pro dárce, tak pro ledvinu. Manuální retroperitoneoskopie kombinuje výhody miniinvazivní chirurgie, které jsou klíčem k rychle rekonvalescenci, dále pak je manuální asistence zárukou bezpečnosti pro dárce a ledvinu (s krátkou teplou ischémií štěpu). K výše uvedenému tato technika navíc přidává extraperitoneální přístup, ten minimalizuje možnost poškození intraabdominálních orgánů a významně se tak podílí na bezpečnosti dárce. Současně je tento přístup zárukou dobré kvality odebrané ledviny (6-9). Dárce je přijat k hospitalizaci den před výkonem, výkon trvá obvykle 2 - 3 hodiny, krevní ztráta je ve většině případů minimální resp. nulová (laparoskopická odsávačka během výkonu není vůbec užita). Dárce je prakticky ve všech případech po tomto typu výkonu propuštěn do domácího ošetřování méně než 48 hodin po operaci.
2. Transplantace ledviny
Transplantaci ledviny lze z technického hlediska nazvat „standardním“ výkonem. Obecně toto platí, v praxi se však výkon liší v závislosti na centru i chirurgovi. Štěp ledviny je po odběru a perfuzi uložen v chladicím boxu v konzervačním roztoku, v případě transplantace ledviny od žijícího dárce je buď uložen stejně (pokud je transplantace až po operaci dárce) nebo je ledvina uložena v emitní misce a transportována na sousední operační sál.
První část operace příjemce spočívá v definitivní úpravě štěpu ledviny k transplantaci. Ledvinu je třeba zbavit veškerého tuku na povrchu, s ponecháním jen malého množství v okolí pánvičky a hilu. Dále je pak nutná kontrola všech vaskulárních struktur a případně jejich rekonstrukce.
Druhá část operace sestává z vyjmutí ledviny z chladného konzervačního roztoku a jejího vložení do operačního pole, kterým je kyčelní jáma, v našem centru při první transplantaci na pravé straně. Lokalitu ovlivňuje stav pánevního cévního řečiště, dále např. přítomnost polycystických ledvin, předchozí transplantace atd. Následuje anastomóza renální žíly a poté tepny, ve většině případů na zevní pánevní tepnu a žílu, můžeme však použít i vnitřní nebo společné pánevní cévy, nebo případně aortu a dolní dutou žílu. V případě mnohočetných cév tyto rekonstruujeme mezi sebou ex vivo nebo je našíváme izolovaně během transplantace. Obě metody jsou možné a ve smyslu výsledků není mezi nimi rozdíl. Pokud má ledvina více žil, je třeba zachovat jen hlavní žilní větev, menší žíly lze podvázat. V případě mnohočetných tepen je nutné až na drobné kapsulární větvičky vždy anastomozovat všechny tepny. Ledvina nemá kolaterály na úrovni arterií a arteriol, za každým uzávěrem by následoval infarkt. Žíly kolaterály vytvářejí; a proto lze některé větve podvázat.
Po provedení vaskulárních anastomóz kontrolujeme jejich průchodnost a průtok, stavíme krvácení z ledviny a operačního pole. Následuje ureterocystoanastomóza, tu provádíme „simple technikou“, s nebo bez zajištění JJ stentem. Technik napojení močovodu štěpu ledviny a močového traktu příjemce bylo historicky popsáno několik. Vyjma „simple techniky“ napojení močovodu štěpu na strop močového měchýře lze dnes ostatní techniky považovat za obsolentní, zejména z důvodů vyššího výskytu časných i pozdních močových komplikací. Výjimku tvoří situace, kdy příjemce má některé močové anomálie, potom lze močovod štěpu anastomozovat na ureter, do ileálního konduitu nebo přímo na kůži stěny břišní formou ureterostomie.
Po dokončení transplantace uzavíráme operační ránu po anatomických vrstvách. Drén vkládáme jen asi u poloviny případů, tento pak většinou extrahujeme dva dny po operaci.
TRANSPLANTACE TENKÉHO STŘEVA A MULTIVISCERÁLNÍ TRANSPLANTACE
Transplantace tenkého střeva je výkon ve většině případů život zachraňující. Většina nemocných je indikována na základě selhání funkce tenkého střeva, buď z důvodu jeho chybění například po resekci nebo z důvodu vrozené poruchy jeho funkce. Indikace mohou být i jiné, mezi takové patří například některé nádory retroperitonea (desmoid) nebo mnohočetné viscerální trombózy. Větší část pacientů s tzv. syndromem krátkého střeva má často dysfunkci jater s fibrózou nebo cirhózou. Po zařazení na čekací listinu nemocný čeká na vhodného zemřelého dárce. Transplantaci lze provést v několika modifikacích, buď jako izolovanou transplantaci tenkého střeva nebo kombinaci tenké střevo + játra nebo tzv. multiviscerální transplantaci.
1. Odběr tenkého střeva a multiviscerální odběr
Preparujeme všechny orgány dutiny břišní a hodnotíme jejich kvalitu. Perfuzní kanylu zavádíme do aorty nad bifurkací nebo unilaterálně do pánevní tepny, odvodnou žilní kanylu obdobně do dolní duté žíly nebo unilaterální pánevní žíly. Perfuzi provádíme in situ objemem 10 litrů konzervačního roztoku. Poté vyjímáme všechny orgány en-bloc a umístíme je do „vaničky“.
2. Úprava odebraných orgánů ex vivo
Orgány uložené ve vaničce v chladném konzervačním roztoku je třeba makroskopicky vyšetřit. Nyní je zásadní rozhodnutí o rozsahu výkonu respektive počtu orgánů k transplantaci. Orgány, které nebudou součástí štěpu, je v této části výkonu vhodné oddělit a připravit ex vivo k dalším transplantacím pro jiné příjemce. Pokud bude například transplantováno tenké střevo izolovaně, oddělíme játra a slinivku, které budou transplantovány jiným příjemcům. U všech orgánů je třeba revidovat jejich kvalitu, cévní stopku a všechny větve cévní stopky ošetřit tak, aby po reperfuzi v těle příjemce nekrvácely.
3. Explantace orgánů z dutiny břišní příjemce
Po výše uvedeném odběru a úpravě následuje operace příjemce. Přístupem je laparotomie od mečíku k symfýze. Její první částí je odstranění jeho vlastních orgánů z dutiny břišní. V některých případech, například po předchozích resekcích, není nutné odstraňovat tenké střevo. V takových případech může být obtížné vytvořit dostatek prostoru pro transplantáty v dutině břišní příjemce. V ojedinělých případech je tak nutné transplantovat i stěnu břišní od zemřelého dárce. V některých případech, zejména pak u mnohočetné viscerální trombózy, může být obtížná explantace dána mohutnou portální hypertenzí s množstvím žilních kolaterál.
4. Transplantace tenkého střeva a transplantace multiviscerální
Vaskulární část transplantace tenkého střeva respektive její modifikace představují ve valné většině případů anastomózu pahýlu dárcovské aorty, která byla odebrána spolu se štěpem/štepy od zemřelého dárce, na aortu příjemce. Na straně žilní pak obdobně anastomozujeme dolní dutou žílu štěpu na příjemcovu. Ve všech případech pak ještě konstruujeme ileostomii k provádění biopsií, také výživnou punkční jejunostomii (10-12).
Transplantace tenkého střeva je komplikovaný a náročný výkon i z pohledu dlouhodobé péče o příjemce, která začíná již před transplantací adekvátní výživou a zajištěním cévních přístupů a pokračuje v potransplantačním období, kdy se z imunologických důvodů provádějí četné, opakované biopsie a současně sledování příjemce vyžaduje spolupráci mnoha specialistů transplantačního centra.
ZÁVĚR
Orgánové transplantace jsou dnes samozřejmou součástí klinické praxe s vysokou úspěšností a s návratem velké většiny příjemců do prakticky normálního života. Přehled chirurgických technik orgánových transplantací představuje velmi pestrý soubor chirurgických výkonů, které se mnohdy navzájem mezi sebou překrývají nebo na sebe navazují. Může jít o výkony život zachraňující jako v případě transplantací jater a tenkého střeva nebo o výkony, které život prodlužují a zlepšují jeho kvalitu jako např. v případě transplantací ledvin. Chirurgický tým je součástí multidisciplinárního transplantačního týmu a podílí se nejen na počátečním výkonu vlastních transplantací, ale i v pozdějším období při řešení různých stavů vyžadujících chirurgickou intervenci.
PROHLÁŠENÍ
Autor práce prohlašuje, že v souvislosti s tématem, vznikem a publikací tohoto článku není ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou. Toto prohlášení se týká i všech spoluautorů.
Adresa pro korespondenci:
Doc. MUDr. Jiří Froněk, Ph.D., FRCS
Klinika transplantační chirurgie
Transplantcentrum IKEM
Vídeňská 1958/9, 140 21 Praha 4
e-mail: jiri.fronek@ikem.cz
Sources
1. Molmenti EP, Klintmalm GB. Atlas of Liver Transplantation. Saunders, An imprint of Elsevier Science, USA; 2002.
2. Fan ST, Wei WI, Young BH et al. Living Donor Liver Transplantation. World Scientfic Publishing, Singapore; 2011.
3. Mazziotti A, Cavallari A. Techniques in Liver Surgery. Greenwich Medical Media, London, UK; 1997.
4. Kootstra G, van Heurn E. Non-heart beating donation of kidneys for transplantation. Nat Clin Pract Nephrol 2007; 3 : 154-163.
5. Wadström J, Lindström P. Hand-assisted retroperitoneoscopic living-donor nephrectomy: initial 10 cases. Transplantation 2002; 73 : 1839-1841.
6. Chandak P, Kessaris N, Challacombe B, et al. How safe is hand-assisted laparoscopic donor nephrectomy? Results of 200 live donor nephrectomies by two different techniques. Nephrol Dial Transplant 2009; 24 : 293–297.
7. Dols LF, Kok NF, Terkivatan T, et al. Optimizing left-sided live kidney donation: hand-assisted retroperitoneoscopic as alternative to standard laparoscopic donor nephrectomy. Transpl Int 2010; 23 : 358-363.
8. Dosani T, Olsburgh J, Mustafa N. et al. Keyhole Mini-Open Donor Nephrectomy A Single Institution Experience. American Journal of Transplantation 2007; 7 : 489.
9. Wadstrom J, Biglarnia A, Gjertsen H, et al. Introducing Hand-Assisted Retroperitoneoscopic live donor nephrectomy. Learning curves and development based on 413 consecutive cases in four centres. Transplantation 2011; 91 : 462-469.
10. Margreiter R, Königsrainer A, Schmid T, et al. Multiple organ procurement--a simple and safe procedure. Transplant Proc 1991; 23 : 2307-2308.
11. Brockmann JG, Vaidya A, Reddy S, et al. Retrieval of abdominal organs for transplantation. Br J Surg 2006; 93 : 133-146.
12. Baranski A. Surgical technique of abdominal organ procurement. Step by step. Springer-Verlag, London; 2009.
Labels
Anatomical pathology Forensic medical examiner ToxicologyArticle was published in
Czecho-Slovak Pathology

2015 Issue 4
-
All articles in this issue
- The autopsy of the brain and spinal cord in the diagnosis of neurodegenerative diseases - a practical approach to optimize the examination
- Morphology of surgical complications in liver biopsies early after transplantation
- Diagnosis of rejection in a transplanted liver
- Recurrence of primary diseases after liver transplantation
- Transplantations of lungs in the Czech Republic – from the perspective of the pathologist
- Surgical techniques of organ transplants
- Periosteal osteosarcoma - personal experience with five cases
- Renal allograft biopsies: a guide of ins and outs for best results
- Czecho-Slovak Pathology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Periosteal osteosarcoma - personal experience with five cases
- Transplantations of lungs in the Czech Republic – from the perspective of the pathologist
- Diagnosis of rejection in a transplanted liver
- Surgical techniques of organ transplants