Kožná bunková reakcia po popálení medúzou
Skin cell response after jellyfish sting
Introduction.
Jellyfish burning is not commonly part of the professional finding in the central Europe health care laboratory. Holiday seaside tourism includes different and unusual presentations of diseases for our worklplaces. Sea water-sports and leisure is commonly connected with jellyfish burning and changes in the skin, that are not precisely described.
Aim.
Authors focused their research on detection of morphological and quantitative changes of some inflammatory cells in the skin biopsy of a 59-years-old woman ten days after a jellyfish stinging. Because of a comparison of findings the biopsy was performed in the skin with lesional and nonlesional skin.
Methods.
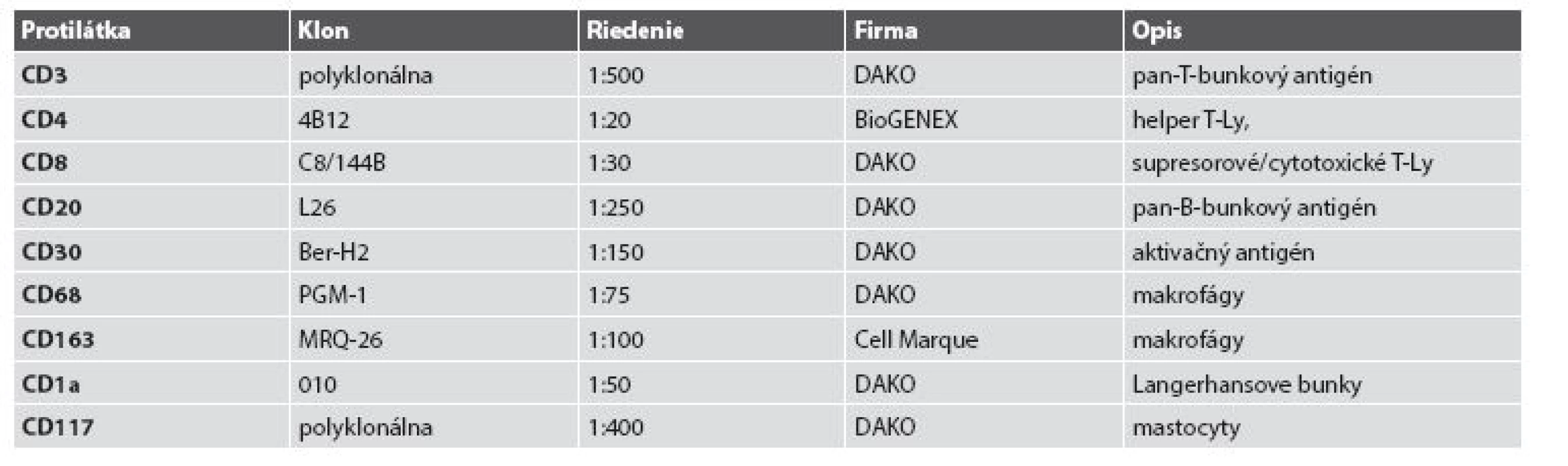
Both excisions of the skin were tested by imunohistochemical methods to detect CD68, CD163, CD30, CD4, CD3, CD8, CD20 a CD1a, to detect histiocytes, as well as several clones of lymphocytes and Langerhans cells (antigen presenting cells of skin), CD 117, toluidin blue and chloracetase esterase to detect mastocytes and neutrophils. Material was tested by immunofluorescent methods to detect IgA, IgM, IgG, C3, C4, albumin and fibrinogen. Representative view-fields were documented by microscope photocamera Leica DFC 420 C. Registered photos from both samples of the skin were processed by morphometrical analysis by the Vision Assistant software. A student t-test was used for statistical analysis of reached results.
Results.
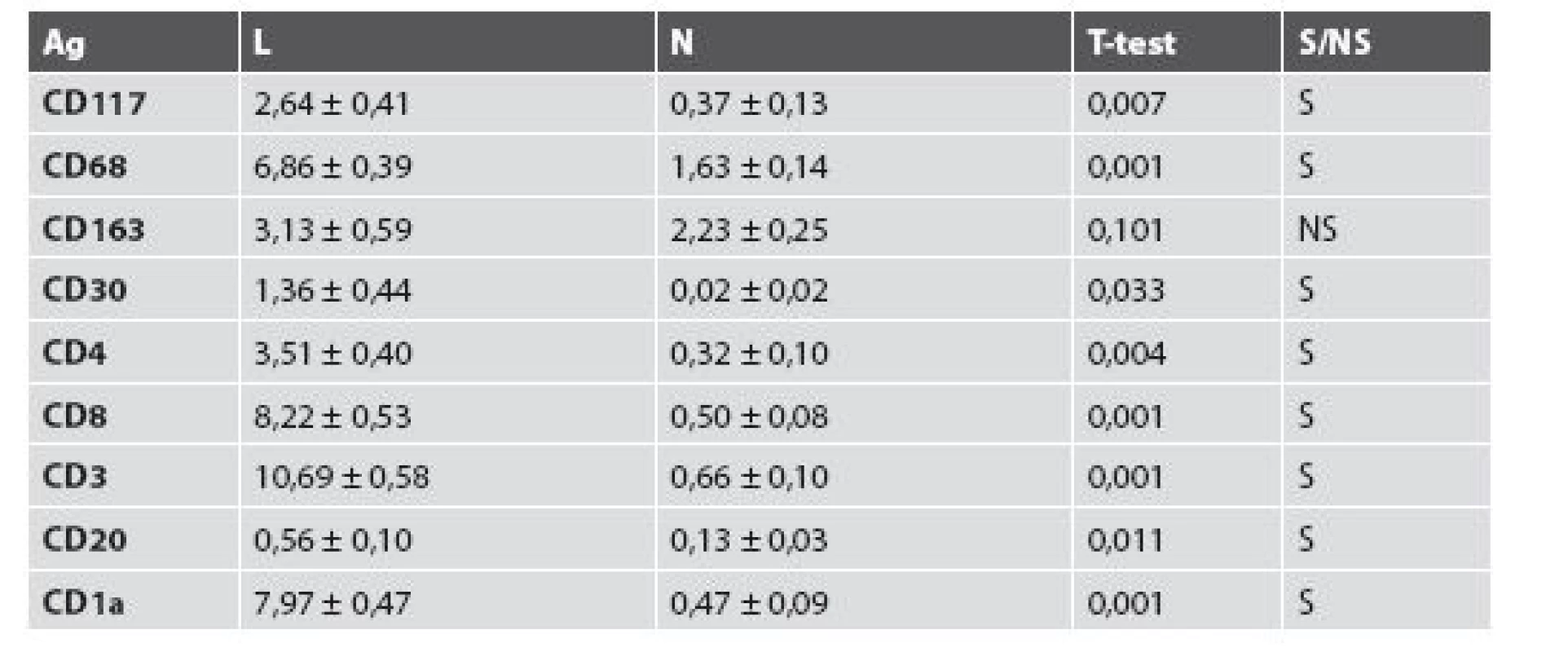
Mean values of individual found cells in the sample with lesion and without lesion were as follows: CD117 -2.64/0.37, CD68-6.86/1.63, CD163-3.13/2.23, CD30-1.36/0.02, CD4-3.51/0.32, CD8-8.22/0.50, CD3-10.69/0.66, CD20-0.56/0.66, CD1a-7.97/0.47 respectively. Generally mild elevation of eosinofils in lesional skin was detected. Increased values of tested cells seen in excision from lesional skin when compared with nonlesional ones were statistically significant in eight case at the level p = 0.033 to 0.001. A not statistically significant difference was found only in the group of CD163+ histiocytes.
Conclusion.
Authors detected numbers of inflammatory cells in lesional skin after the stinging by a jellyfish and compared them with the numbers of cells in the nonlesional skin of the same patient. Statistically significant differences were seen in the level of selected inflammation cells and numerically documented changes of cellularity in the inflammatory focus were caused by a hypersensitivity reaction after jellyfish injury in the period of 10 days after attack.
Keywords:
jellyfish burn – jellyfish sting – contact dermatitis – morphometry
Authors:
Katarína Adamicová 1; Desanka Výbohová 2; Želmíra Fetisovová 3; Elena Nováková 4; Yvetta Mellová 2
Authors‘ workplace:
Ústav patologickej anatómie Univerzita Komenského Bratislava Jesseniova lekárska fakulta Martin a Univerzitná nemocnica Martin
1; Ústav anatómie Univerzita Komenského Bratislava Jesseniova lekárska fakulta Martin
2; Dermatovenerologická klinika Univerzita Komenského Bratislava Jesseniova lekárska fakulta Martin a Univerzitná nemocnica Martin
3; Ústav mikrobiológie Univerzita Komenského Bratislava Jesseniova lekárska fakulta Martin
4
Published in:
Čes.-slov. Patol., 52, 2016, No. 1, p. 55-60
Category:
Original Article
Overview
Úvod.
Popálenie medúzou nie je v strednej Európe časté. Prázdninová prímorská turistika však prináša aj na naše zdravotnícke pracoviská rôzne nezvyčajné chorobné prejavy. Kúpanie sa v mori je častou príčinou výskytu popálenia medúzou a zmien v koži, ktoré biopticky nie sú presne opísané.
Cieľ.
Autori sa zamerali na sledovanie morfologických a numerických zmien niektorých druhov zápalových buniek v koži 59-ročnej pacientky po 10 dňoch od popálenia medúzou. Na porovnanie kožných zmien sa jej na bioptické vyšetrenie odobrala lezionálna aj nelezionálna koža.
Metódy.
Obidve excízie kože sa skúmali pomocou imunohistochemických metód na detekciu antigénu CD68, CD163, CD30, CD4, CD3, CD8, CD20 a CD1a, na detekciu histiocytov, niektorých klonov lymfocytov a Langerhansových buniek kože prezentujúcich antigén, antigén CD117, toluidínová modrá a chlóracetátesteráza na detekciu mastocytov a neutrofilov. Materiál bol vyšetrený aj imunofluorescenčnými metódami na dôkaz IgA, IgM, IgG, C3, C4, albumínu a fibrinogénu. Reprezentatívne zorné polia sa dokumentovali mikroskopickým fotoaparátom Leica DFC 420 C. Získané snímky z obidvoch vzoriek kože sa spracovali morfometrickou analýzou pomocou softvéru Vision Assistant. Získané hodnoty boli spracované štatisticky metódou Studentovho t-testu.
Výsledky.
Priemerné hodnoty buniek v lezionálnej a v nelezionálnej vzorke boli nasledujúce - CD117-2,64/0,37, CD68-6,86/1,63, CD163-3,13/2,23, CD30 - 1,36/0,02, CD4-3,51/0,32, CD8-8,22/0,50, CD3-10,69/0,66, CD20-0,56/0,66, CD1a-7,97/0,47. Mierne zmnožené boli eozinofily v lezionálnej koži. Zvýšené hodnoty sledovaných druhov buniek v lezionálnej excízii v porovnaní s nelezionálnou vzorkou kože boli v ôsmich prípadoch štatisticky významné na hladine p = 0,033 až 0,001. Štatisticky nevýznamný rozdiel bol dokázaný iba medzi hodnotami CD163+ histiocytov.
Záver.
Autori určili počty sledovaných zápalových buniek v lezionálnej koži po popálení medúzou a porovnali ich s nelezionálnou kožou pacientky. Zistili štatisticky významné zvýšenie hladiny vybraných zápalových buniek a numericky dokumentovali zmeny celularity v zápalovom ložisku spôsobené hypersenzitívnou reakciou po poranení medúzou v intervale 10 dní po ataku.
Kľúčové slová:
popálenie medúzou – kontaktná dermatitída – morfometria
Turizmus, najmä dovolenky pri mori sú príčinou výskytu nezvyčajných kožných prejavov aj v zdravotníckych zariadeniach. Dovolenkári pri Stredozemnom mori bývajú pomerne často atakovaní popálením medúzou (jellyfish stings). Kým makroskopický opis kožných lézií po takýchto atakoch je v literatúre pomerne častý, afekcie spôsobené morskými živočíchmi nie sú spravidla bioptizované. Preto práce, ktoré opisujú histologické zmeny kože v dôsledku takýchto postihnutí živočíšnymi toxínmi a alergénmi nie sú priveľmi časté. V predloženej práci sa opisuje histologický, imunohistochemický a imunofluorescenčný obraz lézie na 10. deň od ataku. Zistené počty rôznych typov zápalových buniek v ložisku autori porovnali s počtom buniek v nelezionálnej koži pacientky. Takto vyšetrený bioptický materiál môže viac napovedať o morfológii zápalovej reakcie a o patogenéze medúzou poškodeného tkaniva kože.
KAZUISTIKA
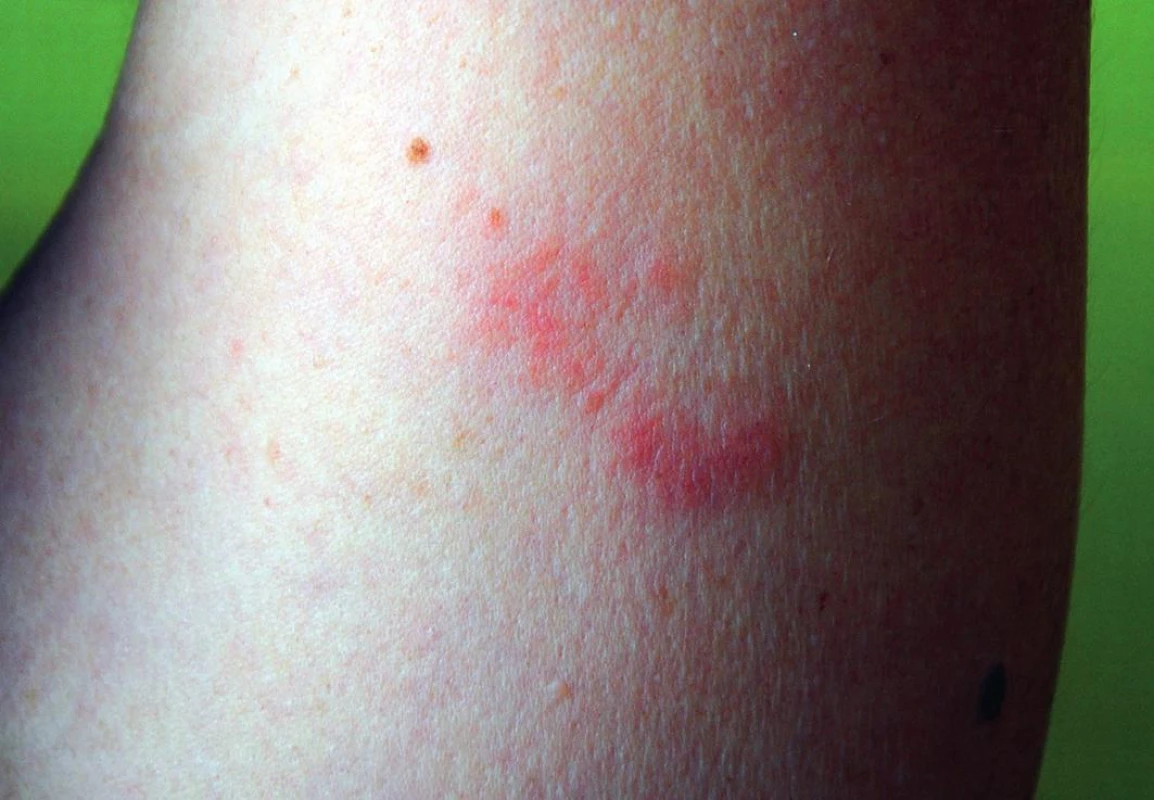
Na letnej dovolenke, pri plávaní v zálive Stredozemného mora pri Ibize, 59-ročná žena zacítila silné bodnutie či popálenie na ľavej hornej končatine a na chrbte. Cez potápačské okuliare videla vzďaľovať sa približne 12 cm dlhú medúzu s transparentným vzhľadom a okrúhlym zvonovitým telom. Nasledovala bezprostredná bolestivá veziko-urtikariálna reakcia v mieste popálenia. Pacientka bola aktuálne ošetrená len oplachovaním rany morskou vodou a použitím ľadu. Svrbenie, mierna bolesť, pálenie, začervenanie a monomorfná papulózna vyrážka trvali ďalších 10 dní (obr. 1). Po návrate domov bola pacientka pre pretrvávajúce lézie na extenzorovej časti ľavej paže (9x4,5 cm) a na ľavej strane chrbta (10x5 cm), bez náznaku výraznejšieho ústupu reakcie, vyšetrená v ambulancii Dermatovenerologickej kliniky JLF UK a UNM v Martine. V uvedených lokalizáciách pretrvávali makulózne až makulopapulózne nepresne ohraničené ložiská naznačeného semicirkulárneho usporiadania, červenej farby rôznej intentizy, okrskovo ploché, aj nad niveau kože. Lézie svrbeli a boleli. Klinik ordinoval excíziu lezionálnej kože z miesta lézie na paži, ako aj (na žiadosť pacientky) z podobného miesta na druhostrannej paži, pre presný diagnostický záver charakteru lézie a pre jej porovnanie s nelezionálnou kožou.
MATERIÁL A METODIKA
Obidve vzorky kože, dĺžky 15 mm, boli fixované 10% neutrálnym formalínom a spracované rutinným spôsobom parafínových blokov. Pozdĺžna periférna časť z odobratých excízií bola odkrojená, zmrazená a spracovaná na priame imunofluorescenčné vyšetrenie (zmrazovací Mikrotom LeikaCM1850UV). Excízie po narezaní na 4 μm hrubé rezy boli zafarbené klasickou hematoxylínovou - eozínovou metódou, toluidínovou modrou, Giemsovou metódou a pomocou chlóracetátesterázy (CHAE). Použilo sa aj spektrum imunohistochemických metód (tab. 1), ako aj imunofluorescenčných metód na detekciu IgA, IgM, IgG, C3, C4, albumínu a fibrinogénu. Materiál bol prezretý aj v polarizovanom svetle.
Všetky kroky imunohistochemických, imunofluorescenčných a histochemických reakcií boli spracované podľa odporúčaní výrobcu. Zorné polia s najvýraznejšími zmenami boli dokumentované mikroskopickým fotoaparátom Leica DFC 42O C pri zväčšení objektívom 20x a 40x, a to tak vzorky z lezionálnej, ako aj nelezionálnej kože.
Morfometrická analýza
Morfometrická analýza digitálnych obrazov bola vykonaná pomocou LabView na programe Vision asistent verzia 7.1.1 (National Instruments, Austin TX, USA). Prahové hodnoty pre intenzitu pozadia boli stanovené v kontrolnom tkanive bez primárnej protilátky. Zápalové bunky boli vyčíslené tak v lezionálnej, ako aj v nelezionálnej koži vo všetkých deviatich skúmaných zápalových bunkových typoch a klonoch. Bunková oblasť bola definovaná ako priemerný percentuálny podiel plochy antigénu v papilárnej a hornej retikulárnej derme rozdelenej do štandardných polí. Snímali sa tri snímky z každej vzorky.
Štatistická analýza
Morfometrické údaje boli vyjadrené ako priemer +/ - smerodajnej odchýlky. Štatistická analýza bola vykonaná metódou nepárového t-testu. Hodnota p nižšia ako 0,05 sa pokladala za minimálnu pre určenie štatistickej významnosti.
VÝSLEDKY
Histológia
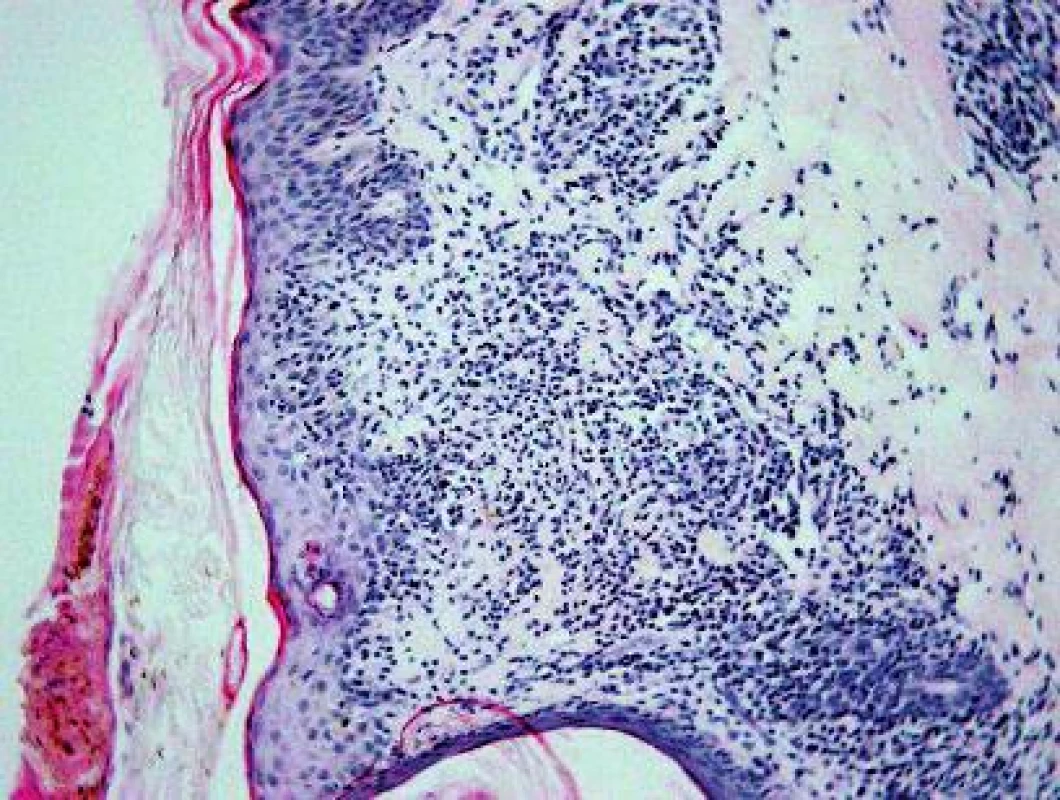
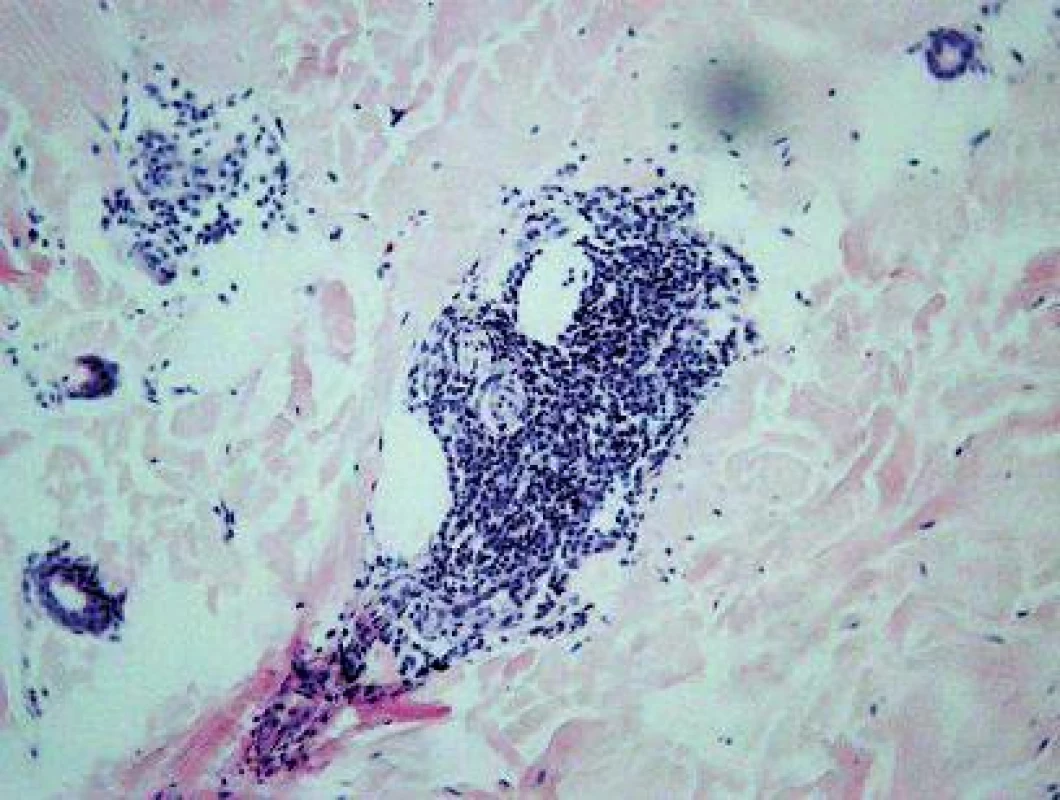
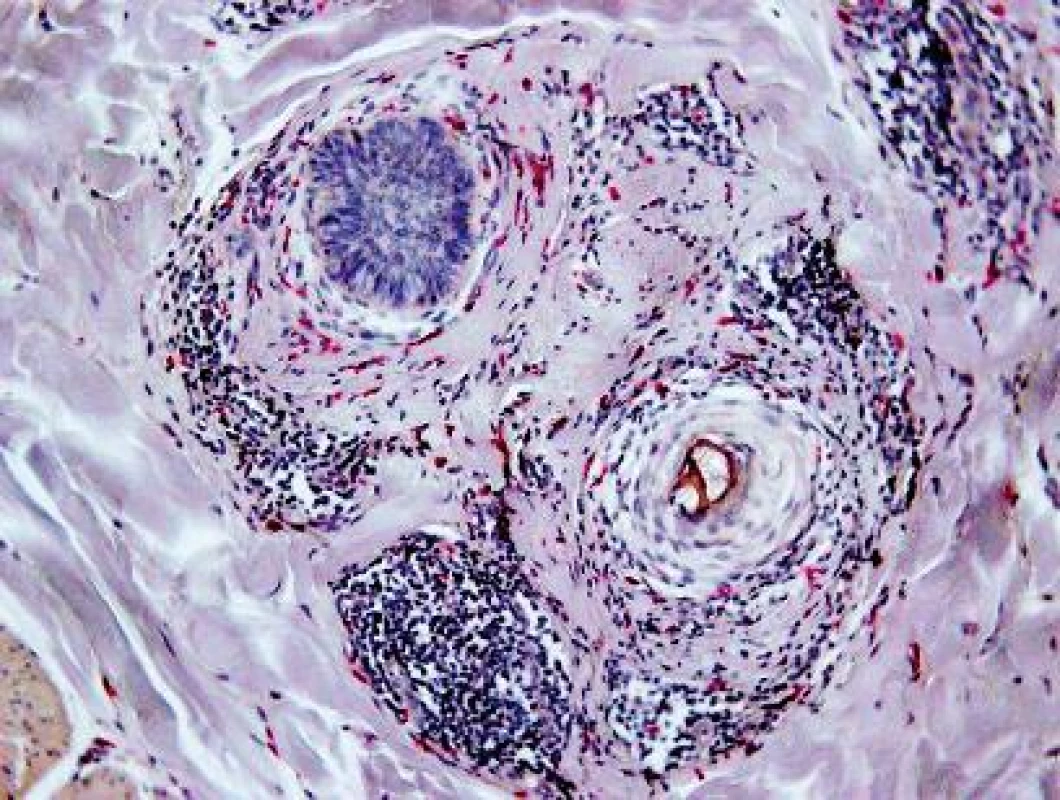
V histologickom obraze z kožnej lézie (HE, Giemsa) bol prítomný mierny edém dermy a výrazná, niekde plášťová zmiešaná zápalová reakcia, a to v oblasti ciev horného vaskulárneho plexu (obr. 2) a v okolí kožných adnexov (obr. 3). Epiderma nebola významnejšie zmenená, bola iba tenšia a cez nepravidelne vlnitú DEJ exocytovali lymfocyty do jej bazálnej časti. Na povrchu epidermy bola „basket wave“ keratóza s ojedinelými miniložiskami krvácania. Zápalový infiltrát obsahoval malé lymfocyty, histiocyty, mastocyty (toluidínová modrá, Giemsa) a iba malé množstvo leukocytov, zväčša eozinofilných.
Detegovanie nematocýst, ktoré sa pri ataku medúzy zvyčajne zapichnú do kože, bolo vo farbených preparátoch, ako aj v polarizačnom vyšetrení negatívne. Druhá vzorka – nelezionálna koža bola bez zápalových zmien.
Imunohistochémia
Imunohistochemickou analýzou (tab. 2) sa zistili štatisticky významne vyššie počty v ôsmich klonoch zápalových buniek v lezionálnej koži v porovnaní s nelezionálnou kožou (CD117, CD68, CD30, CD4, CD8, CD3, CD20 a CD1a), iba nález CD163+ histiocytov bol síce vyšší v lezionálnej koži, ale bez štatistickej významnosti.
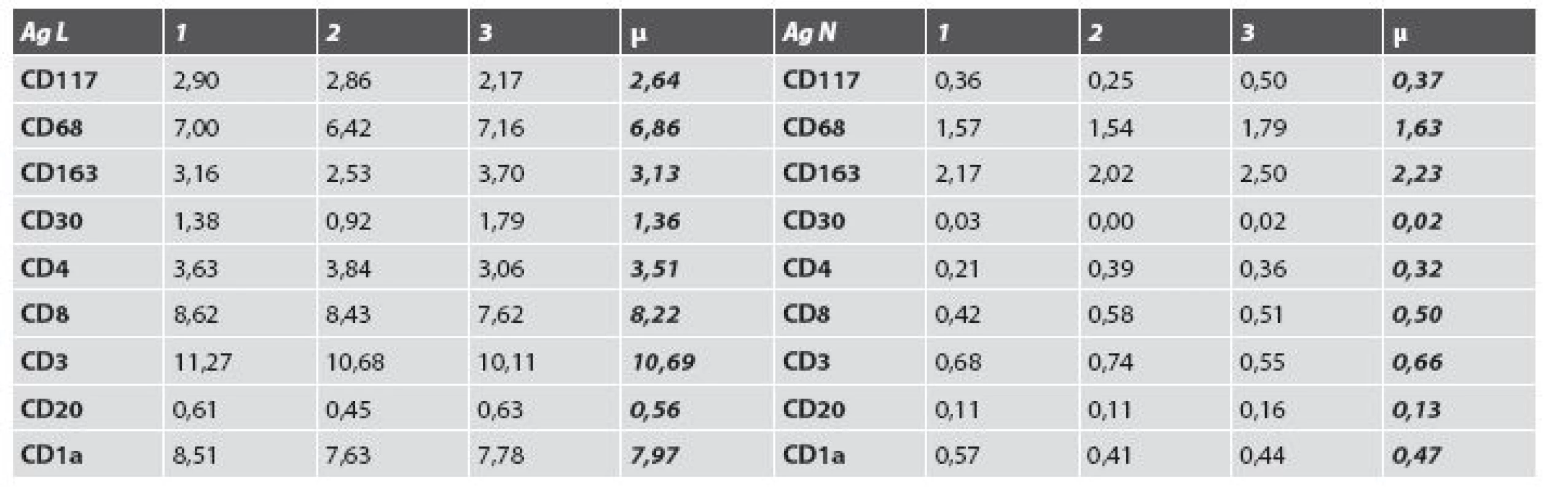
Vyšetrenie klonov lymfocytov: Najväčšie rozdiely sa zistili v množstve CD3+ T-lymfocyty (10,69 v porovnaní s 0,66; obr. 4) a CD8+ T-lymfocyty (8,22 porovnaní s 0,50). Menšie rozdiely sa zistili v počtoch CD4+ T-lymfocyty (3,51 porovnaní s 0,32), CD20+ B-lymfocyty (0,56 porovnaní s 0,13; obr. 5) a CD30+ bunky (1,36 porovnaní s 0,02). Vyšetrenie histiocytov: Významný rozdiel v zistených hodnotách bol pozorovaný v počtoch CD68+ histiocytov (6,86 porovnaní s 1,63; obr. 6). Zaujal prekvapujúco nevýznamný štatistický rozdiel v množstve histiocytov s fenotypom CD163+ (3,13 porovnaní s 2,23). Masívne zvýšené počty buniek CD1a prezentujúcich antigén (Langerhansove bunky) v epiderme a derme (7,97, resp. 0,47) v lezionálnej koži boli v kontraste s pomerne nenápadným zvýšením počtu žírnych buniek detegovaných CD117 (2,64 porovnaní s 0,37; obr. 7). Jednotlivé eozinofily detegované Giemsovou metódou boli prítomné len v povrchovej perivaskulárnej lezionálnej koži a neboli pozorované v nelezionálnej koži.
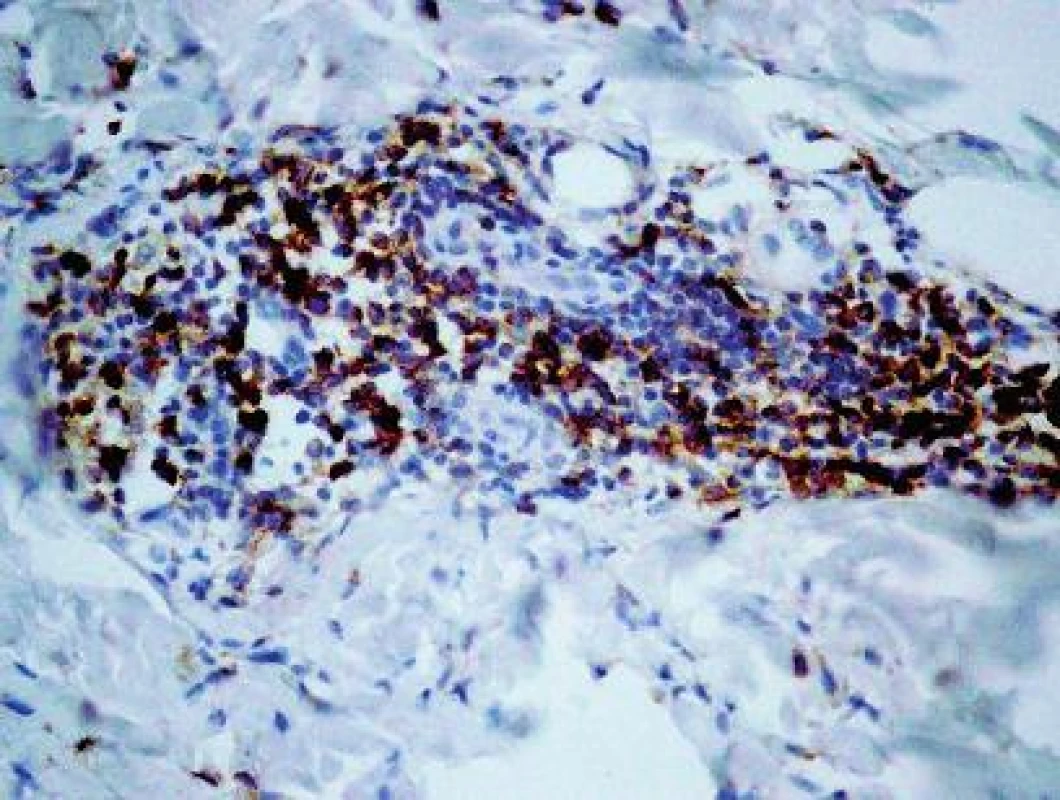
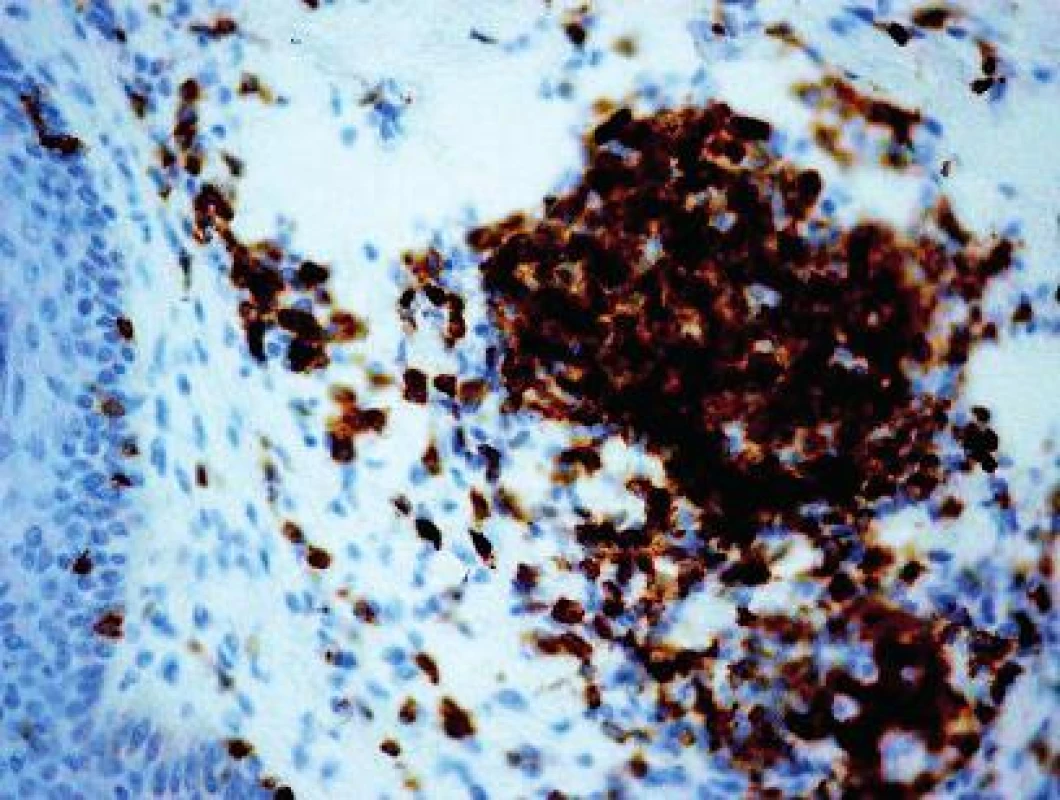
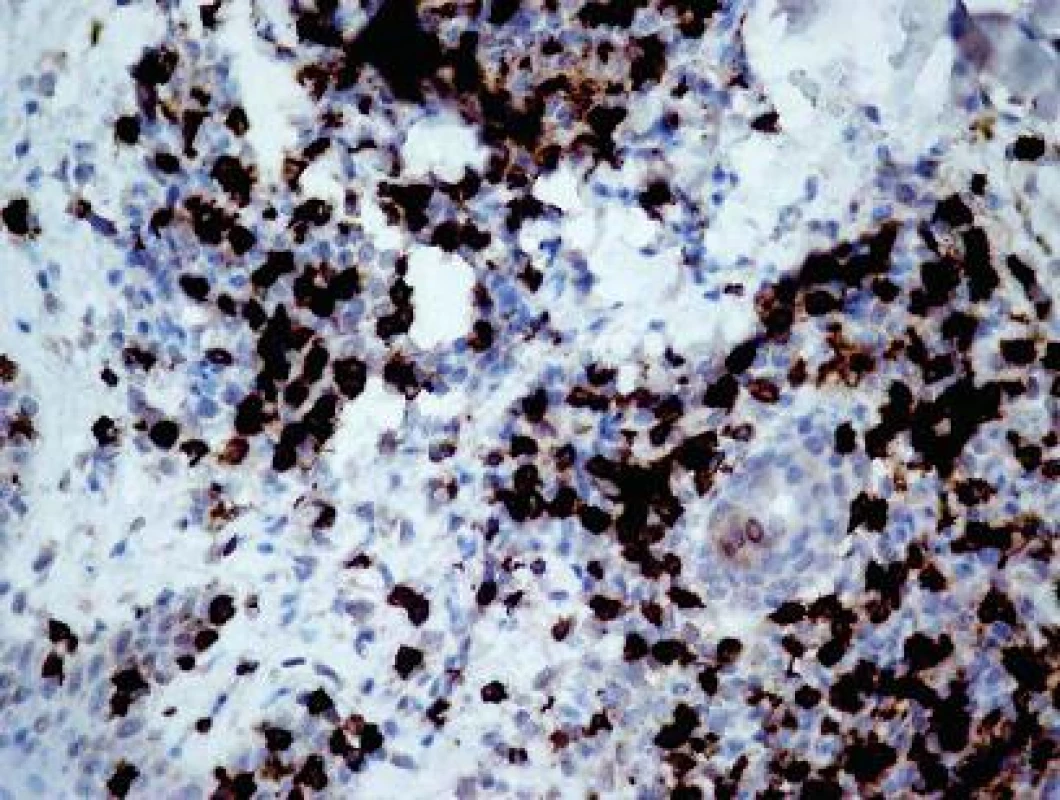
Priama imunofluorescencia
Pri použití protilátok proti IgG, IgA, IgM, C3, C4 a proti albumínu sa nedokázala žiadna pozitivita v lezionálej ani v nelezionálnej koži. Iba pri použití protilátky proti fibrinogénu sa dokázala slabá chumáčikovitá pozitivita (+) v hornej derme a v okolí ciev horného aj dolného vaskulárneho plexu lezionálnej kože.
Bioptický záver
Nález svedčí o poruche superficiálnej kožnej reaktívnej jednotky typu superficiálnej zmiešanej, prevažne lymfocytovej dermatitídy. Do tejto skupiny dermatitíd sa radí aj klinická jednotka – nešpecifikovaná kontaktná dermatitída (L25.8).
DISKUSIA
Jed medúz je zmesou toxických a antigénnych polypeptidov a bioaktívnych lipidov. Ľudská reakcia na tieto zlúčeniny sa prejavuje lokálnou reakciou alebo, zriedkavejšie, systémovými komplikáciami a syndrómami. Patologická reakcia nastáva po dotyku kože s chápadlom medúzy. Táto akcia spúšťa uvoľňovanie jedu trubičkami z intracytoplazmatických organel. Tieto štruktúry, nazývané nematocysty, sa môžu vysunúť s približnou silou 0,9 až 2,3 kg/cm2 (1,2). Lokálne a systémové príznaky, ktoré sa vyvíjajú po popálení medúzou, závisia od typu toxínu, druhu medúzy, trvania a rozsahu expozície, reakcie organizmu a typu prvej pomoci (3). Ich detailný patogenetický mechanizmus nie je do dôsledku známy, ako vyplýva aj z početných prác zaoberajúcich sa touto tematikou. Popálenie medúzou spravidla vyvoláva tri hlavné typy reakcií: – okamžitú alergickú, – okamžitú toxickú a – oneskorenú alergickú reakciu. Najbežnejšou reakciou je miestne popálenie, ktoré spôsobuje lineárnu, urtikariálnu bolestivú erupciu v oblasti kontaktu s chápadlom (2,4). Okamžité kožné reakcie sú charakterizované miestnym začervenaním, bolesťou, svrbením, parestéziami, pľuzgiermi a opuchom (4,5). Niekedy sa začiatok erupcie prejavuje ako bledá papula alebo urtika, ale tá sa čoskoro môže zmeniť na erytémovú škvrnu. Tieto lézie majú rozlične dlhé trvanie, zvyčajne od niekoľkých minút do niekoľkých hodín. Makroskopicky môže ísť aj o vezikulárne, hemoragické, nekrotické alebo ulcerózne ložiská. V sledovanom prípade sa lézia začala vyvíjať vo forme pľuzgierikov na erytematóznej spodine, neskôr prešla do formy bolestivých začervenaných makúl a papúl.
Oneskorené kožné reakcie sa môžu vyskytovať v priebehu niekoľkých dní a prejavujú sa najmä výsevom svrbiacich vyrážok (6).
Jed rôznych druhov medúz má rozličnú chemickú štruktúru. Niektoré komponenty jedu stále nie sú do detailu známe. Bolesť býva spôsobená v súvislosti s reakciou exogénnych alebo endogénnych mediátorov na kožné nervy s najväčšou pravdepodobnosťou pre pôsobenie zmesi polypeptidov a proteínov vrátane katecholamínov, histamínu, hyaluronidázy, fibrinolyzínov, kinínov, fosfolipáz a rôznych hemolytických, kardiotoxických a dermatonekrotických toxínov (7). Pacientka uvedená v opísanom prípade nevedela určiť druh medúzy, mohla uviesť iba jej približnú veľkosť (cca 12 cm v oblasti „zvona“). Dermatonekrotickú reakciu ani systémové prejavy nepozorovala. Histologický nález na koži nemal typický lichenoidný zápal, ako vo svojej práci uviedol Ghost et al. (8). Obraz lymfocelulárnej perivaskulárnej a periadnexálnej dermatitídy je nešpecifický, ako opísali autori v prezentovanej práci. Bez nálezu dutých vlákien „vystrelených“ z nematocýst a podrobnej anamnézy, nie je možné jedoznačne zatriediť tento zápal kože. Pacientka nemala nijaké trvalé následky alebo neskoré komplikácie, napr. keloidy alebo pigmentové strie, ako zaznamenal Cheng et al. (9). Rekurentná dermatitída pod obrazom kontaktnej dermatitídy v mieste popálenia medúzou býva zriedkavá a môže sa vyskytnúť v priebehu nasledujúcich 10 mesiacov (10-12). V opísanom prípade sa prejavy u pacientky zhojili ad integrum po približne troch mesiacoch. Kožné zmeny v mieste ataku medúzou nenastali ani po roku pri pravidelnom follow-up.
Exogénny alergén (jed) medúzy môže stimulovať tak vrodenú, ako aj, pri opakovanom kontakte, získanú imunitu. Z pohľadu hypersenzitivity môže vyvolávať jej okamžitú aj oneskorenú reakciu (1. a 4. typ, resp. podľa Coombsa a Gella). Komplikovaný systém bunkových a cytokínových interakcií po takom stimule súvisí s tým, že ide o reakciu alergénu, resp. toxínu s keratinocytmi, tkanivovými makrofágmi, dendritickými bunkami a mastocytmi. Všetky tieto druhy zápalových buniek boli rozličnou mierou u pacientky zmnožené. Keratinocyty aktivizujú pri fyzikálnom poškodení ochranu, ale pri ataku zároveň uvoľňujú lymfopoetín, ktorý aktivizuje T-bunky k produkcii cytokínov prevládajúcich v alergickej časti odpovede. Dendritické bunky (bunky prezentujúce antigén) sú významné pre začatie imunitnej odpovede, vychytanie a prezentáciu antigénu s následným vyvolaním imunitnej reakcie 4. typu (ekzémový kontaktný typ). Zvýšenie počtu mastocytov možno interpretovať takto: Sú silným producentom zápalu. Odpovedajú v koži na tri typy stimulov, pričom všetky sú prítomné v procesoch pri vyplavení jedu medúz. Ide o – priamu aktiváciu bioaktívnymi lipidmi medúzy, – o aktiváciu PRR (Patter Recognition Receptors) na mastocytoch a – o priame zmeny fyzikálnych parametrov v prostredí vplyvom jedu (pH, osmolarita a ďalšie faktory postihnutého mikroenvironmentu) (15).
Pri opakovanom kontakte (aj nevedomej stimulácii) vzniká po aplikácii jedu klasická IgE dependentná alergická reakcia skorého typu. V prostredí kožných mäkkých tkanív kombinácia 1. a 4. typu hypersenzitívnej reakcie s priamym toxickým poškodením vytvorí obraz imunitnej reakcie, s prevahou toxických prejavov na začiatku ataku, ktoré sa pri bioptickom sledovaní nenašli. Zistený obraz zodpovedal odznievajúcej zápalovej reakcii v období hojenia (nižší počet mastocytov a eozinofilov).
Zaujímavým zistením bolo výrazné zvýšenie počtu CD68 histiocytov u pacientky a iba nesignifikantné čiže menej početné zvýšenie CD163 buniek v lezionálnej koži. Elementy CD68+ aj CD163+ sú myelo/monocytické markery ľudských dermálnych makrofágov. Zjednodušene interpretované – významné zvýšenie CD68+ v poškodenej koži svedčí o aktivácii a pritiahnutí (homing) T-lymfocytov do poškodeného tkaniva, čo je v zhode s nálezom zvýšeného počtu vyšetrovaných klonov lymfocytov v lezionálnej koži v provnaní s nelezionálnou kožou. Tento proces súvisí so stimuláciou a s aktiváciou T-lymfocytov v čase zápalu, kým menšie zmnoženie CD163+ histiocytov možno vysvetliť chýbaním hemolýzy erytrocytov a leukocytov MFS vo vyšetrovanom tkanive. CD163 marker je prítomný na ľudských monocytoch a makrofágoch predovšetkým v neskorej fáze zápalu, teda hodnota týchto elementov môže súvisieť aj s obdobím odberu excízie z postihnutej kože.
CD3 T-lymfocyty a CD8+ lymfocyty sú najčastejšie fenotypy prítomné pri zápalových dermatózach. Zúčastňujú sa na imunitných odpovediach pri patologických procesoch súvisiacich so zápalom. CD8 subpopulácia sú cytotoxické bunky a ich prítomnosť je reakciou na prítomnosť buniek poškodených jedom, aktivitou CD8+ T-lymfocytov nastáva ich priama likvidácia. Prítomnosť CD20 buniek hovorí o tom, že aj humorálna imunita má určitú úlohu pri vývoji opísanej lézie, rovnako ako mierne zvýšená prítomnosť CD4+ (pomocných) T-lymfocytov zúčastňujúca sa na aktivačnom procese bunkovej a humorálnej línie (13–15).
ZÁVER
Autorom sa podarilo dostupnými metódami zmapovať bunkovú kolonizáciu v lézii po popálení medúzou na 10. deň od ataku. Histologický, imunohistochemický a imunofluorescenčný nález svedčí o poruche superficiálnej kožnej reaktívnej jednotky typu superficiálnej zmiešanej prevažne lymfocytovej dermatitídy. Do tejto skupiny dermatitíd sa radí aj klinická jednotka – nešpecifická kontaktná dermatitída (kontaktný ekzém), ktorý patogeneticky prináleží k 1. a 4. hypersenzitívnej reakcii.
PROHLÁŠENÍ
Autor práce prohlašuje, že v souvislosti s tématem, vznikem a publikací tohoto článku není ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou. Toto prohlášení se týká i všech spoluautorů.
Adresa pro korespondenci:
Prof. MUDr. Katarína Adamicová, Ph.D.
Ústav patologickej anatómie Univerzita Komenského Bratislava Jesseniova lekárska fakulta Martin
Kollárova 2,
036 59 Martin,
Slovenská Republika
e-mail: adamicova@jfmed.uniba.sk
mobil: +421 (0) 903 999 653
Sources
1. Kingston CV, Southcott RV. Skin histopathology in fatal jellyfish stinging. Transaction of the Royal Society of tropical Medicine and Hygiene 1960; 54(4): 373–384.
2. Drobina BJ, Lee C. Jellyfish sting. 2013; http:// www.emedicinehealth.com/jellyfish_stings/ article_em.htm
3. Klauzová K. Jizvy z dovolené – medúzy. Referátový výber z dermatovenerológie 2013,v4 : 8–13.
4. Burnett JW. Human injuries folloving jellyfishvsting. Md Med J 1992; 41(6): 509–513.
5. Al-Rubiay KK, Al-Musaoi HA, Alrubaiy L, Al-vFreje MG. Skin and systemic manifestationsvof jellyfish Stings in Iraqi fishermen. LJM 2009; 4(2): 75–77.
6. Uri S, Marina G, Liubov G. Severe delayed cutaneous reaction due to Metiterranean jellyfish (Rhopilema nomadica) envenomation. Contact Dermatitis 2005; 52 : 282–328.
7. Daubert GP. Cnidaria envenomation. 2012; http://emedicine.medscape.com/article/ 769538-overview#a0104.
8. Ghost SK, Bandyopadhyay D, Haldar S.Lichen planus-like eruption resulting from a jellyfish sting: a case report. J Med Case Reports 2009; 3 : 7421.
9. Chang D, Dattaro JA, Yakobi R. Jellyfish stings. emedicine 2008.
10. Rallis E, Limas C. Recurent dermatitis after solitary envenomation by jellyfish partially responded to tacrolimus ointment 0,1%. JEADV 2007; 21 : 1287.
11. Menahem S, Shvartzman P. Recurent dermatitis from jellyfish envenomation. Can Fam Physician 1994; 40 : 2116–2118. 12. Lee NS, Wu ML, Tsai WJ, Deng JF. A case of jellyfish sting. Vet Hum Toxicol 2001; 43(4): 203–205.
13. Chromej I. Atopický ekzém. Banská Bystrica: Dali – BB; 2007 : 240.
14. Maniecki MB, Etzerodt A, Moestrup SK, Moller HJ, Graversen JH. Comparative assessment of the recognition of domain-specific CD163 monoclonal antibodies in human monocytes explains wide discrepancy in reported levels of cellular surface CD163 expression. Immunobiology 2011; 216(8): 882–890.
15. Tibballs J, Yanagihara AA, Turner H, Winkel K. Immunological and Toxinological Responses to Jellyfish Stings. Inflammation and Allergy – Drug Targets 2011; 10(5): 1–9.
Labels
Anatomical pathology Forensic medical examiner ToxicologyArticle was published in
Czecho-Slovak Pathology

2016 Issue 1
-
All articles in this issue
- Kožná bunková reakcia po popálení medúzou
- Postinfekční glomerulonefritida u dospělých: skrytá tvář dlouho známého onemocnění
- Serrated adenomy a karcinomy tlustého střeva
- Morfologie gastroezofageálního refluxu
- Patologická diagnostika nerefluxních ezofagitid
- Folikulový lymfóm a lymfóm z plášťových buniek v biopsiách orgánov žalúdočno-črevnej oblasti
- Hypoglykémie u solitárního fibrózního tumoru jater
- Klinicko-patologická korelace imunoprofilu u difúzního velkobuněčného lymfomu, NOS - zkušenost z jednoho pracoviště
- Czecho-Slovak Pathology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Serrated adenomy a karcinomy tlustého střeva
- Morfologie gastroezofageálního refluxu
- Folikulový lymfóm a lymfóm z plášťových buniek v biopsiách orgánov žalúdočno-črevnej oblasti
- Kožná bunková reakcia po popálení medúzou
