Izolovaná infekční endokarditida pulmonální chlopně: kazuistika
Isolated infectious endocarditis of the pulmonary valve: a case report
Isolated infectious endocarditis of the pulmonary valve is a rare condition and represents 1,5-2% of all cases of infectious endocarditis. We present a case of a 37year-old woman without any relevant medical history. The woman was hospitalized with hallmarks of severe sepsis and bilateral pneumonia; she died several hours after admission with progressive multiorgan failure and disseminated intravascular coagulopathy. Microbiologic examination approved Staphylococcus aureus as the etiological agent. The autopsy showed isolated endocarditis of the pulmonary valve, without any known predisposing factor. Literary data refer single cases or small groups of patients with isolated pulmonary infectious endocarditis. The clinical suspicion of this rare disease in differential diagnosis of febrile conditions is an essential factor in prognosis of afflicted persons. The crucial diagnostic methods for infectious endocarditis are echocardiography and CT examination.
Keywords:
infectious endocarditis – pulmonary valve – Staphylococcus aureus – sepsis
:
Jan Hrudka 1; Monika Grussmannová 2; Václav Mandys 1
:
Ústav patologie 3. lékařské fakulty Univerzity Karlovy a Fakultní nemocnice Královské Vinohrady, Praha
1; 1. interní klinika 3. lékařské fakulty Univerzity Karlovy a Fakultní nemocnice Královské Vinohrady, Praha
2
:
Čes.-slov. Patol., 53, 2017, No. 3, p. 129-133
:
Original Article
Izolovaná infekční endokarditida pulmonální chlopně je vzácná choroba, která představuje 1,5 - 2 % všech infekčních endokarditid. Referujeme případ 37leté ženy bez klinicky známých předchozích chorob, která byla akutně hospitalizována s obrazem těžké sepse a oboustranné pneumonie. Nemocná v krátké době po přijetí zemřela při rozvoji multiorgánového selhání a diseminované intravaskulární koagulopatie. Mikrobiologické vyšetření hemokultur prokázalo jako původce sepse Staphylococcus aureus. Pitva odhalila jako zdroj sepse izolovanou endokarditidu pulmonální chlopně, bez známého predisponujícího faktoru. Literární zdroje uvádějí jednotlivé případy nebo malé soubory nemocných s izolovanou pulmonální infekční endokarditidou. Při dlouhodobě narůstající incidenci infekční endokarditidy je osud nemocných s touto vzácnou chorobou závislý především na klinické suspekci v diferenciální diagnostice horečnatých stavů. Klíčovou metodou v odhalení infekční endokarditidy je echokardiografické vyšetření a nález CT.
Klíčová slova:
infekční endokarditida – pulmonální chlopeň – Staphylococcus aureus – sepse
Infekční endokarditida (IE) je charakterizována přítomností trombu prostoupeného mikroorganismy na srdeční chlopni. Klinicky je jedná o jedno z nejzávažnějších infekčních onemocnění. IE se může vyvinout na normální srdeční chlopni nebo v terénu předchozích patologických změn – touto abnormalitou může být vrozená srdeční malformace, získaná chlopenní vada – porevmatická, degenerativní či myxoidní degenerace chlopně. Predisponujícím faktorem může být i přítomnost cizího tělesa v srdci – chlopenní náhrada, katetr či elektroda pacemakeru. IE může způsobit prakticky kterákoliv bakterie. Asi v 60 % všech případů je to streptokok, pneumokok enterokok a další. Viridující streptokoky jsou původcem endokarditidy typicky na chlopních předem změněných a onemocnění je subakutní. Staphylococcus aureus je původcem asi 20 % případů IE, postiženy mohou být normální chlopně, průběh je akutní (1).
Podmínkou vzniku IE je bakteriémie. Pro cirkulující agens jsou preferenčním místem usazení srdeční chlopně, především mitrální a aortální, což nejspíše souvisí s vyšším tlakem a častějšími chlopenními vadami v levém srdečním oddílu. Navíc relativně vyšší koncentrace kyslíku přispívá k množení bakterií. Bakterie se typicky usazují při volných okrajích cípů – jde zřejmě o locus minoris resistentiae, kdy opakované mechanické inzulty poškozují endotel a činí tak povrch náchylnější ke srážení krve i k adhezi infekčních agens (2). Vegetace je typicky situována na síňové ploše cípaté nebo na komorové ploše poloměsíčité chlopně. Distribuce IE je zhruba: mitrální 40 - 50 %, aortální 30 - 40 %, aortální + mitrální 5 - 10 %, ostatní (pulmonální chlopeň, více chlopní, murální, defekt septa) 1 - 5 % (2). Většina pravostranných endokarditid se vyskytuje u nitrožilních narkomanů (3).
V této práci referujeme o případu izolované endokarditidy pulmonální chlopně, která je sama o sobě velmi vzácná. Jedná se o pacientku, která byla velmi krátce hospitalizována ve Fakultní nemocnici Královské Vinohrady a krátce po přijetí zemřela, diagnóza IE pulmonální chlopně byla stanovena až autopticky.
POPIS PŘÍPADU
37letá pacientka se dosud s ničím neléčila, chronicky užívala pouze hormonální antikoncepci. Čtyři dny před akutním přijetím na I. interní kliniku 3. LF UK a FNKV nemocná cestovala 17 hodin klimatizovaným autobusem s následným rozvojem příznaků nachlazení, které v dalších třech dnech postupně progredovalo s rozvojem febrilií, celkové slabosti, artralgií, myalgií a finálně dušnosti s dráždivým suchým kašlem. Při vstupním pohovoru na interním příjmu nemocná negovala bolest na hrudi i bolest břicha, nauseu a zvracení s výjimkou nevole po užití Coldrexu; dále negovala dysurii, průjem, krvácení, fotofobii i těhotenství. Byl indikován bezprostřední příjem na monitorované lůžko jednotky intenzivní péče. Při vstupním fyzikálním vyšetření dominovala celková schvácenost, přes aplikaci antipyretik subfebrilie 37,6 °C, hypotenze 90/50, tachykardie 105/min, tachypnoe až 35/min a spontánní desaturace až na 87 %. Dále byl patrný ikterus kůže a sklér, poslechově difúzně oslabené dýchání s maximem v distální polovině pravé plíce s chrůpky akcentovanými vpravo při bazi. Při vyšetření srdce nebylo kromě tachykardie zachyceno rozšíření srdečního stínu, zvedavý úder hrotu ani srdeční šelest. Palpačně však byla diagnostikována hepatomegalie s přesahem žeberního oblouku o 5 - 7 cm. Současně byl periumbilikálně zachycen drobný petechiální exantém a vaginální krvácení. Nebyl však zachycen enantém sliznic ani významnější krvácení, kromě drobných ranek rtů při jejich rozpraskání.
Na RTG snímku plic byly popsány infiltráty v obou plicních křídlech s maximy odpovídajícími klinickému vyšetření v dolních a středních plicních polích (obr. 1). Laboratorně byla v krevním obraze detekována leukocytóza 19,1x109/l a významná trombocytopenie 8x109/l. V diferenciálním rozpočtu byl významný levostranný posun s neutrofilní granulocytózou 92,3 % a s excesem neutrofilních tyčí ve výši 39,5 %. Koagulační parametry odrážely rozvoj konzumpce při diseminované intravaskulární koagulopatii s elevací D-dimerů neměřitelně nad 20 tisíc, dále snížení fibrinogenu, antitrombinu a spontánnímu prodloužení INR na 1,41. V biochemii pak dominoval obraz multiorgánového selhání s minerálovou dysbalancí, známkami progrese poruchy jaterních i renálních funkcí, elevace kardiospecifických enzymů a NT - proBNP, dále vysoká elevace CRP 314,6 mg/l i prokalcitoninu 12,7 µg/l. EKG bylo bez známek akutního koronárního syndromu, ale se známkami přetížení levé srdeční komory. Sonograficky byla potvrzena multiorgánová iritace s hepato-splenomegalií, prosakem ledvin, dělohy a volnou tekutinou v Douglasově prostoru a supradiafragmaticky.
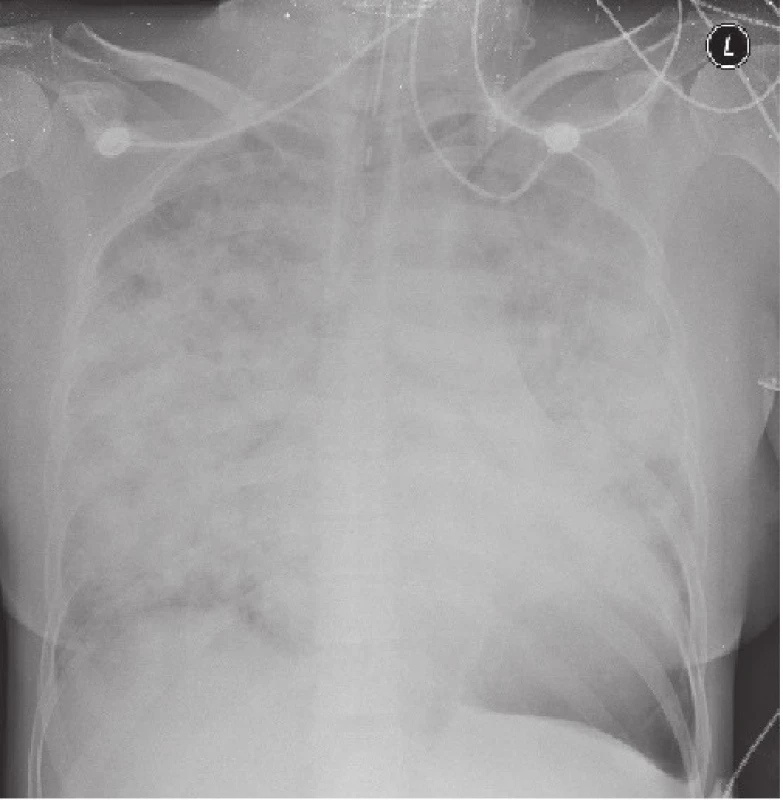
Byla stanovena pracovní diagnóza sepse při bilaterální pneumonii s rozvojem multiorgánového selhání a diseminované intravaskulární koagulopatie. Bez prodlevy byl odebrán kompletní panel vzorků k mikrobiologickému vyšetření a po té byla empiricky zahájena terapie širokospektrými antibiotiky (Unasyn potencovaný Ampicilinem), dále nezbytná volumexpanze a kompletní symptomatická terapie. Pro známky krvácení s konzumpcí krevních destiček i koagulačních faktorů statim podána 3x mražená plasma a trombocyty z aferezy. S odstupem 3 hodin po podání první dávky antibiotik došlo k rozvoji globální respirační insuficience, k tachypnoi 45/min, desaturaci na oxygenoterapii maskou 7 l/min, s nutností orotracheální intubace a umělé plicní ventilace s katecholaminovou podporou. Pacientka byla přeložena na Kliniku anesteziologie a resuscitace 3. LF UK a FNKV. Tam přes veškerou péči pokračovala rychlá progrese celkového stavu s rozvojem anurie, těžké kombinované metabolické i respirační acidózy s vysokou elevací laktátu, s progredující jaterní lézí, spontánní hypoglykemií a masivním krvácením do dýchacích cest. Doplněné orientační echokardiografické vyšetření detekovalo difúzní hypokinézu levé srdeční komory. Finálně necelých 11 hodin od příjmu došlo k srdeční zástavě a ani okamžitá kardiopulmonální resuscitace nebyla úspěšná.
Mikrobiologické vyšetření hemokultur prokázalo Staphylococcus aureus jako původce sepse. K objasnění základního onemocnění byla provedena pitva. Na předním cípu pulmonální chlopně byla zastižena objemná pendulující vegetace velikosti 30x20x5mm. Na intimě plicnice ulpívala ve vzdálenosti 20mm za chlopní plošná vegetace v rozsahu 15x10mm (obr. 2). Ostatní srdeční chlopně byly jemné, bez vegetací. Levá srdeční komora byla zbytnělá se stěnou síly 25 mm, srdce hmotnosti 470 g. Jiné abnormality na srdci nebyly patrné.
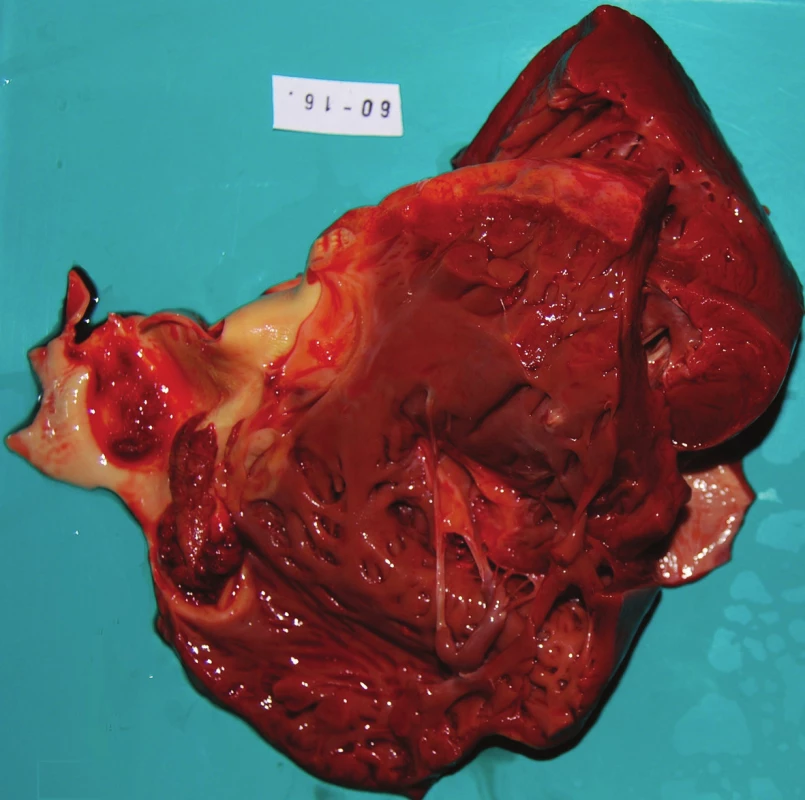
V plicích byl obraz masivní hemoragické a abscedující oboustranné pneumonie; hmotnost plic 1250 g vpravo a 950 g vlevo. Součástí obrazu sepse byla splenomegalie; slezina hmotnosti 450 g. Vedlejším nálezem byl tumorózní útvar velikosti 65 mm v pravém laloku jinak makroskopicky přiměřených jater.
Histologické vyšetření potvrdilo diagnózu infekční ulcero-polypozní endokarditidy pulmonální chlopně se záplavou kolonií Gram-pozitivních koků (obr. 3); hnisavý infiltrát přestupoval i na myokard pravé komory v blízkosti plicnice. V plicích byl obraz DAD (diffuse alveolar damage) s hyalinními membránami. Ve větvích plicních tepen byly nalezeny septické mikroemboly, v plicním parenchymu obraz těžké abscedující pneumonie s pneumoragiemi a koloniemi bakterií (obr. 4). V červené pulpě sleziny bylo nalezeno zmnožení neutrofilních granulocytů a jejich nezralých forem, odpovídající septické aktivaci. Ve vzorku z kostní dřeně těla obratle byla patrná reaktivní hyperplazie myeloidní řady s deplecí zralých granulocytů. Útvar v játrech histologicky odpovídal nodulární hyperplazii.
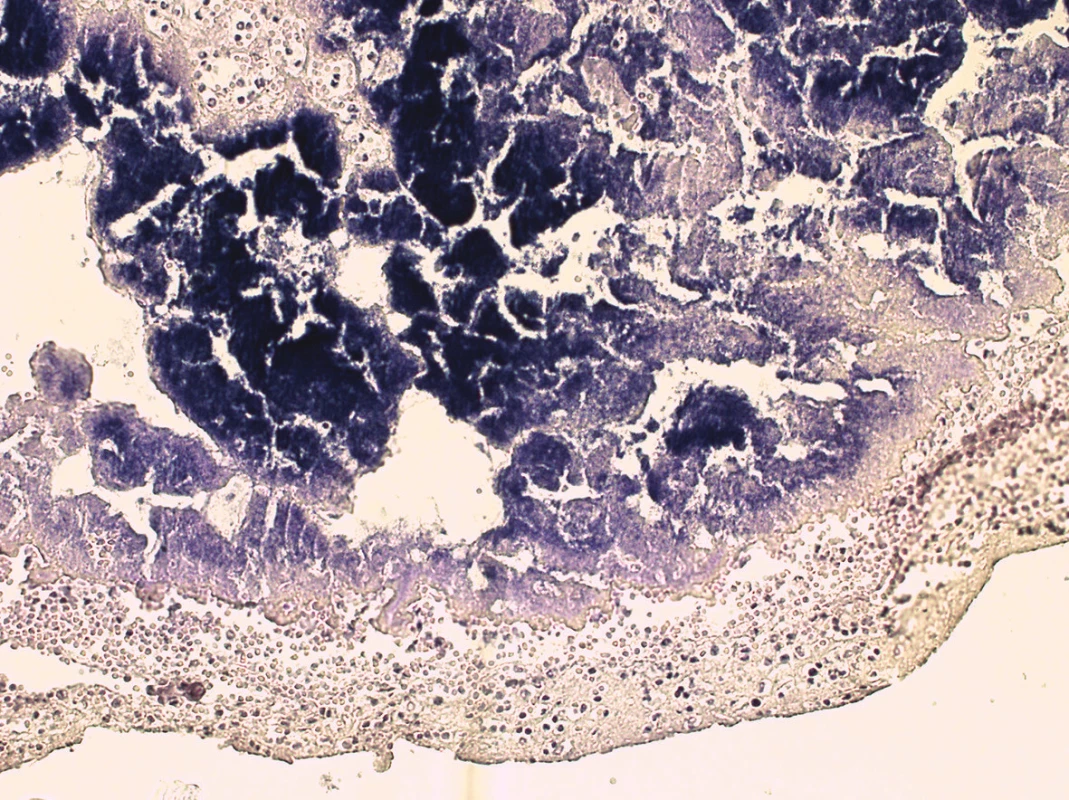
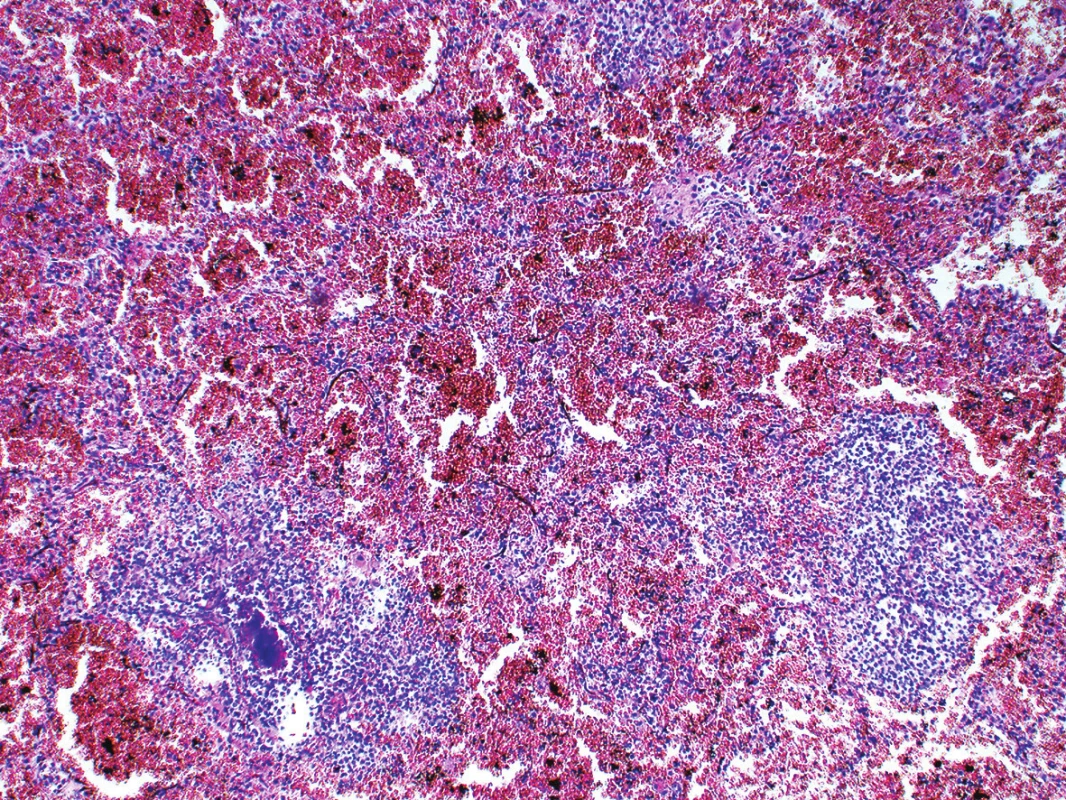
Bakteriologické kultivační vyšetření stěrů z pulmonální chlopně, z plic a ze sleziny ukázalo ve všech vzorcích Staphylococcus aureus.
Jako příčina smrti byl stanoven septický šok a multiorgánové selhání při stafylokokové sepsi při IE pulmonální chlopně.
DISKUZE
Klinický přístup k IE
I přes rozvoj možností diagnostiky, chirurgické a antibiotické léčby je IE závažný stav se smrtností cca 20 % (4), incidence celosvětově stoupá, pohybuje se mezi 1,5-11/100 000 obyvatel (5) a zůstává tak významným klinickým problémem. Klinicky má nemoc bouřlivý začátek s rychle se rozvíjející horečkou, zimnicí, slabostí a malátností (6). Podle doporučení Evropské kardiologické společnosti z roku 2015 má být vzdor nízké incidenci zvažována IE v diferenciální diagnostice u nemocných s nejasnými horečnatými stavy a s nově objevenými srdečními šelesty. Prvním symptomem IE může být také cévní mozková příhoda při embolizaci trombotických hmot z chlopní levého srdce. Anamnestické rizikové faktory jsou srdeční vady, chlopenní protézy, prodělaná revmatická horečka, intravenózní abúzus drog či invazivní zákroky s potenciální sekundární bakteriémií; často však tyto skutečnosti v anamnéze řady nemocných chybí (7). U intravenózních narkomanů je IE asi stokrát častější než u běžné populace (2). Na významu získávají také nozokomiální infekce; rizikovým faktorem je také předchozí pobyt v nemocnici nebo intravenózní katetr (8). Dlouho známými postupy při klinické diagnostice IE je průkaz infekčního agens z hemokultury a echokardiografické vyšetření. Novými doporučenými metodami je CT nebo MRT vyšetření, které může zároveň odhalit ložiska periferní embolizace (7). Další modalitou je užití radioaktivně značených leukocytů („single photon emission computer tomography, SPECT), která umožňuje zobrazit zánětlivá ložiska v srdci i extrakardiálně (9).
Standardem léčby je razantní antibiotická terapie, pokud možno podle citlivost agens, 50 % nemocných potřebuje kardiochirurgické odstranění postižené chlopně. Indikací k operaci je zhoršení srdečního selhání na podkladě zánětlivé destrukce chlopně, vysoké embolizační riziko u velkých vegetací a progrese infekce při konzervativní terapii (7).
Přes pokroky ve vyšetřovacích metodách zůstává infekční endokarditida stále obtížně diagnostikovatelnou jednotkou a nevzácně je objevena až při pitvě. Prognóza všech etiologií IE se udává zhruba: u třetiny nemocných se IE vyhojí bez následků, třetina se vyhojí s následky a třetina zemře (2).
Reference o izolované pulmonální IE
Případ izolované endokarditidy pulmonální chlopně je velmi neobvyklý. V literatuře lze nalézt publikace jednotlivých kazuistik nebo malých souborů nemocných. Většina endokarditid pulmonální chlopně se objevuje ve spojení s IE trikuspidální chlopně. Izolovaná pulmonální endokarditida představuje 1,5 - 2 % všech IE (10).
Vaideeswar et al. (11) popsali 9 autoptických případů izolované pulmonální endokarditidy; v 7 případech se jednalo o zánět v terénu vrozené srdeční vady, 2 nemocní (1 dospělý a 1 dítě) měli pulmonální endokarditidu v normálním srdci. Miranda et al. (12) referují 7 případů izolované IE pulmonální chlopně, z čehož 3 pacienti měli vrozenou srdeční vadu a 5 mělo centrální žilní katetr nebo implantát v srdci; původci byli Enterococcus faecalis a viridující streptokok. Sharma et al. (13) popsali 5 případů izolované pulmonální endokarditidy u pacientů s vrozenými srdečními vadami, bez anamnézy nitrožilního abúzu drog, které se klinicky projevily pravostrannou srdeční nedostatečností, 2 případy pak vykazovaly negativní hemokultury a u 3 byl původcem zánětu Staphylococcus aureus.
V literatuře lze dále nalézt popisy jednotlivých případů izolované pulmonální IE ve spojení s popsanými predisponujícími faktory, zejména s nitrožilním abúzem drog (14,15), s vrozenými srdečními vadami (16,17) a s katetry v žilním systému (18,19). Gonzalez-Juanatey et al. (20) se setkali s případem izolované pulmonální IE v normálním srdci u nemocného bez predisponujících faktorů a zdůrazňují zejména nutnost na tuto vzácnou chorobu v časné diagnostice pomyslet. Jsou popsány případy pulmonální IE etiologie stafylokokové (16,18,19), enterokokové (18) a také kandidové (14). V řadě případů byla pulmonální IE komplikovaná pneumonií (18-19,21).
Někteří autoři zdůrazňují potřebu většího podezření na IE ze strany lékařů; ke správné diagnóze v některých případech vedlo transezofageální echokardiografické vyšetření (19,21). Transezofageální vyšetření má oproti přístupu transtorakálnímu podle literárních dat větší šanci toto poddiagnostikované onemocnění odhalit (22). Passen a Feng (23) zdůrazňují roli CT vyšetření hrudníku v diagnostice této vzácné choroby, která může echokardiografickému zobrazení uniknout.
Trendy v epidemiologii IE, klinicko-patologická korelace
V posledních letech je v některých zemích zaznamenán výrazný nárůst incidence IE (24,25). Z metaanalýzy epidemiologických studií z posledních pěti dekád vyplývá, že podíl zlatého stafylokoka v etiologii endokarditidy stoupl cca o 10 %, zatímco podíl viridujícího streptokoka klesá. Zároveň ve sledovaném období stoupá střední věk nemocných (26).
Nárůst podílu IE vyvolaných stafylokoky je pak zaznamenán i v České republice (27), přičemž stafylokoková IE má v porovnání s jinými běžnými původci horší prognózu (28). Důvodem nárůstu incidence i vyššího výskytu onemocnění ve starším věku je pak nárůst počtu pacientů s chlopenními náhradami a pacemakery, chronicky dialyzovaných a pacientů s diabetem (29). IE je tak stále aktuálnějším klinickým problémem, na který by mělo být pomýšleno v diferenciální diagnostice nejasných horečnatých stavů.
Při interpretaci našeho pitevního nálezu považujeme nález hemoragicko-abscedující pneumonii za fatální komplikaci základního onemocnění, kterým byla izolovaná pulmonální IE. Stafylokoková infekce se rozšířila do plic embolizací hmot chlopenní vegetace za vzniku pyémie v malém oběhu. Je známo, že infekční endokarditida častěji postihuje nemocné s implantáty v srdci či s předchozí chorobou srdce a chlopní. V nejvyšší míře zvyšují riziko vzniku IE vrozené cyanotické srdeční vady, patologie aortální chlopně, mitrální regurgitace a vady s levo-pravým zkratem. V menší míře riziko IE zvyšuje prolaps mitrální chlopně, mitrální stenóza, pulmonální stenóza, vady trikuspidální chlopně a hypertrofická kardiomyopatie (30).
V našem případě však nebyly žádné předchozí patologické změny srdečních chlopní patrné. Významnějším nálezem byla koncentrická hypertrofie levé komory srdeční (obr. 5) s hmotností srdce 470 g. Histologický nález odpovídal běžné „nespecifické“ hypertrofii. Běžnou příčinou hypertrofie levé komory srdeční je déletrvající arteriální hypertenze (2). V našem případě se jedná o vysvětlení nejpravděpodobnější. Pacientka dle sdělení rodiny žádné dlouhodobé potíže neměla, žádné léky neužívala a k lékařům nedocházela; mohlo se tedy jednat o nerozpoznané hypertonické srdce.
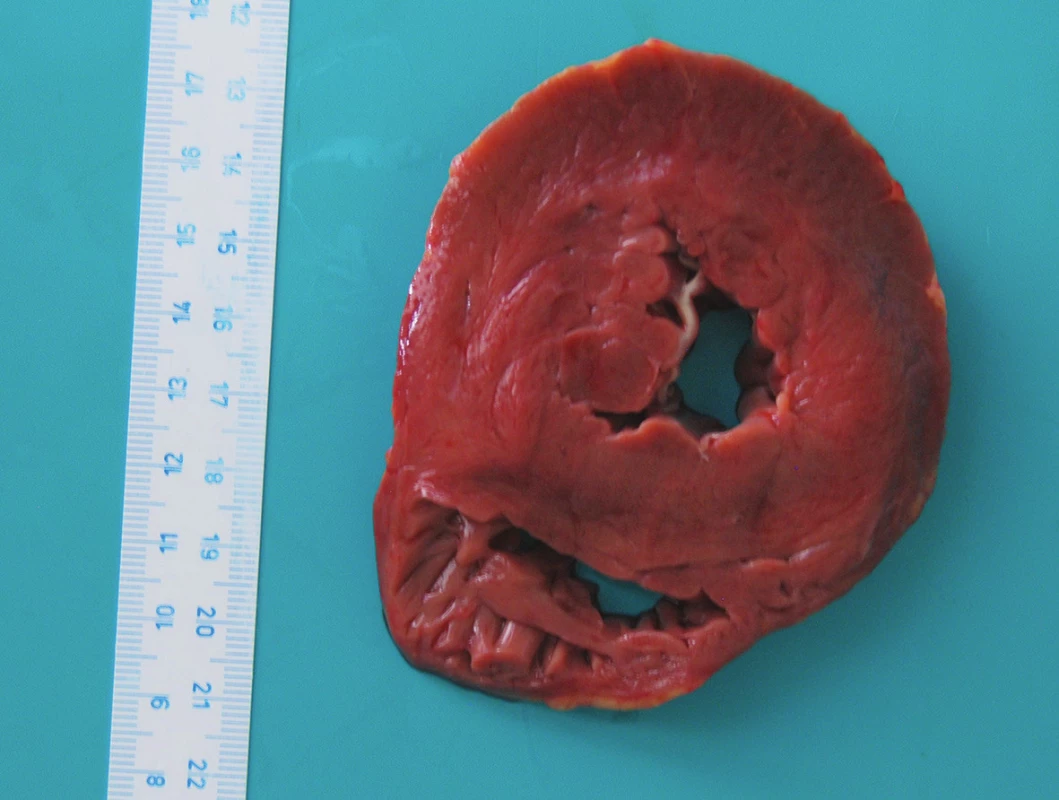
Z pohledu IE systémová hypertenze mezi rizikové faktory nepatří. Navíc v našem případě se jedná o izolovanou IE pulmonální chlopně, která žádné předchozí patologické změny nevykazovala. Pravá komora srdeční, jejíž velikost souvisí s fyziologickými poměry v malém oběhu, byla v našem případě normální (obr. 5).
Ve studii, kterou provedli McKinsey et al. (31) bylo celých 27 % z 63 nemocných s IE bez predisponující choroby srdce či chlopní. V souvislosti s narůstáním incidence stafylokokových IE se pak v našem případě patrně jednalo o případ komunitní vysoce agresivní stafylokokové infekce, která vyvolala IE v srdci bez předchozí srdeční či chlopenní patologie a bez jiného známého rizikového faktoru. V kombinaci s vzácným izolovaným postižením pulmonální chlopně se pak jedná o případ velmi neobvyklý.
PROHLÁŠENÍ
Autor práce prohlašuje, že v souvislosti s tématem, vznikem a publikací tohoto článku není ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou. Toto prohlášení se týká i všech spoluautorů.
Adresa pro korespondenci:
MUDr. Jan Hrudka
Ústav patologie 3. LF UK a FNKV
Šrobárova 1150/50,
Praha 10,
PSČ 100 34
tel: +420 267 16 2500
fax: +420 267 16 3002
email: jan.hrudka@fnkv.cz
Sources
1. Šteiner I, Povýšilová V. Patologie oběhového ústrojí. In: Povýšil C, Šteiner I. Speciální patologie. Praha: Galén; 2007 : 35-36.
2. Šteiner I. Kardiopatologie pro patology i kardiology. Praha: Galén; 2010 : 38; 81-85.
3. Frontera JA, Gradon JD. Right-side endocarditis in injection drug users: review od proposed mechanisms of pathogenesis. Clin Infect Dis 2000; 30(2): 374-379.
4. Chu VH, Park LP, Athan E, et al. Association between surgical indications, operative risk, and clinical outcome in infective endocarditis: a prospective study from the International Collaboration on Endocarditis. Circulation 2015; 131(2): 131-140.
5. Bin Abdulhak AA, Baddour LM, Erwin PJ, Hoen B, Chu VH, Mensah GA, Tleyjeh IM. Global and regional burden of infective endocarditis, 1990–2010: a systematic review of the literature. Glob Heart 2014; 9(1): 131–143.
6. Schoen FJ, Mitchell RN. The Heart. In: Mitchell R, Kumar V, Abbas A, Fausto N, Aster J. Robbins and Cotran Pathologic Basis of Disease (8th ed). Philadelphia: Saunders Elsevier; 2010 : 568.
7. Plicht B, Lind A, Erbel B. Infektiöse Endokarditis, neue Leitlinien 2015. Internist (Berl) 2016; 57(7): 675-690.
8. Benito N, Miró JM, Lazzari E de et al. Health care-associated native valve endocarditis: importance of non-nosocomial acquisition. Ann Intern Med 2009; 150(9): 586-594.
9. Kestler M, Muñoz P, Rodríguez-Créixems M et al. Role of (18)F-FDG PET in Patients with Infectious Endocarditis. J Nucl Med 2014; 55(7): 1093-1098.
10. Deng H, Ma Y, Zhai H, Miao Q. Surgical valve repair of isolated pulmonary valve endocarditis. Interact Cardiovasc Thorac Surg 2013; 16(3): 384-386.
11. Vaideeswar P, Jawale RM, Tullu M. Isolated infective endokarditis of the pulmonary valve: an autopsy analysis of nine cases. Cardiovasc Pathol 2009; 18(4): 231-235.
12. Miranda WR, Connolly HM, DeSimone DC et al. Infective endocarditis involving the pulmonary valve. Am J Cardiol 2015; 116(12): 1928-1931.
13. Sharma S, Desai AG, Pillai MG. Clinical and diagnostic features of pulmonary valve endocarditis in the petting of congenital cardiac malformations. Int J Cardiol 1985; 9(4): 457-464.
14. Devathi S, Curry B, Doshi S. Isolated pulmonary valve infective endocarditis in a middle aged man caused by Candida albicans: a case report. BMC Infect Dis 2014; 14 : 557.
15. Scardigno AD, Deluca G, Chieppa DR, Carbonara V. Endocardite volata della valvola polmonare. G Ital Cardiol (Rome) 2015; 16(11): 649-650.
16. Doi T, Gyoten T, Sakata K et al. Isolated pulmonary valve endocarditis in a patient with aortic regurgitation and patent foramen ovale; report of a case. Kyorbu Geka 2016; 69(7): 537-540.
17. Park HE, Cho GY, Kim HK. Pulmonary valve endocarditis with septic pulmonary thromboembolism in a patient with ventricular septal defect. J Cardiovasc Ultrasound 2009; 17(4): 138-140.
18. Hamza N, Ortiz J, Bonomo RA. Isolated pulmonic valve infective endocarditis: a persistent chalenge. Infection 2004; 32(3): 170-175.
19. Glew T, Feliciano M, Finkielstein D, Hecht S, Hoffman D. Pulmonic valve repair in a patient with isolated pulmonic valve endocarditis and sickle cell disease. Case Rep Cardiol 2015; Volume 2015, Article ID 732073.
20. Gonzalez-Juanatey C, Testa-Fernandez A, Lopez-Alvarez M. Isolated pulmonary native valve infetious endocarditis due to Enterococcus faecalis. Int J Cardiol 2006; 113(1): 19-20.
21. Abdelbar A, Azzam R, Yap KH, Abousteit A. Isolated pulmonary infective endocarditis with septic pulmonary embolism complicating a right ventricular outflow tract obstruction: scarce and devious presentation. Case Rep Surg 2013; Volume 2013, Article ID 746589.
22. Shapiro SM, Young E, Ginzton LE, Bayer AS. Pulmonic valve endocarditis as an underdiagnosed disease: role of transesophageal echocardiography. J Am Soc Echocardiogr 1992; 5(1): 48-51.
23. Passen E, Feng Z. Cardiopulmonary manifestations of isolated pulmonary valve infective endocarditis demonstrated with cardiac CT. J Cardiovasc Comput Tomogr 2015; 9(5): 399-405.
24. Erichsen P, Gislason GH, Bruun NE. The increasing incidence of infective endocarditis in Denmark, 1994-2011. Eur J Intern Med 2016; 35 : 95-99.
25. Correa de Sa DD, Tleyjeh IM, Anavekar NS et al. Epidemiological trend sof infective endocarditis: a population-based study in Olmsted County, Minnesota. Mayo Clin Proc 2010; 85(5): 422-426.
26. Slipczuk L, Codolosa JN, Davila CD, Romero-Corral A, Yun J, Pressman GS, Fiqueredo VM. Infective endocarditis. epidemiology over five decades: a systematic review. PLoS One 2014; 9(10): e111564.
27. Pazderník M, Baddour LM, Pelouch R. Infective endocarditis in the Czech Republic: eight years of experience a tone of the country´s largem medical centers. J Heart Valve Dis 2009; 18(4): 395-400.
28. Fernández Guerrero ML, González López JJ, Goyenechea A, Fraile J, de Górgolas M. Endocarditis caused by Staphylococcus aureus: A reappraisal of the epidemiologic, clinical and pathological manifestations with analysis of factors determining outcome. Medicine (Baltimore) 2009; 88(1): 1-22.
29. Tornos P, Gonzalez-Alujas T, Thuny F, Habib G. Infective endocarditis: the European viewpoint. Curr Probl Cardiol 2011; 36(5): 175-222.
30. Michel PL, Acar J. Native cardiac disease predisposing to infective endocarditis. Eur Heart J 1995; 16 Suppl B: 2-6.
31. McKinsey DS, Ratts TE, Bisno AL. Underlying cardiac lesions in adults with infective endocarditis. The changing spectrum. Am J Med 1987; 82(4): 681-688.
Labels
Anatomical pathology Forensic medical examiner ToxicologyArticle was published in
Czecho-Slovak Pathology

2017 Issue 3
-
All articles in this issue
- Lymph node metastasis of Merkel cell carcinoma without known cutaneous primary - case report
- Isolated infectious endocarditis of the pulmonary valve: a case report
- Changes of the WHO classification of myeloid neoplasms in the context of the 2016 revision
- Changes of the WHO classification of lymphoid neoplasms in the context of the 2016 revision
- Czecho-Slovak Pathology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Lymph node metastasis of Merkel cell carcinoma without known cutaneous primary - case report
- Changes of the WHO classification of lymphoid neoplasms in the context of the 2016 revision
- Isolated infectious endocarditis of the pulmonary valve: a case report
- Changes of the WHO classification of myeloid neoplasms in the context of the 2016 revision
