Placentární mezenchymální dysplázie – morfologie a diferenciální diagnostika
Placental mesenchymal dysplasia – morphology and differential diagnosis
SUMMARY Placental mesenchymal dysplasia is a rare placental lesion characterized by placentomegaly, vascular abnormalities and formation of cystic structures in the placental parenchyma. It can be associated with various genetic abnormalities, fetal growth restriction or intrauterine fetal demise. Placental mesenchymal dysplasia needs to be distinguished from its main differential diagnosis, partial hydatidiform mole. The aim of this article is to provide readers with a basic overview of the morphology and differential diagnosis of this pathological entity.
Keywords:
Placenta – differential diagnosis – placental mesenchymal dysplasia – PMD – cystic lesions
Authors:
Magdaléna Daumová 1,2; Šárka Hadravská 1,2; Andrea Straková Peteříková 1; Marcel Hasch 2,3; Petr Martínek 2
Authors‘ workplace:
Šiklův ústav patologie LFP UK a FN Plzeň
1; Bioptická laboratoř s. r. o., Plzeň
2; Genetika Plzeň, s. r. o.
3
Published in:
Čes.-slov. Patol., 57, 2021, No. 4, p. 203-207
Category:
Reviews Article
Overview
Placentární mezenchymální dysplázie je vzácná jednotka charakterizovaná placentomegalií, cévními abnormalitami a tvorbou cystických útvarů v placentárním parenchymu. Tato léze může být asociována s různými genetickými abnormalitami, růstovou restrikcí plodu či nitroděložním odumřením plodu. Diferenciálně diagnosticky je důležité odlišit placentární mezenchymální dysplázii zejména od parciální hydatidózní moly. Cílem tohoto článku je poskytnout čtenářům základní přehled o morfologii a diferenciální diagnostice této patologické jednotky.
Klíčová slova:
placenta – diferenciální diagnostika – placentární mezenchymální dysplázie – PMD – cystické léze
Placentární mezenchymální dysplázie (PMD) je vzácná léze, která byla poprvé detailně popsána v roce 1991 (1). Tato jednotka je charakterizovaná placentomegalií, přítomností cystických útvarů v placentárním parenchymu a často i aneurysmatickým rozšířením a výrazným vinutím cév choriové plotny (2). PMD může imitovat parciální hydatidózní molu (PHM), na rozdíl od ní však postrádá jakýkoli maligní či invazivní potenciál a jejich vzájemné odlišení je tedy velmi důležité.
PMD se vyskytuje u méně než 1 % gravidit, přesná incidence však není známa. Vzhledem k tomu, že ne všichni patologové jsou s touto jednotkou dostatečně obeznámeni, lze předpokládat, že část případů zůstává nerozpoznána a nelze je tak zahrnout do rozsáhlejších statistik. Většina současných publikací cituje výsledky retrospektivní studie z roku 2002, která potvrdila diagnózu PMD v 7 případech (0,02 %) ze 30 758 vyšetřených placent (3). Druhá robustní studie z roku 2012 však uvádí incidenci daleko nižší, pouze 2 potvrzené případy (0,002 %) z 95 000 vyšetřených placent (4).
Až u poloviny případů PMD byla zaznamenána intrauterinní růstová restrikce plodu (IUGR), v literatuře byla dále popsána i vyšší frekvence nitroděložního odumření plodu v souvislosti s touto lézí (5). Přibližně ve 20 % případů bývá PMD asociována s Beckwith-Wiedemannovým syndromem (BWS) (6). Známá je i asociace s chromozomálními aberacemi, popsány byly případy jejího výskytu v rámci Patauova syndromu, Klinefelterova syndromu, nemolární triploidie (7,8) či delece 13q12.11 (9).
U plodů se mohou vyskytovat mezenchymální hamartomy jater (10, 11) a dále kožní a viscerální hemangiomy (12). V řadě případů však u plodů nejsou nalezeny žádné genetické ani strukturální abnormality. Plody bývají častěji ženského pohlaví (12,13).
U matek lze s vyšší frekvencí pozorovat gestační hypertenzi, preeklampsii, eklampsii a HELLP syndrom (6,14,15). Častěji také bývá přítomna elevace alfa-fetoproteinu (AFP) v mateřské krvi, zatímco hladina lidského choriového gonadotropinu (hCG) bývá normální nebo jen mírně zvýšená (16,17).
Příčina PMD není plně objasněna. Předpokládá se, že v řadě případů jde o důsledek androgenního biparentálního mozaicismu, kdy androgenní buněčná linie vznikla duplikací haploidního otcovského genomu. Vzhledem k tomu, že buněčná linie nesoucí karyotyp 46, YY není životaschopná, lze tímto způsobem vysvětlit vyšší výskyt plodů ženského pohlaví (18). Rozsah postižení placenty a plodu (a tedy i morfologické změny) závisí patrně na viabilitě a funkčnosti androgenního buněčného klonu. Abnormální buněčná linie bývá zpravidla omezena na vilózní mezenchym (stroma a cévy choriových klků). Vzácně však byly popsány i koncepty, v nichž byl prokázán současný výskyt několika buněčných linií – androgenní buněčné linie omezené na mezenchym choriových klků, odpovídající PMD, dále buněčné linie odpovídající kompletní hydatidózní mole (CHM), která byla omezená na trofoblast, a v neposlední řadě i biparentální buněčné linie, která byla reprezentována normálními choriovými klky (19-21). Další možnou příčinou PMD je paternální uniparentální disomie chromozomu 11 (oblast 11p15.5), která je zodpovědná za část případů BWS (22). Mezi charakteristické znaky plodů s tímto syndromem patří makrosomie, makroglosie, defekty přední stěny břišní (omfalokéla, umbilikální hernie, diastáza přímých svalů břišních) a predispozice ke vzniku nádorů (neuroblastom, rhabdomyosarkom, Wilmsův tumor, hepatoblastom, adrenokortikální karcinom a feochromocytom) (23).
MORFOLOGICKÝ NÁLEZ
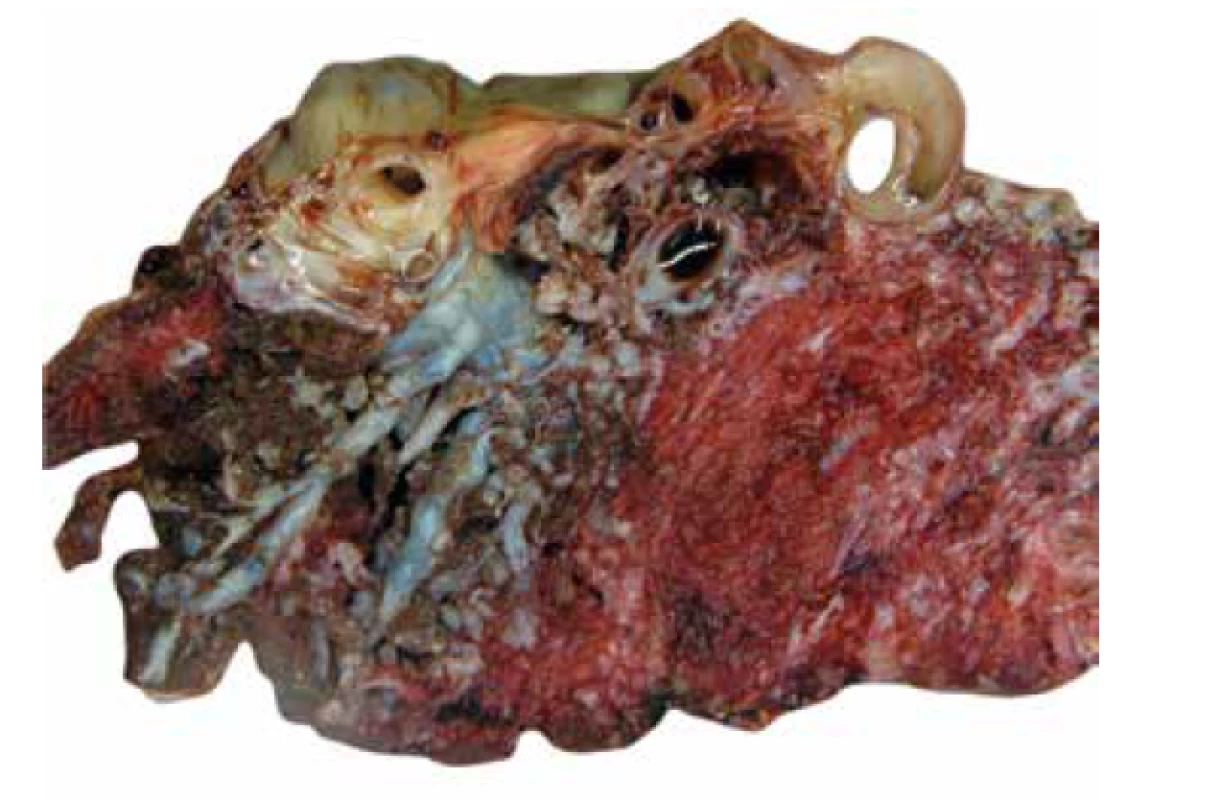
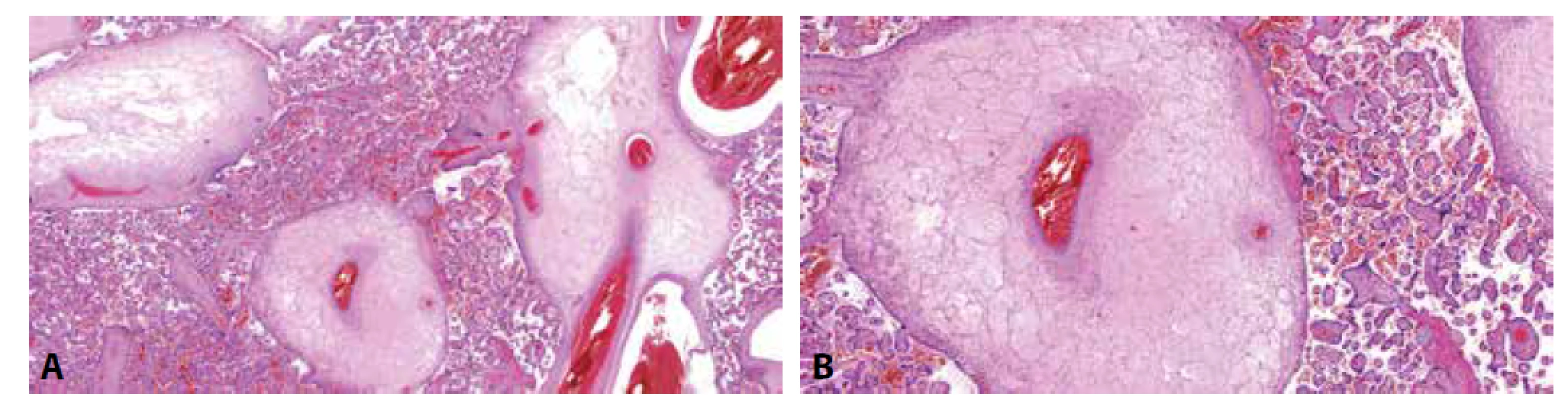
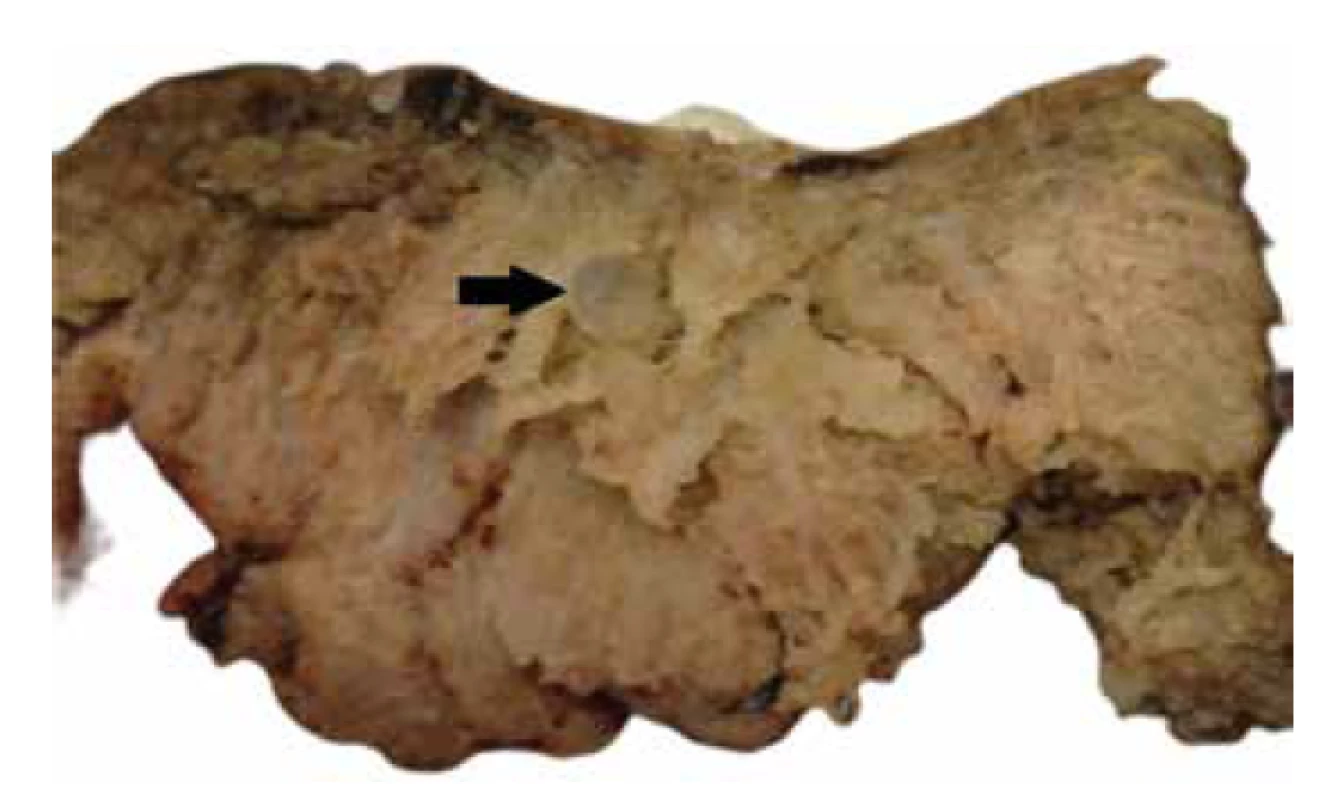
Placenta bývá objemná a její hmotnost často přesahuje průměrnou hmotnost vztaženou k příslušnému gestačnímu věku. Cévy choriové plotny bývají často výrazně vinuté, místy až aneurysmaticky rozšířené (obr. 1), vzácně byla popsána i jejich ruptura (2,24). Na řezu jsou v placentárním parenchymu přítomny disperzní cystické útvary různé velikosti (obr. 2), které odpovídají edematózním kmenovým klkům (obr. 3). Tyto cystické útvary lze v některých případech detekovat již při prenatálním ultrasonografickém vyšetření (USG) v podobě hypo/-anechogenních projasnění (14,25). Okolní parenchym je obvykle bez nápadností.
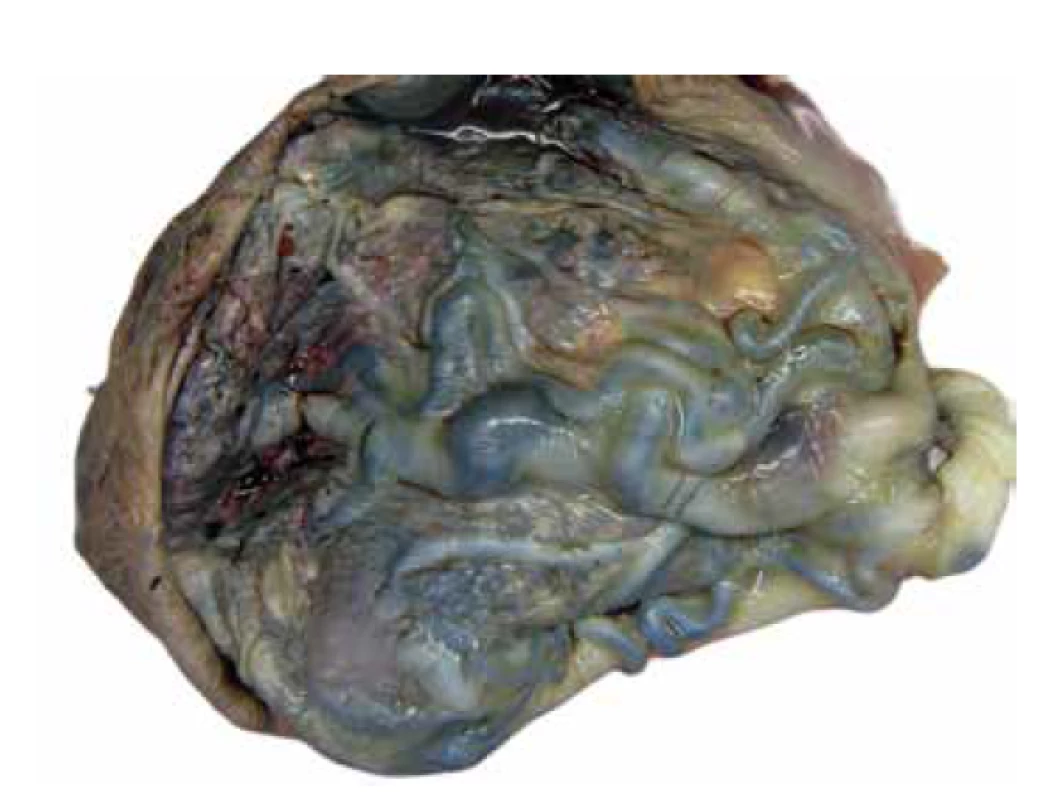

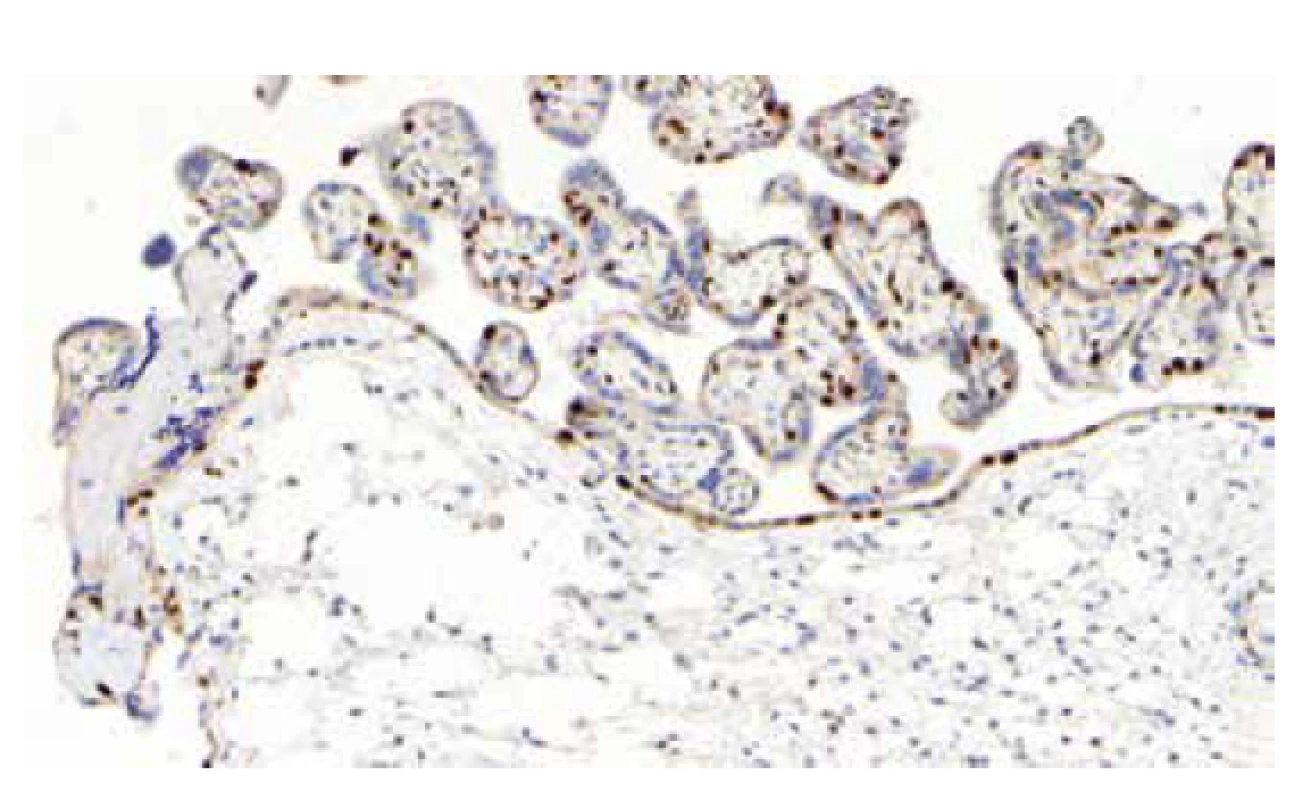
Histologicky nacházíme objemné myxoidně a cystické změněné kmenové klky s tlustostěnnými fetálními cévami (obr. 4). Distální choriové klky mají zpravidla normální morfologii. Hyperplázie trofoblastu není přítomna. Cévy choriové plotny jsou často dilatované, jejich stěna může být rovněž zesílená. Poměrně častým nálezem jsou trombózy cév kmenových klků a choriové plotny, jejichž důsledkem je rozvoj fetální vaskulární malperfúze (FVM) s přítomností avaskulárních choriových klků v povodí cévních uzávěrů (2). Imunohistochemicky lze v některých případech prokázat ztrátu exprese p57 v mezenchymálních buňkách stromatu postižených kmenových klků. Protein p57 je kódován paternálně imprintovaným genem CDKN1C, který je exprimován z mateřské alely (26). Negativní imunohistochemický průkaz p57 tedy svědčí pro paternální původ této buněčné linie. Exprese p57 ve vilózním trofoblastu (cytotrofoblastu) kmenových klků je (na rozdíl od CHM) zachována. Choriové klky v okolí vykazují normální expresi p57 (pozitivita p57 v buňkách stromatu a cytotrofoblastu) (12). Vzhledem k neuniformní distribuci androgenní buněčné populace však může být výsledek tohoto vyšetření značně variabilní (9,12,27), což lze doložit i vlastním pozorováním (obr. 5).
DIFERENCIÁLNÍ DIAGNOSTIKA
Do diferenciální diagnózy PMD vstupuje především molární gravidita, zejména PHM. Mola hydatidosa představuje patologický produkt koncepce vznikající při poruchách fertilizace. PHM vzniká oplozením haploidního vajíčka dvěma haploidními spermiemi, popř. jednou diploidní spermií. Výsledkem je triploidní konceptus (diandrická triploidie) sestávající z genetického materiálu obou rodičů, v němž je však přítomna nadpočetná chromozomální sada otcovského původu. Plod bývá přítomen, je však výrazně malformován. CHM představuje produkt diploidní, u kterého veškerý genetický materiál pochází od otce. CHM vzniká ve většině případů oplozením prázdného vajíčka jednou haploidní spermií a následnou endoreduplikací genetického materiálu (homozygotní monospermatická mola), nebo oplozením prázdného vajíčka dvěma haploidními spermiemi (heterozygotní dispermatická mola) (28,29). Plod nebývá přítomen, výjimku představují pouze vícečetná (dizygotní) těhotenství, u nichž jeden konceptus odpovídá CHM a druhý normálnímu plodu s normální placentou (30-32). Hydatidózní mola (PHM i CHM) je na rozdíl od PMD reprezentována postižením distálních choriových klků. V případě PHM lze v placentě detekovat dvě populace choriových klků – populaci normálních choriových klků a populaci tvořenou objemnějšími iregulárními choriovými klky s edémem stromatu, přítomností trofoblastických pseudoinkluzí a ložiskovou hyperplázií vilózního trofoblastu. CHM je v typických případech charakterizována difúzním edémem choriových klků, které makroskopicky připomínají bobule hroznového vína. Mikroskopicky lze prokázat výrazný edém choriových klků s tvorbou centrálních cisteren, cirkumferenciální hyperplázii vilózního trofoblastu a přítomnost cytologických atypií ve vilózním i extravilózním trofoblastu. Tento morfologický obraz je však charakteristický pouze pro delší dobu vyvíjející se koncepty. Časná CHM může být poměrně nenápadná. Choriové klky mají nepravidelné polypoidní či „květákovité“ kontury, jejich stroma bývá poměrně celulární, myxoidní, s nádechem do modra, a s patrným karyorrhektickým popraškem. Ve stromatu mohou být přítomny rudimentární cévní struktury. Hyperplázie trofoblastu je obvykle mírná (33,34). Imunohistochemicky lze v naprosté většině případů CHM prokázat ztrátu exprese p57 v cytotrofoblastu a v buňkách stromatu choriových klků. Výjimkou jsou pouze vzácné případy CHM, u nichž byla prokázána retence maternálního genetického materiálu (chromozomu 11, resp. chromozomů 6 a 11) (35,36). U PHM a nemolárních gravidit je přítomna jaderná pozitivita p57 v cytotrofoblastu a buňkách stromatu choriových klků. Spolehlivě lze tyto jednotky rozlišit pomocí molekulárně genetického vyšetření.
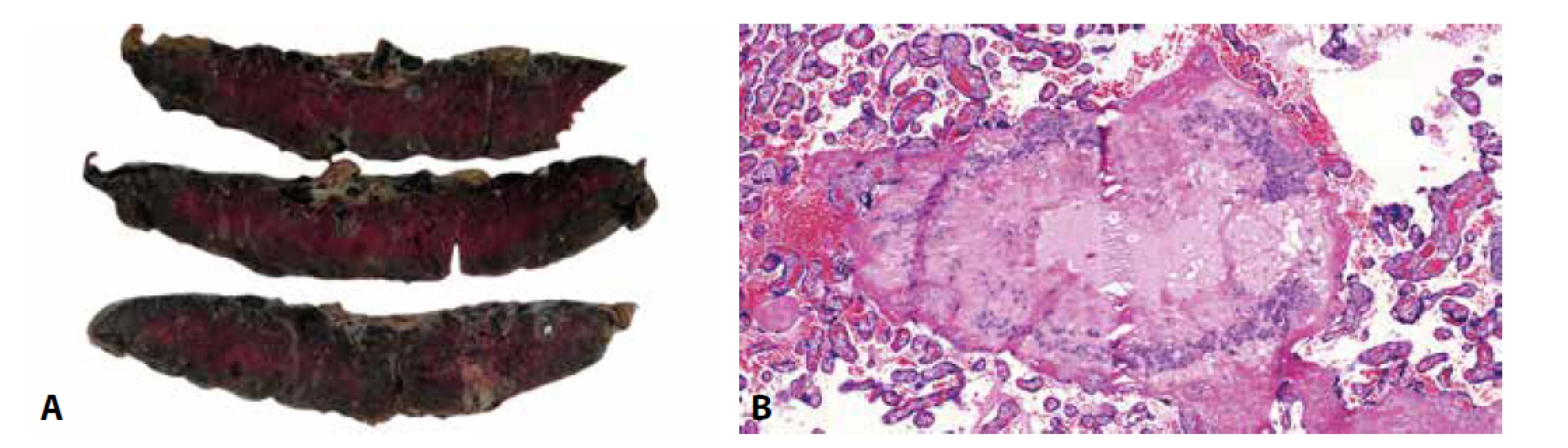
Další jednotku spadající do diferenciální diagnózy PMD představují hydropické aborty reprezentované především chromozomálními aneuploidiemi. Postiženy bývají, stejně jako v případě hydatidózní moly, distální choriové klky. Kromě hydropických změn mohou být zastiženy trofoblastické pseudoinkluze, výrazné zvětšení jader v izolovaných buňkách stromatu, hyperplázie trofoblastu, kalcifikace/mineralizace bazální membrány vilózního trofoblastu a „popraškové“ kalcifikace ve stromatu klků, nebo abnormální vaskularizace choriových klků nejčastěji ve formě nepravidelně se větvících či dilatovaných stromálních cév (37-42). Hydropické změny mohou být v některých případech patrné již při makroskopickém vyšetření (obr. 6).
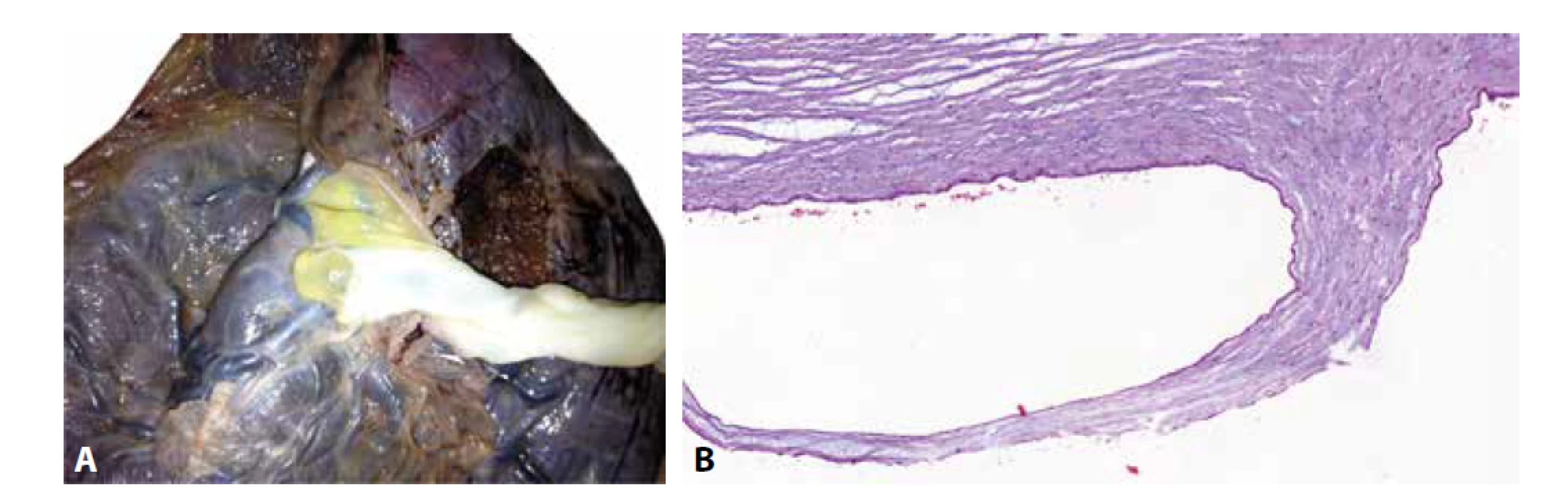
Další cystické změny, které mohou v některých případech makroskopicky napodobovat PMD, zahrnují amniální cysty a extravilózní trofoblastické cysty. Tyto léze obvykle představují náhodný nález a s vyšší frekvencí je lze pozorovat v placentách plodů porozených v termínu. Amniální cysty (obr. 7) jsou cystami inkluzními, jejichž výstelku tvoří jednovrstevný amniální epitel. Tyto cysty se nacházejí především v oblasti pupečníku a mohou dosahovat značné velikosti (43,44). Pokud se nacházejí v místě inzerce pupečníku k choriové plotně mohou napodobovat subchoriální trofoblastické cysty. Extravilózní trofoblastické cysty (obr. 8) představují skupinu cystických, nebo přesněji řečeno pseudocystických lézí, mezi něž řadíme sub-/choriální cysty, cysty ostrůvků extravilózního trofoblastu (EVT) a cysty deciduálních sept. Některé z těchto lézí (cysty v chorion laeve plodových obalů) bývají patrné pouze mikroskopicky, jiné mohou být viditelné již při makroskopickém vyšetření a mohou rovněž dosahovat poměrně velkých rozměrů. V centru těchto cystických lézí je přítomen eozinofilní bílkovinný materiál, který je obklopený vrstvou extravilózního trofoblastu (45). Zpravidla ve větších cystách lokalizovaných subchoriálně může být přítomen hemoragický obsah (46,47). Etiopatogeneze ale i klinický význam extravilózních trofoblastických cyst zůstávají nejasné (48). Předpokládá se, že v etiopatogenezi by mohla hrát roli intrauterinní hypoxie (49). Některé práce navíc poukazují na zvýšený výskyt těchto cystických lézí v souvislosti preeklampsií či maternálním diabetem (50,51). Podle současných doporučení by však izolovaný nález těchto morfologických změn neměl být hodnocen jako jednoznačný projev maternální vaskulární malperfúze (MVM). V kontextu s dalšími charakteristickými nálezy (akcelerovaná maturace choriových klků, distální vilózní hypoplázie, vilózní infarkty, deciduální arteriopatie, atd.) však může přítomnost těchto cystických lézí v placentě diagnózu MVM podpořit (48).
ZÁVĚR
Placentární mezenchymální dysplázie (PMD) je vzácná léze, která i přes svoji charakteristickou morfologii často uniká pozornosti klinických lékařů i patologů. Diferenciálně diagnosticky je důležité tuto jednotku odlišit především od molární gravidity. I přes to, že PMD postrádá jakýkoli maligní či invazivní potenciál, nelze opomenout její možnou asociaci se závažnými komplikacemi, mezi něž patří zejména fetální růstová restrikce a nitroděložní odumření plodu.
PODĚKOVÁNÍ
Práce byla podpořena grantem MŠMT SVV-2021-22 639.
PROHLÁŠENÍ
Autor článku prohlašuje, že v souvislosti s tématem, vznikem a publikací tohoto článku není ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou. Toto prohlášení se týká i všech spoluautorů.
Seznam použitých zkratek
AFP: alfa-fetoprotein
BWS: Beckwith-Wiedemannův syndrom
CHM: kompletní hydatidózní mola
EVT: extravilózní trofoblast
FVM: fetální vaskulární malperfúze
HEELP syndrom: hemolýza, elevace jaterních enzymů, trombocytopenie (Hemolysis, Elevated Liver enzymes, Low Platelets)
IUGR: intrauterinní růstová restrikce plodu (Intrauterine Growth Restriction)
MVM: maternální vaskulární malperfúze
PHM: parciální hydatidózní mola
PMD: placentární mezenchymální dysplázie
USG: ultrasonografické vyšetření
Adresa pro korespondenci:
MUDr. Magdaléna Daumová, Ph.D.
Šiklův ústav patologie LFP UK a FN Plzeň
Edvarda Beneše 1128/13, 305 99 Plzeň
tel.: 377 402 089
Sources
1. Moscoso G, Jauniaux E, Hustin J. Placental vascular anomaly with diffuse mesenchymal stem villous hyperplasia. A new clinico-pathological entity? Pathol Res Pract 1991; 187(2-3): 324-328.
2. Parveen Z, Tongson-Ignacio JE, Fraser CR, Killeen JL, Thompson KS. Placental mesenchymal dysplasia. Arch Pathol Lab Med 2007; 131(1): 131-137.
3. Arizawa M, Nakayama M. Suspected involvement of the X chromosome in placental mesenchymal dysplasia. Congenit Anom 2002; 42(4): 309-317.
4. Zeng X, Chen MF, Bureau YA, Brown R. Placental mesenchymal dysplasia and an estimation of the population incidence. Acta Obstet Gynecol Scand 2012; 91(6): 754-757.
5. Pham T, Steele J, Stayboldt C, Chan L, Benirschke K. Placental mesenchymal dysplasia is associated with high rates of intrauterine growth restriction and fetal demise: A report of 11 new cases and a review of the literature. Am J Clin Pathol 2006; 126(1): 67 - 78.
6. Woo GW, Rocha FG, Gaspar-Oishi M, Bartholomew ML, Thompson KS. Placental mesenchymal dysplasia. Am J Obstet Gynecol 2011; 205(6): e3-5.
7. Cohen MC, Roper EC, Sebire NJ, Stanek J, Anumba DO. Placental mesenchymal dysplasia associated with fetal aneuploidy. Prenat Diagn 2005; 25(3): 187-192.
8. Mungen E, Dundar O, Muhcu M, Haholu A, Tunca Y. Placental mesenchymal dysplasia associated with trisomy 13: sonographic findings. J Clin Ultrasound 2008; 36(7): 454-456.
9. Johnson SL, Walters-Sen LC, Stanek JW. Placental pathology in placental mesenchymal dysplasia with 13q12.11 deletion and a 25-week gestation female infant. American J Case Rep 2018; 19 : 369-373.
10. Francis B, Hallam L, Kecskes Z, Ellwood D, Croaker D, Kent A. Placental mesenchymal dysplasia associated with hepatic mesenchymal hamartoma in the newborn. Pediatr Dev Pathol 2007; 10(1): 50-54.
11. Lin J, Cole BL, Qin X, Zhang M, Kapur RP. Occult androgenetic-biparental mosaicism and sporadic hepatic mesenchymal hamartoma. Pediatr Dev Pathol 2011; 14(5): 360-369.
12. Faye-Petersen OM, Kapur RP. Placental mesenchymal dysplasia. Surg Pathol Clin 2013; 6(1): 127-151.
13. Ohira S, Ookubo N, Tanaka K, et al. Placental mesenchymal dysplasia: chronological observation of placental images during gestation and review of the literature. Gynecol Obstet Invest 2013; 75(4): 217-223.
14. Nayeri UA, West AB, Grossetta Nardini HK, Copel JA, Sfakianaki AK. Systematic review of sonographic findings of placental mesenchymal dysplasia and subsequent pregnancy outcome. Ultrasound Obstet Gynecol 2013; 41(4): 366-374.
15. Simeone S, Franchi C, Marchi L, et al. Management of placental mesenchymal dysplasia associated with fetal anemia and IUGR. Eur J Obstet Gynecol Reprod Biol 2015; 184 : 132-134.
16. Pawoo N, Heller DS. Placental mesenchymal dysplasia. Arch Pathol Lab Med 2014; 138(9): 1247-1249.
17. Himoto Y, Kido A, Minamiguchi S, et al. Prenatal differential diagnosis of complete hydatidiform mole with a twin live fetus and placental mesenchymal dysplasia by magnetic resonance imaging. J Obstet Gynaecol Res 2014; 40(7): 1894-1900.
18. Kaiser-Rogers KA, McFadden DE, Livasy CA, et al. Androgenetic/biparental mosaicism causes placental mesenchymal dysplasia. J Med Genet 2006; 43(2): 187-192.
19. Hoffner L, Dunn J, Esposito N, Macpherson T, Surti U. P57/KIP2 immunostaining and molecular cytogenetics: combined approach aids in diagnosis of morphologically challenging cases with molar phenotype and in detecting androgenetic cell lines in mosaic/chimeric conceptions. Hum Pathol 2008; 39(1): 63-72.
20. Lewis GH, DeScipio C, Murphy KM, et al. Characterization of androgenetic/biparental mosaic/chimeric conceptions, including those with a molar component: morphology, p57 immnohistochemistry, molecular genotyping, and risk of persistent gestational trophoblastic disease. Int J Gynecol Pathol 2013; 32(2): 199-214.
21. Linn RL, Minturn L, Yee LM, et al. Placental mesenchymal dysplasia without fetal development in a twin gestation: a case report and review of the spectrum of androgenetic biparental mosaicism. Pediatr Dev Pathol 2015; 18(2): 146-154.
22. Armes JE, McGown I, Williams M, et al. The placenta in Beckwith-Wiedemann syndrome: genotype-phenotype associations, excessive extravillous trophoblast and placental mesenchymal dysplasia. Pathology (Phila) 2012; 44(6): 519-527.
23. Duffy KA, Cielo CM, Cohen JL, et al. Characterization of the Beckwith-Wiedemann spectrum: Diagnosis and management. Am J Med Genet C Semin Med Genet 2019; 181(4): 693-708.
24. Umazume T, Kataoka S, Kamamuta K, et al. Placental mesenchymal dysplasia, a case of intrauterine sudden death of fetus with rupture of cirsoid periumbilical chorionic vessels. Diagn Pathol 2011; 6 : 38.
25. Psarris A, Sindos M, Kourtis P, et al. Placental mesenchymal dysplasia: ultrasound characteristics and diagnostic pitfalls. Ultrasound Int Open 2020; 6(1): e2-e3.
26. Matsuoka S, Thompson JS, Edwards MC, et al. Imprinting of the gene encoding a human cyclin-dependent kinase inhibitor, p57/KIP2, on chromosome 11p15. Proc Natl Acad Sci U S A 1996; 93(7): 3026-3030.
27. Voloshchuk IN, Barinova IV, Chechneva MA, et al. Placental mesenchymal dysplasia. Arkh Patol 2019; 81(4): 17-25.
28. Lindor NM, Ney JA, Gaffey TA, Jenkins RB, Thibodeau SN, Dewald GW. A genetic review of complete and partial hydatidiform moles and nonmolar triploidy. Mayo Clin Proc 1992; 67(8): 791-799.
29. Candelier JJ. The hydatidiform mole. Cell Adh Migr 2016; 10(1-2): 226-235.
30. McNally L, Rabban JT, Poder L, Chetty S, Ueda S, Chen LM. Differentiating complete hydatidiform mole and coexistent fetus and placental mesenchymal dysplasia: A series of 9 cases and review of the literature. Gynecol Oncol Rep 2021; 37 : 100811.
31. Steller MA, Genest DR, Bernstein MR, Lage JM, Goldstein DP, Berkowitz RS. Natural history of twin pregnancy with complete hydatidiform mole and coexisting fetus. Obstet Gynecol 1994; 83(1): 35-42.
32. Uemura N, Takai Y, Mikami Y, et al. Molecular cytogenetic analysis of a hydatidiform mole with coexistent fetus: a case report. J Med Case Rep 2019; 13(1): 256.
33. Keep D, Zaragoza MV, Hassold T, Redline RW. Very early complete hydatidiform mole. Hum Pathol 1996; 27(7): 708-713.
34. Sebire NJ, Fisher RA, Rees HC. Histopathological diagnosis of partial and complete hydatidiform mole in the first trimester of pregnancy. Pediatr Dev Pathol 2003; 6(1): 69-77.
35. Fisher RA, Nucci MR, Thaker HM, Weremowicz S, Genest DR, Castrillon DH. Complete hydatidiform mole retaining a chromosome 11 of maternal origin: molecular genetic analysis of a case. Mod Pathol 2004; 17(9): 1155 - 1160.
36. McConnell TG, Norris-Kirby A, Hagenkord JM, Ronnett BM, Murphy KM. Complete hydatidiform mole with retained maternal chromosomes 6 and 11. Am J Surg Pathol 2009; 33(9): 1409-1415.
37. Kliman HJ, Segel L. The placenta may predict the baby. J Theor Biol 2003; 225(1): 143-145.
38. Redline RW, Zaragoza M, Hassold T. Prevalence of developmental and inflammatory lesions in nonmolar first-trimester spontaneous abortions. Hum Pathol 1999; 30(1): 93-100.
39. Redline RW, Hassold T, Zaragoza MV. Prevalence of the partial molar phenotype in triploidy of maternal and paternal origin. Hum Pathol 1998; 29(5): 505-511.
40. Redline RW, Hassold T, Zaragoza M. Determinants of villous trophoblastic hyperplasia in spontaneous abortions. Mod Pathol 1998; 11(8): 762-768.
41. Ornoy A, Salamon-Arnon J, Ben-Zur Z, Kohn G. Placental findings in spontaneous abortions and stillbirths. Teratology 1981; 24(3): 243-252.
42. Pierce BT, Martin LS, Hume RF, Jr., Calhoun BC, Muir-Padilla J, Salafia CM. Relationship between the extent of histologic villous mineralization and stillbirth in aneuploid and euploid fetuses. J Soc Gynecol Investig 2002; 9(5): 290-293.
43. Angelico G, Spadola S, Ieni A, et al. Hemangioma of the umbilical cord with associated amnionic inclusion cyst: two uncommon entities occurring simultaneously. Pathologica 2019; 111(1): 13-17.
44. Jacques SM, Qureshi F. Hemangioma of the umbilical cord with amnionic epithelial inclusion cyst. Fetal Pediatr Pathol 2013; 32(3): 235 - 239.
45. Wasmoen TL, Coulam CB, Benirschke K, Gleich GJ. Association of immunoreactive eosinophil major basic protein with placental septa and cysts. Am J Obstet Gynecol 1991; 165(2): 416-420.
46. Hong SC, Yoo SW, Kim T, et al. Prenatal diagnosis of a large subchorionic placental cyst with intracystic hematomas. A case report. Fetal Diagn Ther 2007; 22(4): 259-263.
47. Bonasoni MP, Comitini G, Blasi I, Cavazza A, Aguzzoli L. Large subchorionic cyst located at umbilical cord insertion with vascular displacing and intracystic hemorrhage/hematoma: a case report. Fetal Pediatr Pathol 2020; In press.
48. Khong TY, Mooney EE, Ariel I, et al. Sampling and definitions of placental lesions: Amsterdam Placental Workshop Group consensus statement. Arch Pathol Lab Med 2016; 140(7): 698-713.
49. Redline RW, Patterson P. Pre-eclampsia is associated with an excess of proliferative immature intermediate trophoblast. Hum Pathol 1995; 26(6): 594-600.
50. Stanek J. Placental membrane and placental disc microscopic chorionic cysts share similar clinicopathologic associations. Pediatr Dev Pathol 2011; 14(1): 1-9.
51. Stanek J. Placental membrane laminar necrosis and chorionic microcysts. Pediatr Dev Pathol 2012; 15(6): 514-516.
Labels
Anatomical pathology Forensic medical examiner ToxicologyArticle was published in
Czecho-Slovak Pathology

2021 Issue 4
-
All articles in this issue
- Patologie placenty – nové a méně známé jednotky
- Placenta je tichým svědkem gravidity, jen je potřeba ho donutit mluvit
- 'NEUROPATOLOGIE
- 'HEPATOPATOLOGIE
- 'PULMOPATOLOGIE
- 'ORTOPEDICKÁ PATOLOGIE
- 'PATOLOGIE GIT
- 'PATOLOGIE ORL OBLASTI
- 'GYNEKOPATOLOGIE
- 'UROPATOLOGIE
- 'KARDIOPATOLOGIE
- 'CYTODIAGNOSTIKA
- Morphologic findings in placenta associated with SARS-CoV-2 infection
- Placental mesenchymal dysplasia – morphology and differential diagnosis
- Chronic non-infectious inflammations of the placenta
- 'HEMATOPATOLOGIE
- Pathologia mutans
- Jaká je vaše diagnóza?
- Professor Jaroslav Hlava and his successors – a remembrance on the occasion of the 100th anniversary of the opening of the Hlava institute
- 100th anniversary of the opening of the Hlava institute
- Jaká je vaše diagnóza? Odpověď: Karcinom prsu metastazující do placenty
- Prof. MUDr. František Fakan, CSc. in memoriam
- Non-immune hydrops fetalis associated with two umbilical cord hemangiomas and vascular malformation of the transverse mesocolon. Case report
- Subcutaneous symplastic haemangioma after radiotherapy: A case report
- Czecho-Slovak Pathology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Chronic non-infectious inflammations of the placenta
- Morphologic findings in placenta associated with SARS-CoV-2 infection
- Patologie placenty – nové a méně známé jednotky
- Placental mesenchymal dysplasia – morphology and differential diagnosis
