Novinky ve WHO klasifikaci nádorů centrálního nervového systému 2021
News in WHO 2021 classification of tumours of the central nervous system
The aim of the presented communication is to clearly inform the general professional public about the newly approved modifications in this classification, including the newly approved types of tumours. A significant change is the new grading system for these tumours, including the innovative involvement of tumour profiling at the molecular level in the system for determining the degree of tumour differentiation and the application of the principle of integrated diagnostics, i. e. the synthesis of available histopathological and molecular findings in CNS tumors.
Keywords:
Molecular pathology – WHO classification – grading – tumours of the central nervous system
Authors:
Tomáš Jirásek 1; Lenka Krsková 2; Iva Dolinová 3; Marián Švajdler 4; Aleš Vícha 5; Markéta Hermanová 6; Josef Zámečník 2
Authors‘ workplace:
Oddělení patologie, Centrum PATOS, Krajská nemocnice Liberec, a. s.
1; Ústav patologie a molekulární medicíny 2. LF UK a Fakultní nemocnice Motol, Praha
2; Oddělení molekulární genetiky a diagnostiky, Centrum PATOS, Krajská nemocnice Liberec, a. s.
3; Šiklův ústav patologie, Lékařská fakulta Univerzity Karlovy v Plzni a Fakultní nemocnice Plzeň a Bioptická laboratoř, s. r. o., Plzeň
4; Klinika dětské hematologie a onkologie 2. LF UK a Fakultní nemocnice Motol, Praha
5; I. ústav patologie, LF MU a Fakultní nemocnice u sv. Anny, Brno
6
Published in:
Čes.-slov. Patol., 58, 2022, No. 3, p. 126-134
Category:
Reviews Article
Overview
Cílem předloženého sdělení je přehledným způsobem seznámit širší odbornou veřejnost s nově schválenými úpravami ve WHO 2021 klasifikaci nádorů centrálního nervového systému, včetně nově schválených typů nádorů. Významnou změnou je i nový systém gradingu těchto nádorů, včetně inovativního zapojení profilování nádorů na molekulární úrovni právě do systému stanovení stupně diferenciace nádoru a uplatnění principu tzv. integrované diagnostiky, tedy syntézy dostupných histopatologických a molekulárních nálezů u nádorů CNS.
Klíčová slova:
WHO klasifikace – molekulární patologie – grading – nádory centrálního nervového systému
Páté vydání WHO klasifikace nádorů centrálního nervového systému (1) představuje již šestou verzi tohoto mezinárodního standardu pro klasifikaci nádorů mozku a míchy, které postupně vychází v rozmezí let 1979–2016 (2-6). Páté vydání navazuje a aktualizuje vydání čtvrté z roku 2016 (6) a následná doporučení skupiny cIMPACT-NOW (celým názvem the Consortium to Inform Molecular and Practical Approaches to CNS Tumor Taxonomy – Not Official WHO) (7- 18). Toto vydání stále zůstává ukotvené v léty prověřených základních diagnostických principech a metodách, jakými jsou histologie a imunohistochemie, nově však do konkrétních diagnostických postupů přináší a plně integruje prvek diagnostiky molekulární, bez které již nelze některé jednotky vlastně korektně diagnostikovat. Tomu odpovídá i změna způsobu reportování histologických a molekulárních nálezů u těchto nádorů a formální úpravy ve stanovení stupně jejich diferenciace („grading“). V neposlední řadě přináší tato klasifikace některé nové nádorové jednotky (viz tabulka č. 1) (1,18).

ZMĚNY TAXONOMIE A TERMINOLOGIE
Nová WHO klasifikace z velké části zachovává původní dělení nádorů mozku a míchy do několika skupin, které dále nově dělí dle převažujících histogenetických, molekulárních a zčásti i klinických charakteristik na další podskupiny; zde je nutné zdůraznit, že až na výjimky WHO klasifikace stále obligatorně nestanovuje metody, jakými má být přítomnost konkrétního biomarkeru v nádorové tkáni prokázána a volbu často ponechává na rozhodnutí diagnostikující laboratoře s přihlédnutím k charakteru konkrétního materiálu, ze kterého je daná diagnostika realizována. Termín „typ“ v této souvislosti nahrazuje termín „jednotka“ a termín „podtyp“ termín „varianta“ u konkrétních nádorů (18).
Změny v názvosloví 5. vydání WHO klasifikace nádorů CNS se řídí doporučeními skupiny cIMPACT-NOW z roku 2019 (14), důraz je kladen na zjednodušení a větší konzistentnost. V minulosti měly některé názvy nádorů anatomické modifikátory dle místa (např. chordoidní gliom třetí komory), zatímco jiné nikoli, přestože se vyskytovaly ve specifických lokalitách (např. meduloblastom). Některé zahrnovaly genetické modifikátory (např. glioblastom, IDH-wildtype), zatímco jiné ne, přestože vykazovaly specifické genetické změny (např. atypický teratoidní/rhabdoidní tumor). Jména nádorů v nové klasifikaci byla proto co nejvíce zjednodušena a do klasifikace byly začleněny pouze klinicky užitečné modifikátory (lokalizace nádoru, věk pacienta, genetické modifikátory). Důležité je, že u nádorů s vysoce charakteristickými rysy (např. že chordoidní gliomy se vyskytují ve třetí komoře), jsou tyto zahrnuty v definicích nádorů, i když již nejsou přímo součástí názvu nádoru (viz tabulka č. 2).
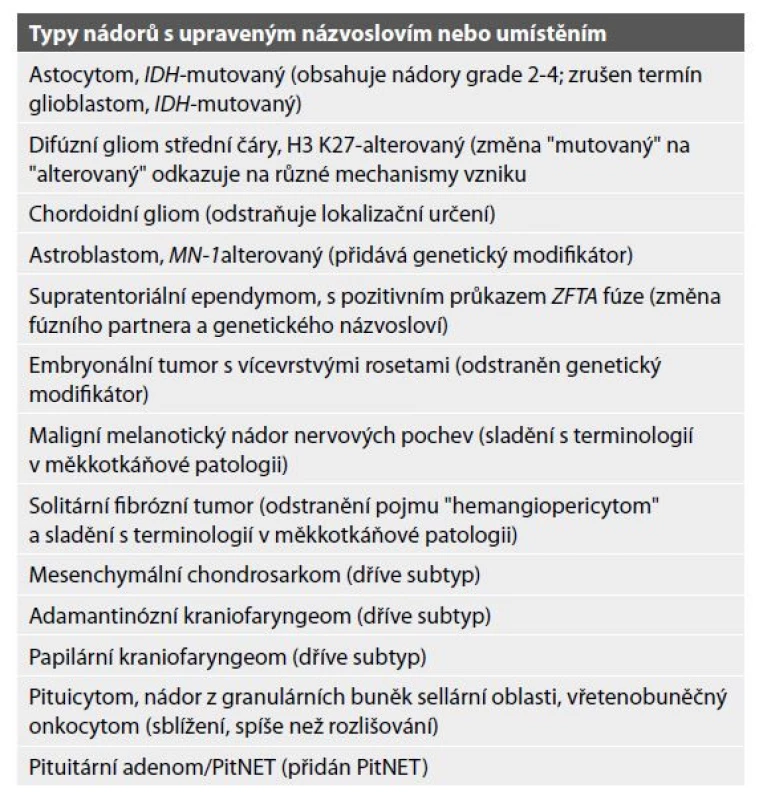
Navíc názvy nádorů někdy odrážejí morfologické vlastnosti a funkce, které nejsou výrazně přítomné ve všech případech; například některé myxopapilární ependymomy jsou minimálně myxoidní a některé nemusí být ani zjevně papilární. Podobně může být xantomatózní změna omezena na malé frakce buněk v pleomorfních xanthoastrocytomech. Termíny mohou také odrážet historické souvislosti, které se staly běžným zvykem; například, ačkoli meduloblast nebyl identifikován ve vývojových studiích, termín meduloblastom je hluboce historicky zakořeněn v terminologii nádorů. Případný nový/jiný název by mohl být rušivý pro klinickou péči a vědecké experimenty, které se opírají o předchozí údaje, stejně jako o epidemiologické studie. Se změnou gradingu „v rámci“ typu nádoru (viz níže), došlo k odstranění modifikačních adjektiv jako „anaplastický“; dříve užívané názvy jako „anaplastický astrocytom“ a „anaplastický oligodendrogliom“ se proto v této klasifikaci již neobjevují (1,18). Další formální změnou je úprava nomenklatury změn genomu dle nově platných standardů HUGO Gene Nomenclature Committee (HGNC) (https://www. genenames.org/) (20,21).
GRADING
Grading nádorů CNS se po mnoho desetiletí lišil od klasifikace jiných, non-CNS novotvarů, protože nádory mozku a míchy využívaly do jisté míry unifikovaný systém gradingu aplikovaný na různé typy nádorů (22). Nová WHO klasifikace přiblížila systém gradingu nádorů CNS blíže tomu, jak se grading provádí u non-CNS novotvarů, ale zachovala si přece jenom některé klíčové aspekty tradičního gradingu nádorů CNS, neboť dosavadní systém je hluboce ukotven v neuroonkologické praxi. V nové WHO klasifikaci se změnily dva specifické aspekty gradingu: používají se arabské číslice (oproti římskému číslování v předchozí klasifikaci) a grading novotvarů je hodnocen v rámci typů (spíše než napříč různými typy nádorů, jak tomu bylo dříve) (14). Protože se však grading nádorů CNS stále liší od gradingu nádorů jiných orgánových soustav, nová WHO klasifikace schvaluje používání termínu „CNS WHO grade“ při samotném gradingu.
Číslování arabskými číslicemi
Formální vyjádření gradingu u nádorů CNS bylo tradičně psáno římskými číslicemi. Nicméně páté vydání WHO klasifikace nádorů CNS zdůrazňuje jednotnější přístup ke klasifikaci nádorů a třídění a preferuje používání arabských číslic, jako je tomu ostatně v současnosti u všech dalších orgánových systémů. Možné nebezpečí používání římských číslic v gradingu nádorů spočívá v možnosti chyby, stupeň „II“ a „III“ nebo „III“ a „IV“ lze poměrně snadno vzájemně zaměnit a neodhalená typografická chyba by mohla mít klinické následky. To bylo méně pravděpodobné, dokud měl každý typ nádoru navíc i jiný název, např. „anaplastický“ u mnoha nádorů třídy «III.»; to ale s novou klasifikací již neplatí (1).
Grading v rámci typu nádoru
Nádory CNS tradičně měly WHO grade přidělený každé jednotce a stupně byly aplikovány napříč různými subjekty (22). Například v předchozích klasifikacích, pokud byl nádor hodnocen jako anaplastický astrocytom, byl automaticky přidělen k WHO stupni III a neexistovala možnost stanovit anaplastickému astrocytomu jiný grade. Obdobně anaplastický (maligní) meningiom měl také přidělen WHO grade III (6). Nádory jako meningiomy a astrocytomy spolu biologicky nesouvisejí, ačkoli bylo obecně očekáváno, že obě kategorie budou mít zhruba podobné biologické vlastnosti i délku přežití. Ale ty byly jen zhruba podobné, klinickým průběh anaplastického astrocytomu byl často docela odlišný od anaplastického (maligního) meningiomu. Tento přístup tak koreluje vlastní grading na idealizované klinickému chování. Například tumory WHO třídy I byly léčitelné, pokud byly chirurgicky odstranitelné; na druhé straně spektra byly vysoce maligní nádory stupně IV, vedoucí k smrti v relativně krátkém časovém období při nepřítomnosti účinné terapie. Tento přístup ke gradingu nádorů CNS se liší od systémů používaných u nádorů jiných orgánových systémů, např. u nádorů prsu, které se gradují každý dle vlastního systému gradingu v rámci typu nádoru.
Již v předchozí klasifikaci nádorů CNS z roku 2016 byl tento přístup uplatněn u solitárního fibrózního tumoru / hemangiopericytomu; nová WHO klasifikace jej zavádí v dalších kategoriích. Tato změna byla provedena z několika důvodů: jednak poskytuje větší flexibilitu gradingu ve vztahu k typu nádoru, dále vede ke zdůraznění biologické podobnosti v rámci typů nádorů spíše než jejich přibližného klinického chování a v neposlední řadě umožňuje zohlednit individuální změny v gradingu nádorů, např. měkkých tkání, které také mohou postihovat CNS.
„Klinicko-patologický“ grading
Protože klasifikace nádorů CNS byla po desetiletí spojena s celkovým očekávaným klinicko-biologickým chováním, nová WHO klasifikace si obecně zachovala rozsahy škály gradingu používané pro jednotlivé typy nádorů jako v předchozích vydáních. V této souvislosti IDH mutované astrocytomy mohou dosahovat grade 2-4 a meningiomy grade 1-3; alespoň prozatím tedy neexistuje ani IDH-mutovaný astrocytom grade 1, ani meningiom grade 4. Vzhledem k tomu, že nádory jsou klasifikovány na základě jejich očekávané přirozené (míněno moderní léčbou neovlivněné) historie, mohou být některé zhoubné nádory (např. meduloblastom, germinom) gradovány stupněm 4 dle WHO, i když jsou nyní spojeny díky účinné léčbě s příznivou dobou přežití, zejména v případě určitých molekulárně definovaných typů, jako je např. WNT-aktivovaný meduloblastom. Výše uvedený přístup ke gradingu je kompromisem mezi původní základní prognostickou korelací založenou na biologické povaze nádorů v době, kdy terapeutické možnosti byly ve srovnání se současností málo účinné. Dnes je již odhad „původní“ biologické povahy těchto nádorů téměř nemožný, protože prakticky všichni pacienti dostávají více či méně účinnou terapii, která často ovlivňuje jejich celkové přežití (23). Například WNT-aktivovaný meduloblastom je embryonální nádor, charakteristický svým agresivním chováním, pokud je ponechán neléčený, ale pokud je u tohoto nádoru aplikována léčba, která odpovídá moderním terapeutickým režimům, tak téměř všichni pacienti dlouhodobě přežívají. Označit takový nádor jako WHO grade 4 (ekvivalentní mnoha neléčitelným dětským mozkovým nádorům s tristními léčebnými výsledky), potenciálně hrozící nabudit falešný pocit nepříznivé klinické prognózy onemocnění. Naopak, označení tohoto nádoru jako WHO grade 1 na základě jeho dobré léčebné prognózy by naopak mohlo vyvolat falešný dojem, že se jedná o nádor biologicky přirozeně benigní povahy, což také neodpovídá skutečnosti (18).
Kombinovaný histologický a molekulární grading
Klasifikace nádorů CNS byla tradičně založena výhradně na jejich histologických vlastnostech, ale přítomnost konkrétních molekulárních znaků může poskytovat užitečné prognostické informace. Z tohoto důvodu jsou nyní molekulární parametry přidány jako biomarkery gradingu a pro další odhad prognózy v rámci více typů nádorů. Příklady v nové WHO klasifikaci zahrnují CDKN2A/B homozygotní deleci u IDH-mutovaných astrocytomů, stejně jako mutace promotoru TERT, amplifikace EGFR a změny počtu kopií chromozomů 7 a 10 (+7/-10) u difuzních astrocytomů IDH-wildtype. Molekulární grading tedy umožňuje zařadit jako glioblastom, IDH-wildtype, grade 4 dle WHO i ty případy, které se jinak jeví histologicky jako gliomy nižšího stupně. Jinými slovy, molekulární parametr může někdy změnit grade nádoru, který by jinak histologicky vykazoval jiný, obvykle nižší stupeň. Změny gradingu jsou demonstrovány v tabulce č. 3.

NOS (NOT OTHERWISE SPECIFIED) A NEC (NOT ELSEWHERE CLASSIFIED)
Použití přípon NOS a NEC umožňují snadné oddělení standardních, dobře charakterizovaných WHO jednotek od těch diagnóz (12,13), které jsou výsledkem buď nedostatku nezbytných diagnostických (např. molekulárních) informací, nebo nediagnostických (tj. nedostatek znaků umožňujících zařazení nádoru dle konkrétního typu dle WHO), případně pro negativní výsledky. Přidání přípony NOS naznačuje, že diagnostické informace (histologické nebo molekulární), nutné k přiřazení konkrétní diagnózy WHO nejsou k dispozici a poskytuje upozornění pro onkologa, že molekulární zpracování nebylo provedeno, nebo technicky selhalo. Přípona NEC na druhé straně naznačuje, že nutné diagnostické testování bylo úspěšně provedeno, ale jeho výsledky neumožňují jednoznačně diagnózu WHO stanovit; například pokud existuje nesoulad mezi klinickými, histologickými, imunohistochemickými a/nebo genetickými vlastnostmi léze. NEC diagnózy jsou to, co patologové nazvali „popisnými diagnózami“. V tomto ohledu označení NEC poskytuje onkologovi upozornění, že i přes adekvátní patologické vyšetření nádor nelze zařadit jako standardní diagnózu WHO. Obě zkratky lze s výhodou využít v rámci „vrstvených“ integrovaných zpráv (18,24).
NOVÉ DIAGNOSTICKÉ METODY
V průběhu času přibyly ke klasickým metodám histologickým i další postupy. Jedná se o imunohistochemii, metody in-situ hybridizace a metody molekulárně patologické (Sangerovo sekvenování, metody MLPA – multiplex ligation-dependent probe amplification a nejnověji i metodiky masivního paralelního sekvenování nové generace NGS – next generation sequencing). Výsledky těchto metod byly již zavzaty do WHO klasifikací předchozích, včetně té poslední z roku 2016 (6). Během poslední dekády došlo k rozšíření další molekulární metodiky, využívané v profilování nádorů CNS, konkrétně se jedná o tzv. metylační profilování (25-28). Některé jednotky (zejména meduloblastomy a ependymomy zadní jámy) bez využití metylačního profilování už prakticky nelze správně diagnostikovat a zařadit. Zájemce o detailnější informace k těmto metodám odkazujeme na samostatné sdělení v tomto čísle časopisu.
INTEGROVANÁ A „VRSTVENÁ“ DIAGNOSTIKA
Vzhledem k rostoucímu významu molekulární informace v klasifikaci, diagnóze a diagnostice nádorů CNS potřebují výsledné zprávy kombinovat různé typy dat do jedné „integrované“ diagnózy. Nová WHO klasifikace zavádí právě takový formát reportování výsledků vyšetření a reflektuje tak platná mezinárodní doporučení (1,24,29). Výsledné zprávy obsahují integrovanou diagnózu nahoře, níže pak následují další vrstvy, které zobrazují histologické, molekulární a další klíčové typy informací (viz tabulka č. 4). Pro některé typy nádorů jsou diagnostické termíny uvedené v nové WHO klasifikaci obecné. V těchto případech právě kombinace diagnostických znaků sestávajících z kombinace relevantních histologických a molekulárních abnormalit vede ke specifické „integrované“ diagnóze. Výše uvedené přístupy jsou popsány pro každou z nádorových skupin a jsou stejné jako postupy, kterými již WHO klasifikace z roku 2016 třídila meduloblastomy (6) a které cIMPACT-NOW Update 4 doporučuje pro skupinu pediatrických low-grade difuzních gliomů (10): integrovaná diagnostika optimálně kombinuje termíny ze seznamů histologicky definovaných a geneticky definovaných nádorů. Přestože každý ze seznamů může obsahovat mnoho položek, některé kombinace jsou častější než ostatní.

V nové WHO klasifikaci je patrná snaha předložit základní a fakultativní diagnostická kritéria pro každý typ nádoru, většinou v tabulární formě. Důvodem je snaha usnadnit uživateli zhodnocení, zda jsou přítomna klíčová diagnostická kritéria pro konkrétní nádor a zda je kombinace těchto kritérií dostatečná pro danou diagnózu. Základní diagnostická kritéria jsou považována za vlastnosti, které nádor musí mít, ač konkrétní kombinace se mohou lišit, tj. ne vždy je nutné splnit všechna pro diagnostiku předepsaná kritéria. Naproti tomu fakultativní kritéria spadají do kategorie „je hezké je mít“, tj. jednoznačně podporují diagnózu, ale samy o sobě nejsou potřeba (1,18).
SPECIFICKÉ ZMĚNY
Tabulka č. 1. shrnuje soupis všech nových jednotek v nové WHO klasifikaci nádorů CNS 2021, včetně tří jednotek provizorních. Změny detailně diskutujeme níže v textu v rámci jednotlivých skupin nádorů.
GLIOMY, GLIONEURONÁLNÍ NÁDORY A NEURONÁLNÍ NÁDORY
Nová WHO klasifikace nově dělí gliomy, glioneuronální nádory a neuronální nádory do 6 různých rodin:
1. difúzní gliomy dospělého typu (sem patří většina primárních mozkových nádorů v neuroonkologické praxi u dospělých, např. glioblastom, IDH-wildtype)
2. difúzní gliomy low-grade dětského typu (očekávaná je u nich obecně dobrá prognóza)
3. difúzní gliomy high-grade dětského typu (očekává se, že se budou chovat agresivně)
4. ohraničené astrocytární gliomy („ohraničené“ s odkazem na jejich kompaktnější růstový vzor, např. ve srovnání s „difúzními“ nádory ze skupiny 1, 2 a 3)
5. glioneuronální a neuronální nádory (různá skupina nádorů s neuronální diferenciací)
6. ependymomy (nyní klasifikované podle lokalizace a histologických a molekulárních znaků).
Nádory choroidního plexu, s jejich výraznými epiteliálními charakteristikami, jsou odděleny nově do samostatné kategorie mimo tuto skupinu. Přibylo celkově čtrnáct nově uznaných typů nádorů v této skupině. Pro některé z nich – zejména pro difúzní high grade gliom dětského typu, H3-wildtype a IDH-wildtype, a pro difuzní low grade gliom, s alterovanou MAPK dráhou – je pro možnost dosažení správné diagnózy nutná integrace histologického vzhledu a molekulárních rysů těchto nádorů, a tato data je nejlépe reportovat ve shora zmíněném integrovaném a vrstveném formátu. Nová klasifikace dále představuje určité menší úpravy v terminologickém značení již existujících typů nádorů, např. difuzní gliom střední čáry je nyní označen jako „H3 K27-alterovaný“ namísto „H3 K27M-mutovaný“, aby bylo možno zahrnout i jejich alternativní molekulární patogenezi (30). Název astroblastom byl změněn a blíže specifikován jako „MN1-alterovaný“, aby poskytla prostor pro bližší zaměření této jednotky; do budoucna lze očekávat další úpravy a zpřesnění parametrů tohoto typu nádoru. Pro další typy nádorů byly zahrnuty změny v nomenklatuře týkající se genetických a lokalizačních modifikátorů při dodržení doporučení aktualizace cIMPACT-NOW Update 6 a 7 (14,16). Téměř všechny nově rozpoznané typy nádorů lze diagnostikovat na základě rozdělení difuzních gliomů na dospělý typ a dětský typ (18). Nová WHO klasifikace uznává klinické a molekulární rozdíly mezi těmi difúzními gliomy, které se primárně vyskytují u dospělých (tzv. „dospělý typ“) a těch, které se vyskytují především u dětí (označované jako „dětský typ“). Všimněte si použití podtržených slov „primárně“ a „především“ v poslední větě, někdy se mohou vyskytnout i nádory dětského typu u dospělých, zejména mladých dospělých, a naopak nádory dospělého typu se mohou vzácněji objevit i u dětí. Rozdělení klasifikace difúzních gliomů na dospělý a dětský typ by mělo být krokem vpřed směřujícím k jasnému oddělení těchto prognosticky a biologicky odlišných skupin nádorů. Potřeba učinit takové rozdělení byla zvažována již delší dobu, ale teprve objasnění molekulárních rozdílů v obou skupinách nádorů umožnilo tento krok provést; důsledkem by mělo být zlepšení péče o děti i dospělé s těmito nádory CNS.
Zjednodušení klasifikace běžných difuzních gliomů dospělého typu
V předchozí WHO klasifikaci nádorů CNS z roku 2016 byly „běžné“ difuzní gliomy dospělých rozděleny do 15 kategorií (6), především proto, že různým nádorovým jednotkám byly přiděleny různé stupně v rámci gradingu (např. anaplastický oligodendrogliom byl považován za jiný typ nádoru než oligodendrogliom) a také proto, že NOS označení byla přidělena odlišným entitám (např. difuzní astrocytom, NOS). Nová WHO klasifikace naproti tomu obsahuje v této kategorii pouze 3 typy nádorů: astrocytom, IDH-mutovaný; oligodendrogliom, IDH-mutovaný a 1p/19q-kodeletovaný a glioblastom, IDH-wildtype. Důvody, které vedly ke změně klasifikace, vyplývají jednak z mnohem přesnější definice používání terminologie NOS a NEC (viz výše), dále z uznání hodnoty molekulární diagnostiky v procesu přesnějšího zařazování špatně definovaných nádorových jednotek (např. oligoastrocytomy nebo IDH-wildtype low-grade difuzní astrocytární tumory) k objektivněji definovanému typu nádoru; v neposlední řadě pak použití gradingu v rámci typu nádoru (14,15), spíše než vyžadování, aby každý grade měl samostatný název (viz výše). Některé dříve samostatně stojící klasické podtypy (např. gliosarkom, či velkobuněčný glioblastom) již nejsou uvedeny separátně, ale jsou diskutovány v příslušných kapitolách.
Nomenklatura a klasifikace běžných difuzních astrocytárních gliomů dospělého typu
V předchozí klasifikaci WHO z roku 2016 byly IDH-mutované difúzní astrocytární nádory přiřazeny ke třem různým typům nádorů (difuzní astrocytom, anaplastický astrocytom a glioblastom), v závislosti na histologickém obrazu nádoru. V současné klasifikaci jsou však všechny IDH-mutované difúzní astrocytární tumory považovány za nádory jediného typu (astrocytom, IDH-mutovaný) a jsou pak klasifikovány jako nádory WHO grade 2, 3 nebo 4. Navíc již není grading založen zcela na histologickém obrazu afekce, protože přítomnost homozygotní delece CDKN2A/B má za následek zařazení takového nádoru jako WHO grade 4, dokonce i v nepřítomnosti mikrovaskulární proliferace a/nebo nekrózy.
Pro IDH-wildtype difuzní astrocytární nádory u dospělých ukázala řada prací, že přítomnost jednoho nebo více ze tří genetických parametrů (mutace promotoru genu TERT, amplifikace genu EGFR, kombinovaný zisk celého chromozomu 7 a ztráta celého chromozomu 10 [+7/−10]) (11, 31) se zdá být dostatečná k hodnocení takového nádoru jako grade 4 dle WHO. Nová klasifikace proto zahrnuje tyto 3 genetické parametry jako kritéria pro diagnostiku glioblastomu, IDH-wildtype, který by měl být diagnostikován jako difuzní a astrocytární gliom u dospělých, u kterého se nachází mikrovaskulární proliferace, a/nebo nekróza, nebo mutace v promotoru genu TERT, nebo amplifikace genu EGFR, nebo +7/-10 změny počtu kopií chromozomů. U difúzních astrocytomů, IDH-wildtype, vyskytujících se v mladších věkových skupinách, je však třeba vzít v úvahu možnost difuzních gliomů dětského typu (viz níže).
Difúzní gliomy low- a high-grade dětského typu
Skupina low-grade nádorů zahrnuje 4 entity, které se vyznačují difúzním růstem v mozku, histologicky tyto nádory někdy vykazují překrývající se a méně specifický mikroskopický obraz; molekulární diagnostika právě v této skupině může pomoci léze charakterizovat a přesněji zařadit. Jedná se o difúzní astrocytom, MYB nebo MYBL1 alterovaný; angiocentrický gliom (rovněž definován alterací MYB); polymorfní low grade neuroepiteliální tumor mladých (PLNTY – polymorphous low-grade neuroepithelial tumor of the young; typicky jsou přítomné alterace MAPK-cesty, nejčastěji mutace BRAF nebo alterace FGFR); a difúzní low grade gliom, s alterovanou MAPK dráhou. Poslední z těchto diagnóz zahrnuje nádory s astrocytární nebo oligodendrogliální morfologií. Přesná diagnostika těchto nádorů vyžaduje jejich molekulární charakterizaci a integraci histopatologických a molekulárních informací ve formě integrovaného a vrstveného reportu, neboť jasné zařazení těchto nádorů je klíčové pro jejich cílenou léčbu.
Skupina high-grade nádorů obsahuje také 4 typy: difúzní gliom střední čáry, H3 K27-alterovaný; difúzní hemisférický gliom, H3 G34-mutovaný; difúzní high-grade gliom dětského typu, H3-wildtype a IDH-wildtype; a hemisférický gliom infantního typu. Difúzní gliom střední čáry, H3 K27-alterovaný, byl uveden již v klasifikaci WHO z roku 2016, ale jeho název byl změněn, aby odrážel skutečnost, že i jiné změny (např. nadměrná exprese proteinu EZHIP nebo mutace EGFR) mohou definovat tuto entitu, kromě již dříve uznané mutace H3 K27. Další 3 nádory jsou nově uznané typy. Difúzní high-grade gliom dětského typu, H3-wildtype a IDH-wildtype je charakterizován wildtype statusem pro H3 i rodinu genů IDH a vyžaduje molekulární charakterizaci a integraci histopatologického obrazu a molekulárních dat pro diagnostické účely ve formě integrovaného a vrstveného reportu. Hemisférický gliom infantního typu je novým typem high-grade gliomu, který se vyskytuje u novorozenců a kojenců a má odlišný molekulární profil s fúzními geny zahrnujícími ALK, ROS1, NTRK1/2/3 nebo MET (32,33). Za zmínku také stojí, že termín „glioblastom“ se již nepoužívá v souvislosti s novotvary dětského věku.
Neuronální a glioneuronální nádory
Skupina nádorů s neuronální složkou zůstala zachována i v nové klasifikaci, ke stávajícím typům byly přidány tři nové typy. První z nich je difúzní glioneurální tumor s oligodendrogliomu podobnými rysy a jadernými shluky (DGONC) a jedná se o provizorní typ nádoru (tj. pravděpodobně se stane plně uznávaným typem v budoucí klasifikaci); dále myxoidní glioneuronální tumor; dále multinodulární a vakuolizující neuronální nádor, diskutovaný již ve WHO klasifikaci z roku 2016 v kapitole o gangliocytomu.
Ependymomy
Nově by nyní měly být klasifikovány podle kombinace histopatologických a molekulární znaků i dle anatomické lokalizace místa výskytu (16). Dělení do molekulárních skupin probíhá tedy mezi nádory supratentoriálními, nádory zadní jámy lební (posterior fossa – PF) a nádory míšního kompartmentu (34). Nová WHO klasifikace uvádí 2 molekulárně definované typy supratentoriálního ependymomu: jeden se ZFTA fúzí (nové označení pro C11orf95, který je považován za reprezentativnější pro daný typ nádoru než RELA, protože může být fúzovaný s více partnery než v dřívější WHO klasifikaci jmenovaný RELA) a další s fúzí YAP1. Nová klasifikace také zahrnuje 2 molekulárně definované typy PF ependymomu, skupinu PFA a skupinu PFB, optimálně diagnostikované na základě metylačního profilu. Pro diagnostiku agresivnějšího PFA ependymomu lze v nouzi použít jako zástupný / surrogate znak imunohistochemicky prokázanou ztrátu exprese trimetylované formy histonu H3 (H3 K27me3). Ve WHO klasifikaci je také doplněn nádor páteře definovaný přítomností amplifikace MYCN, kdy se jedná o vzácný, leč klinicky agresivní nádor. Dále je v nové klasifikaci uvedena skupina ependymomů, definovaná anatomickým umístěním, ale ne molekulárními alteracemi; tyto typy nádorů mohou být použity buď tehdy, když molekulární analýza nalezne jinou molekulární změnu, když molekulární analýza selže nebo je nedostupná (přípony NEC a NOS, viz výše). Myxopapilární ependymom a subependymom zůstávají v nové klasifikaci jako samostatné, na rozdíl od předchozí WHO klasifikace je ale myxopapilární ependymom nyní hodnocen jako nádor WHO grade 2 spíše než 1, protože pravděpodobnost jeho recidivy je podobná jako u konvenčního spinálního ependymomu. Papilární, světlobuněčná a tanycytická morfologická varianta již nejsou uvedeny jako podtypy ependymomu, ale jako histologické vidy v mikroskopickém popisu ependymomu.
Dlouhodobá kontroverze obklopuje reprodukovatelnost a klinicko-patologickou užitečnost gradingu ependymálních nádorů (35). Nová WHO klasifikace uvádí pouze histologicky definovanou diagnózu ependymomu ve kterékoli ze tří výše uvedených anatomických lokalizací. Termín „anaplastický ependymom“ již není zařazen, nicméně WHO grading stupně 2 a 3 v rámci typu nádoru je zachován. Ve formátu integrovaného reportování výsledků může být grade ependymomu uveden ve specifické vrstvě (24).
NÁDORY CHOROIDEÁLNÍHO PLEXU
Klasifikace nádorů choroideálního plexu zůstává v novém vydání „modré“ knihy do značné míry zachována a nezměněna, ačkoli tato skupina nádorů byla oddělena od kategorie primárních neuroepiteliálních nádorů, které se vyznačují větší mírou gliální a/nebo neuronální diferenciace a menší mírou diferenciace epitelové.
MEDULOBLASTOMY
Nová WHO klasifikace změnila třídění meduloblastomů tak, aby odráželo nové poznatky o jejich klinické a biologické heterogenitě. Zpočátku byly konsensem stanoveny 4 hlavní molekulární skupiny: WNT-aktivované, Sonic Hedgehog (SHH)-aktivované, skupina 3 a skupina 4 (36). WNT a SHH-aktivované meduloblastomy byly zahrnuty již do WHO klasifikace z roku 2016; SHH-aktivované nádory byly dále rozděleny na základě stavu TP53 (dělení vychází z toho, že TP53-mutované a TP-53-wildtype tumory mají výrazně odlišný klinicko-patologický charakter). Non-WNT/non-SHH meduloblastomy tvoří pak skupinu 3 a 4. Tyto skupiny jsou zastoupeny v nové WHO klasifikaci. Díky metylačním studiím a profilování transkriptomů vznikly postupně nové podskupiny: 4 podskupiny SHH-aktivovaných a 8 podskupin non-WNT/non-SHH meduloblastomů (37-41). Stejně jako 4 hlavní molekulární skupiny meduloblastomu, některé z těchto nových podskupin jsou spojeny s klinickopatologickými a genetickými rysy, které mající buď diagnostickou, prognostickou nebo prediktivní hodnotu. Histopatologická klasifikace meduloblastomu uvedená v klasifikaci WHO z roku 2016 zahrnovala 4 morfologické typy: klasický, desmoplastický/ nodulární, meduloblastom s rozsáhlou nodularitou (MBEN) a meduloblastom velkobuněčný/anaplastický. Ty byly nyní spojeny do jedné sekce, která je popisuje jako morfologické vidy jednoho typu nádoru, meduloblastomu, histologicky definovaného. Morfologické rozdíly mají své vlastní specifické klinické asociace (42-45) a molekulárně definované meduloblastomy demonstrují zřetelné asociace s morfologickými vzory. Například desmoplastické/nodulární meduloblastomy a MBEN většinou spadají do skupiny SHH-aktivovaných nádorů (46) a obvykle patří do podskupiny SHH-1 nebo SHH-2 (41). Téměř všechny WNT-aktivované nádory mají klasickou morfologii a většina velkobuněčných / anaplastických nádorů patří buď do podskupiny SHH-3 nebo do Grp3/4 podskupiny 2 (40). Meduloblastomy by měly být reportovány vzhledem ke kombinaci histopatologických a molekulárních znaků ve vrstveném a integrovaném formátu.
DALŠÍ EMBRYONÁLNÍ NÁDORY
Ostatní embryonální nádory (tj. typy nádorů mimo meduloblastom) jsou atypický teratoidní/rhabdoidní tumor (AT/RT); embryonální tumor s vícevrstvými rozetami (ETMR); neuroblastom CNS, FOXR2-aktivovaný; a nádor CNS s BCOR interní tandemovou duplikací (ITD). Zatímco AT/RT a ETMR byly zahrnuty v předchozích klasifikacích WHO, druhé dvě léze představují nové typy nádorů zařazené do WHO klasifikace. Kromě toho WHO nově rozpoznává 3 molekulární podtypy AT/RT a dále ETMR s alterací DICER1. CNS nádory s BCOR ITD jsou nyní zahrnuty do WHO klasifikace jako embryonální nádory, ale tyto novotvary nejsou definitivně neuroektodermální a jejich přesný histogenetický původ může být ještě v budoucnosti upřesněn (analogické tumory se vyskytují v měkkých tkáních). Kribriformní neuroepitelový nádor (CRINET) pak představuje zatím provizorní typ nádoru ve WHO klasifikaci. Vrstvený a integrovaný formát reportování výsledků je s výhodou využívat i u této kategorie nádorů, včetně přípon NOS a NEC v odůvodněných případech (18).
NÁDORY EPIFÝZY
Skupina zahrnuje pineocytom, pineální parenchymový tumor intermediální diferenciace (PPTID) a pineoblastom, dále papilární tumor pineální oblasti (PTPR). Nový typ nádoru podle recentní WHO klasifikace představuje desmoplastický myxoidní tumor pineální oblasti, SMARCB1-mutovaný, zatím vzácná jednotka postrádající histopatologické známky malignity, ale s nepříznivým klinickým průběhem u části pacientů (47). Grading nádorů této oblasti by měl být v budoucnosti přesněji definován. Význam molekulární diagnostiky nádorů této oblasti neustále vzrůstá, např. in-frame inzerce KBTBD4 představuje jedno z žádoucích kritérií pro diagnózu PPTID (48).
Pomocí metylačního profilování lze pineoblastomy rozdělit do 4 molekulárních podtypů: pineoblastom, miRNA processing-altered 1 u dětí, který je charakterizován mutacemi DICER1, DROSHA nebo DGCR8; pineoblastom, miRNA processing-altered-2 většinou u starších dětí s relativně dobrou prognózou a také s mutacemi DICER1, DROSHA nebo DGCR8; pineoblastom, MYC/FOXR2-aktivovaný, typicky se záchytem v kojeneckém věku, s aktivací MYC a nadměrnou expresí FOXR2; dále pineoblastom, RB1-alterovaný, opět typický u kojenců a s podobností s retinoblastomem (49,50).
MENINGIOMY
Meningiom je považován v nové WHO klasifikaci za jediný typ nádoru, se širokým morfologickým spektrem, odrážejícím se v 15 v textu uvedených podtypech. Nově se v klasifikaci uplatňuje pravidlo, že kritéria definující atypický nebo anaplastický (tj. 2. a 3. stupeň) meningiom by měla být použita u všech lézí, bez ohledu na základní histologický podtyp. Stejně jako v předchozím vydání klasifikace platí, že chordoidní a světlobuněčný podtyp meningiomu mají vyšší riziko recidivy než meningiomy grade 1 dle WHO a mají tedy být hodnoceny stupněm 2. Rhabdoidní a papilární morfologie sama o sobě již není automaticky dostatečným kritériem pro to, aby byl nádor hodnocen jako grade 3 a tedy jasně maligní. Je pravdou, že papilární a rhabdoidní rysy lze často zastihnout u nádorů v kombinaci s dalšími agresivními rysy, ale samotná rhabdoidní cytologie nebo papilární architektura již není dostatečným důvodem k přiznání grade 3 dle WHO u takových nádorů (51). Nově je též několik molekulárních biomarkerů spojeno s klasifikací meningiomů, včetně mutací SMARCE1 (subtyp z jasných buněk), BAP1 (rhabdoidní a papilární podtypy) a KLF4/TRAF7 (sekreční podtyp). Mutace promotoru TERT (52) a/nebo homozygotní delece CDKN2A/B (53) jsou spojovány s vyšším grade meningiomu (WHO stupeň 3), ztráta jaderné exprese H3K27me3 pak s potenciálně horší prognózou (54) a prognostický význam vykazuje i metylační profilování meningiomů (55).
MEZENCHYMÁLNÍ, NON-MENINGOTELIÁLNÍ NÁDORY
Nová WHO klasifikace nádorů CNS se snaží sladit terminologii mezenchymálních, non-meningoteliálních nádorů CNS, s jejich protějšky ve WHO klasifikaci nádorů kostí a měkkých tkání. Klasifikace nyní pokrývá pouze ty entity, které se vyskytují jedinečně nebo pravidelně i v CNS. Běžné nádory měkkých tkání, které lze výjimečně nalézt i v CNS (např. leiomyom) již nejsou zahrnuty, pokud jejich diagnostické znaky jsou shodné s jejich měkkotkáňovými protějšky. Nové typy, které byly přidány, jsou intrakraniální mezenchymální tumor, FET-CREB fusion-positive (prozatímní typ); CIC-rearranged sarkom a primární intrakraniální sarkom, DICER1-mutovaný. Termín „hemangiopericytom“ byl vyřazen a nádor je nyní nazývaný pouze solitární fibrózní tumor (SFT, preferováno spíše než hybridní termín „solitární fibrózní tumor/ hemangiopericytom“ použitý ve WHO klasifikaci nádorů CNS z roku 2016). Tento termín se nyní shoduje s nomenklaturou v měkkých tkání, i když nově modifikované třístupňové gradingové schéma ve WHO CNS klasifikaci představuje specifický rozdíl, související s lokalitou (18).
NÁDORY Z POCHVY PERIFERNÍHO NERVU
V klasifikaci nádorů nervů bylo provedeno několik změn. Protože paragangliomy zahrnují specializované neuroendokrinní buňky sympatiku a parasympatiku, byly tyto nádory nyní zahrnuty mezi nervové nádory. Vzhledem k odlišnostem v imunoprofilu a metylačním profilu a protože se nejedná o nádor vázaný familiárně, byl paragangliom cauda equina/ filum terminale nově uznáván jako odlišný typ nádoru od častějších paragangliomů, vyskytujících se na jiných místech. Dále bylo konstatováno, že nádor dříve označovaný jako „melanotický schwannom“ je vysoce charakteristický a často agresivní typ nádoru s jedinečným genetickým profilem, který jej odlišuje od všech ostatních nádorů nervových pochev, včetně schwannomů. V souladu klasifikací nádorů měkkých tkání byl tedy jeho název změněn na maligní melanotický nádor nervových pochev. Na závěr byl nový podtyp nádoru přidán i do sekce neurofibromu: jedná se o atypický neurofibromatózní nádor neznámého biologického potenciálu (ANNUBP), je to nádor spojený s neurofibromatózou 1 typu, s přítomností znepokojujících mikroskopických známek maligní transformace, které jsou však stále kvantitativně nedostatečné pro definitivní diagnózu maligního nádoru z pochvy periferního nervu (MPNST) (18).
NÁDORY OBLASTI SELLA TURCICA
V minulých vydáních byly adamantinomatózní kraniofaryngiom a papilární kraniofaryngiom považovány za podtypy (varianty) kraniofaryngiomu, zatímco nyní jsou klasifikovány jako samostatné typy nádorů, vzhledem k odlišnosti jejich klinické demografie, radiologických znaků, histopatologického nálezu, genetickým změnám (mutace CTNNB1 v adamantinomatózním kraniofaryngiomu a mutace BRAF v papilárním kraniofaryngiomu) a metylačnímu profilu (56,57). Naproti tomu pituicytom, nádor z granulárních buněk a vřetenobuněčný onkocytom jsou zařazeny ve společné sekci jako související skupina typů nádorů (58). I když mohou představovat morfologické variace stejného nádoru, demografie pacientů a klinické výsledky se u nich liší, a tak jsou stále klasifikovány samostatně (59). U adenomů hypofýzy se nová WHO klasifikace řídí stále platnými pokyny čtvrtého vydání WHO klasifikace nádorů endokrinního systému, které rozděluje tyto nádory podle jejich histogenetického vztahu k adenohypofyzárním buněčným liniím a podle kombinované imunohistochemické exprese hypofyzárních hormonů a transkripčních faktorů. WHO klasifikace také převzala nový termín hypofyzární neuroendokrinní tumor (PitNET), navržený WHO, o které se bude ještě dále diskutovat (60). Dále byla přidán nový typ nádoru pituitární blastom, což je vzácný embryonální novotvar dětského věku, složený z primitivních blastemálních buněk, neuroendokrinních buněk a buněk Rathkeho epitelu (1,18).
V textu nové WHO klasifikace nádorů CNS dále diskutovaná problematika lymfomů a histiocytárních nádorů CNS, geneticky podmíněných nádorových syndromů postihujících CNS (zde je třeba říci, že došlo k významnému rozšíření této kapitoly o mnoho skupin onemocnění) a sekundárních (metastatických) nádorů CNS již přesahuje rámec tohoto sdělení a zájemce odkazujeme přímo na text nové „modré“ knihy (1,18).
PROHLÁŠENÍ
Autor práce prohlašuje, že v souvislosti s tématem, vznikem a publikací tohoto článku není ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou. Toto prohlášení se týká i všech spoluautorů.
Adresa pro korespondenci:
doc. MUDr. Tomáš Jirásek, Ph.D.
Oddělení patologie, Centrum PATOS
Husova 357/10, 460 63, Liberec
tel: 485 312 303
e-mail: tomas.jirasek@nemlib.cz
Sources
1. WHO Classification of Tumours Editorial Board. World Health Organization Classification of Tumours of the Central Nervous System. 5th ed. Lyon: International Agency for Research on Cancer; 2021.
2. Zulch KJ. Histological Typing of Tumours of the Central Nervous System. Vol. 21. Geneva: World Health Organization; 1979.
3. Kleihues P, Burger PC, Scheithauer BW. Histological Typing of Tumours of the Central Nervous System. Berlin: Springer-Verlag; 1993.
4. Kleihues P, Cavenee WK. World Health Organization Classification of Tumours of the Nervous System. Lyon: WHO/IARC; 2000.
5. Louis DN, Ohgaki H, Wiestler OD, Cavenee WK. World Health Organization Histological Classification of Tumours of the Central Nervous System. 4th ed. Lyon: International Agency for Research on Cancer; 2007.
6. Louis DN, Ohgaki H, Wiestler OD, Cavenee WK. World Health Organization Classification of Tumours of the Central Nervous System. 4th ed., updated ed. Lyon: International Agency for Research on Cancer; 2016.
7. Louis DN, Aldape K, Brat DJ, et al. cIMPACT- NOW (the consortium to inform molecular and practical approaches to CNS tumor taxonomy): a new initiative in advancing nervous system tumor classification. Brain Pathol 2017; 27(6): 851–852.
8. Louis DN, Aldape K, Brat DJ, et al. Announcing cIMPACT-NOW: the Consortium to Inform Molecular and Practical Approaches to CNS Tumor Taxonomy. Acta Neuropathol 2017; 133(1): 1–3.
9. Louis DN, Giannini C, Capper D, et al. cIMPACT- NOW update 2: diagnostic clarifications for diffuse midline glioma, H3 K27M-mutant and diffuse astrocytoma/anaplastic astrocytoma, IDH-mutant. Acta Neuropathol 2018; 135(4): 639–642.
10. Ellison DW, Hawkins C, Jones DTW, et al. cIMPACT-NOW update 4: diffuse gliomas characterized by MYB, MYBL1, or FGFR1 alterations or BRAFV600E mutation. Acta Neuropathol 2019; 137(4): 683–687.
11. Brat DJ, Aldape K, Colman H, et al. cIMPACT- NOW update 3: recommended diagnostic criteria for “Diffuse astrocytic glioma, IDH-wildtype, with molecular features of glioblastoma, WHO grade IV”. Acta Neuropathol 2018; 136(5): 805–810.
12. Louis DN, Wesseling P, Paulus W, et al. cIMPACT- NOW update 1: Not Otherwise Specified (NOS) and Not Elsewhere Classified (NEC). Acta Neuropathol 2018; 135(3): 481–484.
13. Louis DN, Ellison DW, Brat DJ, et al. cIMPACT- NOW: a practical summary of diagnostic points from Round 1 updates. Brain Pathol 2019; 29(4): 469–472.
14. Louis DN, Wesseling P, Aldape K, et al. cIMPACT- NOW update 6: new entity and diagnostic principle recommendations of the cIMPACT Utrecht meeting on future CNS tumor classification and grading. Brain Pathol 2020; 30(4): 844–856.
15. Brat DJ, Aldape K, Colman H, et al. cIMPACT- NOW update 5: recommended grading criteria and terminologies for IDH-mutant astrocytomas. Acta Neuropathol 2020; 139(3): 603–608.
16. Ellison DW, Aldape KD, Capper D, et al. cIMPACT- NOW update 7: advancing the molecular classification of ependymal tumors. Brain Pathol 2020; 30(5): 863–866.
17. Hendrych M, Valeková H, Kazda T, et al. Integrovaná diagnostika difúzních gliomů. Klin Onkol 2020; 33(4): 248-259.
18. Louis DN, Perry A, Wesseling P, et al. The 2021 WHO Classification of Tumors of the Central Nervous System: a summary. Neuro Oncol 2021; 23(8): 1231-1251.
19. Bruford EA, Braschi B, Denny P, et al. Guidelines for human gene nomenclature. Nature genetics 2020; 52(8): 754–758.
20. den Dunnen JT, Dalgleish R, Maglott DR, et al. HGVS recommendations for the description of sequence variants: 2016 update. Hum Mutat 2016; 37(6): 564–569.
21. McGowan-Jordan J, Hastings RJ, Moore S, eds. ISCN 2020: An International System for Human Cytogenomic Nomenclature. Basel: S. Karger; 2020.
22. Louis DN, von Deimling A. Grading of diffuse astrocytic gliomas: Broders, Kernohan, Zülch, the WHO… and Shakespeare. Acta Neuropathol 2017; 134(4): 517–520.
23. von Deimling A, Ono T, Shirahata M, Louis DN. Grading of diffuse astrocytic gliomas: a review of studies before and after the advent of IDH testing. Semin Neurol 2018; 38(1): 19–23.
24. Louis DN, Perry A, Burger P, et al. International Society of Neuropathology--Haarlem consensus guidelines for nervous system tumor classification and grading. Brain Pathol 2014; 24(5): 429–435.
25. Capper D, Jones DTW, Sill M, et al. DNA methylation-based classification of central nervous system tumours. Nature 2018; 555(7697): 469–474.
26. Capper D, Stichel D, Sahm F, et al. Practical implementation of DNA methylation and copy-number-based CNS tumor diagnostics: the Heidelberg experience. Acta Neuropathol 2018; 136(2): 181–210.
27. Jaunmuktane Z, Capper D, Jones DTW, et al. Methylation array profiling of adult brain tumours: diagnostic outcomes in a large, single centre. Acta Neuropathol Commun 2019; 7(1): 24.
28. Priesterbach-Ackley LP, Boldt HB, Petersen JK, et al. Brain tumour diagnostics using a DNA methylation-based classifier as a diagnostic support tool. Neuropathol Appl Neurobiol 2020; 46(5): 478–492.
29. Louis DN, Wesseling P, Brandner S, et al. Data sets for the reporting of tumors of the central nervous system: Recommendations fro the International Collaboration on Cancer Reporting. Arch Pathol Lab Med 2019; 144(2): 196–206.
30. Sievers P, Sill M, Schrimpf D, et al. A subset of pediatric-type thalamic gliomas share a distinct DNA methylation profile, H3K27me3 loss and frequent alteration of EGFR. Neuro Oncol 2021; 23(1): 34–43.
31. Tesileanu CMS, Dirven L, Wijnenga MMJ, et al. Survival of diffuse astrocytic glioma, IDH1/2-wildtype, with molecular features of glioblastoma, WHO grade IV: a confirmation of the cIMPACT-NOW criteria. Neuro Oncol 2020; 22(4): 515–523.
32. Clarke M, Mackay A, Ismer B, et al. Infant high-grade gliomas comprise multiple subgroups characterized by novel targetable gene fusions and favorable outcomes. Cancer Discov 2020; 10(7): 942–963.
33. Guerreiro Stucklin AS, Ryall S, Fukuoka K, et al. Alterations in ALK/ ROS1/NTRK/MET drive a group of infantile hemispheric gliomas. Nat Commun 2019; 10(1): 4343.
34. Pajtler KW, Witt H, Sill M, et al. Molecular classification of ependymal tumors across all CNS compartments, histopathological grades, and age groups. Cancer Cell 2015; 27(5): 728–743.
35. Ellison DW, Kocak M, Figarella-Branger D, et al. Histopathological grading of pediatric ependymoma: reproducibility and clinical relevance in European trial cohorts. J Negat Results Biomed 2011; 10: 7.
36. Taylor MD, Northcott PA, Korshunov A, et al. Molecular subgroups of medulloblastoma: the current consensus. Acta Neuropathol 2012; 123(4): 465–472.
37. Schwalbe EC, Lindsey JC, Nakjang S, et al. Novel molecular subgroups for clinical classification and outcome prediction in childhood medulloblastoma: a cohort study. Lancet Oncol 2017; 18(7): 958–971.
38. Cavalli FMG, Remke M, Rampasek L, et al. Intertumoral heterogeneity within medulloblastoma subgroups. Cancer Cell 2017; 31(6): 737–754.
39. Sharma T, Schwalbe EC, Williamson D, et al. Second-generation molecular subgrouping of medulloblastoma: an international meta- analysis of Group 3 and Group 4 subtypes. Acta Neuropathol 2019; 138(2): 309–326.
40. Kumar R, Liu APY, Northcott PA. Medulloblastoma genomics in the modern molecular era. Brain Pathol 2020; 30(3): 679–690.
41. Hovestadt V, Ayrault O, Swartling FJ, et al. Medulloblastomics revisited: biological and clinical insights from thousands of patients. Nat Rev Cancer 2020; 20(1): 42–56.
42. Eberhart CG, Kepner JL, Goldthwaite PT, et al. Histopathologic grading of medulloblastomas: a Pediatric Oncology Group study. Cancer. 2002;94(2):552–560.
43. McManamy CS, Lamont JM, Taylor RE, et al. Morphophenotypic variation predicts clinical behavior in childhood non-desmoplastic medulloblastomas. J Neuropathol Exp Neurol 2003; 62(6): 627–632.
44. McManamy CS, Pears J, Weston CL, et al. Nodule formation and desmoplasia in medulloblastomas- defining the nodular/desmoplastic variant and its biological behavior. Brain Pathol 2007; 17(2): 151–164.
45. Massimino M, Antonelli M, Gandola L, et al. Histological variants of medulloblastoma are the most powerful clinical prognostic indicators. Pediatr Blood Cancer 2013; 60(2): 210–216.
46. Ellison DW, Dalton J, Kocak M, et al. Medulloblastoma: clinicopathological correlates of SHH, WNT, and non-SHH/WNT molecular subgroups. Acta Neuropathol 2011; 121(3): 381–396.
47. Thomas C, Wefers A, Bens S, et al. Desmoplastic myxoid tumor, SMARCB1-mutant: clinical, histopathological and molecular characterization of a pineal region tumor encountered in adolescents and adults. Acta Neuropathol 2020; 139(2): 277–286.
48. Lee JC, Mazor T, Lao R, et al. Recurrent KBTBD4 small in-frame insertions and absence of DROSHA deletion or DICER1 mutation differentiate pineal parenchymal tumor of intermediate differentiation (PPTID) from pineoblastoma. Acta Neuropathol 2019; 137(5): 851–854.
49. Pfaff E, Aichmüller C, Sill M, et al. Molecular subgrouping of primary pineal parenchymal tumors reveals distinct subtypes correlated with clinical parameters and genetic alterations. Acta Neuropathol 2020; 139(2): 243– 257.
50. Li BK, Vasiljevic A, Dufour C, et al. Pineoblastoma segregates into molecular subgroups with distinct clinico-pathologic features: a Rare Brain Tumor Consortium registry study. Acta Neuropathol 2020; 139(2): 223–241.
51. Vaubel RA, Chen SG, Raleigh DR, et al. Meningiomas with rhabdoid features lacking other histologic features of malignancy: a study of 44 cases and review of the literature. J Neuropathol Exp Neurol 2016; 75(1): 44–52.
52. Sahm F, Schrimpf D, Olar A, et al. TERT promoter mutations and risk of recurrence in meningioma. J Natl Cancer Inst 2016; 108(5): 1–4.
53. Sievers P, Hielscher T, Schrimpf D, et al. CDKN2A/ B homozygous deletion is associated with early recurrence in meningiomas. Acta Neuropathol 2020; 140(3): 409–413.
54. Gauchotte G, Peyre M, Pouget C, et al. Prognostic value of histopathological features and loss of H3K27me3 immunolabeling in anaplastic meningioma: a multicenter retrospective study. J Neuropathol Exp Neurol 2020; 79(7): 754–762.
55. Nassiri F, Mamatjan Y, Suppiah S, et al. DNA methylation profiling to predict recurrence risk in meningioma: development and validation of a nomogram to optimize clinical management. Neuro Oncol 2019; 21(7): 901–910.
56. Müller HL, Merchant TE, Warmuth-Metz M, et al. Craniopharyngioma. Nat Rev Dis Primers 2019; 5(1): 75.
57. Holsken A, Sill M, Merkle J, et al. Adamantinomatous and papillary craniopharyngiomas are characterized by distinct epigenomic as well as mutational and transcriptomic profiles. Acta Neuropathol Commun 2016; 4: 20.
58. Mete O, Lopes MB, Asa SL. Spindle cell oncocytomas and granular cell tumors of the pituitary are variants of pituicytoma. Am J Surg Pathol 2013; 37(11): 1694–1699.
59. El Hussein S, Vincentelli C. Pituicytoma: review of commonalities and distinguishing features among TTF-1 positive tumors of the central nervous system. Ann Diagn Pathol 2017; 29: 57–61.
60. Rindi G, Klimstra DS, Abedi-Ardekani B, et al. A common classification framework for neuroendocrine neoplasms: an International Agency for Research on Cancer (IARC) and World Health Organization (WHO) expert consensus proposal. Mod Pathol 2018; 31(12): 1770–1786.
Labels
Anatomical pathology Forensic medical examiner ToxicologyArticle was published in
Czecho-Slovak Pathology

2022 Issue 3
Most read in this issue
- News in WHO 2021 classification of tumours of the central nervous system
- CNS Tumors – clinical and radiological aspects
- Mucormycosis: Case report
- Giant cell fibroblastoma: a case report
