Metylační analýza jako pomocný nástroj v cytologické diagnostice vzácnějších anogenitálních lézí – pilotní studie
Methylation analysis as an auxiliary tool in cytological diagnostics of infrequent anogenital lesions - a pilot study
Methylation silencing of certain cellular genes is a sign of carcinogenesis progression and therefore tests that detect methylation could be used in the diagnosis or staging of malignant diseases. In the diagnosis of squamous cell carcinomas of the cervix which are almost 100% caused by long-term infection with highrisk human papillomavirus (HR-HPV), methylation silencing of certain cellular genes is a highly specific marker of advanced dysplastic lesions and appears to result from aberrant activation of the methyltransferase DNMT1 by viral oncoproteins E6 and E7. A methylation test performed on a cervicovaginal cytology specimen allows to increase the diagnostic value of this non-invasive test and to select patients with severe squamous cell lesions for follow-up. Other less frequent anogenital malignancies that are induced by HR-HPV to a lesser extent can also be detected by cytological examination - glandular lesions of various origins, most commonly cervical and endometrial adenocarcinomas and anal carcinoma. The aim of our pilot study was to evaluate the utility of a methylation test for the diagnosis of these malignancies in a cohort of 50 liquid-based cervicovaginal cytologies with glandular lesion and 74 liquid-based anal cytologies from HIV-positive men having sex with men who are at high risk for anal cancer development.
Keywords:
cytology – Methylation – HR-HPV – glandular lesions – anal carcinoma
Authors:
Jana Němcová 1,2,3; Kateřina Černá 1,2,3; Radek Šíma 2; Iva Kinkorová Luňáčková 2; Filip Rob 5; Petr Martínek 2; Jiří Bouda 6; Jana; Šmahelová 4; Ondrej Ondič 1,2,3
Authors‘ workplace:
Šiklův ústav patologie, FN Plzeň
1; Bioptická laboratoř, Plzeň
2; Biomedicínské centrum lékařské fakulty v Plzni, Plzeň
3; Katedra genetiky a mikrobiologie, PřF Univerzity Karlovy, Biocev, Vestec
4; Dermatovenerologické oddělení 2. LF Karlovy univerzity v Praze a nemocnice Na Bulovce, Praha
5; Gynekologicko-porodnická klinika LF UK a FN Plzeň, Plzeň
6
Published in:
Čes.-slov. Patol., 59, 2023, No. 1, p. 26-31
Category:
Original Articles
Overview
Metylační umlčení některých buněčných genů je známkou progrese karcinogeneze a proto testy, které metylaci detekují, by mohly být využívány v diagnostice či „stagingu“ maligních onemocnění. V diagnostice dlaždicobuněčných karcinomů děložního hrdla (DH), které jsou téměř ve 100 % způsobeny dlouhodobou infekcí vysoce rizikovými lidskými papilomaviry (HR-HPV), je metylační umlčení určitých buněčných genů vysoce specifickým markerem pokročilé dysplastické léze a zřejmě vzniká důsledkem aberantní aktivace metyltransferázy DNMT1 virovými onkoproteiny E6 a E7. Metylační test provedený ze vzorku cervikovaginální cytologie umožňuje zvýšit výpovědní hodnotu tohoto neinvazivního vyšetření a selektovat pacientky s biologicky závažnou dlaždicobuněčnou lézí pro následné vyšetření. Pomocí cytologického vyšetření lze odhalit také méně časté anogenitální malignity, které jsou indukované HR-HPV v nižší míře – žlázové léze různého původu, nejčastěji adenokarcinomy DH a endometria a anální karcinom. Cílem naší pilotní studie bylo ohodnotit přínos metylačního testu pro diagnostiku těchto malignit na souboru 50 tekutých cervikovaginálních cytologií s nálezem žlázové léze a 74 tekutých análních cytologií HIV-pozitivních homosexuálů, kteří jsou ve vysokém riziku vzniku karcinomu anu.
Klíčová slova:
cytologie – anální karcinom – metylace – HR-HPV – cervikální žlázové léze
Dlaždicobuněčný karcinom DH je nejdéle studovanou malignitou indukovanou vysoce rizikovými lidskými papilomaviry (HR-HPV). Znalosti o etiopatogenezi, postupný proces karcinogeneze a anatomicky přístupná lokalita z této malignity činí jedno z nejlépe preventabilních onkologických onemocnění. Cytologický screening dlaždicobuněčného cervikálního karcinomu dramaticky snížil incidenci a mortalitu tohoto onemocnění, jež před implementací screeningu bylo nejčastějším onkologickým onemocněním u žen (1). Stálá přítomnost HR-HPV ve stěru exfoliovaných cervikálních buněk během všech stádií onemocnění umožňuje využití detekce virové DNA jako nejcitlivějšího molekulárního markeru onemocnění (2). Specifita HR-HPV testu pro detekci klinicky závažných lézí je ale v obecné populaci žen nižší, a proto se v mnoha zemích, včetně České republiky, HR-HPV test s úspěchem využívá jako doplňkový test cytologického cervikálního screeningového programu (3). Klinicky závažné dlaždicobuněčné léze vykazují další vysoce specifické molekulární změny, které lze vyšetřovat ze stěru exfoliovaných buněk epitelu (4,5). Metylační analýza patří mezi nejlépe ověřené metody, které s vysokou přesností identifikují karcinom a léze s vysokým rizikem progrese do karcinomu (6,7).
Metylace DNA je epigenetický proces charakteristický kovalentním navázáním metylové skupiny na cytosin v pozici 5´ v CpG dinukleotidech, které jsou nejčastěji umístěné v regulační oblasti genu. Tento proces je katalyzován enzymy metyltransferázami (DNMT) a patří mezi fyziologické buněčné mechanismy, které regulují expresi genu, ovlivňují replikaci, rekombinaci a opravy DNA nebo sestřih RNA (8,9). Metylace a demetylace DNA hrají důležitou roli zejména při aktivaci a umlčení genů během zárodečného vývoje, zachování genomové stability a potlačení replikace a translace virových genů (10). Aberantní metylace je jednou z nejčastějších změn u nádorových onemocnění – hypometylace zvyšuje genovou nestabilitu a expresi protoonkogenů, naopak hypermetylace tumor-supresorových genů (TSG) vede k utlumení jejich exprese a má tedy podobný následek jako inaktivační mutace. Hypermetylace desítek buněčných genů byla prokázána u HPV-indukovaných malignit v různých anatomických lokalitách – ve zdravé tkáni je metylace těchto genů téměř nulová, ale narůstá v průběhu progrese prekancerózní léze a nejvyšších hodnot dosahuje u karcinomů a pokročilých dysplastických lézí, které mají vysoké riziko progrese v krátkodobém horizontu. Mezi hypermetylací umlčované geny u HPV-indukované karcinogeneze patří např. geny CCNA1 (cyclin A1), TERT (telomerase reverse transcriptase), MGMT (O-6-methylguanine-DNA methyltransferase), CADM1 (cell adhesion molecule 1), CDH1 (cadherine 1), DAPK1 (death-associated protein kinase 1), EPB41L3, FAM19A4, MAL, PAX1 (paired box 1), PRDM14 (PR domain containing 14) a mnoho dalších (11).
Na základě těchto poznatků bylo v nedávné době validováno několik komerčních metylačních testů, které na základě metylačního statusu odlišují biologicky závažné a nezávažné léze DH. Jedná se o testy na bázi metylačně specifické kvantitativní real-time PCR, které porovnávají úroveň metylace několika TSG v exfoliovaných buňkách cytologického stěru. Naprostá většina validačních dat pro užití metylačních testů však byla získána na dlaždicobuněčných cervikálních lézích a poznatky, jak fungují tyto testy u dalších anogenitálních (většinou HPV-asociovaných) malignit, které lze diagnostikovat z cytologického stěru, jsou omezené (12).
Cytologický screening je primárně zaměřený na včasnou identifikaci dlaždicobuněčných prekanceróz DH, ale v cervikovaginálním cytologickém stěru mohou být zachycené také maligní léze z cylindrického epitelu, nejčastěji adenokarcinomy DH a adenokarcinomy endometria. Incidence těchto lézí je výrazně nižší ve srovnání s dlaždicobuněčným karcinomem DH a vzhledem k menší praktické zkušenosti cytotechnologů se závažnými žlázovými lézemi jsou častěji stěry odečteny jako falešně negativní (13). HR-HPV test zvyšuje citlivost záchytu jen částečně, protože etiopatogeneze těchto lézí je spojená s HPV v různé míře, od 0 % u adenokarcinomu gastrického typu, po 72-100 % endocervikálního adenokarcinomu obvyklého typu (14). Pokud by se potvrdila pilotní data o vysoké míře metylační pozitivity těžkých glandulárních lézí publikovaná vědeckým týmem, který stojí za vývojem 2 komerčních testů, mohl by metylační test zvýšit záchyt těchto vzácnějších a často opožděně diagnostikovaných lézí (15,16).
Anální karcinom (AC) se vyskytuje v obecné populaci v nízké frekvenci, přesto je jeho screening oprávněný u rizikových skupin, kde je díky kumulaci rizikových faktorů vysoká incidence tohoto onemocnění (17). Nejvyšší incidence AC se udává ve skupině HIV-pozitivních homosexuálních mužů (MSM, z angl. Men having Sex with Men) a to až 131 na 100 000 za rok (18). V České republice pilotně probíhá oportunní cytologický screening MSM s frekvencí jednou za rok (19). Citlivost a specifita anální cytologie pro detekci těžkých lézí je nižší a výpovědní hodnota HPV DNA testu je v této skupině omezená v důsledku vysoké prevalence HR-HPV (20). Při hledání optimální screeningové strategie včasného záchytu análního karcinomu by proto bylo vhodné doplnit vyšetření anální cytologie o další molekulárně genetické markery, které by zvýšily výpovědní hodnotu stěru a selektovaly pacienty ve vysokém riziku pro následné více invazivní vyšetření.
Cílem naší pilotní studie bylo ohodnotit účinnost metylačního testu a jeho přínos pro screening a diagnostiku výše popsaných vzácnějších, zejména HPV-indukovaných lézí anogenitálního traktu: cervikálních žlázových lézí a análních lézí.
MATERIÁL A METODY
Studie byla schválena etickou komisí Fakultní nemocnice Na Bulovce (číslo 7.6.2016/8097/EK-Z). Účastníci studie podepsali informovaný souhlas. Bylo analyzováno 50 cervikovaginálních cytologických stěrů a 74 análních cytologických stěrů odebraných do ThinPrep media (LBC).
Cervikovaginální vzorky byly odebrány za účelem screeningu karcinomu DH v gynekologických ambulancích v rámci celé České republiky v období 2016-2017 a zpracovány a vyhodnoceny v Bioptické laboratoři s.r.o. s nálezem žlázové atypie vyššího stupně AGC-NEO+ (AGC-NEO a těžší nález). U 43 pacientek byl dostupný histologický materiál.
Anální stěry byly odebrány za účelem cytologického screeningu AC na dermatovenerologickém oddělení Fakultní nemocnici Bulovka v Praze v období 2018-2020 a zpracovány a vyhodnoceny v Bioptické laboratoři. Studijní skupinu tvořili HIV-pozitivní MSM, kteří uvádí pravidelný anální receptivní styk. Všichni pacienti byli vyšetřeni proktologem pomocí palpačního vyšetření. U 21 pacientů, kteří dodrželi protokol, byla provedena konvenční anoskopie.
Cervikovaginální a anální LBC preparáty byly zhotoveny automatizovaným systémem Hologic a vyhodnoceny pomocí ThinPrep Imaging system (Hologic) s počítačově asistovanou analýzou obrazu. Klasifikace cytologických nálezů byla provedena dle třetí edice Bethesda klasifikace, 2014. Ze zbytkového materiálu byla provedena molekulárně genetická analýza, která zahrnovala detekci a genotypizaci HPV a metylační analýzu. Pro tyto účely byla izolována celková DNA z 1 ml cervikální LBC pomocí komerční soupravy QIAamp DNA Micro Kit (QIAGEN) a 2 ml anální cytologie metodou chelexové izolace. Detekce a genotypizace HPV byla provedena komerční soupravou Anyplex II HPV28 (Seegene), která detekuje L1 gen 28 vysoce rizikových (HR) a nízce rizikových (LR) typů HPV na principu multiplexní real-time PCR, a „in-house“ PCR metodou detekující gen E1 širokého spektra slizničních a kožních typů HPV (21). Metylační analýza byla provedena pomocí komerční soupravy QiaSure (Qiagen). Tato souprava detekuje metylaci promotorů dvou TSG: FAM19A4 a mir124-2 pomocí multiplexní metylačně specifické real-time PCR. PCR analýze předcházela bisulfitická konverze izolované DNA komerční soupravou EZ DNA methylationTM Kit (ZYMO Research), která spočívá v konverzi cytosinu na uracil u jednovláknové DNA pomocí hydrogensiřičitanu sodného (NaHSO3). Tato konverze neproběhne u cytosinů, které jsou metylované v pozici 5C. V následné PCR dojde k specifickému namnožení pouze toho úseku, který byl původně metylovaný a jeho DNA sekvence obsahuje stále cytosiny. Hodnota metylace promotorů FAM19A4 a mir124-2 je vztažena k buněčnosti vzorku vyjádřeného amplifikací genu pro beta aktin.
VÝSLEDKY
Cervikovaginální žlázové léze (n=50)
Výsledky odečtu LBC, metylačního testu a HR-HPV detekce jsou shrnuté v tabulce č. 1. Průměrný věk žen s nálezem žlázové atypie vyššího stupně v LBC ve studijní skupině byl 46 let. Nejčastějším cytologickým nálezem byly atypické žlázové buňky – spíše neoplastické (AGC-NEO).
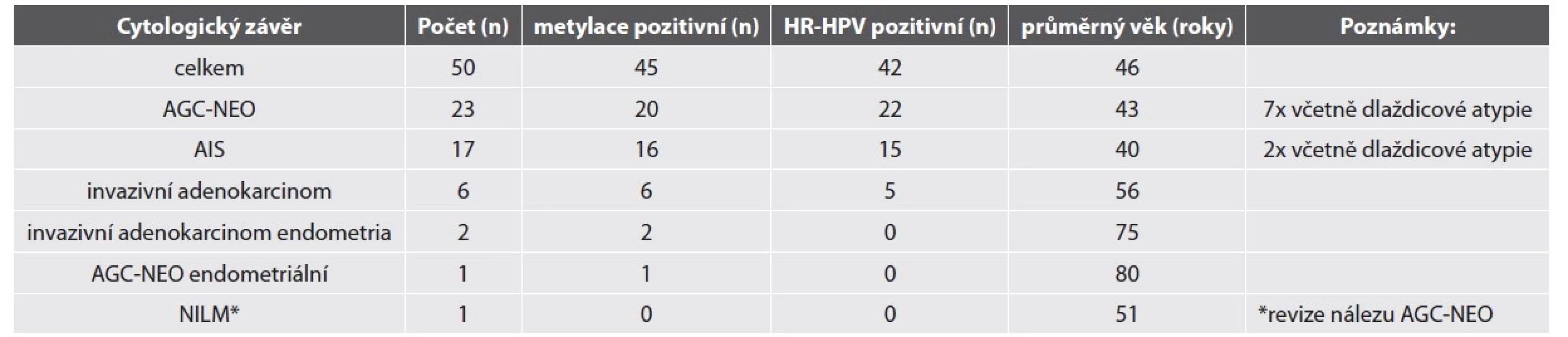
HR-HPV test byl pozitivní u 84 % vzorků. Nejčastějším detekovaným HR-HPV typem byl HPV18 (18/50, 36 %), HPV16 (15/50, 30 %) a HPV45 (5/50, 10 %). Jiné HR-HPV typy byly detekovány v 7 případech, které měly cytologickou diagnózu AGC-NEO a histologicky zde nebyla zachycena těžká žlázová léze (2 LSIL, 3 HSIL, 2 bez dysplazie). Detailní nález u HR-HPV negativních lézí je shrnut v tabulce č. 2.
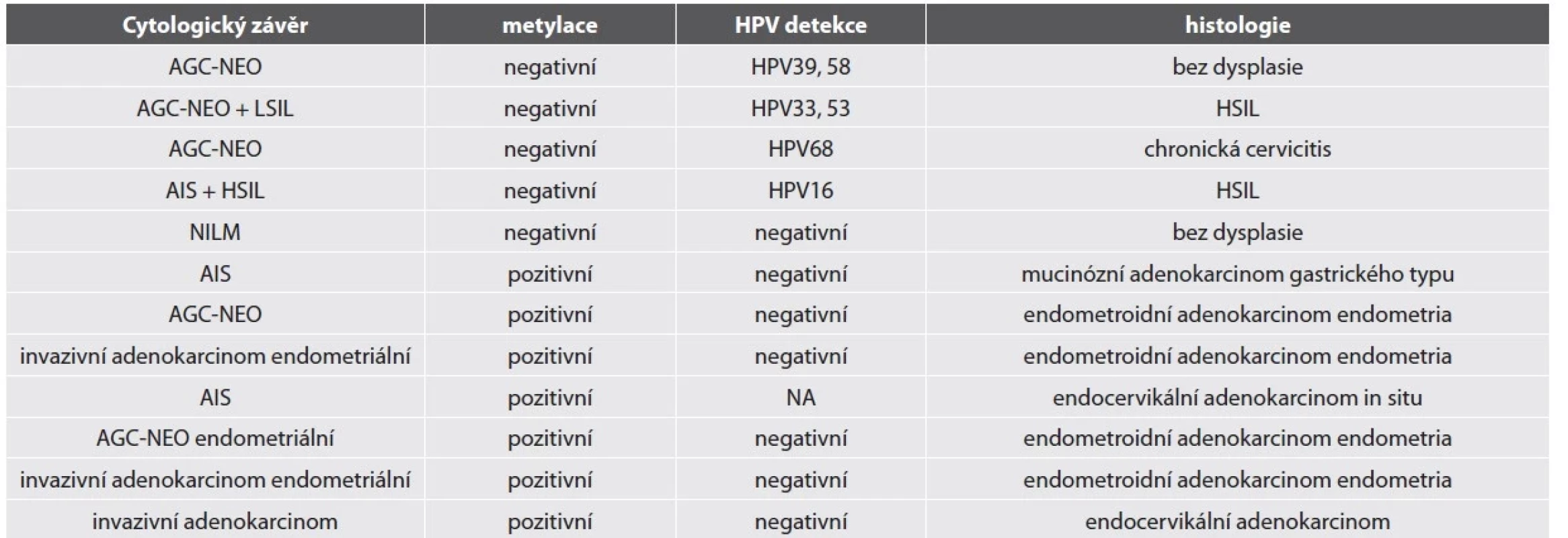
Metylační test byl pozitivní ve většině vzorků (90 %). Ženy s metylačně negativní cytologií neměly přítomnou těžkou žlázovou lézi v histologickém ověření (tab. 2). Metylačně pozitivní byly žlázové léze HR-HPV asociované i HR-HPV independentní. 18 z 20 žen s metylačně pozitivním nálezem AGC-NEO mělo dostupné následné histologické vyšetření, ve všech byl potvrzen těžký nález (9 těžkých žlázových lézí, 9 těžkých dlaždicobuněčných lézí).
Anální léze (n=74)
Výsledky odečtu LBC, metylačního testu a HR-HPV detekce jsou shrnuté v tabulce 3. Průměrný věk MSM ve studijní skupině byl 36 let. Nejčastějším cytologickým nálezem byla LSIL. Nízká buněčnost anální cytologie byla častým fenoménem mezi studijními vzorky, 12 cytologií bylo zcela nehodnotitelných a u dalších 13 cytologií byl stanovený závěr s poznámkou o nízké buněčnosti vzorku.
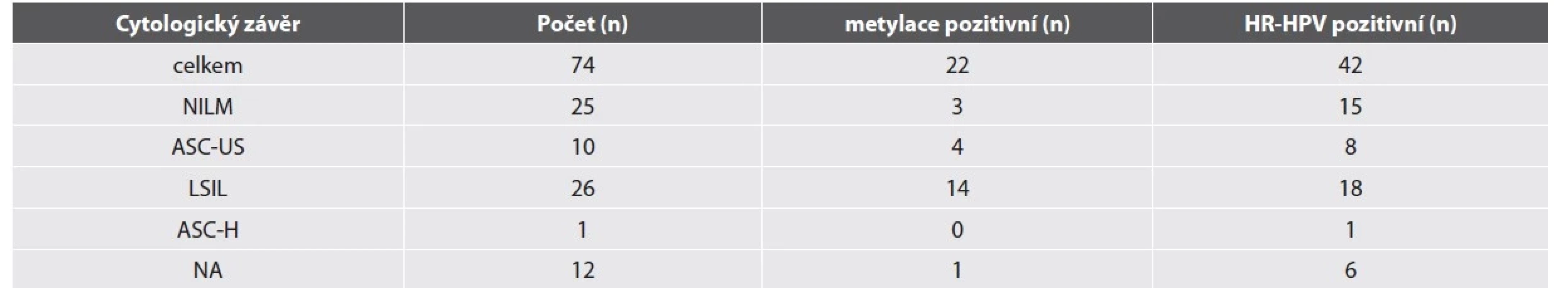
HR-HPV test byl pozitivní u 70 % vzorků. Nejčastějším detekovaným HR-HPV typem byly typy HPV56 a HPV52 (15/74, 20 %), HPV16 (12/74, 16 %) a HPV59 (10/74, 14 %). 8 vzorků nebylo možné analyzovat na přítomnost HPV z důvodu nízké buněčnosti nebo přítomnosti PCR inhibitoru. Nízká buněčnost vzorků představovala velkou limitaci metylačního testu. Pro hodnocení metylace byla snížena kritéria nutné buněčnosti uváděná výrobcem pro cervikální cytologii (hodnota „cycle treshold“ - ct – pro beta aktin 29 a nižší, výrobce doporučuje ct 26 a nižší). Přesto bylo nehodnotitelných 35 vzorků. Metylačně pozitivních bylo 22 a negativních 17 vzorků. Mezi metylačně negativními vzorky byly statisticky významně více zastoupeny negativní cytologické nálezy ve srovnání s metylačně pozitivními vzorky (Fisher exact test, p = 0.0367) a MSM s metylačně negativní cytologií byli spíše mladší (věkový průměr 33 let) ve srovnání s muži s metylačně pozitivní cytologií (věkový průměr 39 let). Mezi metylačně pozitivními vzorky byl častěji detekován HPV16 (5 MSM) ve srovnání s metylačně negativními vzorky (1 MSM), ale rozdíl není statisticky průkazný. Palpačním vyšetřením nebyl detekován AC u žádného z pacientů. Anoskopické vyšetření provedené u 21 pacientů neobjevilo žádnou závažnou lézi.
DISKUZE
Metylační test představuje objektivní molekulárně-genetický přístup validovaný pro použití v klinických laboratořích, který má využití v cytologickém i primárním HPV screeningu karcinomu DH (12). Pozitivní metylační test byl ve studiích spojen s přítomností biologicky závažné dlaždicobuněčné léze, perzistentní HR-HPV infekcí a nižší mírou regrese lézí (22,23).
Spektrum buněčných genů umlčených metylací během cervikální karcinogeneze je ovlivněné histologickým typem léze. Velice podobný metylační profil u dlaždicobuněčného karcinomu a adenokarcinomu DH je však popisován např. u genů DAPK1, CADM1, and RARB (24). V naší studii byla hodnocena metylace promotorů dvou genů FAM19A4 a miR124-2. Cervikovaginální stěry obsahující cytologicky závažné žlázové léze z naší studie byly v naprosté většině (45/50, 90 %) metylačně pozitivní. Pozitivní metylační status odpovídal závažnosti léze v histologickém ověření (43 dostupných biopsií). Negativní výsledek metylačního testu byl u 5 případů, ve třech z nich nebyla v histologii popsána těžká léze, ve dvou byl HSIL. Tento nález je ve shodě s dvěma dostupnými studiemi, které provedl tým zodpovědný za vývoj 2 komerčních metylačních testů. Ve studii z roku 2014 (15) bylo zjištěno metylační umlčení u všech 12 testovaných adenokarcinomů DH (100 %) a u 16 z 21 testovaných endometriálních karcinomů (76 %). Studie byla provedena s pomocí první verze metylační soupravy, která hodnotila metylační umlčení tří TSG: CADM1 and MAL, miR124-2. Ve studii z roku 2020, která hodnotila metylační statut stejných genů jako naše studie, bylo metylačně pozitivních 121 ze 123 testovaných adenokarcinomů (54 cytologických vzorků, 69 FFPE tkání) a 30 ze 32 vzácných histotypů (světlobuněčný karcinom - 14/14, neuroendokrinní karcinom 12/13, adenokarcinom smíšený s neuroendokrinním karcinomem – 1/1, mucinózní adenokarcinom gastrického typu – 2/2, mucinózní adenokarcinom, NOS (1/1), serózní adenokarcinom – 0/1) (16). Na základě výsledků naší pilotní studie hodnotíme použití metylačního testu ve screeningu a diagnostice žlázových genitálních lézí jako velice přínosné. Jeho velikou výhodou je objektivita, vysoká intralaboratorní a mezilaboratorní shoda (25) a schopnost detekovat HR-HPV asociované i HR-HPV independentní gynekologické adenokarcinomy (22,26). Limitací naší studie je nízký počet vzácných typů adenokarcinomů DH a jiného původu a histologicky ověřených benigních lézí. Výsledky budeme dále ověřovat na větším počtu žen se žlázovými abnormalitami v cytologickém stěru s následnou histologickou korelací.
V současné době neexistuje mezinárodní konsenzus pro rutinní screening AC, nicméně většina organizací jako EACS (European AIDS Clinical Society) nebo NYSDOH (New York State Department of Health) se shodují na důležitosti screeningu AC v rizikových skupinách, a to zejména u HIV-pozitivních osob a MSM (27). Detekce časných stádií AC je kruciální pro jeho úspěšnou léčbu. Zatímco časná stádia karcinomu velice dobře odpovídají na chemoterapii, pokročilá stádia vyžadují náročné chirurgické zákroky, které negativně ovlivňují kvalitu života pacienta (28). Naprosto nejčastějším histotypem AC je HPV-asociovaný dlaždicobuněčný karcinom (ASCC). Podobně jako dlaždicobuněčný karcinom DH se AC vyvíjí postupně z anální intraepiteliální neoplázie (AIN). Těžké anální neoplázie (HGAIN) mohou progredovat do invazivního análního dlaždicobuněčného karcinomu, ale zdá se, že míra progrese HGAIN do invazivního stádia je výrazně nižší než v případě těžkých cervikálních lézí (29). Přestože se HGAIN vyskytují velice často, a to až u 20–40 % HIV-pozitivních MSM, jedná se o biologicky nejednotné léze, které často regredují. Přínos chirurgické léčby pro pacienta proto není jasný, neboť ablační zákrok uvnitř análního kanálu je spojený s rizikem dlouhodobých komplikací a ovlivnění funkce svěračů (30). Více informací o prospěšnosti odstraňování HGAIN v rámci prevence AC by měla podat probíhající studie ANCHOR (31).
Anální cytologie je neinvazivní vyšetření, které detekuje maligní změny v exfoliovaných buňkách ve stěru z anální sliznice. Citlivost, specifita i opakovatelnost anální cytologie jsou však suboptimální pro efektivní screening análního karcinomu (17). Doplnění anální cytologie o molekulární markery by mohlo tvořit ideální nástroj screeningu análního karcinomu, dostupný pro všechny rizikové pacienty. Pouze selektovaní, vysoce rizikoví pacienti by pak podstoupili některé z následných více invazivních vyšetření – anoskopii, kolonoskopii, proktoskopii nebo endorektální ultrazvuk pro detekci a odstranění biologicky pokročilé HGAIN nebo časného stádia invazivního karcinomu.
Kandidátní biomarker závažnosti anální léze je genotypizace HPV16 ve vztahu k jeho unikátnímu karcinogennímu potenciálu (32). Nicméně detekce HPV16 sama o sobě není dostačující zejména u HIV-pozitivních MSM, kdy je samostatně detekovaný HPV16 pouze v 67 % případů AC, na rozdíl od HIV-negativních jedinců, kde je frakce AC související s HPV16 kolem 86 % (33). Detekce mRNA 14 HR-HPV (transkripčně aktivní infekce) se také jeví jako slibný biomarker, ale je třeba více dat k ověření charakteristik tohoto markeru (20). Metylace promotorů buněčných genů by mohla být vhodným biomarkerem závažnosti léze, jak naznačuje několik recentních studií, které prokázaly signifikantní rozdíl v metylaci buněčných genů v bioptických vzorcích AC a biologicky pokročilých análních lézí ve srovnání se zdravou okolní tkání (34-36). V klinické praxi je ale třeba používat metylační test, který je standardizovaný a validovaný na vzorky anální cytologie.
V naší studii jsme hodnotili metylaci genů FAM19A4 a miR124-2 pomocí komerčního testu QiaSure, validovaného pro užití v klinických laboratořích pro diagnostiku prekanceróz DH z cytologického stěru. Výsledky metylačního testu u análních cytologií byly negativně ovlivněny nízkou buněčností stěru a nedostupností histologického ověření. Při snížení nároků testu na buněčnost bylo metylačně pozitivních 22 vzorků s převážně abnormálním cytologickým nálezem a relativně vyšším věkem pacientů ve srovnání se stěry, které byly vyhodnoceny jako metylačně negativní. Také častější nález HPV16 (statisticky neprůkazný) u metylačně pozitivních pacientů by mohl naznačovat, že se jedná o skupinu pacientů s rizikovějšími lézemi. Nicméně míra pozitivity metylačního testu (29,3 % pacientů) naznačuje, že současná vyhodnocovací kritéria testu nebudou poskytovat relevantní výsledky odpovídající markeru akutní progrese onemocnění. K podobnému závěru došla i jediná doposud publikovaná studie na podobné téma, která hodnotila míru metylace stejných genů v análních cytologiích u převážně HIV-pozitivních žen (37). Vysoká míra pozitivity metylačního markeru u 75 testovaných žen (95 %) neodpovídala přítomnosti HGAIN u 18 % žen a autoři doporučovali stanovit vyšší hranici pozitivity metylačních markerů, aby výsledky odpovídaly závažnosti histologického nálezu. Dle autorů studie mohla být vysoká míra metylace buněčných genů v anální cytologii ovlivněna spektrem zachycených buněk v análním stěru (vysoký podíl keratinocytů) a možnou přítomností cervikální léze působící metylační „field effect“. Vyšší míra metylace některých genů je také zřejmě důsledkem HIV seropozitivity (38).
Histologicky nebylo možné potvrdit závažnost léze, neboť konvenční anoskopie (u 21 MSM) ani palpační vyšetření všech pacientů (DARE, z angl. Digital Ano-Rectal Examination) neobjevily žádné závažné léze. I když je pravděpodobné, že se v naší studijní skupině vyskytují pacienti s HGAIN, nedokázali jsme tyto detekovat. Nepochybně k tomu přispěla velmi nízká citlivost konvenční anoskopie pro detekci intraanálních lézí. Digitální anoskopie s vysokým rozlišením (HRA, z angl. High Resolution Anoscopy), která je pokládána za zlatý standard v diagnostice análních lézí, je v našich podmínkách nedostupná (28). Nelze vyloučit i vliv věkové struktury sledovaných pacientů.
ZÁVĚR
Metylace genů FAM19A4 a miR124-2 se jeví jako téměř univerzální biomarker HPV a non-HPV indukované cervikální karcinogeneze. Pozitivní metylační test s vysokou citlivostí označí cervikovaginální stěry, které obsahují závažné dlaždicobuněčné i žlázové cervikální léze a gynekologické malignity jiného, než cervikálního původu jako je endometriální karcinom. Velký potenciál má metylační test jako výstupní test pro ženy opouštějící cytologický screeningový program, a to díky jeho vysoké dlouhodobé negativní prediktivní hodnotě pro široké spektrum gynekologických malignit. Lze rovněž zvážit jeho využití ve zvláštních situacích a subpopulacích jako třeba u těhotných nebo graviditu plánujících žen s nálezem HSIL+ nebo AGC-NEO+.
Hodnocení metylace genů FAM19A4 a miR124-2 má zatím velice limitující využití ve screeningu análního karcinomu. Zjištění, že metylačně pozitivní pacienti mají statisticky častěji abnormální cytologický nález a vyšší zastoupení HPV16 ve stěru, naznačuje slibný potenciál metylačních markerů, ale je třeba upravit hodnotící kritéria pro metylační pozitivitu v cílové screeningové skupině nebo detekovat metylaci jiných buněčných nebo virových genů. Výsledky z naší pilotní studie se ověřují na větším počtu MSM.
PODĚKOVÁNÍ
Podpořeno z programového projektu Ministerstva zdravotnictví AZV ČR 17-31777A a projektem institucionálního výzkumu MZČR – FNPI, 00669806. Veškerá práva podle předpisů na ochranu duševního vlastnictví jsou vyhrazena.
PROHLÁŠENÍ
Autor práce prohlašuje, že v souvislosti s tématem, vznikem a publikací tohoto článku není ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou. Toto prohlášení se týká i všech spoluautorů.
Adresa pro korespondenci:
RNDr. Jana Němcová, PhD.,
Bioptická laboratoř, s.r.o.,
Rejskova 10, Plzeň, 32600
email: jana.nemcova@biopticka.cz
tel.: 737220433
Sources
1. Arbyn M, Raifu AO, Weiderpass E, Bray F, Anttila A. Trends of cervical cancer mortality in the member states of the european union. Eur J Cancer 2009; 45(15): 2640-2648.
2. Cuzick J, Bergeron C, Von Knebel Doeberitz M, et al. New technologies and procedures for cervical cancer screening. Vaccine 2012; 30 Suppl 5: F107-116.
3. Kinkorová Luňáčková I, Majek O. Karcinom děložního hrdla v ČR a možnosti jeho prevence. Cesk Patol 2018; 63(4): 164-168.
4. Dijkstra MG, Snijders PJ, Arbyn M, et al. Cervical cancer screening: On the way to a shift from cytology to full molecular screening. Ann Oncol 2014; 25(5): 927-935.
5. Černá K, Němcová J. Molekulárně genetické metody ve skríningu karcinomu děložního hrdla. Cesk Patol 2018; 63(4): 169-174.
6. Lorincz AT, Brentnall AR, Scibior-Bentkowska D, et al. Validation of a DNA methylation HPV triage classifier in a screening sample. Int J Cancer 2016; 138(11): 2745-2751.
7. de Strooper LMA, Verhoef VMJ, Berkhof J, et al. Validation of the FAM19A4/mir124-2 DNA methylation test for both lavage - and brush-based self-samples to detect cervical (pre)cancer in HPV-positive women. Gynecol Oncol 2016; 141(2): 341-347.
8. Chen ZX, Riggs AD. DNA methylation and demethylation in mammals. J Biol Chem 2011; 286(21): 18347-18353.
9. Holčáková J. Vliv metylace DNA na vznik nádorových onemocnění. Klin Onkol 2018; 31(Suppl 2): 41-45.
10. Fernandez AF, Rosales C, Lopez-Nieva P, et al. The dynamic DNA methylomes of double - stranded DNA viruses associated with human cancer. Genome Res 2009; 19(3): 438-451.
11. Steenbergen RD, Snijders PJ, Heideman DA, Meijer CJ. Clinical implications of (epi) genetic changes in HPV-induced cervical precancerous lesions. Nat Rev Cancer 2014; 14(6): 395-405.
12. Kremer WW, Steenbergen R, Heideman D, Kenter GG, Meijer C. The use of host cell DNA methylation analysis in the detection and management of women with advanced cervical intraepithelial neoplasia: A review. BJOG 2021; 128(3): 504-514.
13. Ondič O, Němcová J, Alaghehbandan R, et al. The newly proposed international endocervical adenocarcinoma criteria and classification and its relevance to cervical cytology screening assessed in a prospective 2-year study of 118 cases. Cytopathology 2020; 31(4): 288-291.
14. Yoshida H, Shiraishi K, Kato T. Molecular pathology of human papilloma virus-negative cervical cancers. Cancers (Basel) 2021; 13(24): 6351. doi:10.3390/cancers13246351
15. de Strooper LM, Van Zummeren M, Steenbergen RD, et al. CADM1, MAL and mir124 - 2 methylation analysis in cervical scrapes to detect cervical and endometrial cancer. J Clin Pathol 2014; 67(12): 1067-1071.
16. Vink FJ, Meijer C, Clifford GM, et al. FAM19A4/ mir124-2 methylation in invasive cervical cancer: A retrospective cross-sectional worldwide study. Int J Cancer 2020; 147(4): 1215-1221.
17. Siegenbeek Van Heukelom ML, Marra E, De Vries HJC, Schim Van Der Loeff MF, Prins JM. Risk factors for anal high-grade squamous intraepithelial lesions in HIV-positive MSM: Is targeted screening possible? AIDS 2017; 31(16): 2295-2301.
18. Silverberg MJ, Lau B, Justice AC, et al. Risk of anal cancer in HIV-infected and HIV-uninfected individuals in North America. Clin Infect Dis 2012; 54(7): 1026-1034.
19. Rob F, Němcová J, Šmahelová J, Marx J, Ondič O. Anální karcinom a jeho screening. Čes-slov Derm 2022; 97(1): 3-11.
20. Němcová J, Černá K, Rob F, et al. Prevalence of high-risk human papillomavirus DNA and mRNA and its association with abnormal anal cytology in the Czech male anal cancer screening cohort. Diagn Cytopathol 2021; 49(11): 1188-1195.
21. Tieben LM, Ter Schegget J, Minnaar RP, et al. Detection of cutaneous and genital HPV types in clinical samples by PCR using consensus primers. J Virol Methods 1993; 42(2-3): 265-279.
22. de Strooper LMA, Berkhof J, Steenbergen RDM, et al. Cervical cancer risk in HPV-positive women after a negative FAM19A4/ mir124-2 methylation test: A post hoc analysis in the Pobascam trial with 14 year follow - up. Int J Cancer 2018; 143(6): 1541-1548.
23. Louvanto K, Aro K, Nedjai B, et al. Methylation in predicting progression of untreated high-grade cervical intraepithelial neoplasia. Clin Infect Dis 2020; 70(12): 2582-2590.
24. Wentzensen N, Sherman ME, Schiffman M, Wang SS. Utility of methylation markers in cervical cancer early detection: Appraisal of the state-of-the-science. Gynecol Oncol 2009; 112(2): 293-299.
25. Bonde J, Floore A, Ejegod D, et al. Methylation markers FAM19A4 and mir124-2 as triage strategy for primary human papillomavirus screen positive women: A large European multicenter study. Int J Cancer 2021; 148(2): 396-405.
26. Dick S, Kremer WW, De Strooper LMA, et al. Long-term CIN3+ risk of HPV positive women after triage with FAM19A4/mir124-2 methylation analysis. Gynecol Oncol 2019; 154(2): 368 - 373.
27. Clifford GM, Alberts CJ. Molecular risk stratification for anal cancer prevention. Clin Infect Dis 2021; 72(12): 2164-2166.
28. Leeds IL, Fang SH. Anal cancer and intraepithelial neoplasia screening: A review. World J Gastrointest Surg 2016; 8(1): 41-51.
29. Machalek DA, Poynten M, Jin F, et al. Anal human papillomavirus infection and associated neoplastic lesions in men who have sex with men: A systematic review and meta - analysis. Lancet Oncol 2012; 13(5): 487-500.
30. Berry JM, Jay N, Cranston RD, et al. Progression of anal high-grade squamous intraepithelial lesions to invasive anal cancer among HIV-infected men who have sex with men. Int J Cancer 2014; 134(5): 1147-1155.
31. Lee JY, Lensing SY, Berry-Lawhorn JM, et al. Design of the ANal Cancer/HSIL outcomes research study (ANCHOR study): A randomized study to prevent anal cancer among persons living with HIV. Contemp Clin Trials 2022; 113 : 106679. :106679. doi: 10.1016/j.cct.2022.
32. Clarke MA, Wentzensen N. Strategies for screening and early detection of anal cancers: A narrative and systematic review and meta-analysis of cytology, HPV testing, and other biomarkers. Cancer Cytopathol 2018; 126(7): 447-460.
33. Lin C, Franceschi S, Clifford GM. Human papillomavirus types from infection to cancer in the anus, according to sex and HIV status: A systematic review and meta-analysis. Lancet Infect Dis 2018; 18(2): 198-206.
34. Hernandez JM, Siegel EM, Riggs B, et al. DNA methylation profiling across the spectrum of HPV-associated anal squamous neoplasia. PLoS One 2012; 7(11): e50533.
35. Van Der Zee RP, Van Noesel CJM, Martin I, et al. DNA methylation markers have universal prognostic value for anal cancer risk in hiv-negative and hiv-positive individuals. Mol Oncol 2021; 15(11): 3024-3036.
36. Lorincz AT, Nathan M, Reuter C, et al. Methylation of HPV and a tumor suppressor gene reveals anal cancer and precursor lesions. Oncotarget 2017; 8(31): 50510-50520.
37. Lahiri CD, Nguyen ML, Mehta CC, et al. Pilot study of markers for high-grade anal dysplasia in a southern cohort from the women’s interagency human immunodeficiency virus study. Clin Infect Dis 2020; 70(6): 1121-1128.
38. Arumugam T, Ramphal U, Adimulam T, Chinniah R, Ramsuran V. Deciphering DNA methylation in HIV infection. Front Immunol 2021; 12 : 795121. doi:10.3389/fimmu.2021.795121.
Labels
Anatomical pathology Forensic medical examiner ToxicologyArticle was published in
Czecho-Slovak Pathology

2023 Issue 1
-
All articles in this issue
- Novinky v pulmopatologii
- Patolog vychovává svého klinika a klinik patologa
- 'NEUROPATOLOGIE
- 'NEFROPATOLOGIE
- 'GYNEKOPATOLOGIE
- 'HEPATOPATOLOGIE
- 'PATOLOGIE GIT
- 'CYTODIAGNOSTIKA
- 'PATOLOGIE ORL OBLASTI
- 'KARDIOPATOLOGIE
- 'PULMOPATOLOGIE
- 'UROPATOLOGIE
- Současné možnosti odlišení histopatologického obrazu idiopatické plicní fibrózy od fibrotické hypersenzitivní pneumonie: Jak na to?
- Malobuněčný karcinom plic – nové poznatky o biologii nádoru
- Kazuistika – Warthin-like papilokarcinom štítné žlázy
- Metylační analýza jako pomocný nástroj v cytologické diagnostice vzácnějších anogenitálních lézí – pilotní studie
- Tumor endolymfatického vaku – vzácná komplikace syndromu von Hippel-Lindau
- Karel Rokitanský (1804 - 1878)
- Czecho-Slovak Pathology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Metylační analýza jako pomocný nástroj v cytologické diagnostice vzácnějších anogenitálních lézí – pilotní studie
- Malobuněčný karcinom plic – nové poznatky o biologii nádoru
- Kazuistika – Warthin-like papilokarcinom štítné žlázy
- Tumor endolymfatického vaku – vzácná komplikace syndromu von Hippel-Lindau
