Detekce ß-laktamáz typu AmpC u gramnegativních bakterií izolovaných z moče
Detection of AmpC beta-Lactamases in Gram-negative Bacteria Isolated from Urine
AmpC beta-lactamases, enzymes produced by a range of Gram-negative bacteria and able to hydrolyse penicillins, monobactams, cephalosporins and cephamycins, are not inhibited by beta-lactamase inhibitors. They are spread via plasmids and pose a huge epidemiological and diagnostic problem.
The production of AmpC ß-lactamases was tested in various Gram-negative bacteria. Of strains isolated from urine of patients diagnosed with urinary tract infection, we selected those that were resistant to third generation cephalosporins and did not produce extended-spectrum beta-lactamases (ESBL). The production of inducible AmpC was assayed by modified DDST (double disk synergy test) and that of constitutive AmpC was tested on agar containing oxacillin as an AmpC inhibitor. All constitutive AmpC producers were also tested for susceptibility to amikacin, piperacillin/tazobactam, cefoperazon/sulbactam, imipenem, meropenem and colistin by the disk diffusion method on MH-agar.
Altoghether 119 strains (68 strains of Klebsiella pneumoniae, 20 strains of Escherichia coli and 12 strains of Enterobacter aerogenes) were tested. We detected 38 constitutive AmpC producers, including primarily K. pneumoniae (17 strains), E. coli (10 strains) and E. aerogenes (4 strains). Thirty-two strains were inducible AmpC producers (21 K. pneumoniae strains, 6 Morganella morganii strains and 3 E. aerogenes strains). Two K. pneumoniae strains were ESBL/AmpC coproducers. The constitutive AmpC producers showed relatively good susceptibility to cefepim (84.2 %) and carbapenems.
Key words:
AmpC – ESBL – Gram-negative bacteria – urinary tract infection.
Authors:
L. Černohorská; T. Andrysík
Authors‘ workplace:
Mikrobiologický ústav Lékařské fakulty Masarykovy univerzity a Fakultní nemocnice u sv. Anny v Brně
Published in:
Epidemiol. Mikrobiol. Imunol. 57, 2008, č. 4, s. 141-146
Overview
ß-laktamázy typu AmpC, enzymy produkované řadou gramnegativních bakterií, které hydrolyzují peniciliny, monobaktamy, cefalosporiny a cefamyciny, nejsou inhibovány inhibitory ß-laktamáz. Jsou šířeny cestou plazmidů a představují velký epidemiologický a také diagnostický problém.
Zjišťovali jsme produkci ß-laktamáz typu AmpC u různých gramnegativních bakterií. Kmeny, izolované z močí pacientů s diagnózou močové infekce, byly vybrány na základě rezistence k cefalosporinům 3. generace a přitom nebyly určeny jako producenti ESBL (extended-spectrum beta lactamases). Produkce inducibilních AmpC byla zjišťována pomocí DDST (double disk synergy test) a produkce konstitutivních AmpC pomocí agaru s oxacilinem, který slouží jako inhibitor enzymů AmpC. U všech kmenů s produkcí konstitutivních AmpC byla testována také citlivost k amikacinu, piperacilinu s tazobaktamem, cefoperazonu se sulbaktamem, imipenemu, meropenemu a kolistinu pomocí diskové difuzní metody na MH-agaru.
Celkem bylo testováno 119 kmenů (z toho 68 kmenů Klebsiella pneumoniae, 20 Escherichia coli a 12 Enterobacter aerogenes). Bylo zachyceno 38 konstitutivních AmpC producentů. Produkce byla nejvýraznější u kmenů K. pneumoniae (17), E. coli (10) a E. aerogenes (4). Produkce inducibilní AmpC ß-laktamázy byla prokázána u 32 kmenů (z toho 21 bylo kmenů K. pneumoniae, 6 kmenů Morganella morganii a 3 kmeny E. aerogenes). U 2 kmenů (K. pneumoniae) byla zjištěna současná produkce ESBL a AmpC. Kmeny s konstitutivními AmpC byly poměrně dobře citlivé k cefepimu (84,2 %), také citlivost ke karbapenemům zůstala zachována.
Klíčová slova:
AmpC – ESBL – gramnegativní bakterie – infekce močových cest.
Objev penicilinu, jeho uvedení do klinické praxe a vývoj dalších antibiotik přinesl naději, že bakteriální onemocnění již přestanou být problémem. Na základě těchto názorů se začalo podceňovat dodržování hygienicko-epidemiologického režimu ve zdravotnických zařízeních a docházelo též k nadměrnému a neúčelnému užívání antibiotik [17, 18, 19]. To vedlo k rozšíření bakteriálních kmenů rezistentních k jednotlivým antibiotikům a následně i kmenů multirezistentních. Jako hlavní příčina rezistence se ukazuje právě selekční tlak antibiotik [17, 27]. Mechanismů vzniku rezistence je celá řada, nejčastější příčinou rezistence bakterií k ß-laktamovým antibiotikům je však produkce ß-laktamáz [11, 15]. Geny pro tvorbu ß-laktamáz mohou být přítomny jak na bakteriálním chromozomu, tak i na plazmidech [3, 10, 28]. ß-laktamáz existuje celá řada, pro jejich klasifikaci se používá buď klasifikace podle Amblera, nebo klasifikace podle Bushové-Jacobyho-Madeirose [2, 4, 14]. Klinicky nejvýznamnější je produkce ß-laktamáz typu ESBL (extended-spectrum beta lactamases) a AmpC [5, 10, 11, 14, 23].
ß-laktamázy typu AmpC
Amp C jsou řadou mikrobů produkovány inherentně, hydrolyzují peniciliny, monobaktamy, cefalosporiny a cefamyciny, nehydrolyzují karbapenemy a většinou nejsou inhibovány inhibitory ß-laktamáz. Díky svému spektru účinku jsou někdy označovány jako cefalosporinázy [9, 10]. Podle Amblerovy klasifikace se řadí do skupiny C, podle klasifikace Bushové-Jacoby-Meiderose do skupiny 1 [2, 4]. Geny pro ß-laktamázy typu AmpC jsou přítomny v chromozomu u celé řady bakteriálních druhů, např. Pseudomonas aeruginosa, Enterobacter spp., Morganella morganii, Serratia spp.,Providencia spp., Citrobacter freundii aj. [9, 10, 11, 25]. Původně byly identifikovány pouze chromozomální ß-laktamázy AmpC, později byly popsány i ß-laktamázy AmpC kódované geny přítomnými na plazmidech [9, 10, 25]. První ß-laktamáza AmpC tohoto typu byla identifikována u druhu Proteus mirabilis, lze se s ní setkat i u ostatních bakteriálních druhů, jako např. Salmonella enterica, Shigella sp., Escherichia coli aj., nicméně klinicky a epidemiologicky je nejzávažnější výskyt u druhu Klebsiella pneumoniae [5, 9, 10, 25]. Právě přítomnost genů pro tyto enzymy na plazmidech je příčinou jejich rychlého šíření u stále většího množství gramnegativních bakterií na všech kontinentech [5, 21].
Inducibilní enzymy AmpC (iAmpC) nejsou exprimovány bez přítomností induktoru. Tím může být např. imipenem, cefoxitin nebo inhibitory ß-laktamáz (kyselina klavulanová, sulbaktam, tazobaktam). V mechanismu indukce hrají důležitou roli proteiny vážící penicilin [6, 10, 13]. Mutace v regulačním systému AmpC vede ke konstitutivní nadprodukci ß-laktamáz (tzv. hyperprodukci), tato změna bývá ireverzibilní [21].
Klinický význam bakterií produkujících AmpC
Klinický význam ß-laktamáz AmpC je srovnatelný s ESBL [10]. Zatímco producenti ESBL jsou považováni za rezistentní ke všem ß-laktamům kromě karbapenemů, bez ohledu na výsledky vyšetření citlivosti, a účinek cefoxitinu a kombinace penicilinů s inhibitory ß-laktamáz je nejistý, producenti AmpC jsou rezistentní k inhibitorům ß-laktamáz, cefamycinům a k většině cefalosporinů [3, 10, 11]. I když nebyl ve skupině AmpC dosud popsán žádný enzym schopný hydrolyzovat karbapenemy, je již popisována rezistence k této skupině [10, 20]. Tato rezistence je dána obvykle snížením permeability vnější buněčné stěny [20, 21]. Dále je u producentů AmpC popisována rezistence k ostatním skupinám antibiotik, kódovaná geny nesenými na stejném mobilním elementu [21]. Další nebezpečí selhání léčby u producentů AmpC spočívá v projevujícím se efektu inokula. Jedná se o jev, kdy MIC není konstantou, ale je závislá na množství přítomných bakterií. Při standardním vyšetření se používá inokulum 105 CFU/ml, přičemž v organismu při infekci může být koncentrace bakterií i o několik řádů vyšší, a tak přítomná koncentrace antibiotika nemusí být účinná [10].
Terapeutická doporučení u infekcí způsobených producenty AmpC
U producentů AmpC je podání ß-laktamových antibiotik omezené. Možné je podání cefalosporinů 4. generace (např. cefepimu), je-li k němu kmen citlivý a neprodukuje-li daná bakterie zároveň ESBL [11, 23]. I v případě cefepimu byl však prokázán efekt inokula, proto je třeba posuzovat každý případ individuálně [10]. U producentů inducibilních enzymů lze zvážit podání cefalosporinů 3. a 4. generace pouze u kmenů izolovaných z močových cest. V ostatních případech se podání těchto antibiotik nedoporučuje [10, 11, 24]. Lékem volby jsou zde karbapenemy, pokud k nim je daný kmen citlivý. U producentů AmpC se lze často setkat s rezistencí k chinolonům, která může být podmíněna přítomností genů přítomných na stejném mobilním elementu jako AmpC. Podání chinolonů je možné v případě, že kmen je k antibiotiku citlivý [10]. V krajních případech, při rezistenci ke karbapenemům a jiným antibiotikům, lze použít polymyxiny (kolistin). Je třeba se vyhýbat kombinacím s inhibitory ß-laktamáz. Během léčby je třeba sledovat případný vývoj adaptivní rezistence pravidelným vyšetřováním [10, 23].
Diagnostika AmpC v klinické praxi
K detekci AmpC byla vyvinuta celá řada metod, včetně metod molekulárně biologických [5, 6, 7, 10]. Ty se ale k rutinní diagnostice vzhledem k časové a ekonomické náročnosti zatím moc nehodí. Podobně je tomu u metod využívajících bakteriálních extraktů jak testovaného kmene, tak referenčních kmenů – např. E. coli citlivých k cefalosporinům [10]. Pro účely rutinní laboratorní diagnostiky se jeví jako nejvhodnější metody využívající antibiotických disků na Muellerově-Hintonové agar (MH). Některé testy jsou shodné s testy na produkci ESBL, což umožňuje zařadit testování produkce AmpC do algoritmů diagnostiky ESBL. Jde zejména o modifikace DDST (double disk synergy test), kdy se využívá detekce deformace inhibičních zón mezi disky s cefalosporiny (cefotaximem, ceftazidimem), aztreonamem a diskem s amoxicilinem/kyselinou klavulanovou. Tento test slouží jak k detekci ESBL [16], tak inducibilní AmpC. Pro detekci hyperprodukce AmpC nebo pro detekci kmenů současně produkujících AmpC a ESBL se používá poznatku, že některé látky jsou schopny inhibovat enzymy AmpC. Jde například o kyselinu boritou nebo oxacilin [6, 7, 10, 11].
Materiál a metody
Bylo testováno 68 kmenů K. pneumoniae, z dalších bakterií byly vyšetřovány kmeny Klebsiella oxytoca (2), E. aerogenes (12), E. coli (20), M. morganii (9), Providentia stuartii (2), Proteus mirabilis/Proteus vulgaris (1/3), Serratia marcescens (2). Tyto kmeny byly izolovány z močí zaslaných k vyšetření na Mikrobiologický ústav LF a FN u sv. Anny v Brně z urologické, I. a II. interní kliniky s diagnózou močové infekce. Všichni původci pocházeli od pacientů z komunity. Hraniční koncentrace bakterií v moči, od které byly izolované bakterie považovány za původce onemocnění, byla 104/ml. Identifikace kmenů proběhla soupravou Enterotest 16 (Lachema, Cz). Kmeny byly shromažďovány a průběžně testovány od března 2007 do března 2008.
Testovací kritérium pro výběr kmenů AmpC: Nejprve byly vyloučeny kmeny pouze ESBL-pozitivní. K rutinní detekci těchto kmenů byla použita metoda DDST [11, 16] a metoda CLSI (metoda platí pouze pro rod Klebsiella, E. coli a P. mirabilis) [11]. Námi testované kmeny byly CLSI-negativní i DDST-negativní a vykazovaly rezistenci k některému nebo ke všem cefalosporinům 3. generace.
Testovací kritérium pro výběr kmenů iAmpC: Pro detekci inducibilních enzymů typu AmpC bylo využito DDST testu. Producenti iAmpC vytvářeli zvětšenou inhibiční zónu ve tvaru písmene D u aztreonamu (30 μg), cefotaximu (30 μg) a u ceftazidimu (30 μg) na straně sousedící s diskem amoxicilin/klavulanová kys. (20/10 μg). Vzdálenost disků byla 25 mm.
Ke konfirmaci konstitutivních AmpC stejně jako inducibilních AmpC byla použita metoda využívající inhibici AmpC oxacilinem. Byla připravena suspenze bakterií ve fyziologickém roztoku s glukózou o hustotě 0,5 McFarlanda. Tímto inokulem byly naočkovány Petriho misky s MH a současně s MH se 128 mg/l oxacilinu (MH+OXA). Na obě půdy byl umístěn doprostřed misky disk s amoxicilinem/kyselinou klavulanovou: AMC (20/10 μg). Do vzdálenosti 25 mm od tohoto disku byly pravidelně umístěny disky s 30 μg aztreonamu (ATM), 30 μg ceftazidimu (CAZ), 30 μg cefepimu (FEP) a 30 μg cefotaximu (CTX). Po 24hodinové kultivaci byly odečítány a interpretovány výsledky následovně:
U kmenů s hyperprodukcí AmpC vznikl rozdíl ve velikosti nedeformované inhibiční zóny na agarech MH a MH+OXA, alespoň u jednoho antibiotika větší než 5mm.
V případě produkce ESBL došlo k deformaci inhibičních zón ve tvaru „šampusové zátky“, tzn. k rozšíření inhibiční zóny směrem k disku AMC.
Současná produkce AmpC a ESBL: Oxacilin inhiboval AmpC a umožnil detekci původně skryté ESBL. Došlo proto současně k deformaci inhibičních zón na MH+OXA a zároveň k rozdílu velikosti zón většímu než 5 mm alespoň u jednoho antibiotika oproti MH.
U kmenů bez produkce AmpC nebo ESBL inhibiční zóny na obou agarech nejevily žádné známky deformace a rozdíl mezi velikostí zón na obou agarech byl menší než 5 mm.
U všech kmenů s konstitutivní AmpC byla testována také citlivost k amikacinu, piperacilinu s tazobaktamem, cefoperazonu se sulbaktamem, imipenemu, meropenemu a kolistinu pomocí diskové difúzní metody na MH [28].
Během naší práce jsme kmeny, které se vyskytovaly u pacientů opakovaně, vyšetřili na produkci AmpC znovu, abychom zjistili možný posun rezistence. Těchto 6 kmenů bylo do statistiky zahrnuto pouze jedenkrát, tj. při prvním výskytu.
Výsledky
Celkem bylo ze 119 různých kmenů nalezeno 38 kmenů s hyperprodukcí AmpC a 32 kmenů iAmpC. Konstitutivní produkci AmpC vykazovalo 17 kmenů K. pneumoniae, 10 kmenů E. coli, 4 kmeny E. aerogenes a 3kmeny M. morganii, ostatní bakterie pak spíše ojediněle. Inducibilní produkci vykazovalo21 kmenů K. pneumoniae, 6 kmenů M. morganii a 3 kmeny E. aerogenes. Tento typ rezistence byl zachycen i u jiných námi testovaných bakterií (tab. 1).
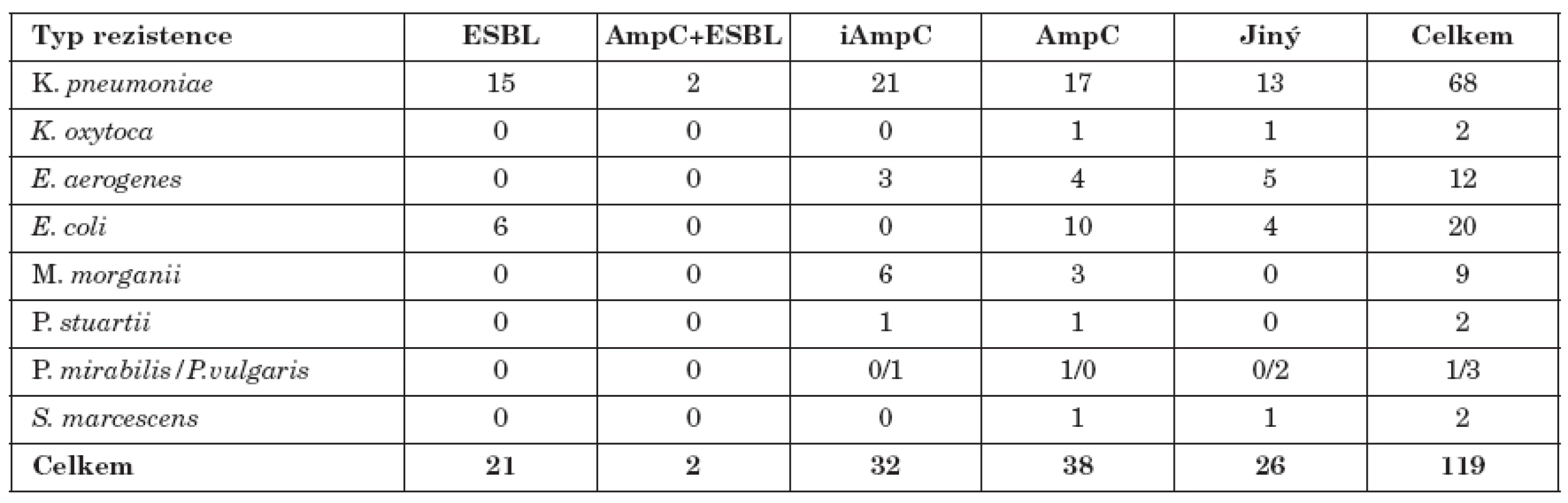
Pouze 2 kmeny (K. pneumoniae) produkovaly současně ESBL a AmpC.
Při opakovaném testování u žádného z testovaných kmenů nenastal zvrat do jiného typu rezistence, došlo pouze ke změnám ve velikosti průměrů inhibičních zón.
Citlivost 38 producentů konstitutivních AmpC byla poměrně dobrá k cefepimu (84,2 %), relativně příznivě vycházela i jiná antibiotika (graf 1). Nejméně byly tyto kmeny citlivé k piperacilinu s tazobaktamem (39,5 %). Citlivost ke karbapenemům zůstala zachována. Podobně citlivost ke kolistinu (pochopitelně s výjimkou přirozeně rezistentních kmenů jako jsou v našem případě M. morganii, P. stuartii, S. marcescens a P. mirabilis)i nadále zůstává dobrá.

Diskuse
Námi použitá metoda DDST prováděná na MH-agaru a MH-agaru s inhibitorem AmpC (v našem případě oxacilinem) je relativně časově a finančně nenáročná, jednoduchá a snadno proveditelná, plně navazuje na algoritmus testování ESBL [11].
Zjistili jsme, že mezi kmeny K. pneumoniae, E. coli a E. aerogenes a M. morganii izolovaných z moče není produkce AmpC ß-laktamáz ojedinělou záležitostí. Na 126 „močových“ producentů ESBL získaných v průběhu 12 měsíců na naší laboratoři bylo detekováno 38 hyperproducentů AmpC, produkce AmpC je tedy asi třetinová ve srovnání s produkcí ESBL, není tedy ojedinělá [1, 5, 24]. Z tohoto důvodu doporučujeme rutinní testování kmenů klebsiell, enterobakterů a escherichií na produkci AmpC. Totéž bychom doporučili u kmenů M. morganii. Přestože v tomto případě počet námi získaných kmenů nebyl vysoký, neboť M. morganii byla méně častým původcem močových infekcí, bylo nalezeno překvapivě velké množství kmenů iAmpC i hyperproducentů AmpC.
Poměrně velké množství kmenů však nelze zařadit do žádného z typů námi testované rezistence. U některých kmenů (S. marcescens, K. oxytoca) lze spíše předpokládat přítomnost jiného typu rezistence jako např. hyperprodukci ß-laktamázy K 1 u K. oxytoca, je také vysoce pravděpodobné, že může jít o různé kombinované typy. U E. coli se nám touto metodou nepodařilo prokázat ani jediný kmen iAmpC, což však nemusí znamenat, že neexistují, protože konstitutivní produkce AmpC byla prokázána u 9 kmenů. Potvrzení produkce ESBL či detekce jiných typů rezistence by bylo možné zjistit např. pomocí moderních molekulárně-diagnostických metod [10, 12, 14]. V naší studii jsme nezachytili žádný kmen Citrobacter spp., i když je jako producent AmpC uváděn [11], nejspíše proto, že tyto kmeny nebyly tak častými původci močových infekcí a většina z nich se jevila jako dobře citlivá.
Přestože u žádného z opakovaně testovaných kmenů nenastal během naší práce zvrat do jiného typu rezistence a došlo poze k drobnému posunu ve velikostech zón, doporučujeme sledovat vývoj rezistence pravidelnými screeningy.
Problematická je otázka interpretace citlivosti. Z již dříve řečeného vyplývá, že podání ß-laktamových antibiotik je omezené na cefalosporiny 4. generace, pokud jsou citlivé, a pokud producent AmpC není zároveň producentem ESBL. U producentů inducibilních enzymů izolovaných z močových cest lze zvážit podání cefalosporinů 3. a 4. generace [10, 11, 24]. Naši hyperproducenti AmpC byli dobře citliví k cefepimu (84,2 %) i karbapenemům, tato antibiotika by tedy mohla představovat léky volby, v polovině případů dobře reagovali i na amikacin. S ohledem na již zmíněný efekt inokula v případě cefepimu, ale souhlasíme s názorem, že je nutné zvážit podání tohoto antibiotika přísně individuálně [10]. Přestože již v literatuře byla popsána rezistence ke karbapenemům [10, 20], u námi testovaných kmenů zatím rezistence zachycena nebyla. I když byly některé naše kmeny relativně dobře citlivé i k piperacilinu s tazobaktamem (39,5 % kmenů) či cefoperazonu se sulbaktamem, nelze preparáty s inhibitory ß-laktamáz doporučit [10]. Kolistin lze považovat za rezervní antibiotikum, ale pochopitelně jej nelze doporučit u kmenů s přirozenou rezistencí na toto antibiotikum. Bohužel faktem zůstává, že námi testovaná antibiotika jsou určena pouze pro intravenózní podání a u ambulantních pacientů, kteří náš soubor tvořili, mají jen omezené použití. V tomto případě přicházejí v úvahu i některé další preparáty, jako jsou chinolony, furantoin a doxycyklin, pokud je k nim vykazována citlivost. Jinak nezbývá než doufat, že se osvědčí nové preparáty jako je např. tigecyklin [10, 14] nebo produkty nepatogenních bakterií koliciny. Ty se začínají testovat u močových infekcí způsobených uropatogení E. coli jako prevence kolonizace močových katétrů a byly už s efektem vyzkoušeny i u některých zvířecích infekcí [22, 26].
Do redakce došlo 20. 6. 2008
MUDr. L. Černohorská
Mikrobiologický ústav LF MU a FN u sv. Anny
Pekařská 53
656 91 Brno
e-mail: lenka.cernohorska@fnusa.cz
Sources
1. Alvarez, M., Tran, J. H., Chow, N. et al. Epidemiology of conjugative plasmid-mediated AmpC ß-lactamases in the United States. Antimicrob Agents Chemother, 2004, 48, 533-537.
2. Ambler, R. P. The structure of ß-lactamases. Phil Trans R Soc Lond Biol, 1980, B 289, 321-331.
3. Bradford, P. Extended-spectrum ß-lactamases in the 21st Century: Characterization, Epidemiology, and Detection of This Important Resistance Threat. Clin Microbiol Rev, 2001, 14, 933-951.
4. Bush, K., Jacoby, G. A., Medeiros, A. A. A functional classification scheme for ß-lactamases and its correlation with molecular structure. Antimicrob Agents Chemother, 1995, 39, 1211-1233.
5. Courdon, P. E., Moland, E. S., Thomson, K. S. Occurrence and detection of AmpC beta-lactamases among Escherichia coli, Klebsiella pneumoniae, and Proteus mirabilis Isolates at a Veterans Medical Center. J Clin Microbiol, 2000, 38, 1791-1796.
6. Dunne, W. M., Hardin, D. J. Use of several inducer and substrate antibiotic combinations in a disk approximation assay format to screen for AmpC induction in patient isolates of Pseudomonas aeruginosa, Enterobacter spp., Citrobacter spp., and Serratia spp. J Clin Microbiol, 2005, 43, 5945-5949.
7. Fortineau, N., Poirel, L., Nordmann, P. Plasmid-mediated and inducible cephalosporinase DHA-2 from Klebsiella pneumoniae. J Antimicrob Chemother, 2001, 47, 207-210.
8. Giamarellos-Bourboulis, E. J., Papadimitriou, E., Galanakis, N. et al. Multidrug resistance to antimicrobials as a predominant factor influencing patient survival. Int J Antimicrob Agents, 2006, 27, 476-481.
9. Hanson, N. D. AmpC ß-lactamases: what do we need to know for the future? J Antimicrob Chemother, 2003, 52, 2-4.
10. Hrabák, J. Klinicky významné ß-laktamázy gramnegativních bakterií: AmpC. Epidemiol Mikrobiol Imununol, 2007, 56, 155-165.
11. Hrabák, J., Vaniš, V., Bergerová, T. et al. Průkaz ß-laktamáz širokého spektra (ESBL) a typu AmpC u enterobakterií. Zprávy CEM (SZÚ Praha), 2007, 16, 31-36.
12. Chromá, M., Kolář, M., Sauer, P. et al. Molekulárno-biologická analýza ESBL-pozitívnych izolátov Klebsiella pneumoniae od pacientov v intenzívnej starostlivosti. Klinická mikrobiologie a infekční lékařství, 2007, 13, 206-211.
13. Jacoby, G. A, Walsh, K. E., Walker, V. Identification of extended-spectrum, AmpC, and carbapenem-hydrolyzing ß-lactamases in Escherichia coli and Klebsiella pneumoniae by disk tests. J Clin Microbiol, 2006, 44, 1971-1976.
14. Kolář, M. Klinický význam širokospektrých ß-laktamáz a zkušenosti s jejich identifikací v mikrobiologické praxi. Klinická mikrobiologie a infekční lékařství, 2007, 13, 195-205.
15. Kolář, M. Vývoj bakteriální rezistence a nová antimikrobní léčiva. Interní med, 2007, 5, 213-216.
16. Kolář, M., Látal, T., Čermák, P. et al. Prevalence of extended-spectrum ß-lactamase-positive Klebsiella pneumoniae isolates in the Czech Republic. Int J Antimicrob Agents, 2006, 28, 49-53.
17. Kolář, M., Urbánek, K., Látal, M. Antibiotic selective pressure and development of bacterial resistance. Int J Antimicrob Agents, 2001, 17, 357-363.
18. Kolář, M., Urbánek, K., Lochmannová, J. Výchozí zdroje racionální antibiotické léčby bakteriálních infekcí. Prakt Lékáren, 2006, 1, 20-23.
19. Laxminarayan, R. Antibiotic resistance: The unfolding crisis. In: Laxminarayan, R., Malani, A., Howard, D. et al. Extending the cure - Policy responses to the growing threat of antibiotic resistance. Washington D.C., Resources for the Future, 2007, 25-34. ISBN 978-1-933115-57-3.
20. Padilla, E., Alonso, D., Doménech-Sánchez, A. et al. Effect of porins and plasmid-mediated AmpC ß-lactamases on the efficacy of ß-lactams in rat pneumonia caused by Klebsiella pneumoniae. Antimicrob Agents Chemother, 2006, 50, 2258-2260.
21. Philippon, A., Arlet, G., Jacoby, G. A. Plasmid-determined AmpC-type ß-lactamases. Antimicrob Agents Chemother, 2002, 46, 1-11.
22. Rijavec, M., Budič, M., Mrak, P. et al. Prevalence of COLE1-like plasmids and Colicin K production among uropathogenic Escherichia coli strains and quantification of inhibitory activity of Colicin K. Appl Environ Microbiol, 2007, 73, 1029-1032.
23. Song, W., Moland, E. S., Hanson, N. D. et al. Failure of cefepime therapy in treatment of Klebsiella pneumoniae Bacteremia. J Clin Microbiol, 43, 2005, 43, 4891-4894.
24. Taneja, N., Rao, P., Arora, J. et al. Occurrence of ESBL & Amp-C ß-lactamases & susceptibility to newer antimicrobial agents in complicated UTI. Indian J Med Res, 2008, 127, 85-88.
25. Thomson, K. S. Controversies about Extended-Spectrum and AmpC beta-lactamases. Emerg Inf Dis, 2001, 7, 333-336.
26. Trautner, B. W., Hull, R. A., Darouiche, R.O. Colicins prevent colonization of urinary catheters. J Antimicrob Chemoter, 2005, 56, 413-415.
27. Urbánek, K., Kolář, M., Lovečková, Y. et al. Influence of third-generation cephalosporin utilization on the occurrence of ESBL-positive Klebsiella pneumoniae strains. J Clin Pharm Therapeut, 2007, 32, 403-408.
28. Urbášková, P. Rezistence bakterií k antibiotikům. Vybrané metody, Trios, 1998.
Labels
Hygiene and epidemiology Medical virology Clinical microbiologyArticle was published in
Epidemiology, Microbiology, Immunology

2008 Issue 4
-
All articles in this issue
- Ilja Iljič Mečnikov a Paul Ehrlich:laureáti Nobelovy ceny v r. 1908 za práce o imunitě
- Rezistence enterobakterií ke karbapenemům
- Charakteristika a prevalence klonů Listeria monocytogenes izolovaných od pacientů v letech 2001-2008 v České republice
- Detekce ß-laktamáz typu AmpC u gramnegativních bakterií izolovaných z moče
- Stanovení koncentrace kalprotektinu ve stolici u nemocných s idiopatickými střevními záněty - srovnání dvou komerčních testů
- Epidemiology, Microbiology, Immunology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Rezistence enterobakterií ke karbapenemům
- Stanovení koncentrace kalprotektinu ve stolici u nemocných s idiopatickými střevními záněty - srovnání dvou komerčních testů
- Detekce ß-laktamáz typu AmpC u gramnegativních bakterií izolovaných z moče
- Ilja Iljič Mečnikov a Paul Ehrlich:laureáti Nobelovy ceny v r. 1908 za práce o imunitě
