Chromozomální integrace šestého lidského herpesviru (HHV-6)
Chromosomal Integration of the Sixth Human Herpes Virus (HHV-6)
Two closely related and commonly found human herpesviruses HHV-6 A and HHV-6 B are classified into the sixth human herpes virus complex (HHV-6). Primary infection with HHV-6 often takes place in early childhood and it can be either asymptomatic or manifests itself as sixth disease (caused by HHV-6 B). HHV-6 remains present in a latent form in the body with the potential for virus reactivation. The article points out the phenomenon of chromosomal integration of HHV‑6 (Ci-HHV-6) which is found in about 1% of the population and, unlike the commonly spread HHV-6 infection, has become hereditary, with its pathological potential in Ci-HHV-6 DNA carriers remaining unknown. Therefore, the focus on clinical consequences of Ci-HHV-6 is of high relevance to the therapeutic strategy for patients with high HHV-6 positivity in molecular biological tests.
Key words:
sixth human herpesvirus – molecular biology – PCR – chromosome
:
Hubáček Petr 1,2; Hrdličková Alena 2; Zajac Miroslav 1
:
Ústav lékařské mikrobiologie 2. lékařské fakulty UK a Fakultní nemocnice v Motole
1; Klinika dětské hematologie a onkologie 2. lékařské fakulty UK a Fakultní nemocnice v Motole
2
:
Epidemiol. Mikrobiol. Imunol. 61, 2012, č. 3, s. 58-66
Do komplexu šestého lidského herpesviru (Human herpesvirus – 6; HHV-6) jsou řazeny dva blízce příbuzné a v populaci běžně se vyskytující viry HHV-6 A a HHV-6 B. Primoinfekce HHV-6 probíhá většinou již v časném dětském věku, a to jak asymptomaticky, tak u HHV-6 B také ve formě šesté exantémové nemoci. Po primoinfekci zůstává HHV-6 v organismu přítomen v latentní formě, s možností virových reaktivací. Článek popisuje v odborné veřejnosti méně známý fenomén chromozomální integrace HHV-6 (Ci-HHV-6), který se v běžné populaci vyskytuje s frekvencí přibližně 1% a který je na rozdíl od běžně se šířící infekce dědičný a bez dosud známého patologického dopadu na nosiče této integrované HHV-6 DNA. I proto je znalost klinických souvislostí přítomnosti Ci-HHV-6 zásadní pro správně vedenou terapii v situaci vysoké pozitivity při molekulárně-biologické detekci HHV-6.
Klíčová slova:
šestý lidský herpesvirus – molekulární biologie – PCR – chromozom
ŠESTÝ LIDSKÝ HERPESVIRUS
Šestý lidský herpesvirus, Human herpesvirus 6 (HHV-6), je názvem komplexu dvou velmi blízce příbuzných virů známých jako HHV-6 A a HHV-6 B, dříve popisovaných jako subtypy HHV-6 [1]. Oba jsou členy podčeledi ß-herpesviridae, stejně jako jeho příbuzní – lidský cytomegalovirus (CMV) a sedmý lidský herpesvirus (Human herpesvirus 7; HHV-7) [36].
Podobně jako další zástupci lidských herpesvirů po primoinfekci zůstává HHV-6 v latentní formě v organismu hostitele [9]. Tato latentní infekce je umožněna epizomickým setrváním samostatné a oproti lidským chromozomům malé cirkulární formy HHV-6 DNA v jádře. Z této, v jádře přítomné latentní formy DNA, je pak HHV-6 schopen se v určitých situacích reaktivovat a zároveň modulovat chování imunitního systému směrem, který zvýhodňuje jeho přežití či pomnožení [9]. Také proto byl prvně popsán jako HBLV (Human B Lymphotrofic Virus – Lidský B lymfotropní virus) u imunosuprimovaných pacientů včetně HIV pozitivních v laboratoři dr. Roberta C. Gala v roce 1986 [17].
Morfologicky je HHV-6 obalený virus s ikosahedrální strukturou kapsidy a genomem, který tvoří dvouřetězcová molekula DNA o velikosti 160, respektive 162 kilobazí a velikostí maturovaného infekčního virionu přibližně 200 nm [9]. Shoda genetické informace HHV-6 A a HHV-6 B na úrovni DNA sekvence je více než 90% [9, 36]. HHV-6 A i HHV-6 B jsou především T lymfotropní, a to i přesto, že byl HHV-6 původně popsán jako B lymfotropní virus [39].
Buněčným receptorem pro HHV-6 je jeden z regulačních proteinů komplementové kaskády – CD46 [9]. Díky tomu, že se tato molekula vyskytuje i na dalších buňkách organismu, je HHV-6 schopný infikovat in vitro také další buňky, jako jsou monocyty/makrofágy, NK buňky, fibroblasty, astrocyty, oligodendroglie, mikroglie, buněčné linie jaterních buněk, epiteliální a endoteliální buňky. In vivo jsou pak u HHV-6 popsány infekce mozkové tkáně, jater, tonzil, slinných žláz, endotelií a kostní dřeně [9].
Stejně jako u dalších herpesvirů, umožňuje obsáhlost genomu HHV-6 nést značné množství genů včetně genů modulujících imunitní odpověď hostitele. Z dosud popsaných 66 genů HHV-6 se známou či předpokládanou funkcí [39], se jedná např. o virové homology chemokinů, jako je kupříkladu produkt genu U83. Tento protein funguje jako vysoce účinný chemokin s vazbou na CCR2 (chemokinový receptor 2, CD192), který při svém výskytu v prostředí přitahuje do místa výskytu HHV-6 buňky monocyto-makrofágového systému. Infikování těchto buněk pak umožňuje snazší šíření HHV-6 infekce v organismu hostitele. Z dalších vlivů HHV-6 pak můžeme zmínit například zvýšení produkce INF-α v napadených buňkách a naopak snížení produkce INF-γ, aktivujícího imunitní odpověď. Obdobným způsobem moduluje HHV-6 imunitní odpověď pomocí napadených buněk monocyto-makrofágového systému, kdy zvyšuje v buňkách produkci IL-10 a snižuje produkci IL-12. Tato modulace pak vede k potlačení cytotoxické a zvýšení protilátkové odpovědi imunitního systému tak, aby nedošlo ke zničení napadených buněk. Tyto a mnoho dalších mechanismů zapojených do modulace chování jednotlivých buněk i celkových imunitních reakcí pak ukazují na komplexnost pochodů při infekci HHV‑6 [9]. Proteinový aparát viru zároveň umožňuje HHV-6 latentní setrvávání v organismu a jeho reaktivaci při stresu, či imunosupresivním stavu [9].
HHV-6 A A HHV-6 B
HHV-6 A a HHV-6 B byly popsány jako subtypy HHV-6 až v roce 1993 po sedmi letech od objevu viru [2]. Přestože jsou, jak již bylo uvedeno, genetické odlišnosti HHV-6 A a HHV-6 B relativně malé, jejich biologické vlastnosti i příznaky infekce (viz níže) se liší. I z těchto důvodů byly podle ICTV (International Committee for Taxonomy of Viruses) oba původní subtypy HHV-6 v updatu 8. vydání mezinárodní virové nomenklatury uznány za dva samostatné virové druhy [1]. Spolu s Herpes simplex virem 1 a 2 a Varicella-Zoster virem (reprezentujícími skupinu lidských α-herpesvirů), svými příbuznými CMV a HHV-7, virem Epstein-Baarové (EBV) a osmým lidským herpesvirem (Human herpesvirus 8; HHV-8) pak jeden z těchto subtypů bude představovat devátý lidský herpesvirus. Aby však nebyly do již existující literatury, věnující se již téměř třicet let zjišťování různých vlastností HHV-6, zanášeny nomenklaturní nejasnosti, budou se i nadále oba viry nazývat svými původními názvy – tedy HHV-6 A a HHV-6 B [1].
EPIDEMIOLOGIE A KLINICKÉ PŘÍZNAKY INFEKCE HHV-6
Z obecného pohledu většina primoinfekcí HHV‑6 probíhá asymptopaticky. V případě HHV-6 A se dosud nepodařilo najít a prokázat zcela jasnou kauzalitu infekce s patologickým stavem [36].
Oproti tomu HHV-6 B je dobře znám jako původce šesté dětské nemoci (Roseola infantum, Exanthema subitum). Toto běžné benigní dětské onemocnění je zpravidla příznakem primoinfekce, která se projevuje dvěma dny horeček s náhlým koncem doprovázeným výsevem prchavého exantému. Samotná „náhlá vyrážka“ (Exanthema subitum) pak ustupuje v řádu desítek minut, takže často ani urychleně přivolaný lékař již nemusí kožní projevy u dítěte zastihnout. Primoinfekce se také může projevit jako respirační, nebo průjmové onemocnění bez exantému, případně ve starším věku příznaky infekční mononukleózy (mononukleosa-like syndrom). Vzácněji může infekce HHV-6 B způsobit febrilní křeče, hepatitidu či encefalitidu [38]. Primoinfekce se odehrává v časném dětském věku a přenáší se tělními sekrety, zejména slinami, do nichž se virus ve velkém množství uvolňuje [27]. Ve stáří 2 let je podle studií séropozitivních více než 95 % vyšetřovaných dětí [30, 36].
U imunosuprimovaných pacientů může být infekce či reaktivace HHV-6 asociována s útlumem krvetvorby, častěji a v závažnější formě se však mohou objevit i výše zmíněné komplikace primoinfekce [24]. U pacientů po transplantaci hematopoetických kmenových buněk (Haematopoietic Stem Cell Transplant – HSCT) je pak HHV-6 asociován s pozdějším přihojením štěpu a zejména opožděnou produkcí krevních destiček [24]. Zároveň je známo, že se u těchto pacientů HHV-6 často reaktivuje v souvislosti s dalšími, zejména herpesvirovými infekcemi [15] a s nemocí štěpu proti hostiteli [35]. Jde-li jen o příznak hloubky imunosupresivního stavu nebo o nějaké aktivní zapojení na základě produkce virových homologů cytokinů a modulace imunitního systému, dosud není zcela objasněno.
DIAGNOSTIKA INFEKCE HHV-6 (B)
V současné době se diagnostika HHV-6 infekce opírá především o klinické hodnocení proběhlého stavu, potvrzeného případně sérologickou detekcí protilátek proti HHV-6 [36]. Sérologická detekce je nicméně významně limitována nedostatkem spolehlivých diagnostických sad založených na principu ELISA, zejména pro detekci protilátek IgM. Detekce protilátek se tak provádí většinou metodou nepřímé imunofluorescence, která je ovlivněná subjektivním hodnocením vyšetřujícího a jeho zkušenostmi. Výpovědní hodnotu sérologických testů také omezuje obtížnost interpretace výsledků u pacientů s latentní infekcí HHV-6 způsobenou zejména zkříženou reaktivitou protilátek proti HHV-6 A, HHV-6 B a HHV-7 u většiny testů, stejně jako možností zkřížené reaktivity dalších protilátek při povšechné aktivaci imunitního systému. U části pacientů v časném stadiu infekce pak naopak ještě nemusí být IgM protilátky detekovány.
Je-li nutná přímá detekce HHV-6, jako např. u imunosuprimovaných pacientů, u kterých je tvorba protilátek značně omezena, či blokována úplně, je přímá diagnostika založená na molekulárně-biologické detekci nukleových kyselin pomocí PCR, případně kvantitativní real-time PCR (RQ-PCR – real-time quantitative PCR) [36]. Možnost detekce antigenu byla prokázána [34], ale na rozdíl od CMV se u HHV-6 nezačala více využívat.
Kultivace HHV-6 není v běžné laboratorní praxi prováděna pro časovou i technickou náročnost [36].
TERAPIE HHV-6
Léčba HHV-6 infekce zpravidla není nutná a žádné virostatikum není přímo schváleno pro terapii HHV-6. Pokud však závažnost klinických příznaků, zejména ve spojení s nedostatečnou imunitní funkcí hostitelského organismu, vyžaduje virostatickou terapii, je infekce léčena stejně jako infekce příbuzným virem CMV včetně dávkování. Terapie je tedy založena na podávání nukleosidových analogů blokujících virovou DNA polymerázu. K dispozici jsou dvě skupiny virostatik. První, do které patří ganciklovir, jeho perorální prodrug valganciklovir, či případně cidofovir, je plně aktivní po fosforylaci pomocí virové thymidin-kinázy. Druhou skupinu, inhibující přímo virovou polymerázu, pak zastupuje foscarnet. Cidofovir, který je velmi účinným virostatikem se širokým spektrem virostatického působení, je pak kvůli významné toxicitě podáván jen v případě krajní nouze.
Nežádoucí účinky virostatické terapie – suprese funkce kostní dřeně (ganciklovir, valganciklovir) či nefrotoxicita (foscarnet a cidofovir) však mohou vést k závažným komplikacím klinického stavu pacientů, a tak je léčba, zaměřená cíleně pouze na HHV-6, relativně vzácná [24].
CHROMOZOMÁLNÍ INTEGRACE HERPESVIROVÉ DNA
Z obecného pohledu je schopnost integrace herpesvirového genomu do genomu hostitele známá od roku 1991 u ptačího herpesviru způsobujícího Markovu chorobu (Marek’s disease) [20]. Tuto infekční nemoc kura domácího popsal v roce 1907 maďarský profesor József Marek jako nervovou paralýzu způsobenou monocytární infiltrací nervové tkáně [26]. Následně pak došlo k průkazu asociace této paralýzy s tvorbou lymfoidních nádorů – lymfomatózou. I proto se ve veterinární medicíně věnuje Markově nemoci drůbeže velká pozornost včetně vakcinační prevence. Zajímavé je, že přestože patří Marek’s disease virus (MDV) mezi α-herpesviry (tedy podobně jako lidský HSV a VZV), je stejně jako HHV-6 lymfotropním virem. Rovněž u EBV byla prokázána schopnost chromozomální integrace v nádorových buňkách in vitro i in vivo [25, 26].
CHROMOZOMÁLNÍ INTEGRACE HHV-6
Chromozomální integrace HHV-6 (Ci-HHV-6) byla in vitro poprvé popsána na buněčných liniích Daibatou et al. v roce 1999 [8]. V roce 2004 Tanaka--Taya et al. popsali dědičnost Ci-HHV-6 [32] a v roce 2006 Clark et al. publikovali pozorování přenosu vysoké hladiny HHV-6 DNA při HSCT z dárce na příjemce bez jakýchkoli jasných obtíží asociovaných s HHV-6 u obou zúčastněných osob [6]. Současně se pomocí fluorescenční in-situ hybridizace (Fluorescent In-Situ Hybridisation – FISH) podařilo prokázat přímo místo integrace v chromozomech dárce. Přestože se celé genomy některých virů integrují do lidského genomu (např. HIV), jedná se v případě HHV-6 mezi lidskými herpesviry o in vivo dosud zřídka popisovanou situaci [26].
Od roku 2006 se chromozomální integraci HHV-6 (Ci-HHV-6) věnuje s ohledem na rozvoj molekulárněbiologické diagnostiky větší pozornost. Důvodem je zejména snadná misinterpretace pozitivního výsledku detekce u vertikálně děděné HHV-6 DNA s následným dopadem na rozhodování o další léčbě pacienta. V současné době nejsou bohužel známy ještě všechny biologické aspekty a souvislosti Ci-HHV-6 [30], přesto bychom v našem článku chtěli shrnout dosud známá fakta o Ci-HHV-6 včetně znalostí o výskytu v České republice.
MECHANISMUS INTEGRACE HHV-6
Bohužel, hned na začátek musíme přiznat, že i v tomto bodě zbývá ověřit ještě mnoho faktů, týkajících se zejména vlastního molekulárněbiologického procesu integrace. Dobře známý je nicméně fakt, že HHV-6 se neintegruje pouze na jedno místo v lidském genomu, tedy na 1 chromozom [26, 30]. Až dosud je v literatuře popsáno kolem dvaceti různých míst integrace HHV-6 DNA do lidských chromozomů. Jsou popsány integrace na krátkých i dlouhých raménkách chromozomů 1, 9, 10, 11, 17, 18, 22 [26]. U pacientů popsaných v České republice byla dosud HHV-6 DNA identifikována na dlouhých raménkách chromozomu 2, 18 a 22 [14].
Všechna dosud popsaná místa integrace virové DNA se nacházejí v telomerické a subtelomerické oblasti chromozomů [4, 19, 26, 28]. Jedná se tedy o koncové oblasti chromozomů, na kterých dochází v průběhu dělení buňky ke zkracování a které jsou tak svým zmenšováním jedním z faktorů podílejících se na regulaci buněčného dělení [29]. I z tohoto důvodu je u nádorových buněk popsána aktivita telomerázy, tedy enzymu znovu syntetizujícího tyto úseky [29]. Zda-li má Ci-HHV-6 nějaký vliv na aktivitu tohoto enzymu, a tak na rozvoj maligní buněčné proliferace, není známo. Arbuckle et al. [3] popsali pravděpodobný mechanismus integrace pomocí homologní rekombinace HHV-6 DNA do telomerických oblastí. Děje se tak na základě podobnosti repetitivních terminálních sekvencí virového genomu a sekvencí telomer pomocí virové rekombinázy UL94. UL94 je pak v případě HHV-6 homologní s jinými virovými enzymy účastnícími se integrace virového genomu do genomu hostitelské buňky, jako je rep68/78 u parvoviru AAV-2 [26]. Ačkoli se jejich výsledky dosud nepodařilo potvrdit, činí využití rekombinantních mechanismů a enzymového aparátu buňky a viru toto vysvětlení velmi pravděpodobným [19]. Z rekombinantního mechanismu také vyplývá, že se HHV-6 DNA integruje kompletní, a je tedy otázkou, zda-li by se nemohla z této integrace také uvolňovat zpět do stadia aktivní infekce, provázené tvorbou volných a infekčních virových partikulí.
DĚDIČNOST A FREKVENCE VÝSKYTU Ci-HHV-6
Integrace HHV-6 do zárodečných buněk dobře vysvětluje klasickou Mendelovskou dědičnost Ci‑HHV-6 v jednotlivých rodinách [26, 30] – obrázek 1. Tato dědičnost předpokládá výskyt integrované HHV-6 DNA již ve spermii a vajíčku. Zmíněné procesy rekombinace jsou známy svou aktivitou v procesu gametogeneze [31], ačkoli dosud nebyl popsán žádný případ de novo integrace HHV-6 do zárodečných buněk. U všech dosud popsaných případů se tedy jednalo o záchyt jedince, který Ci-HHV-6 již zdědil od svých předků, a tak se HHV-6 DNA vyskytuje ve všech buňkách lidského těla. Také z tohoto důvodu se dá pro důkaz Ci-HHV-6 použít detekce virové DNA ve vlasových folikulech nebo v odstřižcích nehtů metodou PCR [13, 37], tedy v bezkrevné tkáni, kde by se herpesvirová DNA neměla vyskytovat ani v případě aktivní proliferace HHV-6 v organismu.
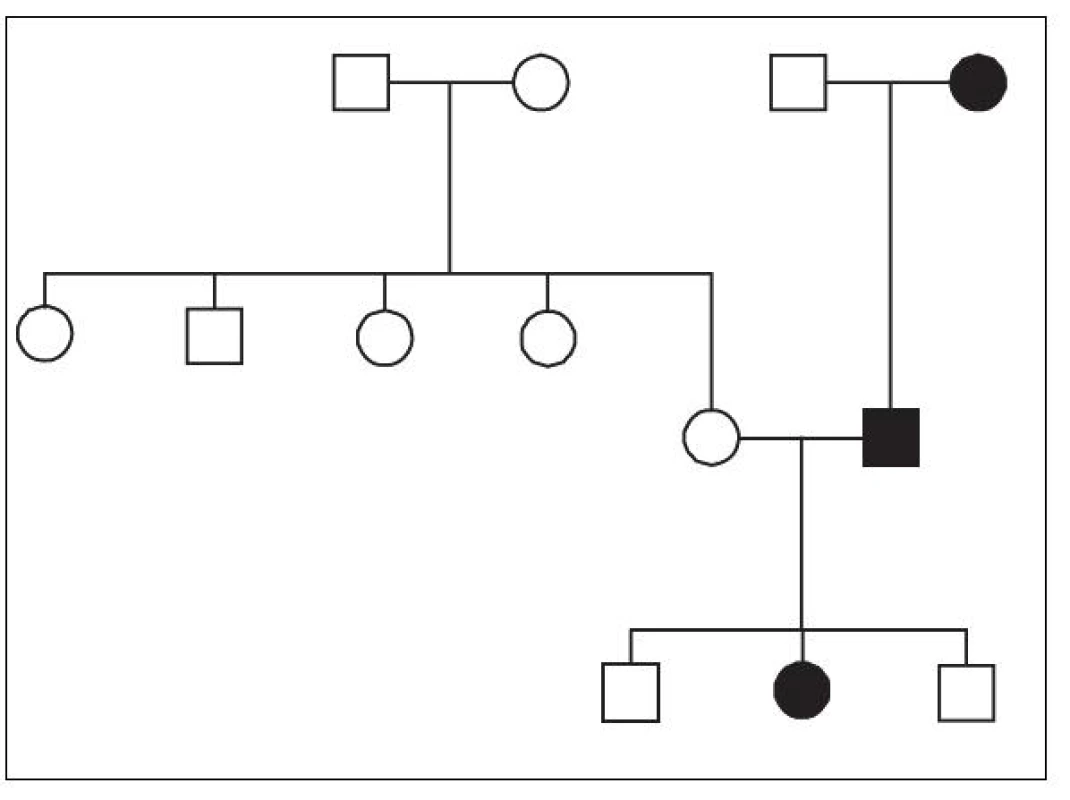
Frekvence výskytu takto děděného HHV-6 je pak popsána mezi 0,2–12,7 % v různých populacích a kohortách pacientů [30, 36] a – pokud sečteme jednotlivé případy – je v současnosti ve světě popsáno přibližně sto rodin, ve kterých se Ci-HHV-6 dědí [30]. Shrneme-li dosud publikovaná data, pohybuje se tedy frekvence výskytu Ci‑HHV-6 přibližně kolem 1 % [30].
V České republice jsme v retrospektivní studii u dětských pacientů s akutními leukémiemi publikované v roce 2009 prokázali frekvenci výskytu 1,5% [13]. V průběhu následujících let jsme množství testovaných pacientů s hematologickými malignitami rozšířili a frekvenci zpřesnili na 1,3 % a zároveň jsme velmi podobnou frekvenci (1,2 %) zachytili ve vzorcích nehtů zdravých dobrovolníků a náhodně vyšetřených pacientů, především studentů, z české populace [Hubáček et al. článek v recenzním řízení].
DETEKCE Ci-HHV-6
Detekce Ci-HHV-6 se zakládá zejména na prokázání vysoké kvantity HHV-6 DNA v testovaném vzorku. Díky tomu, že se HHV-6 DNA vyskytuje v každé buňce, dá se podle buněčnosti extrahovaného materiálu usuzovat na množství detekované DNA. Obecně by tedy poměr virové a lidské DNA měl být přibližně 1 : 1 [30].
Nejčastějšími testovanými materiály jsou plná krev, plazma a sérum, je proto třeba v první řadě zmínit, že „acelulární“ materiály nejsou pro rozlišení aktivní virové infekce a Ci-HHV-6 vhodné [30]. V tomto případě je totiž třeba si jasně uvědomit, že se při detekci jedná nikoliv o buňku, ale pouze o její DNA. Jakákoli újma, která se buňkám v době od odběru do extrahování nukleové kyseliny stane, vede nevyhnutelně k jejich rozpadu a uvolnění lidské DNA (s integrovanou HHV‑6) do extracelulárního prostoru. Na rozdíl od aktivní infekce s tvorbou virových partikulí, kde se průkaz virové DNA v tomto prostoru zpravidla považuje za průkaz virémie, je průkaz virové nukleové kyseliny v plazmě a séru u Ci-HHV-6 pouze průkazem volné lidské DNA. Tyto závěry již byly i na mezinárodním fóru několikrát publikovány [16, 37]. Námi získaná data u pacientů s Hodgkinovým lymfomem pak tato pozorování potvrzují (obrázek 2).
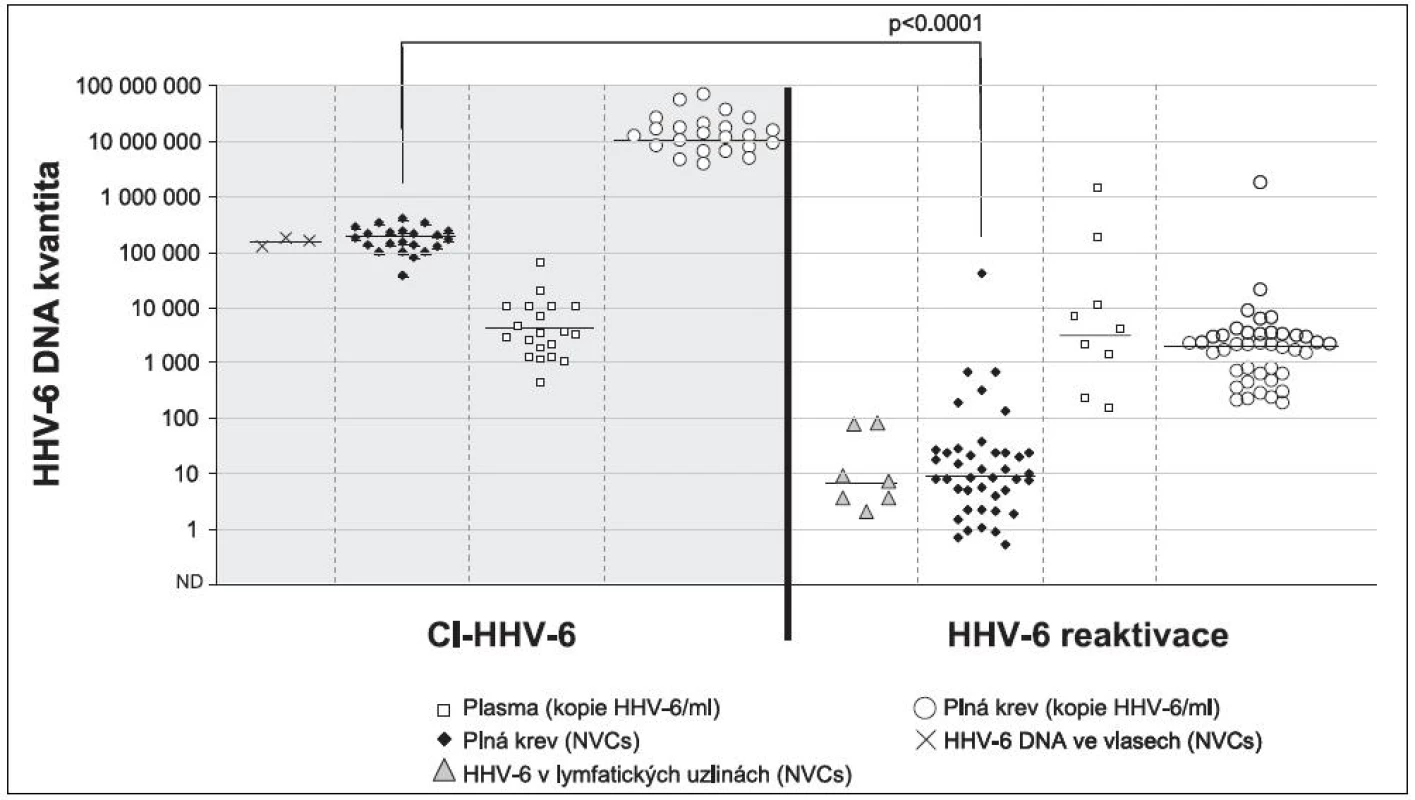
Stejně jako u dalších herpesvirů pak při detekci HHV-6 v plné krvi a v izolovaných mononukleárních buňkách narážíme na problém vyjadřování množství virové DNA. V případě vyjádření pozitivního výsledku na 1 ml plné krve by se o Ci-HHV-6 mělo uvažovat u člověka s normálním krevním obrazem, překročí-li pozitivita 320 000 kopií HHV‑6 DNA/ml (tedy 5,5 log HHV-6 DNA/ml) [5, 6, 30]. Je třeba ale vždy mít na paměti, že v tomto případě může být kvantita ovlivněna také možnými inhibitory PCR či kvalitou extrakce a nebrat tuto číselnou hodnotu úplně absolutně. Pokud je výsledek normalizován na počet buněk nebo na lidské genomické ekvivalenty, kvantifikované pomocí některého z lidských genů (např. genu pro albumin, ß-tubulin), pak by měl být zachován stejný poměr virové a lidské DNA – tedy například 200 tisíc kopií HHV-6 DNA ve 200 000 buňkách, či 10 tisíc kopií HHV-6 DNA v 10 000 kopiích lidských genomických ekvivalentů [13, 14].
Dopad Ci-HHV-6 na nositele integrace
Jak již bylo výše zmíněno, nebyla zatím in vivo popsána schopnost aktivace HHV-6 DNA z místa integrace zpět do stádia aktivní virové infekce s tvorbou infekčních partikulí. Arbuckle et al. [3] sice publikovali in vitro studii, při které se pomocí vcelku agresivních virus-aktivujících látek podařilo z kultury buněk nosiče Ci-HHV-6 izolovat infekční partikuli HHV-6, nicméně tato data se dosud nepodařilo potvrdit dalšími vědeckými skupinami (osobní komunikace).
Důkazy o tom, že se chromozomálně integrovaná HHV-6 DNA může přepisovat do mRNA, jsou nicméně publikovány, a tak je velmi pravděpodobné, že by tedy mohlo docházet také k tvorbě některých virových proteinů [7]. S ohledem na velký proteinový aparát, který je obsažen v genomu HHV-6, jehož jednou z hlavních funkcí je modulace funkcí imunitního systému a jeho buněk, je otázkou, nemůže-li se tvorba takových proteinů a jejich uvolňovaní do buňky a jejího okolí podílet na určitých patologických procesech, a negativně se tak zapojovat do klinického vývoje nemoci nositele Ci-HHV-6. I v případě již prokázaných mRNA (U11, U14, U27, U31, U38, U39, U51, U69, U83, U90, U91 a U94 [7]) se totiž jedná o geny, zapojené také do těchto imunitních modulací.
Jednou z otázek, která zůstávala nezodpovězená, byla také odpověď nositele Ci-HHV-6 na běžnou primoinfekci HHV-6, lépe řečeno alespoň na HHV-6 B [30]. Víme-li totiž o přepisu některých integrovaných genů do mRNA, jsou z obecného pohledu možné dva základní scénáře reakce osoby s Ci-HHV-6 na HHV-6 infekci. Tím prvním je zvýšená reaktivita imunitního systému, a tak přirozená imunita vůči infekci, protože hypoteticky dochází k opakované prezentaci virových proteinů, a tak k opakované stimulaci imunitních buněk hostitele proteiny HHV-6 [21]. Druhou variantou je pak naopak zvýšená citlivost k běžné infekci HHV-6. Tuto hypotézu podporuje nutnost objevení se virových proteinů v době zrání imunitního systému, kdy jsou procesem pozitivní a negativní selekce selektovány lymfocyty, které jsou schopné nutných interakcí s dalšími buňkami imunitního systému, zejména tedy antigen prezentujícími buňkami, které ale zároveň nereagují vůči vlastním antigenům a nejsou tedy autoimunní [21]. Pokud víme, že dochází k přepisu mRNA a dá se tedy předpokládat, že na jejich základě vznikají virové proteiny a jejich fragmenty prezentované následně na HLA-I, měly by i buňky reagující proti aminokyselinovým sekvencím HHV-6 být negativně selektovány a skončit, jako potenciálně autoimunní, apoptózou [21]. Jak bylo výše uvedeno, detekce Ci-HHV-6 i HHV-6 infekce je založena v současné době především na PCR, a tak je rozlišení primoinfekce na podkladě vysoké nálože DNA velmi obtížné. Z našich dat u imunosuprimovaných pacientů nicméně vyplývá, že v případě Ci‑HHV-6 u nositele HHV-6 A, může dojít k infekci i reaktivaci HHV-6 B ve stejné míře, jako je tomu u pacientů bez Ci-HHV-6, a tak tedy muselo v minulosti dojít k primoinfekci HHV-6 B [Hubáček et al. článek v recenzním řízení]. Na úrovni protilátkové odpovědi byla zkřížená reaktivita proti HHV-6 A a HHV-6 B jasně prokázána [33], naše pozorování přesto nepodporují dostatečnou ochrannou zkříženou reaktivitu lymfocytů proti blízce příbuzným a sekvenčně velmi obdobným HHV-6 A a B, a tak nepřímo podporují oddělení těchto dvou subtypů do samostatných virových druhů [Hubáček et al. článek v recenzním řízení]. Dosud se nepodařilo získat jasná data vztahující se v případě HHV-6 primoinfekce u nosiče Ci‑HHV-6 k humorální imunitní odpovědi [30].
Pokud bychom jako modelovou situaci pro reaktivaci jakékoli latentní virové infekce obsažené v organismu včetně HHV-6 vzali HSCT, můžeme konstatovat, že dosud publikovaná data neposkytují důkaz, že by se integrovaný genom HHV-6 jakkoli podílel na zhoršení prognózy pacienta. Ve všech dosud publikovaných případech, a to jak při přenosu integrované HHV-6 DNA v kmenových buňkách dárce allogenní HSCT [6, 10, 18], tak v případě Ci-HHV-6 u příjemce kmenových buněk od dárce bez integrované HHV-6 DNA [11, 14], nejsou jasné důkazy pro jakéhokoli patogenní působení integrovaného viru. V případě dvou námi publikovaných pacientů pak můžeme nanejvýš spekulovat, zda se na rychlém vývoji rezistence CMV vůči virostatické terapii infekce po HSCT nemohly podílet také proteiny HHV-6, které jsou do jisté míry s proteiny CMV homologní [14, 39].
V případě pacientů po orgánových transplantacích pak Lee et al. pozorovali u pacientů s transplantovanou ledvinou a játry tendenci k mírně horší prognóze v souvislosti s Ci-HHV-6 [22, 23].
ČÍM JE TEDY Ci-HHV-6 KLINICKY DŮLEŽITÉ?
S ohledem na diagnostiku HHV-6 infekce je pro správné hodnocení nálože HHV-6 DNA zásadní mít na zřeteli přítomnost virové DNA ve všech buňkách organismu nebo orgánu u Ci-HHV-6. Z tohoto důvodu totiž může být HHV-6 DNA detekována u pacienta s Ci-HHV-6 i v případě např. enterovirové encefalitidy, kdy ale množství virové DNA bude pouze odrážet množství lidské DNA, a tedy množství enteroviry poškozených a zničených buněk a nikoli nutně podíl HHV-6 na neurologických příznacích. Stejně se pak HHV-6 DNA může objevit i v dalších klinických stavech a materiálech, kde by se jinak virová DNA neměla ve velkých kvantitách standardně nacházet – např. u pneumonie. V těchto případech pak může dojít k misinterpretaci výsledku s následným špatným rozhodnutím ohledně nutnosti použít virostatika a případného dalšího diagnostického a terapeutického postupu [12].
Na druhou stranu v případech vzácné opravdové HHV-6 nemoci, tedy plně symptomatické např. pneumonie s proliferací viru či encefalitidy, nelze tuto virovou infekci přehlížet a je nutno ji začít co nejdříve léčit virostatiky. Nasazení terapie je pak často podpořeno i tím, že se nemoc plně rozvine u imunosuprimovaného pacienta. Rozdíl mezi Ci‑HHV-6 a symptomatickou nemocí pak většinou ozřejmí vyšetření hladiny HHV-6 v plné periferní krvi, kdy u pacientů se symptomatickou HHV-6 nemocí nejsou detekované kvantity tak enormní, případně není zachován poměr lidské a virové DNA 1 : 1. Obdobně není možné u symptomatického onemocnění detekovat přítomnost HHV-6 DNA ve vlasových folikulech či nehtech.
JAK POSTUPOVAT V PŘÍPADĚ VYSOKÉ POZITIVITY HHV-6 DNA?
Při interpretaci všech laboratorních výsledků, včetně molekulárněbiologické detekce infekčních agens, je nutné pečlivě přihlížet ke klinickému stavu pacienta. Pokud dojde k detekci pozitivity HHV‑6 v biologickém materiálu, kde HHV-6 DNA neměla být detekována (např. mozkomíšní mok či vzorek z bronchoalveolární laváže) a HHV-6 by mohlo být příčinou obtíží, je na místě podle stavu pacienta a detekované kvantity co nejrychlejší potvrzení nebo vyvrácení Ci-HHV-6. To je možno provést minimálně detekcí vysoké kvantity HHV-6 DNA v plné krvi, případně lépe v nehtech. U vysoce rizikových pacientů s podezřením na symptomatickou HHV-6 infekci (např. u pacientů po transplantacích) je vhodné po dobu nutnou pro kompletní laboratorní vyšetření pacienta zajistit virostatiky. Lékem volby je i v tomto případě i. v. ganciklovir, foscarnet nebo p. o. valganciklovir. Jak bylo výše uvedeno, u hospitalizovaných pacientů je lékem první volby i. v. ganciklovir, především v případě ambulantně léčených pacientů pak p. o. valganciklovir. Pokud se Ci‑HHV‑6 prokáže, je vysoce nepravděpodobné, že je tato zděděná virová DNA příčinou klinických obtíží a je třeba v diferenciálnědiagnostickém vyšetřování postupovat ke správné diagnóze a virostatika je možno, jsou-li nasazena jen z důvodu zajištění pacienta po dobu laboratorního vyšetřování, vysadit. Pokud se Ci-HHV-6 neprokáže, pak by terapie virostatiky měla pokračovat.
ZÁVĚR
Přestože je fenomén Ci-HHV-6 známý již relativně dlouhou dobu, zůstává s ním spojeno mnoho biologicky i medicínsky zajímavých otázek. Důvodem pomalejšího pokroku je pak zejména malý počet popsaných rodin a pacientů s Ci-HHV-6. Nejdůležitější věcí, vyplývající z dosud známých informací o tomto fenoménu, je však nutnost zahrnutí Ci-HHV-6 do základního klinického uvažování s vazbou na HHV-6 pozitivního pacienta a jeho případnou léčbu a opatrné hodnocení výsledků molekulárně-biologické detekce a případné nasazení terapie virostatiky. Pro formulaci jasných diagnosticko-léčebných guidelines jsou pak nezbytně nutné studie s větším množstvím jak pacientů s různými onemocněními, tak zdravých dobrovolníků.
Podpořeno grantem Interní grantové agentury Ministerstva zdravotnictví ČR NS 9907-4.
Do redakce došlo dne: 8. 2. 2012
Kontaktní adresa:
MUDr. Petr Hubáček, Ph.D.
Ústav lékařské mikrobiologie 2. LF UK a FN Motol
FN Motol
V Úvalu 84
150 06 Praha 5-Motol
e-mail: petr.hubacek@lfmotol.cuni.cz
Sources
1. Ablashi, D., Diluca, D., Pellett, P. E. Recognition of Human herpesvirus 6 variants A and B as distinct herpesvirus species. 8th International Committee on Taxonomy of Viruses – update, Report No.: 2011.005a-cV.A.v2 Roseolovirus-2sp,rensp.pdf. Dostupný na www: <http://talk.ictvonline.org/files/ictv_official_taxonomy_updates_since_the_8th_report/m/vertebrate-official/default. aspx>.
2. Ablashi, D. V. et al. Human herpesvirus-6 strain groups: a nomenclature. Arch. Virol., 1993, vol. no. 129, p. 363–366.
3. Arbuckle, J. H. et al. The latent human herpesvirus-6A genome specifically integrates in telomeres of human chromosomes in vivo and in vitro. Proc. Natl. Acad. Sci. USA, 2010, vol. 107, no. 12, p. 5563–5568.
4. Arbuckle, J. H., Medveczky, P. G. The molecular biology of human herpesvirus-6 latency and telomere integration. Microbes Infect., 2011, vol. 13, no. 8–9, p. 731–741.
5. Caserta, M. T. et al. Diagnostic assays for active infection with human herpesvirus 6 (HHV-6). J. Clin. Virol., 2010, vol. 48, no. 1, p. 55–57.
6. Clark, D. A. et al. Transmission of integrated human herpesvirus 6 through stem cell transplantation: implications for laboratory diagnosis. J. Infect. Dis., 2006, vol. 193, no. 7, p. 912–916.
7. Clark, D. A. et al. Reply to Boutolleau et al. and Luppi et. al. J. Infect. Dis., 2006, vol. 194, no. 7, p. 1021–1023.
8. Daibata, M. et al. Inheritance of chromosomally integrated human herpesvirus 6 DNA. Blood, 1999, vol. 94, no. 5, p. 1545–1549.
9. De Bolle, L., Naesens, L., De Clercq, E. Update on human herpesvirus 6 biology, clinical features, and therapy. Clin. Microbiol. Rev., 2005, vol. 18, no. 1, p. 217–245.
10. De Pagter, P. J. et al. Chromosomally integrated human herpesvirus 6: transmission via cord blood-derived unrelated hematopoietic stem cell transplantation. Biol. Blood Marrow Transplant., 2010, vol. 16, no. 1, p. 130–132.
11. Hubacek, P. et al. Disappearance of pre-existing high HHV-6 DNA load in blood after allogeneic SCT. Bone Marrow Transplant., 2007, vol. 40, no. 8, p. 805–806.
12. Hubacek, P. et al. Failure of multiple antivirals to affect high HHV-6 DNAaemia resulting from viral chromosomal integration in case of severe aplastic anaemia. Haematologica, 2007, vol. 92, no. 10, p. e98–e100.
13. Hubacek, P. et al. Prevalence of HHV-6 integrated chromosomally among children treated for acute lymphoblastic or myeloid leukemia in the Czech Republic. J. Med. Virol., 2009, vol. 81, no. 2, p. 258–263.
14. Hubacek, P. et al. HHV-6 DNA throughout the tissues of two stem cell transplant patients with chromosomally integrated HHV-6 and fatal CMV pneumonitis. Br. J. Haematol., 2009, vol. 145, no. 3, p. 394–398.
15. Humar, A. et al. An assessment of herpesvirus co-infections in patients with CMV disease: correlation with clinical and virologic outcomes. Am. J. Transplant., 2009, vol. 9, no. 2, p. 374–381.
16. Jeulin, H. et al. Contribution of human herpesvirus 6 (HHV-6) viral load in whole blood and serum to investigate integrated HHV-6 transmission after haematopoietic stem cell transplantation. J. Clin. Virol., 2009, vol. 45, no. 1, p. 43–46.
17. Josephs, S. F. et al. Genomic analysis of the human B‑lymphotropic virus (HBLV). Science, 1986, vol. 234, no. 4776, p. 601–603.
18. Kamble, R. T. et al. Transmission of integrated human herpesvirus-6 in allogeneic hematopoietic stem cell transplantation. Bone Marrow Transplant., 2007, vol. 40, no. 6, p. 563–566.
19. Kaufer, B. B., Jarosinski, K. W., Osterrieder, N. Herpesvirus telomeric repeats facilitate genomic integration into host telomeres and mobilization of viral DNA during reactivation. J. Exp. Med., 2011, vol. 208, no. 3, p. 605–615.
20. Kishi, M. et al. Inverted repeat regions of Marek’s disease virus DNA possess a structure similar to that of the a sequence of herpes simplex virus DNA and contain host cell telomere sequences. J. Virol., 1991, vol. 65, no. 6, p. 2791–2797.
21. Klein, L. et al. Antigen presentation in the thymus for positive selection and central tolerance induction. Nat. Rev. Immunol., 2009, vol. 9, no. 12, p. 833–844.
22. Lee, S. O. et al. Chromosomally integrated human herpesvirus-6 in kidney transplant recipients. Nephrol. Dial. Transplant., 2011, vol. 26, no. 7, p. 2391–2393.
23. Lee, S. O., Brown, R. A., Razonable, R. R. Clinical significance of pretransplant chromosomally integrated human herpesvirus-6 in liver transplant recipients. Transplantation, 2011, vol. 92, no. 2, p. 224–229.
24. Ljungman, P. et al. Management of CMV, HHV-6, HHV-7 and Kaposi-sarcoma herpesvirus (HHV-8) infections in patients with hematological malignancies and after SCT. Bone Marrow Transplant., 2008, vol. 42, no. 4, p. 227–240.
25. Luo, W. J. et al. Epstein-Barr virus is integrated between REL and BCL-11A in American Burkitt lymphoma cell line (NAB-2). Lab. Invest., 2004, vol. 84, no. 9, p. 1193–1199.
26. Morissette, G., Flamand, L. Herpesviruses and chromosomal integration. J. Virol., 2010, vol. 84, no. 23, p. 12100–12109.
27. Mukai, T. et al. Molecular epidemiological studies of human herpesvirus 6 in families. J. Med. Virol., 1994, vol. 42, no. 3, p. 224–227.
28. Nacheva, E. P. et al. Human herpesvirus 6 integrates within telomeric regions as evidenced by five different chromosomal Sites. J. Med. Virol., 2008, vol. 80, no. 11, p. 1952–1958.
29. Nicholls, C. et al. Molecular regulation of telomerase activity in aging. Protein Cell, 2011, vol. 2, no. 9, p. 726–738.
30. Pellett, P. E. et al. Chromosomally integrated human herpesvirus 6: questions and answers. Rev. Med. Virol., 2011, vol. E-pub ahead of print, no. s.
31. Pradillo, M., Santos, J. L. The template choice decision in meiosis: is the sister important? Chromosoma, vol. 120, no. 5, p. 447–454.
32. Tanaka-Taya, K. et al. Human herpesvirus 6 (HHV-6) is transmitted from parent to child in an integrated form and characterization of cases with chromosomally integrated HHV-6 DNA. J. Med. Virol., 2004, vol. 73, no. 3, p. 465–473.
33. Thader-Voigt, A. et al. Development of a microwell adapted immunoblot system with recombinant antigens for distinguishing human herpesvirus (HHV)6A and HHV6B and detection of human cytomegalovirus. Clin. Chem. Lab. Med., 2011, vol. 49, no. 11, p. 1891–1898.
34. Volin, L. et al. Human herpesvirus 6 antigenaemia in allogeneic stem cell transplant recipients: impact on clinical course and association with other beta-herpesviruses. Br. J. Haematol., 2004, vol. 126, no. 5, p. 690–696.
35. Wang, L. R. et al. Correlations of human herpesvirus 6B and CMV infection with acute GVHD in recipients of allogeneic haematopoietic stem cell transplantation. Bone Marrow Transplant, 2008, vol. 42, no. 10, p. 673–677.
36. Ward, K. N. The natural history and laboratory diagnosis of human herpesviruses-6 and -7 infections in the immunocompetent. J. Clin. Virol., 2005, vol. 32, no. 3, p. 183–193.
37. Ward, K. N. et al. Human herpesvirus 6 chromosomal integration in immunocompetent patients results in high levels of viral DNA in blood, sera, and hair follicles. J. Clin. Microbiol., 2006, vol. 44, no. 4, p. 1571–1574.
38. Ward, K. N. et al. HHV-6 DNA level in CSF due to primary infection differs from that in chromosomal viral integration and has implications for the diagnosis of encephalitis. J. Clin. Microbiol., 2007, vol. 45, no. 4, p. 1298–1304.
39. Yamanishi, K., Yasuko, M., Pellett, P. E. Human herpesvirus 6 and 7. In Knipe, D. M., Howley, P. M., editors. Fields Virology. Fifth ed., Philadelphia, PA Lippincott Williams & Wilkins|Wolters Kluwer Business; 2007. p. 2819–2845.
Labels
Hygiene and epidemiology Medical virology Clinical microbiologyArticle was published in
Epidemiology, Microbiology, Immunology

2012 Issue 3
Most read in this issue
- Chromosomal Integration of the Sixth Human Herpes Virus (HHV-6)
- The Rules for the Transport of Microorganisms
- 30 Years since the First AIDS Cases Were Reported: History and the Present Part II
- Screening Family and Sexual Contacts of HBsAg+ Persons in the Pilsen Region
