Diagnostika Clostridium difficile infekcí – porovnávací studie dvou imunoenzymatických metod s konfirmací pomocí PCR a kultivace s následnou ribotypizací kmene*
Diagnosis of Clostridium difficile infections: Comparative study of two immuno enzyme assays with confirmation by PCR and culture followed by PCR ribotyping
Study objective:
Comparison of two commercially available tests for the detection of Clostridium difficile Glutamate Dehydrogenase (GDH) and toxins A and B for their sensitivity and specificity.
Material and methods:
Eighty-six stool samples from patients hospitalised in the Motol University Hospital were analysed. GDH and toxins A and B were assayed in parallel by two tests: C. difficile Quik Chek Complete® (Techlab, USA) and Liaison® C. difficile GDH and Toxins AαB (DiaSorin, USA). From the stool samples, nucleic acids were also isolated using the UltraClean® Fecal DNA kit (MoBio Laboratories, USA). The commercially available C. difficile Elite MGB® kit (Nanogen, Italy) was used for the polymerase chain reaction (PCR). Anaerobic culture on C. difficile selective medium (Oxoid) was performed for all positive samples at least in one test. Pure isolates were characterized by PCR ribotyping.
Results:
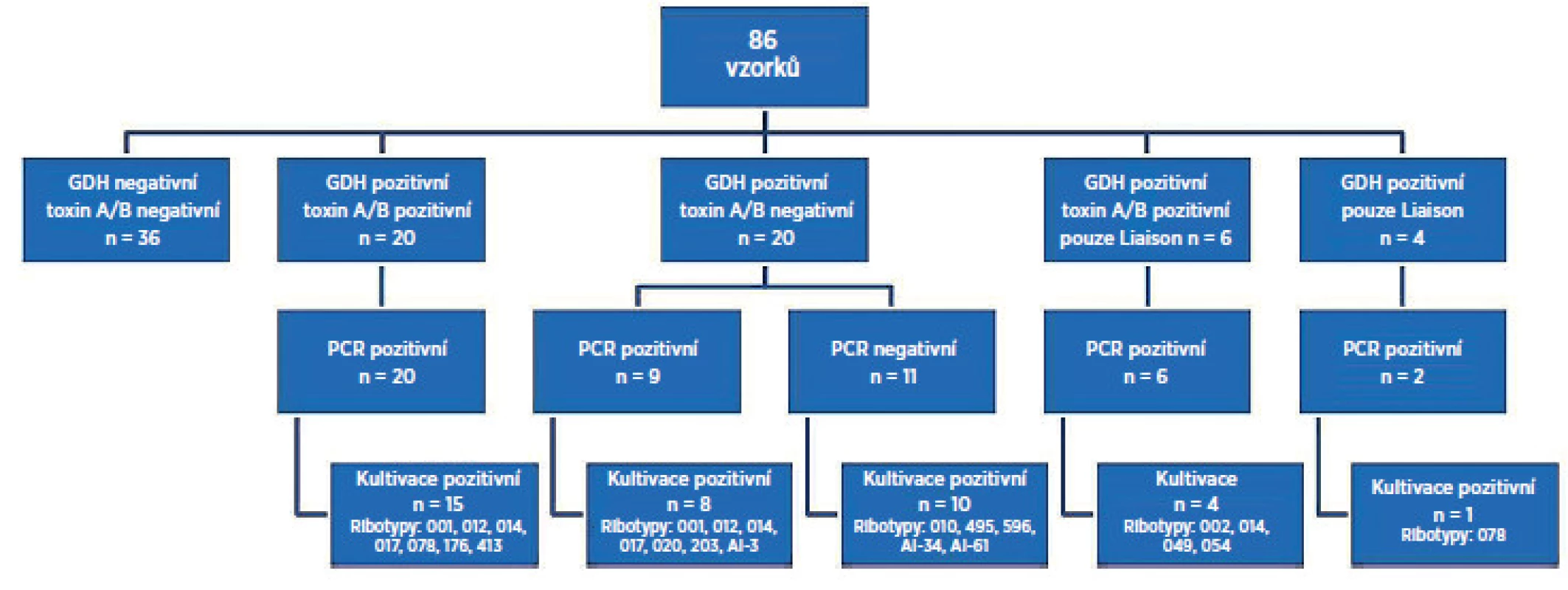
Thirty-six (42%) samples were GDH negative and toxin A/B negative by both tests. Twenty (23%) samples were GDH positive and toxin A/B positive by both tests. Nine (10%) samples were GDH positive and toxin negative by both tests, but were positive by PCR. Eleven (13%) samples that were GDH positive and toxin negative by both tests remained negative by PCR. Six (7%) samples only were GDH positive and toxin positive by the Liaison® test alone. Four (5%) samples were GDH-positive by theLiaison® test alone. Culture failure was observed in 11 (13%) samples, of which seven were positive by PCR. PCR was inhibited in five (6%) samples. The following toxigenic ribotypes: AI-3, 001, 002, 012,014, 017, 020, 049, 054, 078, 176, 203, and 413 and non-toxigenic ribotypes: AI-34, AI-61, 010, 485, 495, and 596 were identified.
Conclusion:
The Liaison® test had seven percent higher sensitivity for the detection of toxins A/B. The two-step protocol of the tests is also cost-saving. The savings can be used e.g. for incorporating the PCR techniques into the diagnostic algorithm of the laboratory.
Keywords:
Clostridium difficile – ribotyping – glutamate dehydrogenase – toxins A/B – Quik Chek Complete – Liaison
:
M. Krůtová; J. Matějková; M. Zajac; P. Hubáček
; O. Nyč
:
Ústav lékařské mikrobiologie, Univerzita Karlova, 2. lékařská fakulta a Fakultní nemocnice v Motole
:
Epidemiol. Mikrobiol. Imunol. 63, 2014, č. 2, s. 99-102
:
Review articles, original papers, case report
*Výsledky této práce byly částečně prezentovány na Kongresu klinické mikrobiologie a infekčního lékařství 2013 v Olomouci.
Cíl práce:
Porovnání senzitivity a specificity dvou komerčních testů na stanovení Clostridium difficile GDH (glutamát dehydrogenázy) a toxinů A/B.
Materiál a metodiky:
Bylo testováno 86 stolic pacientů hospitalizovaných ve FN Motol. GDH a toxiny A/B byly paralelně vyšetřovány dvěma testy: C. difficile Quik Chek Complete®, Techlab,USA) a Liaison® C. difficile GDH a Toxins AαB (DiaSorin USA). Současně byly ze stolic izolovány nukleové kyseliny pomocí UltraClean® Fecal DNA (MoBio Laboratories, USA). Pro metodu PCR byla použita komerční souprava C. difficile Elite MGB® kit (Nanogen, Itálie). Anaerobní kultivace na selektivním médiu pro C. difficile (Oxoid) proběhla u všech vzorků vykazující pozitivitu alespoň jednoho testu. Čisté izoláty byly molekulárně analyzovány ribotypizací.
Výsledky:
GDH a toxin A/B negativních oběma metodami bylo 36 vzorků (42 %). GDH a toxin pozitivních oběma metodami bylo 20 vzorků (23 %). GDH pozitivních a toxin negativních oběma metodami, ale PCR pozitivních bylo 9 vzorků (10 %). GDH pozitivních a toxin negativních oběma metodami a PCR negativních bylo 11 vzorků (13 %). GDH pozitivní, toxin pozitivní pouze testem Liaison® bylo 6 vzorků (7 %). GDH pozitivní pouze Liaison® byly 4 vzorky (5 %). K selhání kultivace došlo u 11 vzorků (13), z toho u 7 vzorků byl pozitivní test PCR. PCR reakce byla inhibována v 5 případech (6 %). Zachycené ribotypy toxigenní: AI-3, 001, 002, 012,014, 017, 020, 049, 054, 078, 176, 203, 413 a netoxigenní: AI-34, AI-61, 010, 485, 495, 596.
Závěr:
Stanovení toxinu A/B testem Liaison® vykazuje u námi vyšetřeného souboru o 7 % vyšší senzitivitu. Dvoukrokové uspořádání testů také přináší ekonomickou úsporu, která může být využita např. k zavedení PCR metod do diagnostického algoritmu laboratoře.
Klíčová slova:
Clostridium difficile – ribotypizace – glutamát dehydrogenáza – toxiny A/B – Quik Chek Complete – Liaison
ÚVOD
Clostridium difficile je významným nozokomiálním patogenem současnosti [1, 2]. V České republice dochází k výraznému nárůstu incidence CDI (Clostridium difficile Infection), zejména v souvislosti s ribotypem 176 [3]. Včasná diagnostika CDI je klíčová k zavedení protiepidemických opatření k zábraně šíření infekce a adekvátní terapie pro pacienta [4]. Podle posledních britských doporučení pro diagnostiku a hlášení C. difficile, která vycházejí z testování 12 441 průjmových stolic, je diagnostiku CDI doporučeno provádět ve dvoustupňovém testovacím schématu, které se skládá z průkazu GDH imunoenzymaticky nebo NAAT (Nucleic Acid Amplification Test) či PCR (Polymerase Chain Reaction) a v druhém kroku použití senzitivního imunoenzymatického testu na průkaz toxinu nebo cytotoxický test [5]. Zavedení PCR metod do diagnostiky CDI je evropským trendem, ať jako metody screeningové nebo konfirmační. Tyto metody se vyznačují vysokou senzitivitou a specificitou a významně zkracují čas získání výsledku [6–13]. V naší práci jsme porovnávali senzitivitu a specificitu dvou komerčních metod (imunoenzymatická a imunoluminiscenční metoda) na stanovení antigenu GDH a toxinů A/B. U všech vzorků byl zároveň proveden průkaz DNA toxigenních C. difficile pomocí real-time PCR. Vzorky, které vykazovaly pozitivitu, alespoň jednoho testu, byly kultivovány v anaerobním boxu. Izoláty C. difficile byly dále analyzovány PCR ribotypizací založené na kapilární elektroforéze.
MATERIÁL A METODY
Materiál
Do testování bylo zařazeno 86 tekutých/neformovaných stolic od pacientů s podezřením na klostridiovou infekci hospitalizovaných ve Fakultní nemocnici Motol za období květen až červen 2013.
Metody
Detekce antigenu GDH a toxinu A/B
C. difficile Quik Chek Complete® (Techlab, USA) je rychlý membránový imunoenzymatický test detekující GDH a toxiny A/B v jednom kroku [14–17].
Princip testu: Specifické protilátky (anti GDH, anti toxin A/B, anti peroxidáza) jsou imobilizovány ve třech liniích na membráně. Vzorek je přidán do ředícího roztoku obsahujícího konjugát (monoklonální protilátka specifická pro GDH a polyklonální protilátka specifická pro toxiny A/B, obě značené křenovou peroxidázou). Během 15minutové inkubace dochází k navázání antigenů ve vzorku na konjugát a migraci komplexů antigen-protilátka přes filtrační papír na membránu s imobilizovanými specifickými protilátkami. Po promytí je přidán substrát. Pokud došlo k navázání imunokomplexů antigen-konjugát na protilátku, dojde k zabarvení testovací linie.
Liaison® C. difficile GDH test (DiaSorin, USA)
Je to automatizovaná chemiluminiscenční imunoanalýza sendvičového typu určená k detekci antigenu GDH na přístroji Liaison®.
Princip testu: Vzorek je podle konzistence naředěn dilučním roztokem. Poté je přidán do extrakční zkumavky, vortexován a centrifugován. Během centrifugace dojde k oddělení pevných částí stolice od tekutiny, která je následně analyzována. Takto upravený vzorek je inkubován s paramagnetickými částicemi potaženými monoklonální protilátkou proti GDH a protilátku proti GDH konjugovanou s isoluminolem. Po inkubaci je nenavázaný materiál vymyt v promývacím kroku. Přidáním startovacího roztoku je započata chemiluminiscenční reakce. Světelný signál je v relativních světelných jednotkách (RLU) měřen fotonásobičem. Intenzita signálu je přímo úměrná ke koncentraci antigenu v kalibrátorech, kontrolách a vzorku.
Liaison® C. difficile Toxins AαB test (DiaSorin, USA)
K provedení testu byl použit předpřipravený vzorek (ředění, extrakce) z testování přítomnosti GDH. Na paramagnetických částicích je navázána monoklonální protilátka proti toxinu A a polyklonální protilátka proti toxinu B. Konjugát obsahuje polyklonální protilátky proti toxinu A a B. V tomto testu je první inkubace s konjugátem a poté inkubace s paramagnetickými částicemi. Jinak se princip testu neliší. Oba testy byly provedeny v souladu s manuálem výrobce.
Detekce DNA toxigenních C. difficile pomocí PCR v reálném čase
DNA ze vzorků stolic byla izolována a purifikována pomocí soupravy UltraClean® Fecal DNA (MoBio Laboratories, USA) podle manuálu výrobce. Interní kontrola amplifikace (součást amplifikační soupravy) byla přidána během izolace (po lyzačním kroku). PCR amplifikace byla provedena soupravou C. difficile Elite MGB® kit (Nanogen, Itálie) v souladu s manuálem výrobce. Tato metoda je založená na triplexové amplifikační reakci v reálném čase a obsahuje specifické MGB proby pro detekci genů pro produkci toxinu A, B a interní kontroly.
Anaerobní kultivace
Vzorky stolic byly kultivovány podle standardního operačního postupu pro anaerobní kultivaci C. difficile FN v Motole. Před kultivací byl vzorek vystaven tzv. „alkoholovému šoku“, kdy je vzorek stolice smíchán v poměru 1 : 1 se 70% alkoholem, vortexován a inkubován 30–60 minut při laboratorní teplotě. Dvě kapky suspenze jsou inokulovány na selektivní agar pro C. difficile (Brazier, Oxoid) a anaerobně kultivovány při 35–37 °C, 48–72 hodin. Suspektní kolonie byly konfirmovány pomocí MALDI-ToF hmotnostní spektrometrie (matrix-assisted laser desorption/ionization time-of-flight mass spectrometry) [18].
PCR ribotypizace
PCR ribotypizace následovala po extrakci DNA z kolonie čistého izolátu pomocí chelexových kuliček [19]. PCR probíhala podle standardního operačního protokolu ECDIS-net (European Clostridium difficile infection surveillance network), který je dostupný po přihlášení na http://www.ecdisnet.eu/.
Toxigenita kmene
Toxigenita kmene C. difficile byla určena pomocí multiplexové PCR reakce se specifickými primery pro geny tcdA (toxin A), tcdB (toxin B), cdtA a cdtB, (binární toxin) [20]. Vizualizace amplifikovaných PCR produktů byla provedena elektroforeticky na agarózovém gelu s barvením GelRed.
VÝSLEDKY
Souhrnné výsledky jsou schematicky znázorněny na obrázku 1. Celkem bylo testováno 86 vzorků tekutých/neformovaných stolic od pacientů s podezřením na CDI hospitalizovaných ve FN Motol. GDH a toxin A/B negativních oběma metodami a PCR negativních bylo 36 vzorků (42 %). GDH a toxin pozitivních oběma metodami a PCR pozitivních bylo 20 vzorků (23 %). GDH pozitivních a toxin negativních oběma metodami, ale PCR pozitivních bylo 9 vzorků (10 %). GDH pozitivních a toxin negativních oběma metodami, ale PCR negativních bylo 11 vzorků (13 %). GDH pozitivní, toxin pozitivní a PCR pozitivních pouze Liaison® bylo 6 vzorků (7 %). GDH pozitivní pouze Liaison® byly 4 vzorky (5 %), z toho u 2 vzorků byla PCR pozitivita. K selhání kultivace došlo u 11 vzorků (13 %), z toho u 9 vzorků byl pozitivní test PCR. PCR reakce byla inhibována v 5 případech (6 %). Po opakované izolaci DNA ze stolice nedošlo k opakované inhibici PCR reakce. Zachycené ribotypy toxigenní: AI-3, 001, 002, 012,014, 017, 020, 049, 054, 078, 176, 203, 413 a netoxigenní: AI-34, AI-61, 010, 485, 495, 596.
DISKUSE
Výsledky naší srovnávací studie ukazují, že průkaz C. difficile toxinu A/B na přístroji Liaison® vykazuje vyšší senzitivitu o 7 % ve srovnání s druhou testovanou metodou a test Liaison® C. difficile GDH o 5 % oproti testu C. difficile Quik Chek Complete®. Tento fakt si vysvětlujeme v rozdílném principu testu. Quik Chek Complete® test je metodou imunoenzymatickou, kdy detekce probíhá na imobilizovaných protilátkách na membráně, zatímco testy Liaison® C. difficile GDH a toxin A/B jsou metodami chemiluminiscenčními a protilátka je navázaná na paramagnetické kuličce, tudíž poskytuje větší povrch pro navázání případného antigenu. Výsledkem chemiluminiscenční reakce je světelný signál měřený fotonásobičem, citlivým detektorem schopným zachytit i slabé světelné signály. Intenzita signálu je přímo úměrná koncentraci analytu ve vzorku. U testu Quik Chek Complete® je hodnocení testu prováděno vizuálně. Výhodu dvoukrokového testu firmy DiaSorin vidíme především v možné ekonomické úspoře u GDH negativních vzorků, vycházíme z vysoké negativní prediktivní hodnoty GDH. GDH negativní vzorky je možno interpretovat jako definitivně negativní na přítomnost C. difficile a není třeba testovat na přítomnost toxinů A/B.
V našem souboru vzorků se jednalo o 36 vzorků (42 %). Pozitivita GDH při negativitě toxinů A, B může znamenat přítomnost netoxigenního kmene C. difficile, ale nevylučuje ani přítomnost toxigenního kmene, kdy je třeba vycházet ze skutečnosti, že žádný z doposud užívaných imunochemických testů pro přímý průkaz toxinů A a B, nedosahuje zcela spolehlivou senzitivitu. Navíc se může vyskytnout zkřížená reaktivita testu GDH s jinými klostridii. Je proto vhodné a v klinické praxi často potřebné další doplňující vyšetření – v našem případě PCR cílené na průkaz genů kódujících produkci toxinů. K selhání kultivace u 11 vzorků došlo zřejmě z důvodů přechodně vzniklé nedostatečné anaerobiózy. Spektrum zachycených ribotypů z kultivovaných kmenů C. difficile odpovídá spektru ribotypů vyskytujících se v ČR. Vycházíme z výsledků PCR ribotypizace cca 200 kmenů v roce 2012. Implementaci molekulárních metod do diagnostiky CDI považujeme za přínosnou, zvláště jako metodu konfirmační u GDH pozitivních vzorků. Náklady na diagnostický set C. difficile Elite MGB® dodávaný firmou Elisabeth Pharmacon jsou poloviční než u komerčních uzavřených systémů, nicméně je nutná předchozí izolace nukleových kyselin a s tím související vybavení a zaškolený personál laboratoře. Součástí každé testované série musí být přítomna pozitivní a negativní kontrola testu, proto je ekonomicky výhodnější testovat více vzorků najednou. Interní kontrola testu je součástí soupravy a přidává se během extrakce nukleových kyselin ze vzorku. Během našeho testování jsme zaznamenali inhibici PCR reakce v 5 případech. Bez přítomnosti interní kontroly v testu by byl vydán falešně negativní výsledek.
ZÁVĚR
Hledání optimální metody či spolehlivého algoritmu kombinujícího několik přístupů v laboratorní diagnostice CDI je stále předmětem odborných diskusí. Kromě toho se objevují stále nové komerční testy se snahou dosáhnout vysoké spolehlivosti. Diagnostické testy Liaison® C. difficile GDH, toxin A/B, (Diasorin, USA) v našem sledování potvrdily vysokou senzitivitu. Implementace přímého průkazu DNA toxigenních C. difficile amplifikací nukleových kyselin nesporně přispívá k urychlení a zkvalitnění diagnostiky CDI jako doplňující nebo konfirmační metoda u GDH pozitivních, toxin negativních vzorků. Vyšší cena PCR vyšetření, může být do jisté míry kompenzována úsporou za neprovedená stanovení toxinů u GDH negativních vzorků. Rychlá a spolehlivá detekce C. difficile má kromě vlastního benefitu pro pacienta (omezení progrese infekce a rozvoje závažných komplikací, snížení počtu následných rekurencí) i významný epidemiologický aspekt spočívající v možnosti včasné prevence šíření C. difficile na další vnímavé jedince.
Podpora: Diagnostické soupravy byly dodány firmami DiaSorin, Elisabeth Pharmacon. Kultivace a PCR ribotypizace byly podpořeny granty: MZ ČR – RVO, FN v Motole 00064203 a MZ ČR IGA NT/14209–3.
Do redakce došlo dne 27. 11. 2013.
Adresa pro korespondenci:
Mgr. Marcela Krůtová
Ústav lékařské mikrobiologie
2. LF UK a FN v Motole
V Úvalu 84
150 06 Praha 5
e-mail: marcela.krutova@seznam.cz
Sources
1. Bauer MP, Notermans DW, van Benthem BH, Brazier JS et. al. ECDIS Study Group. Clostridium difficile infection in Europe: a hospital-based survey. Lancet, 2011; Jan 1, 377(9759):63–73.
2. He M, Miyajima F, Roberts P, Ellison L et al. Emergence and global spread of epidemic healthcare-associated Clostridium difficile. Nat Genet, 2013;45 : 109–113.
3. Nyč O, Pituch H, Matějková J, Obuch-Woszczatynski P, Kuijper EJ. Clostridium difficile PCR ribotype 176 in the Czech Republic and Poland. Lancet, 2011; Apr 23;377(9775):1407.
4. Rupnik M, Wilcox MH, Gerding DN. Clostridium difficile infection: new developments in epidemiology and pathogenesis. Nat Rev Microbiol, 2009;7 : 526–536.
5. Department of Health. Updated guidance on the diagnosis and reporting of Clostridium difficile, 6 March 2012. Dostupný na: http://www.dh.gov.uk/en/Publicationsandstatistics/Publications/PublicationsPolicyAndGuidance/DH_132927 (last accessed 4 May 2012)
6. Belanger SD, Boissinot M, Clairoux N, Picard FJ, Bergeron MG. Rapid detection of Clostridium difficile in feces by real-time PCR. J Clin Microbiol, 2003;41 : 730–734.
7. Peterson LR, Manson RU, Paule SM, Hacek DM, Robicsek A, Thomson RB, Jr, Kaul KL. Detection of toxigenic Clostridium difficile in stool samples by real-time polymerase chain reaction for the diagnosis of C. difficile-associated diarrhea. Clin Infect Dis, 2007;45 : 1152–1160.
8. Barbut F, Braun M, Burghoffer B, Lalande V, Eckert C. Rapid detection of toxigenic strains of Clostridium difficile in diarrheal stools by real-time PCR. J Clin Microbiol, 2009;47 : 1276–1277.
9. Stamper PD, Babiker W, Alcabasa R, Aird D et. al. Evaluation of a new commercial TaqMan PCR assay for direct detection of the Clostridium difficile toxin B gene in clinical stool specimens. J Clin Microbiol, 2009;47 : 3846–3850.
10. Terhes G, Urban E, Soki J, Nacsa E, Nagy E. Comparison of a rapid molecular method, the BD GeneOhm Cdiff assay, to the most frequently used laboratory tests for detection of toxin-producing Clostridium difficile in diarrheal feces. J Clin Microbiol, 2009;47 : 3478–3481.
11. Goldenberg SD, Dieringer T, French GL. Detection of toxigenic Clostridium difficile in diarrheal stools by rapid real-time polymerase chain reaction. Diagn Microbiol Infect Dis, 2010;67 : 304–307.
12. de Jong E, de Jong AS, Bartels CJ, van der Rijt-van den Biggelaar C et. al. Clinical and laboratory evaluation of a real-time PCR for Clostridium difficile toxin A and B genes. Eur J Clin Microbiol Infect Dis, 2012;31 : 2219–2225.
13. Le Guern R, Herwegh S, Grandbastien B, Courcol R, Wallet F. Evaluation of a new molecular test, the BD Max Cdiff, for detection of toxigenic Clostridium difficile in fecal samples. J Clin Microbiol, 2012;50 : 3089–3090.
14. Quinn CD, Sefers SE, Babiker W, He Y et. al. C. Diff Quik Chek complete enzyme immunoassay provides a reliable first-line method for detection of Clostridium difficile in stool specimens. J Clin Microbiol, 2010;48(2):603–605.
15. Sharp SE, Ruden LO, Pohl JC, Hatcher PA et. al. Evaluation of the C.Diff Quik Chek Complete Assay, a new glutamate dehydrogenase and A/B toxin combination lateral flow assay for use in rapid, simple diagnosis of clostridium difficile disease. J Clin Microbiol, 2010;48(6):2082–20826.
16. Kawada M, Annaka M, Kato H, Shibasaki S et. al. Evaluation of a simultaneous detection kit for the glutamate dehydrogenase antigen and toxin A/B in feces for diagnosis of Clostridium difficile infection. J Infect Chemother, 2011;17(6):807–811.
17. Orellana-Miguel MA, Alcolea-Medina A, Barrado-Blanco L, Rodriguez-Otero J, Chaves-Sánchez F. Algorithm proposal based on the C. Diff Quik Chek Complete ICT device for detecting Clostridium difficile infection. Enferm Infecc Microbiol Clin, 2013;31(2):97-9.
18. Coltella L, Mancinelli L, Onori M, Lucignano B et. al. Advancement in the routine identification of anaerobic bacteria by MALDI-TOF mass spectrometry. Eur J Clin Microbiol Infect Dis, 2013;32(9):1183–1192.
19. Valiente E, Dawson LF, Cairns MD, Stabler RA, Wren BW. Emergence of new PCR ribotypes from the hypervirulent Clostridium difficile 027 lineage. Journal of Medical Microbiology, 2012;61 : 49–56.
20. Persson S, Torpdahl M, Olsen KEP. New multiplex PCR method for the detection of Clostridium difficile toxin A (tcdA) and toxin B (tcdB) and the binary toxin (cdtA/cdtB) genes applied to a Danish strain collection. Clinical Microbiology and Infection, 2008;14 : 1057–1064.
Labels
Hygiene and epidemiology Medical virology Clinical microbiologyArticle was published in
Epidemiology, Microbiology, Immunology

2014 Issue 2
-
All articles in this issue
- Phylogenetic and molecular analysis of A/H1N1pdm influenza viruses isolated in the epidemic season 2012/2013 from hospitalised patients with symptoms of influenza-like illness
- An increase in the prevalence of syphilis in women in Eastern Bohemia – 30 years of surveillance
- Diagnosis of Clostridium difficile infections: Comparative study of two immuno enzyme assays with confirmation by PCR and culture followed by PCR ribotyping
- A point prevalence survey of healthcare-associated infections in the Slovak Republic – a part of the EU project
- Nosocomial transmission of listeriosis
- Diversity of human Salmonella isolates in the South Moravian Region in 2009–2012
- Candida dubliniensis in clinical specimens and possibilities for identification
- Natural antibodies against α(1,3) galactosyl epitope in the serum of cancer patients
- Cytolethal distending toxins
- Evaluation of the importance of a ready-made, gentamicin-impregnated spacer in relation to bacteriological findings in patients with periprosthetic joint infections
- Q fever – an occupational disease leading to disability – case report
- Measles re-emerging in the Ústí Region
- Predicted strain coverage of a new protein-based meningococcal vaccine in the Czech Republic
- Post-mortem analysis of Candida albicans breakthrough infection during echinocandin treatment in haematopoietic stem cell transplant recipient
- Viral gastroenteritis in Eastern Bohemia Region of the Czech Republic
- Seroprevalence study of hepatitis E virus infection in two districts of the Czech Republic
- Epidemiology, Microbiology, Immunology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Candida dubliniensis in clinical specimens and possibilities for identification
- A point prevalence survey of healthcare-associated infections in the Slovak Republic – a part of the EU project
- Q fever – an occupational disease leading to disability – case report
- Diagnosis of Clostridium difficile infections: Comparative study of two immuno enzyme assays with confirmation by PCR and culture followed by PCR ribotyping
