Vysoká prevalence virové hepatitidy C ve vyloučené komunitě brněnských Romů
A high prevalence of viral hepatitis C in a socially excluded Roma community in Brno
Objectives: To conduct a pilot study to assess the prevalence of blood-borne and sexually transmitted diseases (STDs) in a socially excluded Roma community engaging in risky behaviours in Brno, Czech Republic.
Methods: Fifty subjects engaging in risky behaviours, of whom 35 self-reported to belong to the Roma ethnicity, were recruited while receiving treatment in a newly established addiction centre in Brno between March and December 2017. All subjects were tested for blood-borne diseases and STDs. Epidemiological and demographic data were collected by means of assisted interview at the time of the first contact.
Results: Forty-three (86%) of 50 participants were anti-HCV positive. Of 35 subjects from the Roma subgroup, 32 (91.5%) tested anti-HCV positive. Among the 43 anti-HCV positive subjects, 35 (81.4%) also showed HCV RNA positivity. Of the 32 anti-HCV positive in the Roma subgroup, 26 (81.3%) were HCV RNA PCR positive. Only HCV (hepatitis C virus) genotypes 1 (a,b) and 3 were detected in the study group. Nine Roma subjects (25.9%)were newly diagnosed with syphilis of which none of them was aware. All study patients were negative for anti-HIV 1,2.
Conclusion: As a proof of concept, this pilot study showed the importance of targeting epidemiological research and preventive care at excluded communities engaging in risky behaviours. The high anti-HCV seroprevalence in the Roma population in Brno who self-admitted intravenous drug use as well as the nine newly diagnosed cases of syphilis illustrate not only a high prevalence of risky behaviours in this excluded community but also the absence of systematic health care coverage in this population. A positive point is that when an appropriate model of care is used, even the Roma clients are willing and able to comply with the therapy. This is true of both viral hepatitis C and syphilis: thanks to close cooperation with addictology services and opiate substitution treatment, all nine patients successfully completed 2 weeks of anti-treponemal antibiotic treatment. More systematic work with socially excluded communities including specific models of care tailored to the needs of poorly compliant patients is an essential prerequisite for controlling HCV epidemics in the Czech Republic. An additional effect in the surveillance of other infectious diseases linked to risky behaviours can be considered as an added value.
Keywords:
Czech Republic – HCV – viral hepatitis C – PWID – infectious diseases – Roma – Brno
:
S. Věchetová 1,2; L. Krekulová 1,3; Z. Oktábec 1,2; V. Řehák 1,2
:
Remedis, s. r. o., Praha
1; Klinika adiktologie, 1. lékařská fakulta, Univerzita Karlova a Všeobecná fakultní nemocnice v Praze
2; IV. Interní klinika, 1. lékařská fakulta, Univerzita Karlova a Všeobecná fakultní nemocnice v Praze
3
:
Epidemiol. Mikrobiol. Imunol. 68, 2019, č. 3, s. 115-121
:
Original Papers
Cíl studie: Formou pilotní studie ověřit výskyt krví přenosných a pohlavních chorob v sociálně vyloučené komunitě rizikově se chovajících Romů v Brně.
Metody: Padesát osob s rizikovým chováním, z nichž 35 uvedlo romskou etnicitu, využilo v období 3–12/2017 služeb nově zřízené adiktologické ambulance v Brně a bylo vyšetřeno na krví a pohlavně přenosné choroby. Současně byla zpracována jejich epidemiologická a demografická data, získaná při asistovaném interview.
Výsledky: Čtyřicet tři (86 %) z celkem 50 vyšetřených subjektů mělo pozitivní antiHCV protilátky. Ze 35 subjektů z romské podskupiny bylo 32 (91,5 %) antiHCV pozitivních. Mezi všemi 43 antiHCV pozitivními pacienty bylo 35 (81,4 %) HCV RNA pozitivních. Z podskupiny 32 antiHCV pozitivních Romů bylo virologicky pozitivních 26 (81,3 %). V souboru byly zachyceny pouze genotypy 1 (a, b) a 3 viru hepatitidy typu C. V rámci vstupního screeningu ve studii byla u 9 (25,7 %) pacientů z romské podskupiny nově diagnostikována luetická infekce, o které před studií nebyl nikdo z nich informován. V hodnoceném souboru nebyly u nikoho detekovány protilátky antiHIV 1, 2.
Závěr: Pilotní práce potvrzuje správnost konceptu cílení epidemiologických průzkumů a léčebné péče na vyloučené komunity s rizikovým chováním. Zjištěná vysoká antiHCV prevalence a vysoký podíl viremických klientů mezi injekčně aplikujícími brněnskými Romy, stejně jako záchyt devíti nových případu lues, dokresluje nejen rizikovost chování této vyloučené komunity, ale i dlouhodobou absenci systematické léčebně preventivní péče v této populaci. Pozitivním momentem je zjištění, že i romští klienti jsou při nastavení vhodného modelu péče ochotni spolupracovat a léčit se. To platí jak pro virovou hepatitidu typu C, tak pro syfilis, kdy díky substituční léčbě a podpůrné adiktologické péči všichni infikovaní úspěšně absolvovali ústavní antitreponemovou léčbu. Další systematická práce s vyloučenými komunitami včetně přiblížení léčebně preventivní péče obtížně spolupracujícím skupinám nemocných je základním předpokladem k dosažení kontroly nad epidemií virové hepatitidy typu C v České republice, má však i efekt v surveillance dalších infekčních chorob s vazbou na rizikové chování.
Klíčová slova:
Česká republika – HCV – virová hepatitida typu C – PWID – infekční choroby – Romové – Brno
ÚVOD
Virus hepatitidy typu C (HCV) je evolučně úspěšný lidský flavivirus rozšířený po celém světě, na jednotlivých kontinentech se liší zastoupení základních HCV genotypů a subtypů [1]. Infekce virem hepatitidy C zůstává celosvětovým problémem [1, 2]. Podle nejnovějších odhadů WHO (World Health Organization – Světová zdravotnická organizace) z roku 2013 bylo infikováno 185 milionů lidí [1], 130–150 miliónů lidí je ve stadiu chronické HCV [3]. Podle posledních Doporučených postupů EASL (European Association for the Study of the Liver – Evropská asociace pro studium jater) z roku 2018 je 71 miliónů viremických jedinců celosvětově [4], což je stále násobek rozsahu pandemie HIV/AIDS [5].
Přes značné rozšíření HCV infekce vznikl v posledních letech reálný plán eradikace tohoto onemocnění [6, 7]. Se zavedením vysoce účinné perorální terapie [8] a s neustálým zdokonalováním a zkracováním léčebných režimů nabývá tento plán stále jasnějších obrysů. Globální eradikace HCV infekce předpokládá naplnění následujících postupných cílů do roku 2030. Prvním postupným cílem, který se ve světle nových terapeutických režimů jeví jako reálný, je dosáhnout 65% redukce mortality v souvislosti s jaterními chorobami. Další prioritou je snížit počty nových infekcí o 90 %. K realizaci předchozích dvou kroků je nutné zvýšit podíl diagnostikovaných infekčních pacientů na 90 % [6, 9].
Se zavedením přímo působících antivirotik (DAA, directly acting antivirals) do léčby HCV infekcí v Evropské unii (EU) v roce 2014 je patrný nárůst léčených pacientů. V roce 2013 se v EU léčilo 67 000 osob v roce 2015 již 150 000 pacientů. Zdaleka ne všichni ze 150 000 léčených nemocných však byli léčeni moderními bezinterferonovými DAA režimy. Úspěšnost terapie se proto počítá nikoliv pouze na DAA režimy, ale na kombinaci léčebných schémat. Setrvalá virologická odpověď (SVR) je odhadnutá na 89 % [9].
Aby bylo dosaženo cíle WHO a došlo k poklesu nových infekcí v roce 2030, počet léčených pacientů v EU se musí zvýšit ze 150 000 léčených za rok na 187 000 do roku 2025, při použití výhradně DAA režimů s více než 95 % SVR [9].
Ve vyspělých a ekonomicky silných zemích, kde by bylo možné investovat do terapie potřebné finanční prostředky, zůstává hlavním problémem identifikace infikovaných osob. V těchto zemích je převažujícím způsobem přenosu virové hepatitidy C rizikové chování spojené s parenterálním užitím a nesterilní aplikací psychoaktivních návykových látek [1, 10, 11]. Osoby injekčně užívající drogy (PWID, people who inject drugs) jsou však obtížně oslovitelné, lékařskou péči vyhledávají jen omezeně a pravidelné návštěvy ve zdravotnickém zařízení představují zejména pro aktivní uživatele často nepřekonatelný problém.
Pro řešení epidemie virové hepatitidy typu C v této populaci je potřebný proaktivní přístup a přiblížení zdravotní péče potřebám závislých osob [12]. Globálně je na eradikaci HCV infekce velmi dobře připravena např. Austrálie, jejíž vláda ve spolupráci s odbornou veřejností přijala již v roce 2015 zásadní opatření, umožňující závislým osobám plný přístup ke specifické virostatické léčbě. Neoddělitelnou součásti této strategie je též podpora výměnných programů a dalších aktivit, které snižují riziko reinfekcí v dané populaci [13].
Skutečnost, že skupinu PWID při eradikaci rozhodně nelze opomenout dokumentují jasně i následující globální data. Pokud vyjdeme z optimističtějšího odhadu, že je na světě 71 milionů osob s chronickou replikující HCV infekcí [4], je v souvislosti s injekční aplikací drog nakaženo 6,1 miliónů jedinců, což je 8,5 % všech infekcí [14, 15]. V roce 2015 bylo 1,7 milionu nových infekcí, z toho 23 % mezi PWID [16] při sdílení jehel a stříkaček [17, 18, 19, 20].
V České republice existuje funkční síť nízkoprahových kontaktních center, výměnných programů, substitučních programů s různě nastavenými podmínkami spolupráce, dále pak psychiatrických ambulancí a léčeben, které se léčbou závislosti dlouhodobě zabývají. Nověji se uplatňují též adiktologická pracoviště nabízející léčbu závislostí a psychosociální pomoc. Některá centra spolupracují se zdravotnickými středisky či nemocnicemi při řešení somatických, hlavně infekčních komplikací závislostí. Již více než 15 let funguje v Praze zdravotnické zařízení Remedis a jeho „Program komplexní léčby“, který nabízí svým klientům adiktologické, psychologické, psychiatrické a zdravotní služby pod jednou střechou. Hepatologická poradna Remedis je současně i Centrem pro léčbu virových hepatitid. Nově byla otevřena pobočka v Brně, která poskytuje obdobné spektrum adiktologických služeb. Specifikem brněnského Remedisu je zřízení adiktologické poradny přímo v místě významné koncentrace osob z romské komunity.
Cílem práce je představit výsledky pilotního projektu, jehož snahou bylo zmapovat epidemiologickou situaci ve výskytu infekčních onemocnění v sociálně izolované skupině injekčně užívajících brněnských Romů.
METODY
Soubor pacientů
Pilotní studie probíhala v adiktologické poradně Remedis Brno, která je lokalizována v Bratislavské ulici, přímo v centru dění tamní romské komunity. Do studie byli prospektivně zařazováni klienti, kteří centrum sami kontaktovali a požádali o některou z nabízených služeb. Ve všech případech se jednalo o prvokontakty. Pacienti byli zařazeni podle pořadí registrace v centru, nebyli jakkoliv selektováni. Ve spektru nových klientů v poradně Remedis Brno převažovala romská minorita. V rámci iniciálního kontaktu byly klientům formou asistovaného interview kladeny dotazy týkající se jejich zdravotního stavu a závislostí s akcentem na rizikové vzorce chování. U všech subjektů byla získána anamnestická a epidemiologická data. Pacientům bylo nabídnuto vyšetření krve a pohlavně přenosných chorob, včetně HIV. Všichni klienti se zařazením do studie souhlasili, poskytli písemný souhlas s odběry a dalším zpracováním anamnestických, epidemiologických a laboratorních dat.
Součástí vyšetření v poradně bylo i předtestové poradenství, nastínění možností léčby v případě průkazu některé z testovaných chorob a stanovení termínu kontroly klienta s výsledky vyšetření. Dále byly nabídnuty služby adiktologa – ať již jednorázová intervence, či dlouhodobá terapie, včetně terapie skupinové nebo rodinné a sociální služby.
Studie byla schválena etickou komisí.
Laboratorní vyšetření
U všech subjektů byly z krevního séra testovány základní biochemické parametry (AST, ALT, ALP, GGT a bilirubin) a přenosné choroby: virové hepatitidy typu A, B, C, HIV/AIDS a syfilis.
Veškeré testování odebraných krevních vzorků probíhalo v certifikované laboratoři, standardizovanými sérologickými testy protilátek. Sety pro sérologické screeningové vyšetření virové hepatitidy A: ARCHITECT HAVAb-IgM, Abbott, analyzátor Architect a ARCHITECT HAVAb-IgG, Abbott, analyzátor Architect. Pro virovou hepatitidu B jsme v rámci vstupního screeningu vyšetřovali tři základní markery: ARCHITECT HBsAg Qualitative II, Abbott, analyzátor Architect, včetně ARCHITECT HBsAg Qualitative II Confirmatory, Abbott, analyzátor Architect. Dále protilátky ARCHITECT Anti-HBs, Abbott, analyzátor Architect a ARCHITECT Anti-HBc II. Pro ověření stavu HCV infekce byl použit ARCHITECT Anti-HCV, Abbott, analyzátor Architect. Pro HIV: ARCHITECT HIV Ag/Ab Combo, Abbott, analyzátor Architect a pro syfilis: ARCHITECT Syphilis TP, Abbott, analyzátor Architect, RPR Reagent, Sekure chemistry, Sekisui Medical co., analyzátor AU.
V případě pozitivních protilátek (antiHCV) či antigenů (HBsAg) byla diagnóza virové hepatitidy typu C, respektive virové hepatitidy typu B, dále konfirmována pomocí virologických testů založených na přímém průkazu virové RNA či DNA pomocí polymerázové řetězové reakce (PCR). K virologické diagnostice byly opět využity standardní diagnostické sety.
U virové hepatitidy C se izolace HCV RNA prováděla pomocí QiaSymphony DSP Virus/Patogen Midi Kit (Qiagen). Vstupní objem séra nebo plazmy 1000 μl, eluce do 60 μl. Izolace byla prováděna automatickým izolátorem QIAsymphony (Qiagen). Kit pro Real-time PCR: artus HCV RG RT-PCR Kit (Qiagen), přístroj pro Real-time PCR: RorGene Q (Qiagen). Genotypizace byla prováděna pomocí Kitu HCV genotypizace (Kitgen).
Epidemiologické údaje
Osobní, demografická a epidemiologická data získaná při odběru anamnézy a strukturovaném interview, byla dále zpracována s využitím statistických programů Microsoft Excel a IBM SPSS software.
VÝSLEDKY
Od zahájení provozu adiktologické poradny Remedis Brno, ve sledovaném období od 8. 3. 2017 do 31. 12. 2017, kontaktovalo poradnu v rámci prvokontaktů celkem 50 jednotlivých subjektů. Jednalo se o 29 mužů (58 %) a 21 žen (42 %). Celkem 35 subjektů ze studijní populace (70 %) uvedlo romskou etnicitu. Věkový průměr celé skupiny 50 pacientů byl 30,34 roku (medián 29). Z 35 romských účastníků, bylo 17 mužů (48,6 %) a 18 (51,4 %) žen. Věkový průměr osob romské národnosti byl 27,97 (medián 27). Podle statistické analýzy provedené pomocí t-testu je zřejmé, že probandi romské národnosti jsou signifikantně mladší (p < 0,001).
V rámci vstupních pohovorů a navazujícího dotazníkového šetření bylo prokázáno, že všichni klienti byli injekčními uživateli drog (PWID) a jejich chování lze označit jako rizikové, ať už ve smyslu sdílení injekčního materiálu a parafernálií při parenterální aplikaci návykových látek, tak při tetování či piercingu v neprofesionálních podmínkách – tedy nesterilními pomůckami. Velmi častou rizikovou aktivitou byl též nechráněný pohlavní styk (PS), jak s nedostatečně známým a prověřeným sexuálním partnerem, tak PS praktikovaný za úplatu. U významné části zařazených osob se rizika kombinovala.
Všichni zařazení pacienti podstoupili testování na přenosné choroby vyskytující se v rizikových populacích v ČR: virové hepatitidy typu A, B, C, HIV a syfilis. Sérologické nálezy shrnuje tabulka 1.
Table 1. Serology results of all probands and Roma probands
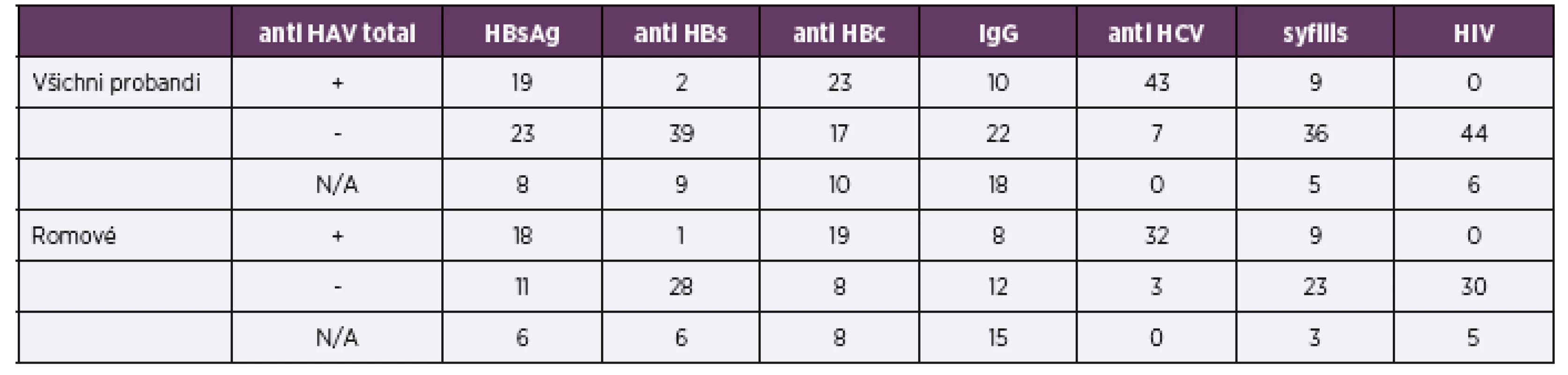
Celkem 19 klientů (38 %) mělo sérologické známky proběhlé infekce virem hepatitidy typu A nebo postvakcinační imunity. V romské podskupině prodělalo virovou hepatitidu typu A 18 osob (51,4 %), o očkování v minulosti neměli romští klienti povědomí. Zkratka N/A (not applicable) znamená neprovedené vyšetření, většinou proto, že při obtížném odběru byla při nedostatku krevního séra preferenčně vyšetřena antiHCV protilátka a HBsAg.
V 50členné skupině jsme zachytili celkem 2 HBsAg pozitivní muže (tj. 4 %, respektive 5 % z celkem 41 vyšetřených vzorků). Jeden HBsAg pozitivní pacient byl z romské podskupiny. Tento muž měl pozitivní také antiHCV protilátku i HCV RNA a zvýšenou hladinu ALT, ALP a GGT. Deset pacientů, z nich 8 z romské skupiny, mělo sérologické známky proběhlé hepatitidy B se sérokonverzí v systému HBs. Všichni účastníci byli testováni na přítomnost HIV infekce pomocí anti HIV 1,2 protilátek s negativním výsledkem.
Z celé skupiny 50 jedinců bylo 43 antiHCV pozitivních (24 mužů a 19 žen), průměrný věk všech antiHCV pozitivních byl 30,46 (medián 29). V podskupině 35 osob romské národnosti bylo antiHCV pozitivních 32 probandů, tj. 91,4 % a průměrný věk antiHCV pozitivních Romů byl 28,57 (medián 28). Podle pohlaví bylo pozitivních 16 ze 17 romských mužů, tj. 94,1 %, a 16 z 18 romských žen, tj. 88,9 %.
Všechny dostupné vzorky s pozitivní antiHCV protilátkou byly dále testovány metodou polymerázové řetězové reakce na přítomnost virové HCV RNA. Z celkového počtu 43 antiHCV pozitivních (z celé 50členné skupiny) bylo vyšetřeno 42 vzorků, z toho 35 bylo HCV RNA pozitivních (83,3 %). Sedm vzorků bylo negativních, tedy bez průkazu virové HCV RNA. Pouze jeden antiHCV pozitivní vzorek nemohl být virologicky otestován, neboť při vstupním odběru krve nebylo dostatek materiálu na virologické vyšetření. V další analýze romské podskupiny bylo ze 32 antiHCV pozitivních subjektů 26 HCV RNA pozitivních (81,3 %). Celkem bylo HCV RNA pozitivních 11 romských mužů a 15 žen. Virologicky negativních bylo 5 vzorků a jeden antiHCV pozitivní vzorek nemohl být dále vyšetřen z důvodů nedostatku krevního séra.
U 25 HCV RNA pozitivních Romů (96,2 %) byl dále stanoven HCV genotyp. Genotypizace u 1 probanda (3,8 %) nebyla realizována z důvodů malého množství biologického materiálu.
Zastoupení genotypů mezi 26 HCV RNA pozitivními romskými pacienty bylo následující: 9 s genotypem 1a (34,6 %), 8 s genotypem 1b (30,8 %), 8 s genotypem 3 a 3a (30,8 %). Pouze u jednoho probanda nebyla genotypizace realizována (3,8 %). Rozložení HCV genotypů v romské podskupině schematizuje graf 1a.
Figures 1a, 1b. HCV genotypes in Roma probands (left panel)
and all probands (right panel)

Jiný genotyp než 1 nebo 3 se ve zkoumaném vzorku romské populace v Brně nevyskytoval, i subtypové zastoupení bylo podle očekávání: 1a, 1b a 3a.
V celé 50členné skupině byla situace obdobná, byly zastoupeny jen 2 genotypy a 3 subtypy – viz graf 1b.
Při detailnějším rozboru genotypů podle pohlaví v celé skupině 50 probandů, pak genotyp 1a mělo 7 mužů (41,2 %), genotyp 1b 4 muži (23,5 %) a genotyp 3 a 3a mělo 6 mužů (35,3 %) z celého vzorku 17 mužů s určeným genotypem. Situace je podobná také u žen, kde genotyp 1a mělo 6 žen (35,3 %), genotyp 1b mělo 7 žen (41,2 %) a genotyp 3a měly 4 ženy (23,5 %) z celého vzorku 17 žen s určeným genotypem. Rozdíly genotypového zastoupení mezi pohlavími ani při analýze genotyp, pohlaví, podskupina nejsou podle t-testů statisticky významné.
Rozložení jednotlivých genotypů v závislosti na pohlaví probandů shrnuje graf 2; vlevo pro celý soubor a vpravo zvlášť pro romskou podskupinu.
Figure 2. Genotype distribution by sex in all probands and Roma
probands

Není bez zajímavosti, že 5 subjektů (19,2 %) z celkem 26 PCR HCV RNA pozitivních Romů, mělo zcela normální „jaterní testy“. Tedy v biochemickém obraze bylo bez elevace ALT, AST, ALP a GGT proti referenčním hodnotám. U celkem 18 osob (53,8 %) byly jaterní testy zvýšené. Ve třech případech (11,5 %) nebyly jaterní testy vyšetřeny (z důvodu obtížného odběru krve a nedostatku materiálu pro biochemickou analýzu – dva probandi s genotypem 1a a jeden proband s genotypem 1b).
Jako velmi významný vedlejší nález v rámci screeningu ve studii byl průkaz 9 případů luetické infekce. Všechna onemocnění byla v romské podskupině. Pohlavní chorobou trpělo 7 žen a 2 muži. Ukázalo se, že všechny ženy byly infikovány při prostituci, kterou provozovaly za účelem výdělku k zakoupení ilegálních psychoaktivních látek. Oba muži s lues se infikovali od svých partnerek, které ale v souboru nejsou zahrnuty.
DISKUSE
Předkládaná pilotní studie potvrzuje předpoklad autorů, že navozením vhodných podmínek, vstřícného pomáhajícího prostředí, které je navíc snadno dostupné a otevřené, lze navázat kontakt a spolupráci i s jinak obtížně dosažitelnými skupinami rizikově se chovajících osob.
Koordinace léčebně preventivní péče prostřednictvím adiktologické poradny ve vyloučené komunitě může být jedním z možných modelů péče o PWID v rámci case managementu. Hledání vhodných cest jak v rizikové PWID populaci poskytovat péči, poradenství a osvětu je důležité, protože se jedná o relativně velkou skupinu schopnou negativně ovlivnit zdravotní stav obecné populace.
Séroprevalenční odhad v roce 2017 uvádí v ČR 47,8 tisíc problémových uživatelů pervitinu a opioidů (PUPO), z toho 34,7 tisíc uživatelů pervitinu a 13,1 tisíce uživatelů opioidů. Odhadovaný počet injekčních uživatelů drog (IDU - PWID) dosáhl 43,7 tisíc. V roce 2017 dosáhla míra prevalence problémového užívání drog v ČR 0,69 % obyvatel ve věku 15-64 let, což je hodnota odpovídající mírnému meziročnímu nárůstu. V horizontu posledních 4 let, je počet PUPO stabilní, již v roce 2013 přesáhl hranici 45 000. Národní odhad počtu problémových uživatelů drog je od roku 2002 prováděn každoročně za použití dat o počtu klientů nízkoprahových programů multiplikační metodou pro jednotlivé kraje a jejich součtem vzniká národní odhad. Tradičně je v ČR velmi vysoký počet injekčně užívajících problémových uživatelů – v roce 2017 to bylo až 91,4 % (43 700 osob). V roce 2013 přesáhl počet PWID hranici 40 000 a dále setrvale mírně narůstá [21].
Podle jednoho z prvních výzkumů v oblasti užívání návykových látek v romské populaci v České republice a na Slovensku (Společnost Hvězda 2002-2004) bylo zjištěno, že nejčastěji užívanou drogou byl heroin, následuje pervitin a Subutex [22].
Zkušenost z průběhu studie ukazuje, že pacienti z romské komunity v Brně jsou nakloněni ke spolupráci při léčebně preventivní péči, pokud je zajištěno adekvátní proklientsky orientované prostředí, empatický personál a jsou respektována specifika této minority.
Současně se ukázalo, že se jedná o velmi ohroženou skupinu. Séroprevalence HCV 91,4 % je alarmující a blíží se číslům z nejrizikovějších světových regionů (Egypt, PWID ve vyloučených komunitách vyspělých zemí apod. [23, 24]). Je velmi obtížné tyto pilotní výsledky srovnávat s dostupnými výstupy jiných prací z ČR. Podle poslední plošné séroprevalenční studie, která byla publikována v roce 2003, je výskyt virové hepatitidy C v nízce rizikové obecné populaci 0,2 %, tedy velmi nízký [25]. Jediná dosud publikovaná multicentrická séroprevalenční studie mezi PWID udává 30 % séropozitivních PWID s významnou variabilitou v jednotlivých regionech [26].
V rizikově se chovající PWID populaci v Praze a ve Středočeském kraji byla v letech 2010–2012 zjištěna séroprevalence 72 % [27]. Ani toto není optimální skupina pro srovnání s pilotními daty, protože nešlo o průřezovou séroprevalenční studii, ale o osoby, které samy vyhledaly vyšetření nebo k němu byly doporučeny z nízkoprahových center.
Další možností je porovnání našich pilotních výsledků s výstupy testování na krví přenosné choroby zveřejněné Národním registrem léčby uživatelů drog. Každoročně dostupné výsledky testování osob hlášených v Národním registru léčby uživatelů drog (NRLUD) pomáhají odhadovat prevalenci infekčních chorob mezi uživateli drog. Sledovány jsou HAV, HBV, HCV a HIV infekce. V roce 2017 bylo v registru hlášeno 8 647 léčených osob, z toho 3 513 prvožadatelů. Testování antiHCV protilátek bylo realizováno u 1 272 osob, pozitivních bylo 214 (séroprevalence 16,8 %), z nich bylo 63,6 % HCV RNA pozitivních. U injekčních uživatelů drog byla séroprevalance HCV 49,4 %. Podle očekávání byla nejvyšší míra promořenosti mezi klienty substitučních programů se séroprevalencí 83,1 %. Dlouhodobě byla séroprevalence HCV mezi PWID v Registru žádostí o léčbu v letech 2003–2014 kolem 31 %. V roce 2015 však proběhla změna způsobu evidence. Došlo ke sloučení substitučního registru (NRULISL) a Registru žádostí o léčbu a v roce 2015 vznikl NRLUD [21]. Data získaná v letech 2015–2017 jsou s předchozími obtížně srovnatelná a výsledná séroprevalence je signifikantně vyšší.
Přestože jedním z podstatných limitů prezentované práce je malý počet probandů, prezentujeme dosavadní výstupy v rámci pilotní práce. Jen další systematická činnost ve sledované komunitě ukáže vývoj v této skupině. Za limitaci lze také považovat metodu výběru probandů, vzhledem k tomu, že do studie byli zařazeni pouze probandi žádající vyšetření v Adiktologické ambulanci Remedis Brno.
Z epidemiologického hlediska je velmi zajímavé vyšší zastoupení žen v pilotní studii, což v ostatních sledovaných PWID komunitách není obvyklé. Pravděpodobné vysvětlení tohoto jevu je možné hledat v rodinných až klanových modelech fungování romské entity s dominancí žen. Matriarchát je patrný v praktických životních aspektech, jako je zachování rodu, péče o potomstvo a přežití obecně, které v této minoritě ženy zpravidla zajišťují [28]. Přestože jsou primární rodiny často nefunkční, rozvedené nebo nikdy nesezdané páry mají stále před sebou jasně dané výhody fungování ve velké vícegenerační rodině. Možná právě proto romské ženy, nejspíše z důvodů zajištění péče o potomstvo, řeší svoji zdravotní situaci a jsou ochotnější k testování a vůbec přijetí nabízené zdravotní péče. Ze zkušenosti autorů vyplývá, že i za muži, kteří se rozhodnou k testování a následné léčbě často stojí ženy, které je motivují a podporují.
Jak již bylo zmíněno, součástí vyšetření v poradně bylo nejen předtestové poradenství, ale i následná kontrola. Pokud klient této nabídky využil, byly mu sděleny a přiměřeným způsobem interpretovány jeho nálezy a nabídnuto řešení včetně specifické terapie. Přestože promořenost ve vyloučené komunitě brněnských Romů je na horní hranici literárně udávaných výsledků ve srovnatelných skupinách [23, 24] a zdaleka přesahuje výsledky například z pražské komunity PWID, jsou zde i jistá pozitiva. Z celkového počtu 26 HCV RNA pozitivních Romů, zahájili 4 (15,4 %) pacienti antivirotickou léčbu již ve sledovaném studijním období. Přestože se jedná o malý vzorek, je 15 % klientů zařazených do virostatické léčby významně více, než je běžně udávaná „propustnost do léčby“ v zahraničních studiích [29, 30, 31]. V naší skupině do léčby již během popisovaného období nastoupil jeden muž s duální infekcí HBV a HCV a 3 ženy. Velmi zajímavé je i dodatečné zjištění, že 3 ze 4 již léčených klientů (1 muž a 2 ženy) mají vlastní děti. Čtvrtá klientka otěhotnět nemůže, a proto je paradoxně i její motivace k léčbě chronické virové hepatitidy typu C vázaná na rodinu; léčí se před plánovanou in vitro fertilizací (IVF).
Zcela mimo očekávání byl nález 9 syfilitických infekcí v romské komunitě, který podtrhuje vysokou míru rizikového chování v kontextu sociálního vyloučení zkoumané skupiny včetně nemožnosti začlenit se do běžného života a pracovního procesu způsobem obvyklým ve většinové společnosti. Čtyři ze 7 nakažených žen toto onemocnění vůbec neznaly. Závislé ženy vydělávají na svoji (a často i partnerovu) drogovou závislost prostitucí, což násobí rizikovost jejich chování. Jako povzbudivé hodnotíme, že všech 9 pacientů s pohlavní chorobou na základě diagnózy stanovené při screeningu neodkladně podstoupilo antibiotickou léčbu za hospitalizace. Přestože se jednalo o klienty závislé na opiátech, podařilo se ve spolupráci s Terapeutickým centrem na Bratislavské, spadajícím pod obecně prospěšnou společnost Podané ruce, zajistit substituční léčbu i během 2týdenní hospitalizace a tím umožnit jejich úspěšné vyléčení.
ZÁVĚR
Podle předpokladů jsme potvrdili vysokou expozici virové hepatitidě typu A u sledované rizikové skupiny, velmi vysoká byla i u virové hepatitidy typu B. V roce 2017 bylo hlášeno v ČR 772 nových případů virové hepatitidy typu A (VHA) z toho 10 u PWID (1,3 %). Výskyt VHA mezi PWID má meziročně kolísavý charakter. V roce 2008 byla zaznamenána epidemie s ohnisky v Praze a ve středních Čechách. Zpočátku docházelo k šíření VHA mezi PWID, následně přeskočila i na obecnou populaci. Celkem bylo v roce 2008 hlášeno 228 případů VHA mezi PWID. Od roku 2008 pak počet případů mezi PWID klesal až do roku 2011. Od roku 2014 je opět patrný mírný nárůst nových infekcí mezi injekčními uživateli. Od srpna 2014 do července 2016 probíhala další epidemie akutní VHA, tentokrát v Karlovarském kraji a od roku 2015 pak probíhala epidemie v Libereckém a Jihomoravském kraji. V roce 2016 bylo 135 hlášených akutních případů VHA mezi PWID [21].
Z diskuse o problému vyplynulo, že séroprevalence virové hepatitidy typu C ve sledované skupině též převyšovala obvyklý výskyt v ostatních rizikových skupinách v jiných regionech. U luetické infekce se jedná o velmi alarmující nález, demonstrující míru rizikového chování a potenciál šíření těchto, ale i dalších infekčních chorob. V roce 2017 bylo nahlášeno celkem 772 nových případů lues, z toho 44 u PWID [21], z toho 9 záchytů bylo v rámci prezentované pilotní studie.
Pravděpodobně pouze velmi příznivá situace ve výskytu HIV infekce u injekčních uživatelů v ČR a tedy velmi nízký počet zdrojů této infekce stojí za negativními nálezy HIV u všech participantů studie.
V roce 2017 bylo 254 nově zachycených případů HIV infekce. Podíl přenosu HIV při injekčním užívání drog je v ČR dlouhodobě velmi nízký. V roce 2017 bylo nově zachyceno pouze 5 případů (2 %) nových infekcí HIV u mužů, u kterých došlo k přenosu infekce velmi pravděpodobně při injekční aplikaci drog. Dominantní cestou přenosu HIV v ČR je sexuální styk mezi muži (MSM, men who have sex with men) – 181 případů (71,8 %) nových infekcí v roce 2017, heterosexuální pohlavní styk přispěl k 58 novým HIV infekcím v roce 2017 [32].
Jestliže HCV infekce je převážně problémem rizikově se chovajících osob, hrozba šíření VHA a HIV i v obecné populaci je významná.
Jak bylo konstatováno v úvodu tohoto textu, virová hepatitida typu C je příkladem onemocnění s potenciálně šťastným koncem. Úspěšnost stávajících léčebných režimů používajících DAA se pohybuje kolem 95 % [33]. Plán na eradikaci tohoto virového onemocnění je proto reálný při synchronním zajištění dostatečného množství finančních prostředků na terapii a přípravu cílených preventivních a léčebných strategií.
V kontextu předpokládaného rozšíření HCV infekce v ČR a zejména ve světle možností nových bezinterferonových režimů se plná dostupnost péče v rizikových a nespolupracujících komunitách jeví jako kritická pro dosažení eradikace tohoto závažného onemocnění.
Poděkování
Studie byla podpořena institucionálním programem podpory PROGRES č. Q06/LF1.
Do redakce došlo dne 4. 10. 2018.
Adresa pro korespondenci:
Mgr. PharmDr. Zbyněk Oktábec, Ph.D. et Ph.D.
REMEDIS, s. r. o
Vladimírova 10
140 00 Praha 4
e-mail: zbynek.oktabec@lf1.cuni.cz
Sources
1. Nelson PK, Mathers BM, Cowie B, et al. Global epidemiology of hepatitis B and hepatitis C in people who inject drugs: results of systematic reviews. The Lancet, 2011;378(9791): 571–583. DOI: 10.1016/S0140-6736(11)61097-0. Dostupné na www: http://linkinghub.elsevier.com/retrieve/pii/S0140673611610970
2. Mohd Hanafiah K, Groeger J, Flaxman AD, et al. Global epidemiology of hepatitis C virus infection: New estimates of age-specific antibody to HCV seroprevalence. Hepatology, 2013; 57(4):1333–1342. DOI: http://doi.org/10.1002/hep.26141
3. The World Health Organisation (WHO). Hepatitis C Fact Sheet. 2014. Dostupné na www: http://www.who.int/mediacentre/factsheets/fs164/en/index.html. Accessed 2 July 2018.
4. Polaris Observatory HCV Collaborators. Global prevalence and genotype distribution of hepatitis C virus infection in 2015: a modelling study. Lancet Gastroenterol Hepatol, 2017;2 : 161–176. DOI: http://doi.org/10.1016/S2468-1253(16)30181-9. Dostupné na www: http://www.thelancet.com/journals/langas/article/PIIS2468-1253(16)30181-9/fulltext
5. UNAIDS. Fact sheet – Latest statistics on the status of the AIDS epidemic. 2018. Dostupné na www: http://www.unaids.org/sites/default/files/media_asset/UNAIDS_FactSheet_en.pdf. Accessed 2 July 2018.
6. World Health Organisation (WHO). Global Health Sector Strategy on Viral Hepatitis 2016-2021: Towards Ending Viral Hepatitis. Geneva: World Health Organization, 2016. Dostupné na www: https://apps.who.int/iris/bitstream/handle/10665/246177/WHO-HIV-2016.06-eng.pdf?sequence=1.
7. Martin NK, Vickerman P, Miners A, et al. Cost-effectiveness of hepatitis C virus antiviral treatment for injection drug user populations. Hepatology, 2012;55(1):49–57. DOI: http://doi.org/10.1002/hep.24656.
8. Wandeler G, Dufour JF, Bruggmann P, et al. Hepatitis C: a changing epidemic. Swiss Medical Weekly, 2015;145:w14093. DOI: http://doi.org/10.4414/smw.2015.14093. Dostupné na www: http://smw.ch/article/doi/smw.2015.14093/.
9. Razavi H, Robbins S, Zeuzem S, et al. Hepatitis C virus prevalence and level of intervention required to achieve the WHO targets for elimination in the European Union by 2030: a modelling study. The Lancet: Gastroenterology & hepatology, 2017;2(5):325–336. DOI: 10.1016/S2468-1253(17)30045-6. Dostupné na www: http://linkinghub.elsevier.com/retrieve/pii/S2468125317300456.
10. Seidenberg A, Rosemann T, Senn O. Patients receiving opioid maintenance treatment in primary care: successful chronic hepatitis C care in a real world setting. BMC Infectious Diseases, 2013;13(1):9. DOI: http://doi.org/10.1186/1471-2334-13-9. Dostupné na www: http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3548742/.
11. Grebely J, Bruggmann P, Backmund M, et al. Moving the Agenda Forward: The Prevention and Management of Hepatitis C Virus Infection Among People Who Inject Drugs. Clinical Infectious Diseases, 2013;57(suppl 2):S29–S31. DOI: http://doi.org/10.1093/cid/cit264. Dostupné na www: https://academic.oup.com/cid/article/57/suppl_2/S29/395032.
12. Mravčík V, Strada L, Reimer J, et al. Hepatitis C treatment uptake and adherence among injecting drug users in the Czech Republic. Epidemiologie, Mikrobiologie, Imunologie, 2014; 64(3):265–269.
13. Hepatitis Australia. 5 September 2018. Dostupné na www: http://www.hepatitisaustralia.com/. Access 2 July 2018.
14. Hajarizadeh B, Cunningham EB, Reid H, et al. Direct-acting antiviral treatment for hepatitis C among people who use or inject drugs: a systematic review and meta-analysis. 2018;3(11):754–767. DOI: 10.1016/S2468-1253(18)30304-2. Dostupné na www: https://linkinghub.elsevier.com/retrieve/pii/S2468125318303042.
15. Greberly J, Larney S, Peacock A, et al. Global, regional, and country-level estimates of hepatitis C infection among people who have recently injected drugs. Addiction, 2019; 114(1):150–166. DOI: 10.1111/add.14393. Dostupné na www: http://doi.wiley.com/10.1111/add.14393.
16. World Health Organization. Global hepatitis report, 2017. Geneva: World Health Organization, 2017. ISBN 978-92-4-156545-5. Dostupné na www: https://apps.who.int/iris/bitstream/handle/10665/255016/9789241565455-eng.pdf;jsessionid=C9466BE13389911B8050493811AEBD83?sequence=1.
17. Wiessing L, Ferri M, Grady B, et al. Hepatitis C Virus Infection Epidemiology among People Who Inject Drugs in Europe: A Systematic Review of Data for Scaling Up Treatment and Prevention. PLoS ONE, 2014;9(7). DOI: 10.1371/journal.pone.0103345. Dostupné na www: http://dx.plos.org/10.1371/journal.pone.0103345.
18. Hagan H, Pouget E R, Des Jarlais DC, et al. Meta-Regression of Hepatitis C Virus Infection in Relation to Time Since Onset of Illicit Drug Injection: The Influence of Time and Place. American Journal of Epidemiology, 2008;168(10):1099–1109. DOI: 10.1093/aje/kwn237. Dostupné na www: https://academic.oup.com/aje/article-lookup/doi/10.1093/aje/kwn237.
19. Page K, Morris MD, Hahn JA, et al. Injection Drug Use and Hepatitis C Virus Infection in Young Adult Injectors: Using Evidence to Inform Comprehensive Prevention. Clinical Infectious Diseases, 2013;57(suppl_2):S32–S38. DOI: 10.1093/cid/cit300. Dostupné na www: http://academic.oup.com/cid/article/57/suppl_2/S32/397297/Injection-Drug-Use-and-Hepatitis-C-Virus-Infection.
20. Morris MD, Shiboski S, Bruneau J, et al. Geographic Differences in Temporal Incidence Trends of Hepatitis C Virus Infection Among People Who Inject Drugs: The InC3 Collaboration. Clinical Infectious Diseases, 2017;64(7):860–869. DOI: 10.1093/cid/ciw869. Dostupné na www: https://academic.oup.com/cid/article/64/7/860/3052314.
21. Mravčík V (Ed.). Výroční zpráva o stavu ve věcech drog v České republice v roce 2017 [Annual Report on Drug Situation 2017 - Czech Republic]. Praha: Úřad vlády České republiky, 2018. ISBN 978-80-7440-219-7. Dostupné na www: https://www.drogy-info.cz/data/obj_files/32962/837/VZdrogy2017_web181207.pdf.
22. Kajanová A, Hajduchová H. Romská minorita a návykové látky v České republice a na Slovensku. Adiktologie, 2014;14(2):168–172.
23. Kouyoumjian SP, Chemaitelly H, Abu-Raddad LJ. Characterizing hepatitis C virus epidemiology in Egypt: systematic reviews, meta-analyses, and meta-regressions. Scientific Reports, 2018;8(1):1661 (published online). DOI: 10.1038/s41598-017-17936-4. Dostupné na www: http://www.nature.com/articles/s41598-017-17936-4
24. Ackelsberg J, Varma JK (coordinators). Hepatitis C in New York City: State of the Epidemic and Action Plan. NYC Health, 2013.
25. Němeček V, Částková J, Fritz P, et al. The 2001 serological survey in the Czech Republic – viral hepatitis. Cent Eur J Public Health, 2003;11, suppl.:S54–61.
26. Zábranský T, Mravčík V, Korčišová B, et al. Hepatitis C Virus Infection among Injecting Drug Users in the Czech Republic – Prevalence and Associated Factors. Eur Addict Res, 2006;12(3): 151–160.
27. Krekulová L, Řehák V, Oktábec Z, et al. HCV Genotype Shift Occurred Over the 15 years in PWIDs in the Czech Republic. Epidemiol Mikrobiol Imunol, 2019;1, 68(1):3–8.
28. Žlnayová E. Postavenie a úloha ženy – matky a muža – otca v rómskej rodine. Romano džaniben, 1996;3(1):29–41.
29. Mehta SH, Genberg BL, Astemborski J, et al. Limited uptake of hepatitis C treatment among injection drug users. J Community Health, 2008;33 : 126–133. DOI: 10.1007/s10900-007-9083-3. Dostupné na www: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3800027/
30. Grebely J, Raffa JD, Lai C, et al. Low uptake of treatment for hepatitis C virus infection in a large community-based study of inner city residents. J Viral Hepat, 2009;16(5):352–358. DOI: 10.1111/j.1365-2893.2009.01080.x. ISSN 1352-0504.
31. Alavi M, Raffa JD, Deans GD, et al. Continued low uptake of treatment for hepatitis C virus infection in a large community-based cohort of inner city residents. Liver Int;34(8): 1198–1206. DOI: 10.1111/liv.12370. ISSN 1478-3223.
32. Státní zdravotní ústav Praha. Trendy vývoje a výskyt HIV/AIDS v ČR v roce 2017. Praha: Státní zdravotní ústav Praha, NRL pro HIV/AIDS, 2018. Dostupné na www: http://szu.cz/uploads/documents/CeM/HIV_AIDS/rocni_zpravy/2017/Tiskova_zprava_NRL_pro_HIV_AIDS_2017.pdf.
33. Bachofner J, Valli PV, Bergamin I, et al. Excellent outcome of direct antiviral treatment for chronic hepatitis C in Switzerland. Swiss Medical Weekly, 2018;148(34). DOI: 10.4414/smw.2018.14560. Dostupné na www: http://doi.emh.ch/smw.2018.14560.
Labels
Hygiene and epidemiology Medical virology Clinical microbiologyArticle was published in
Epidemiology, Microbiology, Immunology

2019 Issue 3
-
All articles in this issue
- A high prevalence of viral hepatitis C in a socially excluded Roma community in Brno
- Incidence and analysis of campylobacteriosis cases in the Czech Republic in 1997–2017
- Molecular study of mycobacterial strains prevalent in the Czech Republic in 2014
- Antiviral adoptive immunotherapy using antigen-specific T cells in allogeneic hematopoietic stem cell transplant recipients
- West Nile virus (lineage 2) detected for the first time in mosquitoes in Southern Bohemia: new WNV endemic area?
- Prevalence and the role of CCR5Δ32 heterozygosity in disease progression in HIV positive patients in the Czech Republic
- Epidemiology, Microbiology, Immunology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Incidence and analysis of campylobacteriosis cases in the Czech Republic in 1997–2017
- Prevalence and the role of CCR5Δ32 heterozygosity in disease progression in HIV positive patients in the Czech Republic
- Antiviral adoptive immunotherapy using antigen-specific T cells in allogeneic hematopoietic stem cell transplant recipients
- A high prevalence of viral hepatitis C in a socially excluded Roma community in Brno
