Diabetická retinopatia 1
Diabetic retinopathy 1
Diabetic retinopathy (DR) is the most common microvascular complication of diabetes mellitus (DM) and one of the most common causes of blindness in working age. The emergence and development of DR and diabetic macular edema (DME) are influenced by systemic and ocular risk factors. The Global Diabetic Retinopathy Project Group simplified the classification of DR and DME to facilitate early diagnosis of the disease, to improve communication between the ophthalmologist, diabetologist and general practitioner, which allows for early indication of effective up-to-date treatment of DR and DME.
Key words:
diabetic retinopathy – diabetes mellitus – diabetic macular edema – microvascular complication
:
Mária Molnárová
:
II. Očná klinika, FNsP F. D. Roosevelta, Banská Bystrica
:
Forum Diab 2012; 1(1): 17-23
:
Diabetická retinopatia (DR) je najčastejšia mikrovaskulárna komplikácia diabetes mellitus (DM) a patrí medzi najčastejšie príčiny slepoty v produktívnom veku. Vznik a vývoj DR a diabetického edému makuly (DEM) sú ovplyvňované systémovými i okulárnymi rizikovými faktormi. The Global Diabetic Retinopathy Project Group zjednodušila klasifikáciu DR na uľahčenie včasnej diagnostiky ochorenia a na zlepšenie komunikácie medzi oftalmológom, diabetológom a praktickým lekárom, čo umožňuje včasnú indikáciu správnej modernej liečby DR a DEM.
Kľúčové slová:
diabetická retinopatia – diabetes mellitus – diabetický edém makuly – mikrovaskulárna komplikácia
Úvod
Prevalencia diabetes mellitus (DM) a diabetickej retinopatie (DR) na celom svete rapídne narastá. Diabetická retinopatia je najčastejšia mikrovaskulárna komplikácia diabetes mellitus a patrí medzi najčastejšie príčiny slepoty vo veku od 20 do 74 rokov. V USA každoročne zaznamenávajú 12 000 až 24 000 nových prípadov oslepnutí pre diabetickú retinopatiu za rok [1]. Relatívne riziko oslepnutia u ľudí s DM je 5,2-krát vyššie ako u ľudí bez DM [2]. Údaje z Wisconsin Epidemiologic Study of Diabetic Retinopathy ukazujú, že proliferatívna diabetická retinopatia (PDR) a DEM sa vyvíja u 1,07 až 1,3 % ľudí starších ako 20 rokov s DM [3]. Podľa Saaddine (2008) bolo v USA v roku 2008 odhadom 14 456 000 diabetickej populácie staršej ako 20 rokov. V tomto roku bolo zistených 154 679 nových prípadov PDR a 187 928 nových prípadov diabetického edému makuly [4]. V roku 2000 bolo v USA 4,1 mil. ľudí s DR a 0,9 mil. ľudí so zrak ohrozujúcou DR. Očakáva sa, že sa tento počet do roku 2050 strojnásobí a vo vekovej kategórii nad 65 rokov bude dokonca 4-násobný [4]. Incidencia a prevalencia DR závisí od typu DM, užívania inzulínu, veku vzniku DM, trvania DM, rasy, pohlavia, od kontroly (kompenzácie) glykémie a ostatných rizikových faktorov [5,6].
Systémové a očné faktory ovplyvňujúce DR
Viac epidemiologických štúdií sledovalo vzťah medzi systémovými faktormi a okulárnymi faktormi a vznikom DEM či progresie už existujúcej DR.
Silný vplyv na prevalenciu retinopatie, incidenciu progresie diabetickej retinopatie s dôsledkami pre centrálnu zrakovú ostrosť (CZO), vyžadujúcu fokálnu alebo panretinálnu laserkoagulačnú liečbu, má nedostatočná kontrola glykémie [7]. Početnými prácami je dokázané, že na vývoj či progresiu retinopatie a DEM má výrazný vplyv vysoký glykozylovaný hemoglobín HbA1c [8]. Vyššia hladina glykozylovaného hemoglobínu sa spája aj so zlyhaním odpovede DEM na fokálnu alebo mriežkovú laserkoaguláciu [9].
Ďalším závažným faktorom na vývoj retinopatie môže byť nekompenzovaný vysoký krvný tlak. Dokázalo sa, že zvýšenie diastolického tlaku je spojené s nárastom DEM [10,11].
Vysoká hladina oxidovaného nízkoviskózneho lipoproteínu cholesterolu môže ovplyvňovať retinopatiu viacerými spôsobmi. Môže mať toxický vplyv na endotel kapilár a pericyty, čím môžu stimulovať zápal zvýšením produkcie cytokínov [12], ďalej môže viesť k zvýšeniu sérovej viskozity alebo spôsobiť narušenie fibrinolytického systému [13]. Veterans Affairs Diabetes Trial a The Blue Mountains Eye Study nenašli a nepotvrdili spojitosť medzi hladinou totálneho cholesterolu, LDL-cholesterolu, HDL-cholesterolu alebo hladinou triacylglycerolov a závažnosťou či progresiou diabetickej retinopatie. Je však dokázaná spojitosť medzi vysokou hladinou cholesterolu a výskytom tvrdých exsudátov u ľudí užívajúcich inzulín bez ohľadu na vek [14]. Podľa Early Treatment Diabetic Retinopathy Study (ETDRS) zvýšená hladina cholesterolu a nízkoviskóznych lipoproteínov je spojená s vysokým výskytom tvrdých exsudátov, ktoré následne zvyšujú riziko straty zraku [15]. Predpokladá sa, že zvýšená hladina sérových lipidov je spojená s poruchou zraku v dôsledku vývoja DEM, ale toto konštatovanie nie je priamym výsledkom štúdie [12]. Odpoveď DEM na fokálnu/mriežkovú laserkoagulačnú liečbu môže závisieť od hladiny rôznych frakcií sérových lipidov. Retrospektívna štúdia na 65 očiach s DEM pri 1. alebo 2. type DM potvrdila, že po laserovej liečbe DEM zlepšenie centrálnej zrakovej ostrosti bolo signifikantne výraznejšie u pacientov, ktorý mali normálnu hladinu triacylglycerolov a HDL-cholesterolu oproti pacientom so zvýšenou hladinou triacylglycerolov a „low“ HDL-cholesterolu [16].
Ďalším rizikovým faktorom vzniku alebo progresie DR a DEM je anémia. Bolo publikovaných niekoľko prípadov, kedy anémia vyvolala exacerbáciu progresie PDR a DEM [17]. Liečba anémie subkutánnou injekciou erytropoetínu asociovala so zlepšením makuly z hľadiska tvrdých exsudátov a so zlepšením vízu.
Epidemiologické dáta WESDR naznačujú, že proteinúria je často spojená s prevalenciou DR a incidenciou PDR u juvenilných diabetikov. Proteinúria je nezávislým rizikovým faktorom pre 25-ročnú incidenciu, ale nie 10-ročnú incidenciu DEM pri 1. type DM. Proteinúria neasociuje s 10-ročnou incidenciou DEM u starších diabetikov vo Wisconsin Epidemiological Study of Diabetic Retinopathy (WESDR). Nízka sérová hladina albumínov a mikroalbuminúria boli spojené so závažnejšími štádiami diabetickej retinopatie [5]. Závažnosť DR u starších i mladších diabetických pacientov s trvaním ochorenia viac ako 10 rokov je v súvislosti s proteinúriou [5]. DM je jedna z možných príčin nefrotického syndrómu charakterizovaného masívnou proteinúriou, hypoalbuminémiou a poklesom sérovej osmolarity. Toto spolu s retenciou solí a vody môže viesť k vývoju a exacerbácii DEM. Diuréza s furosemidom môže zlepšovať DEM v takejto situácii [18]. Hemodialýza a transplantácia obličiek môžu viesť k stabilizácii DR a zlepšeniu či vyriešeniu DEM [19].
Gravidita môže akcelerovať vývoj DR. Zvýšenie výkonu srdca, zvýšenie objemu plazmy, zvýšenie prietoku krvi a príležitostný nástup anémie sprevádzajúcej graviditu môže viesť k vývoju DEM. Vývoj a progresia kapilárnej nonperfúzie sú ireverzibilné a môžu viesť k poškodeniu zrakovej ostrosti. Tieto faktory môžu u gravidných diabetičiek viesť aj ku vzniku DEM [20] a rapídnej progresii preexistujúcej PDR. Progresia DR počas gravidity závisí od závažnosti DR pri počatí, rýchlejšia progresia DR je zaznamenávaná pri pokročilých štádiách DR pred graviditou [5].
Z ostatných systémových faktorov DR a DEM zhoršujú ich prognózu užívanie diuretík, nízka hladina sérového albumínu, vysoká hladina Willebrandovho faktora, hypomagnezémia a nízka hladina aktivátora plazminogénu [5]. Naopak nízka hladina rastového faktora má relatívne protektívny účinok na vývoj DR. Nebola potvrdená súvislosť medzi DR a zvýšenou hladinou celkového cholesterolu, HDL-cholesterolu, LDL-cholesterolu, non-HDL-cholesterolu, fajčením, užívaním aspirínu, počtom bielych krviniek, doštičiek, užívaním betablokátorov [5].
Na základe uvedeného platí, že pred uskutočňovaním laserovej, intravitreálnej a chirurgickej liečby je veľmi užitočné optimalizovať systémové faktory, ktoré ovplyvňujú DR.
Podobne ako systémové faktory, aj niektoré lokálne očné faktory majú vplyv na vznik a vývoj DR. Sú to vysoká myopia a chorioretinálne jazvy po prebehnutej chorioretinitíde, ktoré redukciou časti hypoxickej sietnice výraznou mierou znižujú riziko vzniku PDR. Na tomto princípe v roku 1956 Meyer-Schwickerath účelne vyvinul liečbu DR xenónovou fotokoaguláciou [21].
Definícia DR a DEM, klasifikácia a klinický obraz
DR je súhrn cievnych a ložiskových zmien sietnice, ktoré sú výsledkom systémových (metabolických, endokrinných a hematogénnych) faktorov a okulárnych anatomických osobitostí.
Zmeny, ktoré pri diabetickej retinopatii môžeme vidieť na očnom pozadí, môžeme koncepčne rozdeliť do 3 kategórií:
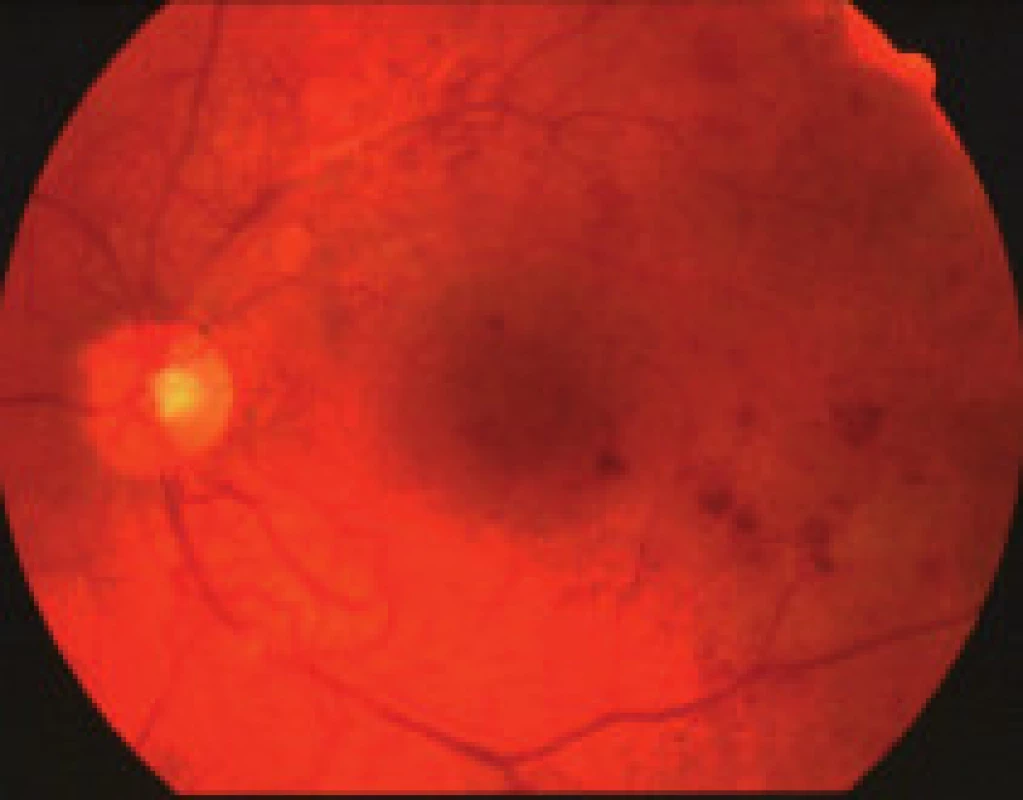
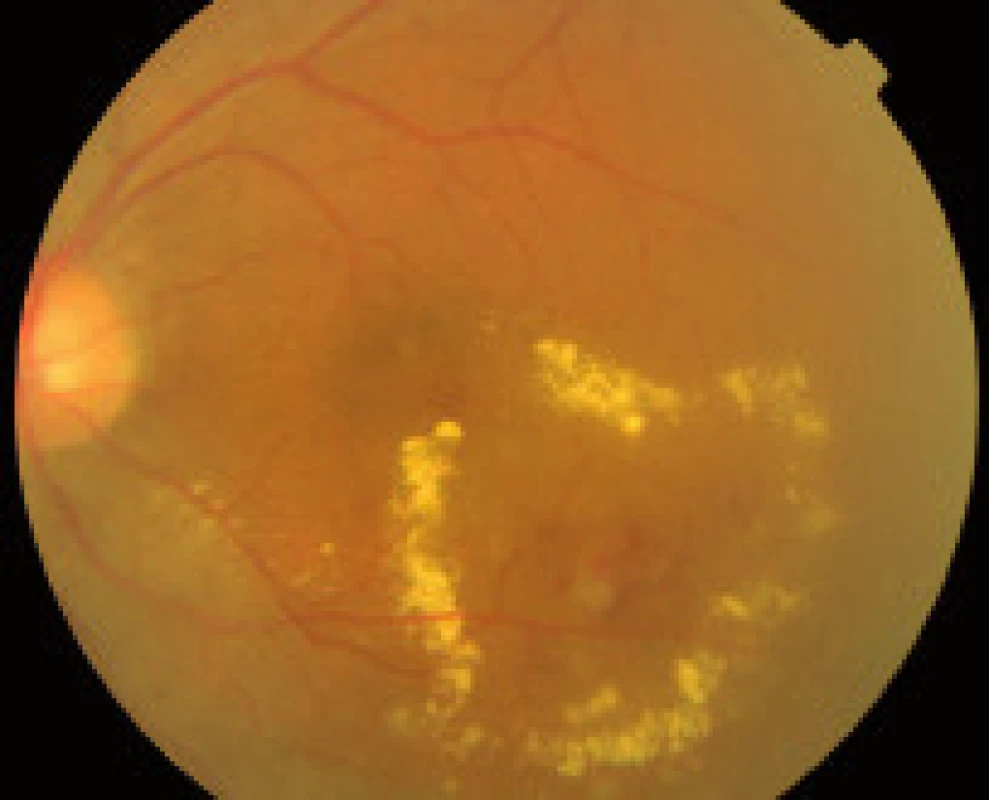
- zmeny, ktoré sú výsledkom presakovania z mikrovaskulatúry (hemorágie, lipoidné exsudáty, edém sietnice),
- nález, ktorý je výsledkom poškodenia štruktúry cievnej steny kapilár sietnice (mikroaneuryzmy, flebopatia),
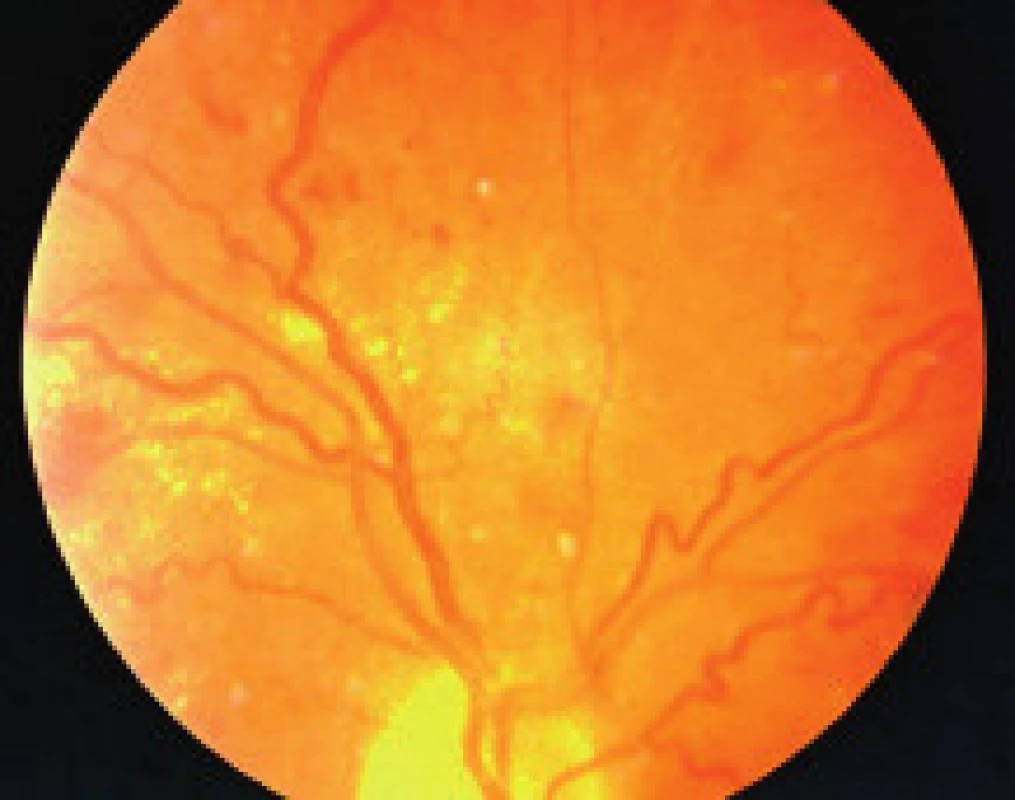
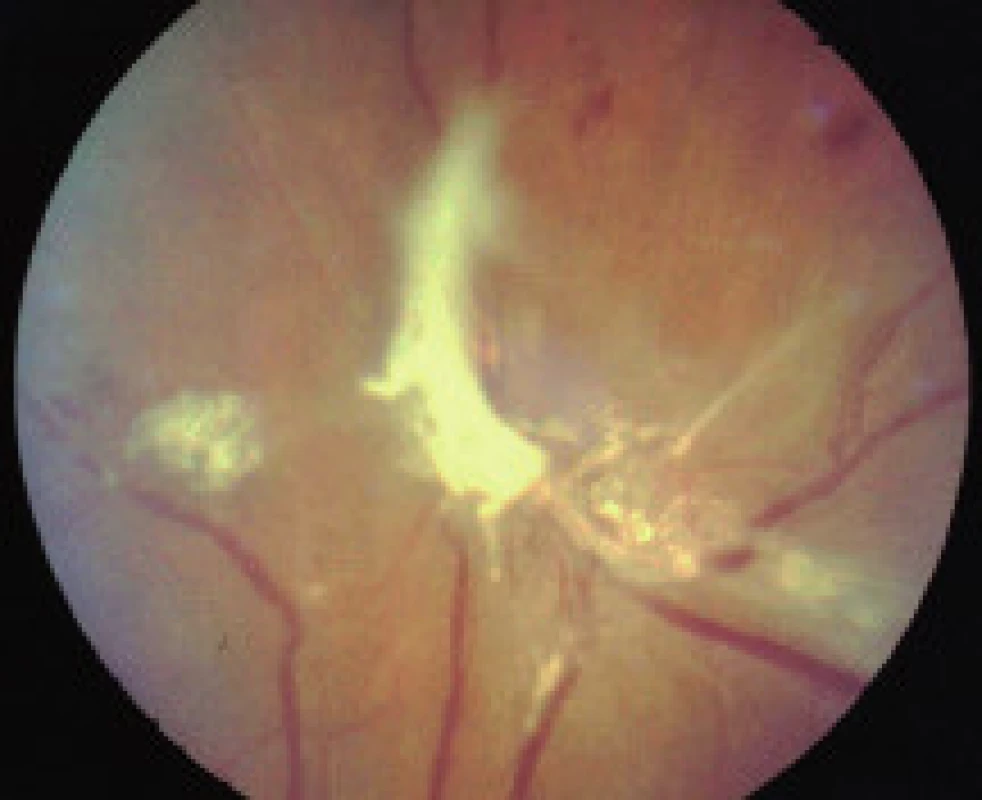
- zmeny, ktoré sú výsledkom ischémie a následnej nadprodukcie rastových faktorov (vatovité ložiská, škvrny, intraretinálne mikrovaskulárne abnormality (IRMA), preretinálne neovaskularizácie, fibrovaskulárne proliferácie, trakčná amócia sietnice, preretinálne hemorágie a hemorágie do sklovca [5].
Závažnosť každého z týchto nálezov môže byť klasifikovaná a kvantifikovaná na základe stupňa poškodenia sietnice, napr. podľa počtu mikroaneuryziem a hemorágií v každom kvadrante fundusu, na základe veľkosti plochy sietnice postihnutej neovaskularizáciami, IRMA, fibroproliferatívnym tkanivom, alebo oblasti makuly so zhrubnutím sietnice. The Eye Diseases Prevalence Research Group klasifikuje prítomnosť DR ako ľahkú, stredne závažnú a závažnú diabetickú retinopatiu a diabetický edém makuly alebo ich rôzne kombinácie navzájom [5]. V súčasnosti The Global Diabetic Retinopathy Project Group sa pokúsila zjednodušiť schému klasifikácie DR na uľahčenie včasnej diagnostiky ochorenia, ako aj na uľahčenie komunikácie medzi oftalmológmi, diabetológmi a praktickými lekármi, aby DR a DEM boli čím skôr detegovateľné, jednotne reprodukovateľné a aby bola čo najskôr indikovaná správna aktuálna moderná liečba tohto ochorenia – tab. 1, tab. 2, [22].


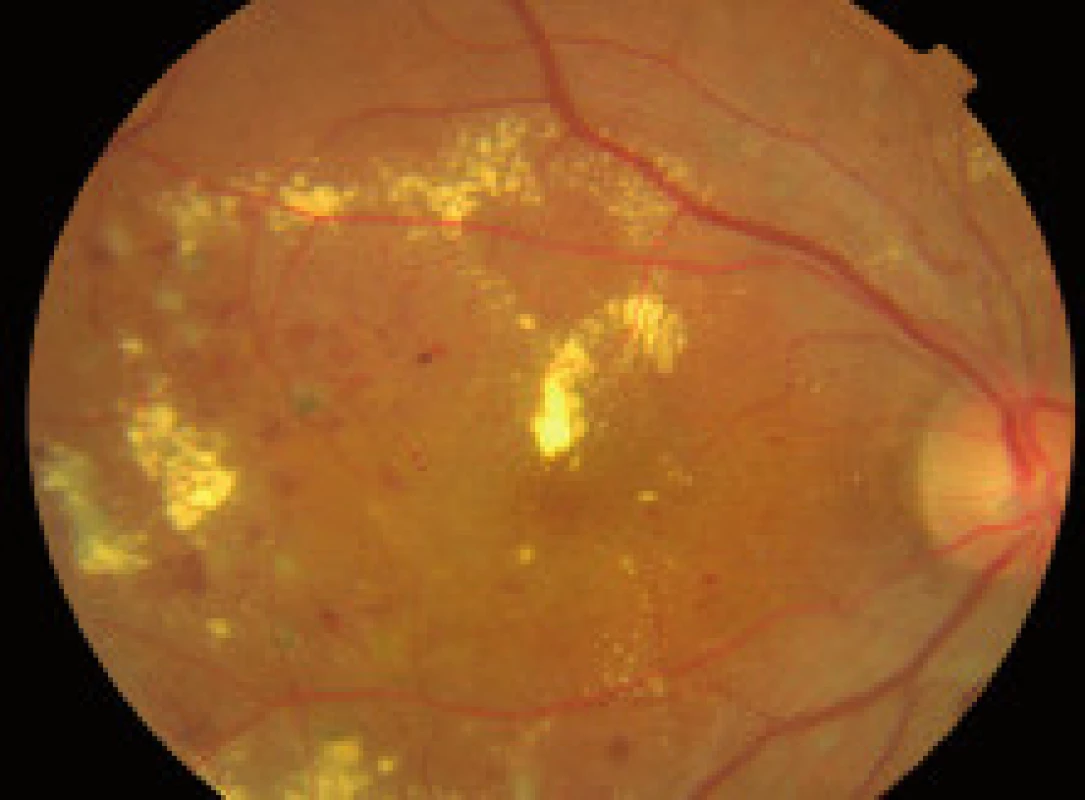
Špecializované zobrazovacie vyšetrovacie metódy
Základom každého očného vyšetrenia je vyšetrenie centrálnej zrakovej ostrosti a vyšetrenie vnútroočného tlaku, predného segmentu oka a očného pozadia. Vyšetrenie očného pozadia u pacienta s DM musí byť uskutočnené najmenej raz ročne – vyšetrenie v arteficiálnej mydriáze, a to u oftalmológa prvého kontaktu direktným priamym oftalmoskopom. V prípade potvrdenia diagnózy DR a/alebo DEM nasleduje vyšetrenie na pracovisku, ktoré sa špecializuje na diagnostiku a liečbu ochorení sietnice.
Na presnú klasifikáciu DR a DEM, na indikáciu správnej liečby a sledovanie vývoja ochorenia sa využívajú špeciálne zobrazovacie vyšetrovacie metódy, z ktorých každá má svoju výpovednú hodnotu [5]:
- Stereoskopické vyšetrenie fundusu umožňuje priestorové plastické vyšetrenie zmien na povrchu sietnice, napríklad plastický reliéf makuly pri jej edéme, epiretinálne lézie (fibrózne pruhy) a výšku trakčnej amócie sietnice.
- Farebná fotografia očného pozadia a stereofotografia fundusu má neoceniteľný význam pri posudzovaní/monitoringu vývoja DR a DEM a ich odpovede na liečbu, tiež z forenzných dôvodov.
- Fluoresceínová angiografia je invazívna vyšetrovacia metóda, pri ktorej sa ako kontrast používa Fluorescit. Pri vyšetrení sa aplikuje 5 ml 10% Fluorescitu do kubitálnej vény a na snímkach, ktoré sa následne robia v sérii, sa hodnotí patologická hyperfluorescencia z presakovania a prifarbovania, rovnako patologická hypofluorescencia z nenaplnenia alebo z blokovania normálnej fluorescencie hemorágiami či exsudátom.
- Optická koherentná tomografia (OCT – optical coherence tomography) je nová neinvazívna vyšetrovacia metóda na vyšetrenie a zobrazenie sietnice hlavne makuly na priereze in vivo odpovedajúc vrstvám sietnice. Má nenahraditeľnú hodnotu hlavne pri diagnostike, klasifikácii DEM, indikácii správnej liečby DEM a monitoringu vývoja DEM pri naturálnom vývoji alebo po liečbe (zobrazenie a kvantifikácia edému).
- Mikroperimetria podáva alternatívne vysvetlenie straty zraku, iné ako množstvo edému merané pomocou vyšetrení OCT. Mikroperimetria fundusu je skenovací laserový oftalmoskop, ktorý mapuje fixačné vlastnosti a citlivosť makuly. Zároveň podáva informáciu aj o paramakulárnej zrakovej funkcii, čo je pri DEM veľmi dôležitá informácia.
- Ultrasonografia mód B, 3D je zobrazovacia vyšetrovacia metóda primárne určená na vyšetrenie očí s opaknými optickými prostrediami a krvácaniami do sklovca. U pacientov s DR pri krvácaniach do sklovca je takéto ultrazvukové vyšetrenie fundusu veľmi dôležité, ponúka informáciu, či je prítomná alebo neprítomná amócia sietnice, ukazuje lokalizáciu a intenzitu hemorágií v sklovci.
- Multifokálna elektroretinografia (ERG) umožňuje simultánne elektrofyziologické testovanie početných malých okrskov sietnice. Abnormálne vlny druhého rádu môžu byť detegované pred rozvojom diabetickej retinopatie na podklade deficitu vo vnútorných vrstvách sietnice.
Liečba diabetickej retinopatie a diabetického edému makuly
S pribúdaním vedeckých poznatkov v etiopatogenéze DR a DEM sa postupne upravujú názory na ich liečbu.
Laserová liečba
Používa silný zdroj svetla na koaguláciu tkaniva. ETDRS odporúča fokálnu koaguláciu presakujúcej liečiteľnej lézie pri fokálnom diabetickom edéme makuly a mriežkovú koaguláciu pri difúznom edéme makuly. Priama fokálna koagulácia cielene uzatvára presakujúce mikroaneuryzmy, čím napomáha udržať aktuálnu centrálnu zrakovú ostrosť a redukuje progresívnu stratu CZO. Laserové svetlo je absorbované hemoglobínom vnútri mikroaneuryziem. Pri mriežkovej fotokoagulácii pri difúznom edéme makuly sa robia na sietnici jemné koagulačné ložiská, laserové svetlo je absorbované bunkami pigmentového epitelu sietnice (PES). Mriežková koagulácia má redukovať presakovanie z permeabilných abnormalít pri porušenej vnútornej i vonkajšej hematookulárnej bariére a obnoviť nátrium-káliovú pumpu regenerovaným pigmentovým epitelom sietnice. Tento mechanizmus vedie k redukcii edému makuly. Fokálna koagulácia liečiteľnej lézie pri DEM vykazuje dobrý a pretrvávajúci efekt na zachovanie a zlepšenie CZO. Difúzny edém makuly pri DM len v 24,6 % odpovedá regresiou na mriežkovú koaguláciu [23]. Pri PDR je indikovaná panretinálna laserkoagulácia, ktorá zlepšuje oxygenáciu sietnice a stále predstavuje zlatý štandard liečby PDR.
Cielená etiopatogénna farmakoterapia
Farmakoterapia DR a DEM ani prevencia vzniku DR a DEM nie je doteraz známa. Nádejou v liečbe DR a DEM sa ukázali intravitreálne aplikované steroidy a antiVEGF, ktoré znižujú hyperpermeabilitu kapilár a tým bránia vzniku alebo progresii DEM, pri PDR zabraňujú vzniku a progresii neovaskularizácií [24]. Steroidy majú pri liečbe diabetického edému makuly viacnásobný efekt. Redukujú cievnu hyperpermeabilitu, bránia poškodeniu hematookulárnej bariéry – antiedémový účinok, znižujú tvorbu VEGF (vascular endothelial growth factor) – antiangiogénny účinok, majú protizápalový účinok, inhibujú metaloproteínkinázu a majú antiproliferatívny účinok [25]. AntiVEGF znižujú neoangiogenézu a výraznou mierou znižujú cievnu hyperpermeabilitu znížením stimulu pre proliferáciu endotelových buniek, pre syntézu intercelulárneho matrixu a znížením fosforylácie okludínu spevňujú spojenia endotelových buniek, čo znižuje permeabilitu ciev [26].
Chirurgická liečba
Je indikovaná v prípadoch, kde laserová liečba je kontraindikovaná: zlyhanie laserovej liečby pri PDR, zlyhanie fokálnej alebo mriežkovej laserovej liečby DEM, zlyhanie antiVEGF-liečby DEM. Chirurgická liečba zahŕňa pars plana vitrektómiu so separáciou zadnej hraničnej vrstvy sklovca (ak je prítomná), kompletné odstránenie fibroproliferatívnych epiretinálnych membrán, peeling membrana limitans interna zo zadného pólu oka. Vitreomakulárna chirurgia musí zaistiť dokonalé odstránenie všetkého epiretinálneho tkaniva [27].
Záver
Pochopenie mechanizmov, ktoré predstavujú základ cukrovky, a naša schopnosť zlepšiť očné komplikácie napredujú rýchlym tempom. Škála disciplín, ktoré prispievajú k pokroku, je veľmi široká a zahŕňa biochémiu, patofyziológiu, molekulárnu biológiu, epidemiológiu, klinickú medicínu, ekonomiku a etiku.
Z oftalmologického hľadiska si starostlivosť o pacienta s DR a DEM vyžaduje včasnú diagnostiku DR a DM, na základe výsledkov nových zobrazovacích vyšetrovacích metód indikovať a uskutočniť správnu modernú liečbu pri dobrej kontrole glykémií a ostatných rizikových faktorov. Prognóza vývoja centrálnej zrakovej ostrosti pacienta s DM závisí od úzkej spolupráce diabetológa a oftalmológa.
MUDr. Mária Molnárová, PhD.
Doručené do redakcie 15. marca 2012
Prijaté do tlače po recenzii 1. apríla 2012
Sources
1. National diabetes fact sheet 2007. Dostupné z: http://www.cdc.gov/diabetes/pubs/pdf/ndfs_2007.pdf. Accessed November 30.
2. Trautner C, Icks A, Haastert B et al. Incidence of Blindness in relation to diabetes. Diabetes Care 1997; 20(7): 1147–1153.
3. Klein R, Klein BEK, Moss SE. The epidemiology of ocular problems in diabetes mellitus. In: Feman SS (Ed). Ocular Problems in Diabetes mellitus. St. Louis: CV Mosby Co 1989 : 255–264.
4. Saaddine JB, Honeycutt AA, Narayan KM et al. Projection of diabetic retinopathy and other major eye diseases among people with diabetes mellitus. United States 2005–2050. Arch Ophthalmol 2008; 126(12): 1740–1747.
5. Browning DJ. Diabetic Retinopathy. Springer: New York – Dordrecht – Heidelberg – London 2010. ISBN 978–0-387–85899–9.
6. Klein R, Klein BEK, Moss SE et al. Wisconsin epidemiologic study of diabetic retinopathy. III. Prevalence and risk of retinopathy when age at diagnosis is 30 or more years. Arch Ophthalmol 1984; 102(4): 527–532.
7. Diabetes Control and Complications Trial research group. Progression of retinopathy with intensive versus conventional treatment in the diabetes control and complication trial. Ophthalmology 1995; 102(4): 647–661.
8. Brown JB, Pedula KI, Summers KH. Diabetic retinopathy. Contemporary prevalence in a well-controlled population. Diabetes Care 2003; 26(9): 2637–2642.
9. Do DV, Shah SM, Sung JU et al. Persistent diabetic macular edema is associated with elevated hemoglobin A1c. Am J Ophthalmol 2005; 139(4): 620–623.
10. Klein R, Klein BEK, Moss SE et al. The Wisconsin epidemiologic study of diabetic retinopathy. XV. The long term incidence of macular edema. Ophthalmology 1995; 102(1): 7–16.
11. UK Prospective Diabetic Study Group. Risk of progression of retinopathy and vision loss related to tight blood pressure control in type 2 diabetes mellitus. Arch Ophthalmol 2004; 122(11): 1631–1640.
12. Cusick M, Chev EY, Chan CC et al. III. Histopathology and regression of retinal hard exudates in diabetic retinopathy after reduction of serum lipid levels. Ophthalmology 2003; 110(11): 2126–2133.
13. Misra A, Vikram NK, Kumar A. Diabetic maculopathy and lipid-lowering therapy. Eye 2004; 18(1): 107–108.
14. Klein BEK, Moss SE, Klein R, Surawitz TS. The Wisconsin epidemiologic study of diabetic retinopathy XIII. Relationship of serum cholesterol to retinopathy and hard exudate. Ophthalmology 1991; 98(8): 1261–1265.
15. Chew EY, Klein ML, Ferris FL et al. Association of elevated serum lipid levels with retinal hard exsudate in diabetic retinopathy – early treatment diabetic retinopathy study (ETDRS) report 22. Arch Ophthalmol 1996; 114(9): 1079–1084.
16. Kremser BG, Falk M, Kieselbach GF. Influence of lipid fractions on the course of diabetic macular edema after photocoagulation. Ophthalmology 1995; 209(2): 60–63.
17. Herman HD, Friedman EA. Partial absorption of hard exudates in patients with diabetic end-stage renal disease and severe anemia after treatment with erythropoetin. Retina 1994; 14(1): 1–5.
18. Ciardella AP. Partial resolution of diabetic macular edema after systemic treatment with furosemide. Br J Ophthalmol 2004; 88(9): 1224–1225.
19. Ramsay RC, Knobloch WH, Barbosa JJ et al. The visual status of diabetic patients. Am J Ophthalmol 1979; 87(3): 305–310.
20. Sinclair S, Nesler C, Foxman B et al. Macular edema and pregnancy in insulin-dependent diabetes. Am J Ophthalmol 1984; 97(2): 154–167.
21. Meyer-Schwickerath G, Schott K. Diabetic retinopathy and photocoagulation. Am J Ophthalmol 1968; 66(4): 597–603.
22. Wilkinson CP, Ferris FL 3rd, Klein RE et al. Proposed international clinical diabetic retinopathy and diabetic macular edema severity scales. Ophthalmology 2003; 110(9): 1677–1682.
23. Lee CM, Olk RJ. Modified grid laser photocoagulation for diffuse diabetic macular edema. Long term visual results. Ophthalmology 1991; 98(10): 1594–1602.
24. Jonas JB, Kreissig I, Soefker A et al. Intravitreal injection of triamcinolone for diffuse diabetic macular edema. Arch Ophthalmol 2003; 121(1): 57–61.
25. Cunningham MA, Edekman JL, Kaushal S. Intravitreal steroids for macular edema: the past, the present and the future. Surv Ophthalmol 2008; 53(2): 139–140.
26. Arevalo JF, Fromow-Guerra J, Quitroz-Mercado H et al. Primary intravitreal bevacizumab for diabetic macular edema: results from the Pan American Collaborative Retina Study Group at s6-month follow-up. Ophthalmology 2007; 114(4): 743–750.
27. Patel JI, Hykin PG, Schydt M et al. Pars plana vitrectomy for diabetic macular edema: OCT and functional correlations. Eye 2006; 20(6): 674–680.
Labels
Diabetology Endocrinology Internal medicineArticle was published in
Forum Diabetologicum

2012 Issue 1
Most read in this issue
- DPP-4-inhibitors – What are the similarities, where are the differences?
- Diabetic retinopathy 1
- Recent aspects of antihypertensive treatment in patients with diabetic nephropathy
- DPP-4-inhibitors – What are the similarities, where are the differences?
