Revaskularizácia pri srdcovom zlyhávaní a diabetes mellitus
Revascularization in heart failure and diabetes mellitus
Surgical revascularization should be preferred in diabetic patients with multivessel coronary artery disease. Myocardial revascularization in presence of heart failure is an acceptable treatment strategy to improve symptomatology, however right indication is crucial. Selection of patients that will benefit from revascularization is equally important as finding the patients with doubtful revascularization outcome. The aim of this article is to characterize mentioned groups of patients and to introduce current strategies of treatment, its indications, limitations and outcomes in context of evidence based medicine.
Key words:
coronary artery disease – heart failure – revascularization
Authors:
MUDr. Marcela Tavačová
Authors‘ workplace:
Národný ústav srdcových a cievnych chorôb, a. s., Bratislava
Published in:
Forum Diab 2015; 4(1): 55-61
Category:
Topic
Overview
U pacientov s diabetom s viaccievnou koronárnou chorobou srdca má byť jednoznačne preferovaná chirurgická revaskularizácia. Revaskularácia myokardu pri súčasne prítomnom srdcovom zlyhávaní s cieľom zlepšenia symptomatológie je akceptovateľnou liečebnou stratégiou, zásadným momentom je však správna indikácia. Rovnako dôležité ako selektovať pacientov vhodných na revaskularizáciu je identifikovať pacientov, ktorí s najväčšou pravdepodobnosťou nebudú z revaskularizácie profitovať. Cieľom článku je charakterizovať uvedené skupiny pacientov a zoznámiť čitateľa s aktuálnymi liečebnými stratégiami, jej indikáciami, limitáciami a výsledkami vo svetle medicíny dôkazov.
Kľúčové slová:
koronárna artériová choroba – srdcové zlyhávanie – revaskularizácia
Úvod
Koronárna choroba srdca (KCHS) je podľa rozsiahleho celoeurópskeho prieskumu príčinou srdcového zlyhávania (SZ) u 68 % pacientov [1]. Treba mať na pamäti, že koronárna choroba srdca, aj keď je u pacientov prítomná, nemusí byť primárnou alebo dominantnou etiológiou syndrómu srdcového zlyhávania. Ischemická kardiomyopatia je definovaná kombináciou systolickej dysfunkcie ľavej komory (ĽK) a viaccievneho koronárneho postihnutia, alebo jasným dôkazom o predchádzajúcom ischemickom poškodení veľkej časti myokardu s následnou remodeláciou. Absencia angíny pektoris alebo dôkazu o prekonaní infarktu myokardu nevylučuje KCHS ako etiologický faktor SZ. Potvrdenie, respektíve vylúčenie prítomnosti a dôsledkov KCHS u všetkých pacientov so SZ je opodstatnené a zmysluplné, pretože ide o potenciálne korigovateľnú príčinu [2,3].
Optimálna stratégia revaskularizácie u chorých s diabetom (DM) a viaccievnou KCHS prešla dôsledným skúmaním v rozsiahlych klinických skúškach. Klinické štúdie z konca minulého storočia presvedčivo ukázali, že diabetici s trojcievnou KCHS majú významne nižšiu dlhodobú mortalitu po chirurgickej revaskularizácii (CABG) v porovnaní s revaskularizáciou perkutánnou (PKI) a súčasne z chirurgickej revaskularizácie profitujú viac diabetici ako pacienti bez diabetu. Najväčšia redukcia mortality v 5-ročnom období sledovania bola zaznamenaná po chirurgickej revaskularizácii práve u diabetikov s dysfunkciou ľavej komory [4,5]. Intervenčné aj chirurgické metódy však prešli v posledných rokoch ďalším vývojom a hlave široké používanie liekom povlečených stentov (DES) by mohlo meniť prístup k revakularizácii u chorých s diabetom. V nedávno publikovanej štúdii FREEDOM sa porovnával efekt CABG a PKI (pri ktorej sa používali DES stenty) u chorých s koronárnou chorobou a diabetom. Viac ako 80% pacientov malo trojcievne ochorenie. Zistilo sa, že pacienti s CABG majú nižšiu celkovú mortalitu, nižší počet infarktov, pri mierne zvýšenom riziku cievnej mozgovej príhody [6]. Veľká časť pacientov s diabetom má nielen koronárnu chorobu, ale súčasne aj srdcové zlyhávanie. Cieľom tohto prehľadového článku je opísať rozhodovací postup pri indikácii revaskularizácie u chorých s KCHS a SZ s ťažkou systolickou dysfunkciou ľavej komory.
Srdcové zlyhávanie pri koronárnej chorobe srdca
Rozvoj systolickej dysfunkcie ľavej komory u pacientov s postihnutím koronárnych artérií poukazuje na pokročilosť ochorenia a spája sa so zhoršením ich prognózy. Srdcové zlyhávanie pri KCHS vychádza z 3 základných dejov: 1. ireverzibilnej straty myocytov po infarkte myokardu s následným vytvorením jazvy; 2. chronickej dysfunkcie hypoperfundovaného, ale viabilného myokardu (tzv. hibernujúci myokard) a 3. remodelácie, ktorá zasahuje zvyšný pôvodne funkčný myokard. Remodelácia je výsledkom maladaptačného procesu, pri ktorom zostávajúci myokard preberá funkciu afunkčných alebo dysfunkčných segmentov v dôsledku obmedzenia alebo prerušenia krvného zásobenia. Pri remodelácii sa mení geometria ľavej komory (ĽK), ktorá sa mení z elipsoidnej na sférickú, ĽK dilatuje, klesá ejekčná frakcia ľavej komory (EF ĽK) obr. 1 a obr. 2. Vzniká uzatvorený bludný kruh, ktorý ďalej zhoršuje podmienky pre funkciu myokardu. V hibernujúcom myokarde dochádza postupne k štrukturálnym zmenám. Dlhotrvajúca a opakovaná ischémia vedie pomaly od degenerácie kardiomyocytov, k ich zániku a ireverzibilnej intersticiálnej fibróze. Zdá sa, že tento proces do určitej miery závisí od dĺžky trvania ischémie.
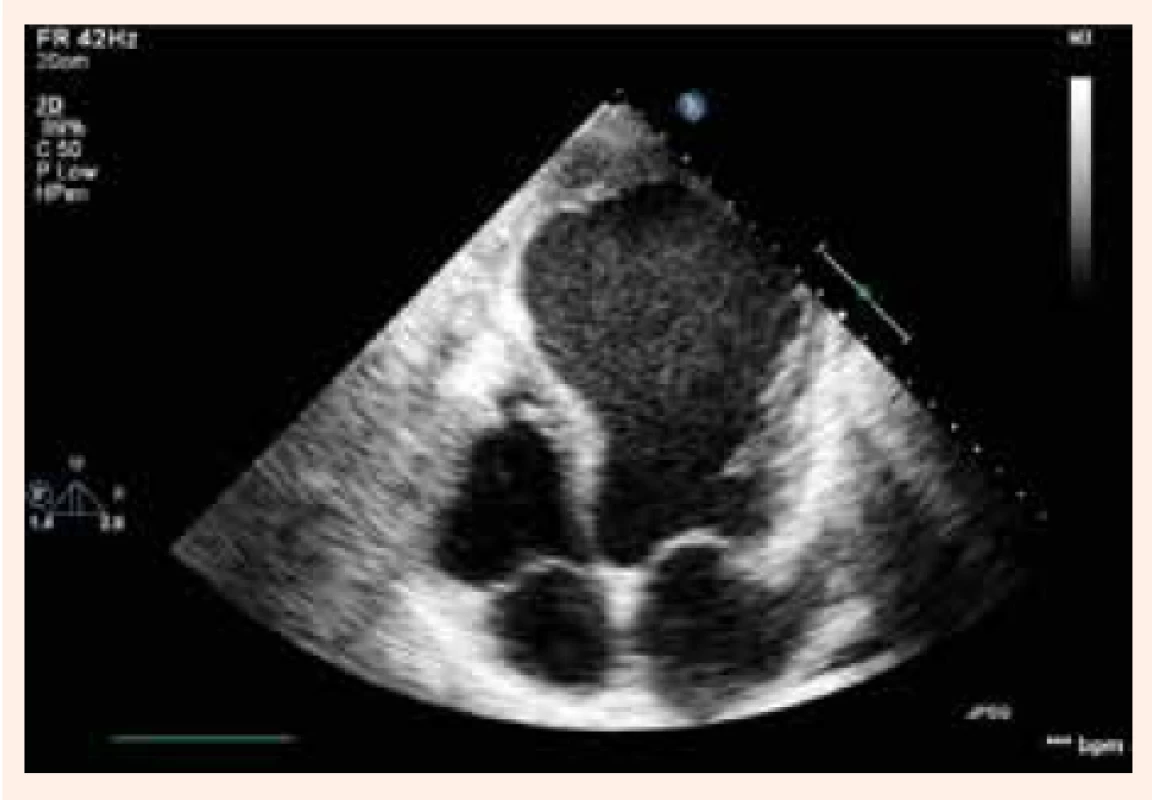
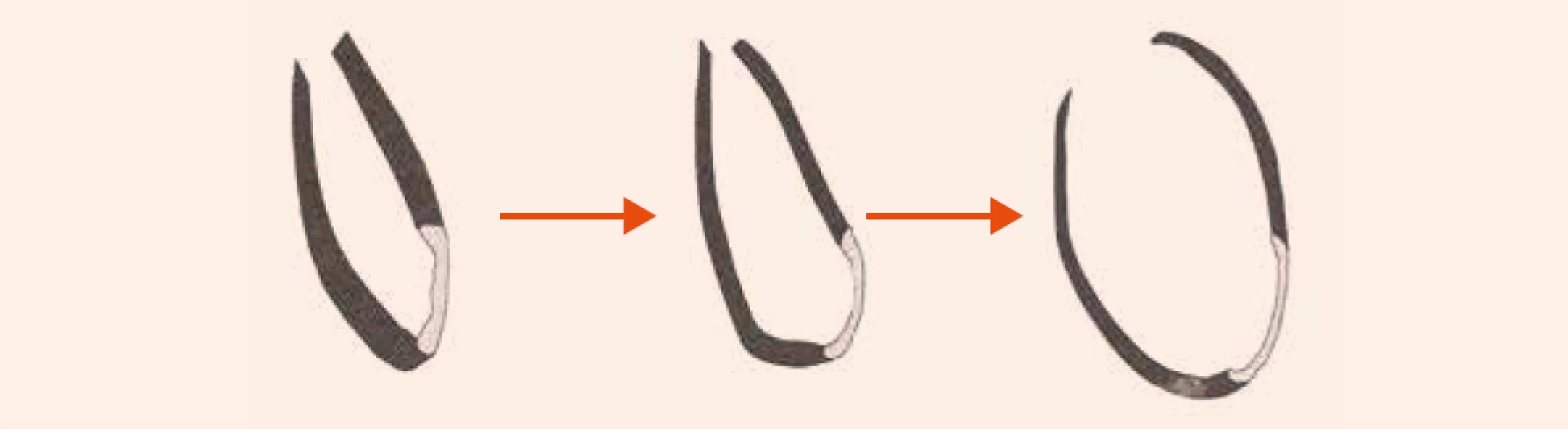
Chirurgická liečba srdcového zlyhávania
Prínos revaskularizácie dysfunkčného myokardu vychádza zo zotavenia kontraktilnej funkcie hibernujúcich segmentov a zabezpečenia dobrej perfúzie funkčných, ale obmedzene perfundovaných segmentov. Súčasne môže znížiť incidenciu malígnych arytmií, a tak priaznivo ovplyvniť prežívanie. Určité množstvo viabilného myokardu môžeme predpokladať u všetkých pacientov s dysfunkčným myokardom. Viabilný myokard je prítomný častejšie a vo väčšom množstve u pacientov po infarkte myokardu bez kmitu Q ako s kmitom Q [7]. Viabilný myokard je prítomný asi u 1⁄3 pacientov s KCHS bez predchádzajúceho infarktu myokardu (IM) a asi u 50 % pacientov po IM [8]. Predpokladom úspešnej revaskularizácie pri SZ je nielen dostatočná masa viabilného myokardu, ale aj charakter samotného koronárneho postihnutia s prítomnosťou lézií vhodných na revaskularizáciu.
Pre dôkaz prítomnosti viabilného myokardu je okrem dobutamínovej echokardiografie a izotopových metód čoraz viac používanou zobrazovacou metódou zobrazenie magnetickou rezonanciou (magnetic resonance imaging – MRI) [9]. Umožňuje posúdiť funkciu komôr, lokálne poruchy kinetiky a viabilitu myokardu. Na rozdiel od iných zobrazovacích metód je schopná identifikovať nielen rozsah, ale aj transmuralitu jazvy, rozlíšiť jazvu od hibernujúceho myokardu bez potreby provokácie ischémie, odlíšiť neischemické lézie [10,11,12] (obr. 3). Ďalší prínos sa očakáva od hybridných zobrazovacích techník [13]. Neinvazívne zobrazovacie metódy poskytujú dôležité informácie pred revaskularizáciou, súčasne však umožňujú určiť pravdepodobnosť regionálneho a globálneho zlepšenia systolickej funkcie ĽK po revaskularizácii.
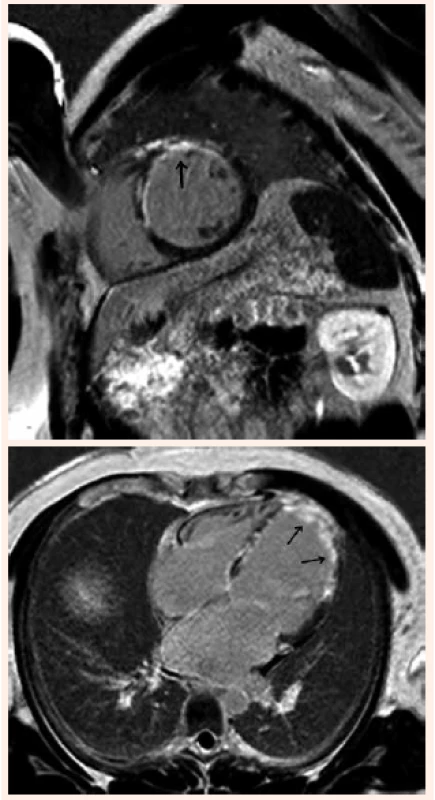
Prítomnosť ťažkej systolickej dysfunkcie ĽK sa v začiatkoch éry chirurgickej revaskularizácie považovala za jej kontraindikáciu vzhľadom na vysokú mortalitu a riziko komplikácií. Staršie randomizované klinické štúdie (RKŠ), porovnávajúce medikamentóznu a chirurgickú liečbu u pacientov s KCHS, vylučovali pacientov so systolickou dysfunkciou ĽK. Len 7 % do nich zaradených pacientov malo EF ĽK pod 40 %, a len 4 % pacientov malo príznaky srdcového zlyhávania [14].
Pokroky v chirurgických technikách a ochrane myokardu viedli k zmene postoja k revaskularizačnej operácii. Hospitalizačná mortalita klesla z pôvodných 15 % na menej ako 6 % [15]. Neskôr sa dokonca ukázalo, že najväčší prínos vzhľadom na redukciu mortality majú práve pacienti s koronárnou chorobou, ischémiou myokardu s ľahkou a stredne závažnou systolickou dysfunkciou ĽK [16]. Chirurgická revaskularizácia u chorých so SZ na podklade koronárnej choroby prináša najlepšie výsledky u hemodynamicky stabilizovaných, euvolemických pacientov, s distálnymi koronárnymi tepnami umožňujúcimi kvalitné anastomózy, s hibernujúcim myokardom bez významnej dilatácie ĽK, bez dysfunkcie pravej komory a závažnej pľúcnej hypertenzie. Pri voľbe štepov pre revaskularizáciu je dôležité voliť metódy, ktoré zabezpečujú čo najlepšiu a dlhodobú priechodnosť. 10 - až 15-ročná priechodnosť mamarokoronárnych by-passov je 65 až 88 %, kým u venóznych štepov sa pohybuje okolo 25 až 50 % [17,18]. Hoci sa chirurgická revaskularizácia s použitím mimotelového obehu používa častejšie, má aj svoje úskalia, ktoré vyplývajú z celkovej zápalovej odpovede organizmu. Miniinvazívne revaskularizačné výkony zahrňujúce „off pump“ techniky na bijúcom srdci bez mimotelového obehu, ale aj výkony z iných šetrnejších chirurgických prístupov predstavujú pre pacienta so systolickou dysfunkciou ĽK menšiu záťaž [19,20]. Väčšinou ale poskytujú neúplnú revaskularizáciu, čo nemusí byť dostatočné na dosiahnutie zlepšenia funkcie ĽK [21]. Pri voľbe optimálnej techniky revaskularizácie je dôležité nájsť správnu rovnováhu medzi rizikom a kompletnosťou revaskularizácie. Samozrejmosťou by mala byť snaha o kompletnú revaskularizáciu.
Prognóza pacientov s chronickou ischemickou systolickou dysfunkciou ĽK zostáva zlá napriek pokrokom v rôznych terapeutických stratégiách. U pacientov s KCHS a ťažkou systolickou dysfunkciou ĽK je z klinického hľadiska praktické rozlišovať 2 skupiny pacientov: 1. pacienti s prevažujúcimi symptómami angíny pektoris a 2. pacienti s prevažujúcimi symptómami srdcového zlyhávania.
Pacienti s dysfunkciou ľavej komory a prevažujúcimi symptómami angíny pektoris
Zlepšenie anginóznej symptomatológie, prežívania a zníženie výskytu koronárnych príhod pacientov s KCHS, AP a dysfunkciou ĽK, ktorí podstúpili revaskularizáciu v porovnaní s tými, ktorí boli liečení konzervatívne, sú dobre zdokumentované. Revaskularizácia u týchto pacientov je uznávanou indikáciou [22,23]. 10-ročné prežívanie pacientov so systolickou dysfunkciou ľavej komory (EF ĽK 35 až 50 %) po aortokoronárnom bypase bola 80 % v porovnaní so 61 % chorých liečených konzervatívne [14]. Výsledky prospektívnych pozorovaní a retrospektívnych analýz pacientov s angínou pektoris a SZ ukazujú lepší dlhodobý osud pacientov, ktorí podstúpili chirurgickú revaskularizáciu, a to aj v prípade ťažkej systolickej dysfunkcie ĽK [24, 25].
Pacienti s dysfunkciou ľavej komory a prevažujúcimi symptómami srdcového zlyhávania
V štúdii CASS (Coronary Artery Surgery Study) z 80. rokov minulého storočia mala podskupina pacientov so systolickou dysfunkciou ĽK s vedúcim klinickým príznakom SZ podobné 3 - až 10-ročné prežívanie po chirurgickej revaskularizácii ako pri konzervatívnej liečbe [26]. Význam revaskularizácie spochybňovali aj úspechy farmakologickej liečby [27].
Ako zásadný predpoklad úspechu sa ukazuje prítomnosť a rozsah masy viabilného myokardu. Podmienkou na zlepšenie klinických ukazovateľov SZ a zlepšenie systolickej funkcie ĽK bola viabilita vyše 25 % myokardu [28]. Práce s dobutamínovou echokardiografiou so 16-segmentovým modelom zistili zlepšenie prognózy, pracovnej kapacity a kvality života pacientov s dysfunkčným myokardom po revaskularizácii v prítomnosti ≥ 6 viabilných segmentov. Neprítomnosť viabilného myokardu je pritom nezávislým rizikovým faktorom perioperačnej a včasnej pooperačnej mortality [29,30]. Metaanalýza observačných štúdií dokumentovala 5-násobne nižšiu mortalitu pacientov s viabilným myokardom, ktorí podstúpili chirurgickú revaskularizáciu oproti konzervatívnej skupine (3,2 % vs 16 %) [31]. Odkladanie revaskularizácie pritom môže zmenšovať jej prínos [28,32], čo je pravdepodobne spôsobené postupujúcimi ireverzibilnými zmenami v hibernujúcom myokarde pri jeho dlhodobej ischémii. Prítomnosť viabilného myokardu, ale nie je jediným určujúcim faktorom, ktorý ovplyvňuje výsledok, a teda aj rozhodovanie o revaskularizácii. Výsledok revaskularizácie závisí nielen od prítomnosti viabilného myokardu, ale aj od rozsahu remodelácie ĽK. U pacientov s veľkým objemom ĽK v systole nedochádza po revaskularizácii napriek dostatočnému rozsahu viabilného myokardu k zlepšeniu kontraktility a klinických prejavov srdcového zlyhávania [33,34]. Neuspokojivé výsledky samotnej chirurgickej revaskularizácie pri remodelovanej a dilatovanej ĽK viedli ku konceptu súčasnej chirurgickej rekonštrukcie geometrie ĽK. Rôzne techniky chirurgickej rekonštrukcie ľavej komory (surgical ventricular restoration – SVR) majú za cieľ zmenšiť objem ĽK a rekonštruovať jej eliptický tvar odstránením jazvy s následnou plastikou ľavej komory. V zmenšenej komore eliptického tvaru dochádza podľa Laplacovho zákona k zníženiu napätia jej stien, čo vytvára priaznivé podmienky na zlepšenie až zotavenie funkcie myokardu. Tieto metódy vychádzajú z postupu, ktorý vypracoval Dor pre resekciu aneuryziem a neskôr aj rozsiahlych akinetických segmentov prednej steny ĽK [35]. Klasickou metódou je aneuryzmektómia ĽK. Výkon sa indikuje väčšinou ako doplnok revaskularizácie u pacientov po infarkte myokardu, u ktorých sa rozvinie symptomatológia srdcového zlyhávania alebo angíny pektoris, komorové arytmie a tromboembolické komplikácie. Pracovná skupina kardiochirurgických pracovísk RESTORE (The Reconstructive Endoventricular Surgery retirning Torsion Original Radius Eliptical shape) publikovala výsledky SVR u 1 198 pacientov. U 95 % z nich sa robila súčasne chirurgická rekonštrukcia koronárnych tepien a u 22 % rekonštrukcia mitrálnej chlopne: 30-dňová mortalita bola 5,3 %, 5-ročné celkové prežívanie 69 %. Z pacientov, ktorí boli pred operáciou vo funkčnej triede NYHA III, IV, bolo po operácii 85 % v triede NYHA I, II [36]. Riziko chirurgickej revaskularizácie myokardu u pacientov s ťažkou systolickou dysfunkciou ĽK je dnes prijateľné. Ak je prítomný viabilný myokard, môžeme očakávať zlepšenie tak symptómov SZ, ako aj funkcie ĽK. Predpokladá sa tiež, že doplnenie revaskularizácie o SVR ovplyvní dlhodobý priebeh ochorenia.
Chirurgická revaskularizácia pri SZ z pohľadu medicíny dôkazov
Všetky vyššie uvedené konštatovania sa zakladajú na retrospektívnych analýzach, analýzach registrov a liečebnej empírii. Až donedávna chýbali randomizované klinické štúdie, ktoré by tieto závery potvrdili. Takýchto prospektívnych randomizovaných klinických skúšok je naozaj málo, sú však zásadným podkladom na formulovanie odporúčaní v tejto oblasti.
Prínos vyšetrenia viability myokardu pred revaskularizáciou u ischemickej systolickej dysfunkcie ĽK spochybnila už prvá randomizovanou klinická štúdia PARR-2. Pacienti, ktorí pred rozhodnutím o revaskularizácii podstúpili vyšetrenie viability metódou PET, mali trend k lepšiemu prežívaniu, tento rozdiel však nebol štatisticky významný. Citlivejším ukazovateľom prospechu z revaskularizácie sa ukázal rozsah (percento) viabilného myokardu. Na druhej strane rozsah jazvy ĽK nemal vzťah k výsledku revaskularizácie [37]. Štúdia HEART (The Heart Failure Revascularisation Trial) mala posúdiť či invazívna stratégia – perkutánna koronárna intervencia, koronárny by-pass (PKI alebo CABG) spolu s medikamentóznou liečbou verzus medikamentózna liečba ovplyvnia prežívanie pacientov s SZ (EF ĽK ≤ 35 %) a koronárnou chorobou s viabilným myokardom podľa zobrazovacích metód. Celková mortalita sa však významne neodlišovala medzi jednotlivými skupinami. Zrealizovaná štúdia sa ukončila predčasne kvôli nízkemu náboru pacientov [38]. Následne boli publikované výsledky prakticky jedinej randomizovanej multicentrickej mortalitnej štúdie STICH (Surgical Treatment of Ischemic Heart Failure) u pacientov s ťažkou ischemickou systolickou dysfunkciou ĽK (EF ĽK ≤ 35 %) prevažne so symptómami SZ. Štúdia vychádzala z dvoch primárnych hypotéz:
Revaskularizácia myokardu (CABG) spolu s medikamentóznou liečbou (MED) zlepší dlhodobé prežívanie v porovnaní so samotnou medikamentóznou liečbou. Randomizovaných bolo 1212 pacientov. Nepreukázal sa štatisticky významný rozdiel v celkovej mortalite po piatich rokoch medzi pacientmi liečenými MED verzus MED + CABG [39]. Po analýze celkovej mortality nielen podľa randomizácie, ale aj podľa liečby vzhľadom na veľký počet prechodov medzi oboma ramenami, rozdiel v celkovej mortalite už dosiahol štatistickú významnosť v prospech skupiny CABG [40,41]. Kardiochirurgická revaskularizácia súčasne významne redukuje kardiovaskulárnu mortalitu a počet hospitalizácií z kardiovaskulárnych príčin (68 % verzus 58 %). Hoci bola včasná 30-dňová mortalita významne vyššia v skupine CABG, dôležitý je kompromis medzi vyšším rizikom krátkodobej mortality a dlhodobým benefitom. Výsledky dokumentujú prospech z revaskularizácie, čo podporuje výhody revaskularizácie u pacientov so SZ [39, 41].
U pacientov s poinfarktovou akinézou prednej steny dokáže chirurgická rekonštrukcia ľavej komory spolu s revaskularizáciou zlepšiť dlhodobé prežívanie v porovnaní so samotnou revaskularizáciou myokardu. Randomizovaných bolo 1 000 pacientov, ktorí spĺňali kritériá pre revaskularizáciu a SVR. Operačná mortalita bola nízka 5 %. Kombinovaný výkon viedol k zníženiu indexu end-systolického objemu ĽK, táto anatomická zmena však nebola spojená so štatisticky významným zlepšením symptómov, znížením frekvencie úmrtia alebo hospitalizácie pre kardiálne príčiny [42]. Výsledky naznačujú, že priaznivý výsledok sa dosahuje vďaka revaskularizácii. K štúdii boli vznesené pripomienky, predovšetkým skutočnosť, že zmenšenie objemu ĽK po rekonštrukcii bolo výrazne menšie ako v predchádzajúcich observačných štúdiách [43]. Výber pacientov na kombinovaný výkon by sa teda mal zakladať na zhodnotení symptómov (prevažujúce symptómy srdcového zlyhávania), objemov ĽK a prítomnosti akinetických a dyskinetických segmentov. Štandardnou zobrazovacou metódou na hodnotenie rozsahu transmurálneho jazvovitého tkaniva myokardu je MRI [12,41].
Výsledky subanalýzy 601 pacientov, u ktorých sa po randomizácii hodnotila viabilita myokardu, sú nepresvedčivé. Prítomnosť viabilného myokardu bola síce spojená s väčšou pravdepodobnosťou prežitia u pacientov s ischemickou chorobou srdca a dysfunkciou ĽK, ale tento vzťah nebol štatisticky významný [44]. Rovnako pacienti, ktorí nemali viabilný myokard, mali porovnateľné prežívanie bez zreteľa na to, či podstúpili operáciu, alebo boli liečení konzervatívne.
Prínos dokazovania prítomnosti viability pred revaskularizáciou myokardu randomizované kontrolované skúšky spochybnili. To nastoľuje potrebu realizácie ďalších prospektívnych štúdií, ktoré zadefinujú prínos zobrazovacích techník na identifikovanie pacientov vhodných na chirurgickú liečbu [45]. Najsľubnejšou v tomto ohľade sa zdá byť zobrazenie magnetickou rezonanciou.
Revaskularizácia pri srdcovom zlyhávaní – posolstvo pre klinickú prax
V súčasnosti sa najčastejšie rozhodovanie o vhodnosti revaskularizácie pri srdcovom zlyhávaní na podklade KCHS zakladá na dôkaze prítomnosti tzv. viabilného myokardu. U nás sa najčastejšie používa dobutamínová echokardiografia. Ak je prítomný viabilný myokard, pri malých dávkach dobutamínu sa zlepšuje funkcia predtým akinetických alebo hypokinetických segmentov myokardu.
Diagnostická a rozhodovacia schéma je založená na tejto postupnosti: srdcové zlyhávanie → koronárna choroba srdca → rekonštruovateľné koronárne riečisko → viabilný myokard → revaskularizácia.
Randomizované kontrolované štúdie z posledných rokov však nepodporujú oprávnenosť tohto konceptu. Napriek jeho logickosti a atraktívnosti má závažné nedostatky. Ani jedno z prospektívnych randomizovaných pozorovaní nepreukázalo, že pacienti s dôkazom viabilného myokardu pred revaskularizáciou majú po nej lepšie prežívanie alebo priaznivejší vývoj ochorenia. Preto dnes pri tomto rozhodovaní máme viac brať do úvahy posúdenie celkového rizika a prínosu chirurgického riešenia.
Uvádzame návrh schémy pre rozhodovanie o indikácii revaskulárizácie u chorých so srdcovým zlyhávaním na podklade koronárnej choroby (schéma). Rozhodnutie o revaskularizácii a samotná revaskularizácia by sa v prípade pacientov so SZ nemali odkladať a urobiť čo najskôr po získaní rozhodujúcich informácií. Zásadné je zhodnotenie prítomnosti angíny pektoris alebo ischémie myokardu, posúdenie rizika kardiochirurgického výkonu ako takého a vhodnosti koronárnej anatómie na chirurgickú rekonštrukciu. Za koronárny nález vhodný na chirurgickú rekonštrukciu sa považuje viaccievne ochorenie so stenózami lumenu viac ako 70 %, stenóza kmeňa ľavej koronárnej tepny viac ako 50 % alebo diabetes mellitus so stenózou ramus interventricularis anterior > 70 %. V selektovaných prípadoch, najmä ak je dokumentovaná rozsiala ischémia, je vhodná perkutánna koronárna intervencia (PKI). Pri rozhodovaní o vhodnosti chirurgickej revaskularizácie má významnú úlohu aj posúdenie nevyhnutnosti, vhodnosti alebo prínosu ďalšieho chirurgického výkonu, najčastejšie rekonštrukcie prípadne náhrady mitrálnej chlopne, plastiky trikuspidálnej chlopne, resekcie aneuryzmy alebo rekonštrukcie geometrie ľavej komory. U vybraných pacientov môže priniesť „pridanú hodnotu” aj chirurgická ablácia fibrilácie predsiení (tzv. Maze operácia).
![Schéma. Manažment pacientov s srdcovým zlyhávaním na podklade KCHS. Upravené podľa [41]](https://pl-master.mdcdn.cz/media/image/cfb6837716400ed9f1ebe7dfa3448426.png?version=1537796986)
Záver
Súčasné poznatky o chirurgickej revaskularizácii myokardu u pacientov s ťažkou systolickou dysfunkciou ĽK, graftovateľným koronárnym nálezom a celkovým nízkym rizikom kardiochirurgického výkonu dokumentujú zlepšenie kvality života a prognózy bez zreteľa na dominantný klinický prejav [16]. Perkutánna koronárna intervencia má obmedzené dôkazy a zatiaľ predstavuje alternatívu k CABG. Dnes akceptované indikácie na revaskularizáciu a SVR uvádza tab. 1 [23,46,47].
![Odporúčania pre revaskularizáciu myokardu u pacientov s chronickým SZ, EF ĽK ≤ 35 %. Upravené podľa [23,46,47] symptómy AP symptómy SZ](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/2062deeb8c7f08173b867f8ee93ea90d.png)
Rozhodnutie o chirurgickej revaskularizácii u chorých so SZ závisí od mnohých faktorov, okrem EF ĽK a koronárnej anatómie, predovšetkým od pridružených ochorení, krehkosti pacienta, následného prístupu k rehabilitačnej a opatrovateľskej starostlivosti a od preferencií pacienta. Optimalizácia medikamentóznej liečby pred revaskularizáciou je samozrejmosťou. Vysoko riziková revaskularizácia má byť indikovaná multidisciplinárnym konsenzom a pacienti by mali byť manažovaní v centrách so zavedeným programom a odbornými znalosťami v liečbe pokročilého SZ vrátane mechanických podporných systémov a transplantácie srdca.
Doručené do redakcie 6. 1. 2015
Prijaté po recenzii 16. 1. 2015
MUDr. Marcela Tavačová
tavacova@nusch.sk
Národný ústav srdcových a cievnych chorôb, a.s., Bratislava
www.nusch.sk
Sources
1. Cleland JGF, Swedberg K, Follath F et al. The EuroHeart Failure survey programe – a survey on the quality of care among patients with heart failure in Europe. Eur Heart J 2003; 24(5): 442–463.
2. Keogh AM, Baron DW, Hickie JB. Prognostic guides in patients with idiopathic or ischemic dilated cardiomyopathy assessed for cardiac transplantation. Am J Cardiol 1990; 65(13): 903–908.
3. Rizzello V, Poldermans D, Biagini E et al. Prognosis of patients with ischaemic cardiomyopathy after coronary revascularisation: relation to viability and improvement in left ventricular ejection fraction. Heart 2009; 95(15): 1273–1277.
4. Frye RL, August P, Brooks MM, et al. A Randomized Trial of Therapies for Type 2 Diabetes and Coronary Artery Disease. N Engl J Med 2009; 360(24): 2503–2515.
5. Farkouh ME, Domanski M, Sleeper LA et al. Strategies for Multivessel Revascularization in Patients with Diabetes. N Engl J Med. 2012; 367(25):2375–2384.
6. Weintraub WS, Grau-Sepulveda MV, Weiss JM et al. Comparative Effectiveness of Revascularization Strategies. N Engl J Med 2012; 366(16): 1467–1476.
7. Yang H, Pu M, Rodriguez D et al. Ischemic and viable myocardium in patients with non-Q-wave or Q-wave myocardial infarction and left ventricular dysfunction: a clinical study using positron emission tomography, echocardiography, and electrocardiography. J Am Coll Cardiol 2004; 43(4): 592–598.
8. Camici PG. Hibernation and congestive heart failure. Heart 2004; 90(2): 141–143.
9. Greenwood JP, Maredia N, Younger JF et al. Cardiovascular magnetic resonance and single-photon emission computed tomography for diagnosis of coronary heart disease (CE-MARC): a prospective trial. Lancet 2012; 379(9814): 453–460.
10. Assomul RG, Prasad SK, Lyne J et al. Cardiovascular magnetic resonance, fibrosis, and prognosis in dilated cardiomyopathy. J Am Coll Cardiol 2006; 48(10): 1977–1985.
11. Hillenbrand HB, Kim RJ, Parker MA et al. Early assessment of myocardial salvage by contrast-enhanced magnetic resonance imaging. Circulation 2000; 102(14): 1678–1683.
12. Assomull RG, Shakespeare C, Kalra PR et al. Role of cardiovascular magnetic resonance as a gatekeeper to invasive coronary angiography in patients presenting with heart failure of unknown etiology. Circulation 2011; 124(12):1351–1360.
13. Di Carli MF, Dorbala S. Cardiac PET-CT. J Thorac Imaging 2007; 22(1): 101–106.
14. Alderman EL, Bourassa MG, Cohen LS et al. Ten-year follow-up of survival and myocardial infarction in the randomized Coronary Artery Surgery Study. Circulation 1990; 82(5): 1629–1646.
15. Kunadian V, Zaman A, Qiu W. Revascularization among patients with severe left ventricular dysfunction: a meta-analysis of observational studies. Eur J Heart Fail 2011; 13(7): 773–84.
16. Moe GW, Ezekowitz JA, O’Meara E et al. The 2013 Canadian Cardiovascular Society Heart Failure Management Guidelines Update: Focus on Rehabilitation and Exercise and Surgical Coronary Revascularization. Can J Cardiol 2014; 30(3): 249–263.
17. Tatoulis J, Buxton BF, Fuller JA. Patencies of 2127 arterial to coronary conduits over 15 years. Ann Thorac Surg 2004; 77(1): 93–101.
18. Zhao DX, Leacche M, Balaguer JM et al. Routine intraoperative completion angiography after coronary artery bypass grafting and 1-stop hybrid revascularization results from a fully integrated hybrid catheterization laboratory/operating room. J Am Coll Cardiol 2009; 53(3): 232–241.
19. Sharoni E, Song HK, Peterson RJ et al. Off pump coronary artery bypass surgery for significant left ventricular dysfunction: safety, feasibility, and trends in methodology over time – an early experience. Heart 2006; 92(4): 449–502.
20. Filsoufi F, Rahmanian PB, Gastillo JG et al. Results and predictors of early and late outcom of coronary artery bypass grafting in patients with severely depressed left ventricular function. Ann Thorac Surg 2007; 84(3): 808–816.
21. Luciani GB, Montalbano G, Casali G et al. Predicting long-term functional results after myocardial revascularization in ischemic cardiomyopathy. J Thorac Cardiovasc Surg 2000; 120(3): 478–489.
22. Eagle KA, Guyton RA, Davidoff R et al. ACC/AHA 2004 guideline update for coronary artery bypass graft surgery: summary article: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (Committee to Update the 1999 Guidelines for Coronary Artery Bypass Graft Surgery). Circulation 2004; 110(9): 1168–1176.
23. Wijns W, Kolh F, Danchin N et al. Guidelines on myocardial revascularization. The Task Force on Myocardial Revascularization of the European Society of Cardiology and the European Association for Cardio-Thoracic Surgery. Eur Heart J 2010; 31(20): 2501–2555.
24. Borger MA, Alam A, Muphy PM et al. Chronic ischemic mitral regurgitation: repair, replace or rething? Ann Thorac Surg 2006; 81(3): 1153–1161.
25. O´Connor CHM, Velazquez EJ, Gardner LH et al. Comparison of coronary artery bypass grafting versus medical therapy on long-term outcome in patients with ischemic cardiomyopathy (a 25-year experience from the Duke Cardiovascular Disease Databank). Am J Cardiol 2002; 90(2): 101–107.
26. Alderman EL, Fischer LD, Litwin P et al. Results of coronary artery surgery in patients with poor left ventricular function (CASS). Circulation 1983; 68(4): 785–795.
27. Cleland JG, Pennell DJ, Ray SG et al. Carvedilol Hibernating reversible ischaemia trial: marker of success invetigators: Myocardial viability as a determinant of the ejection fraction response to carvedilol in patients with heart failure (CHRISTMAS trial): randomised controlled trial. Lancet 2003; 362(9377): 14–21.
28. Lewis ME, Pitt MP, Bonser RS et al. Coronary artery surgery for ischaemic heart failure: the surgeons view. Heart Fail Rev 2003; 8(2): 175–179.
29. Rizzelo V, Poldermans D, Boersma E et al. Opposie patterns of left ventricular remodeling after coronary revascularization in patients with ischemic cardiomyopathy: role of mycardial viability. Circulation 2004; 110(16): 2383–2388.
30. Senior R, Kaul S, Lahiri A. Myocardial viability on echocardiography predicts long-term survival after revascularization in patients with ischemic congestive heart failure. J Am Coll Cardiol 1999; 33(7): 1848–1854.
31. Allman KC, Shaw LJ, Hachamovitch R et al. Myocardial viability testing and impact of revascularization on prognosis in patients with coronary artery disease and left ventricular dysfunction: a metaanalysis. J Am Coll Cardiol 2002; 39(7): 1151–1158.
32. Tarakji KG, Brunker R, McCarthy PM et al. Myocardial viability testing and the effect of early intervention in patients with advanced left ventricular systolic dysfunction. Circulation 2006; 113(2): 230–237.
33. Bax JJ, Schinkel AF, Boersma E et al. Extensive left ventricular remodeling does not allow viable myocardium to improve in left ventricular ejection fraction after revascularization and is associated with worse long-term prognosis. Circulation 2004; 110(11 Suppl 1): II18–22.
34. Schinkel AF, Poldermans D, Rizzello V et al. Why do patients with ischemic cardiomyopathy and a substantial amount of viable myocardium not always recover in function after revascularization? Thorac Cardiovasc Surg 2004; 127(2): 385–390.
35. Dor V, Saab M, Coste P et al. Left ventricular aneurysm: a new surgical approach. Thorac Cardiovasc Surg 1989; 37(1): 11–19.
36. Athanasuleas CI, Buckberg GD, Stanley AW et al. RESTORE group. Surgical ventricular restoration in the treatment of congestive heart failure due to post-infarction ventricular dilation. J Am Coll Cardiol 2004; 44(7): 1439–1445.
37. D’Egidio G, Nichol G, Williams KA et al.PARR-2 Investigators. Increasing benefit from revascularization is associated with increasing amounts of myocardial hibernation: a substudy of the PARR-2 trial. JACC Cardiovasc Imaging. 2009; 2(9): 1060–1068.
38. Cleland JGF, Calvert M, Freemantle N et al. The heart failure revascularisation trial (HEART). Eur J Heart Fail 2011; 13(2): 227–233.
39. Velazquez EJ, Lee KL, Deja MA et al. STICH Investigators. Coronary-artery bypass surgery in patients with left ventricular dysfunction. N Engl J Med 2011; 364(17): 1607–1616.
40. Doenst T, Cleland JG, Rouleau JL et al. STICH Investigators. Influence of crossover on mortality in a randomized study of revascularization in patients with systolic heart failure and coronary artery disease. Circ Heart Fail 2013; 6(3): 443–450.
41. Pron G. Coronary revascularization in ischemic heart failure patients: a rapid review. Toronto. Health Quality Ontario 2013. Dostupné z WWW: <http://www.hqontario.ca/Portals/0/documents/eds/rapid-reviews/coronary-revascularization-130121-en.pdf>.
42. Jones RH, Velazquez EJ, Michler RE et al. for the STICH Hypothesis 2 Investigators. Coronary bypass surgery with or without surgical ventricular reconstruction. N Engl J Med 2009; 360(17): 1705–1717.
43. Shroyer ALW, Collins JF, Grover FL. Evaluating clinical applicability. J Am Coll Cardiol 2010; 56(6): 508–509.
44. Bonow RO, Maurer G, Lee KL et al. for the STICH Trial Investigators. Myocardial viability and survival in ischemic left ventricular dysfunction. N Engl J Med 2011; 364(17): 1617–1625.
45. Chareonthaitawee P, Gersh BJ, Panza JA. Is Viability Imaging Still Relevant in 2012? JACC Cardiovasc Imaging 2012; 5(5): 550–558.
46. McMurray JJV, Adamopoulos S, Anker SD et al. ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure 2012. The Task Force for the Diagnosis and Treatment of Acute and Chronic Heart Failure 2012 of the European Society of Cardiology. Eur Heart J 2012; 33(14): 1787–1847.
47. Montalescot G, Sechtem U, Achenbach S et al. 2013 ESC guidelines on the management of stable coronary artery disease. The Task Force on the management of stable coronary artery disease of the European Society of Cardiology. Eur Heart J 2013; 34(38): 2949–3003.
Labels
Diabetology Endocrinology Internal medicineArticle was published in
Forum Diabetologicum

2015 Issue 1
-
All articles in this issue
-
Koronárna choroba srdca a diabetes mellitus 2. typu.
Pohľad kardiológa – editorial - Diabetes mellitus a ochorenia srdca. Nové paradigmy? – editorial
- Klinická diagnostika stabilnej koronárnej choroby srdca
- Koronárna choroba srdca a ženy
- Význam ambulantného monitorovania krvného tlaku a ambulantného monitorovania EKG u pacientov s koronárnou chorobou srdca
- Diabetes mellitus a arytmie
- Akútny koronárny syndróm a diabetes mellitus z pohľadu invazívneho kardiológa
- Revaskularizácia pri srdcovom zlyhávaní a diabetes mellitus
- Diabetes, hypertenzia a dyslipidémia – smrtiace trio
- Kardiometabolické riziká obezity
- Diétne zmeny a cvičenie v prevencii koronárnej choroby srdca u pacientov s diabetes mellitus 2. typu
- Diabetes, kardiovaskulárne choroby a mikrocirkulácia
-
Koronárna choroba srdca a diabetes mellitus 2. typu.
- Forum Diabetologicum
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Klinická diagnostika stabilnej koronárnej choroby srdca
- Význam ambulantného monitorovania krvného tlaku a ambulantného monitorovania EKG u pacientov s koronárnou chorobou srdca
- Koronárna choroba srdca a ženy
- Diabetes mellitus a arytmie
