Klinická diagnostika stabilnej koronárnej choroby srdca
The clinical diagnosis of stable coronary artery disease
Chronic (stable) forms have an important role in diagnosis of coronary artery disease (CAD) in outpatients or hospitalized patients at departments of internal medicine/cardiology. Stable angina pectoris is one of the most common diagnosed cardiac conditions. Early detection of symptomatology in coronary disease accelerates the correct and complete diagnosis and initiation of treatment.
Diagnostic and differential diagnostic approach is focused on: (1) confirmation of the diagnosis of myocardial ischemia in patients with suspected coronary artery disease, (2) identify or rule out co-morbidities and accelerating factors, (3) stratification of global cardiovascular risk, (4) evaluation of efficacy of treatment in confirmed CAD.
Decision algorithm in patients with suspected stable coronary disease is carried out in three steps. Step 1 is to determine the pretest probability of the presence of CAD. In patients with moderate pre-test probability is performed step 2: non-invasive functional testing for diagnosis of stable coronary artery disease, including non-obstructive forms. Step 3 in patients with moderate pre-test probability consists of pretest risk stratification for the available non-invasive examination and execution of functional stress test(s) and therapeutic procedure is set according to the result.
Article focuses on interpretation and informative value of functional testing in diagnosis of chronic CAD: assessment of pretest probability of CAD and post-test scoring by Duke Treadmill Score. Completion of the non-invasive diagnosis of chronic CAD is followed by determination of prognosis of CAD. This is the basis for the application of lege artis (correct, according to evidence-based medicine) decision algorithm of subsequent therapy: (1) non-interventional (non-pharmacological and pharmacological and/or (2) interventional (percutaneous or cardiac revascularization).
Key words:
angina pectoris – coronary artery disease – myocardial perfusion stress testing – risk stratification of events
Authors:
Slavomíra Filipová
Authors‘ workplace:
Klinika kardiológie a angiológie, LF SZU, NÚSCH, a. s., Bratislava, prednosta prof. MUDr. Róbert Hatala, CSc.
Published in:
Forum Diab 2015; 4(1): 22-32
Category:
Topic
Overview
V diagnostike koronárnej choroby srdca (KCHS) majú chronické (stabilné) formy významné miesto v ambulantnej a nemocničnej internistickej/kardiologickej praxi. Stabilná angína pektoris predstavuje jeden z najčastejších diagnostikovaných kardiologických stavov. Včasné rozpoznanie symptomatológie KCHS urýchli korektnú kompletnú diagnostiku a začatie liečby.
Diagnostický a diferenciálne diagnostický postup je zameraný na: (1) potvrdenie diagnózy ischémie myokardu u pacientov so suspektnou KCHS, (2) identifikovanie alebo vylúčenie komorbidít a urýchľujúcich faktorov, (3) stratifikovanie globálneho KV rizika, (4) zhodnotenie účinnosti liečby už diagnosticky potvrdenej KCHS.
Rozhodovací algoritmus u pacientov s podozrením na stabilnú KCHS sa realizuje v 3 krokoch. Krok 1 je určenie PTP (PTP) prítomnosti KCHS. U pacientov so strednou predtestovou pravdepodobnosťou sa zrealizuje krok 2: neinvazívne funkčné testovanie na určenie diagnózy stabilnej KCHS, vrátane neobštrukčných foriem. Krok 3 sa skladá u pacientov so strednou PTP z predtestovej rizikovej stratifikácie podľa dostupných neinvazívnych vyšetrení a zrealizovania funkčného záťažového testu (testov) a liečebný postup podľa výsledku.
Práca sa bližšie venuje interpretácii a výpovednosti funkčného testovania v diagnostike chronickej KCHS: posúdeniu predtestovej pravdepodobnosti prítomnosti KCHS a potestovému skórovaniu podľa Duke Treadmill Score. Po ukončení neinvazívnej diagnostiky chronickej KCHS nasleduje určenie prognózy KCHS. To je podkladom pre uplatnenie lege artis (správneho, podľa medicíny založenej na dôkazoch) rozhodovacieho algoritmu následnej terapie: (1) neintervenčnej (nefarmakologickej a farmakologickej a/alebo (2) intervenčnej (perkutánnej, alebo kardiochirurgickej revaskularizácie).
Kľúčové slová:
angína pektoris – koronárna choroba srdca – stratifikácia rizika príhod – záťažové testovanie ischémie myokardu
Úvod
Z kardiovaskulárnych (KV) ochorení predstavuje koronárna choroba srdca (KCHS) najčastejšiu chorobu. Chronická, stabilná forma KCHS, sa prevažne manifestuje ako stabilná, námahová angína pektoris (SAP). Má viac ako 50% prevalenciu zo všetkých prípadov KCHS [1,2]. SAP je charakterizovaná ako epizódy bolesti na hrudníku na podklade nedostatočného krvného zásobenia myokardu pri postihnutí koronárnych artérií (najčastejšie aterosklerotickom). Bezprostrednou príčinou je reverzibilná nerovnováha medzi požiadavkou myokardu a aktuálnym zásobovaním myokardu kyslíkom a živinami. Dôsledkom toho vznikne prechodná ischémia alebo hypoxia myokardiálneho tkaniva. Tento stav vzniká zvyčajne počas telesnej námahy, silnej emócie alebo iného stresu a je reprodukovateľný. Môže vzniknúť aj spontánne. Takéto epizódy ischémie/hypoxie sú frekventne sprevádzané subjektívnym pocitom diskomfortu až bolesti na hrudníku (angína pektoris). Stabilná KCHS zahŕňa často aj asymptomatické epizódy (t. j. bez hrudného diskomfortu/bolesti). Bolesti na hrudníku sa vyskytujú aj počas akútneho koronárneho syndrómu [3]. Patofyziologicky prechod medzi stabilnými a nestabilnými syndrómami KCHS je kontinuálny, bez jasnej hranice. Angína pektoris v pokoji spôsobená koronárnym vazospazmom z tohto pohľadu už nie je stabilnou, a už patrí bližšie do akútneho koronárneho syndrómu (AKS) [3–5]. Diferenciálne diagnosticky bolesť na hrudníku môžu spôsobovať aj iné príčiny (ochorenia iných systémov), ktoré je žiaduce oddiferencovať od bolestí ischemického kardiálneho pôvodu [6] (tab. 1).
![Diferenciálna diagnostika bolestí na hrudníku. Upravené podľa [6]](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/4f62c649d9d057ad8e5a5e9d9c4ca6d0.png)
Typy stabilnej KCHS
Stabilná KCHS sa môže prejavovať klinicky rôzne. Zapríčiňujú ju tieto hlavné mechanizmy: (1) obštrukcia epikardiálne prebiehajúcej koronárnej artérie spôsobená aterosklerotickým plátom, (2) ložiskový alebo difúzny spazmus normálnych alebo ateroskleroticky zmenených koronárnych artérií, (3) mikrovaskulárna dysfunkcia, (4) dysfunkcia ľavej komory spôsobená predchádzajúcou akútnou nekrózou myokardu alebo hibernáciou (ischemická kardiomyopatia) [3,7] (tab. 2).
Stabilná angína pektoris (AP) má vyššiu prevalenciu u žien v strednom veku, pravdepodobne na základe častejšieho výskytu funkčnej KCHS a mikrovaskulárnej formy AP. Vo vyššom veku má stabilná AP vyššiu prevalenciu u mužov [3]. Epidemiologické údaje o mikrovaskulárnej AP a vazospastickej AP chýbajú. Aktuálne klinické znalosti však poukazujú na to, že abnormálna koronárna vazomotorika sa vyskytuje u dvoch tretín pacientov, ktorí trpia stabilnou AP, ale nemajú koronarograficky žiadne stenózy na koronárnych artériách [8].
![Hlavné znaky stabilnej koronárnej choroby srdca. Upravené podľa [3]](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/491b11a855c6231a5325939e00b02d6c.png)
Priebeh ochorenia a prognóza
Prvými prejavmi KCHS u mnohých pacientov sú endotelová dysfunkcia a mikrovaskulárne ochorenie. Oba tieto stavy sú spojené so zvýšeným rizikom komplikácií pre KCHS [9,10]. Napriek vysokej prevalencii ochorenia je prognóza pacientov so stabilnou KCHS relatívne priaznivá. Predpokladaná ročná mortalita na SAP je 1,2–2,4 %, s ročnou incidenciou kardiálnej smrti 0,6–1,4 % a nefatálneho infarktu myokardu (IM) medzi 0,6 až 2,7 %. Tieto dáta sú v zhode s observačnými registrami stabilnej AP [11,12]. Horšiu prognózu majú pacienti vo vyššom veku, so závažnejšou anginóznou bolesťou na hrudníku, so zníženou systolickou funkciou ľavej komory (EFĽK), so signifikantnými depresiami segmentu ST, s celkovo nižšou funkčnou kapacitou, so srdcovým zlyhávaním (SZ), s prítomnosťou viaccievneho postihnutia a s proximálnymi léziami koronárnych tepien v koronarografickom náleze [3].
Štandardné rizikové faktory vývoja KCHS, ako sú hypertenzia, hypercholesterolémia, diabetes mellitus, fajčenie, obezita, sedavý štýl života, pozitívna rodinná anamnéza, majú negatívny vplyv na prognózu už diagnostikovaného ochorenia. Vysvetľuje sa to vplyvom uvedených rizikových faktorov na progresiu aterosklerotického procesu. Ich eliminácia a vhodná liečba môže toto riziko znížiť [13–15].
Diagnostika a stratifikácia chronických foriem KCHS
Diagnóza a posúdenie KCHS obsahuje klinické zhodnotenie, vrátane identifikovania klasických rizikových faktorov a ďalších biochemických rizikových parametrov, ďalej špecifické kardiologické vyšetrenia, ako sú záťažové testovanie (ZT) a koronárne zobrazovacie postupy.
Tieto vyšetrenia sú zamerané na:
- potvrdenie diagnózy ischémie myokardu u pacientov so suspektnou KCHS
- identifikovanie alebo vylúčenie komorbidít a urýchľujúcich faktorov
- pomoc pri stratifikovaní KV rizika
- zhodnotenie účinnosti liečby už diagnostikovanej KCHS
- diagnostické a prognostické postupy sa v praxi dejú skôr simultánne ako oddelene.
Veľa vyšetrení slúži súčasne na diagnostické účely aj na posúdenie prognózy.
Symptómy a príznaky
Dobre vedená anamnéza u väčšiny pacientov umožní vysloviť veľmi pravdepodobnú diagnózu prítomnosti/absencie stabilnej KCHS.
Fyzikálne vyšetrenie a objektívne testovanie sú ale nevyhnutné k potvrdeniu diagnózy, na vylúčenie stavov, ktoré imitujú angínu pektoris, na odhalenie rizikových faktorov aterosklerózy, diagnostikovanie komorbidít a na určenie závažnosti už diagnostikovaného prebiehajúceho ochorenia. Na posúdenie závažnosti stabilnej AP sa používa celosvetovo klasifikácia Kanadskej kardiologickej spoločnosti (Canadian Cardiovascular Society, CCS), tab. 3.
![Klasifikácia závažnosti angíny pektoris podľa Kanadskej kardiologickej spoločnosti (CCS).
Upravené podľa [3]](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/6d79da155a328701b25e0bf13744b961.png)
Pacienti s bolesťou na hrudníku sa vo všeobecnej medicínskej praxi vyskytujú veľmi často. Na ich odhalenie si môžno pomôcť aj dobre prevereným postupom predikcie angíny pektoris použitím pravidla 5 parametrov (1 bod za každý):
- vek a pohlavie (muži ≥ 55 rokov, ženy ≥ 65 rokov)
- diagnostikované vaskulárne ochorenie
- pacient si myslí, že bolesť je srdcového pôvodu
- bolesť sa zhoršuje pri telesnej námahe
- bolesť nie je reprodukovateľná palpáciou hrudníka
Tento postup vedie k vylúčeniu KCHS so špecificitou 81% (≤ 2 body) a senzitivitou 87% (3–4 body) [16]. Toto pravidlo je možné použiť aj pre ďalšie klinické informácie, ako je prítomnosť kašľa alebo bodavej bolesti – tie robia diagnózu KCHS menej pravdepodobnou. Naopak, ak je prítomné vyžarovanie bolesti do ľavého ramena, ak je známe srdcové zlyhávanie a diabetes mellitus, tak je diagnóza KCHS viac pravdepodobná [16].
Pri suspektnej AP počas fyzikálneho vyšetrenia sa odporúča zamerať na prítomnosť anémie, artériovej hypertenzie, arytmií, chlopňového ochorenia srdca a hypertrofickej obštrukčnej kardiomyopatie. Je potrebné poznať index telesnej hmotnosti (BMI) a pátrať po nekoronárnych cievnych ochoreniach, ktoré môžu byť asymptomatické (palpácia periférnych artérií, auskultácia karotických a femorálnych artérií, určenie indexu členok rameno, ankle brachial index – ABI). Je potrebné cielene pátrať po príznakoch komorbidít – ochorenia štítnej žľazy, renálne ochorenie, diabetes mellitus.
Neinvazívne vyšetrovacie metodiky
Ak použijeme optimálne kombináciu neinvazívnych diagnostických postupov, môžeme pomerne úspešne rozhodnúť správnou stratifikáciou o správnom ďalšom manažmente pacienta s bolesťou na hrudníku, t. j. ako nasmerovať ďalší diagnostický a terapeutický postup (potrebu invazívneho vyšetrenia koronárnych artérií, rozhodnutie o medikamentóznej terapii). Manažment je závislý na významnosti symptómov, na rizikovom profile a preferenciách pacienta.
Základné vyšetrenia obsahujú:
- štandardné laboratórne biochemické a hematologické vyšetrenia (sérový kreatinín, lipidový profil, hormóny štítnej žľazy, glykémia, p. p. orálny glukózotolerančný test, ionogram, základné hepatálne funkcie, vyšetrenie sérovej kreatinkinázy pri užívaní statínov, základný krvný obraz, základné hemokolagulačné vyšetrenie)
- v prípade podozrenia na akútny koronárny syndróm: troponín, s preferovaním vysokoselektívnych metodík na vylúčenie myokardiálnej nekrózy
- pokojové 12-zvodové EKG pre iniciálnu diagnostiku KCHS (u všetkých pacientov), ak máme u pacienta možnosť zaznamenať EKG počas AP, tak sa odporúča registrovať EKG pri bolesti a neodkladne po epizóde bolesti (po spontánnom ústupe, resp. po podaní nitroglycerínu sublingválne) s cieľom diagnostiky suspektnej nestabilnej KCHS
- echokardiografické vyšetrenie na vylúčenie alternatívnych príčin AP, na zistenie regionálnych porúch kinetiky, hypertrofie stien komôr, zistenie ejekčnej frakcie ľavej komory (EFĽK), určenie diastolickej funkcie ľavej komory
- ultrasonografické vyšetrenie periférnych artérií (karotických artérií a vyšetrenie intimomediálneho indexu (IMT) pri podozrení na KCHS bez známej aterosklerotickej choroby)
- RTG hrudníka pre iniciálnu diagnostiku KCHS (u pacientov s atypickými bolesťami na hrudníku, pri podozrení na ochorenie pľúc a pleury, pri podozrení na srdcové zlyhávanie)
- ambulantné 24-hodinové EKG monitorovanie sa odporúča pre iniciálnu diagnostiku KCHS, ďalej u pacientov s KCHS s podozrením na arytmie a vazospastickú AP
Tri hlavné kroky v rozhodovacom algoritme u pacientov s podozrením na stabilnú KCHS
Krok 1 – určenie predtestovej pravdepodobnosti (PTP) (tab. 4). U pacientov so strednou predtestovou pravdepodobnosťou urobíme krok 2 – neinvazívne funkčné testovanie na určenie diagnózy stabilnej KCHS, vrátane neobštrukčných foriem.
![Klinická predtestová pravdepodobnosť (PTP) vyjadrená v % u pacientov s príznakmi stabilnej angíny
pektoris. Upravené podľa [3,16,17]](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/6c2a1079e338dc5032214a4c0d289ddc.png)
PTP – predtestová pravdepodobnosť SPECT – single photon emission computed tompgraphy MRI – magnetická rezonancia PET – pozitrónová emisná tomografia CTA – výpočtová tomografická angiografia
Ak majú pacienti PTP < 15 %, možno funkčné testovanie odložiť pre veľmi nízku pravdepodobnosť, že sa jedná o KCHS, ale zrealizujeme stratifikáciu podľa SCORE systému.
Krok 3 sa skladá u pacientov so strednou PTP (15–85 %) z rizikovej stratifikácie podľa dostupných neinvazívnych vyšetrení a zrealizovania funkčného záťažového testu a ďalší postup podľa výsledku.
U pacientov s významnými symptómami a veľmi vysokou PTP (> 85 %) je indikovaná včasná selektívna koronarografia bez vykonania predchádzajúceho funkčného záťažového testu a ďalšie riešenie podľa invazívneho nálezu na koronárnych artériách. U týchto pacientov je teda adekvátnym postupom obídenie krokov 2 a 3 neinvazívneho testovania, aby sa urýchlila konečná diagnostika [3,17].
Princípy diagnostického testovania
Neinvazívne diagnostické zobrazovacie metódy na detekciu stabilnej KCHS majú svoju senzitivitu a špecificitu na úrovni medzi 45–85 %. (tab. 5) Minimálne 15 % všetkých diagnostických výsledkov je falošných. Dôsledkom toho bude realizácia neinvazívneho testovania nevýpovedná u pacientov s nízkou predtestovou pravdepodobnosťou (< 15 %), nakoľko týchto pacientov považujeme za zdravých v zmysle chronickej formy KCHS.
![Charakteristiky klinických testov, používaných na diagnostiku prítomnosti KCHS. Upravené podľa [3]](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/54d01dd75f036a40b03b63ef3ce688e1.png)
Naopak, pacienti s PTP > 85 % sú klinicky považovaní všetci za chorých s veľmi vysokou pravdepodobnosťou, preto ich neinvazívne testovanie nezvýši viac presnosť diferenciálne diagnostického postupu, len spôsobí zdržanie v diagnostike a terapii. Sú indikovaní na stratifikáciu rizika KV príhod, najmä ak nie sú pod dostatočnou kontrolou symptómov medikamentóznou terapiou. Títo pacienti majú byť zrýchlene indikovaní na selektívnu koronarografiu. Ak nízky stupeň záťaže vyvolá u pacientov závažnú AP, tento klinický stav potvrdzuje vysoké riziko koronárnej príhody a pacient má byť nasmerovaný priamo na selektívnu koronarografiu a intervenciu podľa jej výsledku frakcionovanej prietokovej rezervy (fractional flow reserve – FFR).
Záťažový ergometrický test (ZET) v diagnostike ischémie myokardu
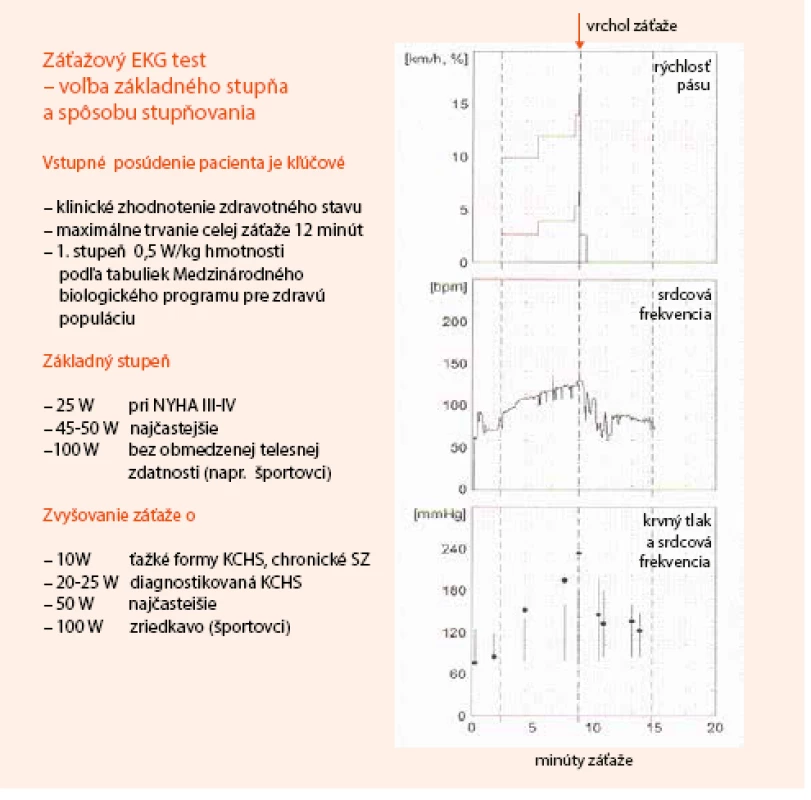
Neinvazívne testovanie pomocou bicyklového alebo behátkového záťažového testu (ZET) s monitoringom 12-zvodového EKG je rozšírená a jednoducho dostupná metodika. Zostáva preto ako užitočná a najviac využívaná metóda v diagnostike pacientov so suspektnou stabilnou KCHS, ktorí majú PTP 15–85 % a sú schopní absolvovať test. Metodický prehľad o voľbe typu záťaže a jej stupňovania je uvedený na obr. 1.
Hlavnými diagnostickými abnormalitami, ktoré sú sledované počas ZET, sú horizontálne alebo descendentné depresie segmentu ST ≥ 0,1 mV, pretrvávajúce v 0, 06–0,08 s po bode J v jednom a viac diagnostických EKG zvodoch. Asi u 15 % testovaných pacientov sa diagnostické zmeny na segmente ST objavia až vo fáze reštitúcie. ZET podáva dodatočné informácie tiež o reakcii srdcovej frekvencie a krvného tlaku na fyzickú záťaž, o provokovaní symptómov (stenokardie, dýchavica, hypertenzia, hypotenzia, klaudikačné bolesti a podobne) a informácie o telesnej zdatnosti. Všetky tieto údaje majú diagnostickú a prognostickú hodnotu.
ZET má viacero klinických a technických obmedzení a kontraindikácií. Ak z viacerých dôvodov nie je schopný pacient absolvovať klasický ZET, sú k dispozícii alternatívne neinvazívne testy s použitím farmák. U pacientov, ktorí sú adekvátne selektovaní, je možnosťou neinvazívna technika na určenie koronárnej anatómie – CT koronárna angiografia. Táto metóda sa neodporúča ako skríningová u asymptomatických pacientov bez klinickej pravdepodobnosti KCHS.
Základnými indikáciami na ZET sú:
- iniciálne vyšetrenie pre určenie diagnózy stabilnej KCHS – t. j. stanovenie prítomnosti/neprítomnosti znakov ischémie u pacientov s normálnym pokojovým EKG a strednou PTP pre KCHS, bez prítomnosti antiischemickej liečby
- u pacientov s už diagnostikovanou KCHS
- a. ako metóda na posúdenie účinnosti liečby (farmakologickej aj intervenčnej)
- b. ako metóda na odhalenie reziduálnej ischémie (nedostatočná farmakologická terapia, neúplná revaskularizácia, progresia ochorenia)
Stratifikácia rizika a určenie prognózy KCHS na základe výsledku ZET
Definícia a výpočet rizika sú závislé od metodiky testovania (ZET, iné zobrazovacie metódy, CT koronarografia) (tab. 6).
![Definícia rizika v závislosti na metóde testovania. Upravené podľa [3]](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/fd8faf77377b12a1d88837f9b92720e7.png)
Z výsledkov klasického elektrokardiografického ZET sa kalkuluje úroveň rizika (pravdepodobná ročná mortalita) ako číslo skóre podľa tzv. Duke Treadmill Score (DTS).
Aktuálne sa používa elektronické modifikované Duke Treadmill Score (eDTS) unifikované ako pre bicyklovú, tak aj pre behátkovú (treadmill) ergometriu. Toto skóre je upravené z pôvodného originálneho vzorca DTS [18]. Výpočet eDTS je možné urobiť kalkulátorom cez webovskú adresu (http://www. cardiology. org/tools/medcalc/duke), spravovanú centrálnym laboratóriom Stanford University v Kalifornii (USA).
Do kalkulátora je potrebné zadať :
- a) hodnotu depresie segment ST v mm
- b) dosiahnutú hodnotu záťaže v MET
- c) údaj o vzniku stenokardie počas záťaže (0, 1, 2), kde 0 = žiadna bolesť, 1 = stenokardia , 2 = limitujúca stenokardia, pre ktorú bol test zastavený)
Do eDTS sa neudáva hodnota celkovej tolerovanej dĺžky záťaže v minútach, aby sa eliminoval vplyv rôznych používaných protokolov bicyklového a behátkového ZET. Výsledkom z elektronického kalkulátora je hodnota skóre aj priamo percento 1-ročného rizika KV mortality.
Ročná mortalita podľa DTS > 3 % je definovaná ako vysoké riziko. U týchto pacientov je predpoklad, že neodkladná revaskularizácia bude mať priaznivý efekt na zlepšenie prognózy. Nízke riziko predstavujú pacienti s pravdepodobnosťou 1-ročnej mortality < 1 %. V strednom riziku sú pacienti s predpokladanou ročnou mortalitou ≥ 1 % ale ≤ 3 %.
Originálne DTS [18] sa zakladá na výpočte z dát získaných záťažovým testom na behátku nasledovne:
DTS = TRVANIE ZÁŤAŽE [min] – (DEPRESIA ST × 5) [mm] – (ANGIÓZNY INDEX × 5)
anginózny index:
0 = bez vzniku AP počas záťaže
1 = prítomná záťažovou vyprovokovaná AP
2 = záťažový test bol prerušený pre AP (limitujúca AP)
nízke riziko podľa pôvodného DTS má hodnotu ≥ 5 a znamená 1-ročnú mortalitu 0,25 %
stredné riziko s hodnotami DTS medzi +4 až -10 znamená 1-ročnú mortalitu 1,25 %
vysoké riziko s hodnotami DTS < -10 predstavuje pravdepodobnú 1-ročnú mortalitu až 5,0 %
Obidva typy výpočtu produkujú pre bežné klinické použitie prakticky identické výsledky.
Riziková stratifikácia na základe zhodnotenia funkcie ľavej komory
Najsilnejším prediktorom dlhodobého prežívania je funkcia ľavej komory. Ak u pacientov so stabilnou KCHS klesá ejekčná frakcia ľavej komory (EFĽK), mortalita stúpa. V štúdii CASS (Coronary Artery Surgery Study) 12-ročné prežívanie u pacientov s EFĽK ≥ 50 % bolo 73 %, pri EFĽK 35–49 % to bolo 54 %. Pri EFĽK < 35 % kleslo prežívanie na 21 % (p < 0,0001) [19].
Ak má pacient EFĽK < 50 %, jeho riziko KV úmrtia je vysoké (ročná mortalita > 3 %) aj bez toho, aby mal ďalšie rizikové faktory. Pri redukcii EFĽK sa významne zvyšuje riziko KV príhod, aj keď sa neodhalí ischémia spôsobená obliteráciou koronárnych artérií. Tu je užitočné namiesto klasického EKG záťažového testu použiť alternatívne zobrazovacie metódy (tab. 5, tab. 6). Aj keď pacienti s normálnym EKG majú vysokú pravdepodobnosť, že majú zachovanú systolickú funkciu ľavej komory, pri asymptomatickej komorovej dysfunkcii nie je zriedkavé, že pacient má normálny nález na koronárnych artériách a má negatívnu anamnézu prekonaného infarktu myokardu. Pokojové echokardiografické vyšetrenie má preto význam u všetkých pacientov so suspektnou KCHS [20]. Echokardiografické vyšetrenie v tomto kontexte má priznanú triedu odporúčaní I.
Riziková stratifikácia na základe znalostí koronárnej anatómie
Počet koronánych artérií postihnutých neobštrukčným aterosklerotickým procesom má prognostickú signifikantnosť pre všetky 3 hlavné koronárne tepny, ak sú vizualizované pomocou CT koronárnej angiografie (CTA). Sú spojené so zvýšenou mortalitou v porovnaní s jedincami bez detekovaných atersklerotických plakov [21]. Aktuálna užitočnosť CTA pre stratifikáciu rizika, okrem signifikantných koronárnych stenóz, je v súčasnoti neistá.
Selektívna koronarografia (SKG) je významou metódou na identifikovanie závažnosti obštrukcie koronárneho lumenu a lokalizáciu KCHS. Predstavuje preto dôležitý prognostický indikátor u pacientov s angínou pektoris. SKG sa jednoznačne odporúča u pacientov so stabilnou AP CCS III, u pacientov s vysokým rizikom KV príhody podľa klinického profilu, najmä ak sú symptomatickí a nereagujú dostatočne na medikamentóznu liečbu. SKG je potrebné vykonať aj u pacientov s miernymi alebo žiadnymi symptómami AP, ak sú pomocou neinvazívnej stratifikácie vyhodnotení ako vysoko rizikoví. Revaskularizácia pacientov so stabilnou AP z týchto skupín zlepšuje ich prognózu [19,22].
Závery k rizikovej stratifikácii
Riziková stratifikácia má teda pyramídovú štruktúru, postupuje nasledovne:
- riziková stratifikácia podľa klinického zhodnotenia
- riziková stratifikácia podľa funkcie ľavej komory (najčastejšie echokardiograficky)
- riziková stratifikácia na základe funkčného testovania (najčastejšie na základe štandardného EKG-ZET a dobutamínovej echokardiografie)
- riziková stratifikácia podľa koronárnej anatómie (SKG a CTA – obe metódy u selektovaných podskupín pacientov)
Komplexné klinické výsledky predstavujú dôležitý prognostický faktor a spolu s predtestovou pravdepodobnosťou a neinvazívnym vyšetrením ischémie/anatómie sa využívajú v rozhodovacom procese určenia prognózy (schéma).
![Schéma. Manažment na základe určenia rizika a prognózy u pacientov s bolesťami na hrudníku a podozrením na KCHS. Upravené podľa [3]](https://pl-master.mdcdn.cz/media/image/0d0b4a61375c99d23d47f9598572a7f8.png?version=1537792283)
Najsilnejším prediktorom dlhodobého prežívania je systolická funkcia ľavej komory. Pacienti s EFĽK < 50 % predstavujú skupinu s vysokým rizikom (ročná mortalita > 3 %). U pacientov s vysokým rizikom určeným na základe neinvazívnej diagnostiky, ktorí tolerujú symptómy, je SKG a revaskularizácia prínosom. Pacienti s vysokou PTP by nemali podstupovať záťažové vyšetrovacie postupy z dôvodu vysokého rizika vzniku KV príhod. (schéma)
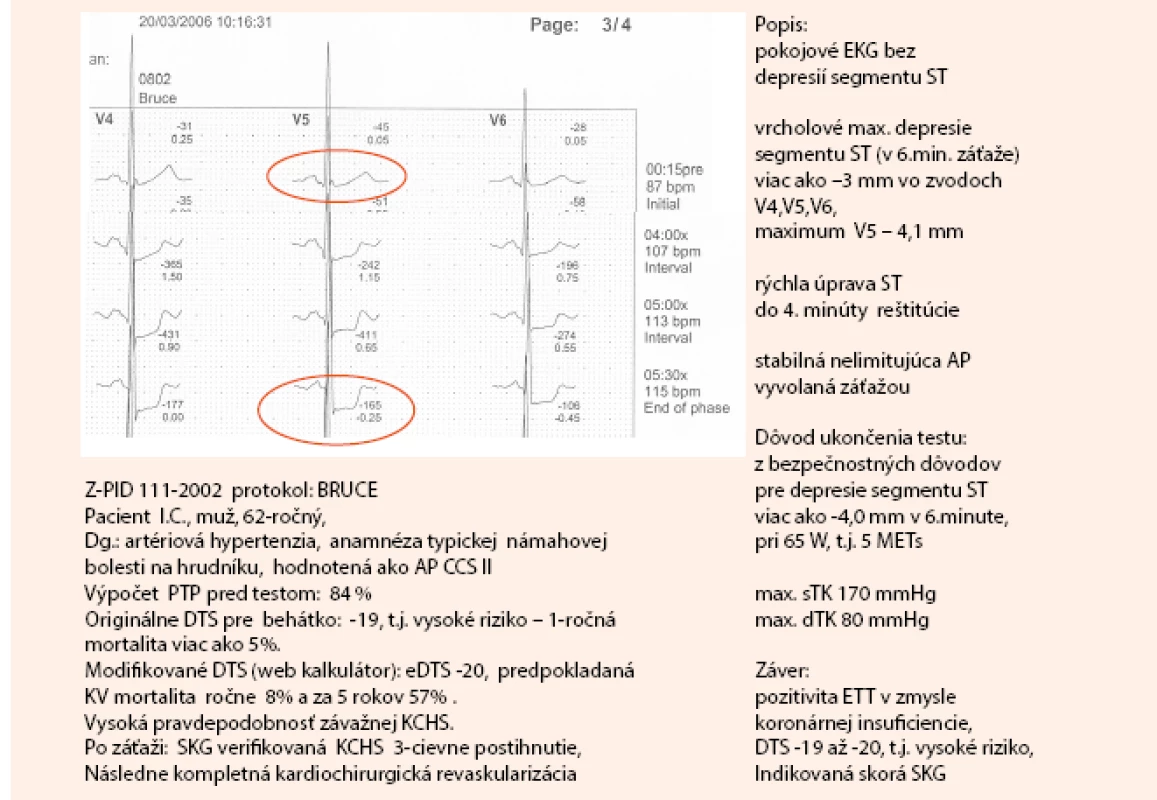
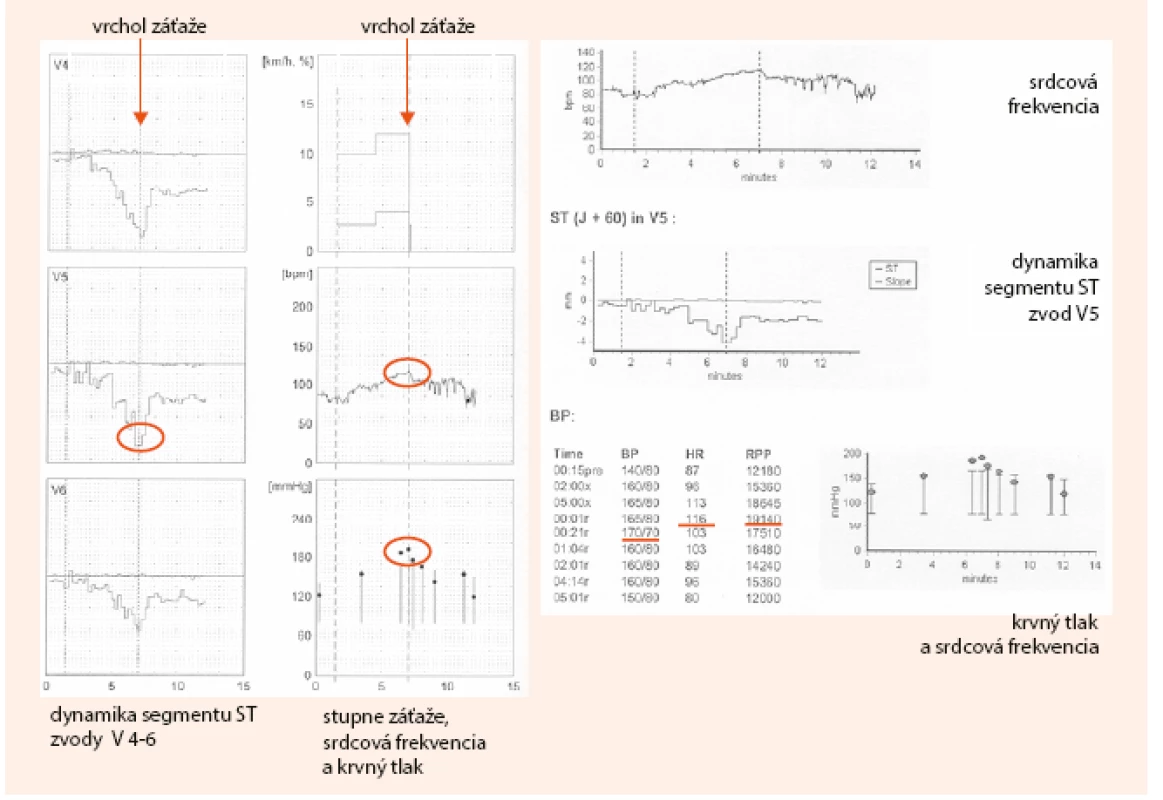
Na obr. 2 a obr. 3 uvádzam kazuistiku diagnostického postupu pomocou klasického záťažového EKG testu, vrátane výpočtov PTP a DTS.
Poznámky k diabetes mellitus vo vzťahu ku KCHS
Diabetes mellitus (DM) predstavuje silný rizikový faktor KV komplikácií. Zvyšuje riziko progresie KCHS. DM by mal byť liečený dôsledne, s dobrou kontrolou glykovaného hemoglobínu (HbA1c) do 7,0 % (53 mmol/mol) celkovo, a na 6,5–6,9 % (48–52 mmol/mol) podľa indivduálneho zhodnotenia pacienta.
Mortalita spôsobená KV ochoreniami je u diabetikov mužov 3-krát vyššia a u diabetických žien 3 až 5-krát vyššia oproti nediabetikom. Preto v rámci prevencie KV komplikácií u diabetikov sa odporúčajú prísnejšie kritériá za účelom kontroly rizikových faktorov a komorbidít. DM aj porucha glukózovej tolerancie sú spojené s horšou prognózou pacientov s akútnymi formami KCHS aj so stabilnou AP [23].
Vysoká prevalencia významnej KCHS a vysoká KV mortalita u diabetikov by mohla byť dôvodom požiadavky rutínneho skríningu KCHS aj na asymptomatických diabetických pacientov. Nemáme však dôkazy o klinickom benefite takéhoto postupu. Stratégia koronárnej revaskularizácie u diabetikov je stále výzvou. Rozhodovanie o tom, či je vhodné preferovať perkutánnu alebo chirurgickú koronárnu intervenciu, sa zakladá na posúdení anatomických pomerov a klinických faktorov. Perkutánna intervencia sa odporúča u diabetikov s jednocievnym postihnutím. U diabetických pacientov s viaccievnym postihnutím sa na základe výsledkov klinických štúdií odporúča kardiochirurgická intervencia po diskusii celého kardiologického tímu [24].
Hospitalizačná a dlhodobá mortalita diabetikov po infarkte myokardu síce klesá, ale napriek tomu celková prognóza diabetických pacientov s KCHS zostáva stále zlá. Dôvody nie sú dostatočne objasnené. Uvedený status sa vysvetľuje najmä vysokou prevalenciou komplikácií v kombinácii s nedostatkom znalostí o liečbe na úrovni medicíny dôkazov [25].
Záver
Napriek tomu že chronické formy KCHS majú relatívne dobrú krátkodobú aj dlhodobú prognózu v porovnaní s akútnymi koronárnymi syndrómami, fakt, že majú vysokú prevalenciu, spôsobuje, že sú frekventným objektom kardiologickej diagnostiky a diferenciálnej diagnostiky. Hranica medzi stabilnými a nestabilnými formami KCHS nie je často diagnosticky ostrá, frekventne stabilná AP kontinuálne prechádza do nestabilnej, t. j. akútnej formy. Samotná diagnostika stabilných foriem, najmä tých s atypickou symptomatológiou, je relatívne častým zdrojom diagnostických chýb alebo opozdení. Atypické symptómy KCHS totiž imitujú ochorenia iných systémov. Ich nedostatočné alebo nesprávne zhodnotenie a posúdenie stability a akútnosti môže viesť až k fatálnym omylom.
Starnutím populácie narastá nielen prevalencia stabilnej KCHS, ale tiež výskyt koronárnych pacientov so závažnými komorbiditami. To komplikuje diagnostiku aj liečbu. Samotné diagnostické algoritmy chronickej KCHS sa v ostatných rokoch významne aktualizovali. Všetky tieto fakty boli podnetom k napísaniu príspevku o základoch diagnostiky chronických foriem KCHS s adresovaním najmä lekárom nekardiológom, ktorí prakticky denne prichádzajú s nimi do kontaktu.
Doručené do redakcie 2. 2. 2015
Prijaté do tlače po recenzii 9. 2. 2015
doc. MUDr. Slavomíra Filipová, CSc. , FESC
filipova@nusch.sk
Klinika kardiológie a angiológie, LF Slovenskej zdravotníckej univerzity a Národný ústav srdcových a cievnych chorôb, Bratislava
www.nusch.sk, www.szu.sk
Sources
1. Allender S, Sharbotough P, Peto V et al. European Cardiovascular Disease Statistics 2008 Edition. British Heart Foundation: London 2008. Dostupné z WWW: <http://www.herzstiftung.ch/uploads/media/European_cardiovascular_disease_statistics_2008.pdf>.
2. Abrams J. Clinical practice. Chronic stable angina. Engl J Med. 2005; 352(24): 2524–2533.
3. Montalescot G, Sechtem U, Achenbach S et al. 2013 ESC guidelines on the management of stable coronary artery disease. The Task Force on the management of stable coronary artery disease of the European Society of Cardiology. Eur Heart J 2013; 34(38): 2949–3003.
4. Greenland P, Alpert JS, Beller GA et al. 2010 ACCF/AHA guideline for assessment of cardiovascular risk in asymptomatic adults: a report of the American College of Cardiolo-gy Foundation/American Heart Association Task Force on Practice Guidelines. J Am Coll Cardiol 2010; 56(25): e50–e103. Dostupné z DOI: <http://doi: 10.1016/j.jacc.2010.09.001>.
5. Fox K, Garcia MA, Ardissino D et al. Guidelines on the management of stable angina pectoris: executive summary: The Task Force on the Management of Stable Angina Pectoris of the European Society of Cardiology. Eur Heart J 2006; 27(11): 1341–1381.
6. Staněk V, Bultas V, Škvařilová M et al. Chronická ischemická choroba srdeční. In: Aschermann M (ed). Kardiologie. Galén: Praha 2004 : 596–649. ISBN 8072622900.
7. Filipová S, Hatala R, Dukát A, Fridrich V et al. Komentár expertnej skupiny Slovenskej kardiologickej spoločnosti pre manažment stabilnej angíny pektoris k Súhrnu odporúčaní Európskej kardiologickej spoločnosti pre manažment stabilnej angíny pektoris. Cardiol 2007; 16(2): 104–108.
8. Ong P, Athanasiadis A, Borgulya G et al. High prevalence of a pathological response to acetylcholine testing in patients with stable angina pectoris and unobstructed coronary arteries. The ACOVA Study (Abnormal COronary VAsomotion in patients with stable angina and unobstructed coronary arteries). J Am Coll Cardiol 2012; 59(7): 655–662.
9. Gulati M, Cooper-DeHoff RM, McClure C et al. Adverse cardiovascular outcomes in women with nonobstructive coronary artery disease: a report from the Women’s Ische-mia Syndrome Evaluation Study and the St James Women Take Heart Project. Arch Intern Med 2009; 169(9): 843–850.
10. Jespersen L, Hvelplund A, Abildstrom SZ et al. Stable angina pectoris with no obstructive coronary artery disease is associated with increased risks of major adverse cardiovascular events. Eur Heart J 2012; 33(6): 734–744.
11. Daly CA, De Stavola B, Sendon JL et al. Predicting prognosis in stable angina: results from the Euro heart survey of stable angina: prospective observational study. BMJ 2006; 332(7536): 262–267.
12. Morbidity & Mortality: 2012 Chart Book on Cardiovascular, Lung, and Blood Diseases. National Heart, Lung, and Blood Institute: 2012. Dostupné z WWW: <https://www.nhlbi.nih.gov/files/docs/research/2012_ChartBook_508.pdf>.
13. Kronmal RA, McClelland RL, Detrano R et al. Risk factors for the progression of coronary artery calcification in asymptomatic subjects: results from the Multi-Ethnic Study of Atherosclerosis (MESA). Circulation 2007; 115(21): 2722–2730.
14. Pekkanen J, Linn S, Heiss G, et al. Ten-year mortality from cardiovascular disease in relation to cholesterol level among men with and without preexisting cardiovascular disease. N Eng J Med 1990; 322(24): 1700–1707.
15. Bayturan O, Tuzcu EM, Uno K et al. Comparison of rates of progression of coronary atherosclerosis in patients with diabetes mellitus versus those with the metabolic syndrome. Am J Cardiol 2010; 105(12): 1735–1739.
16. Boesner S, Haasenritter J, Becker A et al. Ruling out coronary artery disease in primary care: development and validation of a simple prediction rule. CMAJ 2010; 182(12): 1295–1300.
17. Genders TS, Steyerberg EW, Alkadhi H et al. A clinical prediction rule for the diagnosis of coronary artery disease: validation, updating, and extension. Eur Heart J 2011; 32(11): 1316–1330.
18. Gibbons RJ, Balady GJ, Beasley JW et al. ACC/AHA 2002 guideline update for exercise testing: summary article. A report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (Committee to Update the 1997 Exercise Testing Guidelines). J Am Coll Cardiol 2002; 40(8): 1531–1540.
19. Emond M, Mock MB, Davis KB et al. Long-term survival of medically treated patients in the Coronary Artery Surgery Study (CASS) Registry. Circulation 1994; 90(6): 2645–2657.
20. Raymond I, Pedersen F, Steensgaard-Hansen F et al. Prevalence of impaired left ventricular systolic function and heart failure in a middle aged and elderly urban population segment of Copenhagen. Heart 2003; 89(12): 1422–1429.
21. Ostrom MP, Gopal A, Ahmadi N et al. Mortality incidence and the severity of coronary atherosclerosis assessed by computed tomography angiography. J Am Coll Cardiol 2008; 52(16): 1335–1343.
22. Califf RM, Armstrong PW, Carver JR et al. 27th Bethesda Conference: matching the in-tensity of risk factor management with the hazard for coronary disease events. Task Force 5. Stratification of patients into high, medium and low risk subgroups for purposes of risk factor management. J Am Coll Cardiol 1996; 27(5): 1007–1019.
23. Bartnik M, Ryden L, Ferrari R et al. The prevalence of abnormal glucose regulation in patients with coronary artery disease across Europe. The Euro Heart Survey on diabetes and the heart. Eur Heart J 2004; 25(21): 1880–1890.
24. Ryden L, Grant PJ, Anker SD et al. ESC Guidelines on diabetes, pre-diabetes, and cardiovascular diseases developed in collaboration with the EASD: the Task Force on diabetes, pre-diabetes, and cardiovascular diseases of the European Society of Cardiology (ESC) and developed in collaboration with the European Association for the Study of Diabetes (EASD. )Eur Heart J 2013; 34(39): 3035–3087.
25. Lenzen M, Ryden L, Ohrvik J et al. Diabetes known or newly detected, but not impaired glucose regulation, has a negative influence on 1-year outcome in patients with coronary artery disease: a report from the Euro Heart Survey on diabetes and the heart. Eur Heart J 2006; 27(24): 2969–2974.
Labels
Diabetology Endocrinology Internal medicineArticle was published in
Forum Diabetologicum

2015 Issue 1
-
All articles in this issue
-
Koronárna choroba srdca a diabetes mellitus 2. typu.
Pohľad kardiológa – editorial - Diabetes mellitus a ochorenia srdca. Nové paradigmy? – editorial
- Klinická diagnostika stabilnej koronárnej choroby srdca
- Koronárna choroba srdca a ženy
- Význam ambulantného monitorovania krvného tlaku a ambulantného monitorovania EKG u pacientov s koronárnou chorobou srdca
- Diabetes mellitus a arytmie
- Akútny koronárny syndróm a diabetes mellitus z pohľadu invazívneho kardiológa
- Revaskularizácia pri srdcovom zlyhávaní a diabetes mellitus
- Diabetes, hypertenzia a dyslipidémia – smrtiace trio
- Kardiometabolické riziká obezity
- Diétne zmeny a cvičenie v prevencii koronárnej choroby srdca u pacientov s diabetes mellitus 2. typu
- Diabetes, kardiovaskulárne choroby a mikrocirkulácia
-
Koronárna choroba srdca a diabetes mellitus 2. typu.
- Forum Diabetologicum
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Klinická diagnostika stabilnej koronárnej choroby srdca
- Význam ambulantného monitorovania krvného tlaku a ambulantného monitorovania EKG u pacientov s koronárnou chorobou srdca
- Koronárna choroba srdca a ženy
- Diabetes mellitus a arytmie
