Konsenzuálny terapeutický algoritmus pre diabetes mellitus 2. typu (v súlade s SPC, aktuálnym znením indikačných obmedzení a odporúčaní ADA/EASD)
Consensual therapeutic algorithm for type 2 diabetes mellitus (in accordance with SPC, ADA/EASD indicative limitations and recommendations )
Type 2 diabetes mellitus is a heterogeneous medical condition involving multiple pathophysiological mechanisms. Its successful treatment requires an individualized approach and frequently combined therapy with utilizing its effect on multiple levels. Current possibilities enable the employment of such procedures to an incomparably greater extent than before. The effects of different classes of oral antidiabetic drugs on the reduction of glycemia and HbA 1c is mutually comparable. However differences are observed in the proportions of patients who met the required criteria, regarding the increase in weight, incidence of hypoglycemia as well as the effect on cardiovascular, renal or oncologic morbidity and mortality, and severity of specific adverse effects, potential risks and contraindications. The presented text provides the reader with the information about the Consensual therapeutic algorithm for the treatment of type 2 diabetes mellitus in compliance with SPC, the ADA/EASD amended indicative limitations and recommendations, formulated by the Committee of the Slovak Diabetes Society.
Key words:
agonisty GLP-1 receptor agonists – biguanides – gliflozins – gliptins – glitazones – insulin – sulfonylurea
:
Emil Martinka 1; Vladimír Uličiansky 2; Marián Mokáň 3; Ivan Tkáč 4; Peter Galajda 3; Zbynek Schroner 5*
:
Národný endokrinologický a diabetologický ústav n. o. v Ľubochni
1; Via medica, s. r. o., Košice
2; I. interná klinika Jesseniovej LF UK a UNM, Martin
3; IV. interna klinika UN L. Pasteura Košice a LF UPJŠ v Košiciach
4; SchronerMED, s. r. o., interná a diabetologická ambulancia, Košice
5
:
Forum Diab 2016; 5(2): 99-108
:
Guidelines
*v spolupráci členov výboru Slovenskej diabetologickej spoločnosti
Diabetes mellitus 2. typu je heterogénne ochorenie s účasťou viacerých patofyziologických mechanizmov. Jeho úspešná liečba vyžaduje individualizovaný prístup a obvykle kombinovanú terapiu s využitím účinku na viacerých úrovniach. Súčasné možnosti umožňujú v neporovnateľne väčšej miere využívať takéto postupy. Efekt jednotlivých skupín orálnych antidiabetík na zníženie glykémie a HbA1c je porovnateľný. Rozdiely sú však v podiele pacientov, ktorí dosiahli požadované kritériá, v prírastku na hmotnosti, vo výskyte hypoglykémií, ako aj vo vplyve na kardiovaskulárnu, renálnu či onkologickú morbiditu a mortalitu, a v závažnosti špecifických nežiadúcich účinkov, potenciálnych rizikách a v kontraindikáciách. Predkladaný text zoznamuje čitateľov s Konsenzuálnym terapeutickým algoritmom pre liečbu diabetes mellitus 2. typu v súlade s SPC, aktuálnym znením indikačných obmedzení a odporúčaní ADA/EASD formulovaným výborom Slovenskej diabetologickej spoločnosti.
Kľúčové slová:
agonisty GLP1-receptorov – biguanidy – gliflozíny – gliptíny – glitazóny – inzulín – sulfonylurea
Úvod
Diabetes mellitus 2. typu (DM2T) je heterogénne ochorenie s účasťou viacerých patofyziologických mechanizmov. Rovnako jeho úspešná liečba vyžaduje individualizovaný prístup a obvykle kombinovanú liečbu s využitím účinku na viacerých úrovniach. Súčasné možnosti nám takýto prístup umožňujú v neporovnateľne väčšej miere než tomu bolo pred 15–20 rokmi (schéma 1).

Efekt jednotlivých skupín orálnych antidiabetík (OAD) na zníženie glykémie a HbA1c je porovnateľný. Rozdiely sú však v podiele pacientov, ktorí dosiahli požadované kritériá, v prírastku na hmotnosti, vo výskyte hypoglykémií, ako aj vo vplyve na kardiovaskulárnu (KV), renálnu či onkologickú morbiditu a mortalitu, a v závažnosti špecifických nežiadúcich účinkov, potenciálnych rizikách a v kontraindikáciách [10].
Zásadnou problematikou, ktorej sa v súčasnosti venuje najviac pozornosti, je otázka KV-rizika, resp. KV-prínosu jednotlivých skupín a účinných látok OAD. Dôvodom je skutočnosť, že KV-ochorenia sú u pacientov s DM2T hlavnou príčinou morbidity a mortality [20]. Napriek tomu, hodnotenie významu antidiabetickej liečby v otázkach KV-prínosu je často rozpačité a v súčasnosti je (paradoxne) hlavnou požiadavkou FDA a EMA, aby antidiabetický liek nepredstavoval zvýšené KV-riziko.
Výsledky jednotlivých štúdií, ktoré sa venovali KV-problematike u pacientov s DM2T je potrebné vnímať v súvislosti niekoľkých rovín. Do úvahy treba brať jednak skutočnosť, akí pacienti boli predmetom skúšania (t. j. či sa jednalo o pacientov s novozisteným diabetom bez komplikácií alebo sa jednalo už o pacientov s pokročilým ochorením a rozvinutými KV-komplikáciami). Potrebné je tiež zohľadniť formuláciu problému, ktorý bol sledovaný (t. j. či cieľom bola primárna/sekundárna prevencia KV-príhod, alebo mortalitné dôsledky KV-príhod), a tiež ako bol definovaný primárny ukazovateľ, t. j. či bol efekt liečby na jednotlivé zložky kompozitného cieľa homogénny alebo naopak heterogénny. Napokon, je tiež dôležité zohľadniť obdobie, v ktorom skúšanie prebiehalo (s ohľadom na vtedajšie možnosti liečby) a aké bolo pozadie využitia iných liekov so známym prínosom na KV-morbiditu a mortalitu, ako sú statíny či ACE-inhibítory. Aj z tohto rozboru vyplýva, že efekt jednotlivých farmák nie je možné generalizovať na celú skupinu pacientov s DM2T a vo všetkých fázach ochorenia, rovnako ako nie je možné generalizovať mieru KV-rizika. DM2T sa totiž často uniformne považuje za akýsi ekvivalent KV-ochorenia. Je však známe, že KV-riziko je rozdielne a závisí od viacerých faktorov [3]. Z toho vyplýva, že ani terapeutický prístup nie je možné generalizovať a vždy by mal byť individualizovaný s ohľadom na prínosy a riziká u konkrétneho pacienta. Tieto rozdiely zohľadňujú všetky terapeutické odporúčania vrátane aktuálneho terapeutického odporúčania Slovenskej diabetologickej spoločnosti (SDS).
Aktuálne spektrum farmák využívané v antidiabetickej liečbe a ich miesto v terapeutických schémach
Biguanidy
Metformín je zatiaľ zatiaľ jediné antidiabetikum s dôkazom makrovaskulárneho prínosu, primárnej prevencie infarktu myokardu ako aj redukcie úmrtia z akejkoľvek príčiny, ak sa podáva vo včasnom štádiu DM2T [8,10,24]. Z tohto dôvodu metformín zostáva aj naďalej preferovanou liečbou prvej voľby vo všetkých referenčných a zrejme aj národných terapeutických odporúčaniach [10]. Nie je však známe, či takýto efekt metformín dosahuje aj v pokročilejších štádiách u komplikovaných pacientov. Napriek tomu však metformín aj s ohľadom na ďalšie potenciálne prínosy zatiaľ zostáva trvalou súčasťou terapeutickej schémy aj v neskorších štádiách ochorenia. Kardiovaskulárny efekt metformínu pravdepodobne nesúvisí (iba) s vplyvom na glykémiu, krvný tlak či lipidy, ale uplatňuje sa zrejme aj celý rad iných účinkov. Metformín potláča hepatálnu produkciu glukózy a zlepšuje citlivosť periférnych tkanív na inzulín. Stimuláciou sekrécie a expresie génu pre proglukagón zvyšuje hladinu GLP1. Stimuluje sekréciu adiponektínu, visfatínu a RBP4. Prejavuje aj priaznivý efekt na lipidy LDL-cholesterol (LDL-C), priaznivý vplyv na endotel, redukuje chronický adipogénny a vaskulárny subklinický zápal, potláča PAI1, PF4, βTGb a v niektorých prípadoch sa mu pripisuje aj antikarcinogénny efekt. Metformín zostáva liečbou prvej línie a trvalou súčasťou („kostrou“) liečby aj v aktuálnom odporúčaní SDS. V roku 2015 bola v SPC rozšírená možnosť jeho používania aj u pacientov s chronickým renálnym ochorením, a to až do glomerulárnej filtrácie 45 ml/min/1,73 m2 [10]. Podľa nedávneho prieskumu NEFRITI je metformín na Slovensku využívaný u cca 80 % pacientov s DM2T [13,14].
Prípravky na báze sulfonylurey
Sulfonylurea (SU) je jednou z najstarších a najobsiahlejších skupín orálnych antidiabetík (glibenklamid, glimepririd, gliklazid, glipizid). Spoločným menovateľom je stimulácia sekrécie inzulínu, relatívne silný efekt na pokles glykémií a HbA1c a nízka cena.
Prípravky SU majú potvrdený mikrovaskulárny prínos. Kardiovaskulárna bezpečnosť (benefit) je však sporná a väčšina analýz zdôrazňuje potenciálne zvýšené morbiditno-mortalitné riziko, a to nielen u pacientov s preexistujúcim KV-ochorením, resp. KV-príhodou, ale aj u pacientov bez predošlej KV-príhody. Nevýhodou je tiež pomerne vysoké riziko hypoglykémie a prírastok na hmotnosti. Hoci tieto faktory v súčasnej dobe vytláčajú prípravky SU zo všetkých pozícií terapeutických schém, prípravky SU boli v roku 2014 podľa prieskumu NEFRITI využívané až u 42 % pacientov s DM2T liečených OAD [13,14]. Výnimkou spomedzi SU-prípravkov v názoroch na ich terapeutickú hodnotu je gliklazid MR, ktorý je kardiovaskulárne neutrálny, má nízke riziko hypoglykémie (porovnateľné s gliptínmi), hmotnostne je prakticky neutrálny, prejavuje šetriaci efekt na B-bunky a má nefroprotektívny efekt (znižuje mikroalbuminúriu a spomaľuje progresiu chronického zlyhania obličiek (chronical kidney disease – CKD) do konečného štádia renálneho ochorenia, t. j. zlyhania obličiek (end-stage renal disease – ESRD). Tieto benefity gliklazidu MR boli potvrdené vo viacerých štúdiách zásadného významu [3,22,27]. Gliklazid MR sa z týchto dôvodov stal preferovaným prípravkom SU aj v aktuálnom odporúčaní SDS, podobne ako aj v odporúčaniach iných krajín.
Miesto prípravkou SU (s preferenciou gliklazidu MR) je v odporúčaniach SDS predovšetkým v kombinácii s metformínom a inými antidiabetikami vrátane inzulínu a tiež ako alternatíva iniciácie liečby DM2T pri intolerancii alebo kontraindikácii metformínu, alebo ako iniciálna liečba dvojkombináciou v kombinácii s metformínom u pacientov s HbA1c 8–9 % v čase diagnózy DM2T.
Gliptíny (inhibítory DPP4)
Hlavnou výhodou gliptínov (obzvlášť v porovnaní s bežnými prípravkami SU) je nízky výskyt hypoglykémie a hmotnostná neutralita. Vďaka duálnemu efektu na glykémiu (stimulácia inzulínu, supresia glukagónu) možno pri týchto liekoch očakávať síce mierny, ale spoľahlivý aditívny benefit pri všetkých terapeutických kombináciách vrátane kombinácie s inzulínom. Za ďalšie prínosy je možné považovať aditívny efekt na kardiovaskulárne rizikové faktory (redukcia krvného tlaku, úprava lipidov, chronický subklinický zápal, „recruitment“ kmeňových buniek v ischemickom myokarde a ďalšie). V klinickom kardiovaskulárnom morbiditno-mortalitnom benefite (hoci spočiatku v menších štúdiách naznačovanom) sa však zatiaľ takéto účinky neprejavili. Naopak, pri niektorých prípravkoch (saxagliptín a čiastočne alogliptín) sa vynorila obava z potenciálneho zvýšeného rizika srdcového zlyhávania, ak sa podáva pacientom s vysokým KV-rizikom [16]. Zrejme sa však nejedná o „class“ efekt, nakoľko pri iných prípravkoch (sitagliptín) sa takáto obava nepotvrdila [6] a pri ďalších (linagliptín) štúdie ešte prebiehajú. Inou zásadnou otázkou, ktorá vzišla z klinických štúdií a bola rôzne interpretovaná aj pri rôznych metaanalýzach, je pretrvávajúca obava zo zvýšeného rizika akútnej pankreatitídy, ktoré bolo potvrdené, a karcinómu pankreasu, ktoré nebolo potvrdené. Názorom SDS je odporúčanie toto riziko vnímať a zohľadňovať ho aj pri preskripcii a zvážiť vhodnosť liečby gliptínmi najmä u pacientov s už prekonanou pankreatitídou, resp. s prítomnými rizikovými faktormi pre jej vznik.
Gliptíny sú v súčasnej dobe aj v aktuálnych odporúčaniach SDS preferovaným výberom liečby do kombinácie s metformínom, do trojkombinácie, ako aj do kombinácie s inzulínom s alebo bez súčasnej liečby metformínom (vrátane pacientov s redukciou renálnych funkcií či pacientov po prekonaní cievnej mozgovej príhody). Takéto postavenie vyplýva aj zo znenia indikačných obmedzení. Indikačné obmedzenie je pomerne široké a napĺňa väčšinu medicínskych nárokov, zatiaľ však neumožňuje používať gliptíny v kombinácii s agonistami GLP1-receptorov, gliflozínmi ani glitazónmi. V prípade glitazónov je výnimkou možnosť použitia kombinovaného prípravku alogliptínu a pioglitazónu, ak liečbe predchádzala liečba pioglitazónom samostatne alebo v kombinácii s metformínom. Podľa prieskumu NEFRITI sa gliptíny v roku 2014 využívali u cca 20 % pacientov liečených OAD [13,14].
Agonisty GLP1-receptorov
Podstatou svojho účinku sú najviac príbuzné gliptínom. Ich účinok však nezávisí od hladiny a sekrécie vlastných inkretínov, nakoľko receptory pre GLP1 priamo stimulujú. Efekt na pokles glykémie je výraznejší, vedú k poklesu telesnej hmotnosti a výraznejší je aj efekt na pokles krvného tlaku. Zlepšujú profil krvných lipidov ako aj hodnoty zápalových parametrov a iných biomarkerov KV-rizika. V súčasnej dobe sa s napätím očakávajú výsledky prvých štúdií zameraných na zhodnotenie vplyvu agonistov GLP1-receptorov na KV-riziko, resp. benefit. Nedávno (medscape 4. 3. 2016) boli oznámené prvé správy referujúce o signifikantnom benefite liraglutidu na riziko kardiovaskulárnych príhod (KV-úmrtie, nefatálny infarkt myokardu, nefatálna mozgová príhoda) pochádzajúce z 5-ročnej štúdie LEADER na populácii viac ako 9 000 pacientov s vysokým KV-rizikom [11]. Liraglutid je tak prvým agonistom GLP1-receptorov a tretím, resp. štvrtým liekom (po metformíne, pioglitazóne a empagligflozíne) preukazujúcim KV-benefit. Rovnako však aj tu je potrebné zvažovať potenciálne riziká (riziko pankreatitídy a potenciálne onkologické riziká).
V aktuálnom terapeutickom odporúčaní zohľadňujúcom SPC a indikačné obmedzenia je možné agonisty GLP1-receptora využiť v dvojkombinácii s metformínom a do trojkombinácie s metformínom a sulfonylureou. Nedávno sa možnosť využitia agonistov GLP1-receptora rozšírila aj na kombináciu s bazálnym inzulínom. Pri hradenej liečbe však táto indikácia zatiaľ platí iba pre prípravok s fixnou kombináciou inzulínu degludek a liraglutid [9].
Využívanie agonistov GLP1-receptorov je na Slovensku veľmi nízke aj v porovnaní s okolitými krajinami. V roku 2014 sa využívali iba u 0,5 % pacientov [13,14], čo je 5-krát až 10-krát menej než v iných európskych krajinách.
Glitazóny (PPARγ-agonisty)
Glitazóny (tiazolidindióny) sú diskutovanou skupinou orálnych antidiabetík, ktoré sa po úvodnej obľube v posledných rokoch z klinickej praxe prakticky vytratili. Dôvodom boli nepriaznivé ukazovatele rizika KV-morbidity a mortality v metaanalýze výsledkov rosiglitazónu (štúdie DREAM, ADOPT a niekoľko menších štúdií) [16].
Na druhej strane viaceré analýzy štúdií s pioglitazónom [5] u vysokorizikových pacientov s DM2T poukázali na potenciálne KV-benefity (sekundárna prevencia infarktu myokardu – IM a akútneho koronárneho syndrómu u pacientov s predošlým IM, sekundárna prevencia cievnej mozgovej príhody – CMP u pacientov s predošlou CMP, redukcia mortality u pacientov na hemodialýze, redukcia prejavov zápalu pri nealkoholovej steatohepatitíde, redukcia rizika hepatocelulárneho karcinómu a ďalšie benefity), ktoré však zostávali v tieni podozrenia na zvýšené riziko karcinómu močového mechúra a zlomenín kostí. Podľa novších údajov sa však toto riziko nepotvrdilo a očakáva sa „rehabilitácia“ pioglitazónu [10]. Z hľadiska významu pre klinickú prax sa však tieto údaje musia najskôr premietnuť do textov SPC. V našom terapeutickom odporúčaní zostal poioglitazón stabilnou súčasťou terapeutickej schémy podobne ako v odporúčaniach ADA/EASD [10]. V súčasnosti ho však nepovažujeme za preferovaný terapeutický výber nakoľko bezpečnostné údaje zatiaľ neboli zohľadnené v SPC produktu. Pioglitazón sa považuje aj za preferovaný glitazón.
V roku 2014 na Slovensku pioglitazón užívalo cca 1,5 % pacientov s DM2T [13,14].
Gliflozíny (inhibítory SGLT2)
Pokles glykémie sa pri týchto liekoch dosahuje blokovaním spätnej reabsorpcie glukózy z primárneho moču v proximálnom tubule obličiek inhibíciou SGLT2 kotransportu. Dôležitým faktom je, že efekt je nezávislý od sekrécie inzulínu ako aj od citlivosti tkanív na inzulín. Z uvedeného dôvodu gliflozíny poskytujú spoľahlivý aditívny benefit na kontrolu glykémie nielen pri monoterapii, ale aj pri všetkých kombináciách vrátane kombinácie s inzulínom. Cennou vlastnosťou je tiež skutočnosť, že efekt na glykémiu sa dosahuje pri minimálnom riziku hypoglykémie a dochádza k redukcii zvýšenej telesnej hmotnosti. Vedú tiež k poklesu krvného tlaku bez vzostupu frekvencie srdca, poklesu triglyceridov, vzostupu HDL, poklesu kyseliny močovej a poklesu parametrov tuhosti ciev.
Podobne ako pri iných skupinách je aj pri gliflozínoch jednou z najvýznamnejších otázka KV-rizika/benefitu. V tejto súvislosti bolo nepochybne najvýznamnejším poznatkom v diabetológii v roku 2015 zistenie štúdie EMPA-REG OUTCOME, v ktorej bola skúšaná účinná látka empagliflozín na KV-bezpečnosť [26]. Výsledky tejto štúdie priniesli prekvapujúce a mimoriadne hodnotné výsledky. Empagliflozín u pacientov s vysokým KV - rizikom, ktorí už prekonali niektorú z KV-príhod, viedol k výraznej redukcii kardiovaskulárnej mortality (-38 %), čo znamená, že pri liečbe cca 1 000 pacientov sa zachráni 25 životov, alebo že sa predíde 1 z 3 KV-úmrtí [26]. Efekt súvisel najmä s benefitom na srdcové zlyhávanie, pričom empagliflozín znižoval potrebu hospitalizácie pre srdcové zlyhávanie až o 35 % a potrebu hospitalizácie alebo úmrtie z dôvodu srdcového zlyhávania až o 39 %. Význam týchto zistení podčiarkuje aj fakt, že benefity boli dosiahnuté v teréne už predošlej vyťaženej liečbe statínmi a ACE-inhibítormi, ktoré boli donedávna považované za jediné skupiny s jednoznačne dokázaným KV-benefitom. Naviac, efekt empagliflozínu vo vyjadrení počtu pacientov, ktorých je potrebné liečiť, aby sa predišlo jednému úmrtiu (number needed to treat – NNT), bol nižší než v prípade simvastatínu či ramprilu. Podľa najnovších správ, empagliflozín tiež prejavuje nefroprotektívny efekt. Redukuje albuminúriu a spomaľuje progresiu CKD do ESRD. Tieto zistenia favorizujú gliflozíny, konkrétne empagliflozín, práve v liečbe pacientov, ktorí už prekonali KV-príhodu s cieľom predísť jej mortalitnému dôsledku.
Pôvodná obava z významu urogenitálnych infekcií sa neukázala až takým klinickým problémom, ako sa pôvodne predpokladalo. Je však potrebné na túto komplikáciu myslieť. Opatrnosť pri liečbe gliflozínmi je však potrebná najmä u pacientov so sklonom k dehydratácii a jej následkov a u pacientov po CMP. Za kontraindikáciu sa zatiaľ (aj z dôvodu menšej účinnosti) považuje aj znížená funkcia obličiek (GFR < 60 ml/min/1,73 m2), pri ktorej sa zvyšuje aj riziko niektorých nežiadúcich účinkov. U niektorých pacientov bola popísaná tzv. euglykemická diabetická ketoacidóza. Jej výskyt súvisel pravdepodobne s nesprávnou indikáciou inhibítorov SGLT2 pacientom s diabetes mellitus 1. typu (DM1T), resp. nepoznaným DM1T, resp. s latentným autoimunitným diabetes mellitus (LADA). Za potenciálne spúšťacie mechanizmy sa považuje interkurentné ochorenie, dehydratácia, chirurgický zákrok, stres, znížený príjem potravy a tekutín, redukcia dávok inzulínu, nízka funkčná rezerva B-buniek zvýšené nároky na inzulín, požitie alkoholu [18].
Inzulín
Je u pacientov s DM2T veľmi častou liečbou. Cieľové hodnoty HbA1c sa dosahujú u väčšieho podielu pacientov v porovnaní s OAD a efekt je dlhodobý. Inzulín je možné použiť ako:
- iniciálnu liečbu DM2T (humánny inzulín pri HbA1c > 9 %, resp. klinických prejavoch hyperglykémie, resp. pri glykémiách > 14 mmol/l)
- do kombinácie s metformínom (preferenčne bazálny analóg)
- do kombinácie so všetkými skupinami orálnych antidiabetík pri predošlej monoterapii alebo dvojkombinácii OAD
- ako koncovú liečbu po zlyhaní liečby neinzulínovými antidiabetikami
Analógy inzulínu (bazálne aj prandiálne) majú výhodnejšie farmakokinetické vlastnosti, čo je aj dôvodom ich preferencie. Pri bazálnych analógoch sa tieto výhody v klinickej prejavujú v predlženom účinku, nižšom výskyte hypoglykémie (obzvlášť nočnej), nižšej variabilite účinku a vo vyššom podiele pacientov, ktorí dosiahli požadované kritériá liečby bez hypoglykémie, v nižšom prírastku na hmotnosti a väčšej flexibilite podávania. Tieto výhody sú zrejmé najmä pri inzulíne degludek a pri inzulíne glargin 300U [25].
Pre kombináciu inzulínu s gliflozínmi sa v indikačnom obmedzení zatiaľ vyžaduje súčasná liečba metformínom.
Najčastejším spôsobom iniciácie inzulínovej liečby po predošlej liečbe OAD je bazálny inzulín (preferenčne bazálne analógy glargin, detemir, degludek). Alternatívnym iniciálnym režimom pri HbA1c > 8,5 % je režim s bifázickým inzulínom. Intenzifikácia liečby bazálnym inzulínom bola donedávna možná iba pridaním prandiálneho inzulínu. Od 1. 6. 2016 bude možné využiť kombináciu bazálneho inzulínu s agonistom GLP1, zatiaľ však iba pomocou fixnej kombinácie inzulínu degludek a liraglutid [9].
Indikácie a možnosti liečby pomocou inzulínovej pumpy u pacientov s DM2T sú rovnaké ako u pacientov s DM1T.
Inzulín prejavuje antiinflamačný, antioxidačný aj endotelprotektívny efekt. Z hľadiska KV-rizika/benefitu je neutrálny a bezpečný je aj po stránke onkologického rizika [17]. Včasná liečba inzulínom u pacientov s novozisteným DM2T môže viesť k remísii ochorenia. Hlavnými nežiadúcimi účinkami je hypoglykémia a prírastok na hmotnosti. Diskutovanou témou je potenciálne zvýšené morbiditno-mortalitné riziko pri veľmi vysokých dávkach inzulínu [7].
Diabetes špecifické nutričné produkty
Diabetes špecifické nutričné produkty (DŠNP), alebo presnejšie nutričné produkty špecifické pre diabetes, sú súčasťou mnohých národných terapeutických odporúčaní pre liečbu diabetes mellitus. DŠNP sú terapeutické (nie roboračné) nutričné prípravky, ktoré boli vyvinuté s cieľom podpory liečby diabetes mellitus. Majú nízky glykemický index, čo sa dosahuje ich zložením, keď pri rovnakom kalorickom obsahu obsahujú nižší obsah sacharidov a vyšší obsah MUFA (mononenasýtené mastné kyseliny). Používajú sa ako ekvikalorická náhrada časti dennej potravy s cieľom redukcie postprandiálnej glykémie, glykemickej variability, poklesu HbA1c, redukcie výskytu hypoglykémií a redukcie telesnej hmotnosti. Pri liečbe dochádza tiež k poklesu tlaku krvi a úprave lipidov a zápalových parametrov [15].
Ostatné farmaká využívané v liečbe DM2T
Glinidy (repaglinid, nateglinid). Účinkom ako aj nežiaducimi účinkami sú podobné prípravkom sulfonylurey. Majú akcentovaný efekt na kontrolu postprandiálnej glykémie, avšak so zvýšeným rizikom hypoglykémie a prírastku na hmotnosti. Kým u pacientov bez predošlej KV-príhody sú z hľadiska KV-rizika neutrálne, u pacientov s už prekonanou KV-príhodou riziko skôr zvyšujú [10].
Inhibítory alfa-glukozidázy (akarbóza, miglitol). Znižujú vstrebávanie sacharidov v čreve. Majú akcentovaný efekt na postprandiálnu glykémiu. Výhodou je nízke riziko hypoglykémie, hmotnostná neutralita a potenciálny benefit v zmysle redukcie výskytu KV-príhod (STOP-NIDDM). Nevýhodou sú pomerne časté a výrazné gastrointestinálne nežiaduce účinky [10].
Bromokryptín je súčasťou liečby DM2T podľa odporúčania ADA/EASD ako aj Americkej asociácie klinických endokrinológov (AACE). FDA ho pre indikáciu v liečbe DM2T schválila v roku 2009. Bromokryptín pravdepodobne účinkuje prostredníctvom ovplyvnenia cirkadiánnej neuronálnej aktivity v hypotalame, čím ovplyvňuje hypotalamickú reguláciu metabolizmu. Zvyšuje dopaminergnú aktivitu, znižuje sympatikovú a serotoninergnú aktivitu. Potláča hepatálnu produkciu glukózy, zlepšuje citlivosť na inzulín znižuje hladiny volných mastných kyselín a triglyceridov. Prispieva k poklesu HbA1c o 0,4–0,8 % bez rizika hypoglykémie, vedie k poklesu telesnej hmotnosti. Medzi nežiaduce účinky patrí závrat, slabosť, nauzea, rinitída [1,10]. V súčasnosti nie je stabilnou súčasťou odporúčania SDS.
Kolesevelam je sekvestrant žlčových kyselín 2. generácie, ktorý prejavuje efekt tak na hladiny glykémie ako aj lipidov. Efekt na glykémiu sa vysvetľuje supresiou hepatálnej produkcie glukózy a vzostupom hladin inkretínov. Výhodou je, že nevedie k hypoglykémii a súčasne znižuje hladinu LDL-cholesterolu. Nevýhodou je relatívne malý efekt na HbA1c, zápcha a vzostup triglyceridov. Podobne ako bromokryptín je už aj súčasťou terapeutického algoritmu pre liečbu DM2T ADA/EASD ako ak AACE v kombinácii s metformínom, SU alebo inzulínom [1,10]. FDA ho pre indikáciu v liečbe DM2T schválila v roku 2008. Zatiaľ nie je stabilnou súčasťou odporúčania SDS.
Amylínové mimetiká. Pramlintid aktivuje amylínové receptory. Potláča sekréciu glukagónu. Amylínové mimetiká spomaľujú vyprázdňovanie žalúdka a zvyšujú pocit sýtosti. Znižujú postprandiálnu glykémiu a telesnú hmotnosť. Medzi nežiaduce účinky patrí nauzea a hypoglykémia [10]. Zatiaľ nie je sú stabilnou súčasťou odporúčania SDS.
Terapeutický algoritmus pre liečbu DM2T
Základné a trvalé požiadavky Edukácia pacienta, spolupráca pacienta, adekvátna fyzická aktivita, racionálna výživa, redukcia nadváhy/obezity, eliminácia stresu a fajčenia (schéma 2, s. 107).
Iniciálna monoterapia Za najvhodnejší výber iniciálnej liečby sa považuje metformín. Alternatívou pri kontraindikácii alebo intolerancii metfomínu je gliptín alebo sulfonylurea (preferenčne gliklazid MR). Za určitých okolností do úvahy ako iniciálna liečba pripadá aj humánny inzulín (vstupný HbA1c > 9%, glykémie > 14 mmol/l, resp. klinické prejavy hyperglykémie) alebo pioglitazón [1,10].
Dvojkombinácia Kombinácia dvoch druhov OAD sa obvykle využíva pri nedostatočnom účinku monoterapie. Pri vstupných hodnotách HbA1c 8–9 % v čase diagnózy DM2T je však možné dvojkombináciu použiť aj ako iniciálnu liečbu. Indikačné obmedzenie v takomto prípade umožňuje iba kombináciu metformínu so sulfonylureou (preferenčne gliklazidom MR).
Za výhodnú dvojkombináciu orálnych antidiabetík sa považuje kombinácia metfomínu s gliptínom alebo kombinácia metformínu so sulfonylureou. Vhodnou kombináciou sa javí tiež kombinácia metformínu s agonistom GLP1-receptorov. Alternatívnym riešením je kombinácia metfomínu s bazálnym inzulínom. Možná je tiež kombinácia metformínu s glitazónom. Kombináciu metformínu s gliflozínmi zatiaľ ako hradenú liečbu neumožňuje indikačné obmedzenie. Takúto liečbu je však možné použiť ako nehradenú liečbu [1,10].
Trojkombinácia orálnych antidiabetík alebo agonistu GLP1-receptora je v súčasnosti všeobecne akceptovaným postupom pri liečbe DM2T, obzvlášť ak sa využívajú lieky s účinkom na rôznych, resp. odlišných úrovniach. Za základný pilier sa aj v tomto prípade považuje metformín. Ako výhodné sa javia kombinácie metformínu so sulfonylureou a gliflozínom (obzvlášť u pacientov, ktorí už prekonali KV-príhodu, a u obéznych pacientov) a metformínu so sulfonylureou a gliptínom (obzvlášť u pacientov, u ktorých hypoglykémia predstavuje zvýšené morbiditno-mortalitné riziko, či u pacientov po CMP). V zmysle najnovších poznatkov štúdie LEADER sa ako výhodná javí aj kombinácia metformínu a sulfonylurey s agonistom GLP1-receptora [1,10].
Liečba inzulínom v kombinácii s OAD alebo bez nich (schéma 3, s. 106) je obvykle konečným štádiom liečby a predstavuje liečbu využiteľnú aj v prípade kontraindikácie (hepatopatia, nefropatia) či intolerancia OAD. Liečba sa obvykle začína bazálnym inzulínom a kombinuje sa s OAD (obvykle metformín alebo gliptín alebo metformín a gliflozín, alebo metformín a sulfonylurea). Pri intenzifikácii sa k liečbe pridáva prandiálny inzulín alebo agonista GLP1-receptora [10]. Indikačné obmedzenie zatiaľ umožňuje iba fixnú kombináciu degludeku a liraglutidu.

Zásady pri rozhodovaní o výbere lieku a jeho preskripcii
Keďže základnou požiadavkou a súčasne pomerne častým problémom je správna klasifikácia DM, je potrebné v klinicky nejednoznačných prípadoch využívať dostupné markery pre oddiferencovanie DM1T, ako je hladina C-peptidu a autoprotilátky proti antigénovým štruktúram B-buniek pankresu. Nesprávna klasifikácia môže viesť k zásadným omylom pri výbere zvolenej liečby, napríklad nevhodné použitie gliflozínov u pacientov s DM1T alebo s diabetom typu LADA s následným potenciálnym rizikom euglykemickej diabetickej ketoacidózy [18]. Pri indikácii (výbere) jednotlivých prípravkov lekár postupuje na základe svojej klinickej úvahy. Odporúča sa zohľadniť charakteristiky riešeného pacienta a ciele liečby, ktoré sa chcú u konkrétneho pacienta dosiahnuť. S ohľadom na pacienta sa zohľadňuje najmä vek, pohlavie, trvanie diabetu, spolupráca, predošlá liečba, výskyt nežiaducich účinkov, výskyt hypoglykémie, prírastok na hmotnosti, prítomnosť komorbidít, prekonané kardiovaskulárne ochorenia, funkcie obličiek, pečene, celkový stav pacienta, sociálno-ekonomické postavenie a pod. Terapeutický cieľ zohľadňuje nielen HbA1c, ale aj jednotlivé glykémie (pred jedlami a po nich) a ich variabilitu [1,10]. Vo všeobecnosti, u mladších pacientov na začiatku ochorenia, resp. s krátkym trvaním ochorenia (< 5–10 rokov) sa volia prísnejšie kritériá (HbA1c < 7 %, resp. < 6,5 %). Naopak, u starších polymorbidných pacientov s dlhším trvaním ochorenia (> 15–20 rokov), sú kritériá obvykle voľnejšie (HbA1c 7,5–8,0 %). Intenzifikáciu liečby limituje a kritériá zvoľňuje najmä výskyt hypoglykémií, zlá spolupráca, či vysoké KV-riziko.
Intenzívna glykemická kontrola znižuje riziko mikrovaskulárnych komplikácií u všetkých typov diabetu bez ohľadu na trvanie ochorenia a prítomnosť komplikácií [2,3,8,23]. Okrem toho, intenzívna glykemická kontrola, pokiaľ bola začatá v úvode ochorenia, z dlhodobého hľadiska prispieva k primárnej prevencii KV-príhod [8] a k sekundárnej prevencii nefatálneho IM aj u pacientov s vysokým KV-rizikom [2]. U týchto pacientov sa však súčasne zvyšuje riziko fatálneho a nefatálneho srdcového zlyhávania a kardiovaskulárna mortalita [2]. Vysvetlenie tejto asociácie nie je celkom jasné a nedá sa jednoznačne vysvetliť ani vyšším výskytom hypoglykémií v intenzívne liečenej skupine pacientov [4].
Kardiovaskulárny benefit, ktorý sa pri niektorých farmakách prejavil či už v primárnej prevencii KV-príhod (metformín) alebo mortalitných dôsledkoch už prekonaného KV-ochorenia (empagliflozín) ani v jednej z nich nesúvisel priamo s efektom na úpravu glykémie samotnej, ale ani s efektom na krvný tlak, telesnú hmotnosť či lipidy. Vynára sa preto otázka ďalších faktorov, ktoré sa podieľajú na reziduálnom riziku napriek vyťaženej hypolipidemickej a antihypertenznej liečbe, alebo ktoré ovplyvňujú funkciu, resp. metabolizmus myokardu postihnutého KV-ochorením. Z praktického hľadiska tieto štúdie naznačujú význam intenzívnej glykemickej kontroly a preferenčný iniciálny výber metformínu u pacientov na začiatku ochorenia a bez komplikácií, zatiaľ čo pri pacientoch komplikovaných už prekonaným KV-ochorením by mala byť glykemická kontrola striedmejšia so zakomponovaním gliflozínu (zatiaľ najmä empagliflozínu) s ohľadom na kontraindikácie. Miesto agonistov GLP1-receptorov v prevencii KV-ochorení a ich dôsledkov bude zrejmé po oficiálnom zverejnení výsledkov štúdie LEADER a javí sa ako ďalšia reálna nádej. Využitie gliptínu a inzulínu je z hľadiska KV-morbidity a mortality skôr neutrálne zatiaľ čo vhodnosť použitia prípravkov na báze sulfonylurey (s výnimkou gliklazidu MR) je z hľadiska prevencie KV-príhod ako aj ich mortalitných dôsledkov skôr diskutabilná [22].
Jednou zo zásadných požiadaviek je minimalizácia rizika hypoglykémie, a to najmä z hľadiska bezpečnosti a spolupráce pacienta. U pacientov so zvýšeným rizikom hypoglykémie sa preferuje liečba farmakami s nízkym rizikom tohto nežiadúceho účinku (gliptíny, gliflozíny, glitazóny, gliklazid MR, inzulín degludek, inzulín glargin 300U) [25]. Obdobnou požiadavkou je minimalizácia prírastku na hmotnosti. Prítomnosť nadváhy a obezity preferuje hmotnostne neutrálne farmaká (gliptíny, gliflozíny, agonisty GLP1-receptora). U pacientov s poruchou renálnych funkcií sa uprednostňuje inzulín a gliptíny (obzvlášť linagliptin, tab. Konečné rozhodnutie výberu liečby je však vždy individuálne a musí zohľadňovať najmä kontraindikácie.
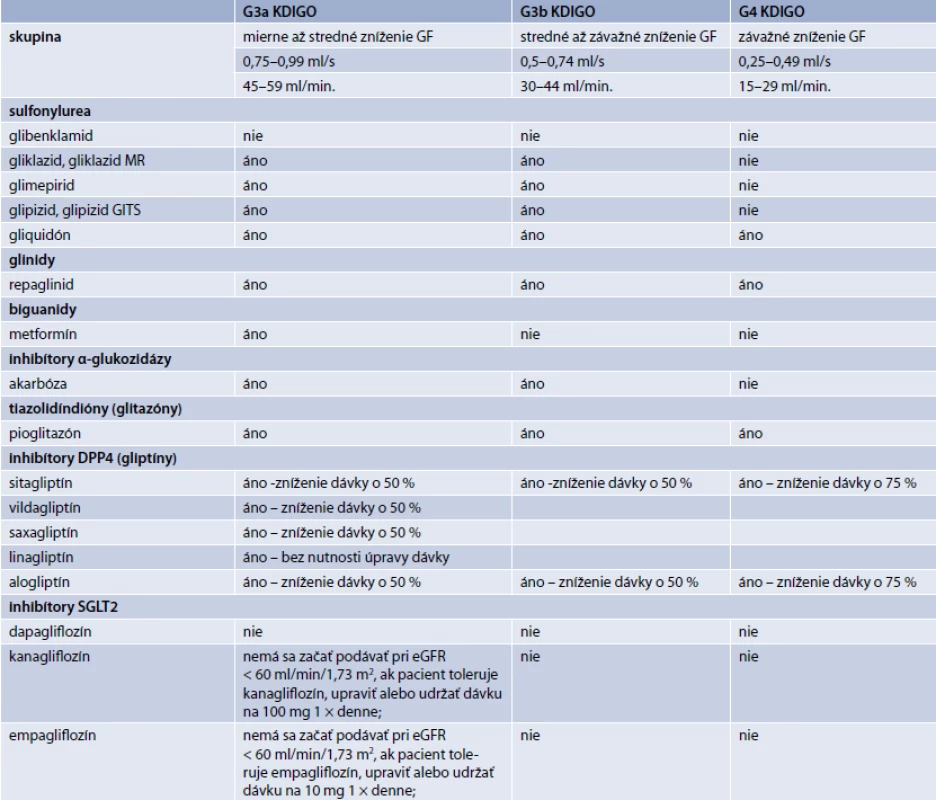
Efektivitu liečby je potrebné pravidelne kontrolovať (obvykle v 3–6mesačných intervaloch). Podobne aj intervaly medzi jednotlivými rozhodovacími procesmi akcentácie alebo zmeny liečby by nemali presiahnuť 3 mesiace, maximálne však 6 mesiacov. Indikačné obmedzenie v niektorých prípadoch vyžaduje interval 6 mesiacov (schéma 2, s. 107). Predmetom kontroly efektivity glykemickej kontroly by okrem HbA1c mali byť preprandiálne glykémie, postprandiálne glykémie, glykemická variabilita aj výskyt hypoglykémií. Z hľadiska glykemickej kontroly je samozrejmosťou aj pravidelná kontrola telesnej hmotnosti, hepatálnych a renálnych parametrov, potenciálnych prejavov kontraindikácií, intolerancie a nežiadúcich účinkov liečby. Vhodnosť použitia jednotlivých farmák s ohľadom na renálne parametre uvádza tab.

Pri preskripcii jednotlivých liekov je vždy je nutné dodržať SPC, ktoré okrem indikácií a dávkovania stanovuje aj kontraindikácie a nežiaduce účinky. SPC sa považuje za medicínsko-právne záväzný materiál a jeho dodržiavanie vyžaduje aj správna klinická prax. Rovnako je potrebné dodržať indikačné obmedzenie, čo je ekonomické obmedzenie pre hradenú liečbu. Pokiaľ sa liek predpisuje mimo indikačného obmedzenia, pacient si liek musí hradiť sám. Znenie aktuálnych indikačných obmedzení je možné nájsť na <http://www.health.gov.sk/Clanok?lieky201605> [9].
Poznámka
Vo februári 2016 s platnosťou od 1. 6. 2016 bol zakategorizovaný prípravok fixnej kombinácie bazálneho inzulínu degludek a agonistu GLP1 liraglutidu, koncentrovaný inzulin glargin U300I/ml s predlženým účinkom a zníženou variabilitou a niektoré prípravky fixnej kombinácie gliflozínu a metformínu. Táto skutočnosť znamená pre možnosti liečby nepochybne významný krok.
doc. MUDr. Emil Martinka, PhD.
martinkaemil@hotmail.com
Národný endokrinologický a diabetologický ústav n. o. v Ľubochni
www.nedu.sk
Doručené do redakcie 29. 4. 2016
Sources
1. Abrahamson MJ, Barzilay YI, Blonde L et al. Aace/Ace comprehensive diabetes management algorithm 2015. Endocr Pract 2015; 21(4) e1. Dostupné z DOI: <http://dx.doi.org/10.4158/EP15693.CS>.
2. Gerstein HC, Miller ME, Byington RP et al. [Action to Control Cardiovascular Risk in Diabetes Study Group]. Effect of intensive glucose lowering in patients with type 2 diabetes. N Engl J Med 2008; 358(24): 2545–2559.
3. Patel A, MacMahon S, Chalmers J et al. [ADVANCE Collaborative Group]. Intensive Blood Glucose Control and VascularOutcomes in Patients with Type 2 Diabetes N Engl J Med 2008; 358(24): 2560–2572.
4. Bonds DE, MillerME, Bergenstal RM et al. The association between symptomatic, severe hypoglycaemia and mortality in type 2 diabetes: retrospective epidemiological analysis of the ACCORD study. BMJ 2010; 340: b4909. Dostupné z DOI: <http://dx.doi.org/10.1136/bmj.b4909>.
5. Dormandy JA, Charbonnel B, Eckland DJA et al. [PROactive investigators]. Secondary prevention of macrovascular events in patients with type 2 diabetes in the PROactive Study (PROspective pioglitAzone Clinical Trial In macroVascular Events): a randomised controlled trial. Lancet 2005; 366 (9493): 1279–89.
6. Green JB., Bethel MA, Armstrong PW et al. Effect of Sitagliptin on Cardiovascular Outcomes in Type 2 Diabetes. N Engl J Med 2015; 373(3): 232–242.
7. Holden SE, Jenkins-Jones S, Morgan CL et al. Glucose-lowering with exogenous insulin monotherapy in type 2 diabetes: dose association with all-cause mortality, cardiovascular events and cancer. Diabetes Obes Metab 2015; 17(4): 350–362.
8. Holman RR, Paul SK, Bethel MA et al. 10-year follow-up of intensive glucose control in type 2 diabetes. N Engl J Med 2008; 359(15): 1577–1589.
9. Aktuálne znenie indikačných obmedzení pre preskripciu liekov hradených z verejného poistenia. Dostupné z WWW: <http://www.health.gov.sk/Clanok?lieky201605>.
10. Inzucchi ES, Bergenstal RM, Buse JB et al. Management of Hyperglycemia in Type 2 Diabetes, 2015: A Patient-Centered Approach: Update to a Position Statement of the American Diabetes Association and the European Association for the Study of Diabetes. Diabetes Care 2015; 38(1): 140–149.
11. Informácie dostupné z WWW: <http://www.medscape.com/viewarticle/859905>.
12. King P, Peacock I, Donnelly R. The UK Prospective Diabetes Study (UKPDS): clinical and therapeutic implications for type 2 diabetes. Br J Clin Pharmacol 1999; 48(5): 643–648.
13. Martinka E. NEFRITI. Dostupné z WWW: <http://dia.euni.sk/category/167-komplikacie-diabetes-mellitus/181-mikrovaskularne-komplikacie/article/2002-nefriti?bid=3>.
14. Martinka, E, Pontuch P, Mišániková M et al. Výskyt diabetickej nefropatie v populácii pacientov s diabetes mellitus na Slovenku : Výsledky prieskumu NEFRITI. Forum Diab 2015; 4(3): 198–207.
15. Mechanick JI, Marchetti AE, Apovian C et al. Diabetes-specific nutrition algorithm: a transcultural program to optimize diabetes and prediabetes care. Curr Diab Rep 2012; 12(2): 180–94.
16. Nissen SE, Wolski K. Effect of rosiglitazone on the risk of myocardial infarction and death from cardiovascular causes. N Engl J Med 2007; 356(24):2457–2471. Erratum in N Engl J Med. 2007; 357(1): 100.
17. Gerstein HC, Bosch J, Dagenais GR et al. [Origin Trial Investigators]. Basal Insulin and Cardiovascular and Other Outcomes in Dysglycemia. N Engl J Med, 2012; 367(4): 319–328.
18. Rosenstock J, Ferrannini E. Euglycemic Diabetic Ketoacidosis: A Predictable, Detectable, and Preventable Safety Concern with SGLT2 Inhibitors. Diabetes Care 2015; 38(9): 1638–1642.
19. Scirica BM., Bhatt DL, Braunwald E et al. [SAVOR-TIMI 53 Steering Committee and Investigators]. Saxagliptin and Cardiovascular Outcomes in Patients with Type 2 Diabetes Mellitus N Engl J Med 2013; 369(4): 1317–1326.
20. Shah AD, Langenberg C, Rapsomaniki E et al. Type 2 diabetes and incidence of cardiovascular diseases: a cohort study in 1–9 million people. Lancet Diabetes Endocrinol 2015; 3(2): 105–113.
21. Schernthaner G, Curie CJ, Schernthaner GH. Do We Still Need Pioglitazone for the Treatment of Type 2 Diabetes? A risk-benefit critique in 2013. Diabets Care 2013; 36(Suppl 2): S155-S161.
22. Schramm TK, Gislason GH, Vaag A et al. Mortality and cardiovascular risk associated with different insulin secretagogues compared with metformin in type 2 diabetes, with or without a previous myocardial infarction: a nationwide study. Eur Heart J 2011; 32(15): 1900–1908. Erratum in Eur Heart J 2012; 33(10): 1183.
23. [UK Prospective Diabetes Study (UKPDS) Group]. Intensive blood-glucose control with sulphonylureas or insulin compared with conventional treatment and risk of complications in patients with type 2 diabetes (UKPDS 33). Lancet 1998; 352(9131): 837–853. Erratum inLancet 1999; 354(9178): 602.
24. [UK Prospective Diabetes Study (UKPDS) Group]. Effect of intensive blood-glucose control with metformin on complications in overweight patients with type 2 diabetes (UKPDS 34). Lancet 1998; 352(9131): 854–865. Erratum in: Lancet 1998; 352(9139): 1558.
25. Yki-Järvinen H, Bergenstal R, Ziemen M et al. [EDITION 2 Study Investigators]. New insulin glargine 300 units/mL versus glargine 100 units/mL in people with type 2 diabetes using oral agents and basal insulin: glucose control and hypoglycemia in a 6-month randomized controlled trial (EDITION 2). Diabetes Care 2014; 37(12): 3235–3243.
26. Zinman B, Wanner C, Lachin JM et al. Empagliflozin, Cardiovascular Outcomes, and Mortality in Type 2 Diabetes. N Engl J Med 2015; 373(22): 2117–2128.
27. Zoungas S, Chalmers J, Neal B. Follow-up of blood-pressure lowering and glucose control in type 2 diabetes. N Engl J Med 2014; 371(15): 1392–1406.
Labels
Diabetology Endocrinology Internal medicineArticle was published in
Forum Diabetologicum

2016 Issue 2
-
All articles in this issue
-
The quality of the care for patients with diabetes in the Czech Republic.
The VZP Data Analysis - Iatrogenic hypoglycemia as a serious medical problem
- The Prevalence of Diabetic Retinopathy in Slovakia
- Kidney transplantation and metabolic syndrome
- Consensual therapeutic algorithm for type 2 diabetes mellitus (in accordance with SPC, ADA/EASD indicative limitations and recommendations )
- Consensual therapeutic algorithm for treatment with insulin pump and continuous monitoring of glucose levels (in compliance with the indicative limitations as amended)
-
The quality of the care for patients with diabetes in the Czech Republic.
- Forum Diabetologicum
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Consensual therapeutic algorithm for treatment with insulin pump and continuous monitoring of glucose levels (in compliance with the indicative limitations as amended)
- Consensual therapeutic algorithm for type 2 diabetes mellitus (in accordance with SPC, ADA/EASD indicative limitations and recommendations )
- Kidney transplantation and metabolic syndrome
- Iatrogenic hypoglycemia as a serious medical problem
