Exacerbace chronické obstrukční plicní nemoci z pohledu intenzivisty
Acute exacerbation of chronic obstructive pulmonary disease as seen by the intensivist
Chronic obstructive pulmonary disease (COPD) is a major cause of mortality and chronic morbidity throughout the world; currently it is the fourth leading cause of death worldwide. The most common causes of acute COPD exacerbation, a frequent reason for hospital admission, include tracheobronchial tree infection, climatic changes, and patient non-compliance. This review outlines the basic pathophysiological characteristics of COPD exacerbation and indication criteria for patient hospitalization in a routine care ward or an ICU. Principles of comprehensive conservative therapy and strategies of invasive and non-invasive ventilatory support are outlined, including current concepts of a potential reduction of respiratory work by administering a mixture of helium and oxygen (heliox) in acute respiratory failure.
Key words:
COPD, respiratory insufficiency, mechanical ventilation, heliox.
:
R. Zazula
; A. Spálený
:
Anesteziologicko-resuscitační klinika 1. lékařské fakulty
a Fakultní Thomayerovy nemocnice
; Přednosta: MUDr. Roman Zazula Ph. D.
; Univerzita Karlova v Praze
:
Prakt. Lék. 2008; 88(8): 437-442
:
Reviews
Chronická obstrukční plicní nemoc (CHOPN) patří celosvětově mezi významné příčiny mortality a chronické morbidity, v současné době je čtvrtou nejčastější příčinou úmrtí ve světě. V případě její těžké exacerbace s rizikem selhání respirace je pacient indikován k přijetí na jednotku intenzivní péče (JIP) nebo lůžkové anesteziologicko-resuscitační oddělení (ARO). V přehledném referátu jsou uvedeny základní patofyziologické momenty rozvoje respirační insuficience při těžké exacerbaci, indikační kritéria rozlišující možnost hospitalizace na standardním oddělení a indikaci hospitalizace na JIP či ARO. Je popsán algoritmus konzervativní léčby vycházející z materiálu Světové iniciativy proti chronické obstrukční plicní nemoci (GOLD – Global Initiative for Chronic Obstructive Lung Disease) a současná doporučení pro vedení antibiotické terapie. Na závěr je uvedena strategie neinvazivní a invazivní ventilační podpory včetně recentních názorů na možnosti snížení dechové práce podáním směsi helia a kyslíku (helioxu) v akutním stadiu respiračního selhání.
Klíčová slova:
CHOPN, respirační insuficience, umělá plicní ventilace, heliox.
Úvod
Chronická obstrukční plicní nemoc je léčitelné plicní onemocnění, kterému lze předcházet a které má významné mimoplicní účinky, jež mohou přispívat k jeho závažnosti u jednotlivých nemocných. Jeho plicní složka je charakterizována omezeným průtokem vzduchu v průduškách (bronchiální obstrukcí), který není plně reverzibilní (12). Bronchiální obstrukce obvykle progreduje a je spojena s abnormální zánětlivou odpovědí na škodlivé částice a plyny a může být spojena s bronchiální hyperreaktivitou. V České republice je CHOPN spolu s astmatem nejčastějším onemocněním dolních dýchacích cest.
Mnoho dřívějších definic CHOPN zdůrazňovalo termíny chronická bronchitida a emfyzém, v nové definici již nejsou uvedeny. Zatímco chronická bronchitida je definována klinicky, emfyzém je definován patologicko-anatomicky.
Chronická bronchitida je produktivní kašel přítomný nejméně 3 měsíce ve dvou po sobě jdoucích letech. Kašel a tvorba sputa mohou předcházet vývoji bronchiální obstrukce, významná bronchiální obstrukce se ale může vyvinout i bez těchto symptomů.
Emfyzém je abnormální trvalé rozšíření dýchacích cest periferně od terminálních bronchiolů a destrukce dýchacích cest bez přítomnosti fibrózy. Postihuje pouze jednu z těžkých strukturálních změn přítomných u nemocných s CHOPN.
CHOPN často vzniká u dlouholetých kuřáků, přičemž sama o sobě nebo ve spojitosti s kouřením je živnou půdou pro vznik četných komorbidit. Známými mimoplicními účinky CHOPN jsou nutriční abnormality, hubnutí a dysfunkce kosterních svalů. Nemocní mají zvýšené riziko ischemické choroby srdeční, respiračních infekcí, osteoporózy, zlomenin, depresí, diabetu, poruch spánku, anémie a glaukomu. CHOPN zvyšuje riziko plicních neoplázií, není zatím jasné, zda je toto spojení vyvoláváno společným rizikovým faktorem:
- kouřením,
- poškozením citlivých genů, nebo
- zhoršeným odstraňováním karcinogenů.
Pracovní skupina GOLD doporučuje klasifikaci tíže CHOPN dle spirometrických nálezů do čtyř stádií (tab. 1). Zařazení do stádií podle spirometrických hodnot je pragmatickým přístupem zaměřeným na praktické postupy a má být považováno spíše za prostředek pro edukaci a za pomůcku pro stanovení typu léčby.

Exacerbace CHOPN je definována jako příhoda v průběhu nemoci, která je charakterizována zhoršením dušnosti, kašlem a/nebo vykašláváním, a to nad obvyklé každodenní kolísání těchto obtíží. Začíná náhle a může zdůvodňovat změnu v zavedené léčbě (12). Diagnóza exacerbace CHOPN je založena na klinickém obraze.
Klinický obraz exacerbace je různorodý, od zvýšení frekvence a tíže chronických symptomů až po manifestní respirační selhání ohrožující život nemocného. Hlavními příznaky jsou zhoršení dušnosti a kašle, často doprovázené sípáním a pocitem tíhy na hrudníku, změnou charakteru a množství sputa, teplotou. Exacerbace se mohou také projevovat množstvím necharakteristických obtíží, jako je nevolnost, nespavost nebo naopak spavost, únavnost, deprese a zmatenost. Tyto nespecifické obtíže mohou být přehlédnuty nebo považovány za příznak jiné choroby (11).
Nejčastější příčiny exacerbace jsou infekce tracheobronchiálního stromu a znečištění ovzduší. Příčinu asi jedné třetiny těžkých exacerbací se nepodaří zjistit a na druhé straně i řada jiných patologických stavů může vést k obrazu exacerbace (tab. 2). Její těžký průběh zejména u CHOPN stadia III a IV patří mezi velmi časté indikace hospitalizace na JIP nebo ARO. Cílem lékaře intenzivisty při těžké exacerbaci s respirační insuficiencí až selháním je podpora dýchání jako jedné ze základních vitálních funkcí.

Patofyziologie respiračního selhání při exacerbaci CHOPN
Při exacerbaci CHOPN dochází k bronchospasmu, edému sliznice bronchů a ke stagnaci hlenu. Tyto změny způsobují výrazné zvýšení odporu dýchacích cest, které je provázeno změnou dechového vzoru. K dosažení normální minutové ventilace se při snížení dechových objemů zvyšuje dechová frekvence.
V rozvoji respiračního selhání se také uplatňuje takzvaný intrinsický PEEPi (pozitivní vnitřní endexpirační tlak), ke kterému dochází buď tak, že v průběhu expiria při dosažení takzvaně kritického tlaku v dýchacích cestách dochází mechanickým útlakem ke kolapsu malých dýchacích cest, a tím k limitaci až zastavení výdechového proudu, nebo mechanismem dynamické plicní hyperinflace. Dynamická hyperinflace s limitací expiračního průtoku je považována za typický patofyziologický rys CHOPN a její exacerbace (2). V jejím důsledku dochází k ne-příznivému inspiračnímu postavení hrudníku s poklesem poddajnosti hrudní stěny, k nepříznivé poloze interkostálních svalů a bránice se zvýšením dechové práce pro výměnu plynů v plicích. Dysfunkce bránice a dýchacího svalstva je pozorována relativně časně v průběhu progrese CHOPN, a to i u nemocných, kteří nevyžadují ventilační podporu.
Nemocní se ocitají v uzavřeném kruhu, práce nutná k překonání proudových odporů je díky obstrukci zvýšená, přítomnost PEEPi je příčinou jejího dalšího nárůstu při spontánním dýchání. Zvýšená práce dýchacích svalů vede k větší spotřebě kyslíku, snížení parciálního tlaku kyslíku ve smíšené venózní krvi a k dalšímu prohloubení poruchy výměny plynů. Při progresi klinického vývoje nebo nedostatečné konzervativní léčbě může dojít k závažnému stavu, při kterém dojde k vyčerpání dýchacích svalů se zhroucením ventilace a oxygenace, které bez včasné intervence vyústí v zástavu oběhu.
Léčba pacienta s exacerbací CHOPN
Základem standardní péče o pacienta s exacerbací CHOPN je správné zhodnocení závažnosti jeho klinického stavu a rozhodnutí mezi ambulantní léčbou nebo hospitalizací, nastavení symptomatické léčby, a v případě známé příčiny exacerbace léčba kauzální. Příznaky obstrukce léčíme podáním bronchodilatancií a kortikosteroidů, hypoxémii podáním kyslíku, známky bakteriální infekce antibiotiky.
Pro určení tíže exacerbace je nutné posouzení klinického stavu pacienta včetně hodnot krevních plynů a acidobazické rovnováhy erudovaným lékařem. Pro hodnocení je podstatnější srovnání dynamiky změn měřených hodnot proti stabilizovanému klidovému stavu než absolutní hodnoty sledovaných parametrů. Základní laboratorní vyšetření a rentgenový snímek plic je samozřejmostí, rovněž mikroskopické a kultivační vyšetření sputa.
Funkční vyšetření plic pacienta s exacerbací CHOPN je obtížné, v praxi většinou neproveditelné, případně redukované pouze na základní parametry PEF (peak expiratory flow – vrcholový výdechový průtok) a FEV1(forced expiratory volume in 1 second – usilovný jednosekundový výdech), přičemž PEF≤100 l/min nebo FEV1≤1 l svědčí pro těžkou exacerbaci, s výjimkou nemocných s trvalou těžkou obstrukční poruchou.
U nemocných ve stadiu I a II je exacerbace zpravidla provázena zvýšením dušnosti, často spolu se zvětšením kašle a zvýšením tvorby sputa. Léčba takového nemocného obvykle nevyžaduje hospitalizaci.
Řada nemocných s exacerbací těžké (st. III) a velmi těžké (st. IV) CHOPN je indikována k přijetí do nemocnice (tab. 3).

Jestliže se však jedná o exacerbaci ohrožující život, měl by být nemocný ihned přijat na jednotku intenzivní péče, či ARO (tab. 4).

Základní principy a algoritmus léčby je uveden v tabulce 5. Léčebný protokol ve své podstatě kopíruje obecné zásady komplexní intenzivní péče o pacienty v ohrožení nebo selhání vitálních funkcí.
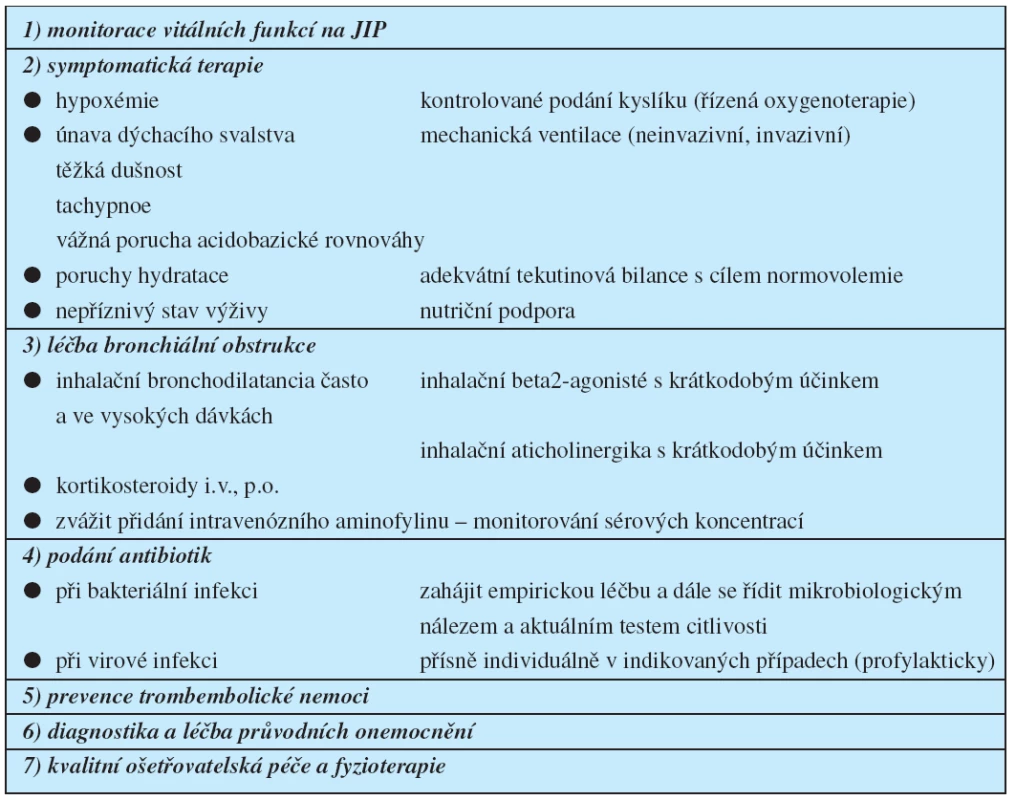
Kontrolované podání kyslíku – léčba kyslíkem
Zmírnění život ohrožující hypoxémie kyslíkovou léčbou je základem nemocniční léčby CHOPN. Užití polomasek k podání zvlhčeného kyslíku současně s možností nastavení jeho inspirační frakce (FiO2 – fraction of inspired oxygen) nebo vysokoprůtokového zařízení typu Venturiho masky umožňuje přesné dávkování kyslíku. Z klinické zkušenosti je ale známo, že pacienti lépe snášejí podání kyslíku nosní kanylou („kyslíkové brýle“). Vzhledem ke značnému riziku retence CO2 je nutno titrovat léčbu zvlhčeným kyslíkem velmi obezřetně k dosaže-ní cílových hodnot PaO2 ≥ 8kPa, SaO2 ≥ 90. Malý vzestup PaCO2 lze tolerovat, hodnota pH by však nemá klesnout pod 7,25. Je tedy nezbytná kontinuální monitorace saturace hemoglobinu kyslíkem pulzní oxymetrií a pravidelná vyšetření krevních plynů k časné detekci retence CO2 a respirační acidózy.
Medikamentózní terapie
Bronchodilatační léčba exacerbací CHOPN spočívá v inhalačním podání beta 2-agonistů s krátkodobým účinkem. Při nedostatečném efektu se doporučuje přidat inhalační anticholinergika s krátkodobým účinkem.
Úloha metylxantinů zůstává kontroverzní, v současné době jsou považovány za druhou linii léčby, pokud je nedostatečná odpověď na léčbu krátkodobě účinnými bronchodilatancii. Vzhledem k možnými nežádoucím účinkům se doporučuje přísné monitorování sérových koncentrací metylxantinů.
V léčbě exacerbace CHOPN je doporučeno rozšíření terapie o systémové podání kortikosteroidů (perorálně nebo intravenózně). Optimální dávka v této indikaci není dosud známa. Pracovní skupina GOLD doporučuje denní dávku 30 až 40 mg prednisolonu po dobu 7–10 dnů. Tato dávka se jeví jako dostatečně účinná a zároveň bezpečná. Pro absenci většího množství studií hodnotících dávkování kortikoidů u nemocných s exacerbací CHOPN vyžadující ventilační podporu je nutné zvážit při neúspěchu léčby i vyšší dávkování (14).
V klinické praxi se v nemocniční léčbě exacerbace CHOPN nejčastěji užívá metylprednisolon v dávce 0,5–1 mg/kg po 6–8 hodinách i.v. Vyšší dávky jsou spojeny s významným rizikem nežádoucích účinků, a proto jsou opuštěny. Ke zlepšení stavu dochází v prvních 72 hodinách, poté již další zvýšení efektu není prokázáno. Prolongovaná léčba nad 14 dnů nezvyšuje účinnost, naopak zvyšuje riziko nežádoucích účinků (např. hyperglykémie, svalová atrofie, nežádoucí imunosupresívní efekt).
Antibiotická léčba u nemocných s exacerbací CHOPN bývá nejčastěji empirická a bohužel často také polypragmatická. Přitom je nezbytné, aby byla její dlouhodobá strategie dobře promyšlená a uvážlivá, protože dostupnost účinných antibiotik ovlivňuje prognózu pacienta, zejména v pokročilých stádiích nemoci. Je tedy mimořádně nerozumné, aby se na počátku léčby běžně používala tzv. rezervní antibiotika.
Na základě dosud provedených studií by měli být léčeni antibiotiky ti nemocní, kteří mají zvýšenou purulenci sputa a jeden z dalších hlavních symptomů exacerbace (dušnost a/nebo zvýšený objem sputa). Dalšími atributy pro rozhodnutí klinika o zahájení léčby a výběru ATB jsou výsledky laboratorních vyšetření, zhodnocení rentgenového nálezu, pokročilost základního onemocnění (stadium CHOPN) a aktuální tíže celkového klinického stavu. Rovněž lokální epidemiologická situace je významným faktorem pro volbu antibiotické strategie.
Je třeba upozornit na možnost virové respirační infekce jako spouštěcího mechanismu exacerbace CHOPN, kdy bakteriální agens je často až sekundární. Rutinní „profylaktické“ podávání antibiotik u kompenzovaných pacientů s pravděpodobnou virovou etiologiií respiračního infektu není indikováno. U rizikových pacientů a těžké exacerbace, zvláště při invazivních léčebných postupech, je však indikace antibiotik oprávněná.
Nutno podotknout, i v klidové fázi onemocnění může být bronchiální sliznice dlouhodobě či trvale kolonizována mikroorganismy, které současně představují nejčastější etiologii vzplanutí bakteriální infekce (Haemophillus influenzae, Streptococcus pneumoniae, Moraxella catarrhalis).
Na kolonizaci dýchacích cest se podílí pravděpodobně více faktorů. Změna charakteru proudění vzduchu a zvýšená depozice exogenních částic v periferních cestách vede k neimunologické poruše obranných mechanismů. Rozhodující je zpomalení ciliárního aparátu při destrukčních změnách epiteliálních buněk. Poškození je zřejmě následkem lokálního zvýšení hladin proteolytických a elastolytických enzymů. Vázne eliminace sekretů, bronchiální žlázy jsou zmnoženy a produkují zvýšené množství hustějšího hlenu. Je narušena humorální i buněčná imunita, která je dysregulována změněným spektrem cytokinů. Obranné funkce makrofágů jsou sníženy. Dlouhodobá přítomnost mikroorganismů v takto postiženém terénu může dále zhoršovat všechny výše uvedené poruchy (8). Opakovaná a mnohdy dlouhodobá expozice antibiotikům je důležitým faktorem, který modifikuje spektrum i vlastnosti přítomných kmenů. V dolních dýchacích cestách se tak vytváří specifický mikrobiální ekosystém, který se dynamicky uplatňuje na případném aktivním infekčním procesu.
Jinou skupinou nemocných jsou pacienti mladšího věku s dosud nekomplikovanou CHOPN bez závažného funkčního postižení, kde se používají pro léčbu bakteriální exacerbace CHOPN základní betalaktamová antibiotika. V našich podmínkách především amoxicilin, který je v dosud příznivé epidemiologické situaci spolehlivě účinný vůči převládajícím vyvolávajícím patogenům (hemofily, pneu-mokoky). Měl by být ordinován v dostatečně vysoké dávce, avšak ve shodě s aktuálními preskripčními doporučeními.
U nemocných s CHOPN pokročilého stadia a s rizikovými faktory (starší osoby s chronickými komorbiditami a opakova-nými epizodami exacerbace v posledním roce) se používají rezervní betalaktamová antibiotika (amoxicilin klavulanát, cefalosporiny druhé generace). Jako alternativy při alergii k betalaktamům, mikrobiální rezistenci nebo atypické etiologii mohou být použity makrolidy, v přísně odůvodněných případech fluorochinolony (např. infekce Pseudomonas aeruginosa, kdy ovšem hrozí nebezpečí rezistence vzniklé intra therapiam).
Je třeba mít na paměti, že k makrolidům a fluorochinolonům u nás strmě narůstá antibiotická rezistence řady infekčních agens. Fluorochinolony proto v mnoha situacích ztratily postavení léků použitelných pro empirickou úvodní léčbu. Zároveň je nezbytné zdůraznit, že základní řada fluorochinolonů není účinná v terapii pneumokokové infekce, zatímco citlivost pneumokoků k penicilinu je u nás dosud zachována.
Zvláštní skupinou jsou nemocní se stavem charakterizovaným jako „chronic bronchial sepsis – chronická přítomnost infekčních agens“, kdy jsou přítomny bronchiektázie a chronické mikrobiální osídlení dolních cest dýchacích změněné opakovanými ATB kůrami (gramnegativní baktérie, anaerobní kmeny). U této skupiny pacientů, vyžadující pečlivý individuální přístup, musí být ATB léčba přísně cílena na mikroflóru přítomnou či aktuálně převládající ve fázi exacerbace a musí být brány v potaz případné změny její citlivosti.
Je-li nemocnému s CHOPN poskytována intenzivní péče včetně umělé plicní ventilace a jeho stav se komplikuje respirační infekcí, je nezbytné postupovat podle obvyklého deeskalačního principu, založeného na úvodní empirické a následné cílené terapii. Určení infekčního agens a jeho citlivosti k antibiotikům je u pacientů s pokročilou CHOPN vždy složitější, a pečlivý mikrobiologický průkaz původce je nezbytný k odlišení prosté kolonizace a vyžaduje tak těsnou spolupráci zkušeného mikrobiologa a klinika.
Kromě patogenů typických pro nemocného s dlouhodobě léčenou CHOPN se etiologicky mohou účastnit také nozokomiální kmeny jako Staphylococcus aureus (eventuálně včetně MRSA – methicilin rezistentní St. aureus, vyskytuje-li se endemicky na daném pracovišti), široká škála gramnegativních bakterií včetně peudomonád a acinetobakterů, u nichž je ovšem mnohdy obtížné odlišit kolonizaci a infekci. Často se jedná o multirezistentní kmeny s velmi omezenými možnostmi volby účinných antibiotik (5). Etiologická úloha atypických patogenů je možná, zatím ale ne zcela objektivně určená.
Ventilační podpora
Součástí léčby těžké exacerbace CHOPN je ventilační podpora. Z obecného hlediska je cílem ventilační podpory, bez ohledu na způsob její aplikace, úleva od dušnosti, podpora přetížené nebo selhávající ventilační pumpy, normalizace pH, a tím získání času do zvládnutí příčiny, která vedla k exacerbaci (2). Ventilační podpora přístrojem, který plně nebo částečně zajišťuje průtok plynů respiračním systémem, je v našich podmínkách poskytována na JIP nebo ARO.
Z fyzikálních principů vyplývá, že základní podmínkou vzniku pohybu plynu je tlakový gradient. Podle způsobu, kterým jej dosahujeme, se dělí umělé plicní ventilace na dva základní typy:
- ventilaci přetlakem (přetlak působící na vstupu do dýchacích cest), a
- ventilaci podtlakem (negativní tlak v interpleurální dutině).
Do tohoto dělení vstupují ještě další skupiny zohledňující dechové objemy a dechovou frekvenci k dosažení adekvátní minutové ventilace (ventilace konvenční a ventilace nekonvenční – vysokofrekvenční, nebo trysková). V klinické praxi je obecně, včetně exacerbace CHOPN, používána ventilační podpora pozitivním přetlakem aplikovaná pomocí přístroje pro umělou plicní ventilaci – plicním ventilátorem.
Podle způsobu zajištění průchodnosti dýchacích cest rozdělujeme ventilační podporu na invazivní a neinvazivní.
Neinvazivní ventilační podpora (NIV) je definována jako způsob mechanické ventilační podpory bez nutnosti invazivního zajištění dýchacích cest tracheální intubací nebo tracheotomií se zavedením tracheostomické kanyly. Základními pomůckami pro aplikaci NIV jsou speciální masky nebo přilby zajišťující těsnost kontaktu se zevními vstupy do dýchacích cest (ústa, nos) a plicní ventilátor. Jejich správná volba je významným faktorem podílejícím se na úspěchu aplikace této metody.
Neinvazivní ventilační podpora je v současné době považována za první volbu u nemocných s exacerbací CHOPN (7, 10). Indikace a kontraindikace k použití NIV jsou uvedeny v tabulce 6.

Pravděpodobnost selhání neinvazivní ventilace se pohybuje mezi 5 až 40 % a závisí na hodnotě pH, PaCO2, stupni alterace vědomí, tíží celkového stavu vyjádřenou hodnotou APACHE II skóre při jejím zahájení a také na zkušeností pracoviště (13) (tab. 7).

Úspěšná NIV přemostí akutní fázi únavy a dechové nedostatečnosti. Může se jednat o jednorázovou nebo opakovanou podporu při kritických epizodách hraniční dechové rezervy. Doporučení pro optimální délku aplikace a frekvenci NIV nejsou v odborné literatuře formulována. Doba trvání ventilační podpory NIV a její způsob – kontinuální či přerušovaný – závisejí na řadě faktorů. Po úvodní optimalizaci nastavení NIV a dosažení tolerance masky bychom neměli přerušovat neinvazivní ventilační podporu minimálně po dobu 30 minut s cílem zhodnocení její účinnosti. Při zlepšování klinického stavu se snažíme zařazovat v pravidelných intervalech odpočinek a neinvazivní ventilaci vysazovat, např. po 1–2 hodinách na 10–15 minut podle compliance nemocného a dynamiky stavu (1).
V případě selhání NIV (tab. 8) přistupujeme k invazívnímu zajištění dýchacích cest a k invazivní umělé plicní ventilaci. Ta je také indikována jako postup první volby u nemocných s kontraindikacemi NIV. Významným aspektem provázejícím invazivní ventilační podporu u nemocných s CHOPN je obtížné odvykání pacienta od mechanické ventilace. Z tohoto pohledu a naší klinické zkušenosti považujeme za indikované provedení časné tracheostomie, zejména u nemocných s pokročilým stadiem onemocnění a vážnými komorbiditami.

Možnosti klinického použití helia u nemocných s exacerbací CHOPN
Do medicínské praxe bylo helium zavedeno ve třicátých letech minulého století ke snížení dechové práce u pacientů s bronchiální obstrukcí. Směs helia a kyslíku je označována jako heliox, přičemž optimální procentní zastoupení obou plynů je v poměru 21 % kyslíku a 79 % helia.
Samotný heliox nemá kauzální léčebný efekt a měl by sloužit pouze jako terapeutický most do nástupu účinku dalších složek terapie. Cílem jeho podání u spontánně ventilujících pacientů je odvrácení intubace redukcí průtočného odporu v dýchacích cestách a snížení dechové práce. U mechanicky ventilovaných pacientů heliox redukuje vrcholové i střední tlaky, snižuje riziko barotraumatu a pneumothoraxu. Podle závěrů recentní prospektivní intervenční studie (9) s aplikací helioxu při umělé plicní ventilaci u pacientů s těžkou CHOPN a významnou hyperinflací byly při ventilaci helioxem statisticky významně zlepšeny hemodynamické parametry (zvýšení indexu srdečního výdeje a snížení pulzové variability).
Mechanismem tohoto příznivého efektu je prokázané snížení intrinsického PEEPi a zadrženého objemu (Vtrapp). Léčba helioxem při umělé plicní ventilaci by měla být vyhrazena pro stavy s extrémní hyperinflací, pokud se nedaří standardními postupy snížit tlak v dýchacích cestách na bezpečné hodnoty ani při tolerancí permisivní hyperkapnie, nebo je-li důsledkem agresivní ventilace závažná hemodynamická nestabilita (3).
Na rozdíl od neinvazivní ventilace heliox není součástí standardního léčebného postupu u exacerbace CHOPN. Bylo prokázáno, že užití helioxu snižuje dechovou práci (4), studie však nehodnotily, je-li užití helioxu u pacientů netolerujících neinvazivní ventilaci srovnatelnou alternativou. Pokud je nám známo, pouze jediná studie byla věnována srovnání klinického efektu neinvazivní ventilace s použitím helioxu a směsi vzduch/kyslík (6). Výsledky nepřinesly statisticky významné rozdíly v počtu odvrácených intubací a délce pobytu na jednotce intenzívní péče, přesto byla ve skupině s helioxem shledána v trendu menší četnost intubací (13 % proti 20 %), byla zkrácena celková délka hospitalizace a celkové náklady na léčbu byly nižší.
Získávání a zpracování helia je dosud nákladné, a cena helioxu je tak relativně vysoká. Jestliže však může heliox pomoci zvrátit respirační selhání, zkrátit délku hospitalizace a zvýšit naději na přežití, mohl by jeho přínos v konečném výsledku vyvážit relativně vysoké náklady spojené s jeho podáním.
Propuštění z nemocnice po úspěšně léčené exacerbaci CHOPN
V současné době nejsou k dispozici dostatečné klinické údaje, které by stanovily optimální délku hospitalizace u nemocných s exacerbací CHOPN. Konsensuální kritéria pro propuštění z nemocnice po exacerbaci CHOPN dle doporučení GOLD uvádí tabulka 9.

Závěr
CHOPN je celosvětově jednou z nejčastějších příčin úmrtí. V léčbě těžké exacerbace, zejména u pacientů s pokročilým stádiem CHOPN, se jeví nepříznivým prognostickým faktorem nutnost invazivního zajištění dýchacích cest, ať už endotracheální intubací, či tracheostomií, a umělá plicní ventilace. Maximální snaha o odvrácení invazivních léčebných postupů je z tohoto pohledu prioritní.
Snížení dechové práce neinvazivní mechanickou podporou ventilace a/nebo aplikací helioxu přináší pacientům nejen subjektivní úlevu, ale i větší naději na přežití. Invazivní ventilační podpora je indikována jako postup první volby u nemocných s kontraindikacemi nebo vysokou pravděpodobností selhání neinvazivních ventilačních podpor.
Nedílnou součástí eticky náročného rozhodování o nezahájení invazivní umělé plicní ventilace při velmi těžkém stádiu CHOPN je vědomí o předem vysloveném přání plně informovaného pacienta, které je nutno znát ještě před těžkou exacerbací.
MUDr. Roman Zazula, Ph. D.
Anesteziologicko-resuscitační klinika 1. LF UK a FTNsP
Fakultní Thomayerova nemocnice s poliklinikou
Vídeňská 800
140 59 Praha 4
E-mail: roman.zazula@ftn.cz
Sources
1. Černý, V. Neinvazivní plicní ventilace. In: Dostál, P. a kol. Základy umělé plicní ventilace. Praha 2004: Nakladatelství Maxdorf, 273 s. ISBN 80-7345-007-0.
2. Dostál, P. Možnosti umělé plicní ventilace u nemocných s exacerbací chronické obstrukční plicní nemoci. In: Zazula R.: Ročenka intenzivní medicíny 2005, Galén Praha 2005, s. 12-15.
3. Fink, J.B. Helium-oxygen: An old therapy creates new interest. RT Magazine, 1999, 4. Dostupný také z WWW: 4. Chevrolet, J.C. Helium oxygen mixtures in the intensive care unit. Critical Care Med. 2001, 5(4), p. 179-181.
5. Jindrák, V. Strategie ATB léčby u pacienta s chronickým respiračním onemocněním. In: Zazula R.: Ročenka intenzivní medicíny 2005, Galén Praha 2005, s. 16-20.
6. Jolliet, P., Tassaux, D., Roeseler, J. et al. Helium-oxygen versus air-oxygen noninvasive pressure support in decompensated chronic obstructive disease: A prospective, multicenter study. Critical Care Med, 2003, 31 (3), p. 878-884.
7. Keenan, S.P., Sinuff, T., Cook, D.J., Hill, N.S. Which patients with acute exacerbation of chronic obstructive pulmonary disease benefit from non-invasive positive-pressure ventilation? A systematic review of the literature. Ann. Intern. Med. 2003, 138, p. 861-870.
8. Kolek, V. Chronická kolonizace bronchiální sliznice u CHOPN. In: Drábková, J. a kol. Péče o nemocné chronickou obstrukční plicní nemocí v České republice. 1. vyd. Praha: Nakladatelství Jalna, 1996. 176 s. ISBN 80-901743-3-7.
9. Lee, D.L., Lee, H., Chang, H.W. et al. Heliox improves hemodynamics in mechanically ventilated patients with chronic obstructive pulmonary disease with systolic pressure variations. Critical Care Med. 2005, 33 (5), 968-973.
10. Lichtowler, J.V., Wedzicha, J.A., Elliot, M.W. et al. Non-invasive positive pressure ventilation to treat respiratory failure resulting from exacerbation of chronic obstructive pulmonary disease: Cochrane systematic review and meta-analysis. BMJ, 2003, 326, p. 185-189.
11. Musil, J. Exacerbace chronické obstrukční plicní nemoci – pohled pneumologa. In: Zazula R.: Ročenka intenzivní medicíny 2005. Praha: Galén 2005, s. 7-11.
12. Musil, J., Kos, S., Vondra, V., Salajka, F. Světová strategie diagnostiky, léčby a prevence CHOPN. 1.vyd. Praha: Nakladatelství Vltavín, 2007. 164 s. ISBN 80-86587-22-3.
13. Nava, S., Ceriana, P. Cause of failure of nonivasive mechanical ventilation. Respir. Care, 2004, 49, p. 295-303.
14. Pařízková, R. Kortikoidy v intenzivní péči, nadledvinová insuficience. Anest. intenziv. Med. 2005, 16, 1, s. 43-49.
Labels
General practitioner for children and adolescents General practitioner for adultsArticle was published in
General Practitioner

2008 Issue 8
- Advances in the Treatment of Myasthenia Gravis on the Horizon
- Hope Awakens with Early Diagnosis of Parkinson's Disease Based on Skin Odor
- Memantine in Dementia Therapy – Current Findings and Possible Future Applications
- Possibilities of Using Metamizole in the Treatment of Acute Primary Headaches
- Memantine Eases Daily Life for Patients and Caregivers
-
All articles in this issue
- Acute exacerbation of chronic obstructive pulmonary disease as seen by the intensivist
- Use of CT for risk stratification and diagnosis of ischemic heart disease
- The use of the fytosterols and omega 3 fatty acids in primary and secondary cardiovascular prevention
- Occupational diseases due to asbestos dust – do we take them into account?
- Chronic damage of the triangular fibrocartilage complex
- Acute facial palsy – a comparison of clinical and laboratory parameters in patients with Borrelia and idiopathic aetiology
- Pancreatic cancer II.
- Gastrotoxicity of non-steroidal anti-inflammatory drugs and their prescription in Slovakia
- Stenosis of the left subclavian artery as a cause of angina pectoris progression after CABG: coronary-subclavian steal syndrome
- Liver abscess in asymptomatic perforating diverticulitis resembling malignant liver tumour
- Angioscopy and intimomedial hyperplasia
- General Practitioner
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Chronic damage of the triangular fibrocartilage complex
- Acute facial palsy – a comparison of clinical and laboratory parameters in patients with Borrelia and idiopathic aetiology
- Stenosis of the left subclavian artery as a cause of angina pectoris progression after CABG: coronary-subclavian steal syndrome
- Acute exacerbation of chronic obstructive pulmonary disease as seen by the intensivist
