Erytropoetin v léčbě nemocných s myelodysplastickým syndromem
Erythropoietin in the treatment of patients with myelodysplastic syndrome
Aim:
The aim of the study was to evaluate the indication of erythropoietin in patients with myelodysplastic syndrome (MDS).
Methods:
Twenty patients with MDS of RA or RARS subtype (according to the FAB classification) were treated with recombinant human erythropoietin (rHuEPO) in the dose of 150 IU/kg 3 times per week for 12 weeks, in 1 patient with profound granulocytopenia rHuEPO was combined with G-CSF in the dose of 300 μg 3 times per week. The criteria for complete response (CR) were achievement of Hb ≥ 115 g/l and transfusion independence, increase in Hb ≥ 15 g/l and transfusion independence were evaluated as a partial response (PR).
Results:
CR was observed in 4 patients (20 %), 4 patients (20 %) achieved PR. After exclusion of 3 patients in whom the favourable response to rHuEPO might be influenced by presence of incipient renal insufficiency, the CR + PR rate was 25 %. In 16 patients who responded to the treatment at least by increase in Hb ≥ 5 g/l or by decrease in the number of transfusions, the administration of rHuEPO was continued in the same dose for additional 12 weeks, nevertheless, no further CR or PR were observed after prolonged treatment. Concomitant administration of oral iron chelator deferiprone in the dose of 2 – 3 g/day in 5 patients with serum ferritin > 2000 μg/l resulted in 1 patient with PR to rHuEPO in a significant decrease of serum ferritin level and increase of urinary iron excretion. In 3 other patients with not sufficient response to rHuEPO a concomitant oral iron chelation enabled to stabilize serum ferritin level despite continuing iron load from red blood cell transfusions.
Conclusions:
Initial level of serum EPO < 100 IU/l, Hb > 85 g/l and dependence on administration of ≤ 2 TU red blood cell transfusions per month before starting treatment were predictive factors for response to rHuEPO administration. In patients with combination of these parameters, CR+ PR rate was 89 % suggesting that this subset of MDS patients with RA should be indicated for treatment with rHuEPO. Combination ot rHuEPO with G-CSF represents an expensive treatment approach and should be limited for patients with RARS, serum EPO < 500 IU/l and dependence on ≤ 2 TU of red blood cells transfusion per month.
Key words:
myelodysplastic syndrome – anemia – growth factors – erythropoietin – iron overload – chelation
Authors:
J. Čermák
Authors‘ workplace:
Ústav hematologie a krevní transfuze, Praha, ředitel prof. MUDr. Pavel Klener, DrSc.
Published in:
Vnitř Lék 2005; 51(10): 1102-1107
Category:
Original Contributions
Overview
Cíl práce:
Cílem studie bylo posoudit indikaci podávání erytropoetinu (EPO) u nemocných s myelodysplastickým syndromem (MDS).
Metodika:
Rekombinantní lidský erytropoetin (rHuEPO) byl podáván 20 nemocným s MDS typu RA či RARS dle FAB klasifikace v dávce 150 IU/kg 3krát týdně po dobu 12 týdnů, u 1 nemocné s těžkou granulocytopenií byl rHuEPO kombinován s G-CSF v dávce 300 μg 3krát týdně. Jako kompletní odpověď (CR) byl hodnocen vzestup hodnot Hb na ≥ 115 g/l a nezávislost na podávání transfuzí, jako parciální odpověď (PR) byl hodnocen vzestup hodnot Hb ≥ 15 g/l spolu s nezávislostí na podávání transfuzí erytrocytů.
Výsledky:
CR bylo dosaženo u 4 nemocných (20 %), 4 nemocní (20 %) dosáhli PR. Pokud nebyli hodnoceni 3 nemocní, u nichž mohla být příznivá odpověď na rHuEPO ovlivněna přítomností chronické renální insuficience mírného stupně, činil počet CR + PR 25 %. U 16 nemocných, kteří odpověděli na léčbu alespoň vzestupem Hb ≥ 5 g/l či poklesem počtu podávaných transfuzí, bylo v léčbě pokračováno stejnou dávkou rHuEPO po dobu dalších 12 týdnů, ale u žádného dalšího nemocného nebylo během této doby dosaženo CR či PR. Současné podávání perorálního chelátoru deferipronu v dávce 2–3 g denně 5 nemocným s hodnotami feritinu v séru > 2000 μg/l vedlo u 1 nemocné s PR na podávání rHuEPO k signifikantnímu poklesu hodnot feritinu v séru a zvýšení odpadu železa močí, u 3 dalších nemocných bylo dosaženo stabilizace hodnot feritinu v séru i při pokračujícím přívodu železa transfuzemi při nedostatečné odpovědi na rHuEPO.
Závěr:
Prediktivními hodnotami pro příznivou odpověď na podávání rHuEPO byly: iniciální hodnota EPO v séru < 100 IU/l, hodnota Hb > 85 g/l a závislost na podávání ≤ 2 TU erytrocytární masy měsíčně před zahájením léčby rHuEPO. U nemocných s kombinací těchto parametrů bylo dosaženo CR + PR v 89 %, což ukazuje na indikovanost podávání rHuEPO u této podskupiny nemocných s MDS typu RA. Podávání kombinace rHuEPO s G-CSF představuje finančně nákladnou léčbu a mělo by být vyhrazeno pro nemocné s MDS typu RARS a hladinou EPO v séru < 500 IU/l při současné závislosti na podávání ≤ 2 TU erytrocytární masy měsíčně.
Klíčová slova:
myelodysplastický syndrom – anémie – růstové faktory – erytropoetin – přetížení železem – chelatace
Úvod
Pro většinu nemocných s myelodysplastickým syndromem (MDS) je charakteristický různý stupeň cytopenie v periferní krvi kontrastující s buněčně bohatou kostní dření s dysplastickými rysy. Anémie je v době diagnózy přítomna u více než 50 % nemocných a téměř 80 % nemocných potřebuje během průběhu onemocnění transfuzi erytrocytární masy [4]. Zejména u nemocných s časnými formami choroby vzniká anémie jako důsledek inefektivní erytropoézy při současně vystupňované proliferaci a zvýšeném zániku (apoptóze) prekurzorů červené krevní řady náležejících k patologickému klonu. Erytropoetin (EPO) je glykoprotein o molekulární hmotnosti 30 400 D produkovaný z velké části ledvinami, jenž prostřednictvím vazby se specifickým receptorem na povrchu cílových buněk ovlivňuje produkci erytrocytů zejména cestou stimulace proliferace a inhibice apoptózy pozdních prekurzorů erytropoézy (tzv. CFU-E buněk) [21]. U nemocných s MDS je podávání EPO odůvodňováno jeho relativním nedostatkem při vystupňované erytropoéze, kdy farmakologická dávka hormonu může podporovat jak diferenciaci prekurzorů náležejících k patologickému klonu směrem ke zralým erytrocytům, tak proliferaci reziduální populace normálních prekurzorů červené řady [1,27]. Krom toho se předpokládá u časných forem choroby i tlumivý efekt EPO na zvýšený stupeň apoptózy progenitorových buněk. Příznivý efekt podávání rekombinantního lidského erytropoetinu (rHuEPO) však byl popsán pouze u 15-20 % nemocných s méně pokročilými formami MDS (RA - refrakterní anémie, RARS - refrakterní anémie se zmnožením prsténčitých sideroblastů, RAEB - refrakterní anémie s nadbytkem blastů) [16]. Řada studií se proto pokouší vzhledem k nákladnosti léčby přesněji charakterizovat nemocné, u nichž lze předpokládat efektivní léčbu rHuEPO, ať již v monoterapii, či v kombinaci s jinými růstovými faktory [5,19,23]. Ukazuje se, že prediktivní význam mají zejména stupeň anémie, hladina EPO v séru a frekvence podaných transfuzí erytrocytů nutných ke korekci anémie [17,18,26]. V naší práci uvádíme zkušenosti s podáváním rHuEPO nemocným s časnými stadii MDS, jež jsou sledováni v Ústavu hematologie a krevní transfuze v Praze.
Soubor nemocných a metodika
Do studie bylo zařazeno 20 nemocných s časnými stadii MDS s hodnotami Hb < 100 g/l, u 18 nemocných se jednalo o primární MDS, u 2 nemocných šlo o sekundární MDS vzniklý po předchozí léčbě karcinomu kombinací chemo - a radioterapie. Klasifikace nemocných byla provedena na základě morfologického vyšetření punktátu a bioptického vzorku kostní dřeně a na základě cytogenetického vyšetření pomocí rutinních metodik a molekulárně biologických technik (FISH - fluorescenční in situ hybridizace) detailně popsaných v souhrnné studii [11]. Hodnocení karyotypu bylo provedeno podle prognostických kritérií daných Mezinárodním prognostickým skórovacím systémem (IPSS) [13]. Při hodnocení nemocných podle francouzsko-americko-britské klasifikace (FAB) [2] bylo 18 nemocných klasifikováno jako RA a 2 nemocní jako RARS. Podle tzv. WHO klasifikace [15] splňovalo kritéria pro RA 11 nemocných, 4 nemocní byli zařazení do skupiny RCMD (refrakterní cytopenie s dysplazií ve více řadách), 4 nemocné splňovaly kritéria pro tzv. 5q-syndrom, 1 nemocná byla klasifikována jako RARS a 1 nemocná byla hodnocena jako RCMDs (refrakterní cytopenie s dysplazií ve více řadách se zmnožením prsténčitých sideroblastů). U všech nemocných byly před zahájením léčby a v intervalu 2 týdnů během léčby sledovány hodnoty krevního obrazu, hladiny železa v séru a feritinu v séru byly vyšetřovány před zahájením léčby a poté kontrolovány každé 4 týdny, hladiny EPO, vitaminu B12 a kyseliny listové v séru byly stanoveny před léčbou a po 12, resp. 24 týdnech léčby. U všech nemocných byly monitorovány základní biochemické parametry (jaterní testy, urea, kreatinin, kyselina močová, minerály v séru, glykemie) a hodnocen měsíční počet podaných transfuzí erytrocytů před zahájením léčby a v průběhu léčby rHuEPO. U všech nemocných byla sérologicky vyloučena spoluúčast imunní hemolytické anémie.
Rekombinantní lidský erytropoetin (přípravky Eprex, Cilag AG, Švýcarsko u 10 nemocných a NeoRecormon, Roche Diagnostic, SRN u 10 nemocných) byl podáván v dávce 150 IU/kg hmotnosti 3krát týdně po dobu 12 týdnů. U nemocné s RCMDs bylo vzhledem k těžké granulocytopenii podávání rHuEPO kombinováno s aplikací granulocytární kolonie stimulujícího faktoru (G-CSF, Neupogen, Amgen Europe, Nizozemí) v dávce 300 µg 3krát týdně. Odpověď na léčbu byla posuzována podle kritérií stanovených Hellströmovou [16] a Chesonem [8], jež jsou uvedena v tab. 1. U nemocných, kteří dosáhli kompletní (CR) či částečné odpovědi (PR), byl nadále podáván rHuEPO v udržovací dávce 150 IU/kg 1-3krát týdně. U nemocných s minimální odpovědí (MR) a u nemocných, kde došlo alespoň k vzestupu Hb o 5 g/l či ke snížení počtu podávaných transfuzí, bylo pokračováno v léčbě dávkou rHuEPO 150 IU/kg 3krát týdně po dobu dalších 12 týdnů a poté znovu hodnocen efekt léčby. U nemocných bez odpovědi na léčbu nebylo v podávání rHuEPO po 12 týdnech pokračováno.

U 5 nemocných s iniciální hladinou feritinu v séru vyšší než 2 000 µg/l byl současně podáván perorální chelátor deferiprone (Ferriprox, Apotex, Kanada) v dávce 2-3 g denně. Čtyři nemocné byly dlouhodobě léčeny malými dávkami kortikosteroidů (Prednison, Zentiva, ČR v dávce od 2,5 mg 2krát týdně do 10 mg denně).
Výsledky
Laboratorní nálezy u nemocných spolu s hodnocením odpovědi na léčbu rHuEPO po 12 týdnech jsou shrnuty v tab. 2. Kompletní odpověď (CR) byla pozorována u 4 nemocných (20 %), parciální odpověď (PR) byla přítomna u dalších 4 nemocných (20 %). Minimální odpověď (MR) hodnocená snížením počtu podávaných transfuzí o více než 50 % byla nalezena u 2 nemocných (10 %), u těchto nemocných a u dalších 6 nemocných, kde po léčbě došlo k vzestupu hodnot Hb ≥ 5 g/l či alespoň ke snížení počtu podávaných transfuzí erytrocytů, bylo pokračováno v podávání rHuEPO po dobu dalších 12 týdnů, ale u žádného z těchto nemocných nebyla po prolongovaném podávání léku pozorována CR či PR. U 4 nemocných nebyl pozorován žádný efekt podávání rHuEPO a léčba byla po 12 týdnech ukončena. U 1 nemocného (č. 10) byl dokonce po podávání rHuEPO pozorován výrazný pokles hodnot Hb, při sérologickém vyšetření se však u tohoto pacienta nepotvrdilo podezření na vznik protilátek proti EPO [6]. U nemocné s RCMDs (č. 4) vedlo kombinované podávání rHuEPO a G-CSF k trvalému vzestupu počtu neutrofilů nad 0,8 x 109/l, ale v červené řadě byla pozorována pouze minimální odpověď.
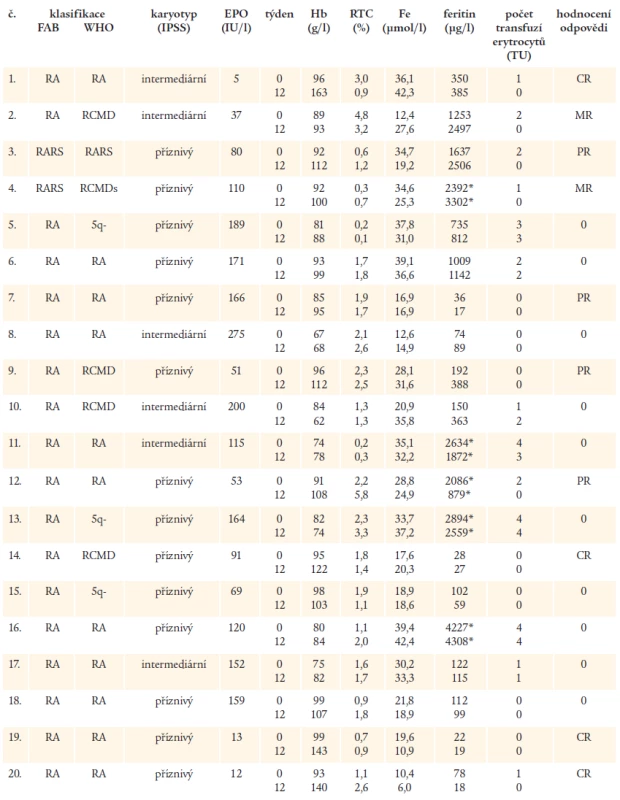
Při podrobnějším rozboru jednotlivých laboratorních parametrů bylo zjištěno, že u všech nemocných, kteří dosáhli CR či PR, byla iniciální hodnota Hb ≥ 85 g/l, naopak, u 8 z 12 nemocných s MR či bez odpovědi na léčbu mělo před léčbou hodnotu Hb < 85 g/l. Žádný z nemocných s CR či PR nepotřeboval před léčbou více než 2 TU erytrocytární masy měsíčně a 3 ze 4 nemocných s CR nebyli závislí na podávání transfuzí erytrocytů. Na druhé straně, u 4 nemocných transfundovaných 3-4 TU erytrocytární masy měsíčně nebyla přítomna ani MR na rHuEPO, pouze u 1 nemocné (č. 11) došlo ke snížení počtu transfuzí a u další nemocné k vzestupu Hb o 7 g/l (č. 5). Všech 8 nemocných s CR či PR mělo hodnotu EPO v séru před léčbou < 200 IU/l, z toho u 7 z nich byla iniciální hodnota EPO < 100 IU/l. Naopak, u 7 z 10 nemocných, kteří nedosáhli MR, byla vstupní hodnota EPO v séru > 150 IU/l a u 2 ze 4 nemocných, kteří vůbec neodpověděli na léčbu, byla hladina EPO v séru před léčbou ≥ 200 IU/l. U nemocné č. 12 s PR na podávání EPO došlo při současném podávání Ferriproxu k významnému poklesu hodnoty feritinu v séru a zvýšení odpadu železa močí, kromě toho, u dalších 3 nemocných byla při kombinovaném podávání rHuEPO a perorálního chelátoru pozorována stabilizace hodnot feritinu v séru i při trvajícím zatížení železem v důsledku opakovaných transfuzí malé odpovědi na EPO, u nemocné č. 4 musela být chelatační léčba přerušena pro nesnášenlivost přípravku.
Diskuze
Rekombinantní lidský erytropoetin je používán ke korekci anémie u nemocných s MDS od počátku 90. let minulého století [3]. V roce 1995 provedla Hellström-Lindbergová [16] metaanalýzu výsledků léčby v 17 studiích publikovaných do té doby, jako kritérium odpovědi na podávání rHuEPO byl hodnocen vzestup Hb ≥ 15 g/l či dosažení nezávislosti na podávání transfuzí erytrocytů. Při užití těchto kritérií byl efekt rHuEPO přítomen u 16 % nemocných, přičemž byl pozorován výrazný rozdíl mezi jednotlivými podskupinami (21,7 % u nemocných s RA a 22,7 % u nemocných s RAEB oproti 7,5 % nemocných s RARS). Nejdůležitějším faktorem ovlivňujícím odpověď na podávání EPO byla nezávislost na podávání transfuzí před léčbou, na léčbu odpovědělo příznivě více než 50 % těchto nemocných s jinou formou MDS než RARS. U nemocných nezávislých na podávání transfuzí a s hladinou EPO v séru < 200 IU/l byla pravděpodobnost příznivé odpovědi na podání EPO 44 % vs 10 % u ostatních nemocných. Naopak, nemocní s RARS závislí na transfuzích a s hladinou EPO v séru > 200 IU/l neodpověděli na léčbu EPO vůbec. Průměrná dávka rHuEPO se pohybovala okolo 450 IU/kg týdně a nebyly pozorovány výraznější rozdíly mezi efektem těchto dávek a stoupajícími dávkami až do 3 000 IU/kg týdně, největší procento odpovědí na léčbu bylo přítomno během prvých 8 týdnů podávání rHuEPO. Analýza německých autorů [12] hodnotící výsledky podávání rHuEPO 423 nemocným ve 27 studiích došla k podobným závěrům, efekt léčby byl přítomen u 24 % nemocných. V randomizované italské studii [20] mělo podávání rHuEPO v dávce 150 IU/kg/den signifikantní efekt na vzestup hodnot Hb oproti placebu, ale podle výše uvedených kritérií byl po 8 týdnech léčby účinek přítomen pouze u 13 % nemocných. Prediktivní význam pro odpověď na podávání EPO měla hladina EPO v séru < 200 IU/l a nárůst hladiny cirkulujících transferinových receptorů v séru o více než 18 % během prvých 4 týdnů léčby, nejlepší efekt byl pozorován u nemocných s RA. Při hledání cest vedoucích ke zlepšení účinku EPO bylo určitého úspěchu dosažení při podávání 300 IU místo 150 IU/kg/den (13 % vs 24 % odpovědí) [20], slibnější výsledky přinesla kombinace rHuEPO s G-CSF využívající synergistický efekt obou růstových faktorů na erytropoézu. Skandinávská studie [17] kombinující podávání rHuEPO v dávce 5 000 či 10 000 IU/den s G-CSF v dávce 30, 75 či 150 µg/den po dobu 12 týdnů prokázala efekt při hodnocení CR či PR dle identických kritérií jako v naší studii u 38 % nemocných, nejvýraznější efekt oproti monoterapii EPO byl přítomen u nemocných s RARS (odpověď u 46 % nemocných), méně u nemocných s RA (efekt u 20 % pacientů), obdobné výsledky přinesla studie Negrina et al (19 % CR u RA a 37,5 % CR u RARS) [25]. V recentní francouzské studii [7] odpovědělo 50 % nemocných s RA (17 % CR a 33 % PR) a 46 % nemocných s RARS (8 % CR a 38 % PR) na podávání rHUEPO (20 000 IU 3krát týdně + G-CSF 105 µg 3krát týdně po dobu 12 týdnů). Někteří autoři zdůrazňují význam prolongovaného podávání EPO, v řecké studii [28] vedlo podávání rHuEPO v dávce 150 IU/kg 3krát týdně po 26 týdnů k odpovědi u 30 % nemocných s RA v porovnání s 13 % odpovídajících po 12 týdnech léčby, ještě výraznější byl rozdíl u nemocných s RARS (42 % vs 4 %).
Výsledky naší studie prokazující účinek EPO (hodnocený dosažením CR či PR) u 40 % nemocných s časnými stadii MDS jsou ve shodě se závěry výše uvedených studií. Pro přesnější interpretaci výsledků je však nutno uvést, že u 2 nemocných s CR a u 1 nemocné s PR byly při podrobnějším klinickém a laboratorním vyšetření prokázány známky chronické ledvinné nedostatečnosti mírného stupně, tento nález může potencovat příznivý efekt exogenně dodaného EPO na krvetvorbu, i když snížená hladina EPO v séru byla přítomna pouze u nemocné č. 1. Při korekci hodnocení léčby o výše uvedené nemocné byl tedy efekt podávání rHuEPO pozorován u 25 % nemocných. Iniciální hodnota Hb, hladina EPO v séru a závislost či nezávislost na podávání transfuzí erytrocytů byly u našich nemocných důležitými faktory ovlivňujícími odpověď na podání EPO. Tyto nálezy se shodují se závěry analýzy dlouhodobého studia léčby anémie u MDS erytropoetinem v monoterapii či v kombinaci s G-CSF provedeného skandinávskou skupinou [18,19], na jejímž podkladě byla navržena jako indikační kritéria pro podávání kombinace EPO s G-CSF nemocným s méně rizikovými podtypy MDS (RA, RARS, RAEB < 10 % blastů) hodnota EPO v séru < 500 IU/l a potřeba méně než 2 TU erytrocytární masy měsíčně, přičemž nejlepší efekt je v této skupině předpokládán u nemocných s hladinou EPO v séru < 100 U/l, kde bylo CR dosaženo u 61 % nemocných [19]. Bowen et al [5] doporučují podávat rHuEPO u nemocných s RA a hodnotami EPO v séru < 200 IU/l při potřebě < 2 TU erytrocytární masy měsíčně v monoterapii, a teprve při nedostatečné odpovědi po 6 týdnech zvážit zdvojnásobení dávky EPO či přidání G-CSF, jenž je od počátku podáván pouze nemocným s RARS a hodnotou EPO v séru < 500 IU/l. Při takto zvolených kritériích nebyl u RA pozorován výrazný rozdíl v procentu CR mezi monoterapií rHuEPO a jeho kombinací s G-CSF, což je nutno brát v úvahu zejména vzhledem k finanční nákladnosti kombinované léčby, jež je více než 3krát dražší než podpůrná léčba [7]. Prolongované podávání stejné dávky EPO nezvýšilo u našich nemocných na rozdíl od jiných studií [28] procento odpovědí na léčbu, z ekonomických důvodů nebylo možno nemocným podávat dvojnásobnou dávku rHuEPO při nedostatečné odpovědi na iniciální léčbu, nicméně, řada autorů poukazuje na to, že pro efekt léčby je u nemocných s MDS rozhodující spíše hladina EPO v séru a závislost na transfuzích než výše podané dávky [12,16,18] a že u odpovídajících nemocných stačí k dlouhodobé stabilizaci hodnot Hb nižší udržovací dávky než při iniciální léčbě [19,24]. Vzhledem k tomu, že žádný z nemocných v naší skupině neměl prognosticky nepříznivé změny karyotypu, nebylo možno ověřit případné negativní ovlivnění odpovědi na EPO přítomností vícečetných chromozomálních aberací [26]. Naše studie pouze potvrdila již dříve pozorovaný malý efekt rHuEPO u nemocných s tzv. 5q-syndromem [19].
Mobilizační efekt podávání EPO na zásoby železa byl opakovaně popsán u nemocných s chronickou renální insuficiencí léčených rHuEPO [9] a je vysvětlován stimulací proliferace erytropoézy a stimulací tvorby a exprese transferinových receptorů na povrchu erytroidních prekurzorů [29]. Významná potenciace účinku chelátorů na nadbytečné zásoby současně podávaným EPO i při trvající závislosti na transfuzích již byla pozorována u nemocné s thalasemia maior [10], obdobný efekt byl přítomen i u nemocné č. 12 v současné studii, kde podávání Ferriproxu sice umožnilo stabilizaci hodnot feritinu v séru mezi 1800-2000 µg/l, avšak kombinace chelátoru s rHuEPO, jenž měl příznivý efekt na četnost podávaných transfuzí, vedla ke snížení hodnoty feritinu na 879 µg/l a k výraznému zvýšení odpadu železa močí potvrzujícímu synergizmus účinku obou léků na mobilizaci zásobního železa. Tento efekt na exkreci železa byl do určité míry vyjádřen i u ostatních nemocných léčených současně s rHuEPO perorálním chelátorem a může vysvětlovat pozorovanou stabilizaci hodnot feritinu v séru i při trvající zátěži transfuzemi erytrocytů.
Závěrem možno shrnout, že naše studie potvrdila oprávněnost podávání erytropoetinu vybraným nemocným s RA, u nichž lze příznivý efekt této nákladné léčby předvídat z hladiny EPO v séru < 200 IU/l při současné potřebě 2 či méně transfuzí erytrocytů za měsíc, na léčbu odpovědělo 57 % nemocných v této skupině. Z našich nálezů vyplývá, že nejlepší odpověď je možno očekávat u nemocných s RA nezávislých na podávání transfuzí, s hladinou EPO v séru < 100 IU/l a hodnotou Hb ≥ 85 g/l. U nemocných s kombinací těchto parametrů bylo CR či PR dosaženo v 89 %. Podávání kombinace rHuEPO s G-CSF představuje velmi nákladnou léčbu, jež by v současné době měla být zřejmě vyhrazena pro nemocné s RARS a hladinou EPO v séru < 500 IU při současné potřebě 2 či méně transfuzí erytrocytů za měsíc. V poslední době se ukazuje u nemocných s MDS jako perspektivní i podávání darbopoetinu [22] a čekáme na zhodnocení efektu podávání dlouhodobých stimulátorů exprese receptoru pro erytropoetin [14].
Práce vznikla v rámci grantového projektu NK/7713-3 Interní grantové agentury ministerstva zdravotnictví České republiky.
prim. MUDr. Jaroslav Čermák, CSc.
www.uhkt.cz
e-mail: cermak@uhkt.cz
Doručeno do redakce: 17. 1. 2005
Přijato po recenzi: 15. 3. 2005
Sources
1. Asano H, Ohashi H, Ichibara M et al. Evidence for nonclonal hematopoietic progenitor cell populations in bone marrow of patients with myelodysplastic syndromes. Blood 1994; 84 : 588-594.
2. Bennett JM, Catovsky D, Daniel MT et al. Proposals for the classification of the myelodysplastic syndromes. Br J Haematol 1982; 51 : 189-199.
3. Bowen D, Culligan D, Jacobs A. The treatment of anaemia in the myelodysplastic syndromes with recombinant human erythropoietin. Br J Haematol 1991; 77 : 419-423.
4. Bowen DT, Hellström-Lindberg E. Best supportive care for the anaemia of myelodysplasia: inclusion of recombinant erythropoietin therapy? Leuk Res 2001; 25 : 19-21.
5. Bowen D, Culligan D, Jowitt S et al. Guidelines for the diagnosis and therapy of adult myelodysplastic syndromes. Br J Haematol 2003; 120 : 187-200.
6. Casadevall N, Nataf J, Viron B et al. Pure red-cell aplasia and antierythropoietin antibodies in patients treated with recombinant erythropoietin. N Engl J Med 2002; 346 : 469-475.
7. Casadevall N, Durieux P, Dubois S et al. Health, economic, and quality-of-life effects of erythropoietin and granulocyte colony-stimulating factor for the treatment of myelodysplastic syndromes: a randomized, controlled trial. Blood 2004; 104 : 321-327.
8. Cheson BD, Bennett JM, Kantarjian H et al. Report of an international working group to standardize response criteria for myelodysplastic syndrome. Blood 2000; 96 : 3671-3674.
9. Čermák J, Brabec V, Indrák K. Combination of recombinant human erythropoietin and iron chelator L1 (deferiprone) in the treatment of iron overload in a patient with inherited hemoglobin disorder. Int J Hematol 1996; 64: S 35 (abstr).
10. Čermák J, Gregora E, Lachmanová J et al. Sledování zásob železa u nemocných s chronickým selháním ledvin léčených rekombinantním lidským erytropoetinem. Vnitř Lék 1994; 40 : 174-178.
11. Čermák J, Vítek A, Michalová K et al. Myelodysplastický syndrom v novém tisíciletí. Jak klasifikovat a léčit nemocné? Vnitř Lék 2005; 51 : 20-30.
12. Ganser A, Hoelzer D. Clinical use of hematopoietic growth factors in the myelodysplastic syndromes. Semin Hematol 1996; 33 : 186-195.
13. Greenberg P, Cox C, Le Beau MM et al. International scoring system for evaluation prognosis in myelodysplastic syndromes. Blood 1997; 89 : 2079-2088.
14. Haselbeck A, Bailon P, Pahlke W et al. The discovery and characterization of CERA, an innovative agent for the treatment of anemia. Blood 2002; 100 : 227a (abstr).
15. Harris NL, Jaffe ES, Diebold J et al. World Health Organization classification of neoplastic diseases of the hematopoietic and lymphoid tissues: report of the Clinical Advisory Committee Meeting - Airlie House, Virginia, November 1997. J Clin Oncol 1999; 17 : 3835-3849.
16. Hellström-Lindberg E. Efficacy of erythropoietin in the myelodysplastic syndromes: a meta-analysis of 205 patients from 17 studies. Br J Haematol 1995; 89 : 67-71.
17. Hellström-Lindberg E, Ahlgren T, Beguin Y et al. Treatment of anemia in myelodysplastic syndromes with granulocyte colony-stimulating factor plus erythropoietin: results from a randomized phase II study and long-term follow-up of 71 patients. Blood 1998; 92 : 68-75.
18. Hellström-Lindberg E, Negrin R, Stein R et al. Erythroid response to treatment with G-CSF plus erythropoietin for the anaemia of patients with myelodysplastic syndromes: proposal for a predictive model. Br J Haematol 1997; 99 : 344-351.
19. Hellström-Lindberg E, Gulbrandsen N, Lindberg G et al. A validated decision model for treating the anaemia of myelodysplastic syndromes with erythropoietin + granulocyte colony-stimulating factor: significant effects on quality of life. Br J Haematol 2003; 120 : 1037-1046.
20. Italian Cooperative Study for rHuEpo in myelodysplastic syndromes: A randomized double-blind placebo-controlled study with subcutaneous recombinant human erythropoietin in patients with low-risk myelodysplastic syndromes. Br J Haematol 1998; 103 : 1070-1074.
21. Koury MJ, Bondurant MC. Erythropoietin retards DNA breakdown and prevents programmed death in erythroid progenitor cells. Science 1990; 248 : 378-381.
22. Mannone L, Gardin G, Quarre MC et al. High response rate to darbopoietin alfa in “low risk” MDS: results of a phase II study. Blood 2004; 104 : 24a (abstr).
23. Miller AM, Noyes WE, Taetle R et al. Limited erythropoietic response to combined treatment with recombinant human interleukin 3 and erythropoietin in myelodysplastic syndrome. Leuk Res 1999; 23 : 77-83.
24. Musto P, Falcone A, Sanpaolo G et al. Efficacy of a single, weekly dose of recombinant erythropoietin in myelodysplastic syndromes. Br J Haematol 2003; 122 : 269-271.
25. Negrin RS, Stein R, Vardiman J et al. Treatment of the anemia of myelodysplastic syndromes using recombinant human granulocyte colony-stimulating factor in combination with erythropoietin. Blood 1993; 82 : 737-743.
26. Seipelt G, Ottmann OG, Hoelzer D. Cytokine therapy for myelodysplastic syndrome. Curr Opin Hematol 2000; 7 : 156-160.
27. Stein RS, Abels RI, Krantz SB. Pharmacologic doses of recombinant human erythropoietin in the treatment of myelodysplastic syndromes. Blood 1991; 78 : 1658-1663.
28. Terpos E, Mougiou A, Kouraklis A et al. Prolonged administration of erythropoietin increases erythroid response rate in myelodysplastic syndromes: a phase II trial in 281 patients. Br J Haematol 2002; 118 : 174-180.
29. Weiss G, Houston T, Kastner S et al. Regulation of cellular iron metabolism by erythropoietin: activation of iron-regulatory protein and upregulation of transferring receptor expression in erythroid cells. Blood 1997; 89 : 680-687.
Labels
Diabetology Endocrinology Internal medicineArticle was published in
Internal Medicine

2005 Issue 10
-
All articles in this issue
-
Fokální síňová tachykardie
Klinické projevy, místa vzniku a výsledky katetrové ablace - Srovnání katetrizační a chirurgické léčby defektu septa síní typu ostium secundum u dospělých pacientů
- Vysoká prevalence a špatná kontrola hypertenze v ordinacích praktických lékařů
- Prevalence a možné rizikové faktory rozvoje samoléčení antibiotiky v České republice
- Erytropoetin v léčbě nemocných s myelodysplastickým syndromem
- Význam L-karnitinu u pacientů s chronickým renálním selháním léčených hemodialýzou
- Úloha apoptózy u kardiovaskulárních onemocnění
- Protrombotický stav ako súčasť metabolického syndrómu
- Infekční endokarditida umělé mitrální chlopně
-
Diagnostika a léčba chronické hepatitidy B
Doporučený postup České hepatologické společnosti a Společnosti infekčního lékařství České lékařské společnosti J. E. Purkyně
-
Fokální síňová tachykardie
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue
-
Fokální síňová tachykardie
Klinické projevy, místa vzniku a výsledky katetrové ablace - Infekční endokarditida umělé mitrální chlopně
- Srovnání katetrizační a chirurgické léčby defektu septa síní typu ostium secundum u dospělých pacientů
- Protrombotický stav ako súčasť metabolického syndrómu
