Hormonální poruchy po úrazu mozku
Hormonal diseases after traumatic brain injury
Traumatic brain injury represents major medical and social problem in all developed countries. Its incidence is about 200 per 100 000 inhabitants per year. In the acute phase immediately after injury the posterior pituitary dysfunction is well known. The incidence of severe, grossly hypernatremic, cases of diabetes insipidus (DI) is about 3 %, les severe form of ADH insufficiency was recognized in 21-26 %. The syndrome of inappropriate antidiuretic hormone secretion (SIADH) was described in about 14 %. These changes are transient in most cases, persisting DI has an incidence of 5-7 % and SIADH cases recover almost always. Since the beginning of this century several series evaluating prospectively all patents after moderate a severe TBI have been published. The permanent hypopituitarism was found in one quarter to one half of them. The most common turned out to be the growth hormone (17.6 %) and gonadotropic (13.4 %) deficiency. Less common is the corticotropic (8.4 %) and thyrotropic (4.3 %) insufficiency. In the majority of patient an isolated dysfunction was discovered. In 9 %, however, a combined failure of two or more pituitary was present. This paper describes the minimum investigation needed to diagnose hypopituitary patient after TBI, who may profit from substitution therapy.
Key words:
traumatic brain injury - TBI - hypopituitarism - diagnosis - substitution
Authors:
J. Čáp
Authors‘ workplace:
II. interní klinika Lékařské fakulty UK a FN Hradec Králové, přednosta prof. MUDr. Jaroslav Malý, CSc.
Published in:
Vnitř Lék 2006; 52(10): 941-946
Category:
Review
Overview
Tupé poranění mozku představuje ve všech rozvinutých zemích závažný medicínský problém. Jeho incidence se odhaduje na 200 případů na 100 000 obyvatel ročně. V akutní fázi po úrazu jsou dobře známy poruchy neurohypofýzy. Těžký diabetes insipidus se vyskytuje asi ve 3 % případů, lehkou formu nedostatku antidiuretického hormonu (ADH) lze prokázat ve 21-26 %. Asi ve 14 % případů je přítomen syndrom nepřiměřené sekrece antidiuretického hormonu (SIADH). Tyto změny jsou většinou přechodné, permanentní diabetes zůstává v asi 5-7 %, SIADH se upraví prakticky vždy. Od počátku tohoto desetiletí bylo publikováno několik prací, ve kterých byla funkce adenohypofýzy vyšetřována systematicky u nemocných léčených pro středně těžké a těžké poranění mozku. Hypopituitarizmus je shodně popisován u čtvrtiny až poloviny pacientů, nejčastěji se jedná o nedostatečnou sekreci růstového hormonu (17,6 %) a gonadotropinů (13,4 %). Méně časté jsou insuficience kortikotropní (8,4 %) a tyreotropní (4,3 %). Většinou jde o poruchu izolovanou, ale asi u 9 % všech nemocných je zjišťována kombinovaná porucha dvou nebo více hypofyzárních os. Práce předkládá jednoduché vyšetřovací schéma doporučené výborem Endokrinologické společnosti České lékařské společnosti J. E. Purkyně. Má za cíle odhalil nemocné, u kterých substituce může zlepšit stav nemocných a napomoci rehabilitaci.
Klíčová slova:
poranění hlavy - hypopituitarismus - vyšetření - substituce
Úvod
Tupé poranění mozku představuje ve všech rozvinutých zemích závažný medicínský problém. Jeho incidence se odhaduje na 200 případů na 100 000 obyvatel ročně. Nejčastější příčinou jsou dopravní úrazy, a proto jsou nejpostiženější věkovou skupinou mladí ve věku 15-24 let s asi trojnásobnou převahou mužů [1]. Těžká poranění, vyžadující léčbu na jednotce intenzivní péče, tvoři asi 10 % úrazů, a úmrtnost se pohybuje od 23,6 na 100 000 obyvatel za rok v USA do 9/100 000 v Německu, kde poklesla z hodnoty 27,2/100 000 v roce 1972 na 9/100 000 v roce 2000 a přesouvá se do vyšších věkových kategorií [2].
Poranění mozku zanechává u přeživších vážné následky neurologické (motorické), kognitivní, emoční i sociální. Až polovina nemocných trpí depresí a třetina je ohrožena sebevražedným jednáním [3]. Dlouho je známo, že úraz mozku může být také příčinou poruchy funkce hypofýzy. První případ posttraumatického hypopituitarizmu byl popsán již v roce 1918 [4].
Mechanizmus vzniku hypopituitarizmu není zcela jasný. V akutní fázi se jistě podílí změny shodné u všech kritických stavů, zejména pokles gonadotropních funkcí, zejména testosteronu u mužů [5]. Poškození hypotalamu a hypofýzy může být způsobeno ischemickým poškozením, zejména při postižení portálního řečiště, které zásobuje většinu adenohypofýzy. Vaskulární hypotézu podporují pitevní nálezy, prokazující ischemické změny a krvácení v oblasti adenohypofýzy a její stopky u nemocných zemřelých krátce po poranění mozku [6]. Dalším možným mechanizmem je komprese otokem, při fraktuře baze lební, nebo při intrakraniální hypertenzi. Popsáno bylo také přímé mechanické postižení stopky [6,7].
Hormonální změny v akutním stadiu
Většina studií zabývajících se hormonálními změnami po úrazu mozku byla provedena s cílem definovat prognostické ukazatele. Hladina kortizolu většinou stoupá, v některých případech je dokonce nesuprimovatelná dexametazonem. Normalizace hyperkortizolemie v některých souborech předpovídala dobrou prognózu [8]. Korelace závažnosti poranění a prognózy s hladinami kortizolu jsou ale konfliktní a jak vysoké, tak nízké hladiny byly spojeny s horším výsledkem léčby [9]. Z praktického hlediska je důležité vyloučit v akutním stadiu sekundární nedostatečnost nadledvin. Parciální a přechodná insuficience byla zjištěna v některých sestavách až u poloviny nemocných s tím, že tyto případy měly nižší krevní tlak a vyžadovaly větší podporu katecholaminy [10]. Nedávná multicentrická, randomizovaná studie CRASH ovšem neprokázala přínos rutinního podávání metylprednisolonu na výsledek terapie, a dokonce zvýšila mortalitu v prvních dvou týdnech terapie [11]. Osa tyreotropní vykazuje v akutním stadiu změny charakteristické pro sick euthyreoid state, a centrální hypogonadizmus je také společný všem kritickým stavům.
Dobře známé jsou v akutní fázi po úrazu mozku poruchy neurohypofýzy. Těžký diabetes insipidus se vyskytuje asi ve 3 % případů, lehkou formu nedostatku antidiuretického hormonu (ADH) lze prokázat v 21-26 % [12] a frekvence výskytu koreluje se závažností úrazu [13]. Asi ve 14 % případů je přítomen syndrom nepřiměřené sekrece antidiuretického hormonu (SIADH) [14]. Diagnóza je dána změnami osmolality a sodíku v séru (natremie a osmolalita séra jsou zvýšené při diabetes insipidus, spolu s hypotonickou polyurií). Pro SIADH je diagnostická diluční hyponatremie, spojená s nepřiměřenou osmolalitou moči (> 100 mOsmol/kg) a koncentrací sodíku v moči nad 40 mmol/l. Nutno je vyloučit adrenální a tyreoidální insuficienci, která může podobný obraz vyvolat. Změny sekrece ADH v naprosté většině případů ustoupí do 6 měsíců po úrazu. Permanentní diabetes zůstává asi v 5-7 %, SIADH se upraví prakticky vždy [12,14].
Chronický posttraumatický hypopituitarizmus
Až do konce minulého století však byly popsány jen kazuistické případy posttraumatického hypopituitarizmu. Benvenga et al shromáždili 352 publikovaných případů, sami popsali dalších 15 nemocných [6].
Od počátku tohoto desetiletí bylo publikováno několik prací, kdy byla funkce hypofýzy vyšetřována systematicky u nemocných léčených pro středně těžké a těžké poranění mozku. Hypopituitarizmus je shodně popisován u čtvrtiny až poloviny pacientů. Výsledky publikovaných sestav shrnuje tab. 1. Metaanalýzu lze obtížně provést, protože byly zahrnuty případy s různě těžkým poraněním mozku, vyšetření bylo provedeno s odlišným odstupem od úrazu a metodika posouzení hypofyzárních funkcí se značně lišila. Celkem byla porucha funkce zjištěna ve 39 % případů, nejčastěji se jednalo o nedostatečnou sekreci růstového hormonu (17,6 %) a gonadotropinů (13,4 %) (tab. 1).
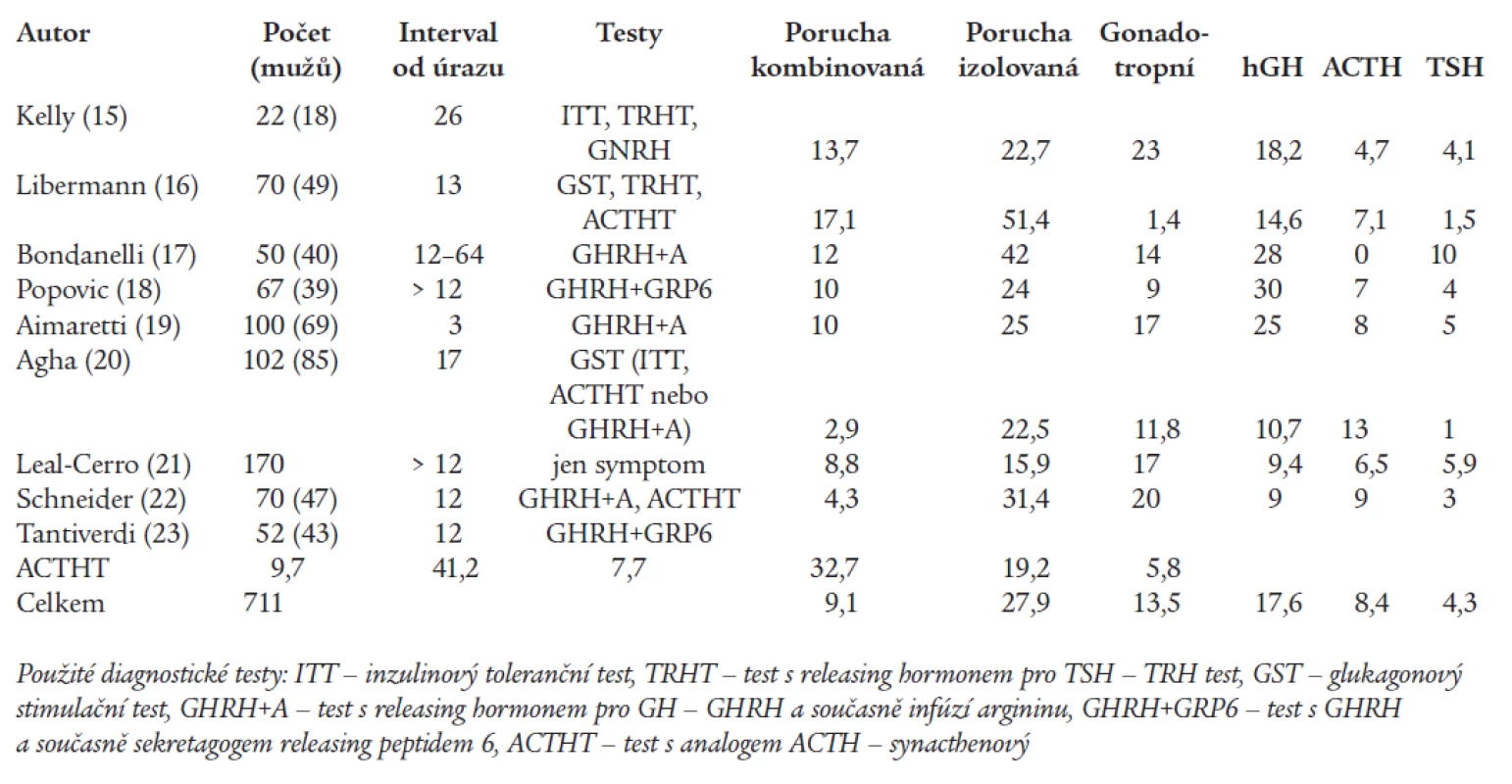
Insuficience růstového hormonu
Často jde o nedostatečnost izolovanou a parciální, u řádově 10 % nemocných však dosahuje stupně těžké insuficience, která je podle současných guidelines indikací k substituci. Protože je syndrom nedostatečné sekrece růstového hormonu spojen se sníženým pocitem zdraví, zvýšenou hladinu úzkosti, sklonem k depresi a sociální izolaci, sníženou výkonností a svalovou sílou [24], tedy příznaky, které se vyskytují i u nemocných po komoci mozku, předpokládá se, že substituce by mohla zlepšit jejich klinický stav. Tento předpoklad byl doložen několika kazuistickými případy [25]. Skupina Popovičové prokázala, že u nemocných po úrazu mozku hladina růstového hormonu při stimulačním testu pozitivně korelovala se schopností verbálního učení a s verbální krátkodobou pamětí [18,25]. Význam substituce u této konkrétní skupiny nemocných však dosud systematicky zkoumán nebyl [26].
Diagnóza nedostatečné sekrece růstového hormonu vyžaduje stimulační testy. Bazální hladina růstového hormonu je nepoužitelná a hladina inzulinu podobného růstového faktoru (IGF-I), respektive jeho vazebného proteinu 3 (IGFBP3), může upozornit na insuficienci GH v případě jasně snížené hodnoty. Je však nutno vyloučit snížení v důsledku nutričních vlivů a u značné části nemocných s těžkou insuficiencí GH je normální. Zlatým standardem pro diagnostiku je inzulinový toleranční test, kdy se intravenózním podáním inzulinu nalačno vyvolá hypoglykemie pod 2,2 mmol/l. Tento test je však pro řadu pacientů po úrazu mozku s možným sklonem k epileptickým záchvatům nevhodný. Alternativou je test s glukagonem a s infuzí argininu. Tyto látky však představují slabou stimulaci a mohou vést k falešně abnormálním výsledkům. Za optimální se dnes považuje kombinace argininu a releasing hormonu pro růstový hormon (GHRH), nebo argininu a sekretagogu růstového hormonu (GHRP). Tyto jsou však v našich podmínkách značně nákladné [24].
Insuficience gonadotropní
V kazuistických souborech se vyskytoval hypogonadizmus u nemocných s poruchou funkce hypofýzy po úrazu mozku prakticky ve 100 % [6]. V souborech, ve kterých jsou prospektivně vyšetřeny všechny případy po traumatu mozku, je diagnostikován ve 2-23 %. Rozdíly ve výskytu je možno vysvětlit výběrem nemocných, časováním vyšetření po úrazu a různými diagnostickými kritérii. Použití stimulačních testů může výskyt přecenit, postačující pro diagnózu jsou bazální hladiny testosteronu, volného testosteronu a sexuální hormony vážícího globulinu (SHBG) u mužů. U žen je důležitým ukazatelem menstruační cyklus, estradiol a gonadotropiny [27]. Není pochyb o tom, že prokázaný hypogonadizmus u mužů v každém věku a u žen v premenopauzálním věku je indikací k substituci. Insuficience testosteronu je spojena se svalovou slabostí, snížením aktivní svalové hmoty a tolerance zátěže. U obou pohlaví potom predisponuje ke vzniku osteoporózy. Tyto negativní konsekvence jsou potencovány imobilitou po úrazu a dalšími hormonální deficity, zvláště nedostatečnou sekrecí růstového hormonu. U hypogonádních nemocných vede substituce ke snížení únavnosti a podrážděnosti, zvýšení sebevědomí a libida, k vzestupu svalové hmoty, síly a kostní hmoty. Lze předpokládat, že substituce u nemocných po úrazu mozku zlepší výsledky rehabilitace, i když efekt substituce na soubor nemocných s touto specifickou příčinou hypogonadizmu dosud publikován nebyl [27].
Insuficience kortikotropní
Trvalá insuficience kortikotropní je méně častá než relativní insuficience v akutní fázi úrazu. Jak vyplývá z tab. 1, zjištěný výskyt se značně liší od 0 do 19 %. Rozdíly jsou zřejmě dány především metodikou vyšetření. Pokud není bazální hladina sérového kortizolu vysloveně nízká, je pro diagnózu nezbytný stimulační test. Zlatým standardem je opět test inzulinový, který často není vhodný, jak bylo uvedeno výše. Glukagonový test incidenci nadhodnocuje. Při použití glukagonového testu zjistili Agha et al kortikotropní insuficienci u 22,4 % nemocných po úrazu mozku, inzulinovým nebo Synacthenovým testem byla však potvrzena jen u poloviny z nich [20]. Není pochyb o tom, že sekundární hypokorticizmus vyžaduje substituci hydrokortizonem, těžší insuficience trvalou, parciální potom jen při stresových situacích.
Tyreotropní nedostatečnost
Trvalá sekundární hypotyreóza je zřejmě nejméně častou poruchou. Jakkoliv v některých souborech byla popsána až v 10 %, průměr publikovaných sestav představuje 4 % (tab. 1). Hypotyreóza zhoršuje kvalitu života nemocných a zejména vyhlídky rehabilitace svými projevy somatickými (bolesti kloubů, svalů) i psychickými - apatie, ztráta zájmu. Pro diagnostiku je nepoužitelná, ba zavádějící hladina TSH. Stimulační test s tyreotropin releasing hormonem (TRH) není nezbytný. Postačující je (opakovaně) snížená hladina volného tyroxinu v séru.
Koho testovat
Vzhledem k velkému výskytu úrazů hlavy není možné nikde na světě provádět u každého takového nemocného kompletní endokrinologické vyšetření včetně stimulačních testů. Všeobecně se proto ustálil konsenzus na tom, že z vyšetření mohou být vyloučeni nemocní s velmi těžkým poraněním a ve vegetativním stavu. Na druhém pólu potom případy s velmi mírným poraněním (Glasgow Coma Scale > 13). Toto omezení je dáno snahou sestředit dostupné zdroje na skupinu s větší pravděpodobností endokrinní poruchy. Je však známo, že i závažný hypopituitarizmus může vzniknout i po velmi mírném úrazu, na který si nemocný často při následném vyšetření nevzpomene [28]. V těchto případech je však nutno se omezit na klinické vyšetření. Výjimku představují nemocní s radiologickými známkami poškození mozku.
Kdy vyšetřovat
Časový faktor je velmi důležitý. Dva soubory nemocných byly opakovaně vyšetřeny za 3 měsíce a za 12 měsíců po úrazu [22,29]. Shodně se ukázalo, že hypopituitarizmus se může po 3 měsících upravit, frekvence postižení za rok byla poněkud nižší. Toto zjištění nepřekvapuje, protože změny po úrazu mozku se mohou reparovat. Poněkud překvapující je další shodné zjištění, že mezi 3 a 12 měsíci po úrazu se mohou objevit nové deficity. Snad jde o úrazem vyvolanou zánětlivou reakci, která může vyvolat další poškození a retrográdní axonální degeneraci vedoucí k odumření neuronu. Definitivní endokrinologické vyšetření by proto nemělo být provedeno dříve než za rok po úrazu [28].
Jak vyšetřovat
Výbor Endokrinologické společnosti vydal doporučení, které má za cíl co nejvíce zjednodušit vyšetření, aby bylo dostupné pro všechny indikované nemocné (tab. 2). Není vyloučeno, že některé parciální deficity, zejména růstového hormonu, nebudou zachyceny, ale podrobné vyšetření všech pacientů stimulačními testy není reálné.

Záhy po úrazu (nejpozději při propuštění z nemocnice) by měla být vyšetřena hladina volného tyroxinu, kortizolu a samozřejmě natremie a sledována diuréza.
Je-li hladina plazmatického kortizolu jasně snížená (pod 300 nmol/l), doporučujeme zahájit substituci hydrokortizonem v substituční dávce 20 mg denně. Při hladině nad 500 nmol/l, tedy jasně normální, není dalších opatření potřeba. Je-li kortizolemie v rozmezí 300-500 nmol/l, měl by být nemocný vybaven upozorněním, že je indikace k substituci kortikoidy při jakékoliv stresové situaci. Je-li volný tyroxin < 8 pmol/l, tedy jasně snížený, je indikace (po vyšetření TSH k vyloučení primární hypotyreózy) k zahájení substituce tyroxinem.
Za 6 a 12 měsíců po úrazu je potom vhodné podrobnější vyšetření uvedené v tab. 3.

Pokud je nemocnému podávána substituce, odebíráme kortizolemii za 24 hodin po poslední dávce hydrokortizonu. Je-li hladina pod 100 nmol/l, je jasně nutno v substituci pokračovat. Je-li nad 500 nmol/l, je kortikotropní insuficience vyloučena. Při hladině mezi 100 a 500 nmol/l je žádoucí provést stimulační test s analogem ACTH Synacthenem.
Pro diagnózu gonadotropní a tyreotropní insuficience postačí bazální hladiny a při opakovaně abnormálním výsledku je indikována substituce.
Stimulační test na růstový hormon je indikován v těchto případech:
- jakákoliv porucha hypotalamo-hypofyzární:
- diabetes insipidus
- insuficience gonadotropní
- insuficience tyreotropní
- insuficience kortikotropní
- opakované významné zvýšení PRL.
- a/nebo snížená hladina IGF-I
- a/nebo klinické podezření.
Závěr
Úrazy mozku jsou velmi časté a představují závažný problém medicínský a společenský. Výzkumy posledních 6 let prokazují, že porucha neuroendokrinních funkcí je častější, než jsme předpokládali. Zavedení jednoduchého vyšetřovacího postupu, který by odhalil nemocné, u kterých substituce může zlepšit stav a napomoci rehabilitaci, je velmi žádoucí. Bude to ale možné jen při informovanosti a spolupráci všech lékařů, kteří o tyto pacienty pečují.
Podpořeno projektem „Výzkumné záměry“ MSM 0021620820.
doc. MUDr. Jan Čáp, CSc.
www.lfhk.cz
e-mail: capj@lfhk.cuni.cz
Doručeno do redakce: 20. 6. 2006
Sources
1. Bondanelli M, Ambrosio MR, Zatelli MC et al. Hypopituitarism after traumatic brain injury. Eur J Endocrinol 2005; 152 : 679-691.
2. Leon-Carrion J, Dominguez-Morales M del R, Barroso Y et al. Epidemiology of traumatic brain injury and subarachnoid hemorrhage. Pituitary 2005; 8 : 197-202.
3. Leon-Carrion J, De Serdio-Arias ML, Cabezas FM et al. Neurobehavioural and cognitive profile of traumatic brain injury patients at risk for depression and suicide. Brain Inj 2001; 15 : 175-181.
4. Cyran E. Hypophysenschädigung durch Schädelbasisfraktur. Deutsch Med Wochenschr 1918; 44 : 1261.
5. Van den Berghe G. Novel insights into the neuroendocrinology of critical illness. Eur J Endocrinol 2000; 143 : 1-13.
6. Benvenga S, Campenni A, Ruggeri RM et al. Clinical review 113: Hypopituitarism secondary to head trauma. J Clin Endocrinol Metab 2000; 85 : 1353-1361.
7. Yuan XQ, Wade CE. Neuroendocrine abnormalities in patients with traumatic brain injury. Front Neuroendocrinol 1991; 12 : 209-230.
8. Agha A, Thompson CJ. Anterior pituitary dysfunction following traumatic brain injury (TBI). Clin Endocrinol (Oxf) 2006; 64 : 481-488.
9. Schneider M, Schneider HJ, Stalla GK. Anterior pituitary hormone abnormalities following traumatic brain injury. J Neurotrauma 2005; 22 : 937-946.
10. Cohan P, Wang C, McArthur DL et al. Acute secondary adrenal insufficiency after traumatic brain injury: a prospective study. Crit Care Med 2005; 33 : 2358-2366.
11. Roberts I, Yates D, Sandercock P et al. Effect of intravenous corticosteroids on death within 14 days in 10008 adults with clinically significant head injury (MRC CRASH trial): randomised placebo-controlled trial. Lancet 2004; 364 : 1321-1328.
12. Tsagarakis S, Tzanela M, Dimopoulou I. Diabetes insipidus, secondary hypoadrenalism and hypothyroidism after traumatic brain injury: clinical implications. Pituitary 2005; 8 : 251-254.
13. Agha A, Thornton E, O'Kelly P et al. Posterior pituitary dysfunction after traumatic brain injury. J Clin Endocrinol Metab 2004; 89 : 5987-5992.
14. Agha A, Sherlock M, Phillips J et al. The natural history of post-traumatic neurohypophysial dysfunction. Eur J Endocrinol 2005; 152 : 371-377.
15. Kelly DF, Gonzalo IT, Cohan P et al. Hypopituitarism following traumatic brain injury and aneurysmal subarachnoid hemorrhage: a preliminary report. J Neurosurg 2000; 93 : 743-752.
16. Lieberman SA, Oberoi AL, Gilkison CR et al. Prevalence of neuroendocrine dysfunction in patients recovering from traumatic brain injury. J Clin Endocrinol Metab 2001; 86 : 2752-2756.
17. Bondanelli M, De Marinis L, Ambrosio MR et al. Occurrence of pituitary dysfunction following traumatic brain injury. J Neurotrauma 2004; 21 : 685-696.
18. Popovic V, Pekic S, Pavlovic D et al. Hypopituitarism as a consequence of traumatic brain injury (TBI) and its possible relation with cognitive disabilities and mental distress. J Endocrinol Invest 2004; 27 : 1048-1054.
19. Aimaretti G, Ambrosio MR, Di Somma C et al. Traumatic brain injury and subarachnoid haemorrhage are conditions at high risk for hypopituitarism: screening study at 3 months after the brain injury. Clin Endocrinol (Oxf) 2004; 61 : 320-326.
20. Agha A, Rogers B, Sherlock M et al. Anterior pituitary dysfunction in survivors of traumatic brain injury. J Clin Endocrinol Metab 2004; 89 : 4929-4936.
21. Leal-Cerro A, Flores JM, Rincon M et al. Prevalence of hypopituitarism and growth hormone deficiency in adults long-term after severe traumatic brain injury. Clin Endocrinol (Oxf) 2005; 62 : 525-532.
22. Schneider HJ, Schneider M, Saller B et al. Prevalence of anterior pituitary insufficiency 3 and 12 months after traumatic brain injury. Eur J Endocrinol 2006; 154 : 259-265.
23. Tanriverdi F, Senyurek H, Unluhizarci K et al. High risk of hypopituitarism after traumatic brain injury: a prospective investigation of anterior pituitary function in the acute phase and 12 months after trauma. J Clin Endocrinol Metab 2006; 91 : 2105-2111.
24. Čáp J. Deficit růstovéh hormonu v dospělosti. Interní medicína pro praxi 2005; 5 : 237-240.
25. Springer J, Chollet A. A traumatic car crash. Lancet 2001; 357 : 1848.
26. Popovic V. GH Deficiency as The Most Common Pituitary Defect After TBI: Clinical Implications. Pituitary 2005; 8 : 239-243.
27. Agha A, Thompson CJ High risk of hypogonadism after traumatic brain injury: clinical implications. Pituitary 2005; 8 : 245-249.
28. Lorenzo M, Peino R, Castro AI et al. Hypopituitarism and growth hormone deficiency in adult subjects after traumatic brain injury: who and when to test. Pituitary 2005; 8 : 233-237.
29. Aimaretti G, Ambrosio MR, Di Somma C et al. Residual pituitary function after brain injury-induced hypopituitarism: a prospective 12-month study. J Clin Endocrinol Metab 2005; 90 : 6085-6092.
Labels
Diabetology Endocrinology Internal medicineArticle was published in
Internal Medicine

2006 Issue 10
-
All articles in this issue
-
Změny v zásobení jodem české dospělé populace po eradikaci jodového deficitu a jejich příčiny
Randomizovaná studie dospělé populace dvou regionů České republiky s odstupem 5 let - Tyreoidální autoimunita u dospělých diabetiků 1. typu. Vlastní zkušenosti z 11letého sledování
- Jod a tyreoidální hormony
- Autoimunitní tyreoiditida: vybrané etiopatogenetické mechanizmy
- Mechanizmus vnútrobunkového pôsobenia hormónov štítnej žľazy
- Hormonální poruchy po úrazu mozku
- Hashimotova encefalopatie
- Kongenitální adrenální hyperplazie na podkladě deficitu 3-β-hydroxysteroidní dehydrogenázy
- Subklinické tyreopatie
- Radionuklidové zobrazovací metody používané v endokrinologii
- Přirozené antiglukokortikoidy
- Příspěvek k diskusi o vzájemném vztahu mezi onemocněním mléčné a štítné žlázy
- Testosteron v léčbě svalové slabosti
- Nádory štítné žlázy a Hirschsprungova choroba: desetileté zkušenosti s molekulárně genetickou diagnostikou RET proto-onkogenu
-
Změny v zásobení jodem české dospělé populace po eradikaci jodového deficitu a jejich příčiny
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue
- Hashimotova encefalopatie
- Radionuklidové zobrazovací metody používané v endokrinologii
- Autoimunitní tyreoiditida: vybrané etiopatogenetické mechanizmy
- Kongenitální adrenální hyperplazie na podkladě deficitu 3-β-hydroxysteroidní dehydrogenázy
