Ubikvitiny, proteazomy, sumoylace a použití dnes a zítra v terapii nádorů i jiných chorob I. Ubikvitin-proteazomový systém a transkripční faktor NF-κB
Ubiquitins, proteasomes, sumoylation and application today and in future for cancer and other diseases therapy I. Ubiquitin-proteasome system and the transcription factor NF-κB
Proteasome is protein complex with proteolytic activity. Proteasomes are in addition to lysosomes the main proteolytic machinery of the eukaryotic cell. Proteins destined for degradation in proteasomes are marked by ubiquitinylation, which consists in attachment of polyubiquitin to relevant protein. The transport of polyubiquitinylated protein follows to proteasome, where protein is cleaved into small peptides. Besides polyubiquitin attachment to protein, monoubiquitinylation of proteins exists and has an important role in DNA repair, transcription of genes, endocytosis and signal transduction. The function of an important transcription factor NF-κB is connected with proteasome. NF-κB is activated after the proteolysis of its inhibitor IκB in proteasome. Ubiqutinylation and degradation of protein in proteasome and the activation of NF-κB play significant roles in taking proteins away and in expression of great numbers of genes important for the regulation of the cell cycle and apoptosis of cells. The inhibition of proteasomes has antiproliferative and antiinflammatory effects and opens new therapeutic approaches to a treatment of cancer and some inflammatory diseases. We divided the review into three parts: I. Ubiquitin-proteasome system and the transcription factor NF-κB, II. Sumoylation and neddylation as post-translational modification of proteins similar to ubiquitinylation and their significance and lastly III. Using of the knowledge of ubiquitin-proteasome system in cancer and other diseases therapy.
Key words:
ubiquitin - proteasome - transcription factor NF-κB
Authors:
O. Fuchs 1; R. Neuwirtová 2
Authors‘ workplace:
Ústav hematologie a krevní transfuze, Praha, ředitel prof. MUDr. Pavel Klener, DrSc.
1; I. interní klinika 1. lékařské fakulty UK a VFN, Praha, přednosta prof. MUDr. Pavel Klener, DrSc.
2
Published in:
Vnitř Lék 2006; 52(4): 371-378
Category:
Review
Overview
Proteazom je bílkovinný komplex s proteázovou aktivitou. Proteazomy jsou vedle lyzozomů hlavním proteolytickým aparátem každé eukaryotické buňky. Proteiny určené k rozkladu jsou označeny tzv. ubikvitinylací, která spočívá v připojení polyubikvitinu k příslušnému proteinu. Následuje transport takto modifikovaného proteinu k proteazomu, ve kterém je protein rozložen na krátké peptidy. Vedle připojení polyubikvitinu k proteinu existuje i monoubikvitinylace proteinů, která hraje důležitou úlohu v opravě DNA, transkripci genů, endocytóze a přenosu signálu. S proteazomem je spojena funkce významného transkripčního faktoru NF-κB, který je aktivován po proteolýze jeho inhibitoru IκB v proteazomu. Ubikvitinylace a odbourávání proteinu v proteazomu a dále aktivace NF-κB hrají důležitou roli v odklízení proteinů a v expresi řady genů důležitých v regulaci buněčného cyklu a apoptózy buněk. Inhibice proteazomů má antiproliferační a protizánětlivý účinek a otevírá tak nové terapeutické přístupy v léčbě nádorů a některých zánětlivých stavů. Přehled jsme rozdělili do tří kapitol, a to I. Ubikvitin-proteazomový systém a transkripční faktor NF-κB, II. Sumoylace a neddylace jako posttranslační modifikace proteinů podobné ubikvitinylaci a jejich význam, a konečně III. Využití poznatků v ubikvitin-proteazomovém systému v terapii nádorů i dalších chorob.
Klíčová slova:
ubikvitin - proteazom - transkripční faktor NF-κB
Úvod
Proteazomy se vyskytují ve všech eukaryotických buňkách, v kterých zajišťují z velké části proteolýzu. Selektivně rozkládají některé regulační proteiny a podílejí se na celé řadě základních funkcí buněk. Proteazomy, známé též pod názvy prozomy nebo multikatalytické proteinázy, objevil Harris [1] koncem 60. let 20. století při elektronmikroskopickém studiu proteinových částic v extraktech lidských erytrocytů. Arrigo et al [2] zavedli v roce 1988 termín proteazomy, který odpovídá mikročásticím, „tělískům“ ve tvaru válce s aktivitou proteáz. Vyskytují se už u archebakterií rodu Thermoplasma acidophilium. Sekvenční shoda podjednotek proteazomů těchto bakterií a proteazomů lidských dosahuje až 40 % [3]. Ztráta funkce proteazomů mutací jejich složek u kvasinek byla pro buňky letální. Stejného důsledku, tj. smrti buňky, lze dosáhnout u buněk savců pomocí specifických inhibitorů proteazomu.
Proteazomy jsou úzce spjaty se systémem ubikvitinů. Ubikvitin byl izolován již v roce 1975 skupinou Goldsteina [4]. Ještě v roce 1984 bylo publikováno méně než 100 prací s klíčovým slovem ubikvitin. Dnes je výzkum v této oblasti daleko rozsáhlejší; svědčí o tom asi 1 000 publikací v roce 2003. Za objev mechanizmu označení proteinů určených k rozkladu v proteazomu polyubikvitinem [5-9] byli v roce 2004 odměněni Nobelovou cenou za chemii Aaron Ciechanover a Avram Hershko z Izraele a Irwin Rose z USA. Jejich objev bude moci být využit k výrobě léků proti mnohým onemocněním.
Ubikvitin a ubikvitinylace
Ubikvitiny jsou malé polypeptidy (76 aminokyselinových zbytků), které jsou přítomny ve všech studovaných eukaryotických buňkách a tkáních. Termín ubikvitin pochází z latinského slova všudypřítomný. Sekvence aminokyselin ubikvitinu je velmi konzervativní a liší se jen ve 3 aminokyselinových zbytcích mezi ubikvitinem kvasinek a člověka. Ubikvitin je kódován genem pro polyubikvitin, kde sekvence kódující několik ubikvitinů následují za sebou bez intronů (vložených nekódujících sekvencí) [10]. Ubikvitin je však také kódován fúzními geny s informací jak pro ubikvitin, tak pro malé ribozomální podjednotky [11]. V buňkách se ubikvitin nachází jen ve formě jednoho proteinu (monoubikvitin).
Proteazom-ubikvitinová cesta (ubiquitin-proteasome pathway) spočívá ve čtyřstupňové enzymatické kaskádě, ve které dochází za použití ATP a energie k označení proteinu, určeného pro rozklad v proteazomu [9,12-14], jak ukazuje obr. 1. Enzym E1 (aktivující enzym) aktivuje C-konec bílkoviny ubikvitinu a tvoří s ní meziprodukt E1-ubikvitin. Aktivovaný ubikvitin je přemístěn z E1 na thiolovou skupinu konjugačního enzymu E2. Ve třetím stupni se ubikvitin připojí na ubikvitinligázu E3, která už specificky rozpoznává bílkovinný substrát, tedy protein určený k degradaci. C-konec ubikvitinu je potom spojen s 6-aminoskupinou lyzinu v proteinu, určeném k proteolýze. Na protein musí být napojeny další molekuly ubikvitinu, což je úloha elongačního faktoru E4 [15]. Ubikvitin obsahuje 7 lyzinových zbytků. Jeden z nich (Lys-48) je použit k připojení dalších molekul ubikvitinu při polyubikvitinylaci [16]. Polyubikvitin je složen z minimálně 4 ubikvitinů. Teprve po připojení více ubikvitinů, minimálně jakéhosi „čtyřspřeží“ ubikvitinů, tzv. polyubikvitinu, je bílkovina určená k proteolýze rozpoznána a dopravena k proteazomu (obr. 1). Do proteazom-ubikvitinového systému patří i rodina deubikvitinylačních enzymů, které odštěpují ubikvitin ze substrátu [17-19]. Ovlivňují stabilitu ubikvitinem označených proteinů a hladinu volného ubikvitinu.
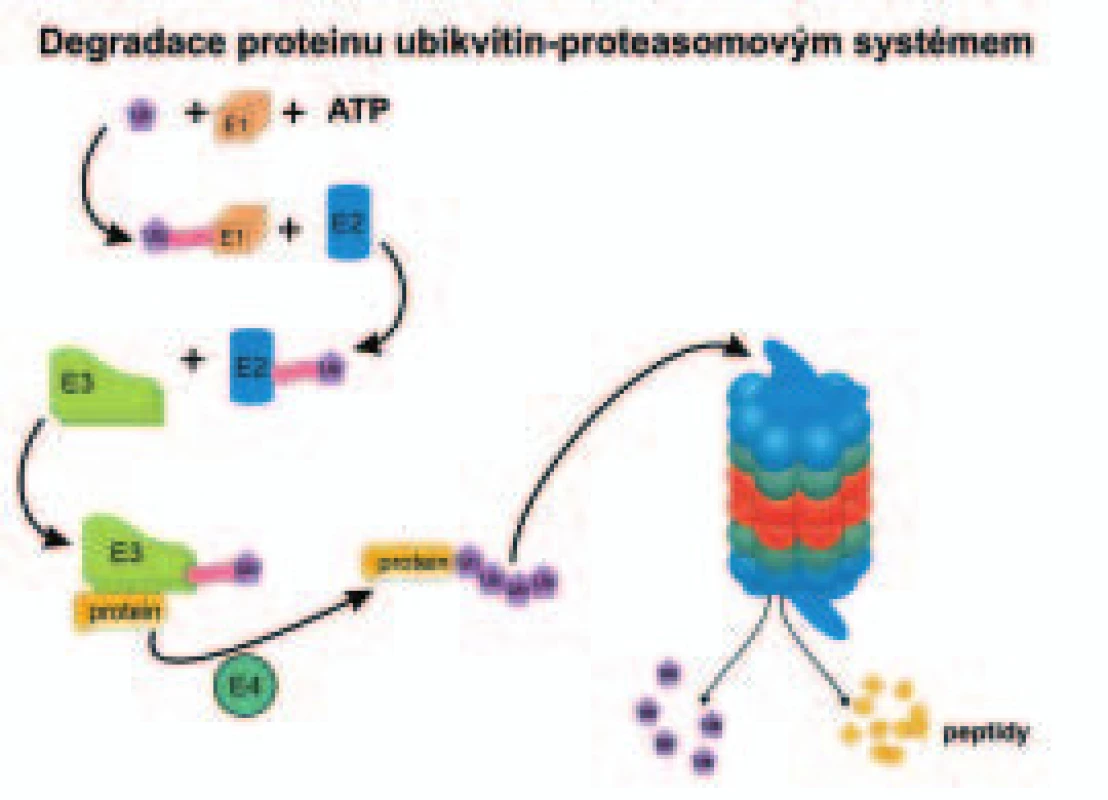
Ubikvitinligázy (E3) jsou velmi početnou heterogenní skupinou proteinů, které umožňují najít a specificky označit polyubikvitinem určité proteiny určené k proteolýze. Pravděpodobnost, že menší skupina proteinů nebo dokonce jednotlivé proteiny mají svou vlastní ubikvitinligázu, dává naději pro vývoj inhibitoru pro velmi cílenou a specifickou terapii. Projekt sekvenace lidského genomu ukázal přítomnost více než 40 různých enzymů E2, přes 500 enzymů E3 a více než 80 různých deubikvitinylačních enzymů [20]. Pro značnou část proteinů, určených k degradaci v proteazomech, zatím neznáme rozpoznávací znaky. Obecně si např. představujeme, že v systému ubikvitin-proteazom je rozpoznávána změna konformace bílkoviny, která splnila svou funkci a má být rozložena. Nejde však jen o odklízení „starých“ bílkovin, ale ubikvitin-proteazomový systém je důležitý pro splnění některých fyziologických funkcí v buňce. Pro některé z těchto procesů už známe mechanizmy, které určují proteolýzu cílové bílkoviny nebo naopak chrání takovou bílkovinu před degradací. Zde uvádíme tři příklady.
- Proteiny s krátkou životností obsahují specifické degradační signály („degrony“), často označované také jako destrukční box. Tato N-koncová sekvence je signálem pro ubikvitinylaci a následnou degradaci v proteazomu [21-25]. Uvedená sekvence obsahuje bazické a hydrofobní aminokyseliny, které destabilizují protein podle tzv. pravidla N-konce [24-26]. Ubikvitinylace podle pravidla N-konce probíhá např. u C-koncového fragmentu kohezinu během mitózy [27]. Kohezin spojuje dvě sesterské chromatidy, které musí být odděleny během mitózy a stávají se na sobě nezávislými dceřinými chromozomy. Při ubikvitinylaci cyklinů, uvádějících buňku do cyklu, je důležitá krátká sekvence 9 aminokyselin na N-konci těchto bílkovin (destrukční box). Tato sekvence je rozpoznávána ubikvitinligázou E3 a molekula cyklinu může být odbourána. Tím končí fáze dělení buňky.
- V degradaci transkripčního faktoru HIF-1α (hypoxia-inducible transcription factor 1 α) hraje úlohu hydroxylace tohoto proteinu. HIF-1α reaguje na hladinu kyslíku. Při normálních hladinách kyslíku je životnost α-subjednotky tohoto faktoru velmi krátká (méně než 5 minut). E3-ubikvitinligáza rozpoznává hydroxylaci HIF-1α na prolinovém zbytku (Pro564) a rychle uvádí tento protein do proteolýzy [28]. Naopak při hypoxii nedochází k hydroxylaci prolinového zbytku faktoru HIF-1α, a tím ani ne k jeho proteolytické degradaci. Subjednotka HIF-1α se spojí se subjednotkou β, faktor se přemístí z cytoplazmy do jádra, kde aktivuje transkripci genů pro erytropoetin, transferinový receptor, vaskulární endoteliální růstový faktor a další geny indukované hypoxií.
- Fosforylace je další modifikací proteinu určeného k degradaci. Fosforylace dvou specifických serinových zbytků na IκB (inhibitoru transkripčního faktoru NF-κB) pomocí IKK (kináza IκB) je předpokladem pro rozpoznání tohoto proteinu enzymem E3 nebo-li ubikvitinligázou [29]. Ubikvitinylovaný inhibiční faktor IκB je potom v proteazomu odbourán. Obdobně fosforylace dvou aminokyselinových zbytků (treoninu a serinu) c-myc vede k rozpoznání tohoto proteinu enzymem E3 nebo-li ubikvitinligázou a k degradaci v proteazomech [30].
Je třeba upozornit, že fosforylace může mít i opačný efekt např. v případě proteinu p53. V odpovědi na poškození DNA je p53 fosforylován. Fosforylovaná forma proteinu p53 se nemůže vázat s ligázou E3 [31]. Protein p53 je stabilizovaný a může splnit svou úlohu uvést do apoptózy potencionálně maligní buňku.
Transkripční faktor NF-κB
Ubikvitin-proteazomový systém je úzce spjat s aktivací transkripčního faktoru NF-κB (nukleární faktor κB). Aktivace transkripčního faktoru NF-κB je vázána na proteolýzu svého inhibičního faktoru IκB v proteazomu (obr. 2) [32,33,34]. NF-κB je v cytoplazmě buněk asociován se svým inhibitorem IκB. Po stimulaci buňky cytokiny, chemokiny, bakteriálními a virovými produkty, UV zářením a volnými radikály dochází k aktivaci NF-κB. Uvedený inhibitor IκB je fosforylován proteinkinázou IKK, jak jsme již uvedli. Fosforylace je nezbytným předpokladem pro polyubikvitinylaci a degradaci IκB v proteazomu. Aktivovaný NF-κB, který se zbavil svého inhibitoru IκB, pak může přestoupit z cytoplazmy buňky do jádra buňky. Zde tento transkripční faktor řídí transkripci cílových genů pro řadu antiapoptotických proteinů (např. bcl 2, bcl-XL, buněčné inhibitory apoptózy IAP1, IAP2 a další), pro cytokiny (např. interleukiny IL1β, IL2, IL6 a IL8, TNFα a další), pro proteiny ovlivňující proliferaci buněk (např. c-myc, cyklin D1 a další), pro receptory (např. receptor pro IL 2, receptor T lymfocytů a další), pro adhezní molekuly, např. ICAM-1 (intercellular cell adhesion molecule-1) a VCAM-1 (vascular cell adhesion molecule-1), pro vlastní inhibitor IκB a pro enzymy zúčastněné v zánětlivém procesu, např. iNOS (indukovatelná forma NO syntézy), COX2 (cyklooxygenáza 2) a další [35-37].
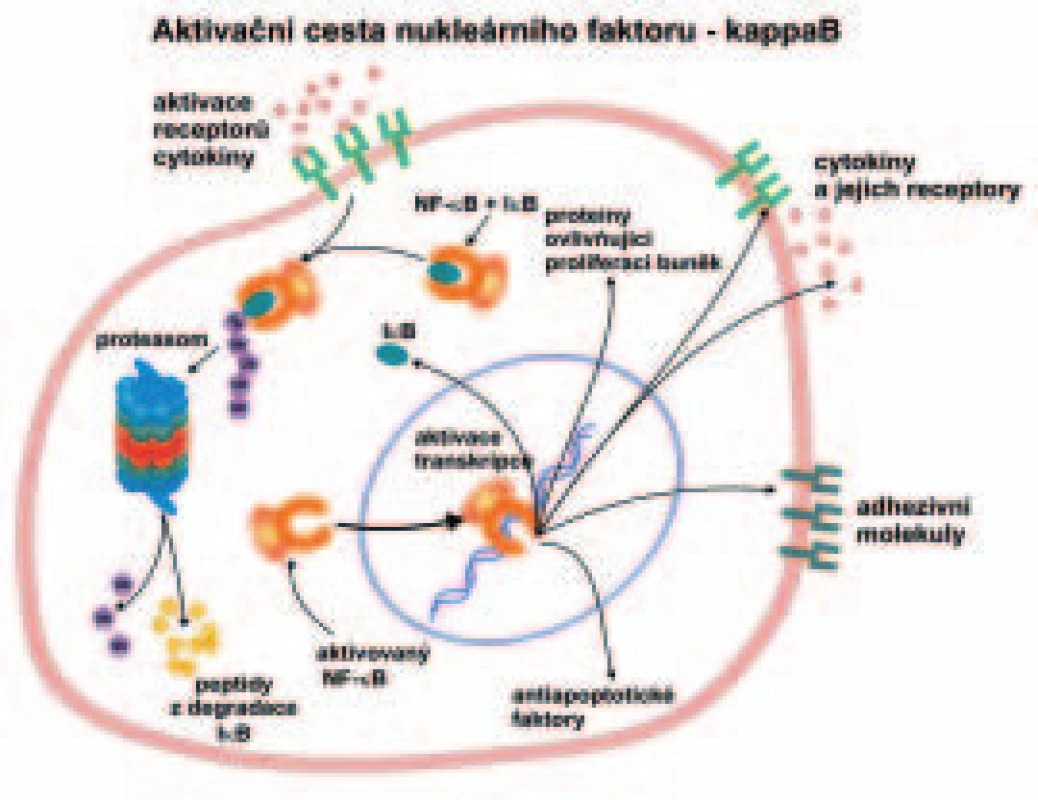
Aktivovaný NF-κB má tedy silný proliferační a antiapoptotický efekt; převedeno do kliniky, podporuje růst nádorových buněk a jejich metastazování. Naopak inhibice NF-κB umožní apoptózu nádorové buňky. Takovým inhibitorem je bortezomib (Velcade), slibný protinádorový lék. Bortezomib nevyvolává apoptózu nádorových buněk jen inhibicí NF-κB, ale řadou dalších mechanizmů. Mimo jiné bortezomib indukuje apoptózu způsobením stresu v endoplazmatickém retikulu buněk a vyvoláním tvorby reaktivních sloučenin kyslíku (ROS, reactive oxygen species) [38,39]. S těmito ději je spojena aktivace proapoptotických proteinů bik (bcl2-interacting killer) a Noxa (pojmenování převzato z latiny) [40,41,42,43].
NF-κB plní funkci v zánětlivé reakci. Aktivovaný NF-κB v endoteliálních buňkách vede k syntéze adhezivních molekul, které způsobí koncentraci leukocytů v místě zánětu. Klinický význam inhibice proteazomů bude podrobněji probrán ve III. části.
Monoubikvitinylace a polyubikvitinylace na jiném lyzinu než Lys-48
Vedle polyubikvitinylace proteinu může dojít k jeho monoubikvitinylaci. Monoubikvitinylace proteinu ho nepředurčuje k degradaci v proteazomech, ale hraje úlohu v endocytóze, opravě DNA, aktivaci proteinkináz v přenosu signálu a v regulaci struktury chromatinu a transkripce [44-46]. Polyubikvitinylace na jiném lyzinovém zbytku než uvedeném Lys-48 prvého připojeného ubikvitinu k proteinu, např. na Lys-63, hraje také úlohu v procesech uvedených u monoubikvitinylace, a ne v degradaci proteinů v proteazomech [47,48].
Příkladem úlohy monoubikvitinylace proteinu v endocytóze receptorů je receptor pro epidermální růstový faktor (EGFR), který náleží do rodiny tyrosinkinázových receptorů [49,50]. Malé molekuly se do buňky dostávají difuzí přes buněčnou membránu, ale makromolekuly (např. hormony, ale i viry) procesem endocytózy. Endocytóza může být zprostředkována receptory na buněčném povrchu. Makromolekuly se vážou k odpovídajícím receptorům a vstupují do buňky v podobě komplexů s receptory v klatrinových váčcích. Bílkovina klatrin (clathrin) se podílí na endocytóze právě pomocí při tvorbě uvedených váčků (vezikul), které se oddělí z buněčné membrány a putují se svým obsahem na místo určení. Endocytóza zprostředkovaná receptory se využívá k příjmu řady pro buňku esenciálních látek (např. železa, vitaminu B12, cholesterolu vázaného na proteiny ve formě lipoproteinů s nízkou hustotou a dalších). Endocytóza probíhá sadou spojených membránových trubiček a větších váčků, které lze dělit na rané a pozdní endozomy. Vnitřek endozomálního oddílu je udržován v kyselém stavu ATP poháněnou H+ pumpou. Kyselé prostředí endozomu vede k uvolnění vázaného nákladu z receptoru.
Endocytóza EGFR při fyziologické koncentraci epidermálního růstového faktoru (EGF) probíhá popsaným procesem endocytózy zprostředkované receptory přes uvedené klatrinové váčky. Při vyšší koncentraci ligandu však endocytóza EGFR probíhá cestou nezávislou na klatrinu a signálem pro tuto endocytózu je monoubikvitinylace EGFR na více místech jeho molekuly. Endocytóza nezávislá na klatrinu vyžaduje rozpoznávací receptory pro ubikvitin (epsin a Eps15 - EGFR pathway substrate 15), které slouží po rozpoznání monoubikvitinylovaného EGFR jako jeho adaptory v endocytické pouti přes endozomy do lyzozomů [49,50]. Tyto rozpoznávací receptory obsahují ve své sekvenci aminokyselinových zbytků oblasti interagující s ubikvitinem. Zatímco endocytóza EGFR závislá na klatrinu umožňuje recyklaci nedegradovaného receptoru (EGFR) zpět na buněčnou membránu, monoubikvitinylace EGFR předurčí EGFR ke degradaci v lyzozomech a ukončí tak přenos signálu vyvolaný nefyziologickou koncentrací EGF.
Dalším příkladem vlivu monoubikvitinylace proteinu na jeho umístění v buňce a posléze vedoucí k opravě DNA je jeden z proteinů Fanconiho anémie (FANCD2, Fanconi disease). Fanconiho anémie je vzácným autozomálně recesivním syndromem, vrozeným onemocněním charakterizovaným nestabilitou chromozomů a predispozicí k leukemii [51,52]. FANCD2 je monoubikvitinylován ve fázi S buněčného cyklu na specifickém lyzinovém zbytku a tato modifikace stimuluje jeho translokaci do specifické oblasti jádra buňky, kde interaguje s proteiny BRCA1, BRCA2 (proteiny pro náchylnost k rakovině prsu). Dále interaguje s proteiny FANCD1 a RAD51 (jeden z rodiny proteinů - produktů exprese „radiation“ genů - angažovaných v „repair“ DNA) a celý komplex uvedených proteinů se podílí na opravě poškozené DNA.
Monoubikvitinylace histonů H2A a H2B hraje úlohu v transkripci genů. Molekula ubikvitinu má asi poloviční velikost ve srovnání s histony. Přítomnost ubikvitinylovaných histonů v nukleozomální struktuře chromatinu rozvolňuje chromatin a stimuluje transkripci. Mechanizmus této stimulace transkripce spočívá v lepším přístupu transkripčních faktorů k DNA podobně jako při rozvolnění chromatinu acetylací histonů.
Monoubikvitinylace a deubikvitinylace histonů je charakteristická i pro průběh buněčného cyklu. Deubikvitinylované histony jsou přítomny během G2 až M-fáze buněčného cyklu, kdy je chromatin v kondenzovaném stavu. Monoubikvitinylované histony se objeví až v G1 fázi buněčného cyklu, kdy podporují rozvolnění chromatinu. Tedy ubikvitinylace a deubikvitinylace histonů mají opačný vliv na transkripci [53]. Monoubikvitinylace histonu H2B podporuje metylaci histonu H3 a způsobí stimulaci transkripce [44,53,54]. Obecně však metylace histonu H3 nevede vždy ke stimulaci transkripce [55,56].
Polyubikvitinylace na jiném lyzinu než Lys-48 prvého připojeného ubikvitinu nevede k degradaci substrátu v proteazomu. Tento způsob polyubikvitinylace hraje úlohu v aktivaci proteinkináz. Jedná se například o polybikvitinylaci několika faktorů účastnících se aktivace proteinkinázy IKK, která má, jak jsme uvedli, důležitou úlohu v aktivaci NF-κB. Polyubikvitinylace těchto faktorů probíhá na Lys-63 prvého připojeného ubikvitinu. Uvedená polyubikvitinylace vede nejprve k aktivaci proteinkinázy TAK1 (TGF-β activated kinase 1), která následně aktivuje IKK [45-57]. Proteinkináza TAK1 má také schopnost aktivovat c-Jun N-koncové kinázy (JNK) a p38 kinázy.
Proteazomy
Proteazom je komplexní bílkovinná částice o sedimentační konstantě 26S a hmotnosti přibližně 2,5 megadaltonů. Proteazomy jsou přítomny v cytoplazmě i v jádře všech eukaryotických buněk [58].
Proteazom se skládá ze dvou funkčních komplexů proteinů (obr. 3). První část (tělo proteazomu) nese katalytickou aktivitu a má tvar sudu délky 15 nm a průměru 11 nm. Skládá se ze čtyř segmentů a má sedimentační konstantu 20S. Dva vnitřní segmenty jsou složeny ze sedmi různých β-podjednotek a dva vnější segmenty ze sedmi různých α-podjednotek. Proteolytickou aktivitu mají 3 ze 7 β-podjednotek a obsahují v katalytickém aktivním centru treoninový nebo serinový zbytek. Proteolytická aktivita je podobná trypsinu, chymotrypsinu a peptidylglutamyl-peptid hydroláze [59-63]. Tělo sudu je z obou stran uzavřeno jakýmisi zátkami či pokličkami, tvořenými komplexem proteinů o sedimentační konstantě 19S, který nese název regulační částice (RP). Regulační podjednotka proteazomu (její protein Rpn10 u kvasinek nebo jeho lidský homolog S5a) a další proteiny s ní asociované se podílí na rozpoznání polyubikvitinylovaného proteinu a na jeho vtažení dovnitř do dutiny proteazomu (viz obr. 3) [64-67]. Uvedené proteiny tedy slouží jako rozpoznávací receptory, které proteazom využívá k výběru proteinů určených k degradaci a k jejich dopravě do proteazomu. V proteazomu, jakémsi „minimixéru“, dojde k rozbalení proteinu a odštěpení ubikvitinů z polyubikvitinylovaných proteinů. Protein je dále rozložen na krátké oligopeptidy, které spolu s molekulami ubikvitinu jsou vypuštěny z proteazomu (obr. 3).
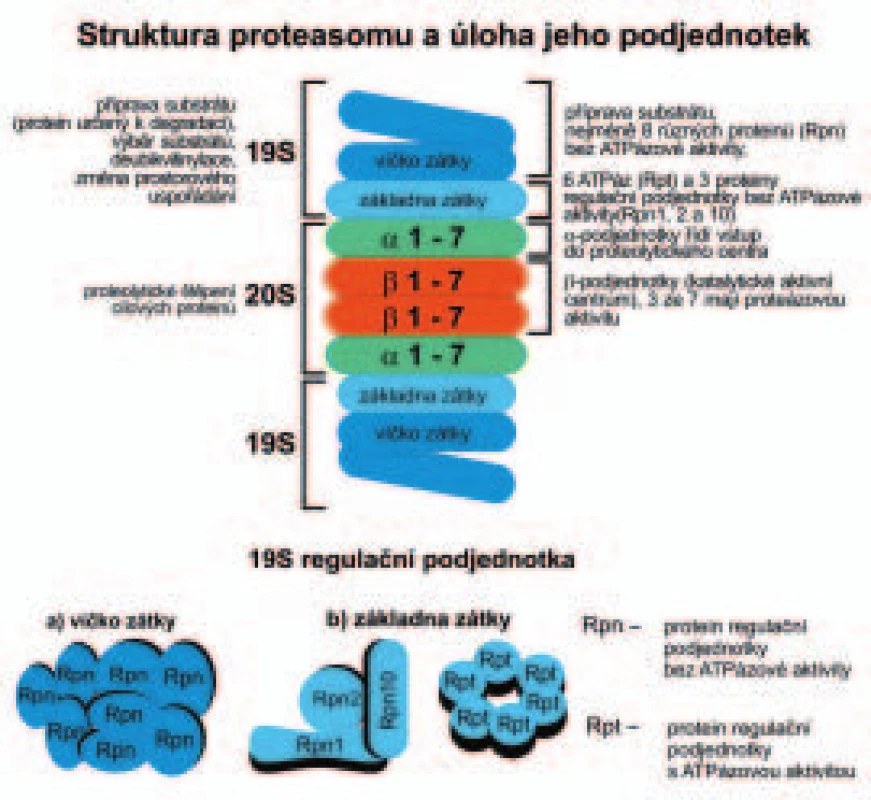
Degradace proteinů v proteazomech nezávislá na předchozí polyubikvitinylaci proteinů
U některých proteinů dochází k degradaci v proteazomech nezávisle na ubikvitinylaci příslušných proteinů [68-72]. Jako rozpoznávací znak pro proteazomy zde slouží jiný protein interagující s proteinem určeným k degradaci nebo nějaký degradační signál v sekvenci proteinu určeného k degradaci. Například ornitindekarboxyláza využívá dalšího proteinu antizymu jako signálu k rozkladu v proteazomech [68,69]. V proteazomech dochází i k degradaci důležitého inhibitoru na cyklinech závislých kináz (cdk), proteinu p21waf1/cip1 nezávisle na předchozí polyubikvitinylaci [70]. Některé proteiny, například supresory vzniku nádorů, proteiny p53 a p73, jsou degradovány v proteazomech po předchozí polyubikvitinylaci i bez ní [72].
Inhibice degradace proteinů v proteazomech pomocí ubistatinů
Nízkomolekulární přirozené inhibitory (ubistatiny) se váží na řetězec polyubikvitinu připojený k proteinu určenému k degradaci v proteazomech, a ruší tím jeho interakci s proteazomy. Konkurují rozpoznávacím receptorům proteazomů pro ubikvitin [73,74]. V kapitole o proteazomech jsme popsali uvedené receptory proteazomů pro rozpoznání polyubikvitinylovaného proteinu. Ubistatiny jsou tedy schopné zrušit interakci protein-protein (polyubikvitinylovaný protein-vyhledávací receptor pro ubikvitin). Tato schopnost ubistatinů bude jistě využita při vývoji obdobných farmakologicky účinných látek.
Funkční důležitost degradace proteinů v proteazomech
Původně se proteazomu připisovala funkce „uklízecí čety buňky“, která měla likvidovat - odbourat proteiny, které už ukončily svou funkci. Odhaduje se, že 80 % proteinů určených k proteolýze, je degradováno v proteazomu. Brzo se však ukázalo, že ubikvitin-proteazomový systém má další funkce: účastní se v procesu rozpoznávání antigenních struktur, hraje významnou úlohu v regulaci buněčného cyklu, podporuje proliferaci buněk a má významnou úlohu v apoptóze buněk [59,60,75-77].
Příkladem práce proteazomu v procesu rozpoznávání antigenních struktur je jeho úloha v dendritických buňkách v systému rozpoznávání a prezentace antigenu pro cytotoxickou reakci zprostředkovanou T-lymfocyty. Antigen je v proteazomu rozložen na fragmenty (krátké peptidy o 8-11 aminokyselinových zbytcích), které jsou transportovány pomocí specifických přenašečů do endoplazmatického retikula ke glykoproteinům MHC I. třídy. Ve spojení s histokompatibilním komplexem je pak peptid externalizován na povrch buňky a prezentován T-lymfocytům [78,79].
Úloha proteazomu v regulaci buněčného cyklu je zprostředkována mimo jiné aktivací transkripčního faktoru NF-κB a degradací cyklinů, jak jsme se již zmínili v kapitole Ubikvitin a ubikvitinylace. Aktivovaný NF-κB má tedy silný proliferační a antiapoptotický vliv. Degradace cyklinů v ubikvitin-proteazomovém systému vede k zástavě buněčného cyklu. Vedle toho jsou i inaktivovány kinázy závislé na cyklinech (cdk). Inhibitor těchto kináz, protein p27kip1, je také degradován v ubikvitin-proteazomovém systému. Další inhibitor cdk, p21waf1/cip1, je také rozložen proteazomy, ale bez předchozí polyubikvitinylace. Snížení hladiny těchto inhibitorů cdk stimuluje proliferaci buňky.
Vliv degradace proteinů v ubikvitin-proteazomovém systému na apoptózu buněk byl již zmíněn při popisu regulace aktivity transkripčního faktoru NF-κB, kdy dochází k degradaci jeho inhibičního faktoru IκB v proteazomech. Zmínili jsme se také o degradaci dalšího důležitého faktoru v aktivaci apoptózy buněk, proteinu p53, v ubikvitin-proteazomovém systému. Proteiny rodiny bcl2 pro - a anti-apoptotických proteinů jsou také degradovány v ubikvitin-proteasomovém systému. Inhibitory apoptózy, proteiny IAP (inhibitor of apoptosis protein) vykazují aktivitu ubikvitinligáz a mohou být proto auto-ubikvitinylovány a degradovány, a tím je spuštěna apoptóza buněk.
Závěr
Díky intenzivnímu výzkumu ubikvitinylace a funkce proteazomu lze očekávat v dohledné době další informace o ubikvitinylaci a účasti proteazomu ve specifických buněčných procesech. Aktivita ubikvitinligáz i připravenost proteinů určených k degradaci (substrátů) je regulována fosforylací a dalšími posttranslačními modifikacemi, které zřejmě budou postupně v jednotlivých dosud nepopsaných případech objeveny a popsány. Důležitým faktorem bude také, kde v buňce k degradaci specifických proteinů v proteazomech dochází vzhledem k jejich umístění jak v cytoplazmě, tak v jádře buňky. Zatím nevíme, zda složení jaderných a cytoplazmatických proteazomů je shodné, či se nějak liší. Výzkum endogenních inhibitorů proteazomů a jejich cíleného působení v subcelulárních strukturách bude jistě také přístupem v blízké budoucnosti. Zatím popsané nízkomolekulární přirozené inhibitory (ubistatiny) jsou schopné zrušit interakci polyubikvitinylovaného proteinu s receptory proteazomů pro ubikvitin, a působí tak na úrovni přísunu polyubikvitinylovaných proteinů určených k degradaci k proteazomu. Otázka specifických inhibitorů jednotlivých enzymů E3 (ubikvitinligáz) pro cílené terapeutické využití a inhibitorů proteazomu s klinickými konsekvencemi bude probrána ve III. části přehledu. Inhibice proteazomů umožňuje apoptózu buněk potlačením aktivity transkripčního faktoru NF-κB a zvýšením aktivity proteinu p53, dalších proapoptotických proteinů a inhibitorů cdk. Zatím provedené klinické studie ukazují, že maligní buňky jsou daleko citlivější k inhibici proteazomů než normální buňky zdravých jedinců. Již dnes je jasné z pokusů na zvířecích modelech a tkáňových a buněčných kulturách, že vedle onkologických onemocněni se inhibitory proteazomů uplatní v léčbě některých zánětlivých reakcí kolem ischemických ložisek (např. při cévní mozkové příhodě nebo u experimentálního infarktu myokardu). Naopak u neurologických onemocnění spojených s hromaděním bílkovinných komplexů (Alzheimerova, Huntingtonova a Parkinsonova choroba, Angelmanův syndrom a další onemocnění) dochází k poruchám v ubikvitin-proteazomovém systému a je třeba naopak zajistit jeho proteolytickou funkci. Podrobnější poznání příčin těchto a podobných onemocnění na základě poruch v ubikvitin-proteazomovém systému jistě povede k účinnějším způsobům jejich léčení.
Práce vznikla za podpory grantu NC/7605-3 Interní grantové agentury Ministerstva zdravotnictví České republiky.
Ing. Ota Fuchs
www.uhkt.cz
e-mail: Ota.Fuchs@uhkt.cz
Doručeno do redakce: 7. 10. 2005
Přijato po recenzi: 26. 1. 2006
Sources
1. Harris JR. Release of a macromolecular protein component from human erythrocyte ghosts. Biochim Biophys Acta 1968; 150 : 534-537.
2. Arrigo AP, Tanaka K., Goldberg AL et al. Identity of the 19 S „prosome“ particle with the large multifunctional protease complex of mammalian cells (the proteasome). Nature 1988; 331 : 192-194.
3. Zwickl P, Lottspeich F, Dahlmann B et al. Cloning and sequencing of the gene encoding the large (alpha-) subunit of the proteasome from Thermoplasma acidophilium. FEBS Lett 1991; 278 : 217-221.
4. Goldstein G, Scheid M, Hammerling U et al. Isolation of a polypeptide that has lymphocyte-differentiating properties and is probably represented universally in living cells. Proc Natl Acad Sci USA 1975; 72 : 11-15.
5. Hershko A, Ciechanover A, Heller H et al. Proposed role of ATP in protein breakdown: conjugation of proteins with multiple chains of the polypeptide of ATP - dependent proteolysis. Proc Natl Acad Sci USA 1980; 77 : 1783-1786.
6. Hershko A, Heller H, Elias S et al. Components of ubiquitin-protein ligase system. J Biol Chem 1983; 258 : 8206-8214.
7. Hershko A, Heller H, Eytan E et al. ATP-dependent degradation of ubiquitin-protein conjugates. Proc Natl Acad Sci USA 1984; 81 : 1619-1623.
8. Hershko A, Ciechanover A. The ubiquitin system. Annu Rev Biochem 1998; 67 : 425-479.
9. Glickman MH, Ciechanover A. The ubiquitin-proteasome proteolytic pathway: destruction for the sake of construction. Physiol Rev 2002; 82 : 373-428.
10. Baker RT, Board PG. The human ubiquitin gene family: structure of a gene and pseudogenes from the Ub B subfamily. Nucleic Acids Res 1987; 15 : 443-463.
11. Baker RT, Board PG. The human ubiquitin-52 amino acid fusion protein gene shares several structural features with mammalian ribosomal protein genes. Nucleic Acids Res 1991; 19 : 1035-1040.
12. Adams J. Potential for proteasome inhibition in the treatment of cancer. Drug Discovery Today 2003; 8 : 307-315.
13. Pickart CM, Eddins MJ. Ubiquitin: structures, functions, mechanisms. Biochim Biophys Acta 2004; 1695 : 55-72.
14. Ciechanover A. Proteolzsis: from the lzsosome to ubiquitin and the proteasome. Nature Rev Mol Cell Biol 2005; 6 : 79-87.
15. Hoppe T. Multiubiquitylation by E4 enzymes: “one size” doesn´t fit all. Trends Biochem Sci 2005; 30 : 183-187.
16. Pickart CM. Ubiquitin in chains. Trends Biochem Sci 2000; 25 : 544-548.
17. Wilkinson KD. Regulation of ubiquitin-dependent processes by deubiquitinating enzymes. FASEB J 1997; 11 : 1245-1256.
18. D´Andrea A, Pellman D. Deubiquitinating enzymes: a new class of biological regulators. Crit Rev Biochem Mol Biol 1998; 33 : 332-337.
19. Wilkinson KD. Ubiquitination and deubiquitination: targeting of proteins for degradation by the proteasome. Semin Cell Dev Biol 2000; 11 : 141-148.
20. Wong BR, Parlati F, Qu K et al. Drug discovery in the ubiquitin regulatory pathway. Drug Discov Today 2003; 8 : 746-754.
21. Bachmair A, Finley DJ, Varshavsky A. In vivo half-life of a protein is a function of its amino-terminal residue. Science 1986; 234 : 179-186.
22. Bachmair A, Varshavsky A. The degradation signal in a short-lived protein. Cell 1989; 56 : 1019-1032.
23. Chau V, Tobias JW, Bachmair A et al. A multiubiquitin chain is confined to specific lysine in a targeted short-lived protein. Science 1989; 243 : 1576-1583.
24. Johnson ES, Gonda DK, Varshavsky A. Cis-trans recognition and subunit-specific degradation of short-lived proteins. Nature 1990; 346 : 287-291.
25. Bartel B, Wünning I, Varshavsky A. The recognition component of the N-end rule pathway. EMBO J 1990; 9 : 3179-3189.
26. Varshavsky A, Turner G, Du F et al. The ubiquitin system and the N-end rule pathway. Biol Chem 2000; 381 : 779-789.
27. Rao H, Uhlmann F, Nasmyth K et al. Degradation of cohesin subunit and the N-end rule pathway is essential for chromosome stability. Nature 2000; 410 : 955-959.
28. Jaakkola P, Mole DR, Tian YM et al. Targeting of HIF-alpha to the von Hippel-Lindau ubiquitylation complex by O2-regulated prolyl hydroxylation. Science 2001; 292 : 468-472.
29. Karin M, Ben-Neriah Y. Phosphorylation meets ubiquitination: the control of NF-B activity. Annu Rev Immunol 2000; 18 : 621-663.
30. Amati B. Myc degradation: dancing with ubiquitin ligases. Proc Natl Acad Sci USA 2004; 101 : 8843-8844.
31. Ashcroft M, Taya Y, Vousden KH. Stress signals utilize multiple pathways to stabilize p53. Mol Cell Biol 2000; 20 : 3224-3233.
32. Barnes PJ, Karin M. Nuclear factor-κB: a pivotal transcription factor in chronic inflammatory diseases. N Engl J Med 1997; 336 : 1066-1071.
33. Yaron A, Hatzubai A, Davis M et al. Identification of the receptor component of the IB-ubiquitin ligase. Nature 1998; 396 : 590-594.
34. Yaron A, Gonen H, Alkalay I et al. Inhibition of NF-B cellular function via specific targeting of the IB-ubiquitin ligase. EMBO J 1997; 16 : 6486-6494.
35. Chen ZJ. Ubiquitin signalling in the NF-B pathway. Nature Cell Biol 2005; 7 : 758-765.
36. Yamamoto Y, Gaynor RB. IκB kinases: key regulators of the NF-κB pathway. Trends Biochem Sci 2004; 29 : 72-79.
37. Leníček M, Muchová L, Vítek L. Nukleární faktor κB v léčbě zánětlivých a nádorových onemocnění. Čas Lék Čes 2004; 143 : 680-684.
38. Fribley A, Zeng Q, Wang CY. Proteasome inhibitor PS-341 induces apoptosis through induction of endoplasmic reticulum stress-reactive oxygen species in head and neck squamous cell carcinoma cells. Mol Cell Biol 2004; 24 : 9695-9704.
39. Nawrocki ST, Carew JS, Dunner K et al. Bortezomib inhibits PKR-like endoplasmic reticulum (ER) kinase and induces apoptosis via ER stress in human pancreatic cancer cancer cells. Cancer Res 2005; 65 : 11510-11519.
40. Zhu H, Zhang L, Dong F et al. Bik/NBK accumulation correlates with apoptosis-induction by bortezomib (PS-341, Velcade) and other proteasome inhibitors. Oncogene 2005; 24 : 4993-4999.
41. Nikrad M, Johnson T, Puthalalath H et al. The proteasome inhibitor bortezomib sensitizes cells to killing by death receptor ligand TRAIL via BH3-only proteins Bik and Bim. Mol Cancer Ther 2005; 4 : 443-449.
42. Qin JZ, Ziffra J, Stennett L et al. Proteasome inhibitors trigger NOXA-mediated apoptosis in melanoma and myeloma cells. Cancer Res 2005; 65 : 6282-6293.
43. Pérez-Galán P, Roué G, Villamor N et al. The proteasome inhibitor bortezomib induces apoptosis in mantle-cell lymphoma through generation of ROS and Noxa activation independent of p53 status. Blood 2006; 107 : 257-264.
44. Johnson ES. Ubiquitin branches out. Nat Cell Biol 2002; 4: E295-E298.
45. Schnell JD, Hicke L. Non-traditional functions of ubiquitin and ubiquitin-binding proteins. J Biol Chem 2003; 278 : 35857-35860.
46. Sun L, Chen ZJ. The novel functions of ubiquitination in signaling. Curr Opin Cell Biol 2004; 16 : 119-126.
47. Pickart CM. Mechanisms underlying ubiquitination. Annu Rev Biochem 2001; 70 : 503-533.
48. Weissman AM. Themes and variations on ubiquitylation. Nat Rev Mol Cell Biol 2001; 2 : 169-178.
49. Aguilar RC, Wendland B. Endocytosis of membrane receptors: Two pathways are better than one. Proc Natl Acad Sci USA 2005; 102 : 2679-2680.
50. Sigismund S, Woelk T, Puri C et al. Clathrin-independent endocytosis of ubiquitinated cargos. Proc Natl Acad Sci USA 2005; 102 : 2760-2765.
51. D’Andrea AD. The Fanconi road to cancer. Genes Dev 2003; 17 : 1933-1936.
52. Montes de Oca R, Andreassen PR, Margossian SP et al. Regulated interaction of the Fanconi anemia protein, FANCD2, with chromatin. Blood 2005; 105 : 1003-1009.
53. Zhang Y. Transcriptional regulation by histone ubiquitination and deubiquitination. Genes Dev 2003; 17 : 2733-2740.
54. Zhu B, Zheng Y, Pham AD et al. Monoubiquitination of human histone H2B: the factors involved and their roles in HOX gene regulation. Mol Cell 2005; 20 : 601-611.
55. Zhang Y, Reinberg D. Transcription regulation by histone methylation: interplay between different covalent modifications of the core histone tails. Genes Dev 2001; 15 : 2343-2360.
56. Zhang K, Dent SYR. Histone modifying enzymes and cancer: going beyond histones. J Cell Biochem 2005; 96 : 1137-1148.
57. Deng L, Wang C, Spencer E et al. Activation of the IκB kinase complex by TRAF6 requires a dimeric ubiquitin-conjugating enzyme complex and a unique polyubiquitin chain. Cell 2000; 103 : 351-361.
58. Wojcik C, DeMartino GN. Intracellular localization of proteasomes. Int J Biochem Cell Biol 2003; 35 : 579-589.
59. Fuchs O. Proteazomy. Biol Listy 1996; 61 : 13-27.
60. Špička I, Kleibl Z, Hájek R. Bortezomibum. Remedia 2005; 15 : 196-203.
61. Groll M, Huber R. Substrate access and processing by the 20S proteasome core particle. Int J Biochem Cell Biol 2003; 35 : 606-616.
62. Pickart CM, Cohen RE. Proteasomes and their kin: proteases in the machine age. Nat Rev Mol Cell Biol 2004; 5 : 77-187.
63. Wolf DH, Hilt W. The proteasome: a proteolytic nanomachine of cell regulation and waste disposal. Biochim Biophys Acta 2004; 1695 : 19-31.
64. Madura K. Rad23 and Rpn10: perennial wallflowers join the mêlée. Trends Biochim Sci 2004; 29 : 637-640.
65. Verma R, Oania R, Graumann J et al. Multiubiquitin chain receptors define a layer of substrate selectivity in the ubiquitin-proteasome system. Cell 2004; 118 : 99-110.
66. Elsasser S, Finley D. Delivery of ubiquitinated substrates to protein/unfolding machines. Natur Cell Biol 2005; 7 : 742-749.
67. Varadan R, Assfalg M, Raasi S et al. Structural determinants for selective recognition of a Lys48-linked polyubiquitin chain by a UBA domain. Mol Cell 2005; 18 : 687-698.
68. Orlowski M, Wilk S. Ubiquitin-independent proteolytic functions of the proteasome. Arch Biochem Biphys 2003; 415 : 1-5.
69. Hoyt MA, Coffino P. Ubiquitin-free routes into the proteasome. Cell Mol Life Sci 2004; 61 : 1596-1600.
70. Chen X, Chi Y, Bloecher A et al. N-acetylation and ubiquitin-independent proteasomal degradation of p21 (Cip1). Mol Cell 2004; 16 : 839-847.
71. Asher G, Bercovich Z, Tsvetkov P et al. 20S proteasomal degradation of ornithine decarboxylase is regulated by NQO1. Mol Cell 2005; 17 : 645-655.
72. Asher G, Tsvetkov P, Kahana C et al. A mechanism of ubiquitin-independent proteasomal degradation of the tumor suppressors p53 and p73. Genes Dev 2005; 19 : 316-321.
73. Bellows DS, Tyers M. Chemical genetics hits “reality”. Science 2004; 306 : 67-68.
74. Verma R., Peters NR, D‘ Onofrio M et al. Ubistatins inhibit proteasome-dependent degradation by binding the ubiquitin chain. Science 2004; 306 : 117-120.
75. Špička I, Klener P. Inhibitory proteazomu - nová možnost léčby nádorových onemocnění. Čas Lék Čes 2004; 143 : 701-704.
76. Burger AM, Seth AK. The ubiquitin-mediated protein degradation pathway in cancer: therapeutic implications. Europ J Cancer 2004; 40 : 2217-2229.
77. Rajkumar V, Richardson PG, Hideshima T et al. Proteasome inhibition as a novel therapeutic target in human cancer. J Clin Oncol 2005; 23 : 630-639.
78. Heemels M-T, Ploegh H. Generation, translocation, and presentation of MHC class I-restricted peptides. Annu Rev Biochem 1995; 64 : 463-491.
79. Vigneron N, Stroobant V, Chapiro J et al. An antigenic peptide produced by peptide splicing in the proteasome. Science 2004; 304 : 587-590.
Labels
Diabetology Endocrinology Internal medicineArticle was published in
Internal Medicine

2006 Issue 4
-
All articles in this issue
- Jsou chronická onemocnění ledvin a poruchy ledvinné funkce na standardním lůžku interních oborů dostatečně diagnostikovány?
- Nefarmakologická léčba hypertrofické obstrukční kardiomyopatie - srovnání výsledků léčby metodami perkutánní transluminální septální myokardiální ablace a 2dutinové kardiostimulace
- Videotorakoskopie v lokální anestezii v diagnostice a léčbě pohrudničních výpotků
- Pozdní kardiotoxicita u nemocných léčených pro maligní lymfomy chemoterapií s doxorubicinem
- Primární prevence ischemické choroby srdeční u mužů středního věku v Praze: výsledky dvacetiletého sledování
- Polymorfizmus v promotorové oblasti genu pro MMP-2 u revmatoidní artritidy
- Histiocytóza z Langerhansových buněk u osob dospělého věku - zkušenosti jednoho pracoviště a přehled léčebných možností
- Ubikvitiny, proteazomy, sumoylace a použití dnes a zítra v terapii nádorů i jiných chorob I. Ubikvitin-proteazomový systém a transkripční faktor NF-κB
- Profylaxe žilních tromboembolických komplikací v interních oborech - rozpor mezi teorií a praxí
- Problémy s interpretací nízkých hladin tyreoidálních hormonů podmíněné změnami v transportních proteinech
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue
- Videotorakoskopie v lokální anestezii v diagnostice a léčbě pohrudničních výpotků
- Primární prevence ischemické choroby srdeční u mužů středního věku v Praze: výsledky dvacetiletého sledování
- Ubikvitiny, proteazomy, sumoylace a použití dnes a zítra v terapii nádorů i jiných chorob I. Ubikvitin-proteazomový systém a transkripční faktor NF-κB
- Profylaxe žilních tromboembolických komplikací v interních oborech - rozpor mezi teorií a praxí
