Minerálově-kostní porucha při chronickém onemocnění ledvin
Mineral-bone disorder with chronic kidney disease
Mineral-bone disorder in chronic kidney disease is a clinical syndrome provoked by the combination of three factors: abnormal laboratory results, bone morphology disorder and extra-bone calcification. Its onset in adult age is linked with a decrease in glomerular filtration (GF < 1 ml/s). Fully developed forms occur in the course of regular dialysis treatment. The use of the traditional denomination „renal osteodystrophy“ is currently restricted to the bone morphology finding. As there are two threshold types of bone turnover (low and high) and two degrees of mineralisation (low and normal), there is a total of four basic variants of mineral-bone disorder. The high turnover variants – secondary hyperparathyreosis and a combined disorder – are still the most frequent and are diagnosed in 70 to 80 % of cases. Low turnover disorders include osteomalatia (OM) and adynamic bone disease (ABD). While OM is becoming increasingly rare, the occurrence of ABD is on the rise. The main reason for this may be the steady growth in the age of dialised patients and a number of risk factors, as well as treatment with inadequately high doses of vitamin D. Progressive chronic kidney disease may be linked with D-hormone deficit, negative calcium balance and with positive phosphate balance. Phosphates become a key factor in the development and progression of secondary hyperparathyreosis and extra-bone calcification in the case of D-hormone substitution. Therefore, maintaining a good phosphate balance by restricting their intake or by reducing their intestinal resorption through the use of phosphate binders is the most efficient therapeutic procedure. In patients with chronic kidney failure, adequate dialysis treatment is necessary. Hyperphosphatemia and extra-bone calcification are new independent risk factors of cardiovascular morbidity and mortality.
Key words:
renal osteodystrophy – chronic kidney disease – biochemical markers – secondary hyperparathyreosis – extra-bone calcification
Authors:
D. Sobotová; A. Zharfbin; M. Neobálková; J. Svojanovský; M. Souček
Authors‘ workplace:
II. interní klinika Lékařské fakulty MU a FN u sv. Anny Brno, přednosta doc. MUDr. Miroslav Souček, CSc.
Published in:
Vnitř Lék 2007; 53(7-8): 841-851
Category:
Overview
Minerálově-kostní porucha při chronickém onemocnění ledvin je klinický syndrom tvořený kombinací 3 složek, kterými jsou laboratorní abnormality, porucha kostní morfologie a mimokostní kalcifikace. V dospělosti se začíná rozvíjet při poklesu glomerulární filtrace GF < 1 ml/s. Plně rozvinuté formy se vyskytují až při pravidelném dialyzačním léčení. Tradiční název renální osteodystrofie se nově omezuje jen na morfologický kostní nález. Protože jsou 2 mezní typy kostního obratu (nízký a vysoký) a 2 stupně mineralizace (nízký a normální), vyskytují se celkem 4 základní varianty minerálově-kostní poruchy. Nejčastější jsou stále vysokoobratové varianty – sekundární hyperparatyreóza a smíšená porucha, které se zjišťují v 70–80 % případů. Nízkoobratové poruchy zahrnují osteomalacii (OM) a adynamickou kostní nemoc (ABD). Zatímco OM je stále vzácnější, výskyt ABD narůstá. Hlavní příčinou může být stále se zvyšující věk dialyzovaných nemocných s mnoha rizikovými faktory, ale také léčba nepřiměřeně vysokými dávkami vitaminu D. Postupující chronické onemocnění ledvin je spojeno s deficitem D-hormonu, negativní bilancí vápníku a pozitivní bilancí fosfátů. Při substituci D-hormonu se klíčovým faktorem vzniku a progrese sekundární hyperparatyreózy a mimokostních kalcifikací stávají fosfáty. Nejúčelnějším léčebným postupem je proto udržení vyrovnané bilance fosfátů omezením jejich příjmu, případně snížením střevní resorpce pomocí fosfátových vazačů. U nemocných s chronickým selháním ledvin je nezbytné adekvátní dialyzační léčení. Hyperfosfatemie a mimokostní kalcifikace jsou novými nezávislými rizikovými faktory kardiovaskulární morbidity a mortality.
Klíčová slova:
renální osteodystrofie - chronické onemocnění ledvin - biochemické markery - sekundární hyperparatyreóza - mimokostní kalcifikace
Úvod
Minerálově-kostní porucha při chronickém onemocnění ledvin (CKD) je klinický syndrom tvořený kombinací 3 složek, kterými jsou laboratorní abnormality, porucha kostní morfologie a mimokostní kalcifikace. V dospělosti se začíná rozvíjet při poklesu glomerulární filtrace GF < 1 ml/s, resp. GF <‹ 60 ml/min (CKD – stadium 3). Plně rozvinuté formy se vyskytují až při pravidelném dialyzačním léčení (CKD – 5).
Laboratorní nález
Kostní soubor tvoří intaktní PTH (iPTH), vápník korigovaný na albumin, fosfor, celková alkalická fosfatáza (ALP) a bikarbonáty z venózní krve. Součin Ca × P je vypočítaná hodnota. Normy uvedených biochemických markerů a jejich cílové hodnoty pro funkční stadia CKD 3-5 jsou v tab. 1. Doporučené intervaly vyšetřování uvádí tab. 2. Korekce vápníku se provádí při hypalbuminemii, např. podle vzorce SCakorig = SCaakt + [0,02 × (41,3 – Salbakt)]. Ze vztahu je zřejmé, že Cakorig je tím vyšší, čím je nižší albuminemie.

S ubývající funkcí ledvin se cílové koncentrace iPTH zvyšují, u dialyzovaných nemocných až na 4násobek horní hodnoty normy. Důvodem je prevence adynamické kostní nemoci léčebným udržováním účelné úrovně sekundární hyperparatyreózy a dále nespecifičnost vyšetřovací metody, která stanovuje směs iPTH a biologicky neaktivních fragmentů, čímž hladiny PTH nadhodnocuje o 40-60 %. Diagnostické jsou koncentrace iPTH < 100 pg/ml, které svědčí pro nízkoobratovou kostní nemoc, a koncentrace iPTH > 400 pg/ml, které ukazují na vysoký kostní obrat. V rozmezí iPTH 100-400 pg/ml je interpretace komplikovaná. Předpokládá se, že v budoucnu se místo iPTH bude vyšetřovat 1-84 PTH pro jeho lepší reprodukovatelnost, případně poměr 7-84 PTH/1-84 PTH. Zjišťování kostní frakce ALP a ionizovaného vápníku má okrajový význam. Běžné vyšetřování kostních biomarkerů (osteokalcin, osteoprotegerin, TRAP-5b, pyridolin, prokolagen typ I) se v blízké době neočekává. Problematická je jejich eliminace závislá na funkci ledvin a nákladovost [6,13,23].
Porucha kostní morfologie
Porucha kostní morfologie se nazývá renální osteodystrofie (ROD) a je pouze jednou ze složek syndromu. Typ kostní poruchy se zjišťuje z kostní biopsie. Hodnotí se kostní obrat, mineralizace a objem kostních trámců. Protože jsou dva mezní typy kostního obratu - nízký a vysoký - a 2 stupně kostní mineralizace - nízký a normální až zvýšený - vyskytují se celkem čtyři základní varianty ROD (tab. 3). Kostní biopsie se pro diagnózu renální minerálově-kostní nemoci nevyžaduje a v naprosté většině případů se neprovádí. Je však indikována při odporujících si biochemických nálezech (např. vysoký iPTH a nízké ALP), nevysvětlitelných zlomeninách nebo bolestech kostí, těžkých a postupujících mimokostních kalcifikacích, nevysvětlitelné hyperkalcemie, podezření na toxicitu kovů (např. hliníku), před paratyreoidektomií tehdy, předcházela-li významná zátěž hliníkem a před zamýšlenou léčbou bisfosfonáty. Kontrolní biopsie je namístě nejdříve v odstupu 200 dní, až po ukončení kostního remodulačního cyklu [9,13].

Mimokostní kalcifikace
Mimokostní kalcifikace se tvoří v měkkých tkáních. Cíleně se má pátrat po vaskulárních kalcifikacích (VC). Boční RTG snímek břicha je jednoduchým, levným a radiačně nezatěžujícím screeningovým vyšetřením. Pozitivním nálezem jsou viditelné kalcifikace aorty. Přínosné je vyšetření pulzového tlaku a rychlosti pulzové vlny. Celotělová tomografie (CT) nebo EBCT/MSCT (electron beam computed tomography a multislice computed tomography) jsou vyšetřením preciznějším, senzitivnějším a kvantitativním, avšak drahým, radiačně zatěžujícím, a proto pro screening nevhodným [13].
Ostatní vyšetřovací metody
Kostní denzitometrie poskytuje informaci o kostní mineralizaci. Metoda DEXA měří absorpci RTG záření o dvojí energetické hladině v kortikální i trabekulární kosti. Proměřované místo je hodnoceno tzv. BMD (bone mineral denzity) v g/cm2 v T - nebo Z-skóre. U dialyzovaných nemocných se má vyšetřovat oblast distálního radia, která koreluje s iPTH a je prediktivní pro riziko zlomenin. BMD měřená v oblasti stehenního krčku nebo bederního obratle může být zavádějící a vést k neadekvátnímu podání léků proti osteoporóze. Opakovaná měření BMD jsou indikována u nemocných po transplantaci ledviny. Sonografií, CT nebo zobrazením magnetickou rezonancí příštítných tělísek se zjišťuje jejich velikost. 99mTc-MIBI je scintigrafická metoda prokazující zvýšenou činnost příštítných tělísek. Etážové odběry krve na hladiny PTH z centrálního řečiště se provádějí při závažné hyperparatyreóze a negativním výsledku zobrazovacích metod. Ze skupiny vitaminů D má praktický význam stanovení 25-hydroxycholekalciferolu [25(OH)D]. Normální hodnota je > 30 ng/ml. Sérová koncentrace hliníku u zdravých je do 10 µg/l (0,37 mmol/l). Převyšuje-li u dialyzovaných nemocných 60 µg/l (2,2 mmol/l), je indikován desferalový test. Zvýší-li se po podání Desferalu aluminemie do následující dialýzy o více než 50 µg/l (1,85 mmol/l), je podezření na hliníkovou nízkoobratovou kostní poruchu a je indikována kostní biopsie [5,13,23].
Klinické formy minerálově-kostní poruchy
A. Vysokoobratová porucha zahrnuje sekundární hyperparatyreózu s normální mineralizací a smíšenou renální osteodystrofii s vysokým kostním obratem a nízkou mineralizací.
Sekundární hyperparatyreóza
Sekundární hyperparatyreóza je kompenzační odpovědí příštítné žlázy na dlouhodobou negativní bilanci vápníku, která postupující chronické onemocnění ledvin provází.

![Schéma 2. Hyperplazie příštítných tělísek při chronickém selhání ledvin. Difuzní hyperplazie se mění na nodulární, počet receptorů pro vitamin D (VDR) a vápník (CaR) se snižuje [15].](https://pl-master.mdcdn.cz/media/image/ee1541245de9e75fcec7cd7c2f745a2e.png?version=1537797529)
Patogeneze
Klíčovými faktory jsou deficit D-hormonu, hyperfosfatemie, hypokalcemie a rezistence kosti na PTH (obr. 1). Účast dalších faktorů, např. deficit biologicky aktivní formy kostního morfogenního proteinu BMP-7, je pravděpodobná, prozatím ale klinicky nezhodnotitelná. Deficit D-hormonu kalcitriolu vzniká poklesem syntézy v buňkách proximálního a distálního renálního tubulu, který je úměrný zmenšujícímu se objemu produkční tkáně. Tento morfologicky podmíněný nedostatek kalcitriolu je prohlubován retencí fosfátů. Hyperfosfatemie snižuje syntézu kalcitriolu v reziduální tkáni tím, že inhibuje aktivitu renální 1α-hydroxylázy. Jednak přímo, jednak skrze fibroblastový růstový faktor FGF23, který vlivem hyperfosfatemie produkují kostní buňky ve značném množství. FGF23 kromě inhibice 1α-hydroxylázy zvyšuje fosfaturii. Nedostatkem kalcitriolu klesá střevní resorpce vápníku, která je jediným zdrojem jeho příjmu do organizmu. Snižuje se i reabsorpce vápníku v ledvinách, neboť je rovněž kalcitriol-dependentní. Vzniká hypokalcemie, která potlačením aktivity membránového vápníkového receptoru (CaR) v příštítných buňkách zvýší sekreci zásobního PTH.
Syntézu PTH regulují kalcitriol, fosfatemie a kalcemie přímým a na sobě nezávislým účinkem. Kalcitriol řídí syntézu PTH prostřednictvím receptoru pro vitamin D (VDR). Komplex kalcitriol/VDR v jádru příštítných buněk syntézu PTH inhibuje. Při nedostatku kalcitriolu se vazebná kapacita VDR snižuje a exprese PTH-genu a syntéza PTH hormonu se zvyšuje. Kalcemie a fosfatemie modulují stabilitu genového transkriptu PTHmRNA. Ta je závislá na rovnováze mezi degradačními endonukleázami a protektivními cytosolickými proteiny, které se vážou na intaktní 3´UTR oblast PTHmRNA. Hypokalcemie a hyperfosfatemie zesilují vliv protektivních proteinů a degradaci transkriptu zpomalují. Za fyziologických okolností je PTH transkript odbouráván za 40-60 min, při hypokalcemii, hyperfosfatemii a v uremickém prostředí obecně až za 180 min.
Nadprodukce PTH obnoví normální hladiny vápníku a fosfátů v extracelulární tekutině. V kostech zvyšuje osteoresorpci a z kostního minerálu uvolňuje vápník a fosfáty. V ledvinách zvyšuje fosfaturii, reabsorpci vápníku a syntézu kalcitriolu. Vlivem zvýšené tvorby kalcitriolu vzroste resorpce vápníku ve střevě, ale také syntéza a mineralizace osteoidu. Protichůdný účinek PTH a kalcitriolu na kost je podkladem zvýšeného kostního obratu. Udržení účelných adaptací vyžaduje stále vyšší koncentrace PTH. Příčinou je rozvíjející se rezistence kosti na PTH. Její podstata je neobjasněna, pravděpodobný je vliv retence fosfátů, cytokinů kostní remodelace (IL-1, IL-6, TNF-α) a pokles hustoty kostních receptorů pro PTH. Dlouhodobá stimulace buněk příštítných tělísek (PT) vede k jejich hyperplazii, která zvětšuje objem produkční tkáně. Zprvu je hyperplazie PT difuzní, později nodulární, která je spojena s úbytkem receptorů VDR i CaR a následně s rezistencí příštítných tělísek na kalcitriol i hypokalcemii (obr. 2). Buňky PT se vymykají ze systému zpětnovazebních regulací a stávají se částečně až zcela autonomní. Sekundární hyperparatyreóza přechází ve formu terciární [15,19-21].
Klinický obraz
Klinický obraz je asymptomatický nebo necharakteristický. Je stížnost na bolest v kostech a pruritus. V pokročilých fázích se zjišťují mimokostní kalcifikace.
Diagnóza
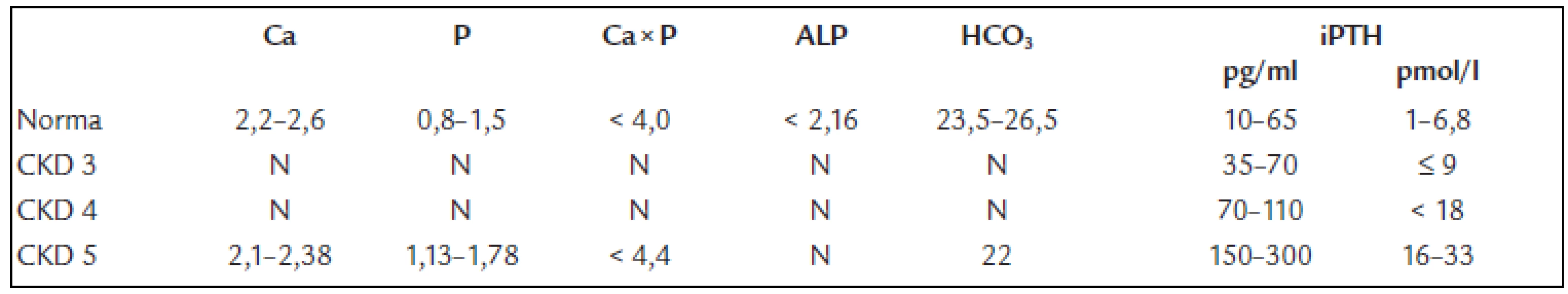
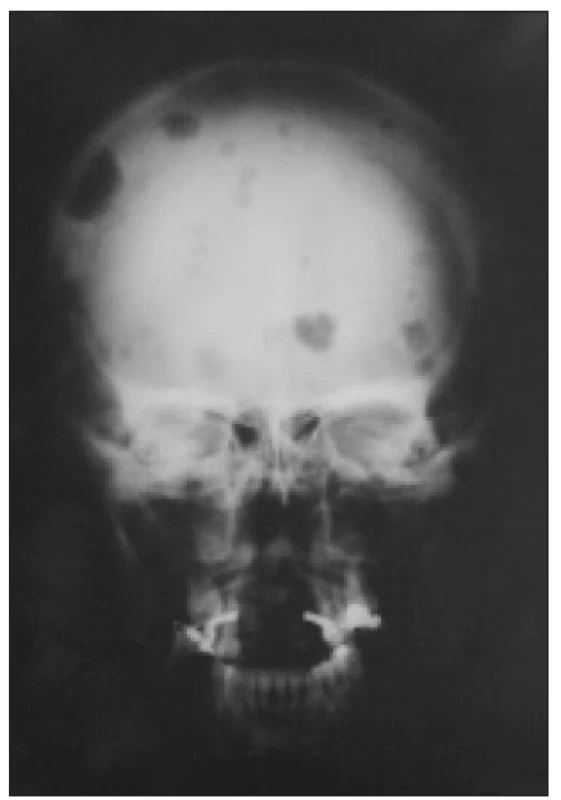
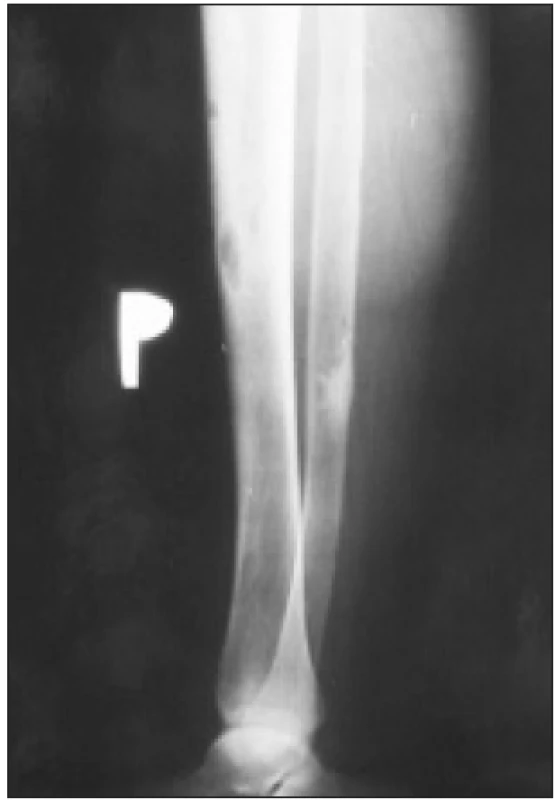
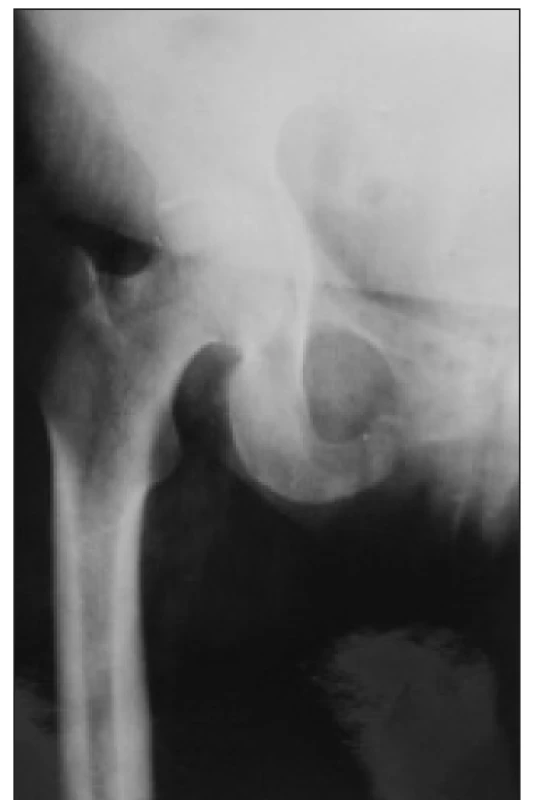
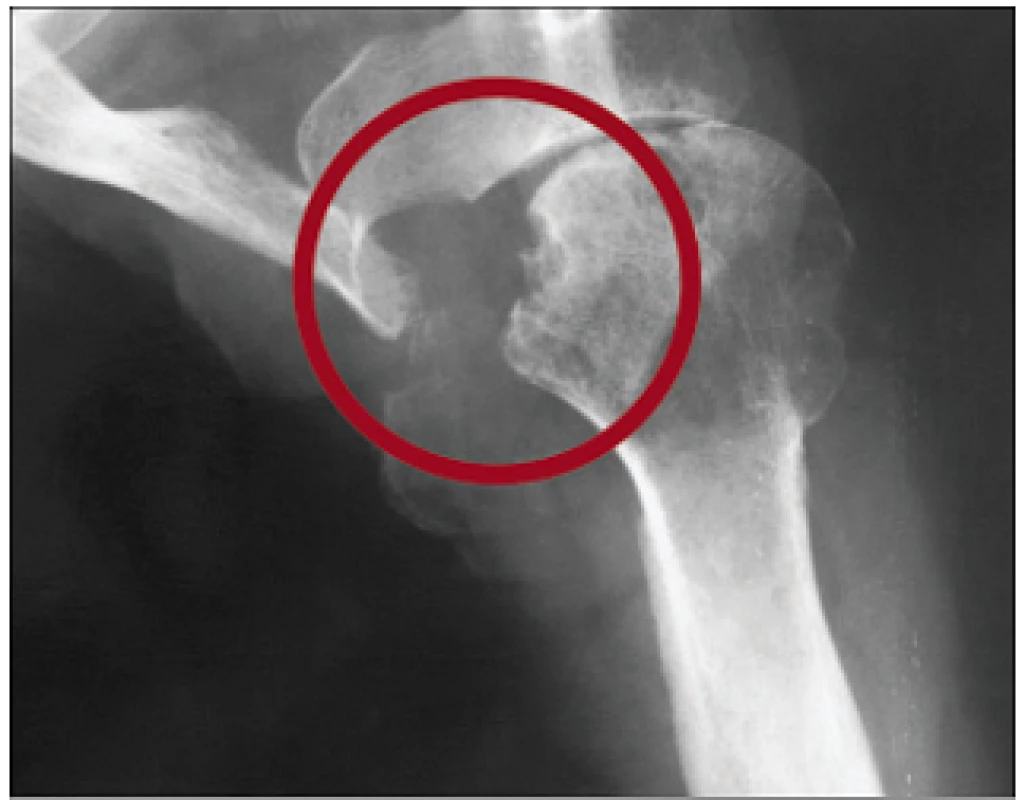
Tvoří ji chronická porucha funkce ledvin stupně 3-5, zvýšení iPTH a zvýšení aktivity nebo zvětšení jednoho i více příštítných tělísek. Sérové koncentrace vápníku, fosforu, ALP, bikarbonátů a hodnota Ca × P součinu odrážejí pokročilost poruchy a jsou důležité při léčebném rozhodování. Na RTG snímku rukou mohou být drobná projasnění v distálních článcích prstů, podmíněná subperiostální osteoresorpcí. Osteolytická ložiska různých velikostí kdekoliv ve skeletu jsou dnes raritní (obr. 3 a 4). Vyskytují se u nejtěžších forem terciární hyperparatyreózy a jejich podkladem jsou obrovskobuněčné nádory, tzv. hnědé tumory (obr. 5). Tvoří je fibroblasty, myofibroblasty a proliferující osteoklasty, čili vícejaderné obrovské buňky.
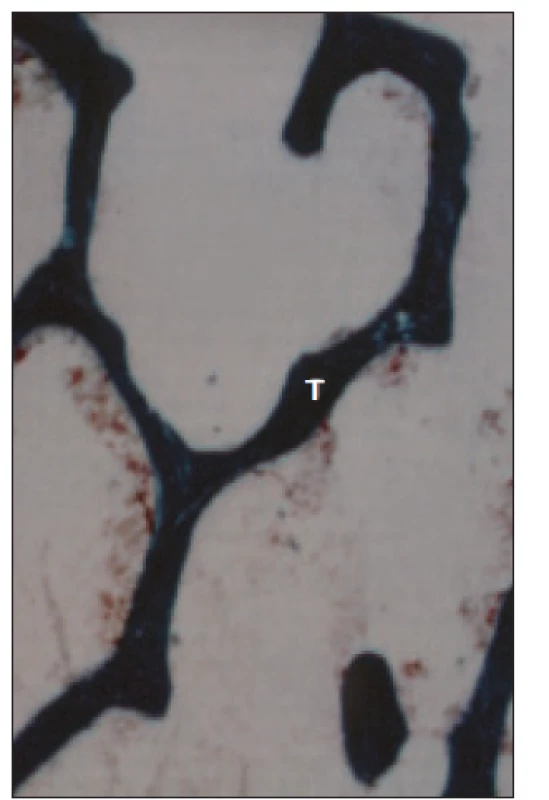
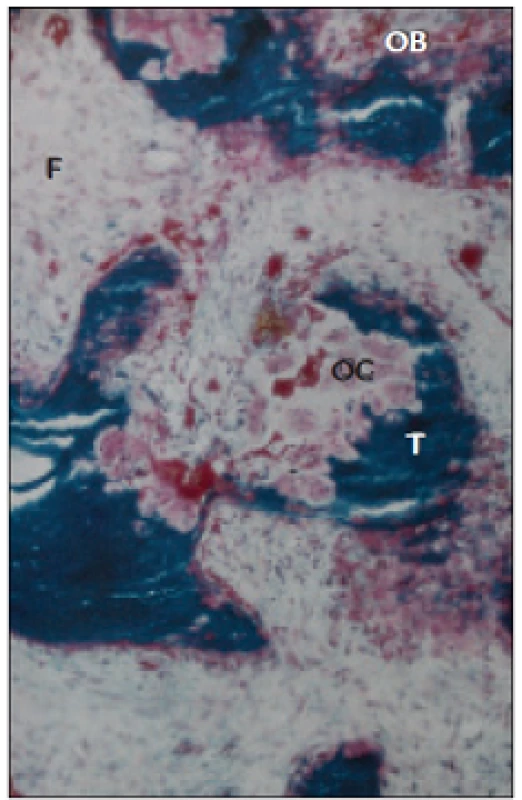
V kostní biopsii je typickým nálezem zmnožení osteoklastů, uzurace kostních trámců a fibróza kostní dřeně - osteitis fibrosa cystica. Zjišťuje se v 5-30 % kostních biopsií (obr. 6 a 7).
Smíšená renální osteodystrofie
Tento syndrom je v našich podmínkách nejčastější variantou renální minerálově-kostní poruchy, zjišťuje se zhruba v 70 % kostních biopsií. Morfologicky ji charakterizuje vysoký kostní obrat, nízká mineralizace a normální kostní objem. Patogeneticky se uplatňuje sekundární hyperparatyreóza a faktory podmiňující osteomalacii. Diagnóza je možná jen z kostní biopsie.
B. Nízkoobratová kostní porucha zahrnuje osteomalacii (OM), která je spojena s nízkou mineralizací, a adynamickou kostní nemoc (ABD) s mineralizací normální. V kostních biopsiích jsou zastoupeny 5-25 %.
Patogeneze
Čistá OM je při chronickém onemocnění ledvin v současnosti vzácností, příčinou je zřejmě nedostatek D vitaminu. V některých případech je v kostních vzorcích barvením prokazován hliník. Výskyt ABD naopak stoupá. V minulosti byla nejčastější příčinou intoxikace hliníkem, který se hromadí na rozhraní osteoidu a mineralizované kosti a v makrofázích kostní dřeně. Dnes v našich geografických podmínkách převažují nehliníkové formy ABD. Rizikovými faktory jsou kontinuální ambulantní peritoneální dialýza (CAPD), totální paratyreoidektomie, nepřiměřená suprese PTH vysokými dávkami D-vitaminu nebo vápníkem (dialýza proti roztoku se zvýšenou koncentrací kalcia, vysoké dávky kalciových vazačů fosfátů), malnutrice, diabetes mellitus (vliv pokročilých produktů glykace - AGE - advanced glycated endoproduct, relativní hypoparatyreóza při mikroangiopatii PT), stáří (deficit estrogenů, androgenů a tyreoidálních hormonů) a předchozí léčba kortikosteroidy. Inhibiční vliv na kostní metabolizmus má kromě hliníku také železo, stroncium a kadmium. Někdy je však příčina nejasná [5,12].
Klinický obraz
Klinický obraz je necharakteristický, je zvýšený sklon ke zlomeninám. Protože kost není schopna akumulovat kalciumfosfát, je značné riziko mimokostních kalcifikací.
Diagnóza
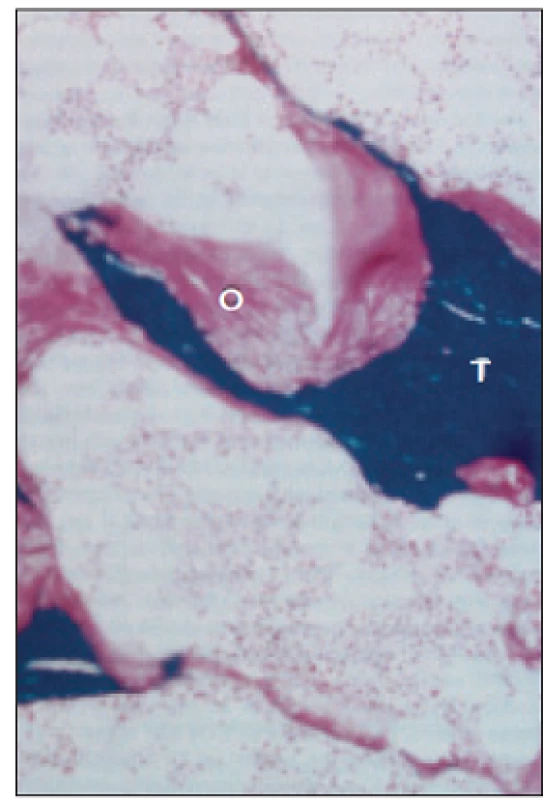
Diagnóza obou forem se zakládá na kostní biopsii. Podezření vzniká při iPTH < 100 pg/ml (< 10 pmol/l) a přítomnosti alespoň jednoho rizikového faktoru. Naopak iPTH > 400 pg/ml (> 33 pmol/l) nízkoobratové formy kostní poruchy vylučuje. Ukazatelem ABD může být zvýšení plazmatické koncentrace hliníku > 60 µg/l (> 2,2 mmol/l) a pozitivní desferalový test. Pro těžkou OM svědčí RTG nález pseudofraktur (Looserovy zóny), obr. 8. V kostní biopsii při OM jsou kostní trámce tvořeny z větší části nemineralizovaným osteoidem, který obklopuje nepravidelně ztenčenou mineralizovanou kost. Objem osteoidu se zvyšuje z normálních 2 až na 40 % (obr. 9). Při ABD je kost prořídlá, kostní trámce se nepropojují, lem osteoidu je úzký, nejsou vidět kostní buňky (obraz mrtvé kosti), obr. 10.

![Schéma 3. Při vzniku mediálních cévních kalcifikací je klíčovým faktorem hyperfosfatemie (PO4↑). Činností Na/P kotransportéru (NPC) se dostává fosfor z extracelulárního prostoru do hladké svalové buňky cév. Zvýšený intracelulární obsah fosfátů zásahem do exprese genů způsobí změny, které v konečném důsledku přispívají k tvorbě bioapatitu; podle [8].](https://pl-master.mdcdn.cz/media/image/189b1309ef872ca1cc34eb616db004de.png?version=1537792665)
Mimokostní kalcifikace
Tyto jsou patologické uloženiny vápníku a fosfátů (Ca/P) v měkkých tkáních. Při chronickém selhání ledvin se vyskytují v 80-90 % případů.
Patogeneze
Po ukončení kostního růstu každý příjem fosfátů, který přesahuje jejich renální exkreční kapacitu, vede k precipitaci Ca/P v měkkých tkáních. Po zániku funkce ledvin je proto vznik mimokostních kalcifikací nevyhnutelný, když denní příjem fosfátů převýší eliminační kapacitu dialyzačních procedur.
Dílčí poznatky ukazují, že klíčovými faktory jsou hyperfosfatemie, nedostatek inhibitorů kalcifikace a systém osteoprotegerin - receptor aktivátoru nukleárního faktoru κB-receptorový ligand (OPG-RANK-RANKL systém). Komplex inhibitorů kalcifikace tvoří cirkulující inhibitory fetuin A a osteoprotegerin a místní působky matrixový Gla-protein (MGP) a pyrofosfáty. Fetuin A patří mezi proteiny negativní fáze, tvoří se v játrech, jeho syntézu snižují zánět a malnutrice. Fyziologická hladina v krvi je kolem 1g/l, při selhání ledvin je snížena na polovinu. Osteoprotegerin je solubilní receptor pro RANKL, tvoří ho osteoblasty. MPG je závislý na K vitaminu, jeho deficit (dieta, warfarin) snižuje inhibiční funkci proteinu. Pyrofosfáty brání růstu hydroxyapatitových krystalů, rozkládá je tkáňově nespecifická alkalická fosfatáza (Tnap). Zánět, malnutrice, deficit K-vitaminu a Tnap tedy působí prokalcifikačně. Systém OPG-RANK-RANKL je biochemickým korelátem spřažení osteoblastické a osteoklastické kostní aktivity, neboť receptor RANK je exprimován na prekurzorech osteoklastu a jeho ligand RANKL na prekurzorech osteoblastu. Vazba RANK/RANKL podporuje osteoresorpci, vazba OPG/RANKL ji brzdí (účinek osteoprotektivní). V měkkých tkáních OPG inhibuje precipitaci Ca/P, a má proto účinek vaskuloprotektivní.
Nejpozoruhodnějším nálezem je však zjištění, že mimokostní kalcifikace vznikají aktivně regulovaným buněčným procesem. Proces byl popsán na hladké svalové buňce cév (SMVC), která vzniká diferenciací z pluripotentní buňky mezenchymální. Při hyperfosfatemii vnikají fosfáty do SMVC činností Na/P kotransportéru a zvýšený intracelulární obsah fosfátů změní kontraktilní svalovou buňku v sekreční buňku osteoblastického charakteru. Změna fenotypu buňky zahrnuje inhibici genů zodpovědných za syntézu svalových proteinů, expresi klíčového transkripčního faktoru osteoblastické diferenciace CBF A1 (core binding factor A1) a sekreci matrixových vezikul. CBF A1 reguluje tvorbu a sekreci důležitých osteoblastických proteinů včetně proteinů vázajících vápník. Matrixové vezikuly jsou úlomky dlouhých výběžků buněk osteoblastického typu, které jsou jádrem pro růst hydroxyapatitových krystalů. V mimokostní tkáni tak vznikají podmínky pro tvorbu uloženin typu hydroxyapatitu (obr. 11) [2,4,8,10,17,22].
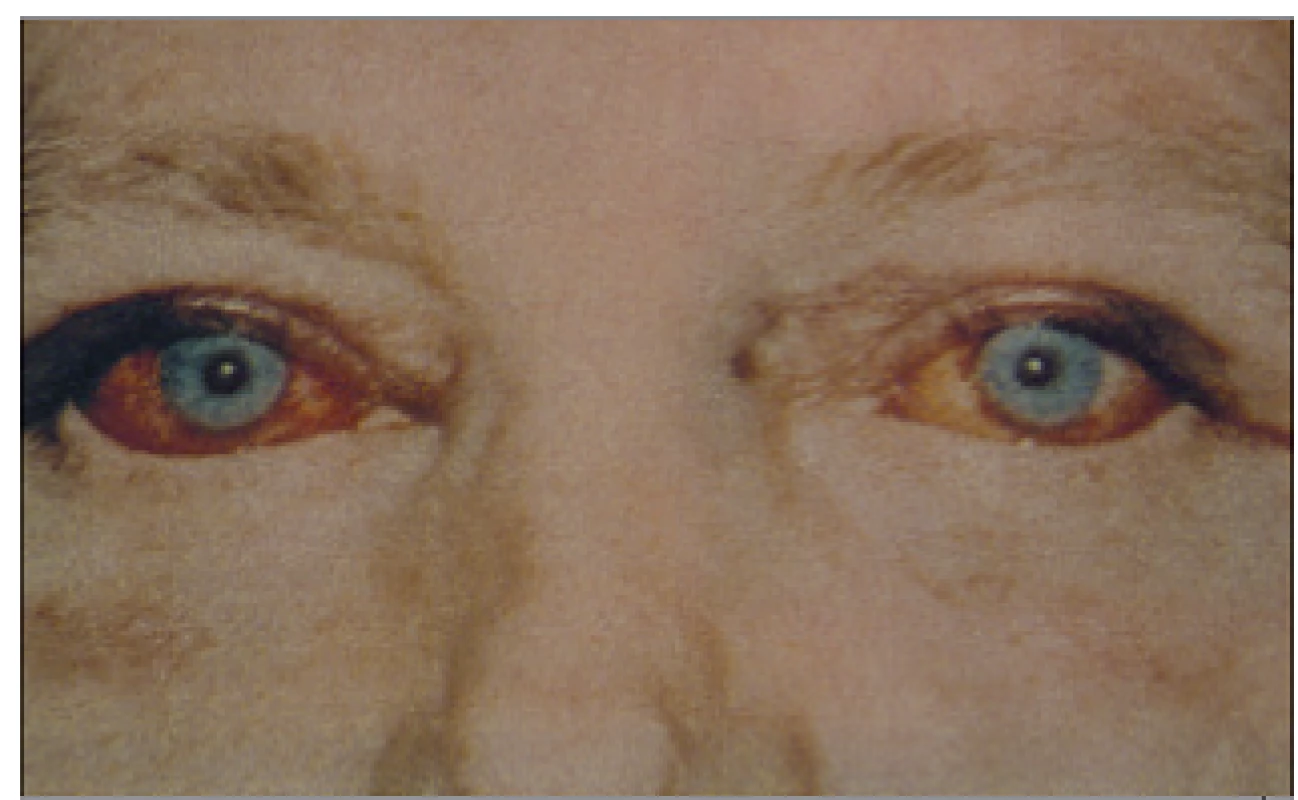
Klinický obraz
Klinicky nejnápadnější jsou kalcifikace v podkoží, okolí kloubů nebo spojivkách (obr. 12 a 13). Nejzávažnější jsou ale kalcifikace vaskulární (VC), které jsou dvojího typu: buď intimální, které jsou součástí aterosklerózy jako v běžné populaci, nebo mediální (Mönckebergova arterioskleróza čili mediokalcinóza). Tyto kalcifikace jsou difuzní a obkružující a vznikají na základě minerální poruchy. Kalcifylaxe neboli kalcifikující uremická arteriolopatie je vzácnou formou VC. Při distálním typu je postižena kůže dolních končetin, při proximálním typu kůže břicha, hýždí či vnitřních ploch stehen. Vznikají nehojící se ulcerace a na léčbu rezistentní gangréna, která vede k amputacím nebo nekontrolované sepsi a smrti. Hyperfosfatemie a cévní kalcifikace jsou nezávislým rizikovým faktorem kardiovaskulární morbidity i mortality [1,4,11,18].
Dialyzační kostní amyloidóza
Dialyzační kostní amyloidóza je jedním z projevů specifické systémové amyloidózy, která postihuje nemocné léčené déle než 5 let hemodialýzou přes nízkopropustné membrány. Při peritoneální dialýze je riziko amyloidózy nižší, pravděpodobně pro dlouhodoběji zachovanou zbytkovou funkci ledvin. Z důvodu diferenciální diagnostiky se řadí mezi minerálově-kostní poruchy, i když etiopatogeneticky k nim nepatří.
Patogeneze
Příčinou je ukládání glykovaného β2-mikroglobulinu (AGE-β2-MG) v podobě amyloidových vláken do kolagenních struktur kosti a chrupavky. Β2-MG (11 800 D) tvoří endotelie a buňky imunitního systému, je součástí molekul antigenů I. třídy HLA systému, odstraňuje se ledvinami. Po filtraci je reabsorbován tubulárními buňkami a v nich odbourán lysozomálními proteinázami. Normální plazmatická koncentrace je 0,8-3 mg/l, u hemodialyzovaných nemocných se zvyšuje až 40krát. Uloženiny β2-MG v kostech a kloubech vzbuzují tvorbu prozánětlivých cytokinů IL-1, IL-6, TNFα a zvyšují činnost osteoklastů. Dochází k erozi chrupavky a osteoresorpci, která není následována kostní novotvorbou, na rozdíl od účinku PTH.
Klinický obraz
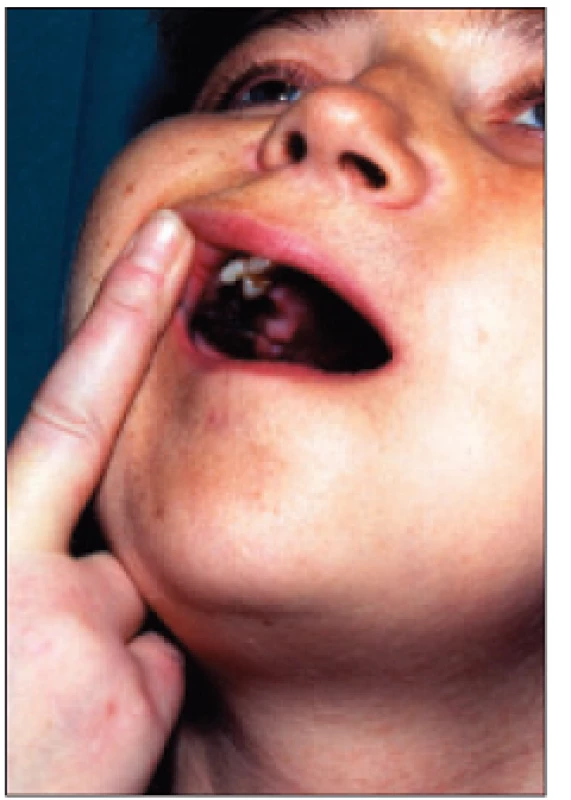
Nejčastějšími klinickými projevy jsou syndrom karpálního tunelu (SCT), periartritis ramenního kloubu, kostní cysty a destruktivní artropatie (obr. 14).
Diagnóza
Diagnóza se zakládá na typických klinických projevech. Při SCT jsou příznaky útlaku mediálního nervu. Při kloubním postižení je chronický otok a bolest, někdy výpotek, který je často hemoragický. Kostní cysty způsobují patologické zlomeniny. Plazmatické koncentrace β2-MG se nevyšetřují, neboť s tíží klinických projevů nekorelují. Ze zobrazovacích metod lze využít sonografii, CT, izotopové vyšetření, nejčastější je však RTG vyšetření. Hlavní radiologickou známkou jsou periartikulární eroze a subchondrální kostní cysty v blízkosti synoviálních kloubů, které se typicky zvětšují [7].
Léčba
Vysokoobratová minerálově-kostní porucha
Vyrovnaná bilance fosfátů
Cílem je předejít rozvoji sekundární hyperparatyreózy. Je třeba omezit denní příjem fosfátů na < 1 000 mg. Ze stravy se vylučují sýry tavené, zrající a tvrdé, vaječný žloutek, vnitřnosti, nevykostěné ryby jako sardinky, očka a sledě, suché luštěniny, čokoláda a tmavé nápoje typu koly, také černé pivo. Při hlavních jídlech se užívají střevní vazače fosfátů. U nás je nejčastěji užívaným vazačem uhličitan vápenatý. Z nekalciových vazačů je dostupný sevelamer hydrochlorid a uhličitan lanthanu [21]. Denní příjem bílkovin se redukuje podle funkčního stadia chronického onemocnění ledvin. Přednost mají biologicky plnohodnotné bílkoviny, v indikovaných případech se podávají ketoanaloga esenciálních aminokyselin. Pacient musí být nutričně sledován, aby se zabránilo malnutrici.
Prevence a léčba deficitu D-vitaminu
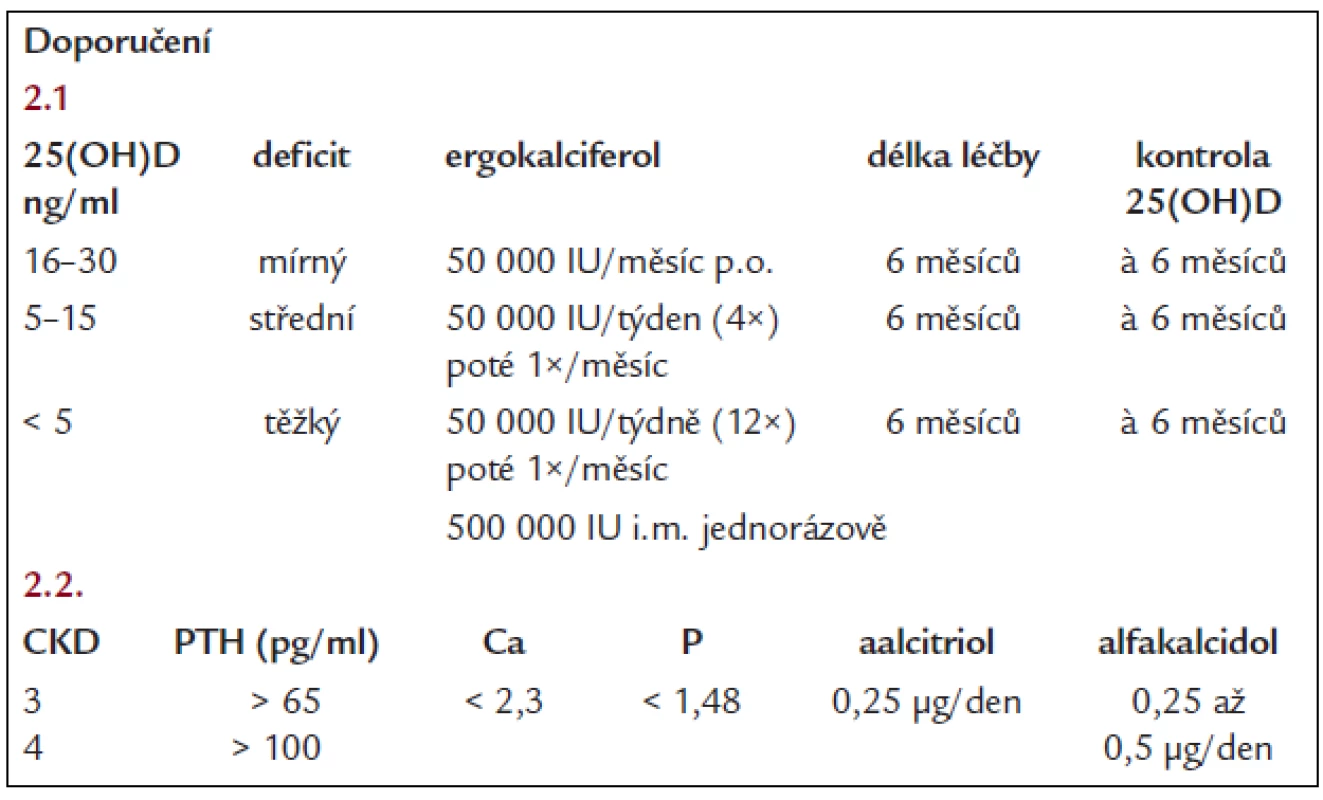
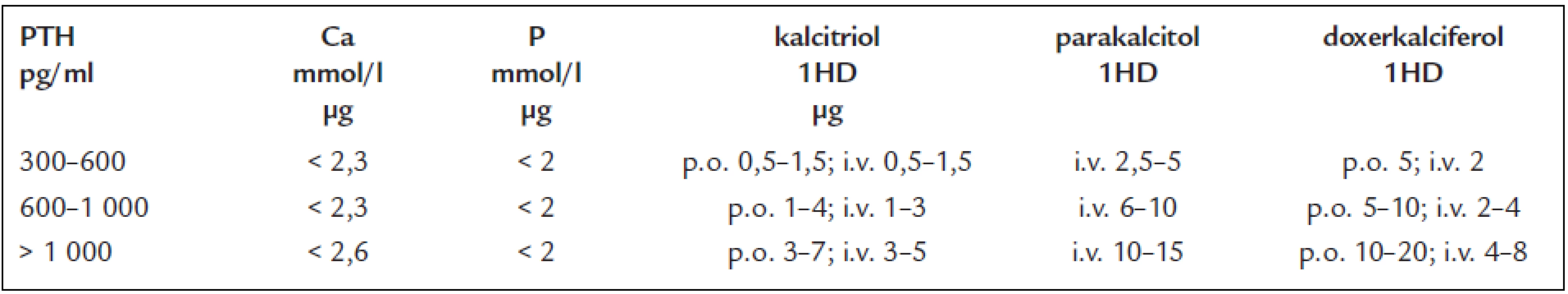
Cílem je zabránit vzniku osteomalacie i neúčelnému rozvoji sekundární hyperparatyreózy. Převyšuje-li hladina iPTH horní limit doporučeného rozmezí pro daný stupeň chronického onemocnění ledvin (tab. 1), měla by se změřit hladina 25-hydroxycholekalciferolu v séru. Je-li < 30 ng/ml, je na místě doplnění ergokalciferolem, aktivními metabolity či analogy D-vitaminu (tab. 4). Po zahájení léčby by se měly sérové hladiny vápníku a fosforu kontrolovat 1krát za měsíc po první 3 měsíce a poté jednou za 3 měsíce [3,23].
Suprese sekrece a syntézy PTH
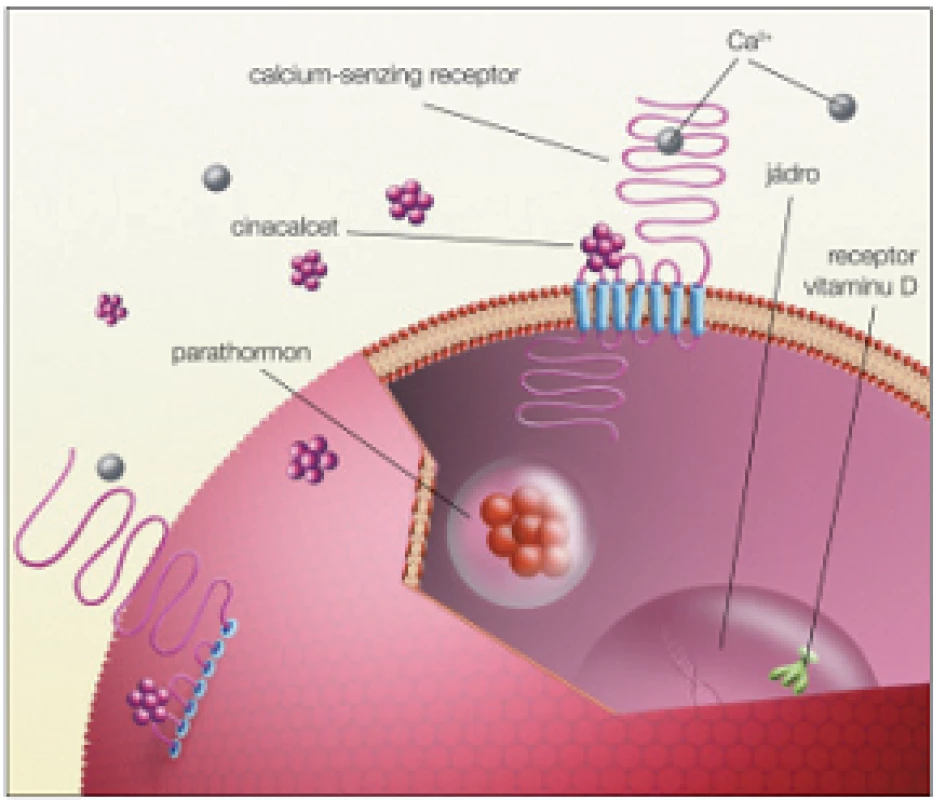
Cílem je předejít vzniku kostní poruchy, mimokostních kalcifikací a nodulární hyperplazie PT. Provádí se u dialyzovaných nemocných, když iPTH > 300 pg/ml. Lékem první volby je kalcitriol. Při neúčinnosti nebo vzniku hyperkalcemie a hyperfosfatemie jsou na místě analoga D vitaminu nebo kalcimimetikum. Analoga D-vitaminu podporují střevní resorpci vápníku a fosfátů méně než kalcitriol a riziko hyperkalcemie a hyperfosfatemie při jejich podávání je proto nižší. Kalcimimetika střevní resorpci Ca a P neovlivňují vůbec, jsou synteticky vytvořenými ligandy receptoru pro vápník (CaR). V buňkách příštítné žlázy zvyšují aktivitu CaR podobně jako zvýšená hladina vápníku. Důsledkem je pokles sekrece a syntézy PTH. Na rozdíl od vápníku, který se váže na extracelulární část receptoru, vazebným místem pro kalcimimetika je membranózní část CaR (obr. 15) [1,3,14,16,23].
Úvodní dávkovací schéma uvádí tab. 5. V průběhu léčby nemají sérové hladiny Ca a P překračovat doporučené rozmezí.
Paratyreoidektomie
Paratyreoidektomie je indikována u těžké hyperparatyreózy s hyperkalcemií a rezistencí na konzervativní léčbu. Při subtotální metodě se ponechá in situ resekát nejmenšího tělíska s cévním zásobením, ostatní nalezená tělíska se odstraní. Při totální metodě se odstraní všechna tělíska a resekát se transplantuje do svaloviny předloktí. Nověji se v indikovaných případech doporučuje tzv. miniinvazivní paratyreoidektomie. Je vhodná při zjištění adenomu jen jednoho tělíska. Ten se odstraní operativně, zbývající tělíska se nerevidují, jejich činnost se dále kontroluje konzervativními léčebnými postupy.
Léčba nízkoobratových minerálově-kostních poruch
Osteomalacie
OM způsobená nedostatkem D-vitaminu se léčí jeho dodáním (viz léčba vysokoobratové poruchy). Osteomalacii způsobené toxicitou hliníku lze předejít. Je třeba se vyhnout preparátům obsahujícím hliník nebo citrát, který resorpci hliníku podporuje. V dialyzačním roztoku nemá hladina hliníku přesahovat 10 µg/l. Přetížení hliníkem je indikací pro léčbu desferoxaminem [4,23].
Adynamická kostní nemoc
Cílem je iPTH > 100 pg/ml, kdy se zvyšuje kostní obrat. Je nutno snížit dávky D-vitaminu nebo jeho podávání přerušit. Koncentrace vápníku v dialyzačním roztoku by měla být 1,25 mmol/l [4,23].
Léčba při výskytu mimokostních kalcifikací
Je nutné omezit příjem fosfátů a udržovat jejich vyrovnanou bilanci. Pro snížení střevní resorpce fosfátů jsou vhodné jedině vazače nekalciového typu. Preparáty s vápníkem a D-vitaminy jsou kontraindikovány. K supresi PTH lze užít jen analoga D-vitaminu nebo kalcimimetikum [1].
Léčba dialyzační kostní amyloidózy
Jedinou účinnou léčbou je transplantace ledviny, která zastaví progresi. Mimotělní očišťování krve by se mělo provádět přes vysoce propustné membrány, které umožňují high-flux hemodialýzu, hemofiltraci nebo hemodiafiltraci. Jinou možností je užití membrán absorbujících β2-MG [7].
Závěr
Postupující chronické onemocnění ledvin je spojeno s deficitem D-hormonu, negativní bilancí vápníku a pozitivní bilancí fosfátů. Při substituci D-hormonu se klíčovým faktorem vzniku a progrese sekundární hyperparatyreózy a mimokostních kalcifikací stávají fosfáty. Nejúčelnějším léčebným postupem je proto udržení vyrovnané bilance fosfátů omezením jejich příjmu, případně snížením střevní resorpce pomocí fosfátových vazačů. Aby tato opatření byla účinná, musí být zahájena včas. U nemocných s chronickým selháním ledvin je nezbytné adekvátní dialyzační léčení. Všechny ostatní léčebné prostředky již jen mírní následky nedodržování této zásady a jsou finančně nákladné.
Poznámka
Nový název, definice a klasifikace kostních poruch při chronickém onemocnění ledvin je doporučením KDIGO (Kidney Disease: Improving Global Outcomes). Při vyšetřování a hodnocení biochemických nálezů a pro léčebné postupy odkazuje na nová doporučení americké National Kidney Foundation - New K/DOQI (Kidney Disease Outcomes Quality Initiative) z roku 2003. KDIGO je nezávislá a neprofitní nadace, která byla založena v roce 2003 a je řízená mezinárodní radou ředitelů - expertů. Jejím posláním je zlepšit péči a výsledky léčby nemocných s renálním onemocněním podporou spolupráce, integrace iniciativ a koordinace. Vytváří doporučení, která mají být všeobecně akceptovatelná a realizovatelná v běžné klinické praxi. V roce 2004 dala KDIGO doporučení klasifikace chronického onemocnění ledvin na základě hodnoty glomerulární filtrace, která se dnes již běžně používá.
MUDr. Doris Sobotová, CSc.
www.fnusa.cz
e-mail: doris.sobotova@fnusa.cz
Doručeno do redakce: 9. 5. 2007
Sources
1. Block GA, Spiegel DM, Ehrlich J et al. Effects of sevelamer and calcium on coronary artery calcification in patients new to hemodialysis. Kidney Int 2005; 68 : 1815-1824.
2. Braun J. Extraosseous calcification in patiens with chronic renal failure - no escape? Nephrol Dial Transplant 2005; 20 : 2054-2059.
3. Braun AJ, Dusso AS, Slatopolsky E. Vitamin D analogues for secondary hyperparathyreoididism. Nephrol Dial Transplant 2002; 17 (Suppl 10): 10-19.
4. Cannata-Andia JB, Rodriguez-Garcia M. Hyperphosphatemia as a cardiovascular risk factor - how to manage the problem? Nephrol Dial Transplant 2002; 17 (Suppl 11): 16-19.
5. Cannata-Andia JB Pathogenesis, prevention and management of low-bone turnover. Nephrol Dial Transplant 2006; 15 (Suppl 5): 15-17.
6. Ferreira A Biochemical markers of bone turnover in the diagnosis of renal osteodystrophy: What do we have, what do we need? Nephol Dial Transplant 1998; 13 (Suppl 3): 29-32.
7. Ferreira A, Urena P, Ang KS et al. Relationship between serum β2mikroglobulin, bone histology, and dialysis membranes in uremic patients. Nephrol Dial Transplant 1995; 10 : 1701-1707.
8. Floege J, Ketteler M. Vascular calcification in patients with end-stage renal disease. Nephrol Dial Transplant 2004; 19 (Suppl 5): 59-66.
9. Gal-Moscovici A, Popovtzer MM. Parathyreoid hormone-independent osteoclastic resorptive bone disease: a new variant of adynamic bone disease in haemodialysis patients. Nephrol Dial Transplant 2002; 17 : 620-624.
10. Ketteler M, Floege J. Calcification and the usual suspect phosphate: still guilty but there are other guys behind the scenes. Nephrol Dial Transplant 2006; 21 : 33-35.
11. London GM, Guerin AP, Marchais SJ et al. Arterial media calcification in end-stage renal disease: impact on all-cause and cardiovascular mortality. Nephrol Dial Transplant 2003; 18 : 1731-1740.
12. Malluche HH. Aluminium and bone disease in chronic renal failure. Nephrol Dial Transplant 2002; 17 (Suppl 2): 21-24
13. Moe S, Drüeke T, Cunningham J et al. Definition, evaluation, and classification of renal osteodystrophy: A position statement from Kidney Disease: Improving Global Outcomes (KDIGO). Kidney Int 2006; 69 : 1945-1953.
14. Persy VP, Behets GJ, Bervoets AR et al. Lanthanum: A safe phosphate binder. Seminars in Dialysis 2006; 19 : 195-199.
15. Rodriguez M, Nemeth E, Martin D. The calcium-sensing receptor: a key factor in the pathogenesis of secondary hyperparathyreoidism. Am J Physiol Renal Physiol 2005; 288: F253-F264.
16. Shahapuni I, Mansour J, Harbouche L et al. How do calcimimetics fit into the management of parathyroid hormone, calcium, and phosphate disturbances in dialysis patients? Seminars in Dialysis 2005; 18 : 226-238.
17. Shanaham CM. Vascular calcification - a matter of damage limitation. Nephrol Dial Transplant 2006; 21 : 1166-1169.
18. Sigrist M, Bungay P, Taal MT et al. Vascular calcification and cardiovascular function in chronic kidney disease. Nephrol Dial Transplant 2006; 21 : 707-714.
19. Silver J. Molecular mechanism of secundary hyperparathyreoidism. Nephrol Dial Transplant 2000; 15 (Suppl 5): 2-7.
20. Slatopolsky E. The role of calcium, phosphorus and vitamin D metabolism in the development of secondary hyperparathyreoidism. Nephrol Dial Transplant 1998; 13 (Suppl 3): 3-8.
21. Tokumoto M, Tsuruya K, Fukuda K et al. Parathyroid cell growth in patients with advanced secondary hyperparathyroidism: vitamin D receptor and cyclin-dependent kinase inhibitors, p21 and p27. Nephrol Dial Transplant 2003; 18 (Suppl 3): 9-12.
22. Westenfeld R, Ketteler M, Brandenburg VM. Anti-RANKL therapy - implications for the bone-vascular-axis in CKD? Denosumab in post-menopausal women with low bone mineral density. Nephrol Dial Transplant 2006; 21 : 2075-2077.
23. National Kidney Foundation. K/DOQI clinical praktice guidelines for bone metabolism and disease in chronic kidney disease. Am J Kidney Dis 2003; 42 (Suppl 3).
Labels
Diabetology Endocrinology Internal medicineArticle was published in
Internal Medicine

2007 Issue 7-8
-
All articles in this issue
- Kam kráčíš, hypofýzo? Hrst novinek a perspektiv
- Subklinické tyreopatie
- Aspirační cytologie štítné žlázy
- Autoimunitní polyglandulární syndromy: klinické aspekty
- Endokrinologicko-nukleárně medicínské aspekty v léčbě nádorů štítné žlázy
- Hypopituitarizmus: substituční terapie
- Náhodně zjištěné expanze v selární oblasti
- Incidentalomy nadledvin
- Diferenciální diagnostika hyperkalcemií
- Glukokortikoidy a osteoporóza
- Minerálově-kostní porucha při chronickém onemocnění ledvin
- Perorální léčba diabetes mellitus 2. typu
- Transplantace v léčbě diabetu
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue
- Hypopituitarizmus: substituční terapie
- Autoimunitní polyglandulární syndromy: klinické aspekty
- Aspirační cytologie štítné žlázy
- Náhodně zjištěné expanze v selární oblasti
