Využití pozitronové emisní tomografie (18F‑FDG PET) v diagnostice chronických periaortitid
The use of positron emission tomography (18F-FDG PET) in diagnosing chronic periaortitis
Chronic periaortitis involving idiopathic retroperitoneal fibrosis, inflammatory aneurysm of the abdominal aorta and perianeurysmal retroperitoneal fibrosis is a rare disease characterised by the development of an inflammatory fibrotising process surrounding large vessels and organs of the retroperitoneum. According to some authors, chronic periaortitis results from a systemic autoimmune inflammation with vasculitis affecting aortal vasa vasorum and medium and small calibre retroperitoneal vessels. The disease is assumed to have immunopathogenetic background. Chronic periaortitis is diagnosed with the use of ultrasonography, computed tomography or magnetic resonance, and needle biopsy is mostly used for biopsy examinations. Positron emission tomography (PET) is a non-invasive diagnostic method which shows the biodistribution of positron emitter labelled radiopharmaceuticals in the body. Due to the fact that not only tumorous, but in certain conditions also some inflammatory cells may exhibit increased accumulation of 18F-FDG (2-[18F]-fluoro-2‑de-oxy-D-glukose, 18F-FDG PET can be used to diagnose and to ascertain the activity of some types of chronic inflammations. We report a case of a 60-year old man with idiopathic retroperitoneal fibrosis. 18F-FDG PET examination shoed an increased accumulation of the radiopharmaceutical around the abdominal aorta and of common ileac veins of the retroperitoneum. 18F-FDG PET fusion and computed tomography (CT) showed a correlation between the metabolically active tissue (PET) and the soft tissue infiltrate visible in CT images. A control exam done 4 months after the start of systemic therapy showed that the pathological accumulation of the radiopharmaceutical in the retroperitoneum had disappeared. 18F-FDG PET may be a useful tool to improve diagnosis of chronic periaortitis. A significant contribution of this method is the possibility to assess the activity of the pathologic process while monitoring the effect of the treatment.
Key words:
diagnosis – chronic periaortitis – retroperitoneal fibrosis – therapy – 18F-FDG
Authors:
P. Němec 1; Z. Řehák 2; P. Fabian 3; M. Souček 1
Authors‘ workplace:
II. interní klinika Lékařské fakulty MU a FN u sv. Anny Brno, přednosta doc. MUDr. Miroslav Souček, CSc.
1; Oddělení nukleární medicíny – centrum PET Masarykova onkologického ústavu Brno, vedoucí lékař oddělení prim. MUDr. Karol Bolčák
2; Oddělení onkologické a experimentální patologie – úsek diagnostické bioptické patologie Masarykova onkologického ústavu Brno, vedoucí lékař oddělení prim. MUDr. Rudolf Nenutil, CSc.
3
Published in:
Vnitř Lék 2008; 54(11): 1093-1099
Category:
Case Report
Overview
Chronická periaortitida, zahrnující idiopatickou retroperitoneální fibrózu, zánětlivé aneurysma abdominální aorty a perianeurysmální retroperitoneální fibrózu, je vzácné onemocnění charakterizované vývojem zánětlivého fibrotizujícího procesu obklopujícího velké cévy a orgány retroperitonea. Podle některých autorů je chronická periaortitida výsledkem systémového autoimunitního zánětu s vaskulitidou postihující aortální vasa vasorum a retroperitoneální cévy středního a malého kalibru. Předpokládá se imunopatogenetický podklad tohoto onemocnění. K diagnostice chronické periaortitidy se využívá ultrasonografie, výpočetní tomografie nebo magnetická rezonance a bioptické vyšetření prováděné nejčastěji jehlovou biopsií. Pozitronová emisní tomografie (PET) je neinvazivní diagnostická metoda zobrazující biodistribuci radiofarmak značených pozitronovým zářičem v lidském těle. Vzhledem k tomu, že nejen nádorové buňky, ale za určitých podmínek i některé buňky zánětu mohou vykazovat zvýšenou akumulaci 18F‑FDG (2-[18F]-fluoro‑2-deoxy-D-glukózy), lze 18F‑FDG PET využít rovněž k diagnostice a určení aktivity některých typů chronických zánětů. Předkládáme případ 60letého muže s idiopatickou retroperitoneální fibrózou. 18F‑FDG PET vyšetření prokázalo u tohoto pacienta zvýšenou akumulaci radiofarmaka v okolí břišní aorty a společných ilických tepen v retroperitoneu. Fúze 18F‑FDG PET a výpočetní tomografie (CT) prokázala korelaci mezi metabolicky aktivní tkání (PET) a měkkotkáňovým infiltrátem patrným na CT. Kontrolní vyšetření provedené 4 měsíce po zahájení systémové terapie prokázalo vymizení patologické akumulace radiofarmaka v retroperitoneu. 18F‑FDG PET může být užitečným nástrojem přispívajícím k diagnostice chronické periaortitidy. Významným přínosem této vyšetřovací metody je možnost posouzení aktivity patologického procesu a současně možnost monitorace efektu jeho léčby.
Klíčová slova:
diagnostika – chronická periaortitida – retroperitoneální fibróza – terapie – 18F‑FDG PET
Úvod
Chronická periaortitida, zahrnující idiopatickou retroperitoneální fibrózu (RPF), zánětlivé aneurysma abdominální aorty a perianeurysmální RPF, je vzácné onemocnění charakterizované vývojem zánětlivého fibrotizujícího procesu obklopujícího velké cévy a orgány retroperitonea [1,2]. RPF, která byla poprvé popsána v roce 1948, je rovněž označována jako morbus Ormond [3]. Onemocnění se vyskytuje 2krát častěji u mužů než u žen, nejčastěji mezi 30. a 60. rokem s incidencí přibližně 1 případ na 20 tisíc obyvatel [4]. Předpokládá se imunopatogenetický mechanizmus vzniku a vývoje tohoto onemocnění [5]. Idiopatická RPF tvoří 2/3 případů, zbývající 1/3 případů RPF je asociovaná s chronickými zánětlivými procesy, malignitami, použitím některých léků nebo s procesy postihujícími retroperitoneum, jako jsou infekce, trauma, aneurysma abdominální aorty nebo akutní pankreatitida [4,6]. K diagnostice chronické periaortitidy se ze zobrazovacích metod standardně využívá ultrasonografie (USG), výpočetní tomografie (CT) nebo magnetická rezonance (MRI). Ve většině případů je nutné k definitivnímu potvrzení diagnózy provést bioptické vyšetření. Pozitronová emisní tomografie (PET) je neinvazivní diagnostická metoda zobrazující biodistribuci radiofarmak značených pozitronovým zářičem v lidském těle. Tato metoda je nejčastěji využívána k diagnostice a hodnocení aktivity nádorových onemocnění. Vzhledem k tomu, že i některé buňky zánětu mohou vykazovat zvýšenou akumulaci 18F‑FDG (2-[18F]-fluoro‑2-deoxy-D-glukózy), lze 18F‑FDG PET rovněž využít k diagnostice a monitorování aktivity některých typů chronických zánětů. Předkládáme případ 60letého muže s idiopatickou RPF, u kterého byla 18F‑FDG PET využita k diagnostice onemocnění a monitoraci aktivity procesu v průběhu terapie.
Kazuistika
60letý muž, dlouholetý kuřák s doposud nevýznamnou anamnézou, vyjma alergické kožní reakce po užití acetylsalicylové kyseliny a V-penicilinu, byl v lednu roku 2006 vyšetřen praktickým lékařem pro bolesti dolní části zad a pálivé bolesti močové trubice, které se objevily po prodělaném horečnatém onemocnění s příznaky infektu horních cest dýchacích. Byla zjištěna hypertenze a zahájena terapie ACE inhibitorem. Bolesti dolní části zad byly diagnostikovány jako vertebrogenní obtíže a pacient byl odeslán na rehabilitační oddělení k pohybové terapii a elektroléčbě. Pro přetrvávající dysurické obtíže byl pacient odeslán na urologii. Na základě výsledků provedených vyšetření (USG, CT) bylo vysloveno podezření na přítomnost ložiskového procesu retroperitonea. Pacient byl nadále ambulantně sledován v urologické ambulanci. Jeho potíže se však stupňovaly. Zvyšovala se intenzita bolestí dolní části zad. Pacient tyto bolesti popisoval jako tupé, kontinuální, vystřelující symetricky do oblasti hýždí a třísel. Dále popisoval časté nutkání k močení a pálivé bolesti močové trubice. Opakovaně byl léčen antibiotiky pro recidivující záněty močových cest.
V lednu roku 2007 byl hospitalizován na urologickém oddělení. USG vyšetření prokázalo homogenní, středně echogenní infiltrát cirkulárně obkružující břišní aortu v šířce 11–13 mm. Lékař hodnotící USG vyšetření vyslovil podezření na lymfadenopatii, případně maligní proces. Doprovodným nálezem byly známky městnání v dutém systému pravé ledviny s rozšířením ledvinných kalichů na 15 mm a dilatací extrarenálně uložené ledvinné pánvičky rozměrů 32 × 20 mm, s odstupujícím ureterem šíře 7 mm, bez průkazu konkrementů ve vývodných močových cestách. Vyšetření dále prokázalo konkrement velikosti 11 mm v dolním kalichu levé ledviny, bez známek městnání v dutém systému. Laboratorně byly detekovány normální sérové hladiny močoviny (4,69 mmol/l) a kreatininu (84,56 μmol/l), zvýšená sérová hladina C‑reaktivního proteinu (CRP) na 19,27 mg/l a normální parametry krevního obrazu. Drenáž obou ledvin byla zajištěna inzercí JJ stentů do obou ureterů. Pacientovi bylo doporučeno provedení laparoskopického výkonu s bioptickým odběrem vzorku patologických tkání retroperitonea. Pacient však doporučený výkon odmítl.
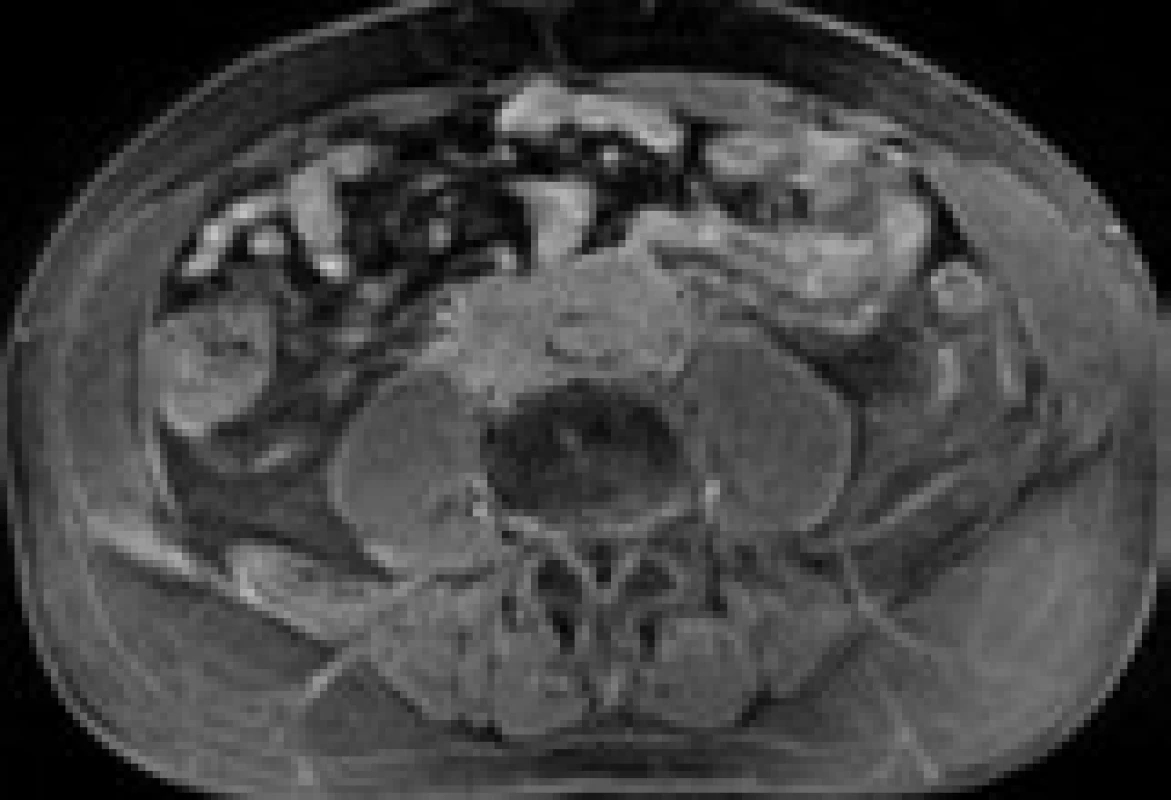
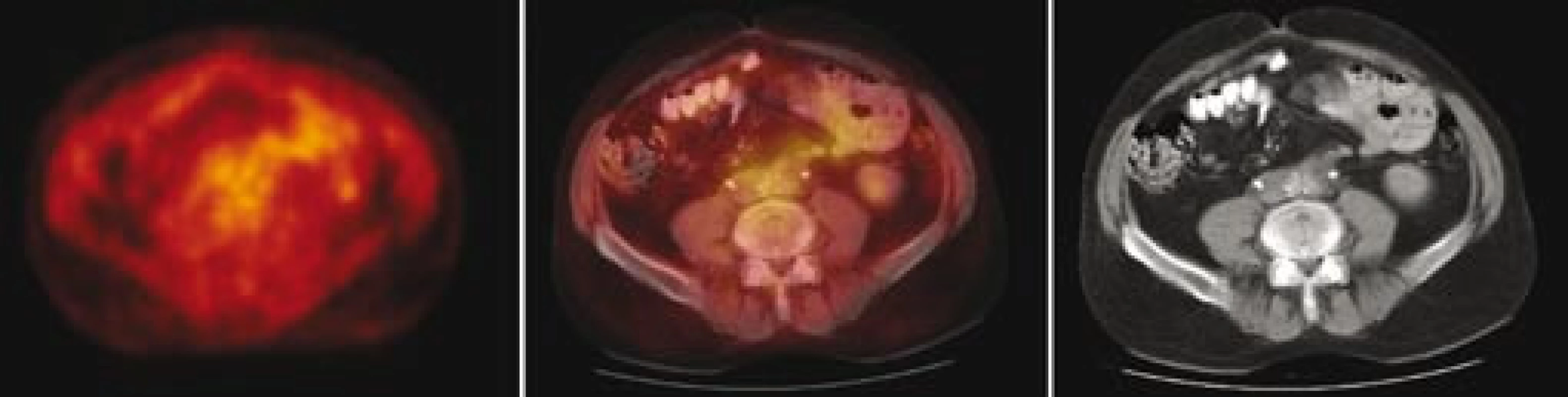
Následně byl předán do péče Masarykova onkologického ústavu v Brně. V dubnu roku 2007 bylo provedeno první vyšetření 18F‑FDG PET, které prokázalo ložisko patologického hypermetabolizmu glukózy v retroperitoneu obkružující kaudální část břišní aorty a společné iliické tepny (obr. 1). Fúze PET a CT prokázala korelaci metabolicky aktivních tkání (PET) s lemem měkkotkáňových struktur obkružujících břišní aortu (CT) (obr. 2). Současně bylo provedeno MRI vyšetření retroperitonea, které prokázalo rozsáhlý patologický infiltrát v retroperitoneu v okolí abdominální aorty zasahující od odstupu renálních tepen až do malé pánve přibližně 5 cm pod úroveň bifurkace aorty, do kterého byly zavzaty velké cévy, zejména abdominální aorta a pravá společná iliická tepna (obr. 3). Vyšetření rovněž prokázalo výraznou kompresi dolní duté žíly tímto infiltrátem. Kraniokaudální rozměr infiltrátu byl 14 cm. V transverzálním řezu v úrovni bifurkace aorty měl infiltrát rozměry 74 × 38 mm. Bylo vysloveno podezření na RPF nejasné etiologie. Pro rizikovost výkonu nebylo doporučeno provedení jehlové biopsie pod CT kontrolou.
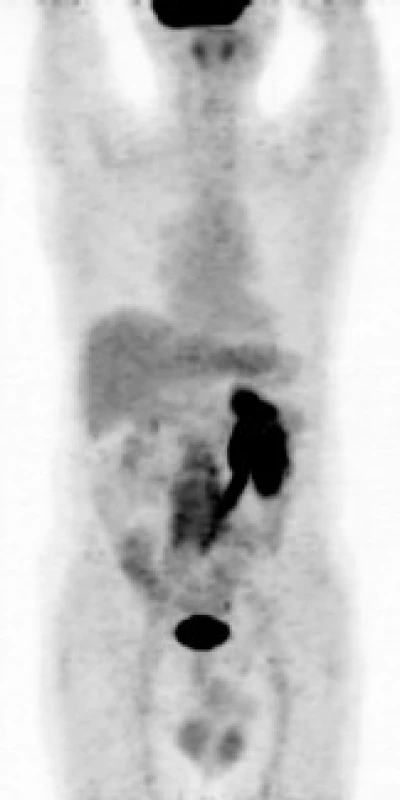
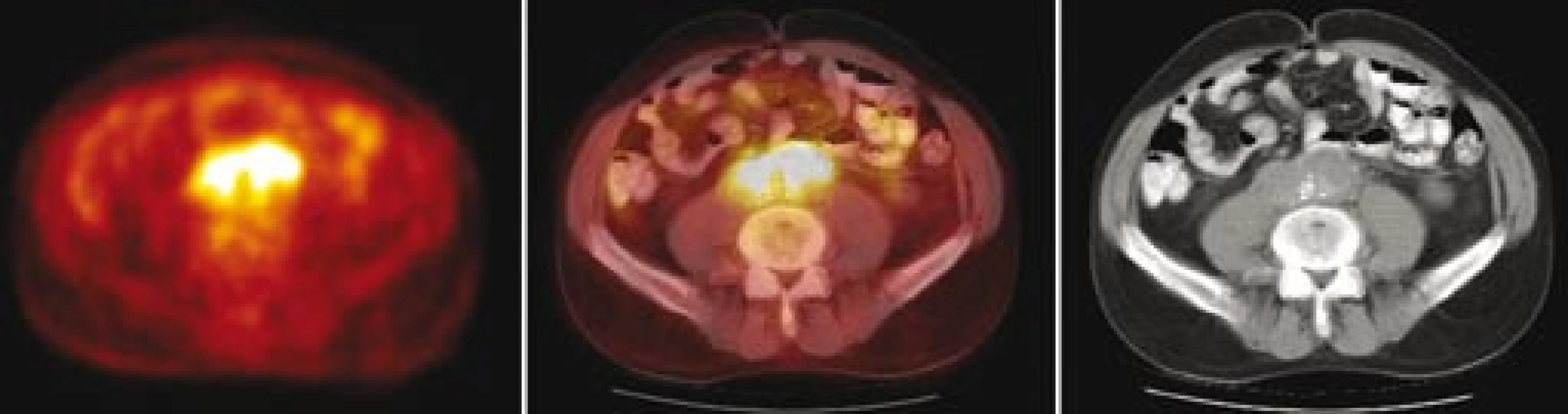
Pacient byl následně v červnu roku 2007 přijat k hospitalizaci na chirurgické oddělení Masarykova onkologického ústavu v Brně. Laboratorně byly prokázány mírně zvýšené sérové hladiny močoviny (10,8 mmol/l) a kreatininu (136 μmol/l), normální hladiny minerálů a normální parametry krevního obrazu. Byl proveden laparoskopický výkon s pokusem o odběr vzorku patologické tkáně retroperitonea. Z důvodu neúspěchu však následně musela být provedena laparotomie, při které byly odebrány bioptické vzorky retroperitoneálního infiltrátu. Histologické vyšetření, prokazující přítomnost bohatě fibrotizované tkáně, tvořené sítí širokých kolagenních vláken s ložisky chronického zánětlivého infiltrátu, tvořeného zejména lymfocyty, zralými plazmatickými buňkami a ojedinělými histiocyty, s relativním nedostatkem neutrofilních granulocytů, potvrdilo diagnózu idiopatické RPF (obr. 4).
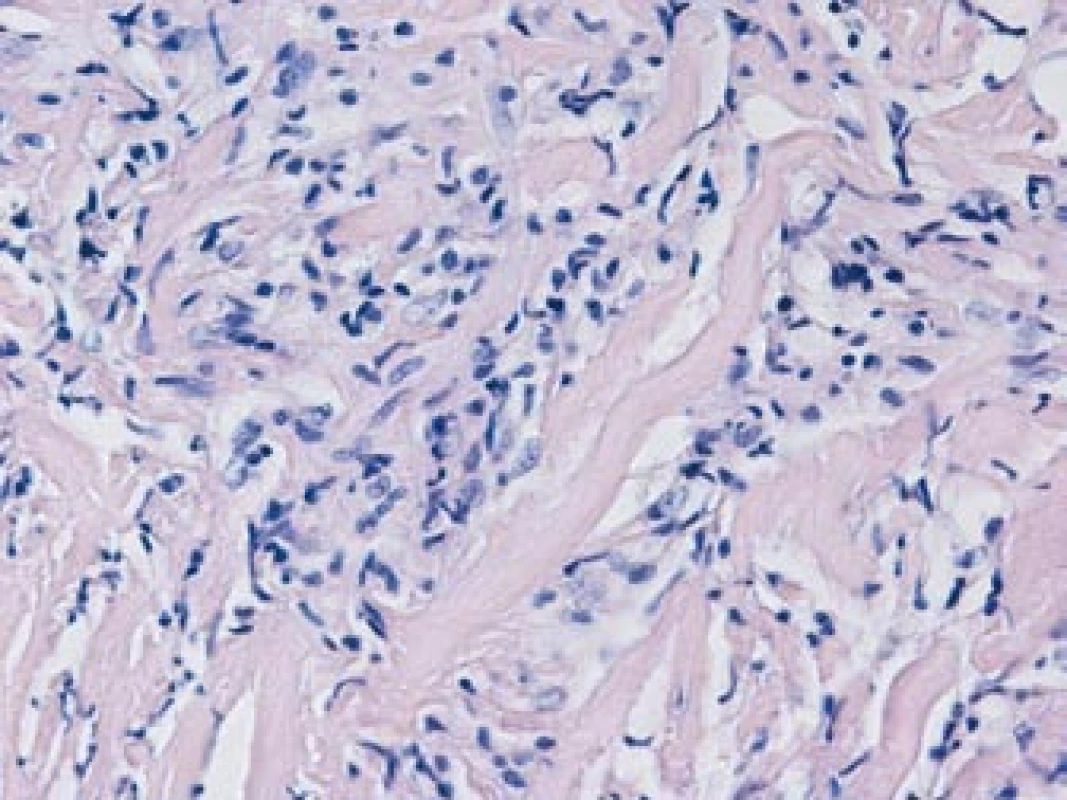
Pacient byl předán do péče revmatologické ambulance II. interní kliniky FN u sv. Anny v Brně. První vyšetření proběhlo v červenci roku 2007. Pacient si stěžoval na neustupující bolesti v bederní krajině vystřelující do obou třísel. Klinické vyšetření prokázalo normální tělesnou teplotu, normální hodnoty krevního tlaku na horních i dolních končetinách (130/80 mm Hg). Vyšetření kardiovaskulárního a respiračního systému nevykazovalo abnormální nález, rovněž vyšetření břicha prokázalo normální nález. Lymfatické uzliny nebyly zvětšené. Pulzace nad tepnami obou dolních končetin byly hmatné. Laboratorní vyšetření krve prokázalo mírně zvýšenou sérovou hladinu močoviny (8,6 mmol/l) a kreatininu (138 μmol/l), systémovou zánětlivou aktivitu (sedimentace erytrocytů – FW 52 mm/hod, CRP 21,1 mg/l, CIK C1q 65 μg/ml, elektroforéza plazmatických bílkovin – zvýšená hladina α-2-globulinu). Krevní obraz vykazoval normální počet erytrocytů (4,82 × 1012/l), normální počet leukocytů (7,6 × 109/l), normální počet krevních destiček (345 × 109/l) a normální diferenciální rozpočet bílých krvinek. Z dalších laboratorních parametrů byla mírně zvýšena glykemie na 6,9 mmol/l, celkový cholesterol byl 4,80 mmol/l a HDL‑cholesterol 3,23 mmol/l, jaterní testy byly v normě (transaminázy, celkový bilirubin, alkalická fosfatáza, γ-glutamyl-transpeptidáza a albumin), ASLO bylonegativní. Imunologické testy neprokázaly přítomnost autoprotilátek včetně revmatoidních faktorů, antinukleárních protilátek, anti ds-DNA, protilátek proti cytoplazmě neutrofilů (ANCA) a antifosfolipidových autoprotilátek. Hladiny C3, C4 složek komplementu byly v normě. Odchylky od normy byly zaznamenány v hladinách imunoglobulinů [IgA 5,49 g/l (0,82–4,53), IgG 896 IU/ml (0–100)]. Alela HLA B 27 nebyla prokázána. Byla zahájena systémová terapie metylprednisolonem v úvodní denní dávce 32 mg (0,5 mg/kg tělesné hmotnosti) a tamoxifenem v úvodní dávce 10 mg/den. Dávka tamoxifenu byla po 4 týdnech zvýšena na 20 mg/den. Současně pacient dostával vápník v dávce 600 mg denně a cholekalciferol v dávce 200 IU denně, dále inhibitor protonové pumpy omeprazol v dávce 20 mg denně. Při této léčbě nebyl zaznamenán výskyt nežádoucí účinků.
Laboratorní vyšetření, které bylo provedeno po 8 týdnech od zahájení systémové terapie, v září roku 2007, prokázalo pokles zánětlivé aktivity (CRP 2,0 mg/l), přetrvávající mírné zvýšení sérové hladiny močoviny (8,18 mmol/l). Sérová hladina kreatininu byla při horní hranici normy (109 μmol/l). V krevním obrazu byl zvýšen počet leukocytů (15,0 × 109/l). Ostatní parametry byly v normě. Pacient si stěžoval na občasné pálení močové trubice a přetrvávající bolesti dolní části zad mírnější intenzity. Pokračovala terapie tamoxifenem v dávce 20 mg denně. Byla snížena dávka metylprednisolonu na 16 a 32 mg obden.
Při následujícím vyšetření v listopadu roku 2007 prokázalo laboratorní vyšetření nárůst zánětlivé aktivity (CRP 17,5 mg/l, FW 11 mm/hod) a normální sérové hladiny močoviny a kreatininu. V krevním obrazu byl zvýšen počet leukocytů (15,1 × 109/l). Ostatní parametry krevního obrazu byly v normě. V močovém sedimentu byly však četné erytrocyty a leukocyty a ojedinělé dlaždicové epitelie. Bylo provedeno kontrolní vyšetření 18F‑FDG PET, které tentokrát již neprokázalo ložisko zvýšené akumulace radiofarmaka v retroperitoneu (obr. 5). Fúze PET/CT současně prokázala i zmenšení velikosti měkkotkáňového infiltrátu obkružujícího břišní aortu (obr. 6). Dávka tamoxifenu byla zvýšena na 40 mg denně a dávka metylprednisolonu byla snížena na 16 mg denně.
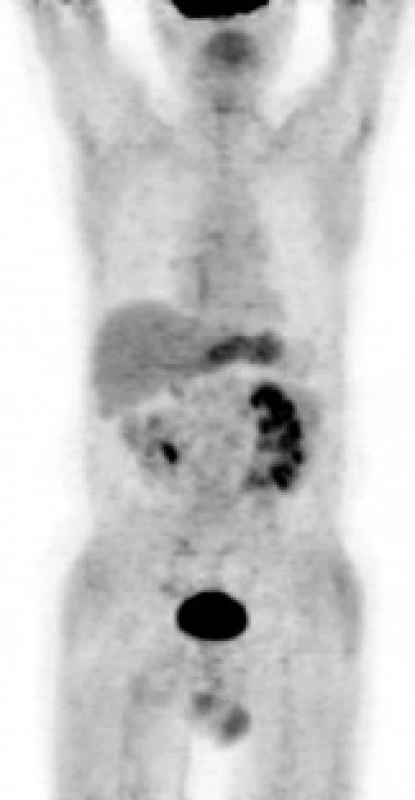
Zatím poslední kontrolní vyšetření v revmatologické ambulanci proběhlo v dubnu roku 2008. Pacient si stále stěžoval na přetrvávající bolesti mírné intenzity v bederní krajině propagující se do levého třísla. Jeho zdravotní stav byl komplikován vývojem hluboké žilní trombózy pravé dolní končetiny, pro kterou byl v únoru roku 2008 hospitalizován na interním oddělení v místě bydliště. Při vyšetření v revmatologické ambulanci pacient užíval warfarin v dávce 5 mg denně. Laboratorní vyšetření prokázalo normální hodnoty CRP (5,5 mg/l), hodnotu FW 23 mm/hod, normální sérovou hladinu močoviny (6,6 mmol/l) a mírně zvýšenou hladinu kreatininu (111 μmol/l). V krevním obrazu byl zvýšen počet leukocytů (13,5 × 109/l), ostatní parametry byly v normě. Biochemické vyšetření dále prokázalo mírně zvýšenou hladinu alaninaminotransferázy (0,80 μkat/l). Ostatní jaterní testy byly v normě. V močovém sedimentu byly četné erytrocyty. Bylo provedeno CT vyšetření retroperitona, které prokázalo další zmenšení velikosti retroperitoneálního infiltrátu, který v příčném rozměru dosahoval rozměrů 63 × 30 mm. V kraniokaudálním rozměru se jeho rozsah neměnil. Vyšetření dále prokázalo svraštělou pravou ledvinu a konkrement stacionární velikosti v dolním segmentu levé ledviny. Dutý systém obou ledvin nevykazoval známky městnání. V obou ureterech byly zavedeny JJ stenty. Vzhledem k prodělané tromboembolické příhodě byla terapie tamoxifenem ukončena a pokračovala terapie metylprednisolonem v dávce 8 a 16 mg obden. Pacient byl současně sledován v urologické ambulanci. Urologové plánovali provedení operační revize dutiny břišní s uvolněním levého ureteru z retroperitoneálního infiltrátu a odstranění nefunkční pravé ledviny.
Diskuze
RPF je méně časté onemocnění charakterizované chronickým zánětlivým procesem pojivové tkáně retroperitonea. Idiopatická RPF tvoří 2/3 případů. Ačkoliv příčina vzniku idiopatické RPF nebyla dosud odhalena, předpokládá se imunopatogenetický mechanizmus vzniku a vývoje tohoto onemocnění. Toto tvrzení podporuje častá asociace RPF s řadou zánětlivých chorob, přítomnost laboratorních známek zánětu, zánětlivý buněčný infiltrát v histologických nálezech, případná detekce autoprotilátek a odpověď na imunosupresivní terapii. Idiopatická RPF bývá spolu se zánětlivým aneurysmatem abdominální aorty a perianeurysmální RPF řazena k chronickým periaortitidám. Tato onemocnění jsou charakterizovaná fibrotizujícím zánětlivým procesem obklopujícím abdominální aortu a ilické tepny, šířícím se retroperitoneem. Obvykle postihují pacienty s pokročilou aterosklerózou. Proces je pravděpodobně důsledkem lokální autoimunitní zánětlivé odpovědi na některé antigeny aterosklerotických plaků ve stěně břišní aorty, jako jsou oxidované low density lipoproteiny (LDL) nebo tukový pigment ceroid. Protilátky proti oxidovanému LDL jsou častěji prokazovány u pacientů s chronickou periaortitidou než u zdravých mladých kontrol [7]. Podle některých autorů je chronická periaortitida výsledkem systémového autoimunitního procesu s vaskulitidou postihující aortální vasa vasorum a retroperitoneální cévy středního a malého kalibru [8]. Prevalence vaskulitidy, postihující cévy malého a středního kalibru, u pacientů s chronickou periaortitidou je udávána mezi 10 a 80 % [8]. Představu o autoimunitní povaze onemocnění podporují mimo jiné nálezy asociace chronické periaortitidy s řadou systémových autoimunitních chorob, např. systémovým lupusem erythematodes, revmatoidní artritidou, ankylozující spondylitidou, Wegenerovou granulomatózou, polyarteritis nodóza nebo velkobuněčnou arteritidou a rovněž dobrá odpověď na terapii glukokortikoidy a jinými imunosupresivními léky [9–14]. K rizikovým faktorům vývoje chronické periaortitidy patří kouření [15,16], viry (Herpes simplex, Cytomegalovirus) [17] a rovněž genetické rizikové faktory (asociace s HLA‑DRB1*03) [18,19].
Terapie idiopatické RPF je závislá na stadiu onemocnění. Doporučení pro léčbu idiopatické RPF doposud nebyla vytvořena. Provedení katetrizace močových cest s inzercí JJ stentů je vyžadováno v případě obstrukce močových cest. Pro použití moderních imunosupresivních léků svědčí případy regrese retroperitoneálního procesu po použití těchto preparátů [20]. V literatuře najdeme rovněž několik případů prokazujících efekt glukokortikoidů na zmírnění projevů choroby a zmenšení rozsahu RPF [21]. Neexistuje však shoda v dávce a délce trvání terapie glukokortikoidy. V terapii idiopatické RPF byl použit rovněž azatioprin, cyklofosfamid, D-penicilamin a chlorambucil [4,22,23]. Dalším lékem používaným v terapii idiopatické RPF je tamoxifen [24–33]. Efekt tamoxifenu se obvykle dostavuje pomalu, ale byly popsány případy kompletní regrese retroperitoneálního infiltrátu. Předčasné ukončení terapie tamoxifenem může vést ke vzplanutí procesu. Proto je doporučována dlouhodobá terapie tímto preparátem.
Na diagnózu RPF je nutno pomýšlet u pacientů s jinak nevysvětlitelnou bolestí dolní části zad a břicha a s nálezem retroperitoneálního infiltrátu při vyšetřeních zobrazovacími metodami. Subjektivní stesky pacientů a klinické projevy choroby jsou způsobeny útlakem retroperitoneálních struktur, zejména aorty, dolní duté žíly a často útlakem ureterů. Ze zobrazovacích metod se k diagnostice RPF využívá USG, CT nebo MRI, ačkoliv ani jedna z těchto metod není schopna jednoznačně odlišit RPF od maligního procesu postihujícího retroperitoneum [6]. Tyto metody tedy poskytují sice sugestivní výsledky, ale nikoliv specifické pro idiopatickou RPF [34–38]. V takovém případě je přínosným vyšetřením, potvrzujícím diagnózu idiopatické RPF, jehlová biopsie retroperitoneálních hmot prováděna nejčastěji pod CT kontrolou. V některých případech je nevyhnutelné provedení laparotomie s odběrem bioptických vzorků.
PET je neinvazivní diagnostická metoda zobrazující biodistribuci radiofarmak značených pozitronovým zářičem v lidském těle. Je užívána především k diagnostice, stagingu a monitorování řady maligních onemocnění. Vzhledem k tomu, že za určitých podmínek i ně-kte-ré buňky zánětu mohou vykazovat zvýšenou akumulaci radiofarmaka (18F‑FDG), lze 18F‑FDG PET využít nejen k diagnostice nádorů, ale i jako účinný nástroj diagnostiky a monitorování aktivity některých neonkologických onemocnění, k nimž patří i zánětlivé procesy.
V odborné literatuře se objevují četná sdělení týkající se použití 18F‑FDG PET jako potenciálně užitečného nástroje k průkazu zánětlivých změn cévní stěny u vaskulitid velkých cév, jakými jsou např. velkobuněčná arteritida nebo Takayasuova arteritida [39–42]. Podobně se v literatuře objevují zatím ojedinělá sdělení poukazující na možnost využití 18F‑FDG PET v diagnostice a monitoraci aktivity chronických periaortitid. V práci Salvaraniho et al [43] autoři vyšetřili touto metodou celkem 7 pacientů s chronickou periaortitidou (2 pacienty s perianeurysmální RPF a 5 pacientů s idiopatickou RPF), diagnostikovanou na základě CT vyšetření, a kontrolní skupinu 14 pacientů s maligním onemocněním. Pro každý případ chronické periaortitidy a malignity byli vyšetřeni 2 zdraví dobrovolníci stejného věku a pohlaví. U všech pacientů s chronickou periaortitidou byla zaznamenána zvýšená akumulace radiofarmaka stupně 2+ nebo 3+ ve stěně břišní aorty a iliických tepen. Naopak u žádného případu z kontrolní skupiny nebyla vyšší akumulace radiofarmaka v této oblasti zaznamenána. Navíc u 3 (43 %) pacientů s chronickou periaortitidou byla detekována zvýšená akumulace radiofarmaka ve stěně hrudní aorty a jejich hlavních větví. U žádného případu z kontrolní skupiny nebyla ve stěně hrudní aorty a jejich větví prokázána vyšší akumulace radiofarmaka. Autoři svoji práci uzavírají tvrzením, že data získaná na základě vyšetření 18F‑FDG PET prokazují, že chronická periaortitida může být reprezentována vaskulitidou velkých cév postihující břišní aortu a společné ilické tepny a v některých případech i hrudní aortu a její hlavní větve. Současně však autoři článku upozorňují na fakt, že přítomnost aterosklerotického postižení tepen může poskytovat falešně pozitivní výsledky při 18F‑FDG PET vyšetření, které mohou být vysvětleny přítomností makrofágů v aterosklerotických placích. Skupina japonských autorů publikovala kazuistické sdělení případu pacienta s RPF diagnostikovanou pomocí CT [44]. 18F‑FDG PET prokázala u tohoto pacienta zvýšenou akumulaci radiofarmaka v měkkotkáňových strukturách obkružujících břišní aortu. Kontrolní 18F‑FDG PET, provedená 2 měsíce po zahájení terapie 30 mg prednisonu, neprokázala v této oblasti zvýšenou akumulaci radiofarmaka. Současně CT vyšetření prokázalo zmenšení rozsahu retroperitoneálního infiltrátu.
PET je neinvazivní diagnostická metoda zobrazující biodistribuci radiofarmak značených pozitronovým zářičem v lidském těle. Vzhledem k tomu, že za určitých podmínek i některé buňky zánětu mohou vykazovat zvýšenou akumulaci 18F‑FDG, lze 18F‑FDG PET použít jako účinný nástroj k diagnostice a monitorování aktivity některých chronických zánětů, ke kterým je řazena i chronická periaortitida. V námi popisovaném případu 60letého muže s idiopatickou RPF vyšetření 18F‑FDG PET prokázalo zvýšenou metabolickou aktivitu patologického procesu detekovaného na základě CT a MRI vyšetření v okolí břišní aorty a společných ilických tepen v retroperitoneu. Kontrolní 18F‑FDG PET vyšetření, provedené 4 měsíce po zahájení systémové terapie, prokázalo vyhasnutí metabolické aktivity retroperitoneálního infiltrátu. Fúze PET/CT vyšetření navíc prokázalo zmenšení rozsahu patologického procesu. 18F‑FDG PET může proto být užitečným nástrojem přispívajícím k diagnostice chronické periaortitidy. Významným přínosem této vyšetřovací metody je i možnost posouzení aktivity patologického procesu a současně možnost monitorace efektu jeho léčby.
MUDr. Petr Němec, Ph.D.
www.fnusa.cz
e‑mail: petr.nemec@fnusa.cz
Doručeno do redakce: 19. 5. 2008
Přijato po recenzi: 8. 7. 2008
Sources
1. Mitchinson MJ. Chronic periaortitis and periarteritis. Histopathology 1984; 8 : 589–600.
2. Parums DV. The spectrum of chronic periaortitis. Histopathology 1990; 16 : 423–431.
3. Ormond J. Bilateral ureteral obstruction due to envelopment and compression by an inflammatory retroperitoneal process. J Urol 1948; 10 : 1072–1079.
4. McDougal WS, MacDonell RC Jr. Treatment of idiopathic retroperitoneal fibrosis by immunosuppression. J Urol 1991; 145 : 112–114.
5. Hoffman WW, Trippel OH. Retroperitoneal fibrosis: etiological considerations. J Urol 1961; 86 : 222–231.
6. Amis ES Jr. Retroperitoneal fibrosis. AJR Am J Roentgenol 1991; 157 : 321–329.
7. Parums DV, Brown DL, Mitchinson MJ. Serum antibodies to oxidized low-density lipoprotein in chronic periaortitis. Arch Pathol Lab Med 1990; 114 : 383–387.
8. Vaglio A, Corradi D, Manenti L et al. Evidence of autoimmunity in chronic periaortitis: a prospective study. Am J Med 2003; 114 : 454–462.
9. Littlejohn JO, Keystone EC. The association of retroperitoneal fibrosis with systemic vasculitis and HLA‑B27: a case report and review of literature. J Rheumatol 1981; 8 : 665–669.
10. De La Iglesia Martinez F, Grana Gil J, Gomez Veiga F et al. The association of retroperitoneal fibrosis and ankylosing spondylitis. J Rheumatol 1992; 19 : 1147–1149.
11. Ter Maaten JC, Franssen CFM, Daenekkindt AA et al. Triple Wegener’s granulomatosis in the urogenital tract. Nephron 1993; 63 : 358–359.
12. De Roux-Serratrice C, Serratrice J, Granel B et al. Periaortitis heralding Wegener’s granulomatosis. J Rheumatol 2002; 29 : 392–394.
13. Hautekeete ML, Babany G, Marcellin P et al. Retroperitoneal fibrosis after surgery for aortic aneurysm in a patient with periarteritis nodosa: successful treatment with corticosteroids. J Intern Med 1990; 228 : 533–536.
14. Machado EBV, Michet CJ, Ballard DJ et al. Trends in incidence and clinical presentation of temporal arteritis in Olmsted County, Minnesota, 1950–1985. Arthritis Rheum 1988; 31 : 745–749.
15. Rasmussen TE, Hallet JW Jr. Inflammatory aortic aneurysm – a clinical review with new perspectives in pathogenesis. Ann Surg 1997; 225 : 155–164.
16. Nitecki SS, Hallett JW Jr, Stanson AW et al. Inflammatory abdominal aortic aneurysm: new clinical implication from a case-control study. J Vasc Surg 1996; 23 : 860–869.
17. Tanaka S, Komori K, Okadome K et al. Detection of active cytomegalo virus infection in inflammatory aortic aneurysms with RNA polymerase chain reaction. J Vasc Surg 1994; 20 : 235–243.
18. Rasmussen TE, Hallett JW Jr, Metzger RLM et al. Genetic risk factors in inflammatory abdominal aortic aneurysms: polymorphic residue 70 in the HLA‑DRB1 gene as a key genetic element. J Vasc Surg 1997; 25 : 356–364.
19. Martorana D, Vaglio A, Greco P et al. Chronic periaortitis and HLA‑DRB1*03: another clue to an autoimmune origin. Arthritis Rheum 2006; 55 : 126–130.
20. Artom A, Gandolfo N. Idiopathic retroperitoneal fibrosis: a case report without increased levels of acute-phase reactants. Noninvasive diagnosis and treatment. Ann Ital Med Int 2004; 19 : 50–53.
21. Kubota Y, Nomura Y, Tamaki M et al. Four cases of idiopathic retroperitoneal fibrosis markedly responsive to steroid therapy. Hinyokika Kiyo 2005; 51 : 315–319.
22. Hollingworth P, Denman AM, Gumpel JM. Retroperitoneal fibrosis and polyarteritis nodosa successfully treated by intensive immunosuppression. J R Soc Med 1980; 73 : 61–64.
23. Maillart E, Laueriere L, Kassis S et al. Is there an evidence‑based management of idiopathic retroperitoneal fibrosis? Rev Med Interne 2006; 27 : 854–857.
24. Clark CP, Vanderpool D, Preskitt JT. The response of retroperitoneal fibrosis to tamoxifen. Surgery 1991; 109 : 502–506.
25. Loffeld RJ, van Weel TF. Tamoxifen for retroperitoneal fibrosis. Lancet 1993; 341 : 382.
26. Frankart L, Lorge F, Donckier J. Tamoxifen for retroperitoneal fibrosis. Postgrad Med J 1997; 73 : 653–654.
27. Owens LV, Cance WG, Huth JF. Retroperitoneal fibrosis treated with tamoxifen. Am Surg 1995; 61 : 842–844.
28. Bourouma R, Chevet D, Michel F et al. Treatment of idiopathic retroperitoneal fibrosis with tamoxifen. Nephrol Dial Transplant 1997; 12 : 2407–2410.
29. Ozener C, Kiris S, Lawrence R et al. Potential beneficial effect of tamoxifen in retroperitoneal fibrosis. Nephrol Dial Transplant 1997; 12 : 2166–2168.
30. Chambers JC, McGovern K. Tamoxifen for retroperitoneal fibrosis. Palliat Med 2005; 19 : 163–164.
31. Ergun I, Keven K, Canbakan B et al. Tamoxifen in the treatment of idiopathic retroperitoneal fibrosis. Int Urol Nephrol 2005; 37 : 341–343.
32. van Bommel EF, Hendriksz TR, Huiskes AW et al. Brief communication: tamoxifen therapy for nonmalignant retroperitoneal fibrosis. Ann Intern Med 2006; 144 : 101–106.
33. Vaglio A, Greco P, Buzio C. Tamoxifen therapy for retroperitoneal fibrosis. Ann Intern Med 2006; 144 : 619.
34. Degesys GE, Dunnick NR, Silverman PM et al. Retroperitoneal fibrosis: use of CT in distinguishing among possible causes. AJR Am J Roentgenol 1986; 146 : 57–60.
35. Glazer HS, Lee JK, Levitt RG et al. Radiation fibrosis: differentiation from recurrent tumor by MR imaging. Radiology 1985; 156 : 721–726.
36. Yuh WT, Barloon TJ, Sickels WJ et al. Magnetic resonance imaging in the diagnosis and followup of idiopathic retroperitoneal fibrosis. J Urol 1989; 141 : 602–605.
37. Dixon AK, Mitchinson MJ, Sherwood T. Computed tomographic observations in periaortitis. A hypothesis. Clin Radiol 1984; 35 : 39–42.
38. Hricak H, Higgins CB, Williams RD. Nuclear magnetic resonance imaging in retroperitoneal fibrosis. AJR Am J Roentgenol 1983; 141 : 35–38.
39. Wenger M, Calamia KT, Salvarani C et al. Do we need 18F‑FDG-positron emission tomography as a functional imaging technique for diagnosing large vessel arteritis? Clin Exp Rheumatol 2003; 21 (Suppl 32): S1–S2.
40. Blockmans D. The use of (18F)fluoro‑deoxyglucose positron emission tomography in the assessment of large vessel vasculitis. Clin Exp Rheumatol 2003; 21 (Suppl 32): S15–S22.
41. Řehák Z, Fojtík Z, Staníček J et al. 18F‑FDG PET v diagnostice vaskulitid velkých cév. Vnitř Lék 2006; 52 : 1037–1044.
42. Řehák Z, Fryšáková L, Tichý T et al. Detekce temporální arteritidy pomocí 18F‑FDG PET. Čes Radiol 2006; 60 : 234–238.
43. Salvarani C, Pipitone N, Versari A et al. Positron emission tomography (PET): Evaluation of Chronic Periaortitis. Athritis Rheum 2005; 53 : 298–303.
44. Sakamoto A, Okamoto K, Ishizaka N et al. 18F‑fluorodeoxyglucose positron emission tomography in a case of retroperitoneal fibrosis. Int Heart J 2006; 47 : 645–650.
Labels
Diabetology Endocrinology Internal medicineArticle was published in
Internal Medicine

2008 Issue 11
-
All articles in this issue
- Bezpečnost dlouhodobého podávání losartanu v běžné klinické praxi: neintervenční studie NCT-CZ 14/04/LOZ
- Prolaktín – marker aktivity systémových ochorení spojiva?
- Subklinické akutní rejekce v protokolárních biopsiích 3 měsíce po transplantaci ledviny
- Význam stanovování inhibinu B v klinické andrologické praxi
-
Histiocytóza z Langerhansových buněk u osob dospělého věku – nemoc s mnoha tvářemi.
Zkušenosti jednoho pracoviště a přehled projevů nemoci - Akutní embolizace do tepen splanchnického řečiště – přehled současných diagnostických přístupů a terapie
- Využití pozitronové emisní tomografie (18F‑FDG PET) v diagnostice chronických periaortitid
- Hypokalemická periodická paralýza u pacientů s hypertyreózou
- Nově diagnostikovaný syndrom Churga-Straussové u pacientky s podezřením na akutní koronární syndrom
- Perzistentní průjmy, hypotenze a polyneuropatie
- Vztah mezi familiární kombinovanou hyperlipidemií a inzulinovou rezistencí
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue
- Hypokalemická periodická paralýza u pacientů s hypertyreózou
-
Histiocytóza z Langerhansových buněk u osob dospělého věku – nemoc s mnoha tvářemi.
Zkušenosti jednoho pracoviště a přehled projevů nemoci - Bezpečnost dlouhodobého podávání losartanu v běžné klinické praxi: neintervenční studie NCT-CZ 14/04/LOZ
- Význam stanovování inhibinu B v klinické andrologické praxi
