Centrální pravostranná hemiparéza jako dominující projev systémové vaskulitidy
Central hemiparesis as manifestation of systemic vasculitis
We present a case report of patient with systemic vasculitis with affection of heart, skin, gastrointestinal tract and rare involvement of central nervous system. Diagnosis of systemic vasculitis was based on clinical manifestations, blood hypereosinophilia and brain magnetic resonance imaging. Immunosuppressive therapy led to regression of symptoms including initially present neurologic manifestation.
Key words:
systemic vasculitis – central nervous system affection
:
Ľ. Cibičková 1; T. Soukup 1; J. Tomš 1; L. Klzo 2; Abuhajar Mohamed Abdalla 2; P. Bradna 1
:
II. interní klinika Lékařské fakulty UK a FN Hradec Králové, přednosta prof. MU Dr. Jaroslav Malý, CSc.
1; Radiologická klinika Lékařské fakulty UK a FN Hradec Králové, přednosta prof. MU Dr. Pavel Eliáš, CSc.
2
:
Vnitř Lék 2010; 56(11): 1194-1197
:
Case Reports
Prezentujeme kazuistiku pacientky se systémovou vaskulitidou s postižením srdce, kůže, gastrointestinálního traktu a raritním poškozením centrálního nervového systému. Diagnóza systémové vaskulitidy byla stanovena na základě klinických projevů, výrazné eozinofilie a magnetické rezonance mozku. Promptně nasazená imunosupresivní terapie vedla k regresi příznaků včetně úpravy původně přítomného neurologického postižení.
Klíčová slova:
systémová vaskulitida – postižení centrálního nervového systému
Úvod
Zánětlivé postižení cév malého a středního kalibru vede k destrukci cévní stěny, proliferaci a uzávěru cév s následnou poruchou prokrvení v zásobované oblasti. Nejčastěji jsou postiženy plíce, periferní nervový systém a kůže, může však dojít i k projevům v gastrointestinálním systému, ledvinách, myokardu a vzácně v centrálním nervovém systému (CNS) [1].
Popis případu
Předmětem našeho sdělení je případ 58leté ženy, u které nebylo zjištěno v rodinné anamnéze žádné závažné autoimunitní onemocnění. Několik let se léčila pro arteriální hypertenzi a autoimunitní hypotyreózu. Pro diabetes mellitus 2. typu držela diabetickou dietu a byla sledována pro středně těžké bronchiální astma. V roce 2003 prodělala perikarditidu. Léčena však byla na spádovém pracovišti, a tak jsme neměli k dispozici bližší informaci o etiologii.
První obtíže se objevily koncem dubna roku 2008, kdy vyhledala praktického lékaře pro bolesti epigastria a zelenožluté průjmy bez příměsi krve či hlenu doprovázené subfebriliemi. Terapie nifuroxazidem a ciprofloxacinem nepřinesla úlevu, kultivačně nebyly zjištěny žádné patogeny. Dne 12. 5. 2008 proběhlo ambulantní gastroenterologické vyšetření s nálezem stázy žaludečního obsahu, antrální gastritidy a axiální hiátové hernie. Následně byla doporučena léčba inhibitorem protonové pumpy omeprazolem a prokinetikem itopridem. Za 2 dny poté však pacientka již přišla na akutní interní ambulanci a následně byla přijata k hospitalizaci pro poruchu hybnosti dolních i horních končetin a poruchu orientace v prostoru. Pacientka si také stěžovala na mlhavé vidění, neobratnost horních končetin a změny psychiky ve smyslu zvýšené plačtivosti. Při vstupním laboratorním vyšetření byla zjištěna elevace kardiomarkerů (CKMB 1,47 μkat/l, norma: 0–0,5 µkat/l; TnT 1,85 µg/l, norma 0–0,03 µg/l) a 1mm deprese ST nad přední stěnou (obr. 1). Pacientka však negovala bolesti na hrudi a ultrazvukové vyšetření srdce neprokázalo poruchu kinetiky myokardu.

Na kůži pod nehty a pretibiálně měla pacientka drobné třískovité hematomy. Kromě zvýšených kardiomarkerů byly v krvi také zvýšené známky zánětu (CRP 79 mg/l, leukocyty 14,5/nl) a rovněž diferenciální rozpočet ukazoval na eozinofilii (69 %). Vyšetření stolice však parazity neprokázalo.
Pro progredující centrální pravostrannou hemiparézu bylo provedeno CT mozku s negativním výsledkem. Lumbální punkce neprokázala neuroinfekci (Pandy: negativní, segmenty: 5/3, lymfocyty 1/3). Nepřítomnost antikardiolipinových protilátek v séru vyloučila možnost antifosfolipidového syndromu. Vzhledem k dalším nálezům, které vedly k podezření na vaskulitidu (bronchiální astma, eozinofilie v krevním obraze, subungvální hematomy, neurologické symptomy, postižení srdce a trávicího traktu), bylo přistoupeno k vyšetření mozku magnetickou rezonancí (MR) (obr. 2). Zde byla dominujícím nálezem vícečetná T2 hyperintenzní ložiska v korových i podkorových oblastech, drobné ložisko bylo nalezeno i v pravém mezencefalu a pravé mozečkové hemisféře, velikost ložisek se pohybovala do 20mm v nejdelším rozměru u postižení v okcipitální oblasti. Postižení zejména rozvodí mozkových tepen a terminálních částí cévního řečiště mozku budilo podezření především na vaskulitickou etiologii. Uvedené nálezy a zejména progrese neurologického postižení vedly k rozhodnutí o zahájení imunosupresivní terapie 1 g pulzy metylprednisolonu, které byly podány celkem 5krát obden. Následoval převod na perorální formu v dávce 1 mg/kg/den s postupnou detrakcí podle doporučení EULAR (the European League against Rheumatism) pro terapii generalizovaných vaskulitid [3].
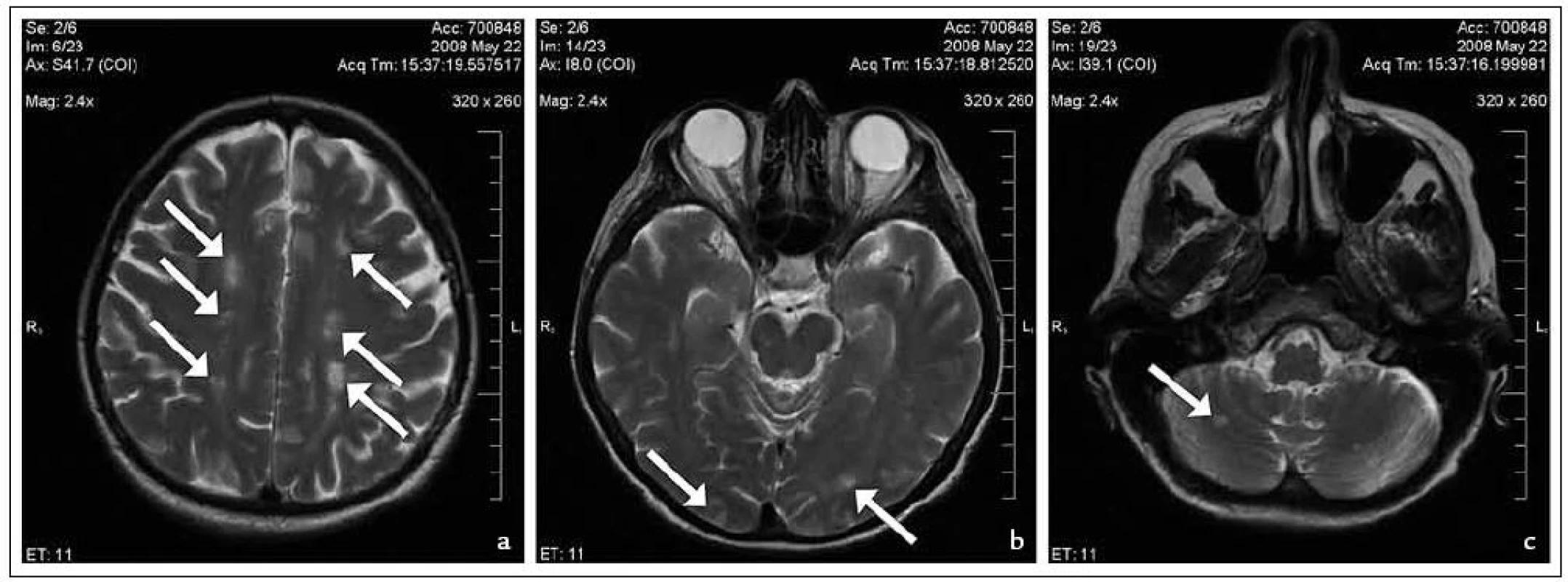
Při této terapii postupně došlo ke zlepšení motoriky i orientace pacientky. I přesto jsme pokračovali v dalším vyšetřování. Jako druhé možné vysvětlení intrakraniálních ložisek se jevilo kardioemboligenní postižení. Tato interpretace byla podporována nálezem intermitentní erytrocyturie a třískovitých hematomů. Při jícnovém ultrazvukovém vyšetření srdce (TEE) byl sice 2krát zachycen drobný (2 × 1 mm) vlající útvar na zadním cípu mitrální chlopně, neměl však charakter vegetace a při dalším vyšetření již nebyl zachycen. Navíc odebraná série hemokultur byla kultivačně negativní. Tuto etiologii jsme tedy vyloučili a provedli odběr z jednoho z drobných papulózních ložisek na přední straně bérce.
Histologické vyšetření tohoto ložiska zachytilo infiltráty s malou účastí neutrofilů lokalizovaných kolem cév subpapilárního plexu. Nález však byl velmi diskrétní a nevedl ke stanovení konkrétní diagnózy. Museli jsme tedy vyloučit ještě další vaskulitidu postihující malé cévy, a sice mikroskopickou polyangiitidu (MPA). Pátrali jsme proto po charakteristickém postižení ledvin. Záchyt hematurie byl pouze intermitentní a proteinurie nedosahovala ani 0,5 g/den. Následná cystoskopie a scintigrafie ledvin neprokázaly žádnou patologii a bylo přistoupeno k biopsii ledviny. Histologické vyšetření odebraného vzorku však neodhalilo známky svědčící pro nekrotizující glomerulonefritidu. Také při opakovaném odběru krve nebyly zachyceny ANCA (anti nenutrophil cytoplasma antibodies) protilátky (vyšetření pomocí imunofuorescence i přímo ELISA proti myeloperoxidáze).
Pacientce byla postupně snižována dávka metylprednisolonu a vzhledemk postižení centrálního nervového systému a srdce (opakovaně pozitivní troponin T a pyrofosfátový scan srdce) bylo zahájeno podávání intravenózních pulzů cyklofosfamidu 500mg à 1 měsíc, které jsou doporučovány jako základ terapie při generalizované vaskulitidě [3]. Při této terapii a rehabilitaci došlo k úpravě původní hemiparézy, rozmazaného vidění, narušené grafie i orientace. Kontrolní MR mozku (prosinec roku 2008) ukázalo stacionární nález vaskulitických ložisek. Eozinofilie prvotně přítomná v krevním obraze zcela regredovala. Ani po podání 6. pulzu cyklofosfamidu nebyly nalezeny žádné známky svědčící pro aktivitu vaskulitidy, a proto bylo přistoupeno k ukončení terapie cyklofosfamidem a zahájeno podávání azathioprinu v dávce 2 mg/kg/den, jak je doporučuje EULAR k udržení remise [3]. Na dlouhodobé terapii azathioprinem a malou dávkou metylprednisolonu nedošlo dosud (červen roku 2010) k relapsu onemocnění, které jsme uzavřeli jako systémovou vaskulitidu s vzácným postižením CNS.
Diskuze
Syndrom Churga-Straussové (CSS), dříve nazývaný i jako alergická gramulomatózní angiitida, je vzácná nekrotizující vaskulitida postihující cévy malého a středního kalibru. Naše pacientka splnila pouze 3 z klasifikačních kritérií ACR (American College of Rheumatology) 1990 [2] (tab. 1) pro diagnózu syndromu CSS, konkrétně bronchiální astma, eozinofilie vyšší než 10 % a neuropatie. Další 3 klasifikační kritéria splněna nebyla – pacientka neměla postižení plic (vyloučeno pomocí HRCT plic) ani paranazálních dutin (proveden RTG), eozinofilní infiltráty se v histologii kůže nepodařily prokázat. Onemocnění jsme tedy zatím neuzavřeli jako CSS, ale pouze obecně jako systémovou vaskulitidu. Tato vaskulitida měla u naší pacientky fázovitý průběh, jako je to typické pro CSS. Nejdříve prodromální fáze, projevující se bronchiálním astmatem (bez zjištění konkrétního alergenu) a poté vaskulitická s vícesystémovým postižením – gastrointestinální trakt (průjmy), srdce a centrální nervový systém (CNS).
![Diagnostická kritéria CSS dle Americké revmatologické společnosti [2].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/ab7cef1a029ca197a20eb07d2581fe00.jpeg)
Neurologická manifestace CSSje poměrně častá (62–81 %) [1,4], avšak většinou onemocnění postihuje periferní nervový systém. Podstatou tohoto postižení je vaskulitida vasa nervorum. CNS je poškozen u méně než 10 % pacientů [1,4], bývá pouze jedním z dalších postižených orgánů [5]. Nejčastěji se postižení CNS projeví jako ischemická příhoda (jako tomu bylo u naší pacientky – pravostranná hemiparéza) či krvácení [5]. Jiné příznaky jsou již raritní, avšak některé z nich byly také u uvedené pacientky přítomné – stav zmatenosti, vertigo, rozmazané vidění a dysgrafie. Tyto projevy měly svůj korelát v ischemických ložiscích na MR mozku. Vertigo mělo typický charakter mozečkového postižení, kde právě bylo jedno z ložisek. Také porucha vízu byla hodnocena jako centrální etiologie, protože oko samotné včetně očního pozadí nejevilo známky poškození, avšak okcipitálně se nacházelo jedno z ložisek a také vizuální evokované potenciály vykazovaly prodlouženou latenci vedení. U naší pacientky nebyla provedena MR angiografie, což nás nutilo vylučovat kardioemboligenní etiologii ložisek (jak je zmiňováno výše). Nebylo však jisté, zda by byla angiografie schopná zachytit typické vaskulitické stenózy, protože byla postižena terminální část cévního řečiště mozku, kde již je MR angiografie velmi limitovaná.
Postižení srdce u CSS je velmi variabilní. Může se projevit jako (peri)myokarditida, srdeční selhání, infarkt myokardu, perikardiální výpotek až tamponádu. Prevalence je odhadována na 35–62 %, je častější u ANCA negativního CSS a je spojena s horší prognózou [1,6]. Nejčastější změny jsou popisovány na EKG a při MR vyšetření srdce [6]. MR srdce u naší pacientky nebylo provedeno, avšak na EKG jsme zachytili jak 1mm deprese ST úseku nad přední stěnou, tak opakované paroxyzmy supraventrikalární tachykardie. Také na pyrofosfátovém scanu srdce došlo k mírnému záchytu radiofarmaka v celém myokardu. Obdobné projevy při postižení srdce u CSS (ST deprese na EKG a pozitivita troponinu T bez bolestí na hrudi a s normální koronarografií) byl již v naší literatuře popsán [7].
Absence granulomů a eozinofilních infiltrátů při histologickém vyšetření kůže bérce nás vedla k podezření na MPA. U této vaskulitidy bývají častěji postiženy ledviny (69 % u MPA vs 16 % u CSS) [1], avšak nefropsie glomerulonefritidu neprokázala. Zpočátku nás zaváděl močový nález, kde byla zprvu (a také intermitentně) přítomná erytrocyturie a také proteinurie (do 0,5 g/den). Po odstranění cévky a terapii opakované močové infekce však obojí regredovalo. Rovněž protilátky pANCA bývají u MPA častější než u CSS (75 % vs 38 %) [1]. U naší pacientky nebyly ani při opakovaných odběrech tyto protilátky zachyceny.
Závěr
Popsali jsme případ pacientky se systémovou vaskulitidou malých cév, která jevila rysy vzácného CSS, avšak nesplnila požadovaný počet diagnostických kritérií. Onemocnění se manifestovalo typickou anamnézou bronchiálního astmatu, postižením kůže, srdce, gastrointestinálního traktu a raritním postižením CNS. Tato kazuistika upozorňuje na nutnost pomýšlet na systémové vaskulitidy jako příčinu ischemie CNS u pacientů s centrální mozkovou příhodou a na nutnost promptní imunosupresivní terapie přes to, že nemáme splněna diagnostická kritéria pro některou ze systémových vaskulitid.
Poděkování
Tato práce byla podpořena Výzkumným záměrem MZO 00179906.
MU Dr. Ľubica Cibičková, Ph.D.
www.fnhk.cz
e-mail: cibickova@seznam.cz
Sources
1. Lamprecht P, Holle J, Gross WL. Update on clinical, pathophysiological and therapeutic aspects in ANCA‑associated vasculitides. Curr Drug Discov Technol 2009; 6 : 241 – 251.
2. Masi AT, Hunder GG, Lie JT et al. The American College of Rheumatology 1990 criteria for the classification of Churg ‑ Strauss syndrome (allergic granulomatosis and angiitis). Arthritis Rheum 1990; 33 : 1094 – 1100.
3. Mukhtyar C, Guillevin L, Cid MC et al. EULAR recommendations for the management of primary small vessel vasculitis. Ann Rheum Dis 2009; 68 : 310 – 317.
4. Sehgal M, Swanson JW, DeRemee RA et al. Neurologic manifestations of Churg ‑ Strauss syndrome. Mayo Clin Proc 1995; 70 : 337 – 341.
5. Finsterer J. Neurological manifestations of Churg - Strauss syndrome. Eur J Neurol 2009; 17 : 524 – 525.
6. Dennert RM, van Paassen P, Schalla S et al. Cardiac involvement in Churg - Strauss syndrome. Arthritis Rheum 2010; 62 : 627 – 634.
7. Husár R, Václavík J, Lukl J. Nově diagnostikovaný syndrom Churga ‑ Straussové u pacientky s podezřením na akutní koronární syndrom. Vnitř Lék 2008; 54 : 1102 – 1105.
Labels
Diabetology Endocrinology Internal medicineArticle was published in
Internal Medicine

2010 Issue 11
-
All articles in this issue
- Metastatic involvement of the heart and pericardium – MR case reports
- Diffuse plane normolipemic xanthomatosis and necrobiotic xanthogranuloma associated with monoclonal gammopathy – determining the disease stage with PET‑ CT and treatment experience. Two case studies and literature review
- Autoimmune polyendocrine syndrome type 2 associated with autoimmune hypophysitis and coeliac disease
- Lymphoma‑like course in aggressive adult multisystem Langerhans cell histiocytosis and the benefit of PET/ CT imaging in evaluation of diffuse metabolic activity of lung parenchyma
- Central hemiparesis as manifestation of systemic vasculitis
- Professor Frantisek Por MD and Professor Robert Klopstock MD, students at Budapest and Prague Faculties of Medicine
- A different view of acute upper gastrointestinal bleeding in liver cirrhosis patients
- Risk stratification by cardiac gated SPECT combined with coronary artery calcium score in patients with diabetes mellitus and/ or renal failure
- Determination of the progression of prostate cancer using RT‑PCR method
- Osteoporosis in chronic obstructive pulmonary disease
- Angiotensin converting enzyme inhibitors and angiotensin II receptor blockers in atrial fibrillation
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue
- Central hemiparesis as manifestation of systemic vasculitis
- Autoimmune polyendocrine syndrome type 2 associated with autoimmune hypophysitis and coeliac disease
- Lymphoma‑like course in aggressive adult multisystem Langerhans cell histiocytosis and the benefit of PET/ CT imaging in evaluation of diffuse metabolic activity of lung parenchyma
- Determination of the progression of prostate cancer using RT‑PCR method

