Endokrinní odchylky a cévy u diabetiků
Endocrine abnormities and vessels in patients with diabetes
Endocrine impairment is more common in patients with diabetes than in general population. Both hyper ‑ and hypothyroidism increases cardiovascular morbidity and mortality. Subclinical hypothyroidism is a risk factor for coronary hearth disease in patients younger than 65 years. In elderly is its influence questionable or even preventive and the benefit of substitution should be weighted against the risks. Treatment with glucocorticoids in a dose of 7.5 mg methylprednisolone and higher considerably increases risk of vascular impairment. Patients cured from endogenous Cushing’s syndrome maintain increased cardiovascular risk factors and structural changes of vessels. Subclinical hypercortisolism seems to have little effect. Growth hormone (GH) insufficiency increases cardiovascular risks and contributes to increased mortality of these patients. To the contrary increased GH production in acromegaly effect more heart than vessels. Hypogonadism is established risk factor for ischemic accidents in men. The relationship between hypogonadism and diabetes is bidirectional. Low testosterone level increases the risk of type ‑ 2 diabetes and in diabetics is the testosterone level often low. Substitution with testosterone can not only ameliorate hypogonadal symptoms but also decrease cardiovascular risk and even improve control of diabetes.
Key words:
diabetes mellitus – atherosclerosis – hypothyroidism – hypercortisolism – growth hormone – testosterone
Authors:
J. Čáp
Authors‘ workplace:
přednosta prof. MU Dr. Jaroslav Malý, CSc.
; II. interní klinika Lékařské fakulty UK a FN Hradec Králové
Published in:
Vnitř Lék 2010; 56(4): 280-283
Category:
11th National Diabetes Symposium "Diabetes and Angiology", Hradec Kralove, 5 to 6 June 2009
Overview
Hormonální poruchy, zejména štítné žlázy, jsou u diabetiků častější než v běžné populaci. Jak snížená, tak zvýšená funkce štítné žlázy zvyšuje kardiovaskulární riziko. Subklinická hypotyreóza přispívá ke vzniku ischemické choroby srdeční u osob mladších než 65 let, u starších osob je její význam sporný, nebo dokonce protektivní. U starších osob je proto nutno vážit přínos substituce a její možná rizika. Terapie kortikoidy v dávce vyšší než 7,5 mg prednizolonu denně významně zvyšuje riziko cévního postižení. Po kompenzaci endogenního Cushingova syndromu přetrvávají rizikové faktory ischemické choroby i některé strukturální změny cévní stěny. Subklinický hyperkortizolizmus má zřejmě malý význam. Nedostatek růstového hormonu vede ke zvýšení kardiovaskulárního rizika a přispívá ke zvýšené úmrtnosti hypopituitárních nemocných. Naproti tomu nadbytek růstového hormonu u akromegalie působí více na srdeční sval než na cévy. Rizikovým faktorem pro rozvoj cévních změn je hypogonadizmus u mužů. Vztah mezi nízkou hladinou testosteronu a diabetem je obousměrný. Nízká hladina testosteronu u mužů zvyšuje riziko diabetu 2. typu. Naopak u diabetiků je hladina testosteronu častěji snížená. Substituce může v indikovaných případech nejen odstranit příznaky androgenního deficitu, ale také zmírnit kardiovaskulární riziko, a dokonce zlepšit kompenzaci diabetu.
Klíčová slova:
diabetes mellitus – ateroskleróza – hypotyreóza – hyperkortizolizmus – růstový hormon – testosteron
Úvod
Hormonální poruchy, zejména štítné žlázy, jsou u diabetiků častější než v běžné populaci. Cílem tohoto přehledu je diskutovat, jak ovlivňují vývoj cévních změn a kardiovaskulární mortalitu změny hormonů štítné žlázy, poruchy sekrece růstového hormonu, kortizonu a testosteronu u mužů. Vliv ženských hormonů a problematika jejich substituce přesahuje rozsah tohoto článku.
Hormony štítné žlázy
Hormony štítné žlázy významně ovlivňují metabolizmus lipidů. Prostřednictvím stimulace HMG-CoA reduktázy stimulují syntézu cholesterolu v játrech. Zároveň však stimulují expresi LDL receptorů, a tak zvyšují clearance LDL-cholesterolu. Zvyšují aktivitu jaterní lipázy a transportního proteinu pro estery cholesterolu (CETP), a tím zvyšují hydrolýzu HDL2 a jeho přeměnu na HDL3. Celkový HDL je tak nižší při hypertyreóze a zvýšený při hypotyreóze [1]. Změny LDL-cholesterolu jsou však vyšší, takže poměr LDL-/ HDL-cholesterol je proaterogenní při hypotyreóze a příznivý při hypertyreóze.
Manifestní tyreotoxikóza je přestospojena se zvýšenou incidencí koronárních příhod [1]. Subklinická hypertyreóza, charakterizovaná sníženou hladinou TSH při ještě normálních hodnotách tyreoidálních hormonů, nebyla v metaanalýze studií, které braly ohled na věk, hladinu lipidů, kouření, krevní tlak a další kardiovaskulární rizikové faktory, spojena s vyšším výskytem koronárních příhod ani kardiovaskulární úmrtnosti [2]. Naproti tomu v jiné metaanalýze byla celková úmrtnost nemocných se subklinickou hypertyreózou statisticky významně zvýšená [3]. Prospektivní studie prokázala zvýšenou kardiovaskulární i celkovou úmrtnost osob se subklinickou hypertyreózou starších než 60 let [4].
Manifestní hypotyreóza vede řadou mechanizmů ke zvýšení kardiovaskulárního rizika, souhrn byl publikován i v našem písemnictví [5]. Subklinická hypotyreóza je charakterizovaná zvýšenou hladinou TSH při ještě normálních hodnotách tyreoidálních hormonů. I subklinická hypotyreóza vede k mírně vyšší hladině celkového a LDL-cholesterolu. V intervenční studii byl při substituci 100 μg tyroxinu zaznamenán malý (řádově 5%) pokles hladiny celkového a LDL-cholesterolu. Míra poklesu korelovala se změnou hladiny volného tyroxinu [6]. Kromě změny lipidového spektra vede subklinická hypotyreóza k endoteliální dysfunkci. Recentní studie prokázala u osob se subklinickou hypotyreózou normální bazální koronární průtok, ale statisticky sníženou odpověď na chladový test, který je prakticky výlučně závislý na vazodilataci navozené kysličníkem dusnatým [7]. Výše zmíněná intervenční studie potom prokázala zlepšení schopnosti průtokem navozené dilatace na předloktí při substituci [6]. Subklinická hypotyreóza je zřejmě spojena se zvýšeným rizikem ischemické choroby srdeční. V průřezových studiích bylo relativní riziko okolo 1,5 [2,8]. V prospektivních studiích je potom relativní riziko nižší 1,2 – 1,5 [2,9]. Nedávná podrobná metaanalýza prospektivních studií ukázala, že výsledky závisí na věku nemocných. Tam, kde byl průměrný věk účastníků nižší než 65 let, bylo relativní riziko ICHS 1,51 (95% meze spolehlivosti 1,09 – 2,09), zatímco ve studiích, kde byl průměrný věk nad 65 let, bylo riziko jen 1,05 (95% meze spolehlivosti 0,90 – 1,22) [9,10].
Lze tedy shrnout, že jak snížená, tak zvýšená funkce štítné žlázy zvyšuje kardiovaskulární riziko. Zatímco u mladších osob je jistě indikováno i subklinické stavy korigovat, u starších osob je přínos substituce subklinické hypotyreózy sporný a je nutné vážit individuálně přínos a riziko.
Glukokortikoidy
Nadbytek glukokortikoidů způsobuje obezitu, inzulinorezistenci, porušenou glukózovou toleranci, dyslipidemii a hypertenzi [11].
Kromě toho mají kortikoidy přímý vliv na hladký sval cév i na endoteliální buňky a v případě sklerotického plátu i na makrofágy (tab. 1).
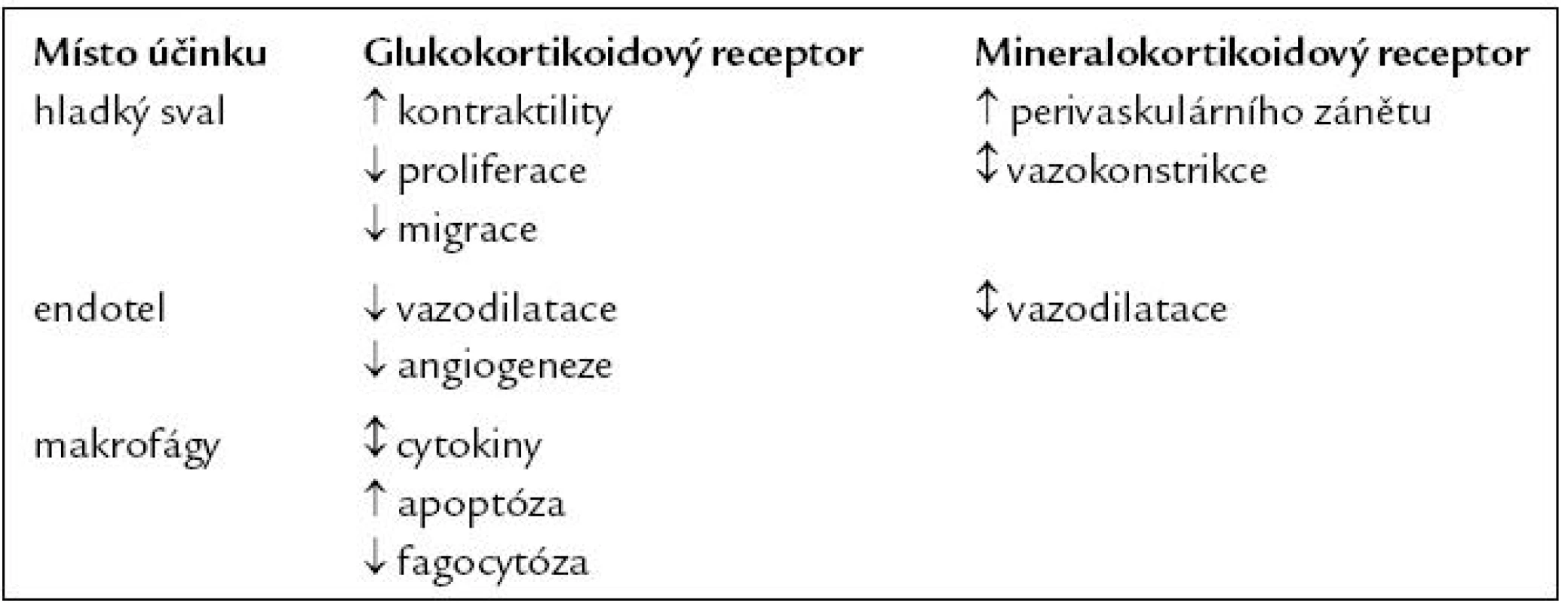
Terapie glukokortikoidy je spojena se zvýšením rizika kardiovaskulárních příhod. Ve velké studii, zahrnující více než 68 000 nemocných léčených kortikoidy, bylo riziko zvýšeno 2,56krát. Lokální terapie a dávky do 7,5 mg prednizolonu denně riziko statisticky významně nezvyšovaly [12]. Asi 4krát je zvýšené riziko také u endogenní nadprodukce kortikoidů u Cushignova syndromu [13].
Hyperkortizolizmus v důsledku zvýšené aktivity osa hypotalamus hypofýza nadledviny se zřejmě podílí i v patogenezi metabolického syndromu. Jeho příčina není jasná, roli hraje chronický stres a nízká porodní hmotnost. U metabolického syndromu je ale také popsána zvýšená produkce kortizolu z kortizonu v periferních tkáních (především tuku, ale i přímo v cévách) v důsledku aktivity dehydrogenázy 17 - β-hydroxysterodů typu 1. Byla popsána i zvýšená citlivost receptorů pro glukokortikoidy [14].
Po úspěšné kompenzaci endogenního Cushingova syndromu přetrvávají nepříznivé kardiovaskulární rizikové faktory (vyšší cholesterol, fibrinogen, inzulinová rezistence), jakož i zvýšená síla intima media a abnormální vazodilatace, nejspíše pro přetrvávání abdominální obezity [15]. Některé rizikové faktory cévního postižení jsou popisovány také u subklinického Cushingova syndromu, který je přítomen až u 20 % nemocných s korovými adenomy nadledvin a jeho odhadovaná prevalence v populaci je kolem 1 % obyvatel [13]. Nedávná retrospektivní práce ale neprokázala u nemocných s incidentalomy léčenými chirurgicky nižší mortalitu ani horší ukazatele kardiovaskulárního rizika ve srovnání s nemocnými pouze sledovanými, a to bez ohledu na přítomnost subklinické autonomní sekrece kortizolu [16].
Růstový hormon
Hypopituitární nemocní s nedostatkem růstového hormonu mají v epidemiologických studiích vyšší úmrtnost, zejména na kardiovaskulární onemocnění [17]. Je to přisuzováno faktu, že tito pacienti mají oproti zdravé populaci vyšší hladiny celkového a LDL-cholesterolu, apolipoproteinu B, triglyceridů a sníženou hladinu HDL cholesterolu. Příčinou je zvýšené množství abdominálního tuku a nižší svalová hmota, vedoucí k inzulinové rezistenci [13,18]. Nemocní s insuficiencí růstového hormonu mají větší tloušťku vrstvy cévní stěny mezi medií a intimou [13,19]. Substituce růstovým hormonem dokáže zlepšit řadu kardiovaskulárních rizikových faktorů – snižuje hladinu celkového a HDL cholesterolu, množství abdominálního tuku, diastolický krevní tlak, zároveň však alespoň přechodně zhoršuje citlivost k inzulinu [18]. Rovněž síla cévní stěny mezi intimou a medií se při substituci zmenšuje [19]. Zda dokáže upravit zvýšenou kardiovaskulární úmrtnost, ukážou až další studie [20]. Na zvýšené úmrtnosti u hypopituitárních nemocných se totiž podílí také další faktory, zejména nedostatečná substituce pohlavních hormonů, nadměrná substituce kortikoidy a hormony štítné žlázy [21].
U akromegalie nejsou změny v lipidovém spektru velké a spíše příznivé. Nadprodukce růstového hormonu je však spojena s dalšími kardiovaskulárními rizikovými faktory, zejména inzulinovou rezistencí, hypertenzí a endoteliální dysfunkcí. Nepřekvapuje proto, že nemocní s aktivní akromegalií (při stanovení metodou RIA s růstovým hormonem vyšším než 2,5 ng/ ml nebo zvýšenou hladinou IGF I) mají asi dvojnásobnou úmrtnost než nemocní kompenzovaní [22]. Na kardiovaskulární úmrtnosti se ale více podílí postižení srdce – hypertrofie s diastolickou a později i systolickou dysfunkcí [13]. Zvýšení rizika ischemické choroby srdeční nebylo u aktivních akromegaliků v prospektivní studii prokázáno [23].
Testosteron
Snížená hladina testosteronu je poměrně častá. Ve studii zahrnující 2 162 mužů starších než 45 let byla zjištěna ve 39 %; prevalence se zvyšuje s věkem [24]. Rizikovým faktorem je obezita (relativní riziko 2,38, hladina testosteronu negativně koreluje s indexem tělesné hmotnosti). Druhým nejvýznamnějším rizikovým faktorem je potom diabetes s rizikem zvýšeným na dvojnásobek. U nemocných s diabetem 2. typu je hladina testosteronu nižší než u osob stejného věku a hmotnosti bez diabetu. V metaanalýze zahrnující 3 852 mužů ze 36 průřezových a 7 prospektivních studií byl rozdíl v hladině celkového testosteronu 0,77 μg/ l. U žen byla hladina testosteronu naopak u diabetiček vyšší o 0,06 μg/ l [25].
Na druhou stranu nedostatek testosteronu pravděpodobně zvyšuje riziko vzniku diabetu a koronárních příhod. Ve velkém souboru 73 196 mužů léčených pro karcinom prostaty vedla suprese androgenů pomocí superanalogů gonadoliberínu ke zvýšení rizika diabetu (relativní riziko 1,44), mírně, ale statisticky významně byla zvýšena incidence ischemické choroby srdeční, infarktu myokardu a náhlé smrti [26]. Ve zcela recentní studii byla zvýšená incidence diabetu při supresi testosteronu u karcinomu prostaty potvrzena, riziko ischemické choroby srdeční však zvýšené nebylo [27]. Vyšší riziko vzniku diabetu bylo zjištěno ale i v prospektivních studiích mužů bez iatrogenně navozeného hypogonadizmu. Nedávná metaanalýza [25] prokázala, že muži, kteří měli hladinu celkového testosteronu vyšší než medián celého souboru, měli o 42 % nižší riziko vzniku diabetu 2. typu než ti, kteří měli hladinu v dolní polovině.
Mužský hypogonadizmus je spojen s abdominální obezitou, zhoršením citlivosti k inzulinu a nepříznivě ovlivňuje hladinu lipidů. Nadto přímo působí na cévní stěnu a jeho nedostatek se projevuje endoteliální dysfunkcí [28,29]. Naskýtá se otázka, zda substituce testosteronem může zlepšit metabolický stav u diabetu. V roce 2003 byla publikována práce, v níž substituce testosteronem vedla k poklesu glykemie, snížení glykovaného hemoglobinu z 10,4 na 8,6 % [30]. Nedávno prokázal Kapoor et al ve dvojitě slepé studii [31], že substituce u hypogonádních diabetiků 2. typu snížila statisticky významně glykemii (o 1,58 mmol/ l), glykovaný hemoglobin (o 0,37 %) a zlepšila citlivost k inzulinu (HOMA index poklesl o 1,73). Došlo také ke snížení cholesterolu a množství viscerálního tuku.
Vztah mezi nízkou hladinou testosteronu a diabetem je tedy obousměrný. Nízká hladina testosteronu u mužů zvyšuje riziko diabetu 2. typu. Naopak u diabetiků je hladina testosteronu častěji snížená. Substituce může v indikovaných případech nejen odstranit příznaky androgenního deficitu, ale také zlepšit kompenzaci diabetu.
prof. MUDr. Jan Čáp, CSc.
www.fnhk.cz
e-mail: capj@lfhk.cuni.cz
Doručeno do redakce: 2. 1. 2009
Sources
1. Neves C, Alves M, Medina JL et al. Thyroid diseases, dyslipidemia and cardiovascular pathology. Rev Port Cardiol 2008; 27 : 1211 – 1236.
2. Singh S, Duggal J, Molnar J et al. Impact of subclinical thyroid disorders on coronary heart disease, cardiovascular and all‑cause mortality: a meta‑analysis. Int J Cardiol 2008; 125 : 41 – 48.
3. Haentjens P, Van Meerhaeghe A, Poppe Ket al. Subclinical thyroid dysfunction and mortality: an estimate of relative and absolute excess all‑cause mortality based on time ‑ to ‑ event data from cohort studies. Eur J Endocrinol 2008; 159 : 329 – 341.
4. Parle JV, Maisonneuve P, Sheppard MC et al. Prediction of all‑cause and cardiovascular mortality in elderly people from one low serum thyrotropin result: a 10‑year cohort study. Lancet 2001; 358 : 861 – 865.
5. Jiskra J, Límanová Z, Antošová M. Tyreopatie, dyslipidemie a kardiovaskulární rizika. Vnitř Lék 2007; 53 : 382 – 385.
6. Razvi S, Ingoe L, Keeka G et al. The beneficial effect of L ‑ thyroxine on cardiovascular risk factors, endothelial function, and quality of life in subclinical hypothyroidism: randomized, crossover trial. J Clin Endocrinol Metab 2007; 92 : 1715 – 1723.
7. Biondi B, Galderisi M, Pagano L et al. Endothelial ‑ mediated coronary flow reserve in patients with mild thyroid hormone deficiency. Eur J Endocrinol 2009; 161 : 323 – 329.
8. Rodondi N, Aujesky D, Vittinghoff E et al. Subclinical hypothyroidism and the risk of coronary heart disease: a meta‑analysis. Am J Med 2006; 119 : 541 – 551.
9. Ochs N, Auer R, Bauer DC et al. Meta‑analysis: subclinical thyroid dysfunction and the risk for coronary heart disease and mortality. Ann Intern Med 2008; 148 : 832 – 845.
10. Razvi S, Shakoor A, Vanderpump M et al. The influence of age on the relationship between subclinical hypothyroidism and ischemic heart disease: a metaanalysis. J Clin Endocrinol Metab 2008; 93 : 2998 – 3007.
11. Walker BR. Glucocorticoids and cardiovascular disease. Eur J Endocrinol 2007; 157 : 545 – 559.
12. Wei L, MacDonald TM, Walker BR. Taking glucocorticoids by prescription is associated with subsequent cardiovascular disease. Ann Intern Med 2004; 141 : 764 – 770.
13. Marek J, Hána V, Kršek M. Jak ovlivňujíi kortikoidy, růstový hormon a estrogeny lipidy a aterosklerózu. Vnitř Lék 2007; 53 : 386 – 390.
14. Anagnostis P, Athyros VG, Tziomalos Ket al. Clinical review: The pathogenetic role of cortisol in the metabolic syndrome: a hypothesis. J Clin Endocrinol Metab 2009; 94 : 2692 – 2701.
15. Colao A, Pivonello R, Spiezia S et al. Persistence of increased cardiovascular risk in patients with Cushing’s disease after five years of successful cure. J Clin Endocrinol Metab 1999; 84 : 2664 – 2672.
16. Sereg M, Szappanos A, Toke J et al. Atherosclerotic risk factors and complications in patients with non‑functioning adrenal adenomas treated with or without adrenalectomy: a long‑term follow‑up study. Eur J Endocrinol 2009; 160 : 647 – 655.
17. Rosén T, Bengtsson BA. Premature mortality due to cardiovascular disease in hypopituitarism. Lancet 1990; 336 : 285 – 288.
18. Maison P, Griffin S, Nicoue ‑ Beglah M et al. Impact of growth hormone (GH) treatment on cardiovascular risk factors in GH ‑ deficient adults: a Metaanalysis of Blinded, Randomized, Placebo ‑ Controlled Trials. J Clin Endocrinol Metab 2004; 89 : 2192 – 2199.
19. Colao A, Di Somma C, Spiezia S et al. Growth hormone treatment on atherosclerosis: results of a 5‑year open, prospective, controlled study in male patients with severe growth hormone deficiency. J Clin Endocrinol Metab 2008; 93 : 3416 – 3424.
20. Čáp J. Substituce růstového hormonu u dospělých: zlepšení kvality, nebo prodloužení života? Vnitř Lék 2003; 49 : 589 – 591.
21. Tomlinson JW, Holden N, Hills RK et al. Association between premature mortality and hypopituitarism. West Midlands Prospective Hypopituitary Study Group. Lancet 2001; 357 : 425 – 431.
22. Holdaway IM, Bolland MJ, Gamble GD. A meta‑analysis of the effect of lowering serum levels of GH and IGF‑I on mortality in acromegaly. Eur J Endocrinol 2008; 159 : 89 – 95.
23. Bogazzi F, Battolla L, Spinelli C et al. Risk factors for development of coronary heart disease in patients with acromegaly: a five‑year prospective study. J Clin Endocrinol Metab 2007; 92 : 4271 – 4277.
24. Mulligan T, Frick MF, Zuraw QC et al. Prevalence of hypogonadism in males aged at least 45 years: the HIM study. Int J Clin Pract 2006; 60 : 762 – 769.
25. Ding EL, Song Y, Malik VS et al. Sex differences of endogenous sex hormones and risk of type 2 diabetes: a systematic review and meta‑analysis. JAMA 2006; 295 : 1288 – 1299.
26. Keating NL, O'Malley AJ, Smith MR. Diabetes and cardiovascular disease during androgen deprivation therapy for prostate cancer. J Clin Oncol 2006; 24 : 4448 – 4456.
27. Alibhai SM, Duong‑Hua M, Sutradhar Ret al. Impact of androgen deprivation therapy on cardiovascular disease and diabetes. J Clin Oncol 2009; 27 : 3452 – 3458.
28. Traish AM, Saad F, Feeley RJ et al. The dark side of testosterone deficiency: III. Cardiovascular disease. J Androl 2009; 30 : 477 – 494.
29. Traish AM, Saad F, Guay A. The dark side of testosterone deficiency: II. Type 2 diabetes and insulin resistance. J Androl 2009; 30 : 23 – 32.
30. Boyanov MA, Boneva Z, Christov VG. Testosterone supplementation in men with type 2 diabetes, visceral obesity and partial androgen deficiency. Aging Male 2003; 6 : 1 – 7.
31. Kapoor D, Goodwin E, Channer KS et al. Testosterone replacement therapy improves insulin resistance, glycaemic control, visceral adiposity and hypercholesterolaemia in hypogonadal men with type 2 diabetes. Eur J Endocrinol 2006; 154 : 899 – 906.
Labels
Diabetology Endocrinology Internal medicineArticle was published in
Internal Medicine

2010 Issue 4
-
All articles in this issue
- Úvodní slovo
- Diabetes a prediktivní medicína – paralaxa současnosti
- Ischemická choroba dolních končetin a diabetes
- Komplexní péče o diabetika se syndromem diabetické nohy
- Klinický význam cévního postižení u diabetiků s onemocněním ledvin – pohled nefrologa
- Lokální léčba ran a cévní zásobení
- Endokrinní odchylky a cévy u diabetiků
- Diabetes mellitus a protrombotická aktivita
- Co spojuje obezitu a aterosklerózu?
- Pohybová aktivita v prevenci cévních komplikací a diabetes
- Hyperglykemie v akutní fázi mozkové ischemie a rekanalizační léčba
- Diabetes mellitus a ischemická choroba srdeční
- Léčba hypertenze u pacientů s diabetes mellitus a ischemickou chorobou dolních končetin
- Antihyperglykemická léčba a cévní onemocnění
- Chirurgická léčba ischemické choroby srdeční a diabetes mellitus
- Perkutánní intervenční výkony na věnčitých tepnách u diabetiků
- Péče o diabetika s cévním onemocněním
- Flebologické problémy a diabetes
- Angiopatie a oko
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue
- Angiopatie a oko
- Ischemická choroba dolních končetin a diabetes
- Chirurgická léčba ischemické choroby srdeční a diabetes mellitus
- Diabetes mellitus a ischemická choroba srdeční
