Fibrilace síní v době katétrové ablace
Atrial fibrillation in the era of catheter ablation
Atrial fibrillation is the most frequent heart rhythm abnormality and is associated with increased morbidity and mortality. Trigerring ectopias and arrhythmogenic substrate that enable arrhythmia to sustain are both influenced by many modulating factors. Which risk factor is the most signifficant one remains unknown. Understanding pathophysiology of atrial fibrillation including molecular and genetic aspects is necessary to assign the most effective preventive measures as well as treatment of atrial fibrillation. Pharmacological treatment is the method of choice but “upstream therapy” that counteracts atrial remodelling has been more and more discussed. Presently the most effective treatment of atrial fibrillation is catheter ablation. Successful ablation prevents from the progression of electrical, structural and mechanical myocardial remodelling, improves left ventricle function and the risk of trombembolism drops to the level of healthy population. The restitution of sinus rhythm triggers a reversal remodelling. We present results of catheter ablations performed at Internal Cardiology Department of the MU Medical Faculty and Faculty Hospital Brno.
Key words:
atrial fibrillation – pathophysiology – remodelling – upstream therapy – catheter ablation
Authors:
R. Lábrová
Authors‘ workplace:
Interní kardiologická klinika Lékařské fakulty MU a FN Brno, pracoviště Bohunice, přednosta prof. MUDr. Jindřich Špinar, CSc., FESC
Published in:
Vnitř Lék 2010; 56(8): 871-879
Category:
50th Birthday - Jindřich Špinar, MD, CSc., FESC
Overview
Fibrilace síní je nejčastější poruchou srdečního rytmu a je spojena se zvýšenou morbiditou a mortalitou. Spouštěcí ektopie i arytmogenní substrát pro udržení arytmie jsou výrazně ovlivňovány mnoha modulujícími faktory. Který z rizikových faktorů je nejvýznamnější, zatím není zcela jasné. Pochopení patofyziologie fibrilace síní, včetně molekulární úrovně a genetiky, je nutné ke stanovení nejen účinné léčby fibrilace síní, ale i terapie v rámci prevence. Léčebnou metodou první volby je léčba farmakologická, ale stále více se diskutuje nasazení tzv. upstream terapie, která zasahuje do remodelace síně. Zatím nejúčinnější léčbou fibrilace síní je katétrová ablace. Úspěšná ablace fibrilace síní zabrání progresi elektrické, strukturální a mechanické remodelace myokardu, zlepšuje funkci levé komory a riziko tromboembolie se dostává na úroveň rizika zdravé populace. Nástupem sinusového rytmu se spouští i reverzní remodelace. V práci se prezentují výsledky katétrových ablací na Interní kardiologické klinice LF MU a FN Brno.
Klíčová slova:
fibrilace síní – patofyziologie – remodelace – upstream terapie – katétrová ablace
Úvod
Prevalence fibrilace síní (FS) u dospělé populace byla dříve udávána 0,4%, v současnosti 1,0 % a zvyšuje se s věkem [1,2]. Tento vzestup nelze vysvětlit pouze stárnutím populace při zlepšené léčbě ostatních chorob a prodloužením průměrné délky života. Vyšší výskyt FS byl pozorován i po korekci na věk, pohlaví a přidružené choroby [3,4]. U mladších osob pod 55 let je výskyt FS kolem 0,1 %, u osob starších 60 let je 4 % a u osob nad 80 let 10 %. U mladších pacientů se objevují spíše formy paroxyzmální a s přibývajícím věkem, díky elektrické a strukturální remodelaci levé síně a přidruženým chorobám, se FS postupně mění ve formu perzistentní až permanentní [5].
Výskyt srdečního selhání (SS) a FS má rostoucí tendenci a čím je závažnější srdeční selhání, tím častěji je přítomná FS. U pacientů s asymptomatickou dysfunkcí levé komory při funkční třídě NYHA I (New York Heart Association) je prevalence FS kolem 5 %, u třídy NYHA IV téměř 50 %. V posledních studiích byl zjištěn nižší výskyt FS u dobře zaléčeného SS [6]. Strukturální změny, které vznikají při SS, umožní vznik FS. FS může být i příčinou kardiomyopatie s rozvojem srdečního selhání. Podílí se na tom rychlá frekvence komor, antrioventrikulární dyssynchronie, nepravidelný RR interval, aktivace neurohumorálních mechanizmů, změna tonu autonomního nervstva, intersticiální fibrotizace myokardu, objemové a tlakové přetížení srdce. Obě tyto choroby zhoršují toleranci zátěže, kvalitu života, ale také zhoršují morbiditu a mortalitu [7,8].
Na dvojnásobné mortalitě u pacientů s FS se podílí převážně tromboembolické mozkové příhody a částečně i progrese srdečního selhání. Riziko mozkové příhody je u pacientů s FS 5krát vyšší než u sinusového rytmu (SR). Úspěšná léčba FS a obnovení SR potom vedou k částečnému zlepšení, někdy až k úplné normalizaci funkce levé komory [9,10].
Patogeneze a patofyziologie FS
Epidemiologické odhady nárůstu výskytu FS v příštích 50 letech 2,5–5krát jsou varující, a proto je potřeba v nejbližší době navrhnout správnou strategii prevence a léčby FS [3]. K tomu je potřebné odhalit a pochopit složitý proces patofyziologie FS již na molekulární úrovni. Vzájemná souvislost FS se srdečním selháním, hypertenzí, mozkovou příhodou, cukrovkou a jinými přidruženými chorobami a pravděpodobně i zánětem, metabolickým syndromem, obstrukční spánkovou apnoí, se intenzivně zkoumá od molekulární úrovně, genetiky až po klinický výzkum [11,12].
V současné době probíhá výzkum ve 3 oblastech, protože jsou pouze omezené znalosti patofyziologie FS na molekulární úrovni. Zkoumají se změny v genetické expresi iontových kanálů, které ovlivňují průběh akčního potenciálu myokardiálních buněk síní, dále molekulární změny, které jsou spouštěny běžící arytmií a které jsou důležité pro přechod arytmie z paroxyzmální do chronické formy. Dále se zkoumají možné genetické defekty, které jsou podkladem familiární formy arytmie, nebo které vytváří určitou predispozici ke vzniku arytmie [13]. Bude velice těžké posoudit a odlišit, zda změny na molekulární úrovni jsou skutečnou příčinou vzniku FS nebo jsou pouze jejím důsledkem, tzn. výsledkem adaptačních či kompenzačních mechanizmů při FS. Adaptační změny v síních při FS nazýváme remodelací, která může být elektrická, strukturální i na molekulární úrovni.
Elektrická remodelace síní
Elektrofyziologické změny, které vznikají v rámci elektrické remodelace při běžící FS, vznikají v horizontu minut až dnů. Při vzniku a udržení reentry arytmií hraje důležitou roli různorodost akčních potenciálů v čase i mezi jednotlivými oblastmi myokardu síní [14]. Variabilita délky akčních potenciálů souvisí s iontovými kanály – převážně vápníkovými a draslíkovými. V místech s nejdelším trváním akčního potenciálu je největší zastoupení ICa-L, v oblastech s nízkou amplitudou akčního potenciálu je nízká denzita Ito. Při FS dochází k redukci L typu kalciových proudů, které vedou ke zkrácení efektivní refrakterní periody a zkrácení délky excitační vlny [15]. Postupné zkracování efektivní refrakterní periody, zkrácení trvání akčního potenciálu a zvýšená disperzita refrakterních period vede k udržování reentry okruhů a snižuje se možnost spontánní verze na sinusový rytmus.
Angiotenzin II také modifikuje elektrofyziologii síní pomocí nepřímých vlivů na iontové kanály. Stimulace AT1 receptorů aktivuje fosfolipázu C, která vede k inositoltrifosfátem indukovanému uvolnění vápníku ze sarkoplazmatického retikula. Zvýšená hladina vápníku a redukce draslíku podporují změnu síňové refrakterity [16].
Strukturální remodelace síní
U chronických forem FS se vyvíjí morfologické změny při strukturální remodelaci v průběhu měsíců. Některé změny mohou být na podkladě stárnutí, degenerativních změn, aktivací renin‑angiotenzin‑aldosteronového systému (RAAS).
Vzniká dilatace a hypertrofie síní, objevuje se hypertrofie myocytů, myolýza, fibrotické změny, tuková infiltrace. Depozita pojivové tkáně mezi myocyty síní vedou k ohraničeným elektrofyziologickým nehomogenitám, což zpomaluje vedení v síni a dává prostor ke vzniku mateřských reentry okruhů, které se podílejí na vzniku a trvání FS [14,17].
Elektronová mikroskopie prokázala u zvířecích modelů zvýšený počet a velikost mitochondrií a fragmentaci sarkoplazmatického retikula, dále myolýzu s úbytkem kontraktilních elementů [18]. Vzhledem k úbytku kontraktilních elementů v myocytech síní nedochází po verzi FS na SR k úpravě mechanické funkce síní hned, ale síňová kontraktilita se obnoví až po několika týdnech.
Některé změny při strukturální remodelaci jsou reverzibilní, ale vratnost strukturálních změn a fibrózy nemusí být úplná. Zabránění remodelace potom zvýší pravděpodobnost obnovení a udržení SR.
Na strukturální remodelaci síní se podílí i RAAS. Vazebným místem pro angiotenzin II jsou AT1 a AT2 receptory. Stimulace AT1 receptoru indukuje hypertrofii síňových myocytů, fibrózu, postihuje kontraktilitu síní. Stimulace AT2 receptoru má účinek opačný a proliferativní procesy inhibuje.
Dvě různé studie ukázaly variabilní zastoupení subtypů receptorů pro angiotenzin II u paroxyzmální a perzistentní FS. AT1 receptorová deregulace potom souvisí s těžšími formami FS [19]. Někteří autoři prokázali u perzistentní formy FS lokálně zvýšenou hladinu angiotenzin‑konvertujícího enzymu ve tkáni síně u pacientů s normální systolickou funkcí levé komory [20]. Dalším důležitým mechanizmem, kterým působí angiotenzin II na buněčné úrovni, je aktivace proteinkináz, které indukují apoptózu a fibrózu.
Mechanická remodelace síní
V důsledku strukturální remodelace dochází ke snížení mechanické funkce levé síně. Chybí organizovaná mechanická kontrakce, snižuje se výdejová rychlost ouška levé síně. Jsou vytvořeny podmínky pro krevní stázu a tvorbu trombu, a tím se zvyšuje riziko tromboembolie. V důsledku chybění síňového příspěvku může dojít ke snížení minutového srdečního výdeje až o 20 %.
Teorie mechanizmu vzniku a udržení FS
V současné době se opíráme o teorii vytvořenou v roce 1998 Haissaquerrem et al [21]. Teorie vychází z existence jednoho nebo více ektopických fokusů většinou v síňovém myokardu v ústí plicních žil, méně často v jiných lokalizacích, jako je crista terminalis, ústí horní duté žíly v pravé síni, oblast koronárního sinu a Marshallovy žíly v levé síni, slouží ke spuštění FS. Dále je nutná existence jednoho nebo více reentry okruhů (tzv. rotorů) v levé síni, které jsou lokalizovány ve venózní zadní části levé síně, ale i v antrech PŽ a slouží k udržení FS. U paroxyzmální FS převládá význam ektopie, u perzistentní či permanentní FS, kdy je přítomná již strukturální remodelace levé síně, jsou podmínky pro reentry okruhy k udržení FS.
Genetická epidemiologie
První gen pro FS byl odhalen v roce 2003 [22]. Jedná se o mutaci na chromozomu 11 v genu KCNQ1, kódujícím a podjednotku draslíkového kanálu IKs. Zvýšená funkce tohoto draslíkového kanálu vede ke zkrácení akčního potenciálu a efektivní refrakterní periody, což se pravděpodobně podílí na vzniku a udržení FS.
Ne u všech pacientů, kteří mají známou kardiopatii, se objeví FS. Tito pacienti s FS by mohli mít určitou genetickou predispozici, a proto se v současné době hledají asociace genů, jejichž přítomnost by mohla být rizikem vzniku FS. Existuje předběžný důkaz asociace mezi polymorfizmem RAAS genu se zvýšeným rizikem vzniku FS [23]. Práce jiných autorů ukazují, že na vzniku FS se podílí oxidativní stres a existuje spojitost mezi polymorfizmem genu 174 G/C pro interleukin‑6, zvláště u pacientů po kardiochirurgických operacích [24].
Nové rizikové faktory
Diastolická dysfunkce je běžným projevem stárnutí a u starších lidí je často podkladem vzniku srdečního selhání bez přítomnosti systolické dysfunkce. Zhoršování diastolické dysfunkce bývá spojeno s dilatací levé síně a zvýšeným napětím stěny síně. Až u 20 % pacientů s těžkou diastolickou dysfunkcí došlo ke vzniku FS během 5 let ve srovnání s pacienty bez této dysfunkce, kde vznikla FS pouze u 1 % pacientů [25,26].
Spánková apnoe, pokud se neléčí během spánku nepřetržitou pozitivní přetlakovou ventilací, se také podílí na vzniku FS, a to v důsledku hypoxemie, hyperkapnie, zvýšeného sympatického či sníženého vagového tonu, dále při vazokonstrikci a. pulmonalis dochází ke zvýšení tlaků pravostranných srdečních oddílů a zvýšenému uvolňování síňového natriuretického peptidu [27,28].
Zánět: Hromadící se důkazy z genetických studií, kvantifikace stanovených zánětlivých markerů a histologické vzorky ukazují na významnou spojitost mezi zánětem a FS, na kterém se významně podílí aktivace RAAS. Angiotenzin II má některé prozánětlivé vlastnosti, jako aktivaci různých zánětlivých mediátorů, např. C-reaktivní protein, tumor necrosis faktor α, interleukin‑6, nukleární faktor κ B a nukleární faktor α a také stimuluje infiltraci neutrofily. Dále bylo demonstrováno, že zvýšená síňová exprese angiotenzinu II je spojená se zvýšenou smrtí buněk síní a leukocytární infiltrací, což znovu podporuje těsné spojení mezi RAAS, zánětem a FS [29]. Angiotenzin II má i protrombotické vlastnosti, čímž zvyšuje riziko mozkové příhody v přítomnosti FS [30–32].
Léčba fibrilace síní
Terapií první volby u pacientů s FS stále zůstává terapie farmakologická. Účinnost této antiarytmické léčby je kolem 40–60 % a je většinou dočasná a nese s sebou řadu nežádoucích účinků. Riziko nejvážnějšího proarytmického účinkuantiarytmika se zvyšuje se závažností strukturálního postižení srdce.
U pacientů bez přítomného organic-kého postižení srdce podáváme ke kontrole rytmu antiarytmika I. třídy Vau-ghanovy-Williamsovy klasifikace – pro-pafenon, event. v kombinaci s beta‑blo-kátorem či verapamilem. U ICHS a dobrou funkcí LK podáváme ke kontrole rytmu antiarytmika III. třídy – sotalol nebo amiodaron, event. amiodaron v kombinaci s beta‑blokátorem. Pro pacienty se srdečním selháním a ejekční frakcí levé komory pod 35 % je k dispozici pouze amiodaron, event. v kombinaci s beta‑blokátorem.
Účinnost antiarytmické terapie je nízká a ještě se snižuje s délkou jejího podávání. Podle klinických studií jednoroční podávání propafenonu nebo sotalolu udrží SR asi u 40 % pacientů a podání nejúčinnějšího amiodaronu u 70 % pacientů. Po jednoroční terapii antiarytmiky I. třídy se musela léčba pro nežádoucí účinky zastavit asi u 1/3 pacientů ve studii AFFIRM a po několikaletém užívání se musel asi u 30 % vysadit i amiodarone [33,34].
Z nových antiarytmik se jeví nadějně dronedaron, což je benzofuran, antiarytmikum III. třídy, který je strukturálně podobný amiodaronu, ale neobsahuje molekulu jódu, která je zodpovědná za většinu nežádoucích účinků. Je indikován v prevenci recidiv FS. V poslední velké studii ATHENA, multicentické dvojitě slepé placebem kontrolované, se hodnotil dronedaron z hlediska prevence hospitalizací z kardiovaskulárních příčin a mortalita z jakékoliv příčiny u FS. Dronedaron vykazoval velmi nízké riziko orgánové toxicity a proarytmického účinku. Výrazně snížil relativní riziko hospitalizace z kardiovaskulárních příčin nebo celkové mortality o 24 %, výrazně snížil riziko úmrtí z kardiovaskulárních příčin, a to o 29 %. Dronedaron je jediným antiarytmikem u pacientů s FS, které snižuje počet kardiovaskulárních hospitalizací a celkové mortality [35].
V klinických studiích se dále zkouší nová antiarytmika III. třídy – azimilid, tedisamil, dále antiarytmikum působící selektivně v síních vernakalant, který se používal k medikamentózní verzi FS.
Pokud pacient není indikovaný ke kontrole rytmu, většinou z důvodu přítomnosti významných komorbidit a věku pacienta, ponecháváme FS jako základní rytmus a ke kontrole frekvence komor podáváme antiarytmika, která zpomalují vedení v oblasti AV uzlu, verapamil, beta‑blokátory, event. digoxin.
„Upstream“ terapie FS
Tzv. upstream léčba vede k prevenci a také léčbě remodelace síní, která se podílí na vzniku a udržení FS. Stupeň remodelace je také důležitý z hlediska účinnosti léčby FS. Zabráněním remodelace síní se zvýší pravděpodobnost obnovení a udržení SR, což také ukazují studie se síňovými defibrilátory, kdy časná léčba atak FS vedla ke snížení četnosti paroxyzmů FS. Podle menších studií byly v upstream léčbě podávány statiny, glukortikoidy a ω‑3 vícenenasycené mastné kyseliny. Podávání statinů i kortikoidů vedlo ke statisticky významnému snížení rekurence FS, což bylo zřejmě důsledkem jejich protizánětlivého účinku [36–38]. Pozitivní účinek této neantiarytmické léčby v rekurenci FS je ještě nutné prokázat v klinických studiích s větším souborem pacientů.
U pacientů s kardiovaskulárním onemocněním a zvláště s přítomnou dysfunkcí levé komory se zvyšuje aktivace RAAS, který se podílí na regulaci rovnováhy vodního prostředí, minerálů a dále reguluje cévní odpověď na poškození a zánět. U FS má RAAS vliv jak na elektrickou, tak na strukturální remodelaci. V upstream léčbě se nejvíce uplatňuje blokáda RAAS, a to především inhibitory angiotenzin konvertujícího enzymu a blokátory receptoru 1 pro angiotenzin II. Obě skupiny léků ovlivňují negativní působení angiotenzinu II na buňky. Angiotenzin II je největším stimulátorem fibrózy, která je nejvýznamnějším rizikovým faktorem vzniku FS. Inhibice RAAS brání fibróze, apoptóze, zánětu, leukocytární infiltraci a následné remodelaci, a tím vzniku a recidivě FS [30–32].
Kontrola rytmu, nebo kontrola frekvence?
Na tuto otázku, zda udržet sinusový rytmus nebo ponechat fibrilaci síní jako základní rytmus a pouze kontrolovat frekvenci komor, měly odpovědět studie PIAF, RACE, STAF, ale především největší studie AFFIRM [39–42]. Studie v podstatě dospěly ke stejnému závěru, že není rozdíl mezi skupinami s kontrolou rytmu a kontrolou frekvence, že mortalita i vznik kardioembolických příhod je srovnatelná. Na podkladě těchto závěrů by potom nemělo smysl usilovat o sinusový rytmus. Tyto studie měly řadu nedostatků. Do studie AFFIRM byli zařazeni pacienti starší, málo symptomatičtí. Mladší a významně symptomatičtí pacienti zařazeni nebyli, tito byli zřejmě indikováni ke katétrové ablaci. Skupina pacientů randomizovaná ke kontrole rytmu měla na konci sledování v 63 % sinusový rytmus a skupina randomizovaná ke kontrole frekvence měla SR u 33 % pacientů. Ve studii jde spíše o porovnání dvou farmakologických postupů: nasazení uzlových antiarytmik u fibrilace síní k udržení přiměřené komorové odpovědi vs podání antiarytmik I. a III. třídy u sinusového rytmu k zabránění recidiv FS. Subanalýza této studie ukázala snížení rizika mortality u pacientů se SR o 47 % [43].
Pokud nedojde ani po antiarytmické terapii k udržení sinusového rytmu nebo nedosáhneme eufrekvenční FS, je nutné zvolit v léčbě FS některý z nefarmakologických postupů.
Pokud pacient není indikovaný k selektivní katétrové ablaci a ponecháme FS jako základní srdeční rytmus a nedaří se udržet přiměřená komorová odpověď, indikujeme neselektivní ablaci atrioventrikulární junkce s nutností implantace trvalého kardiostimulátoru, event. při přítomnosti SS se zváží resynchronizační biventrikulární stimulace srdce. Jestliže je pacient s FS indikovaný ke kardiochirurgickému zákroku, provádí se během jednoho výkonu MAZE procedury (tzv. bludiště), kdy se radiofrekvenční energií nebo kryoablací provádí v levé síni cirkumferenční a lineární linie, které brání šíření elektrické reentry aktivity v síních. Pokud jsou v oušku levé síně tromby, ouško se pro velké riziko vzniku tromboembolických příhod odstraní.
K velkému rozvoji došlo v oblasti selektivních katétrových ablací symptomatických paroxyzmálních, ale v současnosti i chronických forem FS, a to jak u pacientů bez organického postižení srdce, tak stále častěji se indikují i pacienti s projevy SS.
V poslední době již bylo publikováno několik studií, které u pacientů s FS srovnávají účinnost antiarytmické terapie s radiofrekvenční katétrovou ablací. Výsledky těchto studií vyšly jednoznačně ve prospěch katétrových ablací. Poprvé byly výsledky retrospektivní, nerandomizované studie prezentované v roce 2003 C. Papponem z Milána, který srovnával 589 pacientů s FS, kteří podstoupili RFA, s 582 pacienty léčenými antiarytmickou terapií. Doba sledování byla 900 dnů. Po katétrové ablaci došlo k významnému snížení morbidity, zvláště byl snížen výskyt CMP a SS, rekurence FS byla snížena o 70 %. Došlo i k významnému snížení celkové mortality, kdy po katétrové ablaci se celková mortalita dostává na úroveň zdravé populace [44]. Na podkladě těchto výsledků vznikly potom již prospektivní randomizované studie, které srovnávají obě metody. První studie RAAFT byla publikovaná v roce 2005 [45]. Bylo zařazeno 70 pacientů s paroxyzmální formou FS. Po ročním sledování byli pacienti po katétrové ablaci v 87 % a po antiarytmické terapii pouze v 37 % bez FS. V roce 2006 byla publikována studie CACAF, do které bylo zařazeno 137 pacientů jak s paroxyzmální, tak perzistentní formou FS [46]. Po ablaci bylo 56 % a po farmakologické terapii 9 % bez FS. Ve stejném roce prezentoval Pappone studii APAF, ve které bylo 198 pacientů s paroxyzmální formou FS [47]. Po ročním sledování bylo po cirkumferenční ablaci plicních žil 94 % a po antiarytmiích 35 % bez FS. Další studií, která sledovala 112 pacientů s paroxyzmální FS, byla studie A4. Po elektrické izolaci plicních žil a u některých pacientů s doplněním lineárních lézí bylo po ročním sledování 75 % a po antiarytmické léčbě pouze 6 % pacientů bez FS [48].
V roce 2006 publikoval Oral výsledky studie se 146 pacienty s chronickou FS, kteří byli randomizováni na léčbu ablační nebo léčbu amiodaronem [49]. Asi 1/3 pacientů, která podstoupila cirkumferenční ablaci plicních žil, musela podstoupit druhý zákrok. Ve skupině léčené amiodaronem v případě recidivy FS bylo možné indikovat maximálně 2 elektrické kardioverze. V průběhu sledování 3/4 pacientů s amiodaronem se také rozhodly podstoupit ablaci. Takže po jednom roce bylo po ablaci 74 % pacientů bez rekurence FS a na amiodaronu pouze 4 %.
Na podkladě výsledků těchto studií je jednoznačné, že strategie kontroly rytmu katétrovou ablací je na rozdíl od podání antiarytmické terapie z hlediska úspěšnosti, morbidity i mortality lepší.
Selektivní katétrová ablace paroxyzmální FS
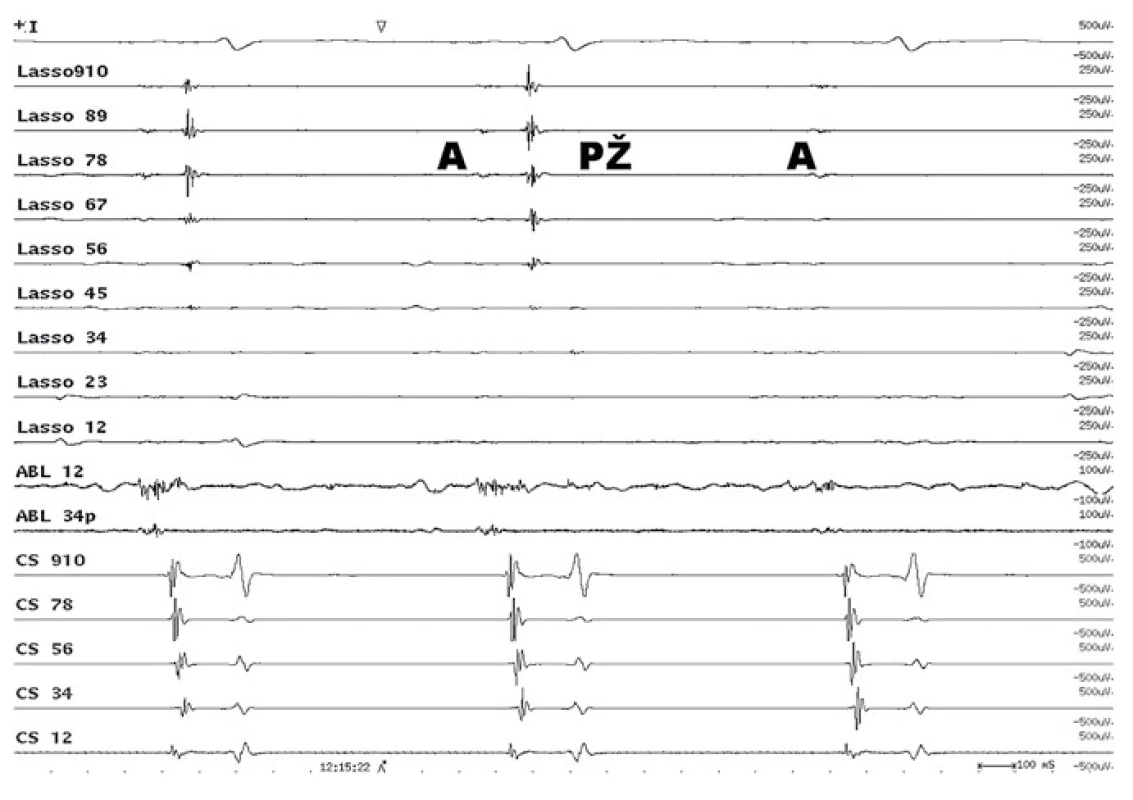
Rozšiřující se poznatky o roli plicních žil v patofyziologii FS a nedostatcích fokální ablace vedly na konci 90. let minulého století ke vzniku tzv. obkružující ablace kolem plicních žil. Po dvojnásobné transseptální punkci se přes transseptální dlouhé sheathy zavede do plicní žíly cirkulární mapovací katétr, který snímá elektrické potenciály generované myokardem plicních žil po celém obvodu ústí plicní žíly a ablační katétr. Současně se vedle sebe rozvíjely dvě ablační strategie. Tzv. segmentální izolace plicních žil vypracovaná v Bordeaux je založena na mapování elektrické aktivity v ústích plicních žil pomocí cirkulárního katétru, vyhledání a následném přerušení svalových snopců spojujících elektricky myokard levé síně a plicních žil. Jejím cílovým momentem je dosažení úplné elektrické izolace všech plicních žil (obr. 1).
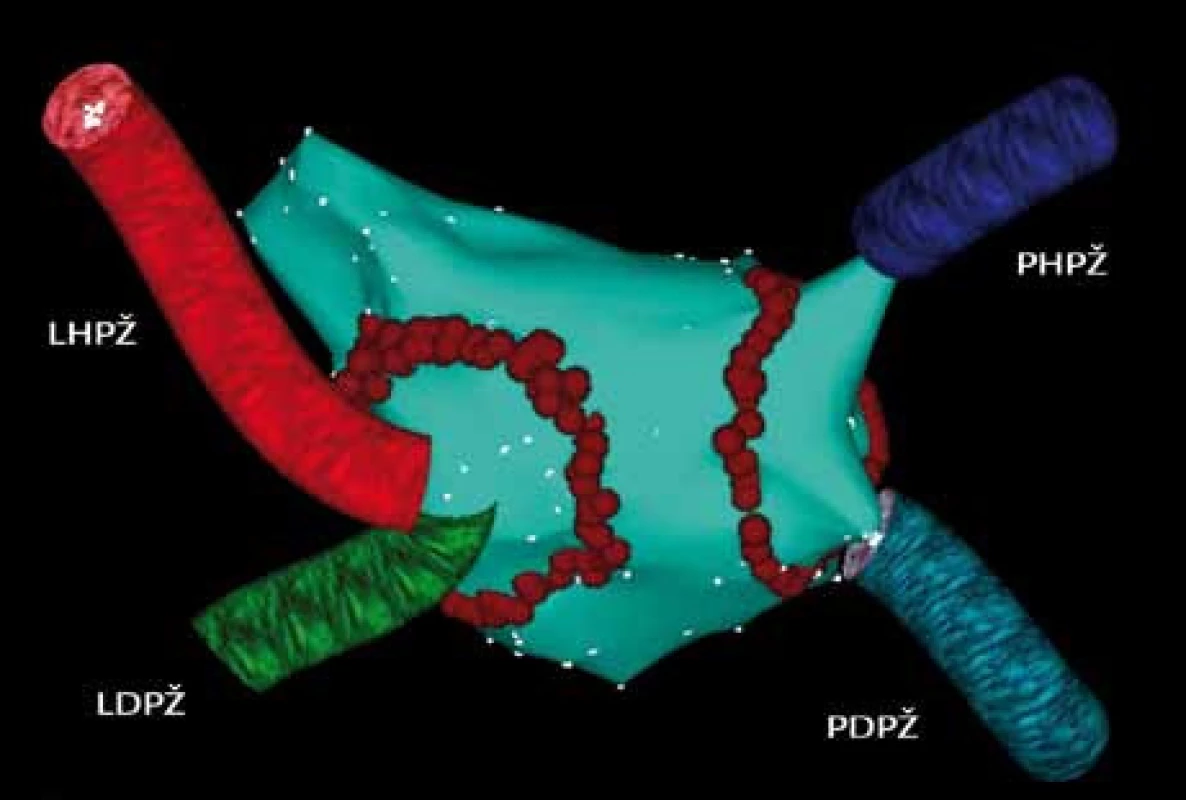
Současně byla na pracovišti v Miláně rozvinuta metoda, která je založena na použití trojrozměrného elektroanatomického mapování levé síně a vytvoření širších obkružujících-cirkumferenčních ablačních lézí kolem pravostranných a levostranných plicních žil (obr. 2). Během ablace dochází k modifikaci arytmogenního substrátu, redukci svaloviny schopné arytmii udržovat a vagové denervaci. V současné době se obě metody kombinují [50,51].
Selektivní katétrová ablace dlouhodobě perzistující FS
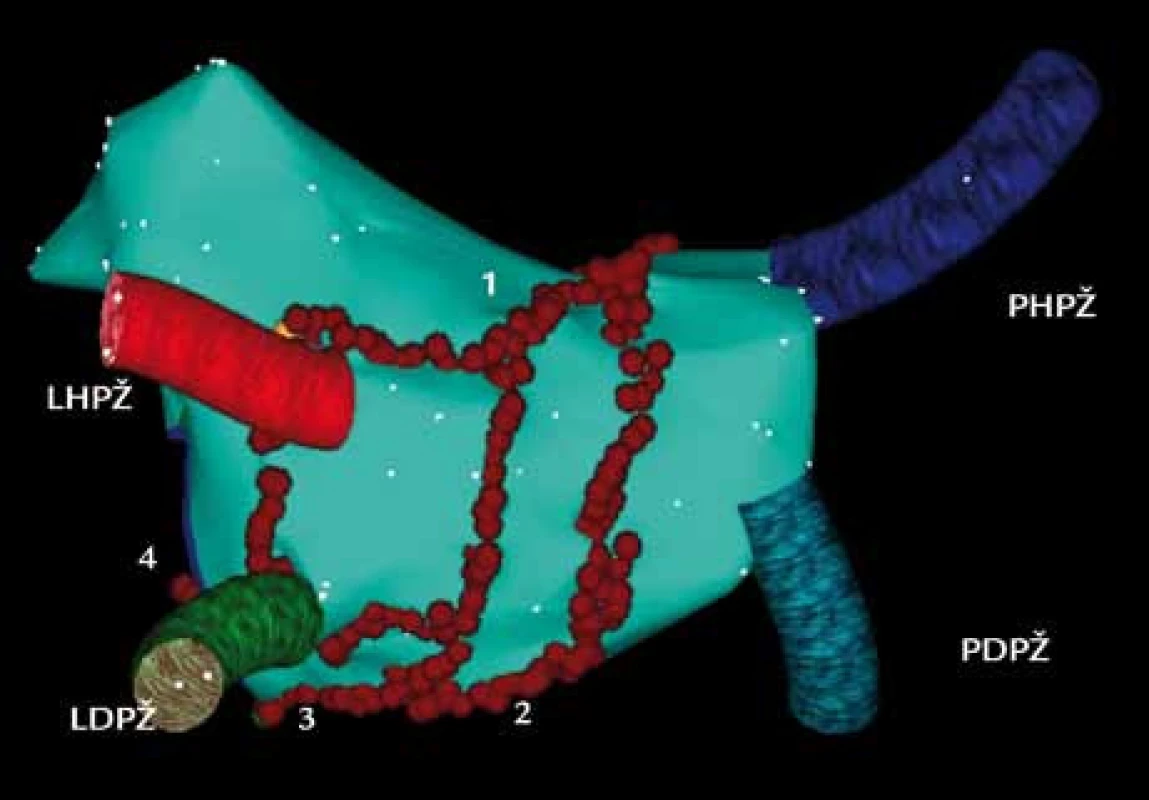
U chronických forem FS je arytmogenní substrát složitější, protože je již přítomná remodelace síní. Vedle ektopické a reentry aktivity vycházející z plicních žil se na mechanizmu perzistujících forem FS podílejí i lokalizované tzv. mateřské reentry okruhy neboli rotory a také větší makroreentry okruhy využívající převážně myokard levé síně, ale i koronárního sinu. Proto nestačí pouhá elektrická izolace plicních žil, která je dostačující u paroxyzmální formy FS, ale je nutná komplexní ablace v levé síni. Zatím nebyla vytvořena jednotná ablační strategie, která by byla všeobecně akceptována. Většinou se provádí širší cirkumferenční – obkružující léze kolem plicních žil s kontrolou elektrické izolace a doplněné o lineární léze, nejčastěji se provádí linie ve stropu levé síně a v oblasti mitrálního istmu (obr. 3). Některá pracoviště provádí ablaci frakcionovaných potenciálů v levé síni a ablaci gangliových plexů. Podle potřeby může následovat rozšíření ablace na koronární sinus a ablaci v pravé srdeční síni a v horní duté žíle.
S počtem ablačních linií dochází k postupné organizaci fibrilace síní do levosíňové tachykardie, u které se dohledávají kritická místa pro udržování tachykardie a dalších aplikací RF energie do těchto míst se tachykardie ukončuje. Někdy již provedením linií se ukončuje FS s nástupem SR.
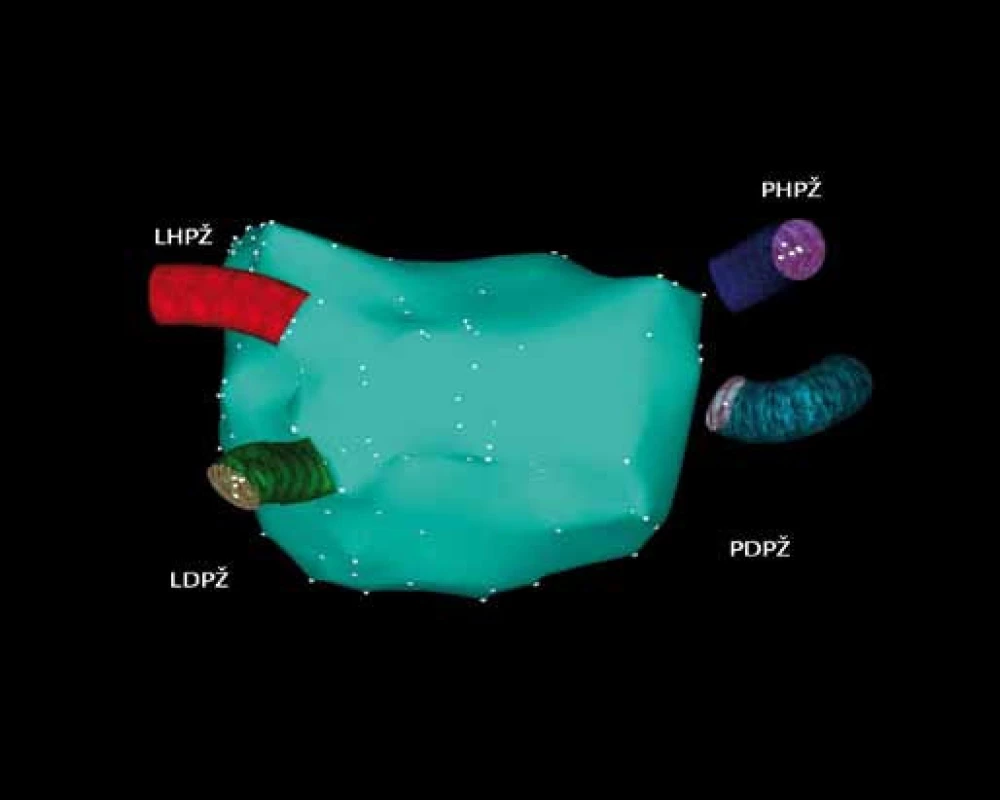
V současné době se stále hledá účinnější a bezpečnější ablační metoda, která by zjednodušila a zkrátila výkon a umožnila řešit větší počet pacientů s FS. V poslední době je možnost integrace obrazu levé síně a plicních žil z výpočetní tomografie nebo magnetické rezonance s trojrozměrnou elektroanatomickou mapou získanou systémem CARTO nebo NavX (obr. 4–6). Tato integrace přesněji ozřejmí anatomické poměry, a tím se stává ablace přesnější a bezpečnější. K bezpečnosti pomáhá i zavedení intrakardiálního ultrazvuku během výkonu. Používají se i robotické dálkově navigační systémy, s magnetickou navigací (Stereotaxis) a elektromechanickou navigací (Hansem Medical). U těchto výkonů je lepší stabilita ablačního katétru a je významně snížená radiační zátěž jak pro pacienta, tak pro vyšetřujícího. Očekávají se výsledky klinických studií, které používají tyto systémy při léčbě FS. Testují se i alternativní zdroje ablační energie jako laser, vysokoenergetický ultrazvuk či kryoablace, většinou ve formě balónkových katétrů, ve formě balónků se testuje i radiofrekvenční energie. Nevýhodou těchto nových technologií je nedostatek dlouhodobého sledování pacientů, a tím chybění ověřování úspěšnosti a komplikací výkonů.
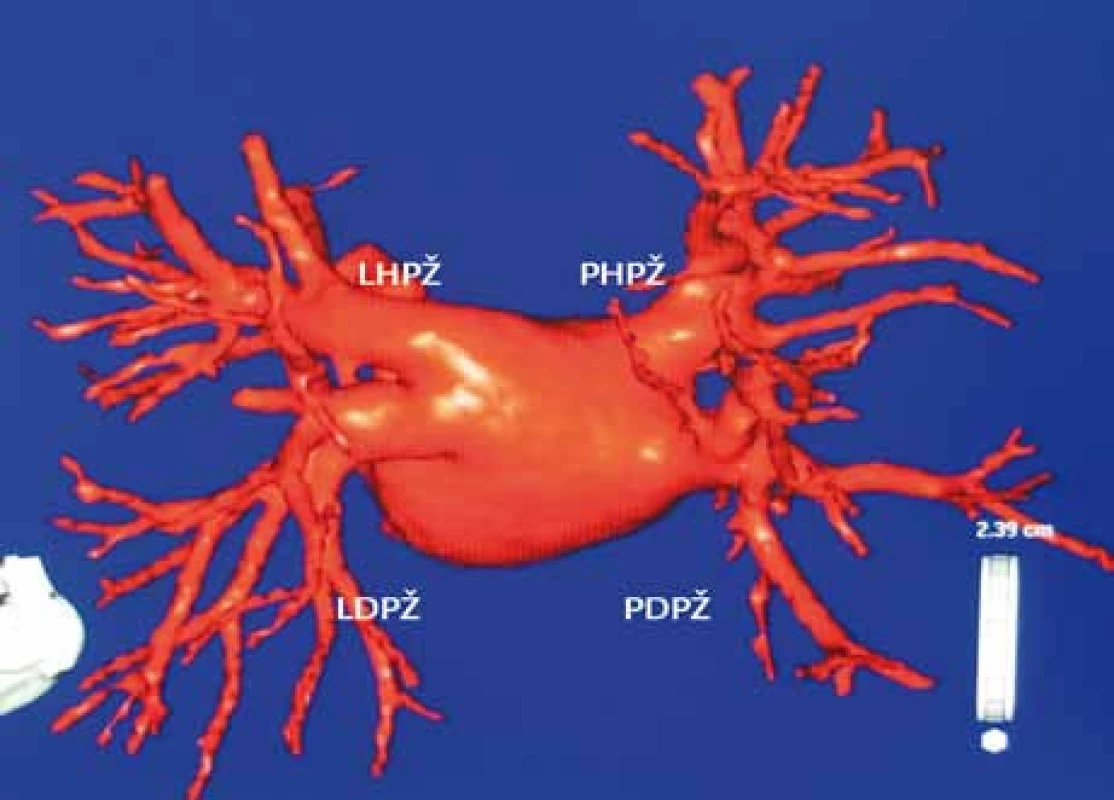
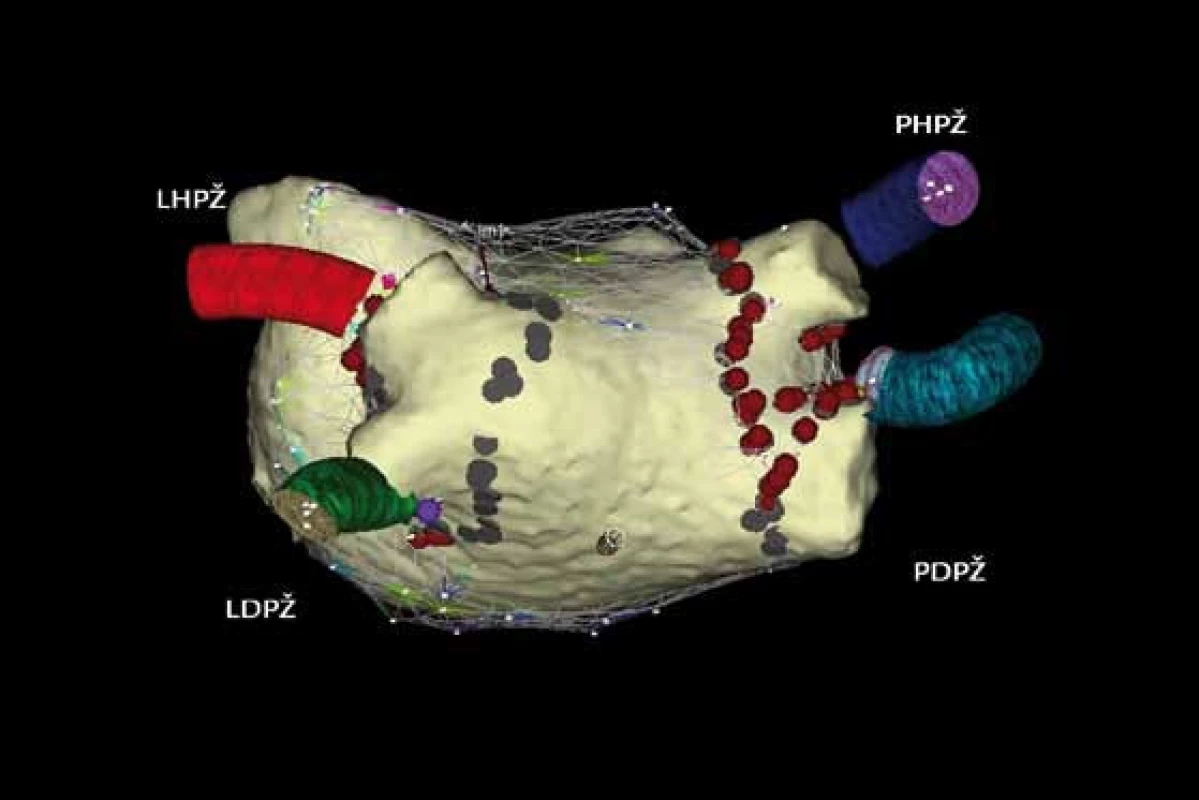
Naše výsledky
Od září roku 2004 do září roku 2009 jsme provedli na Interní kardiologické klinice FN Brno 157 katétrových ablací symptomatických paroxyzmálních forem FS. Při neúčinnosti nejméně jednoho antiarytmika většinou v kombinaci s beta‑blokátorem nebo při nemožnosti podání antiarytmické terapie z důvodu jejich nežádoucích účinků, jsme indikovali katétrovou ablaci. Od září roku 2004 jsme používali konvenční metodu – segmentální katétrovou ablaci, kdy jsme cíleně přerušovali elektrické vedení jednotlivých myokardiálních snopců, které spojovaly svalovinu levé síně a plicní žíly, bez širších obkružujících lézí. Od října roku 2006 jsme zavedli druhou ablační strategii za pomocí elektroanatomického mapování systémem CARTO, kdy jsme prováděli společné širší obkružující léze pravostranných a levostranných plicních žil a pomocí cirkulárního vyšetřovacího Lasso katétru umístěného v ústí plicní žíly jsme kontrolovali elektrickou izolaci jednotlivých plicních žil. Od roku 2009 máme možnost integrace obrazu levé síně a plicních žil získaného z výpočetní tomografie s elektroanatomickou mapou, vytvořenou pomocí trojrozměrného mapování systémem CARTO. Cílovým momentem ablací paroxyzmální FS byla elektrická izolace všech 4 plicních žil.
V souboru 157 pacientů bylo 53 žen (34 %) a 104 mužů (66 %), o průměrném věku 50,6 ± 9,5 let (31–76), folow up byl 42,7 měsíců (6–66). Pacienti byli většinou bez významného organického postižení srdce (EF levé komory 59 ± 5 %) a s přítomnou mírně dilatovanou levou síní (příčný rozměr levé síně 42 ± 6 mm). Nejčastějších rizikovým faktorem byla hypertenze, která se vyskytovala téměř u 3/4 pacientů. Medián počtu aplikací RF energie byl 38 min, délky radiačního času 41,9 min, délky výkonu 210 min. Úspěšnost ablace v našem souboru se shoduje s dostupnou literaturou. V roce 2004 jsme měli úspěšnost 87,5 %, v roce 2005 77,4 %, v roce 2006 79,2 %, v roce 2007 80,1%, v roce 2008 83,2 %, v roce 2009 82,9 %. Po úspěšné katétrové ablaci se statisticky významně snížil počet pacientů, kteří medikovali kombinovanou antiarytmickou terapii, a také samostatně antiarytmikum I. třídy – propafenon – a antiarytmika III. třídy – amiodaron a sotalol. Po katétrové ablaci se statisticky významně zvyšuje počet pacientů bez antiarytmické terapie ze 4 % před ablací na 26 % po zákroku (p < 0,0001). Statisticky významně se snižuje počet pacientů na dvojkombinaci antiarytmické terapie – ze 41 % před na 15 % po ablaci (p < 0,0001). Po ablaci se nemění užívání beta‑blokátorů, ale statisticky významně méně medikují amiodaron (o 24 %, p < 0,001), propafenon (o 14 %, p < 0,05), digitalis (o 16 %, p < 0,05) i sotalol (o 23 %, p < 0,001). Po ablaci se také statisticky významně snižuje počet pacientů na chronické antikoagulační terapii. Před zákrokem byli všichni pacienti účinně antikoagulováni, po zákroku zůstalo 38 % na antikoagulační terapii (p < 0,0001), 42 % medikovali kyselinu acetylsalicylovou a 20 % pacientů bylo bez antikoagulační či antiagregační terapie.
Závěr
Léčba fibrilace síní je značně individuální a měla by být komplexní – včetně léčby hypertenze, srdečního selhání, zánětu a prevence tromboembolie. Zatím nejúčinnější léčbou FS je katétrová ablace. Dříve byla indikována katétrová ablace až po selhání dvou a více antiarytmik. Od roku 2006 podle doporučení Americké a Evropské kardiologické společnosti jsou doporučení ke katétrové ablaci symptomatiční pacienti s FS, u kterých selhalo alespoň jedno antiarytmikum. Katétrová ablace v časných fázích choroby, kdy se jedná o paroxyzmální formu FS, má vyšší úspěšnost než u formy perzistující, což nás vede k časnější indikaci invazivního zákroku. Úspěšná ablace FS zabrání vzniku a progresi elektrické, strukturální a mechanické remodelace myokardu, zlepšuje funkci levé komory a riziko tromboembolie se dostává do rizika zdravé populace. Nástupem SR se spouští i reverzní remodelace, která vede k přestavbě stěny a zmenšení síní. RF katétrová ablace FS, s postupným nabýváním zkušeností katetrizujících, se stává u symptomatických pacientů dostupnou a účinnou terapií.
Doručeno do redakce: 4. 6. 2010
doc. MUDr. Růžena Lábrová, Ph.D.
www.fnbrno.cz
e‑mail: labrova@seznam.cz
Sources
1. Go AS, Hylek EM, Phillips KA et al. Prevalence of diagnosed atrial fibrillation in adults: national implications for rhythm management and stroke prevention: the AnTicoagulation and Risk Factors in Atrial Fibrillation (ATRIA) Study. JAMA 2001; 285 : 2370–2375.
2. Feinberg WM, Blackshear JL, Laupacis A et al. Prevalence, age distribution, and gender of patients with atrial fibrillation. Analysis and implications. Arch Intern Med 1995; 155 : 469–473.
3. Tsang TS, Petty GW, Barnes ME et al. The prevalence of atrial fibrillation in incident stroke cases and matched population controls in Rochester, Minnesota: changes over three decades. J Am Coll Cardiol 2003; 42 : 93–100.
4. Miyasaka Y, Barnes ME, Gersh BN et al. Secular trend incidence of atrial fibrillation in Olmsted County, Minnesota, 1980 to 2000, and implications on the projection for future prevalence. Circulation 2006; 114 : 119–125.
5. Furberg CD, Psaty BM, Manolio TA et al. Prevalence of atrial fibrillation in elderly subject (the Cardiovascular Health Study). Am J Cardiol 1994; 74 : 236–241.
6. Maisel WH, Stevenson LW. Atrial fibrillation in heart failure: epidemiology, pathophysiology, and rationale for therapy. Am J Cardiol 2003; 91 : 2D–8D.
7. Cha YM, Redfield MM, Shen WK et al. Atrial fibrillation and ventricular dysfunction: a vicious electromechanical cycle. Circulation 2004; 109 : 2839–2843.
8. Lábrová R, Špinar J. Srdeční selhání a fibrilace síní. Cor Vasa 2008; 50 : 385–392.
9. Fuster V, Rydén LE, Cannom DS et al. ACC/AHA/ESC 2006 guidelines for the management of patients with atrial fibrillation‑executive summary: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines and the European Society of Cardiology Committee for Practice Guidelines. Eur Heart J 2006; 27 : 1979–2030.
10. Gentlesk PJ, Sauer WH, Gerstenfeld EP et al. Reversal of left ventricular dysfunction following ablation of atrial fibrillation. J Cardiovasc Electophysiol 2007; 18 : 9–14.
11. McGovern PG, Jacobs DR Jr, Shahar E et al. Trends in acute coronary heart disease mortality, morbidity, and medical care from 1985 through 1997: the Minnesota Heart Survey. Circulation 2001; 104 : 19–24.
12. Go AS, Hylek EM, Phillips KA et al. Prevalence of diagnosed atrial fibrillation in adults: national implications for rhythm management and stroke prevention: the AnTicoagulation and Risk Factors in Atrial Fibrillation (ATRIA) Study. JAMA 2001; 285 : 2370–2375.
13. Brugada R. Molecular biology of atrial fibrillation. Minerva Cardioangiol 2004; 52 : 65–72.
14. Feng J, Yue L, Wang Z et al. Ionic mechanism of regional action potential heterogeneity in the canine right atrium. Circ Res 1998; 83 : 541–551.
15. Bosch RF, Scherer CR, Rub NL et al. Molecular mechanisms of early electrical remodeling: transcriptional downregulation of ion channel subunits deduces I (Ca, L) an I (to) in rapid atrial pacing in rabbits. J Am Coll Cardiol 2003; 41 : 858–869.
16. Madrid AH, Escobar C, Rebollo JM et al. Angiotensin receptor blocker as adjunctive therapy for rhythm control in atrial fibrillation: results of the irbesartan‑amiodarone trial. Card Electrophysiol Rev 2003; 7 : 243–246.
17. Douglas P. The left atrium: a biomarker of chronic diastolic dysfunction and cardiovascular disease risk. J Am Coll Cardiol 2003; 42 : 1206–1207.
18. Morillo CA, Klein GJ, Jones DL et al. Chronic rapid atrial pacing. Structural, functional, and electrophysiological characteristics of a new model of sustained atrial fibrillation. Circulation 1995; 91 : 1588–1595.
19. Goette A, Arndt M, Röcken C et al. Regulation of angiotension II receptors subtypes during atrial fibrillation in humans. Circulation 2000; 101 : 2678–2681.
20. Goette A, Staack T, Röcken C et al. Increased expression of extracellular signal‑regulated kinase and angiotensin‑converting enzyme in human atria during atrial fibrillation. J Am Coll Cardiol 2000; 35 : 1669–1677.
21. Haïssaguerre M, Jaïs P, Shah DC et al. Spontaneous initiation of atrial fibrillation by ectopic beats originating in the pulmonary veins. N Engl J Med 1998; 339 : 659–666.
22. Chen YH, Xu SJ, Bendahhou S et al. KCNQ1 gain‑of‑function mutation in familial atrial fibrillation. Science 2003; 299 : 251–254.
23. Tsai CT, Lai LP, Lin JL et al. Renin‑angiotensin system gene polymorphisms and atrial fibrillation. Circulation 2004; 109 : 1640–1646.
24. Korantzopoulos P, Kolettis TM, Galaris D et al. The role of oxidative stress in the pathogenesis and perpetuation of atrial fibrillation. Int J Cardiol 2007; 115 : 135–143.
25. Tsang TS, Gersh BJ, Appleton CP. Left ventricular diastolic dysfunction as a predictor of the first diagnosed nonvalvular atrial fibrillation in 840 elderly men and women. J Am Coll Cardiol 2002; 40 : 1636–1644.
26. Lábrová R. Epidemiologie fibrilace síní. Kardiofórum 2007; 5 : 6–10.
27. Gami AS, Pressman G, Caples SM et al. Association of atrial fibrillation and obstructive sleep apnea. Circulation 2004; 110 : 364–367.
28. Shamsuzzaman AS, Winnicki M, Lanfranchi P et al. Elevated C‑reactive protein in patients with obstructive sleep apnea. Circulation 2002; 105 : 2462–2464.
29. Das UN. Is angiotensin‑II an endogenous pro‑inflammatory molecule? Med Sci Monit 2005; 11: RA155–RA162.
30. Brown NJ, Vaughan DE. Prothrombotic effects of angiotensin. Adv Intern med 2000; 45 : 419–429.
31. Lábrová R, Špinar J. Inhibitory ACE, sartany a fibrilace síní. Intern Med 2009; 11 : 327–331.
32. Špinar J, Lábrová R. ACTIVE I a upstream terapie. Interv Akut Kardiol 2009; 8 : 325–327.
33. AFFIRM First Antiarrhythmic Drug Substudy Investigators. Maintenance of sinus rhythm in patients with atrial fibrillation: an AFFIRM substudy of the first antiarrhythmic drug. J Am Coll Cardiol 2003; 42 : 20–29.
34. Chun SH, Sager PT, Stevenson WG et al. Long‑term efficacy of amiodarone for the maintenance of normal sinus rhythm in patients with refractory atrial fibrillation or flutter. Am J Cardiol 1995; 76 : 47–50.
35. Hohnloser SH, Crijns HJ, van Eickels M et al. Effects of dronedarone on cardiovascular events in atrial fibrillation. N Engl J Med 2009; 360 : 668–678.
36. Calò L, Bianconi L, Colivicchi F et al. N-3 fatty acids for the prevention of atrial fibrillation after coronary artery bypass surgery: a randomized, controlled trial. J Am Coll Cardiol 2005; 45 : 1723–1728.
37. Dernellis J, Panaretou M. Relationship between C‑reactive protein concentrations during glucocorticoid therapy and recurrent atrial fibrillation. Eur Heart J 2004; 25 : 1100–1107.
38. Young‑Xu Y, Jabbour S, Goldberg R et al. Usefulness of statin drugs in protecting against atrial fibrillation in patients with coronary artery disease. Am J Cardiol 2003; 92 : 1379–1383.
39. Hohnloser SH, Kuck KH, Lilienthal J et al. Rhythm or rate control in atrial fibrillation‑pharmacological intervention in atrial fibrillation (PIAF): a randomized trial. Lancet 2000; 356 : 1789–1794.
40. van Gelder IC, Hagens VE, Bosker HA et al. Rate Control versus Electrical Cardioversion for Persistent Atrial Fifrillation (RACE) Study Group. A comparison of rate control and rhythm control in patients with recurrent persistent atrial fibrillation. N Engl J Med 2002; 347 : 1834–1840.
41. Carlsson J, Miketic S, Windeler J et al. Randomized trial of rate‑control versus rhythm‑control in persistent atrial fibrillation: STAF (Strategies of Treatment of Atrial Fibrillation) study. J Am Coll Cardiol 2003; 41 : 1690–1696.
42. Wyse DG, Waldo AL, DiMarco JP et al. Atrial Fibrillation Follow‑up Investigation of Rhythm Management (AFFIRM) Investigators. A comparison of rate control and rhythm control in patients with atrial fibrillation. N Engl J Med 2002; 347 : 1825–1833.
43. Corley SD, Epstein AE, DiMarco JP et al. AFFIRM Investigators. Relationships between sinus rhythm, treatment, and survival in the Atrial Fibrillation Follow‑up Investigation of Rhythm Management (AFFIRM) study. Circulation 2004; 109 : 1509–1513.
44. Pappone C, Rosanio S, Augello G et al. Mortality, morbidity, and quality of life after circumferential pulmonary vein ablation for atrial fibrillation: outcomes from a controlled nonrandomized long‑term study. J Am Coll Cardiol 2003; 42 : 185–197.
45. Wazni OM, Marrouche NF, Martin DO et al. Radiofrequency ablation vs antiarrhythmic drugs as first‑line treatment of symptomatic atrial fibrillation: a randomized trial. JAMA 2005; 293 : 2634–2640.
46. Stabile G, Bertaglia E, Senatore G et al. Catheter ablation treatment in patients with drug‑refractory atrial fibrillation: a prospective, multi‑centre, randomized, controlled study (Catheter Ablation For The Cure of Atrial Fibrillation Study). Eur Heart J 2006; 27 : 216–221.
47. Pappone C, Augello G, Sala S et al. A randomized trial of circumferential pulmonary vein ablation versus antiarrhythmic drug therapy in paroxysmal atrial fibrillation: the APAF Study. J Am Coll Cardiol 2006; 48 : 2340–2347.
48. Jais P, Cauchemez B, Macle L. Atrial fibrillation ablation vs antiarrhythmic drugs: a multicenter randomized trial. Heart Rhythm 2006; 3. Abstract 1126.
49. Oral H, Pappone C, Chugh A et al. Circumferential pulmonary‑vein ablation for chronic atrial fibrillation. N Engl J Med 2006; 354 : 934–941.
50. Lábrová R, Špinar J. Katetrizační ablace fibrilace síní. Kardiol. Rev 2008, 10 : 103–110.
51. Lábrová R, Fiala M, Toman O et al. Radiofrekvenční katetrová ablace paroxyzmální fibrilace síní konvenční metodou, bezprostřední a dlouhodobé výsledky. Vnitř Lék 2008; 54 : 953–960.
Labels
Diabetology Endocrinology Internal medicineArticle was published in
Internal Medicine

2010 Issue 8
-
All articles in this issue
- Komplexní léčba kardiovaskulárního rizika. Zaměřeno na telmisartan
- Charakteristiky a osud pacientov s akútnym srdcovým zlyhávaním v aktuálnej klinickej praxi
- Anémie při chronickém srdečním selhání
- Terapie implantabilními kardiovertery-defibrilátory (ICD) na prahu 3. tisíciletí
- Význam fenofibrátu v liečbe aterogénnej dyslipoproteinémie
- Fibrilace síní v době katétrové ablace
- Rychlost aortální pulzové vlny u nemocných s metabolickým syndromem a hypertenzí léčených sartany
- Transplantace srdce – minulost, současnost a výhled do budoucna
- Zmeny hladín NT‑proBNP u pacientov s fibriláciou predsiení v závislosti od srdcového zlyhávania
- Primární lymfomy centrálního nervového systému
- Péče o nemocné na umělé plicní ventilaci z pohledu lékaře internisty
- Úspěšná léčba angiomatózy thalidomidem a interferonem α. Popis pěti případů a přehled léčby angiomatózy a proliferujících hemangiomů
- Imunoglobulin G4 pozitivní cholangitida
- Rizikový profil hypertonika
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue
- Péče o nemocné na umělé plicní ventilaci z pohledu lékaře internisty
- Terapie implantabilními kardiovertery-defibrilátory (ICD) na prahu 3. tisíciletí
- Anémie při chronickém srdečním selhání
- Zmeny hladín NT‑proBNP u pacientov s fibriláciou predsiení v závislosti od srdcového zlyhávania
