Neuroendokrinné nádory horného tráviaceho traktu, charakteristika a porovnanie efektivity lokalizačnej diagnostiky
Neuroendocrine tumours of the upper gastrointestinal tract, characteristics and comparison of localization diagnostics
In daily clinical practice it’s important to think of neuroendocrine tumors, since their prevalence for the past 5 years exceeded even the common occurrences of stomach, esophageal and pancreatic cancers. Patients diagnosed early and accurately with NET, have a greater chance for complete cure. The diagnostic tools over the past century were significantly inefficient in diagnosing NET i.e. (40% of tumors were not localized after USG, CT, MRI, AG investigations). Until the past 2 decades that major turnover in diagnostic methods has been achieved. In particular, the introduction of the somatostatine receptor scintigrafy (SRS) and endoscopic ultrasonography (EUS) have increased sensitivity of localization diagnostics up to 90%. Our work is to test the success of the localization diagnostics in 22 patients with surgically and histologically confirmed NET of the pancreas and duodenum. These patients fulfilled jointly SRS, CT and/or MRI, but also classic USG and EUS. From our comparison, clearly endoscopic USG is the most efficient tool with 90% sensitivity.
Key words:
neuroendocrine tumors – characteristic – localization diagnostics – EUS – somatostatin receptor scintigraphy – CT scan – MRI – USG
Authors:
R. Hyrdel 1; I. Režnák 2; P. Hyrdel 1; H. Poláček jr. 2; H. Poláček 3; M. Hladká 3; S. M. Agouba 1; J. Janík 4; Ľ. Laca 4
Authors‘ workplace:
Interná klinika gastroenterologická, Centrum pre rezistentné peptické vredy a neuroendokrinné nádory Jesseniovej lekárskej fakulty UK a UNM Martin, Slovenská republika, prednosta prof. MUDr. Rudolf Hyrdel, CSc.
1; Klinika nukleárnej medicíny Jesseniovej lekárskej fakulty UK a UNM Martin, Slovenská republika, prednosta doc. MUDr. Ivan Režňák, CSc., mim. prof.
2; Rádiologická klinika Jesseniovej lekárskej fakulty UK a UNM Martin, Slovenská republika, prednosta MUDr. Hubert Poláček, CSc.
3; Klinika transplantačnej a cievnej chirurgie Jesseniovej lekárskej fakulty UK a UNM Martin, Slovenská republika, prednosta prof. MUDr. Ľudovít Laca, PhD.
4
Published in:
Vnitř Lék 2011; 57(12): 1017-1024
Category:
70th birthday of prof. MUDr. Petr Dítě, DrSc.
Overview
Na neuroendokrinné nádory treba myslieť pri každodennej klinickej praxi, nakoľko ich výskyt v ostatných 5 rokoch prekročil aj spoločný výskyt pacientov s karcinómom pažeráka, žalúdka a pankreasu. Včas a správne diagnostikovaní pacienti s neuroendokrinnými nádormi majú reálnu šancu na úplné vyliečenie. Diagnostika bola ešte v nedávnom minulom storočí značne neefektívna (vyše 40 % nádorov aj po vyšetrení USG, CT, MR a AG ostávalo nelokalizovaných, t. j. okultných). Až posledné 2 desaťročia priniesli zásadný obrat v ich diagnostike. Najmä zavedenie somatostatínovej receptorovej scintigrafie (SRS) a endoskopickej ultrasonografie (EUS) zvýšili senzitivitu lokalizačnej diagnostiky až k 90 %. V našej práci porovnávame úspešnosť lokalizačnej diagnostiky u 22 pacientov s operačne a histologicky potvrdenou diagnózou NETu pankreasu a duodena. Týmto pacientom bola urobená SRS, a spoločne s ňou aj CT a/alebo NMR, ale aj klasické USG a EUS. Z nášho porovnania vyšla jednoznačne ako najefektívnejšia endoskopická ultrasonografia s 90% senzitivitou.
Kľúčové slová:
neuroendokrinné tumory – charakteristika – lokalizačná diagnostika – EUS – somatostatínová receptorová scintigrafia – CT – MR – USG
Úvod
Neuroendokrinné nádory (NET), pôvodne veľmi zriedkavé, nadobúdajú v súčasnosti čoraz väčší klinický význam. Incidencia týchto nádorov sa za ostatných 30 rokov zvýšila viac ako 5-násobne [1–3]. Podieľa sa na tom hlavne zlepšená diagnostika a veľmi pravdepodobne aj skutočný nárast počtu týchto ochorení. Práve zlepšenými diagnostickými možnosťami a ich vzájomným porovnaním dosiahnutých výsledkov v súbore našich pacientov sa zaoberá naša práca.
Charakteristika
Väčšina NETov patrí do skupiny dobre alebo stredne diferencovaných nádorov. Hoci majú benígnejšie správanie ako klasické karcinómy, sú v súčasnosti všetky považované za potenciálne malígne. Prejavujú sa veľmi rôznorodou klinickou symptomatológiou. Táto závisí od prítomnosti a intenzity sekrécie hormónov a biogénnych amínov, ale aj od ich veľkosti [4–6]. Rozpoznávame NETy z luminálneho gastrointestinálneho traktu (GIT) a NETy pankreatické (pNETy). Väčšina NETov luminálnej časti sa zhoduje s v minulosti popisovanými karcinoidnými nádormi [5,6]. Dnes ich nazývame NETy s karcinoidovým rysom. Pôvodné, ale ešte stále zaužívané, je delenie NET podľa miesta vzniku z pôvodného predného, stredného a zadného čreva (foregut, midgut a hingut) [1]. NETy môžu produkovať a vylučovať rôzne GI hormóny a amíny [4–6]. Najčastejšie serotonín, inzulín, gastrín, vazoaktívny intestinálny peptid, somatostatín, glukagón, ale aj veľa iných [7]. Avšak nie všetky NETy secernujú aktívne zložky, alebo sa tieto nemusia klinicky manifestovať. Takéto nádory označujeme ako nefunkčné [8].
Epidemiológia
NETy sa môžu nachádzať takmer vo všetkých orgánoch a tkanivách, ale najčastejšie sa nachádzajú v gastrointestinálnom trakte (GITe). Podľa údajov SEER (Surveillance, Epidemiology, and End Result), najväčšej štatistickej databázy, sú prítomné v GITe až v 67,5 %, v bronchopulmonárnom trakte (25,3 %). Z GITu býva najčastejšie postihnuté tenké črevo (41,8 %), rectum (27,4 %) a žalúdok (8,7 %) [9,10]. Táto databáza monitoruje NETy od roku 1974. Podľa nej je ročná incidencia malígnych pNETov 0,32 na 100 000 obyvateľov [1]. Najčastejšie zastúpenými pankreatickými NETmi sú tzv. nefunkčné, za nimi nasledujú gastrinómy a inzulinómy. Ostatné typy ako VIPóm, glukagonóm, somatostatinóm a ďalšie sú len veľmi zriedkavé [11].
Incidencia a prevalencia
Podľa SEER databázy sa incidencia NETov za posledných 30 rokov dramaticky zvýšila, a to až 5-násobne. V roku 2000 sa vyrovnala incidencia NETov incidencii malígnych neoplázií žalúdka a predpokladá sa, že bude naďalej stúpať. V roku 2004 v USA presiahol počet pacientov s NET číslo 103 312, čo v prevalencii presahuje súčet malignít žalúdka (65 836), pankreasu (32 253) a ezofagu [1,10]. Rovnako aj európske registre potvrdzujú obdobne významný nárast prevalencie NETov [12].
Patobiológia
V etiopatogenéze neuroendokrinných tumorov je veľmi heterogénny obraz genetických alterácií. NETy pankreasu môžu byť sporadické alebo asociované s geneticky podmieneným ochorením. Štruktúra genetických porúch pNET sa značne odlišuje od karcinoidov, najmä midgut pôvodu. Tieto sú len veľmi zriedkavo asociované s dedičnými ochoreniami, na rozdiel od pNET, ktoré bývajú asociované so syndrómom mnohopočetnej endokrinnej neoplázie tzv. MEN I syndrómom, ale aj ďalšími [13]. MEN I syndróm je autozomálne dominantný syndróm charakterizovaný adenómami prištítnych teliesok, adenómami hypofýzy a pankreatickými NETmi. Ďalším je VHL syndróm (Von Hippel-Lindau) – autozomálne dominantné ochorenie charakterizované vysokou predispozíciou pre hemangioblastómy postihujúce mozoček a retinu, Grawitzov karcinóm obličiek, feochromocytóm, ako aj rôzne typy pNETov [14]. Pre midgut karcinoidy je kľúčová strata chromozómu 18q, zatiaľ čo u pNET je najčastejšie poškodený tumor supresor MEN I na 11q13 kódujúci peptid menín [15]. Identifikovateľnú MEN I mutáciu vykazuje 8 % pacientov s inzulinómom a nefunkčným NETom, 37 % s gastrinómom, 44 % s VIPómom a 67 % s glukagonómom [13–15].
V prípade, že diagnostikujeme MEN I syndróm, mali by byť na MEN I mutáciu vyšetrení všetci prvostupňoví príbuzní a všetci s pozitívnou mutáciou, by mali byť vyšetrení na prítomnosť nádorov prištítnych teliesok, pankreasu a hypofýzy.
Prognostické faktory
Prognostické faktory NETov závisia od lokalizácie primárneho tumoru, jeho veľkosti, diferenciácie a veku pacienta a hlavne štádia (stage), v ktorom sa tumor nachádza. Dôležité môže byť stanovenie prognostických biomarkerov najmä chromogranínu A (CgA) a neurón špecifickej enolázy (NSE). Ak počas terapie došlo k normalizácii hladín CgA a NSE, zlepšila sa úroveň prežívania [16]. V recentnej pilotnej štúdii bola preukázaná úloha chromogranínu B ako indikátora horšej prognózy [17].
Klasifikácia
NET klasifikujeme podľa embryologického pôvodu na tumory tzv. predného čreva: Foregut (pľúca, žalúdok, proximálne duodenum), stredného čreva: Midgut (distálne duodenum, jejunum, ileum, pravá časť hrubého čreva) a zadného čreva: Hindgut, zahrňujúceho colon transverzum, sigmu a rectum.
Podľa histologického obrazu na dobre diferencované (G1), stredne diferencované (G2), slabo diferencované (G3) a nediferencované (G4) tumory.
Podľa prítomnosti metastáz, lokálnych aj vzdialených, uvádzame delenie v tab. 1.
![WHO TMN klasifikácia tumorov pankreasu [18].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/c902e2837963ff00a03e97c1c53b6d9e.jpeg)
Uvedené atribúty sú v rámci „stagingu“ rôzne posudzované podľa klasifikačných schém viacerých spoločností (Európska spoločnosť pre NET – ENETS, WHO, American Joint Committee on Cancer – AJCC), rôzne. Rôzne je hodnotený aj „grading“ nádorov rôznych orgánov (tab. 2). V súčasnosti ešte neexistujú celosvetovo unifikované klasifikačné kritériá.
![WHO grading system pre pankreatické NETy [19].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/fa6f7bfcf3db5e63829d285ed1e6df5e.jpeg)
Symptomatológia
Príznaky asociované s NETmi bývajú často prisudzované rôznym iným, častejším ochoreniam, ktorých skúmanie odďaľuje určenie správnej diagnózy. V priemere až o 5–7 rokov [3]. Pacienti bývajú liečení len symptomaticky, často nesprávne. Medzi najčastejšie príznaky patria flush, hnačky, potenie, neuroglykopénia, bolesti brucha, krvácanie z GITu, ochorenie srdca, bronchospazmus. Pacienti s NETmi bývajú často považovaní za alkoholikov, psychicky labilných ľudí s anxietou, simulantov a epileptikov [20]. Môžu byť liečení ako syndróm dráždivého čreva (IBS), peptické vredy, astma bronchiale, pre alergie na jedlá [21]. Ženám sa najčastejšie prisúdi diagnóza menopauzy a čaká sa na jej spontánne ukončenie.
Prognóza
Podľa SEER je prognóza 5-ročného prežívania u dobre a stredne diferencovaných NETov (G1, G2), lokalizovaných, s regionálnymi metastázami a distálnymi metastázami 82 %, 68 % a 35 % [1]. Priemerná dĺžka života zodpovedá 223, 111, alebo 33 mesiacom [1]. Pre zle diferencované NET je 5-ročné prežívanie podľa uvedenej schémy len 38 %, 21 % a 4 % [1]. Čas prežívania je 34, 14 a 5 mesiacov [1]. Najčastejšou príčinou úmrtnosti v minulosti boli karcinoidové krízy s hnačkou a hemodynamickou instabilitou [1]. Pacienti s gastrinómom zomierali na komplikácie peptických vredov, ale aj na rozvrat vnútorného prostredia. T. č. býva príčinou smrti samotná progresia tumoru jeho metastatická generalizácia a karcinoidové ochorenie srdca. To sa podieľa na mortalite pacientov s NETom asi v 30 %.
Diagnostika
Správna diagnostika je pre spomínanú klinickú rôznorodosť značne náročná. Priemerná doba diagnózy ochorenia od nástupu prvých symptómov sa odhaduje na 5–7 rokov [1]. Podľa SEER má v čase diagnózy až 50 % NETov vzdialené a/alebo regionálne metastázy [1]. Tieto čísla sú ale veľmi variabilné. Podľa miesta lokalizácie primárneho tumoru v čase diagnózy má metastázy 9 % NET rektálneho pôvodu a až 71 % NETov tenkého čreva. Rovnako priemerný vek pacienta s novo diagnostikovaným NETom rekta je 56 rokov, zatiaľ čo u tenkého čreva je to až 66 rokov [1].
NETy tenkého čreva a apendixu bývajú diagnostikované často náhodne. Najčastejšie bývajú z histopatologického nálezu diagnostikované NET apendixu – po rutinných apendektómiách. NET hrubého čreva a rekta, ako aj žalúdka bývajú diagnostikované pri screeningových endoskopických vyšetreniach. Cielene sa pátra po funkčných NEToch horného tráviaceho traktu, ktorým sa budeme venovať aj v našom príspevku. Funkčné NETy diagnostikujeme na základe príznakov podmienených nadprodukciou biologicky aktívnej substancie a jej chemickým dôkazom. Nefunkčné NETy diagnostikujeme na základe ťažkostí súvisiacich s veľkosťou nádoru, jeho tlakom alebo infiltráciou okolitých orgánov a tkanív, ako aj prítomnosťou metastáz. Diagnostikujú ich predovšetkým chirurgovia.
Biochemické markery
V laboratórnej diagnostike kvantitatívne stanovujeme markery NETov. Z týchto markerov je najdôležitejší nešpecifický marker chromogra-nín A (CgA). Ďalšími nešpecifickými markermi sú 5-HIOK, serotonín, neurón špecifická enoláza (NSE) a pankreatický polypeptid (PP) [21].
5-HIOK v moči je metabolický produkt serotonínu. Stanovenie 5-HIOK využíva väčšina svetových pracovísk ako screeningové vyšetrenie. Je pomerne náročné na vyhodnotenie, nakoľko hraničné hodnoty môžu vzniknúť po konzumácii viacerých jedál a liekov, ktoré jeho hladinu ovplyvňujú. Preto musí byť dodržaná prísna diéta vylučujúca tieto interferujúce zložky potravy. Moč musí byť okyslený HCl, nie kyselinou octovou, nakoľko táto pri vyšetrení interferuje s 5-HIOK.
Pre pNETy je nešpecifický marker PP a zo špecifických markerov sú to najmä gastrín, inzulín, proinzulín, glukagón, somatostatín a VIP [21].
Nefunkčné NETy, napriek tomu, že sú klinicky „nemé“, môžu tiež produkovať rôzne peptidy a amíny, ktoré sa klinicky neprejavujú. S ich produkciou súvisí súčasná produkcia CgA, ktorú využívame v diagnostike. Okrem CgA môže byť v sére pozitívny aj PP [21].
Diagnostickým problémom môže byť falošná pozitivita CgA pri viacerých ochoreniach, ako je chronická atrofická gastritída, terapia PPI, chronické zápalové ochorenia pečene a obličiek, hepatálne a renálne zlyhávanie, ale aj arteriálna hypertenzia.
Inzulinómy
Inzulinóm je endokrinne aktívny tumor vychádzajúci z B-buniek Langerhansových ostrovčekov v pankrease. Typické inzulinómy sú malé, solitárne, uložené v pankrease.
Malígnych je menej ako 10 %. V súčasnosti sa uznáva 6 laboratórnych diagnostických kritérií realizovaných nalačno:
- sérová hladina glukózy pod < 2,2 mmol/l,
- sérová hladina inzulínu nad 6 µU/l nalačno,
- sérová hladina C peptidu nad 200 pmol/l,
- sérová hladina proinzulínu nad 5 pmol/l,
- sérová hladina hydroxybutyrátu v sére < 2,7 mmol/l,
- absencia metabolitov sulfonylurey v moči/sére [22].
Predbežnú diagnózu inzulinómu je možné určiť na základe tzv. Whippleyovej triády, ktorá spočíva v príznakoch laboratórne verifikovanej hypoglykémie < 2,8 mmol/l a okamžitom ústupe ťažkostí po podaní glukózy. Zlatým štandardom v diagnostike inzulinómu zostáva 24–72-hodinový hladový test, kedy sa pri symptómoch hypoglykémie a/alebo pri poklese glykémie pod 2,2 mmol/l stanovuje v sére IRI, C peptid a proinzulín. Vyšetrenia IRI pomocou RIA metodiky majú vyššiu výpovednú hodnotu, ale sú finančne náročnejšie ako vyšetrenia pomocou ELISA testov.
Gastrinómy
Gastrinómy sa vyskytujú najčastejšie ako sporadické (75–80 %), ale aj ako súčasť MEN I syndrómu. Zvyčajne sú lokalizované v pankrease a v duodene. Symptomatológia závisí prevažne od masívnej hyperacidity spôsobenej hypergastrinémiou. Prejavuje sa peptickými vredmi, hnačkami a ezofageálnou refluxovou chorobou. Gastrinóm spôsobuje klinický stav nazývaný Zollingerov-Ellisonov syndróm. Pri klinickom podozrení na gastrinóm pri peptických vredoch asociovaných s hnačkami je potrebné vyšetriť hodnotu bazálnej sekrécie HCl (BAO) a stanoviť hodnoty bazálneho sérového gastrínu (BSG). Pacienti s gastrinómom mávajú hodnoty BSG aj 10-násobne vyššie oproti norme (menej ako 100 pg/ml). Malá časť pacientov môže mať hladinu gastrínu aj v medziach referenčných hodnôt, alebo len mierne zvýšenú. Taktiež po resekčných výkonoch na žalúdku môžu byť hodnoty len mierne zvýšené, alebo normálne hodnoty BSG [23]. U týchto pacientov sa odporúča urobiť provokačný sekretínový alebo kalciový test. Pacienti s gastrinómom bez resekcie žalúdka mávajú hodnoty BAO vyššie ako 15 mmol H+/hod, pacienti po resekcii žalúdka majú BAO nad 5 mmol H+/hod. Je veľmi málo pravdepodobné, aby pacienti s normálnou, alebo dokonca so zníženou produkciou HCl, mali prítomný gastrinóm (pokiaľ neužívajú vysoké dávky PPI!). Provokačný test robíme len u pacientov s hypersekréciou HCl a hraničnými hodnotami BSG (t. j. medzi 150 a 200 pg/ml). Sekundárne zvýšená koncentrácia bazálneho sérového gastrínu býva prítomná pri absentujúcej alebo nízkej produkcii HCl, atrofickej gastritíde pri pernicióznej anémii, alebo pri dlhodobom užívaní PPI. Infekcia Helicobacterom pylori býva spojená s miernou eleváciou BSG. Po eradikácii HP infekcie dochádza k úprave BSG na referenčné hodnoty.
VIPóm
Symptómy Verner-Morrisonového syndrómu, známeho aj ako WDHA (z anglickej skratky watery diarrhea, hypokaliemia, achlorhydria), sú výsledkom zvýšenej nadprodukcie VIPu pri pankreatických endokrinných neopláziach [24]. Symptomatológiu spôsobuje VIP-om stimulovaná intestinálna sekrécia prejavujúca sa vodnatou hnačkou. Ďalšími prejavmi sú flush tváre, hypochlórhydria, glykogenolýza a hyperkalciémia [24]. Výskyt masívnych hnačiek môže byť konštantný, intermitentný, alebo epizodický. Denné straty tekutín môžu prekročiť aj 8–10 litrov denne. Je nevyhnutná i.v. substitúcia tekutín s tesnou kontrolou mineralogramu a acidobázy. Pre závažnosť hnačiek, spôsobených stimuláciou cAMP receptorov, podobne ako pri cholere, sa ochorenie nazýva aj pankreatická cholera. Často sú prítomné kŕčovité bolesti brucha. Záchvaty flushu sa vyskytujú len zriedka. Ostatné symptómy sa dávajú do súvisu s hypokaliémiou, následkom hnačiek. Sú to slabosť svalov, letargia a nauzea. Diagnosticky užitočné je vyšetrenie sekrécie žalúdkovej kyseliny, ktorá býva nulová a dôkaz extrémne nízkych hladín draslíka. Diagnostickým dôkazom je potvrdenie vysokej koncentrácie sérového VIPu.
Glukagonóm
Klinické príznaky glukagonómu sú najčastejšie migrujúca dermatitída, stomatitída a glositída, významná strata hmotnosti, anémia a diabetes mellitus [25]. Dermatitída býva prezentovaná ako nekrotický migrujúci erytém. Je charakteristická cyklickou plazivou migráciou s následným hojením sa od stredu lézie. Hyperglukagonémia spôsobuje poruchu glukózovej tolerancie až ťažký sekundárny diabetes. Následkom intenzívneho katabolického vplyvu glukagónu pacienti kachektizujú. Klinicky sa môžu prejavovať už malé nádory aj bez metastáz. Pacienti sú náchylní na vznik hlbokých žilových trombóz s následnými tromboembolickými príhodami v riečisku pulmonálnej artérie. Preto je namieste profylaktická liečba nízkomolekulovými heparínmi. Až polovica pacientov s glukagonómom trpí na normochrómnu, normocytárnu anémiu, čo sa prejavuje zvýšenou únavnosťou.
Somatostatinóm
Klinický prejav somatostatínu súvisí so všeobecnou inhibičnou aktivitou somatostatínu v metabolizme. Pacienti so somatostatinómom majú podobné príznaky ako pacienti s diabetom. Je to spôsobené účinkom somatostatínu na sekréciu inzulínu a glukagónu. Inhibícia cholecystokinínu somatostatínom potenciuje biliárnu stázu, čo môže vyústiť do tvorby kameňov a následnej obštrukcie žlčovodov a súvisiacich ochorení. Relatívne často sa objavujú hnačky se steatorheou alebo bez nej. Sú spôsobené inhibíciou pankreatických enzýmov a sekrécie bikarbonátov.
Podobné, ale miernejšie príznaky pozorujeme aj pri dlhodobej liečbe somatostatínovými analógmi (SSA). Preventívna CHE sa považuje za vhodné profylaktické riešenie pred plánovanou liečbou SSA z dôvodu prítomnosti iných NETov.
Zobrazovacie diagnostické metódy
Klasické zobrazovacie metódy (USG, CT a MR) v 80. a 90. rokoch minulého storočia dosahovali v lokalizácii NETov len veľmi slabú efektivitu. Vyše 40 % tumorov ostávalo okultných. Nakoľko ich senzitivita dosahovala len 20–40 %, bolo potrebné vytvoriť nové diagnostické možnosti. Prvou z nich bola farmakologická AG po i.v., alebo intraartériovom podaní sekretínu. Neskôr sa k nej pridali aj selektívne odbery krvi z hepatálnych vén na stanovenie hladín peptidov, tzv. selektívny intraartériový sekretínový test. O niečo neskoršie to bola scintigrafia somatostatínovových receptorov SRS (Octreoscan) a následne aj endoskopická ultrasonografia (EUS). Selektívny intraartériový test sme v UN Martin zaviedli v roku 1990 ako 3. pracovisko po Tokiu (1987) a Bethesde (1989) [26]. Octreoscan robíme systematicky v spolupráci s Klinikou nukleárnej medicíny od roku 1996 a EUS horného GITU využívame od roku 2001.
Endoskopia, EUS a manažment NETov žalúdka
Primárnou úlohou endoskopie a endosonografie v manažmente karcinoidov žalúdka je detegovať uloženie lézie v mukóze a submukóze a posúdiť možnosť endoskopickej resekcie [27]. Po endoskopickej intervencii karcinoidov žalúdka sa významne znižuje výskyt nežiaducich komplikácií, ako sú krvácania, ale aj metastázovanie do pečene a lymfatických uzlín. Nepodarilo sa však preukázať dlhodobý benefit po endoskopickej resekcii karcinoidov I. a II. typu na prežívanie. Pravdepodobne preto, že ani neresekované gastrické karcinoidy I. a II. typu významnejšie neskracujú priemerné prežívanie pacientov. Karcinoidy III. typu, alebo sporadické karcinoidy žalúdka bez hypergastrinémie bývajú zvyčajne väčšie, chovajú sa invazívnejšie a majú podstatne horšiu prognózu. Tá je podobná pacientom s klasickým adenokarcinómom. Pacientov s karcinoidom žalúdka III. typu indikujeme bez zbytočného strácania času na radikálnu chirurgickú resekciu.
EUS a manažment NETov dvanástnika
NETy tenkého čreva vyrastajú najčastejšie zo sliznice alebo submukózy. Sú väčšinou malé, a preto len obtiažne zobraziteľné endoskopickými a inými zobrazovacími metódami. Užitočné môžu byť endoskopy s bočnou optikou. Avšak zásadné zlepšenie diagnostických možností prinieslo až zavedenie endosonografie do klinickej praxe. Radiálne EUS umožňuje endosonografistovi precíznu lokalizáciu lézie duodenálnych aj ampulárnych NETov. Za pomoci lineárnej sondy môže endoskopista zrealizovať punkciu primárnej lézie, ale aj lymfatickej uzliny, prípadne aj punkciu metastáz v dostupných častiach pečene. EUS vyšetrenie je kľúčové v hodnotení stagingu lézie, čo je nevyhnutné k eventuálnej endoskopickej resekcii duodenálnych, resp. ampulárnych NETov. Pre duodenálne NETy je typická ich výrazná vaskularizácia a uloženie v submukóze, čo zvyšuje krvácavé komplikácie a možnosť perforácie steny duodena [28,29]. Na našom pracovisku duodenálne NETy endoskopicky neresekujeme. Všetky NETy nad 10 mm indikujeme na chirurgickú resekciu (dobre prístupné aj laparoskopicky).
EUS a manažment NETov pankreasu
EUS dominuje v diagnostike NETov pankreasu a peripankreatickej oblasti. Dosahuje sa s ňou až 80 % senzitivita [30]. Prítomnosť ohraničenej, oválnej, homogénnej, väčšinou hypoechogénnej masy je takmer isté diagnostické potvrdenie NETu pankreasu [31]. U pacientov s inzulinómom dominovalo jednoznačne EUS až s 93 % senzitivitou, pričom SRS bola len slabo senzitívna s veľmi nízkym záchytom na úrovni 21 % [4]. Na základe EUS obrazu sa nedajú jednotlivé typy NETov rozlíšiť. Falošne pozitívne nálezy registrujeme pri peripankreatickej lymfadenopatii a stavoch po prekonanej pankreatitíde. Falošne negatívne nálezy môžu byť pri stopkatých extrapankreatických inzulinómoch a duodenálnych NEToch minimálnych rozmerov [31].
Lineárna EUS pankreasu
Použitie lineárnej EUS s odobratím tkanivovej vzorky ev. aspiračnej cytológie pomocou FNA (tenko ihlová aspirácia) zvyšuje diagnostickú cenu vyšetrenia. Senzitivita EUS + FNA v diagnostike pNETov je približne 80 %. Prínos EUS bioptizácie sa ešte zvýšil po uvedení nových metód aspirácie a použitím Trucutovej ihly, ktorá umožňuje odobrať jadro pankreatického tkaniva. Biopsia pomocou Trucutovej ihly (TNB) môže byť vhodným doplnkovým vyšetrením k FNA u pacientov s NETom. Pri NEToch pankreasu je výťažnosť FNA 77 %, TNB 56 % a pri ich kombinácii je to až 83 % [32].
EUS na rozdiel od klasických zobrazovacích metód odhaľuje veľké množstvo malých, klinicky nevýznamných NETov u pacientov s MEN I syndrómom [33]. Všeobecne len 5–10 % pankreatických lézií pri MEN I syndróme detegovaných pomocou EUS bolo možné zachytiť aj štandardnými zobrazovacími metódami a SRS. Niektorí autori odporúčajú každoročnú EUS kontrolu pacientov s MEN I syndrómom [33].
V novších prácach bola popísaná senzitivita a pozitívna prediktívna hodnota EUS na úrovni 77–94 % pre pankreatické tumory (inzulinómy a gastrinómy) a 58–78 % pre metastatické lymfatické uzliny. EUS umožňuje aj citlivé monitorovanie rastu lézií. Predpokladá sa, že v blízkej budúcnosti budú pacienti s neoperovateľnými nádormi a problematickou kontrolou sekrécie gastrínu a inzulínu liečení injektážou etylalkoholu pomocou lineárnej EUS.
Význam CT v diagnostike NETov
Funkčné pankreatické NETy bývajú napriek pozitívnej klinike zvyčajne veľmi malé. V CT obraze nebýva prítomná zmena tvaru, ani veľkosti pankreasu. V obraze natívneho CT sa neodlišujú od zdravého tkaniva pankreasu – sú izodenzné. Väčšinu tumorov pankreasu môžeme zvýrazniť intravenóznym podaním kontrastnej látky. Najlepšia zobraziteľnosť týchto menších hypervaskulárnych lézií je do istej miery variabilná. Najlepší kontrast medzi tumorom a parenchýmom pankreasu býva najlepší v arteriálnej fáze [34,35]. Zriedkavejšie sú v portálnej venóznej fáze lepšie zobraziteľné islet-cell tumory. Pre zvýšenie výťažnosti vyšetrenia je odporúčané bifázické kontrastné vyšetrenie [34].
Význam nukleárnej magnetickej rezonancie v diagnostike NETov
V detekcii pNETov sa podľa uvádzaných štúdií dosiahla vysoká senzitivita i špecificita aj v rozsiahlych súboroch pacientov. V 5 štúdiách spolu na 192 pacientoch sa dosiahla záchytnosť sľubných 73 % (rozpätie 50–94 %) [35,36]. Pri zameraní sa na detekciu pečeňových metastáz dosiahlo vyšetrenie NMR ešte vyššiu záchytnosť 95 % a 82 % (rozsah 80–85 %). Je to priemer zo 4 štúdií a spolu bolo vyšetrených 138 pacientov [36]. Naše skúsenosti hovoria tiež jednoznačne v prospech zachytenia pečeňových metastáz. Podstatne horšie je to s detekciou drobných intrapankreatických nádorov, kde je senzitivita MR vyšetrenia podstatne nižšia [37,38].
Použitie značených somatostatínových analógov v diagnostike NET
Zastúpenie somatostatínových receptorov sa v bunkách NE tumorov líši. Podľa viacerých štúdií dosahuje 70–100% prítomnosť [39]. Väčšina NETov exprimuje viacero podtypov receptorov a ich zastúpenie býva podstatne vyššie v porovnaní s normálnym tkanivom. Táto skutočnosť vytvára základ pre lokalizačnú diagnostiku za pomoci rádioaktívnymi látkami označených somatostatínových analógov. Somatostatínová receptorová scintigrafia (SRS) je v súčasnosti už štandardný postup v diagnostike NETov GITu, paragangliómov, nádorov CNS (hlavne meningiómy), malo aj nemalobunkových nádorov pľúc, ako aj tumorov spôsobujúcich ektopický ACTH syndróm [40,41].
Pozitrónová emisná tomografia (PET) v diagnostike NET
Vyšetrenie PET použitím značenej flórodeoxyglukózy je dnes už bežne dostupné aj u nás. Funguje na princípe zobrazenia zvýšeného metabolizmu označeného derivátu glukózy v nádorových bunkách. Vyšetrenie PET má význam v širokom spektre diagnostiky rôznych malignít. Avšak u pacientov s NET nie je primárne indikované, pre podstatne slabšiu senzitivitu. Táto vyplýva z nižšej metabolickej aktivity a pomalšieho rastu NETov oproti klasickým karcinómom. Neplatí to však pre pacientov s NETmi s vysokou proliferačnou aktivitou a vysokým stupňom dediferenciácie [42]. Do praxe sa uvádzajú vyšetrenia PET s novými označenými aminoprekurzormi, ktoré majú vysokú senzitivitu porovnateľnú, alebo dokonca vyššiu, ako SRS.
Náš súbor
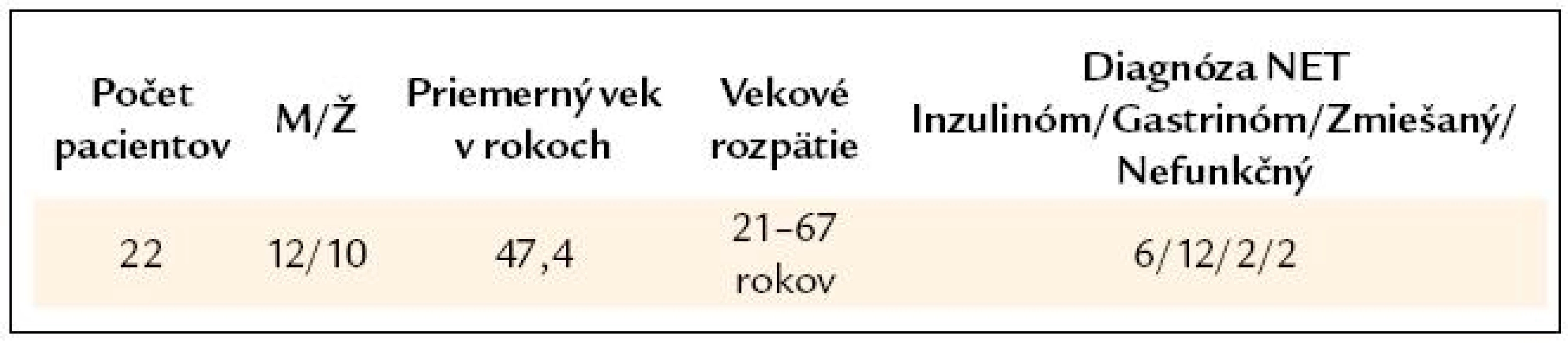
Pacienti a metodika
Interná klinika gastroenterologická JLF UK a UN v Martine je od roku 1990 ustanovená MZ SR ako Celoštátne centrum pre rezistentné peptické vredy a neuroendokrinné nádory. Od toho obdobia sme do súčasnosti diagnostikovali a liečili vyše 220 pacientov s rôznymi druhmi NETov (131 pacientov s gastrinómom, 28 pacientov s inzulinómom, 60 pacientov s karcinoidovým nádorom, 2 pacientov s VIPómom, 3 pacientov so zmiešaným neuroendo//exokrinným nádorom a 4 pacientov s nefunkčnými NETmi duodena).
Do súboru vyhodnotených pacientov sme zaradili len pacientov diagnostikovaných po roku 2001, t. j. v ostatných 10 rokoch, kedy sme už rutinne používali EUS vyšetrenie. Základný súbor tvorilo 62 pacientov, ktorým bolo urobené scintigrafické vyšetrenie somatostatínových receptorov (Octreoscan) pre podozrenie na NET pankreasu alebo duodena. Z týchto pacientov sme vybrali za sebou idúcich 22 pacientov, ktorí mali urobené všetky základné zobrazovacie metódy to znamená USG, CT a/alebo MR a aj EUS. Podmienkou zaradenia bolo absolvovanie operácie s histologicky potvrdenou diagnózou NETu. Na potvrdenie lokalizačnej diagnózy vyžadujeme zhodu lokalizácie tumoru minimálne 2–3 metódami. Tam, kde boli výsledky minimálne 2 vyšetrení jednoznačné, sme už ďalšie diagnostické metódy obyčajne nepoužili (z ekonomických dôvodov, nakoľko sa nejednalo o klinickú štúdiu). V tab. 3 uvádzame charakteristiku vyhodnoteného súboru.
Výsledky
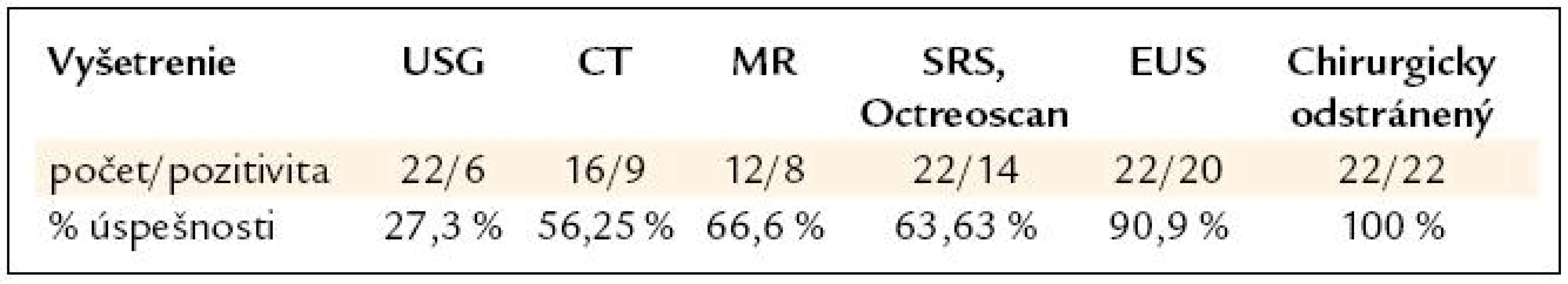
Senzitivitu jednotlivých vyšetrení v správnej lokalizácii NETu ukazuje tab. 4.
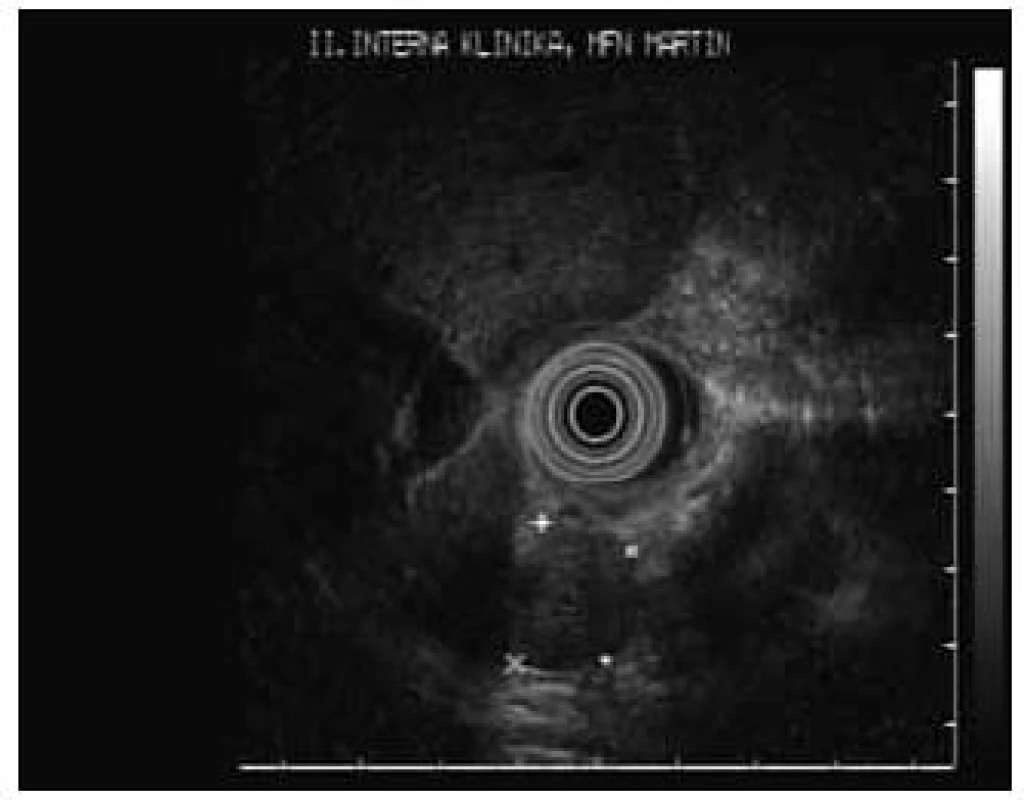
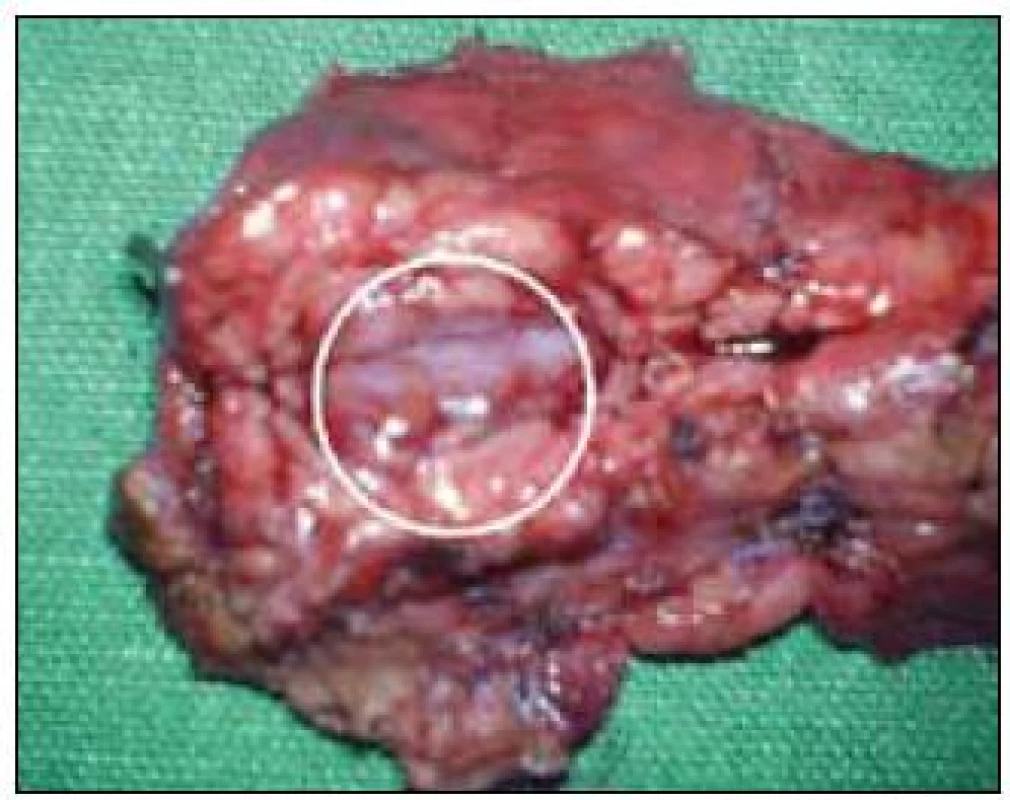
Ako zaujímavosť poukazujeme na prípad 17-ročného chlapca (nebol zaradený do sledovaného súboru, nakoľko u nás sa robilo len EUS vyšetrenie) s klinickými prejavmi ťažkých hypoglykemických príhod s bezvedomím a tonickoklonickými kŕčmi, ktorý posledné 2 týždne pred lokalizáciou a následnou resekciou inzulinómu v chvoste pankreasu musel byť na permanentnej infúznej liečbe roztokmi glukózy. Tomuto pacientovi boli urobené opakované vyšetrenia pomocou USG, CT, MR, Octreoscanu aj PET – všetky s negatívnym ložiskovým nálezom. Až na našej klinike sa podarilo pomocou EUS lokalizovať a následne aj odstrániť 12 mm NET vo chvoste pankreasu (obr. 1 a 2).
Diskusia
Ako vidieť z tabuľkového porovnania úspešnosti lokalizačných metód, najúspešnejšou lokalizačnou metódou v diagnostike intrapankreaticky a paraduodenálne uložených NETov bola jednoznačne endoskopická ultrasonografia. Jej úspešnosť bola až vyše 90 %. V jednom prípade u pacientky s klinicky a biochemicky potvrdeným gastrinómom sme pomocou EUS lokalizovali hypoechogénny ohraničený útvar paraduodenálne naliehajúci na hlavu pankreasu, avšak chirurg pri laparoskopickej operácii v uvedenej oblasti žiadny tumor nenašiel. Nález sme hodnotili ako falošne pozitívny, avšak je možné, že tumor unikol chirurgom, nakoľko endokrinná aktivita pretrvávala aj po operácii a pacientka sa na liečbe dlho účinkujúcim somatostatínovým analógom kompenzovala a je v dobrom klinickom stave. Ďalšiu sadu lokalizačných vyšetrení plánujeme o 6 a 12 mesiacov.
Na druhom mieste v úspešnosti lokalizácie bola NMR so 66% úspešnosťou, ktorá predstihla úspešnosť scintigrafie somatostatínových receptorov – SRS – Octreoscan so 63 %. Tu však musíme skonštatovať, že je diametrálny rozdiel v pozitivite SRS medzi detekciou gastrinómu a inzulinómu, nakoľko zo 14 pozitívnych octreoscanov bolo pozitívne lokalizovaných 10 z 12 gastrinómov a len 4 pozitívne z ostatných 12 NETov. Zo 6 inzulinómov boli len 2 octreoscan pozitívne, t. j. len 33 %. Na základe týchto skúseností už pacientov s podozrením na inzulinóm neindikujeme na vyšetrenie octreoscanom. Podstatne nižšiu senzitivitu mali klasické vyšetrovacie metódy, a to v nasledujúcom poradí CT a USG s hodnotami úspešnosti 56 % a 27 %. Je treba skonštatovať, že zavedením moderných viac vrstvových CT prístrojov sa ich diagnostické schopnosti oproti starým CT prístrojom z 80. rokov minulého storočia výrazne zlepšili. Z pôvodných 30–40 % zachytených NETov na dnešných 50–60 %. Taktiež moderné USG prístroje za pomoci nových kontrast zvyšujúcich materiálov sú schopné zachytiť nie 20–25 %, ale 30–40 % NETov.
Úspešnosť vyšetrenia pomocou PET a intraarteriálneho selektívneho sekretínového testu sme nevyhodnocovali, pretože ich používame len v ojedinelých prípadoch, keď sme neúspešní v ostatných diagnostických modalitách. Pozitívny výsledok PET sme dosiahli len u pacientov s generalizovaným gastrinómom. Distribúcia patologických ložísk (metastázy) zodpovedala ložiskám, ktoré sme potvrdili aj pomocou Octreoscanu, prípadne CT vyšetrením.
Záver
NETy sa postupne stávajú bežnou súčasťou klinickej praxe. Preto je potrebné zvýšiť pozornosť pri ich včasnom záchyte. Pretože včas diagnostikovaný a lokalizovaný nádor má vyššiu šancu na radikálne chirurgické vyliečenie. V našej práci chceme upozorniť na veľký prínos EUS vyšetrenia v úspešnej lokalizácii neuroendokrinných nádorov. Je to metóda vysoko efektívna, neporovnateľne lacnejšia a menej zaťažujúca ako vyšetrenie pomocou CT, NMR, Octreoscanu alebo PET. Je len veľkou škodou pre slovenské zdravotníctvo, že výkon nie je adekvátne bodovo ocenený a tým sa stáva aj nedostupný pre súkromnú prax. V našom článku sme poukázali aj na prípad, kde EUS bola jedinou diagnostickou modalitou schopnou lokalizovať nádor ohrozujúci život mladého človeka. Včasná diagnostika prináša nielen zvýšenú šancu na úplné vyliečenie pacienta, ale šetrí aj prostriedky neskôr vynakladané na finančne náročnú a pritom často aj neperspektívnu onkologickú liečbu.
prof. MUDr. Rudolf Hyrdel, CSc.
www.mfn.sk
e-mail: hyrdel@jfmed.uniba.sk
Doručeno do redakce: 17. 10. 2011
Sources
1. Yao JC, Hassan M, Phan A et al. One hundred years after “carcinoid”: epidemiology of and prognostic factors for neuroendocrine tumors in 35,825 cases in the United States. J Clin Oncol 2008; 26 : 3063–3072.
2. Kaltsas GA, Besser GM et al. The diagnosis and medical management of advanced neuroendocrine tumors. Endocr Rev 2004; 25 : 458–511.
3. Modlin IM, Moss SF, Chung DC et al. Priorities for improving the management of gastroenteropancreatic neuroendocrine tumors. J Natl Cancer Inst 2008; 100 : 1282–1289.
4. Kaplan LM. Endocrine tumors of the gastrointestinal tract and pancreas. In: Isselbacher KJ et al (eds). Harrison’s Principles of Internal Medicine. 13th ed. New York, NY: McGraw-Hill 1994 : 1535–1542.
5. Rorstad O. Prognostic indicators for carcinoid neuroendocrine tumors of the gastrointestinal tract. J Surg Oncol 2005; 89 : 151–160.
6. Creutzfeldt W. Carcinoid tumors: development of our knowledge. World J Surg 1996; 20 : 126–131.
7. National Comprehensive Cancer Network. NCNN Clinical Practice Guidelines in Oncology: Neuroendocrine Tumors V.2.2010
8. Oberg K. Pancreatic endocrine tumors. Semin Oncol 2010; 37 : 594–618.
9. Modlin IM, Lye KD, Kidd MA. 5-decade analysis of 13,715 carcinoid tumors. Cancer 2003; 97 : 934–959.
10. National Cancer Institute. SEER Cancer Statistics Review 1975–2004. http://seer.cancer.gov/csr/1975_2004/#contents.
11. Metz DC, Jensen RT. Gastrointestinal neuroendocrine tumors: pancreatic endocrine tumors. Gastroenterology 2008; 135 : 1469–1492.
12. Hauso O, Gustafsson BI, Modlin IM et al. Neuroendocrine tumor epidemiology: contrasting Norway and North America. Cancer 2008; 113 : 2655–2664.
13. Zhuang Z, Vortmeyer AO, Pack S et al. Somatic mutations of the MEN1 tumor suppressor gene in sporadic gastrinomas and insulinomas. Cancer Res 1997; 57 : 4682–4686.
14. Moore PS, Missiaglia E, Antonello D et al. Role of disease-causing genes in sporadic pancreatic endocrine tumors: MEN1 and VHL. Genes Chromosomes Cancer 2001; 32 : 177–181.
15. Wang EH, Ebrahimi SA, Wu AY et al. Mutation of the MENIN gene in sporadic pancreatic endocrine tumors. Cancer Res 1998; 58 : 4417–4420.
16. Yao JC, Lombard-Bohas C, Baudin E et al. Daily oral everolimus activity in patients with metastatic pancreatic neuroendocrine tumors after failure of cytotoxic chemotherapy: a phase II trial. J Clin Oncol 2010; 28 : 69–76.
17. Bech P, Ramachadran R et al. Chromogranin B is a Prognostic Marker in NETs. 8th Annual ENETS Conference for the Diagnosis and Treatment of Neuroendocrine Tumor Disease. Lisbon, Portugal 2011.
18. Bosman FT, Carneiro F, Hruban RH et al. WHO classiffication of Tumours of the Digestive System. 4th ed. Lyon, France: International Agency for Research on Cancer (IARC) 2010 : 280.
19. Rindi G, Arnold R, Bosman FT et al. Nomenclature and classification of neuroendocrine neoplasms of the digestive system. In: Bosman FT, Carneiro F, Hruban RH et al (eds). WHO Classification of Tumors of the Digestive System. Lyon: IARC 2010.
20. Toth-Fejel S, Pommier RF. Relationships among delay of diagnosis, extent of disease, and survival in patients with abdominal carcinoid tumors. Am J Surg 2004; 187 : 575–579.
21. Modlin IM, Oberg K, Chung DC et al. Gastroenteropancreatic neuroendocrine tumours. Lancet Oncol 2008; 9 : 61–72.
22. Grant CS. Insulinoma. Best Pract Res Clin Gastroenterol 2005; 19 : 783–798.
23. Hyrdel R. Klinický význam sérového gastrínu. Banská Bystrica: Centro Median 2001.
24. Marks IN, Bank S, Louw JH. Islet cell tumor of the pancreas with reversible watery diarrhea and achylorhydria. Gastroenterology 1967; 52 : 695–708.
25. Wermers RA, Fatourechi V, Kvols LK. Clinical spectrum of hyperglucagonemia associated with malignant neuroendocrine tumors. Mayo Clin Proc 1996; 71 : 1030–1038.
26. Hyrdel R, Kašuba J, Pokorný O et al. The significance of selective intratherial secretin test for localisation of gastrinoma. Hepato-Gastroenterology 1991; 38 (Suppl): 14.
27. Varas Lorenzo MJ, Miquel Collell JM, Maluenda Colomer MD et al. Preoperative detection of gastrointestinal neuroendocrine tumors using endoscopic ultrasonography. Rev Esp Enferm Dig 2006; 98 : 828–836.
28. Ahmad NA, Kochman ML, Long WB et al. Efficacy, safety, and clinical outcomes of endoscopic mucosal resection: a study of 101 cases. Gastrointest Endosc 2002; 55 : 390–396.
29. Dalenbäck J, Havel G. Local endoscopic removal of duodenal carcinoid tumors. Endoscopy 2004; 36 : 651–655.
30. Zimmer T, Stölzel U, Bäder M et al. Endoscopic ultrasonography and somatostatin receptor scintigraphy in the preoperative localisation of insulinomas and gastrinomas. Gut 1996; 39 : 562–568.
31. Anderson MA, Carpenter S, Thompson NW et al. Endoscopic ultrasound is highly accurate and directs management in patients with neuroendocrine tumors of the pancreas. Am J Gastroenterol 2000; 95 : 2271–2277.
32. Wittmann J, Kocjan G, Sgouros SN et al. Endoscopic ultrasound-guided tissue sampling by combined fine needle aspiration and trucut needle biopsy: a prospective study. Cytopathology 2006; 17 : 27–33.
33. Gauger PG, Scheiman JM, Wamsteker EJ et al. Role of endoscopic ultrasonography in screening and treatment of pancreatic endocrine tumours in asymptomatic patients with multiple endocrine neoplasia type 1. Br J Surg 2003; 90 : 748–754.
34. Stafford-Johnson DB, Francis IR, Eckhauser FE et al. Dual-phase helical CT of nonfunctioning islet cell tumors. J Comput Assist Tomogr 1998; 22 : 335–339.
35. Ichikawa T, Peterson MS, Federle MP et al. Islet cell tumor of the pancreas: biphasic CT versus MR imaging in tumor detection. Radiology 2000; 216 : 163–171.
36. Thoeni RF, Mueller-Lisse UG, Chan R et al. Detection of small, functional islet cell tumors in the pancreas: selection of MR imaging sequences for optimal sensitivity. Radiology 2000; 214 : 483–490.
37. Shi W, Johnston CF, Buchanan KD et al. Localization of neuroendocrine tumours with [l 1JIn]-DTPA-octreotide scintigraphy (Octreoscan): a comparative study with CT and MR imaging. QJM 1998; 91 : 295–301.
38. Carlson B, Johnson CD, Stephens DH et al. MRI of pancreatic islet cell carcinoma. J Comput Assist Tomogr 1993; 17 : 735–740.
39. Dromain C, de Baere T, Lumbroso J et al. Detection of liver metastases from endocrine tumors: a prospective comparison of somatostatin receptor scintigraphy, computed tomography, and magnetic resonance imaging. J Clin Oncol 2005; 23 : 70–78.
40. Papotti M, Bongiovanni M, Volante M et al. Expression of somatostatin receptor types 1-5 in 81 cases of gastrointestinal and pancreatic endocrine tumors. A correlative immunohistochemical and reverse-transcriptase polymerase chain reaction analysis. Virchows Arch 2002; 440 : 461–475.
41. Krenning EP, Kwekkeboom DJ, Bakker WH et al. Somatostatin receptor scintigraphy with [111In-DTPA-D-Phe1] - and [123I-Tyr3]-octreotide: the Rotterdam experience with more than 1000 patients. Eur J Nucl Med 1993; 20 : 716–731.
42. Oberg K, Eriksson B. Nuclear medicine in the detection, staging and treatment of gastrointestinal carcinoid tumours. Best Pract Res Clin Endocrinol Metab 2005; 19 : 265–276.
Labels
Diabetology Endocrinology Internal medicineArticle was published in
Internal Medicine

2011 Issue 12
-
All articles in this issue
- Potrebujeme ešte endoskopickú skleroterapiu pažerákových varixov alebo posledný nech zhasne svetlo
- Epidemiologie Helicobacter pylori
- Screening celiakie u pacientů s osteoporózou a osteopenií
- Očekávaná zátěž nádory jícnu, žaludku a kolorekta ve světě
- Aldosteron jako endogenní kardiovaskulární toxin a možnosti jeho terapeutického ovlivnění
- Neuroendokrinné nádory horného tráviaceho traktu, charakteristika a porovnanie efektivity lokalizačnej diagnostiky
- Keratinové fragmenty jako sérologický ukazatel u nemocných s jaterní chorobou
- Existuje racionální terapie Crohnovy nemoci a ulcerózní kolitidy?
- Ablatívna liečba rektosigmoideálnych prekanceróz a včasných karcinómov
- Přežívání nemocných po TIPS ve Fakultní nemocnici Hradec Králové
- Souběžný výskyt alkoholické jaterní cirhózy a chronické pankreatitidy
- Komplikácie endoskopickej retrográdnej cholangiopankreatikografie alebo ako ich znížiť na najmenšiu možnú mieru
- Nedostatečný screening a malá informovanost o rizikových faktorech u příbuzných I. stupně nemocných s kolorektálním karcinomem
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue
- Neuroendokrinné nádory horného tráviaceho traktu, charakteristika a porovnanie efektivity lokalizačnej diagnostiky
- Komplikácie endoskopickej retrográdnej cholangiopankreatikografie alebo ako ich znížiť na najmenšiu možnú mieru
- Aldosteron jako endogenní kardiovaskulární toxin a možnosti jeho terapeutického ovlivnění
- Potrebujeme ešte endoskopickú skleroterapiu pažerákových varixov alebo posledný nech zhasne svetlo
