Vývoj koagulačních markerů chronické diseminované intravaskulární koagulace (DIK) u pacienta s mnohočetnou angiomatózou v průběhu léčby antiangiogenními léky: interferonem α, thalidomidem a lenalidomidem
Chronic disseminated intravascular coagulation (DIC) markers in a patient with multiple angiomatosis during treatment with antiangiogenics: interferon α, thalidomide and lenalidomide
Background:
Multiple angiomatosis is a rare disease with angiomatous formations in multiple organs and tissues and associated with a risk of fatal bleeding.
Case description:
In this patient, the bones, pleural and peritoneal cavities and digestive tract were involved. The patient had long-term been administered zoledronate that provided relief from bone pain as early as after the second dose. The effect of antiangiogenics was evaluated on CT and MRI. Since angiomatous proliferation is associated with chronic disseminated intravascular coagulation (DIC) and anaemisation, blood count and fibrinogen as well as D-dimer and soluble fibrin monomer concentrations are also used to assess treatment response.
Results:
Before treatment, D-dimer levels were in excess of 20 μg/mL, fibrinogen 1.4 g/L and soluble fibrin monomers were at measurable levels. During treatment with interferon α at a dose of 6 million units 3 times a week with the dose reduction after 10 month, the median fibrinogen concentration increased to 1.5 (1.2–2.0) g/L, the median D-dimer levels declined to 17.2 (13.4–20.0) μg/mL and fibrin monomers were still detectable. Thalidomide therapy (100 mg/day) provided reduction in the median D-dimer levels to 6.07 (4.71–10.21) μg/ml and increase in median fibrinogen concentration to 1.9 g/L; soluble fibrin monomers were unidentifiable. CT imaging suggested significant reduction of angiomatous mass. Progressing neuropathy required dose reduction of thalidomide to 50 mg/day, leading to D-dimer increase. Lenalidomide 10 mg/day provided an increase in median D-dimer concentration to 10.8 (10.8–17.35) and decline in the level of haemoglobin to a median of 124 (135–117) g/L. Soluble fibrin monomers became detectable again. Therefore, a low dose of lenalidomide 10 mg/day was combined with thalidomide 100 mg and, subsequently, 50 mg/day. Treatment with lenalidomide 10 mg and thalidomide 50 mg provided median D-dimer levels of 9.32 and the disease has remained stable for 9 months.
Conclusion:
Thalidomide 100 mg/day stabilized multiple angiomatosis better than interferon alfa. Thalidomide 50 mg/day was insufficient to maintain disease stability. Lenalidomide at a dose of 10 mg was tolerated really well but this dose was insufficient to maintain low D-dimer levels and normal haemoglobin concentrations. The combination of lenalidomide 10 mg and thalidomide 50 mg daily stabilized the disease for 9 months.
Key words:
hemangiomatosis – angiomatosis – thalidomide – lenalidomide – D-dimers – chronic disseminated intravascular coagulation – PET-CT imaging
Authors:
Z. Adam 1; L. Pour 1; M. Matýšková 1; M. Krejčí 1; M. Tomíška 1; P. Szturz 1; Z. Řehák 2; R. Koukalová 2; L. Křikavová 3; T. Nebeský 3; Č. Neuman 4; M. Navrátil 1; R. Hájek 1; Z. Král 1; J. Mayer 1
Authors‘ workplace:
Interní hematoonkologická klinika Lékařské fakulty MU a FN Brno, pracoviště Bohunice, přednosta prof. MUDr. Jiří Mayer, CSc.
1; PET CT oddělení Masarykova onkologického ústavu Brno, přednosta prim. MUDr. Karol Bolčák
2; Radiologická klinika Lékařské fakulty MU a FN Brno, pracoviště Bohunice, přednosta prof. MUDr. Jiří A. Válek, CSc., MBA
3; Chirurgická klinika Lékařské fakulty MU a FN Brno, pracoviště Bohunice, přednosta prof. MUDr. Zdeněk Kala, Ph. D.
4
Published in:
Vnitř Lék 2012; 58(2): 145-153
Category:
Case Reports
Overview
Východisko:
Mnohočetná angiomatóza je raritní onemocnění s postižením více orgánů a tkání angiomatózními útvary s rizikem smrtelného krvácení.
Popis případu:
V popisovaném případu byly postiženy kosti, pleurální i peritoneální dutina a trávicí trubice. Pacient dlouhodobě dostává zoledronát, již po druhé dávce zoledronátu vymizely bolesti kostní. Účinnost antiangiogenních léků jsme hodnotili dle CT a MR zobrazení. Protože angiomatózní proliferace je spojena s chronickou diseminovanou intravaskulární koagulací (DIC) a anemizací, hodnotíme léčebnou odpověď také dle krevního obrazu a dle koncentrace fibrinogenu, D-dimerů a průkazu solubilních fibrinových monomerů.
Výsledky:
Před léčbou byly hodnoty D-dimerů vyšší než 20 μg/ml, fibrinogen 1,4 g/l a byly přítomny solubilní fibrinové monomery. Při léčbě interferonem α 6 milionů j. 3krát týdně s redukcí dávky po 10 měsících se zvýšil medián koncentrace fibrinogenu na 1,5 (1,2–2,0) g/l, poklesl medián hodnoty D-dimerů na 17,2 (13,4–20,0) μg/ml, stále byly přítomny fibrinové monomery. Při terapii thalidomidem (100 mg/den) poklesl medián D-dimerů na 6,07 (4,71–10,21) μg/ml a zvýšil se medián hodnoty fibrinogenu na 1,9 g/l, solubilní fibrinové monomery nebyly průkazné. Dle CT zobrazení se výrazně zmenšily angiomatózní masy. Progredující neuropatie byla důvodem pro snížení dávky thalidomidu na 50 mg/den, při níž se ale zvýšily D-dimery. Při podávání lenalidomidu 10 mg/den se zvýšil medián koncentrace D-dimerů na 10,8 (10,8–17,35) a poklesla hodnota hemoglobinu na medián 124 (135–117) g/l. Opět byl pozitivní průkaz solubilních fibrinových monomerů. Proto jsme zkombinovali nízkou dávku lenalidomidu 10 mg/den s thalidomidem 100 mg a posléze 50 mg denně. Při léčbě lenalidomidem 10 mg a thalidomidem 50 mg byl medián hodnoty D-dimerů 9,32 a onemocnění bylo po 9 měsíců stabilní.
Závěr:
Thalidomid 100 mg/den stabilizoval mnohočetnou angiomatózu lépe než interferon alfa. Thalidomid 50 mg/den již neudržel stabilitu nemoci. Lenalidomid v dávce 10 mg byl excelentně tolerován, ale tato dávka nedostačovala pro udržení stabilně nízkých hodnot D-dimerů a normální koncentrace hemoglobinu. Kombinace 10 mg lenalidomidu a 50 mg thalidomidu denně stabilizovala nemoc na dlouhých 9 měsíců.
Klíčová slova:
hemangiomatosis – angiomatosis – thalidomid – lenalidomid – D-dimery – chronická diseminovaná intravaskulární koagulace – PET-CT zobrazení
Úvod
Angiomatóza je termín pro mnohočetné, postupně proliferující hemangiomy (angiodysplazie), postihující více orgánů či tkání současně. O pacientovi s mnohočetnou angiomatózou, postihující hrudní dutinu, břišní dutinu, trávicí trubici a kosti, stejně jako o histologické klasifikaci cévních neoplazií a o možnostech jejich léčby, jsme v časopise Vnitřní lékařství již referovali [1,2].
Pro detekci těchto ložisek jsou velmi dobře použitelná zobrazení pomocí počítačové tomografie (CT) a magnetické rezonance (MR). Léčebnou odpověď lze však těmito metodami hodnotit obtížně, protože jde o mnohočetné špatně ohraničení útvary. Klasické hodnocení léčebné odpovědi pojmy parciální remise (zmenšení o více než 50 %) nebo minimální léčebné odpovědi (zmenšení o více než 25 % a méně než o 50 %) je velmi obtížně aplikovatelné. Angiomatóza je chronické, současnými metodami nevyléčitelné onemocnění, které vyžaduje trvalou léčbu, snižující vaskulární proliferaci, a tedy frekvenci krvácivých komplikací. Proto pro hodnocení aktivity onemocnění a účinnosti léčby navrhujeme používat termíny stabilní onemocnění (stabilní klinický stav bez epizod krvácení a stabilní hodnoty hemoglobinu) a progredující onemocnění (epizody akutního krvácení či chronické krevní ztráty, tedy klesající hodnoty hemoglobinu, Fe a ferritinu).
Teoreticky by bylo možné na léčebnou odpověď usuzovat dle markerů angioneogeneze (endoteliální růstového faktoru – VEGF a dalších). Jejich vyšetřování sice v ČR v rámci výzkumných projektů prováděno je, ale není zdravotní pojišťovnou hrazeno. Hledali jsme náhradní markery, dle nichž bychom mohli hodnotit aktivitu onemocnění a účinnost léčby. Velké hemangiomy a angiomatóza jsou provázeny laboratorními známkami chronické diseminované intravaskulární koagulace (DIK), která může někdy způsobit i trombocytopenii. Proto jsme u našeho pacienta sledovali nejen hodnoty, které signalizují akutní či chronické krvácení (krevní obraz, železo, ferritin), ale také základní koagulační parametry doplněné o koncentraci D-dimerů a průkaz solubilních fibrinových monomerů pomocí etanolgelifikačního testu.
V této publikace dokumentujeme souvislost mezi stabilitou nemoci a poklesem parametrů diseminované intravaskulární koagulace a progresí nemoci a vzestupem parametrů diseminované intravaskulární koagulace. Dále dokumentujeme jejich změny při léčbě antiangiogenními léky.
Dále v této publikaci referujeme o PET-CT zobrazení mnohočetné angiomatózy, protože v literární databázi MEDLINE jsme nenašli žádnou publikaci popisující PET-CT zobrazení angiomatózy.
Popis případu
Příznaky nemoci a stanovení diagnózy
S mnohočetnou angiomatózou jsme se setkali u mladého muže, narozeného 1977. Podrobně jsme o anamnéze a diagnostických problémech referovali [1]. V květnu roku 2005 byl na naše pracoviště přijat mladý muž ve věku 28 let se závažnou anémií, vyžadující transfuze. Pro nejasný nález na CT obraze dutiny břišní byla provedena probatorní laparotomie. Po otevření dutiny břišní byl překvapující nález velkých hemangiomatózních uzlů v oblasti mesenteria a retroperitonea. Potíže nemocného shrnuje tab. 1.

Operační nález z probatorní laparotomie
Peritoneální dutina byla bez výpotku.
Revize tenkých kliček: asi do poloviny orálního jejuna byla patrná atypická struktura, zesílená granulovaná stěna, další tenké střevo normálního charakteru. Byla provedena enterotomie a odběr stěny v celé síle na histologii. Mezenterium příslušné takto změněnému střevu bylo zesílené, byly hmatné uzliny a houbovitá tkáň s dilatovanými cévami.
Revize podjaterní krajiny: celá stěna žlučníku byla prorostlá vaskulární tkání, ligamentum hepatoduodenale infiltrované, patrná dilatovaná cévní pleteň. Játra byla palpačně i vizuálně bez patologií, slezina normální velikosti a struktury.
Maximum změn bylo nalezeno v retroperitoneu, z něhož se vyklenovala tkáň houbovité struktury, ze které prosvítaly uzly charakteru hemangiomů a procházející cévy průměru 0,5–1,0 cm. Tyto změny sestupovaly až k ilickým svazkům. Dále jimi bylo prostoupeno téměř celé mesocolon. Volný byl úsek jen od hepatické flexury do poloviny příčného tračníku. Směrem k lienální flexuře byly cévní změny patrny i při okraji střeva. Mesosigma již bylo celé prostoupené, nedovolovalo manipulaci se střevem, ale přesto byly patrny cévní malformace i na stěně břišní směrem k lopatě kosti kyčelní. Za vzestupným tračníkem byla hmatná stejná tkáň jako v retroperitoneu.
Žaludek byl bez výraznějších patologií, v oblasti pyloru až k duodenu začínají obdobné patologické změny s dilatovanými žilami. Nad žaludkem v retroperitoneu byl stejný nález angiomatózy. Odběr histologie z retroperitonea hrozil exsanguinací, a proto nebyl proveden. Byla jen odebrána část tkáně, adheze mezi žlučníkem a duodenem, kterým probíhala dilatovaná céva. Dále bylo na stěně pyloru zvoleno jedno místo s dilatovanou cévou a mezi stehy byla provedena excise. Došlo k masivnímu arteriálnímu krvácení, které bylo zastaveno prošitím stěny žaludku. Od dalších odběrů jsme odstoupili, byla provedena kontrola hemostázy, drén k pyloru, sutura laparotomie.
Operační diagnóza: angiomatosis retroperitonei, vesicae feleae a mesocoli, která byla potvrzena histologickým vyšetřením.
Léčba
Léčba byla zahájena 23. června 2005 interferonem α (Introna) a zoledronátem (Zometa). Pacient měl po celou dobu normální funkci ledvin, takže nebylo nutné upravovat dávky léků dle funkce ledvin.
Zoledronát
Indikací pro léčbu zoledronátem byly osteolytické destrukce kostí způsobené angiomatózními hmotami. Zoledronát byl po celou dobu podáván ve standardní dávce 4 mg nitrožilní infuzí v intervalech 28 týdnů po dobu prvních 4 let. Od 5. roku jsme změnili dávkování na 1krát za 2 měsíce. Bolesti kostí vymizely po 2 měsících léčby zoledronátem a po dobu 5 let jsme nepozorovali žádné nežádoucí účinky zoledronátu.
Interferon α
Interferon α (Introna) byl zpočátku podáván v dávce 6 milionů jednotek 3krát týdně. Tato dávka interferonu α byla tolerována po několik měsíců relativně dobře, ale s postupem času se zvýšila intenzita nežádoucích účinků (nechuť k jídlu, patologická únava – fatigue, deprese) natolik, že po 10 měsících bylo nutné dávku interferonu α snížit na 3 miliony jednotek 3krát týdně. Tuto dávku interferonu nemocný snášel zpočátku dobře, ale s postupem času i se tato dávka ukázala jako problematická a zatěžující a bylo nutné ji změnit. Tolerance interferonu α se postupně zhoršovala a při posledním nasazení jsme velmi brzy pro klasické nežádoucí účinky museli interferon α ukončit. Z tab. 2 je zřetelné, že intervaly, po něž pacient snášel interferon α, se postupně zkracovaly.
Thalidomid
Vzhledem k malému účinku léčby interferonem α a nutnosti snížit jeho dávku z 6 na 3 miliony jednotek jsme zvažovali, kterým dostupným lékem potencovat tuto léčbu. Po domluvě s pacientovou zdravotní pojišťovnou byl od června roku 2006 přidán další lék s prokázaným inhibičním vlivem na angioneogenezi – thalidomid (Myrin), v dávce 100 mg denně. Publikované zkušenosti hovoří o tom, že 100 mg je optimální dávka, zatímco 50 mg již nemá dostačující účinek [3].
Jak interferon α, tak thalidomid mají nežádoucí účinky, které se zintenzivňují v závislosti na délce léčby. A tak thalidomid (Myrin), zpočátku velmi dobře tolerovaný, začal být po měsících léčby problematický díky postupnému zhoršování neuropatie.
Proto, jak je zřetelné z přehledné tab. 2, dávky i složení léčby se v čase měnily dle převládajících nežádoucích účinků toho či onoho preparátu. Přechodem na jiný preparát jsme doufali, že se sníží intenzita nežádoucích účinků předchozího léku natolik, aby bylo možné se k němu opět navrátit.
Pro nežádoucí účinky 100 mg thalidomidu jsme začali testovat nižší dávky, střídání 100 a 50 mg/den a posléze 50 mg/den. Při snížené dávce thalidomidu se však začaly postupně zvyšovat hodnoty D-dimerů.
Lenalidomid 10 mg v monoterapii
V květnu roku 2010 jsme pro výrazné nežádoucí účinky (závažná neuropatie) přerušili podání thalidomidu a přešli jsme na aplikaci lenalidomidu (Revlimidu), který má také výrazný inhibiční vliv na angiogenezi, nezpůsobuje však neuropatii. Zvolili jsme nejnižší dostupnou dávku, 10 mg tablety 1krát denně, ve stejném schématu, v jakém se podává u mnohočetného myelomu v rámci udržovací léčby, tedy denní podávání10 mg/den po dobu 3 týdnů s týdenní pauzou před další dávkou lenalidomidu.
Intenzita neuropatických potíží po změně léčby – nahrazení thalidomidu preparátem lenalidomidu – poklesla. A protože po 3 měsících, v srpnu roku 2010, se při monoterapii lenalidomidem mírně navýšila hodnota D-dimerů a i nepatrně poklesla koncentrace hemoglobinu, rozhodli jsme se pro kombinovanou léčbu thalidomidem a lenalidomidem.
Lenalidomid v kombinaci s thalidomidem
Thalidomid i lenalidomid se shodují v tom, že mají antiangiogenní působení, ale jejich nežádoucí účinky jsou různé. Proto jsme od srpna roku 2010 podávali zpočátku thalidomid 100 mg a lenalidomid 10 mg. Od listopadu roku 2010 jsme snížili thalidomid na 50 mg denně a ponechali lenalidomid 10 mg. Tolerance této léčby byla dobrá. Při uvedené dávce nedocházelo k žádnému poklesu neutrofilů, subjektivně tuto léčbu snášel pacient dobře a díky ní byl jeho stav dlouhodobě (9 měsíců) stabilizovaný až do kontroly v dubnu roku 2011, kdy opět došlo k poklesu hemoglobinu.
Hodnocení účinku léčby
CT a MR vyšetření
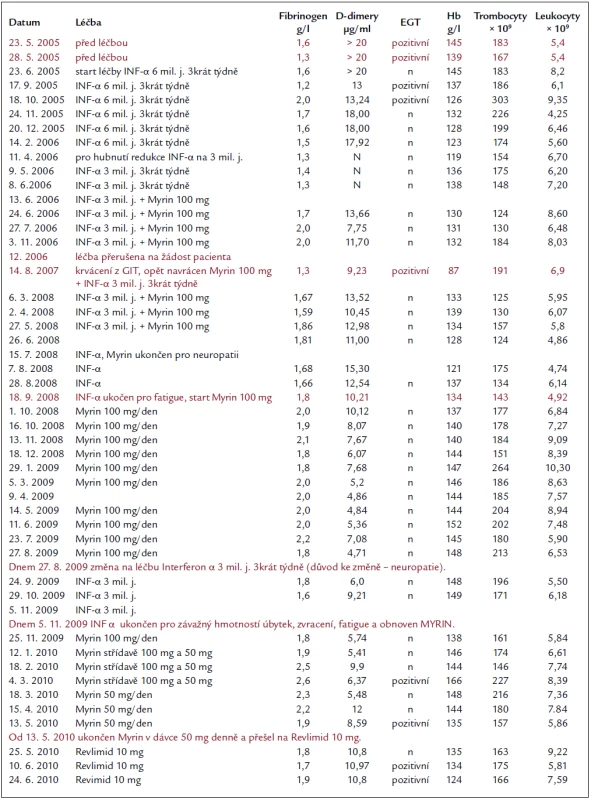
Rozsah angiomatózních hmot je viditelný na MR i na CT zobrazení mediastina a břišní dutiny. Tato zobrazení jsme publikovali již dříve [1,2] a zde připomínáme, jak vypadá infiltrace více obratlů angiomatózními hmotami při CT zobrazení (obr. 1 a 2).

PET-CT vyšetření s nitrožilním podáním kontrastu
Vzhledem k léčebným rozpakům jsme u tohoto pacienta provedli PET-CT zobrazení. Cílem vyšetření bylo nejen zjištění rozsahu nemoci, ale i získání odpovědi na otázku, zda v některé lokalizaci nedochází ke zvýšenému vychytávání fluorodeoxyglukózy, tedy k vyšší metabolické (proliferační) aktivitě. Zvažovali jsme případnou radioterapii na ložiska se zvýšeným vychytáváním fluorodeoxyglukózy, protože bychom v nich předpokládali vyšší metabolickou aktivitu, a tedy i radiosenzitivitu.
Na PET-CT zobrazení byly patrné četné hemagiomy v obratlech Th (Th7,8 a Th10-12) a LS (L4-S1) páteře a levé kosti kyčelní, v těchto místech byla detekována snížená akumulace fluorodeoxyglukózy, která nedosahovala ani fyziologické aktivity v okolních nepostižených obratlech (obr. 3). Mediastinem, jaterním hilem a kaudálněji celým retroperitoneálním prostorem se spolu s cévami pruhovitě táhl „cárovitě“ hypodenzní (hemangiomatózní) infiltrát, jehož metabolická aktivita byla srovnatelná s pozadím (obr. 4).
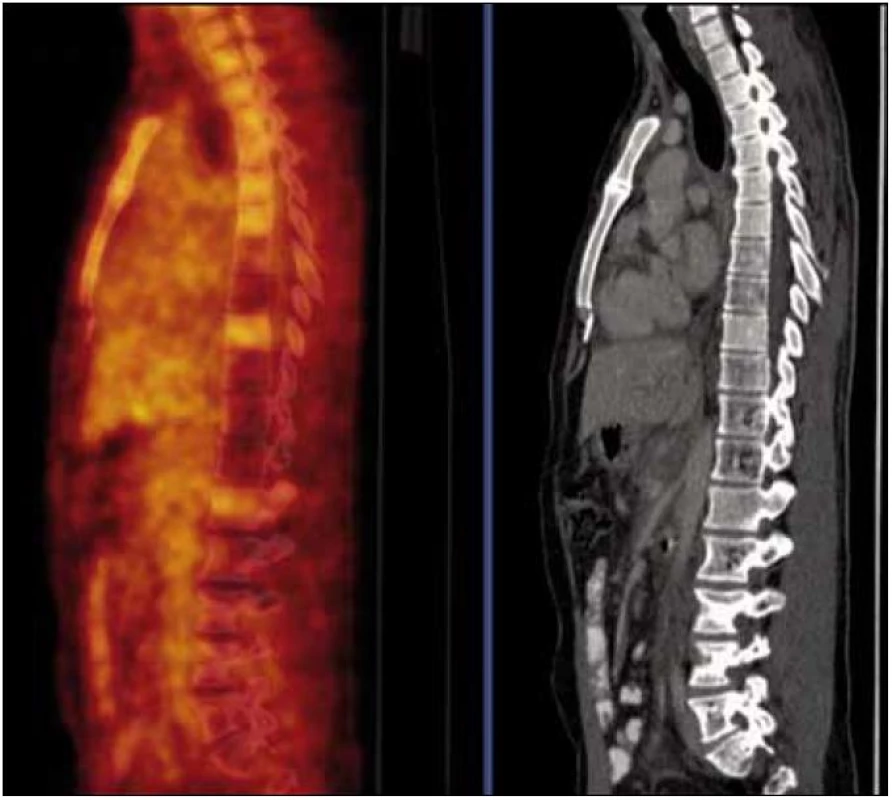
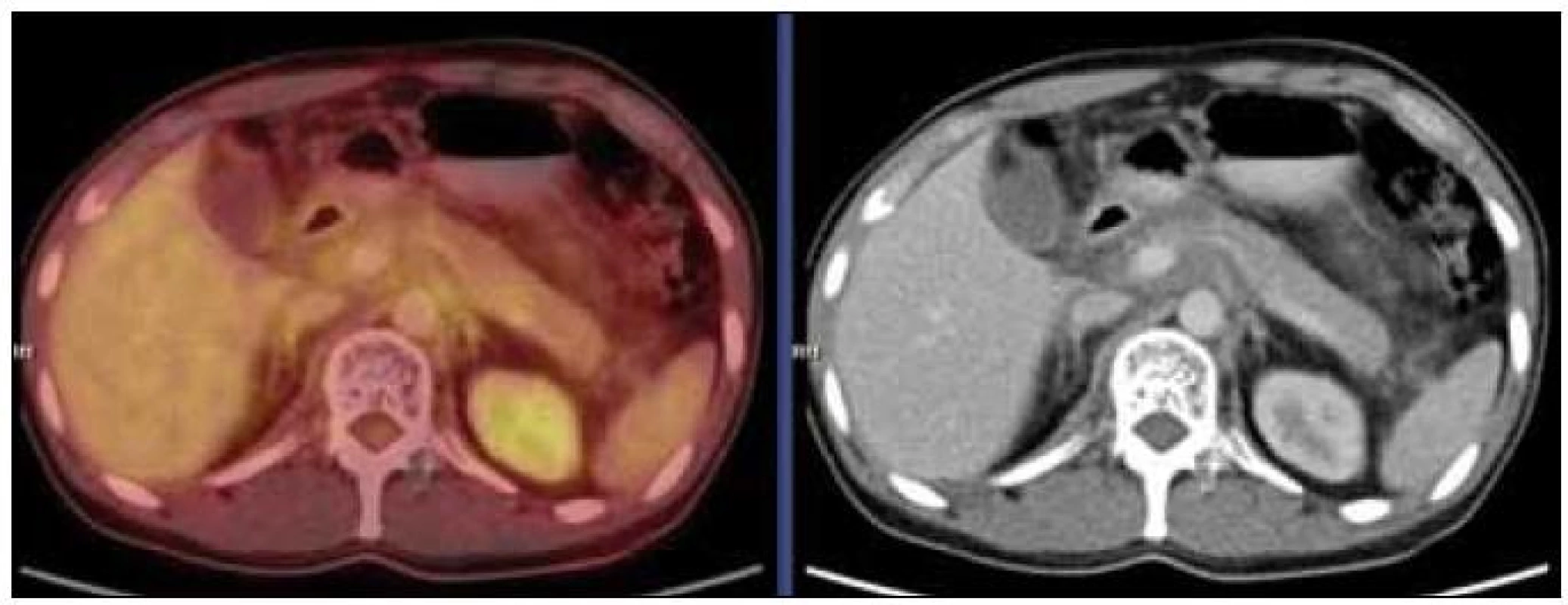
Lze tedy říct, že ani kostní postižení ani infiltrát v mediastinu a retroperitoneu nevykazoval patologicky zvýšenou akumulaci fluorodeoxyglukózy (FDG), kterou běžně vídáme u většiny ložisek maligní etiologie. V případně kostního postižení hemangiomem byla akumulace fluorodeoxyglukózy v postižených obratlích výrazně nižší než v obratlích s fyziologickou kostní dření. Tento rozdíl umožní velmi dobře odlišit postižení obratle angiomatózní tkání se sníženým vychytáváním radioaktivní glukózy ve srovnání se zdravou tkání obratů od postižení obratle mnohočetným myelomem či jinou maligní nemocí, kdy je vychytávání glukózy podstatně vyšší než v kostní dřeni zdravých obratlů.
Laboratorní známky aktivity procesu
Intenzivní proliferace angiomatózních struktur je spojena s tvorbou specifických působků, např. vaskulárního endoteliálního růstového faktoru (VEGF). Tyto hodnoty však nelze použít pro rutinní monitorování, protože jejich analýza není hrazena ze zdravotního pojištění.
Proliferace angiomatózních struktur způsobuje diseminovanou intravaskulární koagulaci (DIK) s následným snížením hodnot fibrinogenu, výrazným navýšením hodnot D-dimerů a přítomností solubilních fibrinových monomerů. V závažných případech bývá i pokles počtu trombocytů.
Tento chronicky probíhající DIK v angiomatózních masách není ovlivnitelný aplikací heparinu, jak popisuje literatura a jak jsme ověřili u tohoto pacienta. Aplikace nízkomolekulárního heparinu vůbec tyto hodnoty neovlivnila, zůstávaly stejné během jeho podávání i po ukončení aplikace.
Patologické hodnoty koagulace však byly ovlivnitelné léky inhibujícími angioneogenezi, jak vyplývá z tab. 2.
Při úspěšné léčbě interferonem α (Introna) a thalidomidem (Myrin) se snížily hodnoty D-dimerů (stanovené testem STA LIATEST DDI firmy Stago), zvýšila se hodnota fibrinogenu a vymizely fibrinové monomery, prokazované etanolgelifikačním testem. Zároveň se stabilizovala hodnota hemoglobinu.
Uvedené koagulační parametry spolu s hodnotou hemoglobinu nyní používáme k průběžnému hodnocení aktivity jednotlivých typů léčby, byť s jistým omezením, protože organizmus člověka i angiomatóza v něm obsažená se vyvíjejí v čase.
- Před zahájením léčby byly hodnoty D-dimerů vyšší než 20 μg/ml, hodnota fibrinogenu snížená na 1,4 g/l a byly prokazatelné solubilní fibrinové monomery etanolgelifikačním testem.
- Při terapii interferon α (Introna) v dávce 6 milionů j. 3krát týdně, po 10 měsících snížené na 3 miliony j. 3krát týdně, byl medián koncentrace fibrinogenu 1,5 (1,2–2,0) g/l, medián hodnoty D-dimerů 17,2 (13,4–20,0) μg/ml, etanolgelifikační test nebyl vždy vyšetřen, pokud však vyšetřen byl, tak zůstával pozitivní. První léčba interferonem probíhala od 23. 6. 2005 až do 13. 6. 2006.
- Při monoterapii thalidomidem (Myrin) v dávce 100 mg (18. 9. 2008–27. 8. 2009) byl medián hodnoty D-dimerů 6,07 (4,71–10,21) μg/ml, medián hodnoty hemoglobinu 144 g/l, medián hodnoty fibrinogenu 1,9 g/l, etanolgelifikační test nebyl prováděn.
- Při použití 50 mg Myrinu (18. 3. 2010––13. 5. 2010) bylo zřetelné postupné narůstání hodnot D-dimerů.
- Při použití lenalidomidu (Revlimid) v dávce 10 mg došlo ke zvýšení hodnoty D-dimerů na medián 10,8 (10,8–17,35) μg/ml a poklesla hodnota hemoglobinu, medián 124 (135–117) g/l. Byl pozitivní průkaz fibrinových monomerů etanolgelifikačním testem.
- Při použití lenalidomidu (Revlidmid) v dávce 10 mg po dobu 21 dnů a thalidomidu 50 mg denně byl stav stabilní, medián D-dimerů byl 9,32 (7,7–17,0) μg/ml, byly stabilní jak hodnoty hemoglobinu, tak ferritinu.
Diskuze
Mnohočetná angiomatóza, diagnostikovaná v dospělosti, je velmi vzácným, raritním onemocněním, o němž lze získat informace z popisu případů, nikoli z klinických studií. Údaje o incidenci mnohočetné angiomatózy jsme v literatuře nenašli. Pro léčbu angiomatózy nejsou stanoveny žádné postupy ověřené klinickými studiemi. Léčba angiomatózy je vždy individuální, dle lokalizace se kombinuje intervenční (embolizační) léčba a medikamentózní léčba. Přehled léčebných postupů jsme podrobně rozebrali v předchozí publikaci [2].
Zobrazení angiomatózy pomocí klasických metod, sonografie, CT a MR
Hemangiomy je možné zviditelnit sonograficky, zobrazují se jako hyperechogenní noduly s nepatrným posteriorním akustickým zvýrazněním, lze je prokázat dopplerovským vyšetřením. Vzhledem k difuznímu růstu angiomatózních hmot však v tomto případě sonografické vyšetření nevedlo k rozpoznání této nemoci.
Při CT se zobrazují jako hypodenzní ložiska s denzitou odpovídající cévním strukturám, které lze potvrdit typickým sycením po aplikaci kontrastní látky.
Velmi dobře se hemangiomy znázorňují pomocí MR zobrazení. V T1 váženém obraze mají hemangiomy nízkou intenzitu signálu, zatímco při T2 zobrazení vykazují vysokou intenzitu, která umožní velmi dobře odlišit hemangiomatózní struktury od ostatních orgánů.
Zobrazení angiomatózy pomocí PET-CT
O zobrazení angiomatózy při PET-CT vyšetření není dostatek publikovaných údajů. Proto zde uvádíme výsledek PET-CT vyšetření. U popisovaného pacienta postižené obratle vykazovaly velmi nízkou metabolickou aktivitu (až výpadek aktivity neboli fotopenii), tedy výrazně nižší aktivitu než u okolních zdravých obratlů. V takovém případě byl předpoklad nálezu metabolicky neaktivní struktury. Tak nízkou aktivitu vykazují solitární hemagiomy, kostní cysty nebo nejčastěji iatrogenní útlum metabolizmu v kostní dřeni po provedené radioterapii. Většina benigních kostních tumorů vykazuje aktivitu spíše na úrovni fyziologické aktivity, mohou být tedy svou aktivitou k nerozeznání od zdravých tkání (obr. 1 a 2).
Medikamentózní léčba
Přehled léků s prokázaným antiangiogenním účinkem jsme uvedli v předchozí publikaci [2]. Z nich jsme vybrali pro zahájení léčby interferon α a zoledronát. Protože při léčbě interferonem α dochází s postupem času k zintenzivňování nežádoucích účinku, je délka léčby interferonem obvykle časově omezená.
Thalidomid je lék s výrazným antiangiogenním působením a představuje velmi účinný lék pro léčbu cévních dysplazií, hemangiomů, teleangiektazií a podobných afekcí. Leč ani tento lék není bez nežádoucích účinků.
Lenalidomid je derivátem thalidomidu. Patří do skupiny léků zvané IMIDs (imunomodulatory drugs). Protinádorový účinek těchto léků je velmi komplexní. Mimo jiné stimulují protinádorovou imunitní odpověď a inhibují angioneogenezi, jak dokumentuje obr. 5. Lenalidomid se velmi dobře vstřebává při perorálním podání, z organizmu je vylučován ledvinami, proto je jeho dávkování nutné upravovat dle funkce ledvin [4–10].
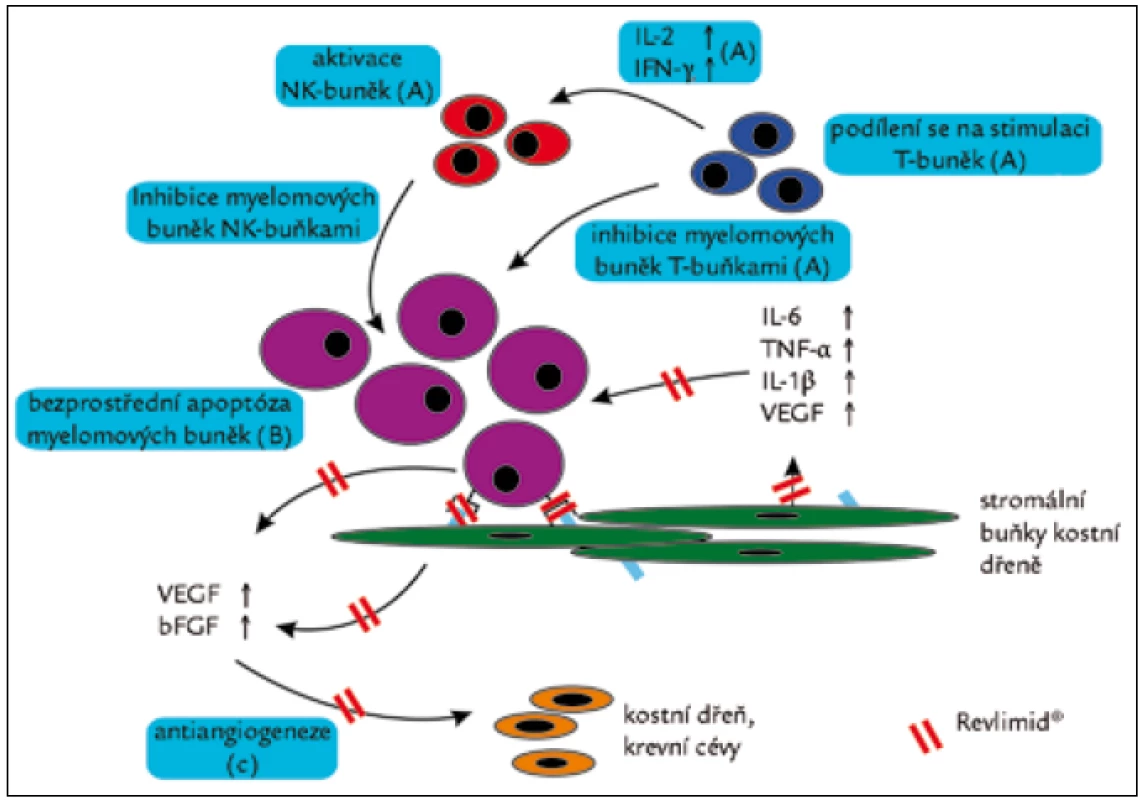
U lenalidomidu, podobně jako u thalidomidu, byl popsán výrazný inhibiční vliv na novotvorbu cév [11]. Inhibiční vliv lenalidomidu na proliferaci cév se liší od blokátorů vaskulárního endoteliálního růstového faktoru (VEGF) bevacizumabu (firemní název Avastin), po němž jsou udávány krvácivé komplikace typu epistaxe. Po thalidomidu a po lenalidomidu se neobjevují spontánní krvácení jako po inhibitoru VEGF, nicméně antiangiogenní efekt je spojen s prokoagulačním působením, které při kombinaci s dalšími prokoagulačně působícími medikamenty zvyšuje počet tromboembolických příhod [12,13]. Lenalidmid je standardním lékem pro mnohočetný myelom [14] a je používán i u dalších nemocí [15–26].
Ve světovém písemnictví jsme našli pouze jednu zprávu o úspěšném podání lenalidomidu v indikaci mnohočetného postižení střeva hereditární hemoragickou angiodysplazií. V této zprávě se udává, že léčbu zahájili 10 mg lenalidomidu. Tuto dávku pro malou účinnost postupně zvýšili na 15 mg denně. Po 15 týdnech museli tuto léčbu přerušit pro cytopenii a po úpravě krvetvorby přešli na dávku 15 mg ob den a posléze 25 mg ob den. Autoři této publikace uvádějí, že při léčbě lenalidomidem v dávce 15 mg ob den či 25 mg ob den měl pacient menší krevní ztráty než při léčbě 100 mg thalidomidu denně [27].
V jiné publikaci se popisuje, že se lenalidomid osvědčil u multifokálního epiteloidního hemangioendoteliomu [28].
Vlastní zkušenosti s lenalidomidem
Publikovaná zkušenost [3], že 50 mg thalidomidu není dostačující léčba a že je nutná vyšší dávka thalidomidu 100 mg denně, koreluje s našimi zkušenostmi.
První publikovaná informace o účinné dávce lenalidomidu pro léčbu (dosažení bezpříznakovosti) u pacienta s cévní dysplazií uvádí, že 10 mg denně není dostačující, že účinnou kontrolu nemoci lze dosáhnout vyšší dávkou (15–25 mg ob den).
V našem případě jsme zvolili nejnižší dostupné dávkování lenalidomidu, 10 mg denně. Pacient dostával lék po dobu 21 dnů v měsíčních cyklech. Tato dávka je standardně používána u pacientů s mnohočetným myelomem v rámci udržovací léčby. Našemu pacientovi jsme tedy po seznámení s aplikací registrovaného léčiva v nestandardní indikaci a podepsání informovaného souhlasu podali lenalidomid (Revlimid) v dávce 10 mg.
Při použité dávce lenalidomidu 10 mg denně se však postupně zvyšovaly hodnoty D-dimerů. Na to, že zvyšování hodnoty D-dimerů je klinicky signifikantní, jsme usoudili nikoli na základně jejich statistického hodnocení, ale ze současného poklesu hodnoty hemoglobinu, který byla s vysokou pravděpodobností způsoben krevními ztrátami, a ne myelosupresivním vlivem lenalidomidu, protože hodnoty leukocytů a trombocytů se při používání lenalidomidu oproti hodnotám v době užívání thalidomidu nijak signifikantně neměnily. Při Myrinu 100 mg denně byl medián počtu leukocytů 7,57 (4,92–10,3) × 109/l a trombocytů 144 (143–213) × 109/l, při lenalidomidu byl medián počtu leukocytů 6,89 (5,81–9,22) × 109/l a trombocytů 166 (163–210) × 109/l.
Vzhledem k tomu, že pacient bude potřebovat tuto léčbu dlouhodobě, nešli jsme u něj cestou navyšování dávky lenalidomidu, ale cestou kombinování thalidomidu a lenalidomidu. V prvních 3 měsících dostával pacient lenalidomid 10 mg, k tomu thalidomid 100 mg, a když se zvýšila koncentrace hemoglobinu a poklesla hodnota D-dimerů, byla dávka thalidomidu snížena na 50 mg.
Při této kombinované léčbě lenalidomidem 10 mg a thalidomidem 50 mg byl pacient stabilní po dobu 9 měsíců až do dubna roku 2011, kdy došlo k poklesu hemoglobinu.
Doufáme, že touto léčbou dosáhneme dlouhodobé stability nemoci.
Závěr
Mnohočetná angiomatóza je agresivní, byť nemaligní cévní onemocnění. Pro léčbu byl standardně používán prednison a interferon α. Pediatři popisují pozitivní zkušenosti s propranololem.
Thalidomid je zřejmě nejúčinnějším lékem pro angiomatózu a progredující hemangiomy.
Lenalidomid je dalším účinným lékem pro tato onemocnění, je však zapotřebí používat vyšší dávky než 10 mg denně, nebo jej kombinovat s thalidomidem.
Rozsah onemocnění je dobře detekovatelný ve skeletu i mimo skelet pomocí MR i PET-CT vyšetření a odlišitelný od postižení skeletu mnohočetným myelomem [29,30].
Poděkování
Léčba pacienta se uskutečnila za laskavé podpory firmy Celgene, s. r. o., z projektu Compassionate Use Program určeného pro pacienty se vzácnými hematoonkologickými onemocněními.
Práce byla vypracována v rámci aktivity následujících grantů: grantu IGA ČR NT 12215-4, výzkumného záměru MZ ČR: FUNDIN MZ0MOU2005 a dále pak grantů MŠMT MSM0021622434, LC06027, specifického výzkumu MUNI/A/0784/2011 a grantů IGA MZd NT11154, NT12130, NT12215 a NS10408.
prof. MUDr. Zdeněk Adam, CSc.
www.fnbrno.cz
e-mail: z.adam@fnbrno.cz
Doručeno do redakce: 3. 6. 2011
Přijato po recenzi: 21. 7. 2011
Sources
1. Adam Z, Křikavová L, Krejčí M et al. Léčba mnohočetné angiomatózy postihující skelet, břišní i hrudní dutinu interferonem α, thalidomidem a zoledronatem. Vnitř Lék 2008; 54 : 553–664.
2. Adam Z, Pour L, Krejčí M et al. Úspěšná léčba angiomatózy thalidomidem a interferonem α. Popis pěti případů a přehled léčby angiomatózy a proliferujících hemangiomů. Vnitř Lék 2010; 56 : 810–824.
3. Heidt J, Langers AMJ, van der Meer et al. Thalidomide as treatment for digestive angiodysplasias. Neth J Med 2006; 64 : 425–428.
4. Crane E, List A. Immunomodulatory drugs. Cancer Invest 2005; 23 : 625–634.
5. De Sanctis JB, Mijares M, Suárez A et al. Pharmacological properties of thalidomide and its analogues. Recent Pat Inflamm Allergy Drug Discov 2010; 4 : 144–148.
6. Dreicer R. Lenalidomide: immunomodulatory, antiangiogenic, and clinical activity in solid tumors. Curr Oncol Rep 2007; 9 : 120–123.
7. Elice F, Jacoub J, Rickles FR et al. Hemostatic complications of angiogenesis inhibitors in cancer patients. Am J Hematol 2008; 83 : 862–870.
8. Knight R. IMiDs: a novel class of immunomodulators. Semin Oncol 2005; 32 (Suppl 5): S24–S30.
9. Kotla V, Goel S, Nischal S et al. Mechanism of action of lenalidomide in hematological malignancies. J Hematol Oncol 2009; 2 : 36–40.
10. Teo SK. Properties of thalidomide and its analogues: implications for anticancer therapy. AAPS J 2005; 7: E14–E19.
11. Lu L, Payvandi F, Wu L et al. The anti-cancer drug lenalidomide inhibits angiogenesis and metastasis via multiple inhibitory effects on endothelial cell function in normoxic and hypoxic conditions. Microvasc Res 2009; 77 : 78–86.
12. Elice F, Rodeghiero F. Bleeding complications of antiangiogenic therapy: Pathogenetic mechanisms and clinical impact. Thromb Res 2010; 125 (Suppl 2): S55–S57.
13. Zangari M, Fink LM, Elice F et al. Thrombotic events in patients with cancer receiving antiangiogenesis agents. J Clin Oncol 2009; 27 : 4865–4873.
14. Hájek R, Maisnar R, Adam Z et al. Mnohočetný myelom, diagnostika a léčba. Doporučení pro diagnostiku a léčbu České myelomové skupiny. Transfuze Hematol dnes 2009; 15: (Suppl 2): 2–80.
15. Awan FT, Johnson AJ, Lapalombella R et al. Thalidomide and lenalidomide as new therapeutics for the treatment of chronic lymphocytic leukemia. Leuk Lymphoma 2010; 51 : 27–38.
16. Dasanu CA, Reale MA, Bauer F. Mantle cell lymphoma arising in a multiple myeloma patient responding to lenalidomide. Leuk Res 2010; 34 : 178–180.
17. Fine HA, Kim L, Albert PS et al. A phase I trial of lenalidomide in patients with recurrent primary central nervous system tumors. Clin Cancer Res 2007; 13 : 7101–7106.
18. Mandac I, Kolonic SO. Lenalidomide induced good clinical response in a patient with multiple relapsed and refractory Hodgkin’s lymphoma. J Hematol Oncol 2010; 3 : 20–25.
19. Sher T, Miller KC, Lawrence D et al. Efficacy of lenalidomide in patients with chronic lymphocytic leukemia with high-risk cytogenetics. Leuk Lymphoma 2010; 51 : 85–88.
20. Böll B, Borchmann P, Topp MS et al. Lenalidomide in patients with refractory or multiple relapsed Hodgkin lymphoma. Br J Haematol 2010; 148 : 480–482.
21. Habermann TM, Lossos IS, Justice G et al. Lenalidomide oral monotherapy produces a high response rate in patients with relapsed or refractory mantle cell lymphoma. Br J Haematol 2009; 145 : 344–339.
22. Galustian C, Dalgleish A. Lenalidomide: a novel anticancer drug with multiple modalities. Expert Opin Pharmacother 2009; 10 : 125–133.
23. Tempescul A, Ianotto JC, Morel F et al. Lenalidomide, as a single agent, induces complete remission in a refractory mantle cell lymphoma. Ann Hematol 2009; 88 : 921–922.
24. Wiernik PH, Lossos IS, Tuscano JM et al. Lenalidomide monotherapy in relapsed or refractory aggressive non-Hodgkin’s lymphoma. J Clin Oncol 2008; 26 : 4952–4957.
25. Chanan-Khan AA, Cheson BD. Lenalidomide for the treatment of B-cell malignancies. J Clin Oncol 2008; 26 : 1544–1552.
26. Darabi K, Kantamnei S, Wiernik PH. Lenalidomide-induced warm autoimmune hemolytic anemia. J Clin Oncol 2006; 24: e59.
27. Bowcock SJ, Patrick HE. Lenalidomide to control gastrointestinal bleeding in hereditary haemorrhagic telangiectasia: potential implications for angiodysplasias? Br J Haematol 2009; 146 : 220–222.
28. Sumrall A, Fredericks R, Berthold A et al. Lenalidomide stops progression of multifocal epitheloid hemangioendothelioma including intracranial disease. J Neurooncol 2010; 97 : 275–277.
29. Ščudla V, Heřman M, Minařík J et al. Přínos celotělové magnetické rezonance pro diagnostiku monoklonální gammapatie nejistého významu, mnohočetného myelomu a stanovení klinického stadia dle Durie-Salmon Plus stážovacího systému. Vnitř Lék 2011; 57 : 52–60.
30. Mysliveček M, Bačovský J, Ščudla V et al. 18F-FDG PET/CT v diagnostice mnohočetného myelomu a monoklonální gamapatie nejistého významu: srovnání s 99mTc-MIBI scintigrafií. Klin Onkol 2010; 23 : 325–331.
Labels
Diabetology Endocrinology Internal medicineArticle was published in
Internal Medicine

2012 Issue 2
-
All articles in this issue
- Přehled dosud publikovaných analýz srovnávajících efektivitu léčby inzulinovou pumpou a režimu několika injekcí inzulinu denně u diabetiků 1. typu
- Léčba hypertyreózy radiojodem 131I v ambulantním režimu – bezpečná, účinná a ekonomická varianta
- Celiakie – opomíjená diagnóza
- Trvalá virologická odpoveď kombinovanej imunomodulačnej liečby pegylovaným interferónom-α a ribavirínom u bývalých intravenóznych drogovo závislých jedincov s chronickou vírusovou hepatitídou C
- Příznaky bažení po jídle u dětí staršího školního věku a jejich vztah k body-mass indexu
- Klinické dôsledky zväčšenia ľavej predsiene
- Hemokoagulační mechanizmy v procesu aterotrombózy
- Význam urokinázy a jejích inhibitorů pro invazi a metastazování zhoubných nádorů
- Měkké tkáně, hormony a skelet
- Lieky a štítna žľaza
- Vývoj koagulačních markerů chronické diseminované intravaskulární koagulace (DIK) u pacienta s mnohočetnou angiomatózou v průběhu léčby antiangiogenními léky: interferonem α, thalidomidem a lenalidomidem
- Goodův syndrom (s thymomem spojená hypogamaglobulinemie) – 2 kazuistiky
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue
- Klinické dôsledky zväčšenia ľavej predsiene
- Lieky a štítna žľaza
- Léčba hypertyreózy radiojodem 131I v ambulantním režimu – bezpečná, účinná a ekonomická varianta
- Goodův syndrom (s thymomem spojená hypogamaglobulinemie) – 2 kazuistiky

