Oční víčka se žlutými granulomy a kašel – periokulární xantogranulom dospělých spojený s astmatem. Popis případu a přehled klinických forem juvenilního xantogranulomu a terapie
Eyelids with yellow granulomas and cough – periocular xanthogranuloma associated with adult-onset asthma. A case study and an overview of clinical forms of juvenile xanthogranuloma and its therapy
Histiocytic diseases caused by proliferation and accumulation of phagocytosing macrophages (foamy macrophages) have many clinical forms. These are classified under “juvenile xanthogranuloma” within the WHO classification of blood disorders. Localized forms with benign course include normolipaemic xanthomatosis, xanthogranuloma and necrobiotic xanthogranuloma. Disseminated forms in children take a form of so called “disseminated juvenile xanthogranuloma” or Erdheim-Chester disease in adults. We describe a case of a patient who, at 53 years of age, first noticed yellow granulomas on her eyelids. The disease progressed gradually and, at 59, affects the eyelids as well as their closest surroundings. According to MR and PET-CT, the disease gradually infiltrated the inside of the orbit, orbital fat as well as extraocular muscles and started to cause exoftalmus of one of the eyes. Propagation of the xanthogranuloma into the orbit and infiltration of extraocular muscles might impair eye function. Over the last year, the patient complained of cough. Pulmonary function evaluation confirmed recent asthma bronchiale. These findings correspond to periocular xanthogranuloma associated with adult-onset asthma. No other abnormities have been shown in this patient. Exoftalmus was observed in 2011 after 6 years of monitoring with very slow progression of eyelid and extraocular infiltration. Therefore, prednisone was initiated in 2011, leading to cessation of exoftalmus. It is not known at present whether this is a permanent improvement with a suppression of histiocytary proliferation or whether this was a temporary improvement due to suppression of inflammatory changes in the xanthogranuloma with no effect on histiocytary proliferation. Progression during therapy with corticosteroids would warrant cytostatic treatment. The discussion section provides an overview of diseases caused by foamy histiocytes with illustrations and an overview of experiences with their treatment.
Key words:
foamy histiocytes – juvenile xathogranuloma – normolipemic xanthoma planum – adult onset periocular xanthoranuloma – adult onset asthma and periocular xanthogranuloma – necrobiotic xanthogranuloma – Erdheim-Chester disease – monoclonal gammopathy – 2-chlorodeoxyadenosin – cladribin – thalidomid – lenalidomid
Authors:
Z. Adam 1; K. Veselý 2; I. Motyčková 3; P. Szturz 1; R. Koukalová 4; Z. Řehák 4; A. Štouracová 5; J. Vaníček 6; M. Krejčí 1; L. Pour 1; L. Zahradová 1; R. Hájek 1; Z. Král 1; J. Mayer 1
Authors‘ workplace:
Interní hematoonkologická klinika Lékařské fakulty MU a FN Brno, pracoviště Bohunice, přednosta prof. MUDr. Jiří Mayer, CSc.
1; I. patologicko-anatomický ústav Lékařské fakulty MU a FN u sv. Anny Brno, přednostka prof. MUDr. Markéta Hermanová, Ph. D.
2; Oční klinika Lékařské fakulty MU a FN Brno, pracoviště Bohunice, přednostka prof. MUDr. Eva Vlková, CSc.
3; Oddělení nukleární medicíny, centrum PET Masarykova onkologického ústavu Brno, přednosta prim. MUDr. Karol Bolčák
4; Radiologická klinika Lékařské fakulty MU a FN Brno, pracoviště Bohunice, přednosta prof. MUDr. Vlastimil A. Válek, CSc.
5; Klinika zobrazovacích metod Lékařské fakulty MU a FN u sv. Anny Brno, přednosta MUDr. Jiří Vaníček, Ph. D.
6
Published in:
Vnitř Lék 2012; 58(5): 365-377
Category:
Case Reports
Overview
Histiocytární choroby způsobené proliferací a akumulací fagocytujících makrofágů (pěnitých makrofágů) mají velmi mnoho klinických podob. Dle WHO klasifikace krevních chorob jsou řazeny do skupiny s označením „juvenilní xantogranulom“. K lokalizovaným formám s benigním průběhem patří normolipemická xantomatóza, xantogranulom a nekrobiotický xantogranulom. Diseminované formy u dětí nabývají formy tzv. „diseminovaného juvenilního xantogranulomu“, u dospělých pak Erdheimovy-Chesterovy nemoci. Popisujeme případ pacientky, která si poprvé ve věku 53 let všimla žlutých granulomů na víčkách. Choroba pozvolna progredovala a ve věku 59 let postihuje nejen víčka, ale i jejich nejbližší okolí. Choroba dle MR a PET-CT zobrazení postupně infiltruje nitro orbity, orbitální tuk i okohybné svaly a začala již způsobovat exoftalmus na jednom oku. Propagace xantogranulomu do nitra orbity a infiltrace okohybných svalů může narušit funkce oka. Pacientka si v posledním roce stěžovala na kašel. Funkční plicní vyšetření prokázalo recentní astma bronchiale. Tyto nálezy odpovídají nosologické jednotce periokulárního xantogranulomu dospělých spojené s astmatem (adult onset asthma and periocular xantogranulomula). Jiné abnormality zatím nebyly u pacientky prokázány. Po 6 letech sledování s velmi pomalou progresí infiltrace víček a okohybných svalů vznikl v roce 2011 exoftalmus. Proto byla v roce 2011 zahájena aplikace prednisonu. Tato léčba vedla k vymizení exoftalmu. Zatím není jasné, zda šlo o trvalé zlepšení s potlačením histiocytární proliferace, nebo zda šlo pouze o dočasné zlepšení v důsledku potlačením zánětlivých změn v xantogranulomu bez ovlivnění histiocytární proliferace. Pokud by při kortikoterapii docházelo k progresi, bude nutná cytostatická léčba. V diskuzi přinášíme přehled chorob tvořených pěnitými histiocyty i s jejich obrázky a přehled zkušeností s jejich léčbou.
Klíčová slova:
pěnité histiocyty – juvenilní xantogranulom – normolipemická plošná xantomatóza – xantogranulom – nekrobiotický xantogranulom – Erdheim-Chesterova choroba – monoklonální gamapatie – 2-chlorodeoxyadenosin – kladribin – thalidomid – lenalidomid
Úvod
Základní termíny
Xantom je označení pro žlutou či oranžovo-žlutavou plochu, mírně vyvýšenou nad povrch s ostrou hranicí oproti nepoškozené pokožce. Xantomy postihují nejčastěji oblasti očních víček, ale také flexorové části končetin a trup. V některých případech jsou snad průvodním znakem hyperlipoproteinemie, ale častější jsou normolipemické formy, kdy xantom je výrazem nekontrolované proliferace a akumulace pěnitých histiocytů, obsahujících tuky.
Xantogranulom je označení pro žlutou či žlutooranžovou tkáň, která tvoří uzlíky (granulomy). Pokud v xantogranulomu dochází k nekrobióze a ulceracím, nazývá se nekrobiotický xantogranulom.
Histologický obraz
V histologickém obraze plochých xantomů dominují tzv. pěnité histiocyty, což jsou histiocyty naplněné tukovými částicemi. V histologickém obraze xantogranulomu jsou kromě pěnitých histiocytů s tukovými inkluzemi přítomny také zánětlivé buňky, lymfocyty, plazmocyty, makrofágy a obrovské mnohojaderné Toutonovy buňky [1].
Nejčastější lokalizace
Z neznámého důvodu dochází k akumulaci pěnitých histiocytů nejčastěji v oblasti periorbitální (víčka a tkáně navazující na víčka), ale může být postiženo i nitro orbity včetně okohybných svalů. Proto jsou to nejčastěji oční lékaři, k nimž přicházejí pacienti se žlutými morfami na víčkách a kolem víček s otázkou: „Co s tím?“. Proto také hodně publikací o této nemoci lze nalézt v oftalmologických časopisech. Xantomy a xantogranulomy nemusí mít vždy periorbitální lokalizaci. Mohou se objevit kdekoli, nejčastěji v oblasti kůže a podkoží. Proto druhá část informací pochází z dermatologických odborných časopisů. Dle příslušnosti k buněčné linii patří tyto nemoci dle WHO klasifikace do skupiny hematologických neoplazií, byť se o nich v hematologických časopisech píše jen výjimečně [2–4].
V následujícím textu popíšeme případ ženy s periorbitálním xantogranulomem a astmatem a v diskuzi přineseme přehled informací o této výjimečné nosologické jednotce o její léčbě.
Popis případu
Žena, narozená roku 1952, se k nám dostavila poprvé v červnu roku 2011, ve věku 59 let, na konziliární vyšetření. V anamnéze měla cholecystektomii a v posledních 5 letech se léčila pro hypertenzní nemoc. Jinak byla anamnéza bez zvláštností.
Asi před 6 lety, tedy v roce 2005, si poprvé všimla oteklých víček a tvorby žlutých morf na horním i dolním víčku. První histologie byla brána v nemocnici Kyjov, výsledek nemáme. Nicméně posléze bylo přistoupeno k odběru vzorku i z hlubších struktur na oční klinice v Brně. První hodnocení patologem znělo „zánětlivý pseudotumor“ a pacientka byla dlouhodobě léčena kortikoidy.
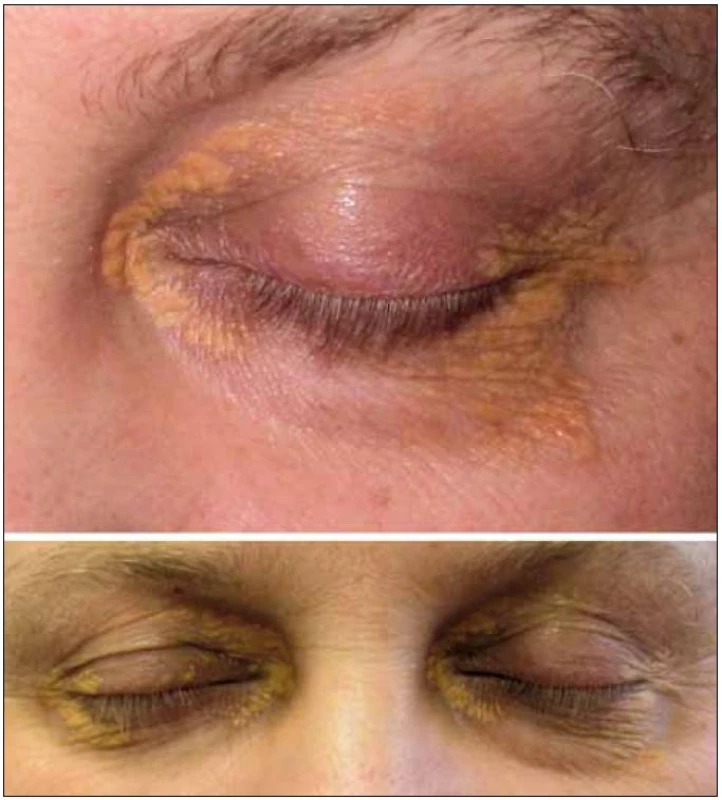
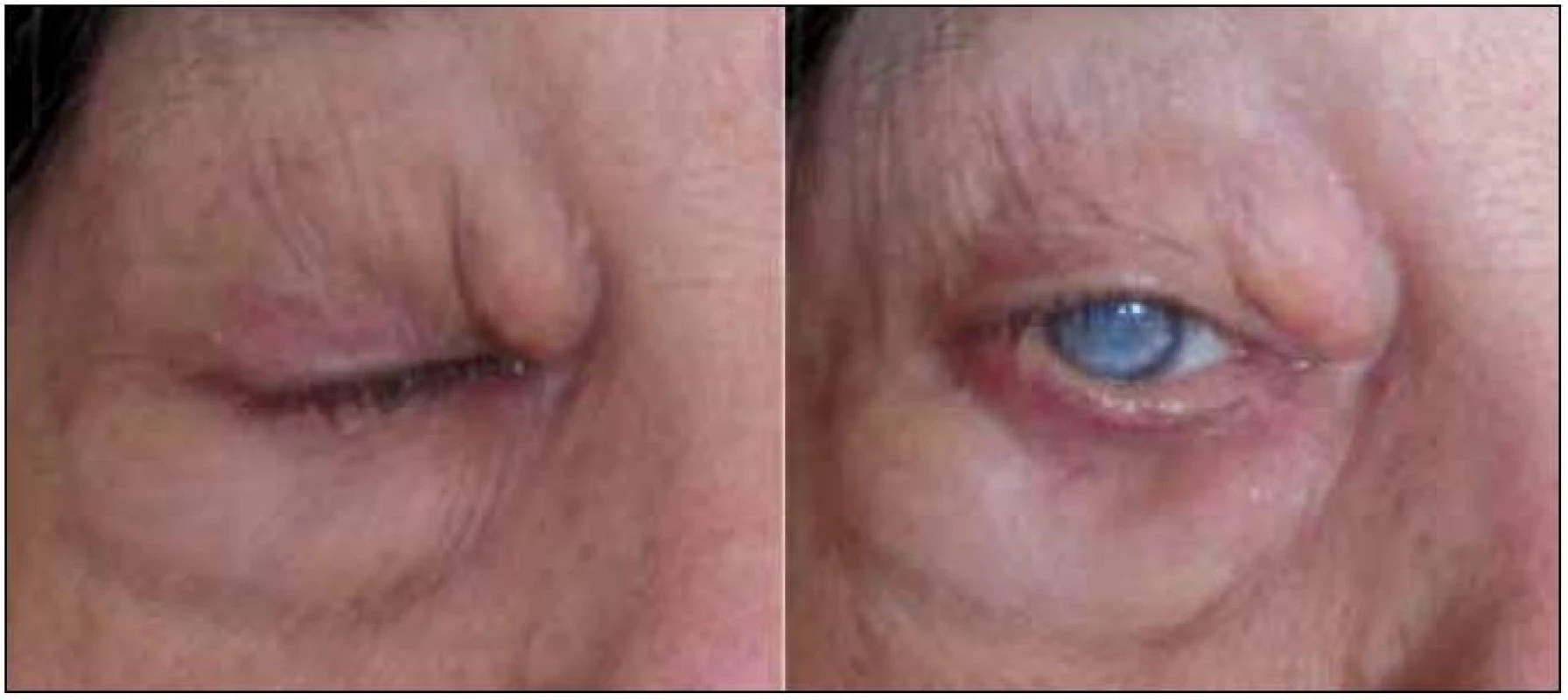
V červnu roku 2005 byla tato pacientka odeslána ke konziliárnímu vyšetření na naše pracoviště. V té době měla infiltrovaná a zduřelá horní i dolní víčka. Zduřelé byly i tkáně pod víčky. Nápadná byla žlutá barva. Nešlo však o pouhá povrchová xantelasmata, již při prvním pohledu bylo zřetelné, že indurace postihuje hlubší vrstvy. Na obr. 1–3 jsou zachyceny periokulární infiltráty této nemocné.

První CT zobrazení v roce 2005
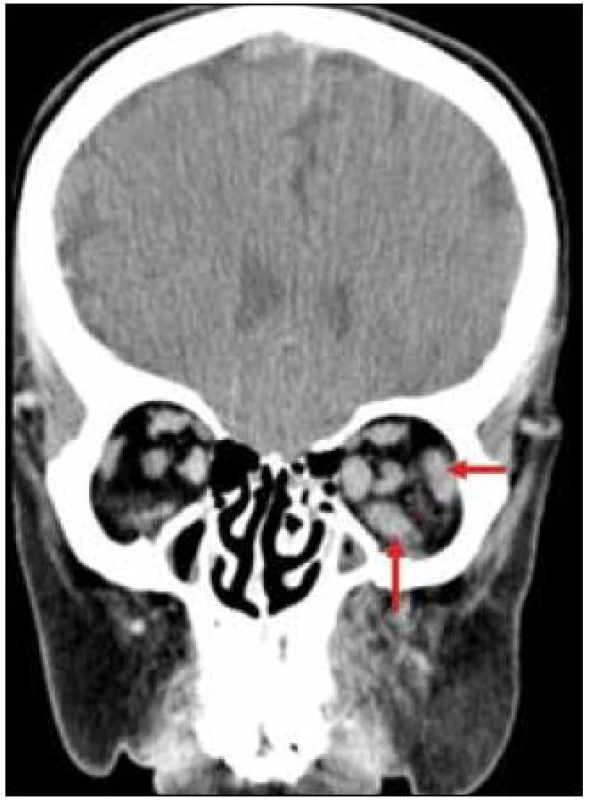
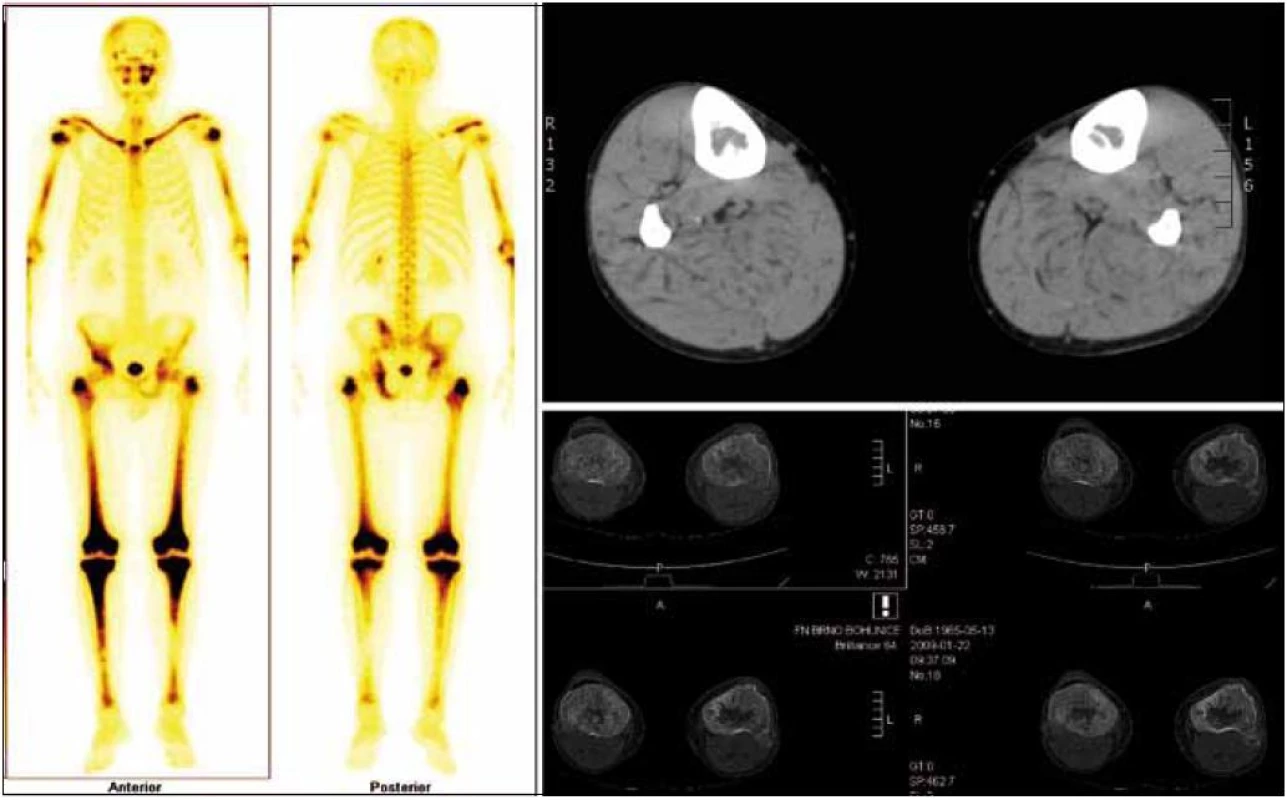
Již při první návštěvě oční kliniky bylo provedeno CT vyšetření orbit, které prokázalo zesílení některých okohybných svalů, zřejmě jako důsledek jejich infiltrace xantogranulomem, jak dokumentují obr. 4 a 5.
PET-CT vyšetření
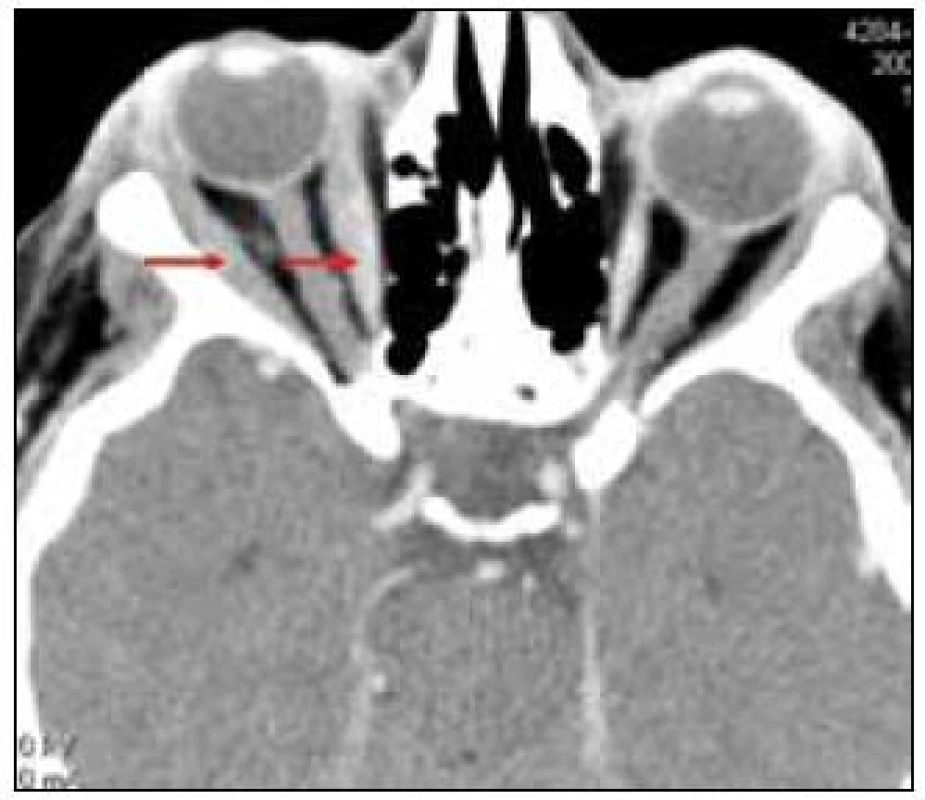
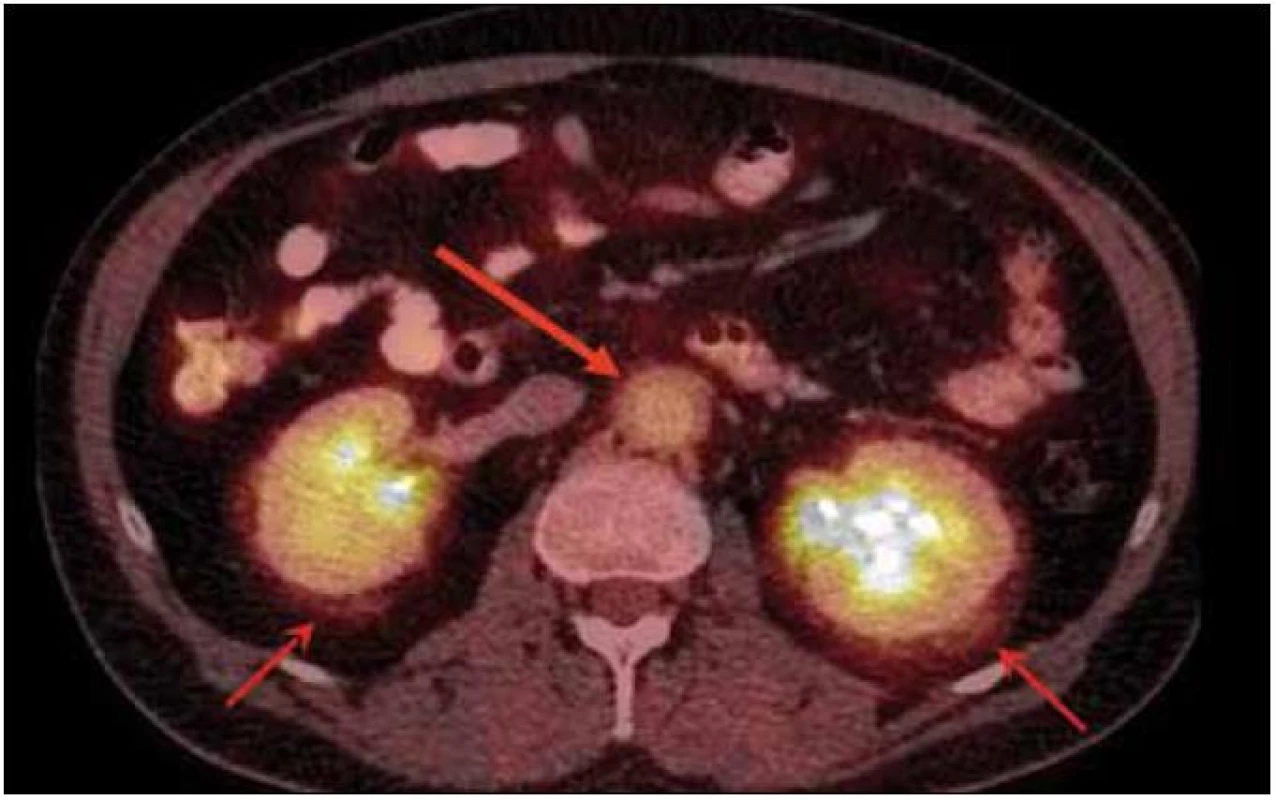
V rámci zjištění vývoje rozsahu procesu bylo provedeno v roce 2011 PET-CT zobrazení. V CT obraze byla infiltrovaná oblast pravého víčka s pozitivním korelátem, šíře víčka asi 1 cm. V CT obraze bylo naznačeno zbytnění m. rectus medialis l. dx a m. rectus inferior l. dx. Skelet byl bez patologie. Všechna v CT obraze zřetelná patologická ložiska mají v PET korelát. Relativně vyšší aktivita je i vlevo v m. rectus medialis, jak dokumentují obr. 6 a 7.

Kontrolní MR zobrazení
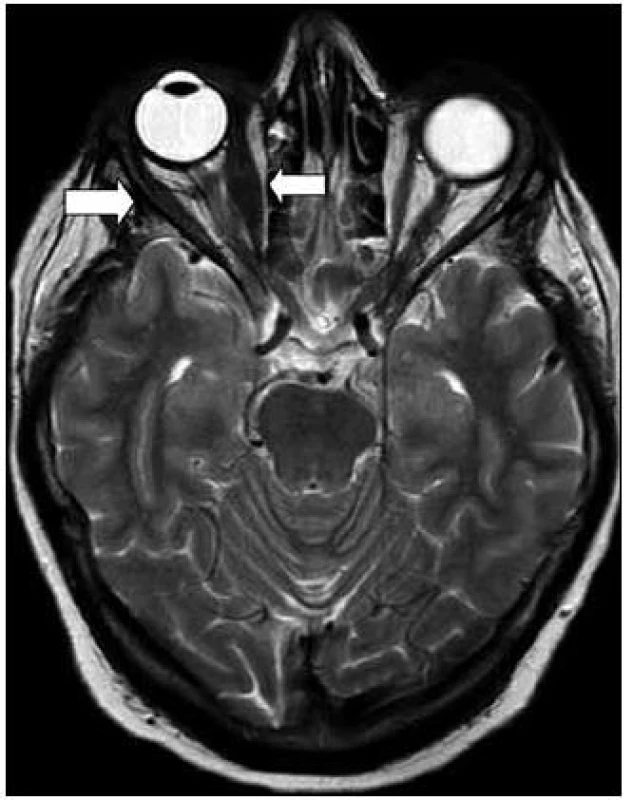
V roce 2011 bylo také v rámci pátrání po rozsahu nemoci provedeno MR zobrazení orbit.
Vpravo byl atypický signál přímých očních svalů, zejména dolního a vnitřního. V zadní porci orbity byl změněn i signál zevního přímého očního svalu. Svaly byly zesílené, postkontrastně se zvýšeně sytily. Vpravo byl dále otok měkkých tkání víček a byl zřetelný exoftalmus. Lehce prosáklá byla i struktura slzné žlázy vpravo (obr. 8 a 9). Při srovnání s CT nálezem z roku 2005 nelze prokázat zásadní změnu, byť jde o 2 odlišná zobrazení, které se obtížně srovnávají.

Druhé histologické hodnocení
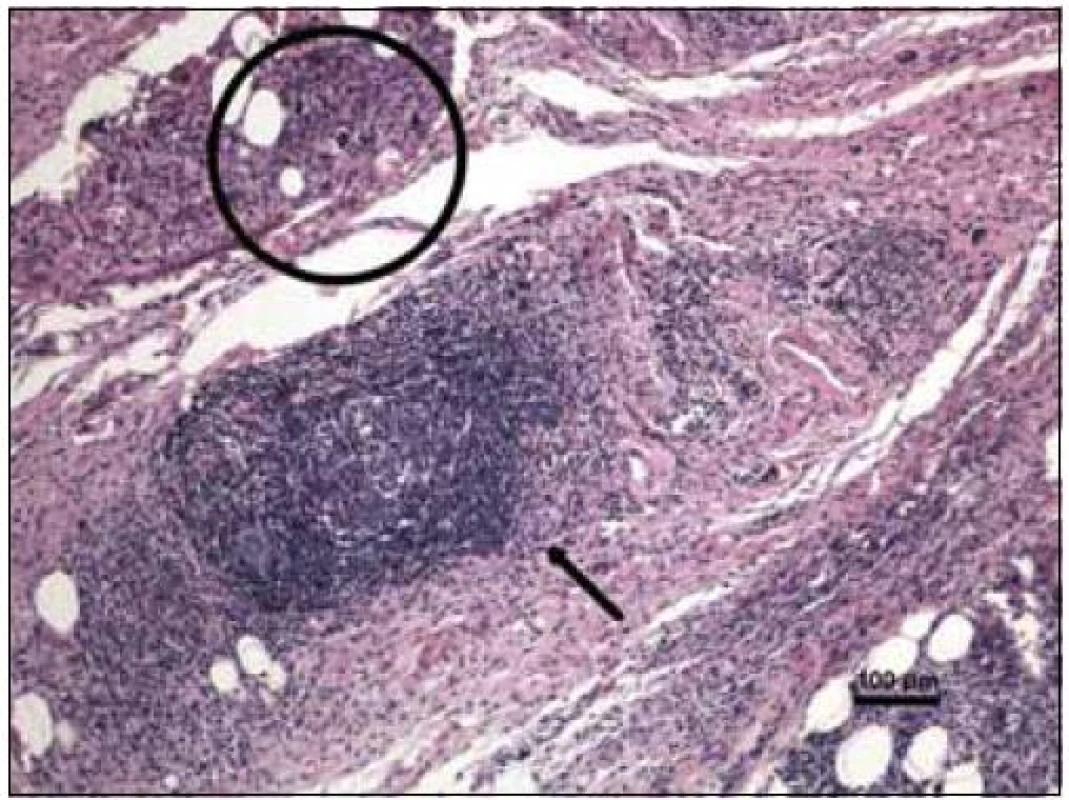
Vzhledem k tomu, že nález na víčkách odpovídal publikovaným případům xantogranulomu, požádali jsme patology o druhé čtení. Patologům jsme poskytli informaci o podobě nemoci a jejím rozsahu, což je pro ně důležité. Citujeme z popisu patologa při druhém čtení vzorku:
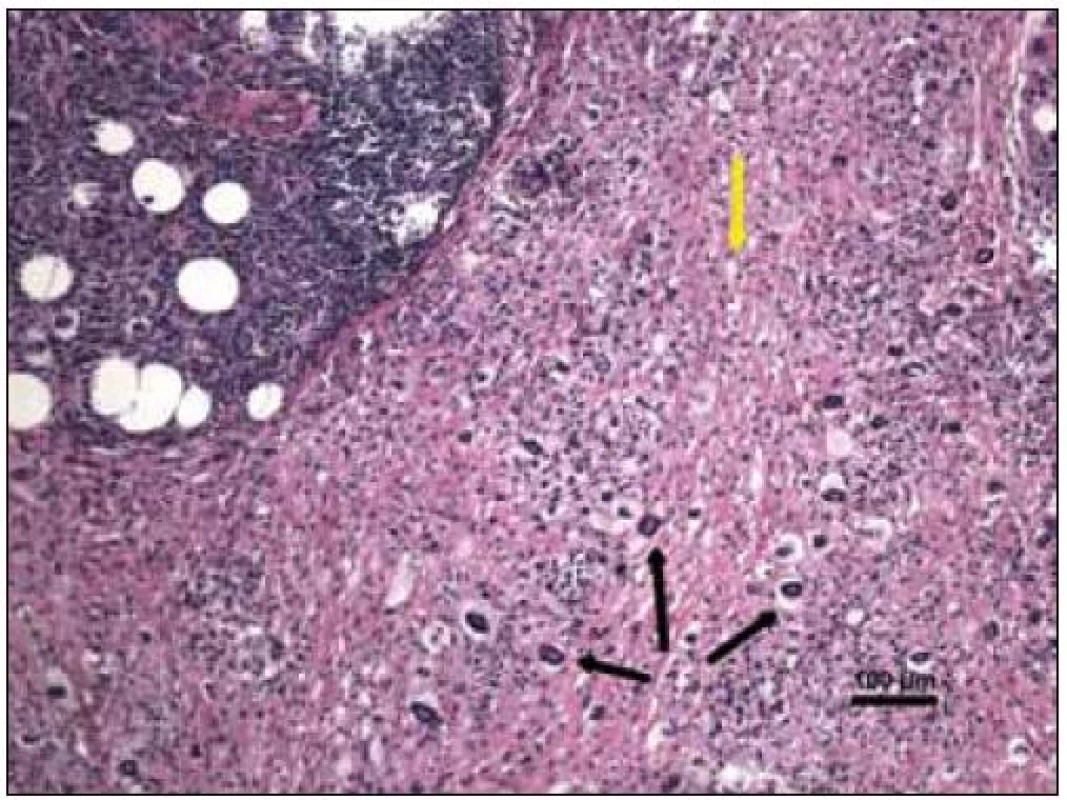
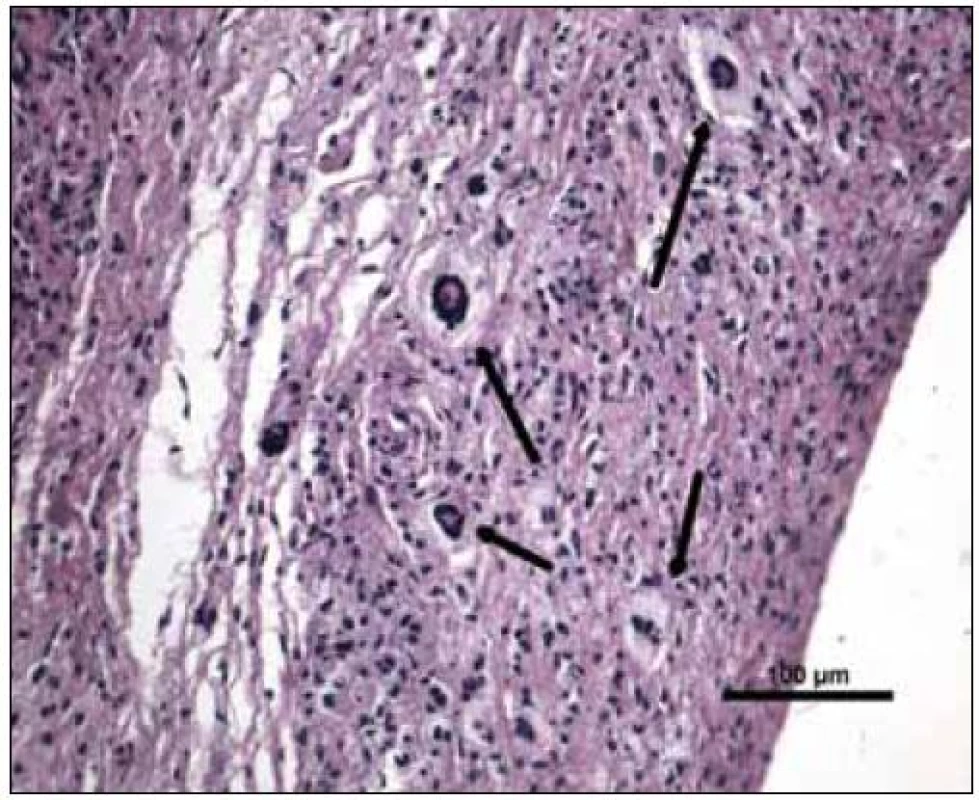
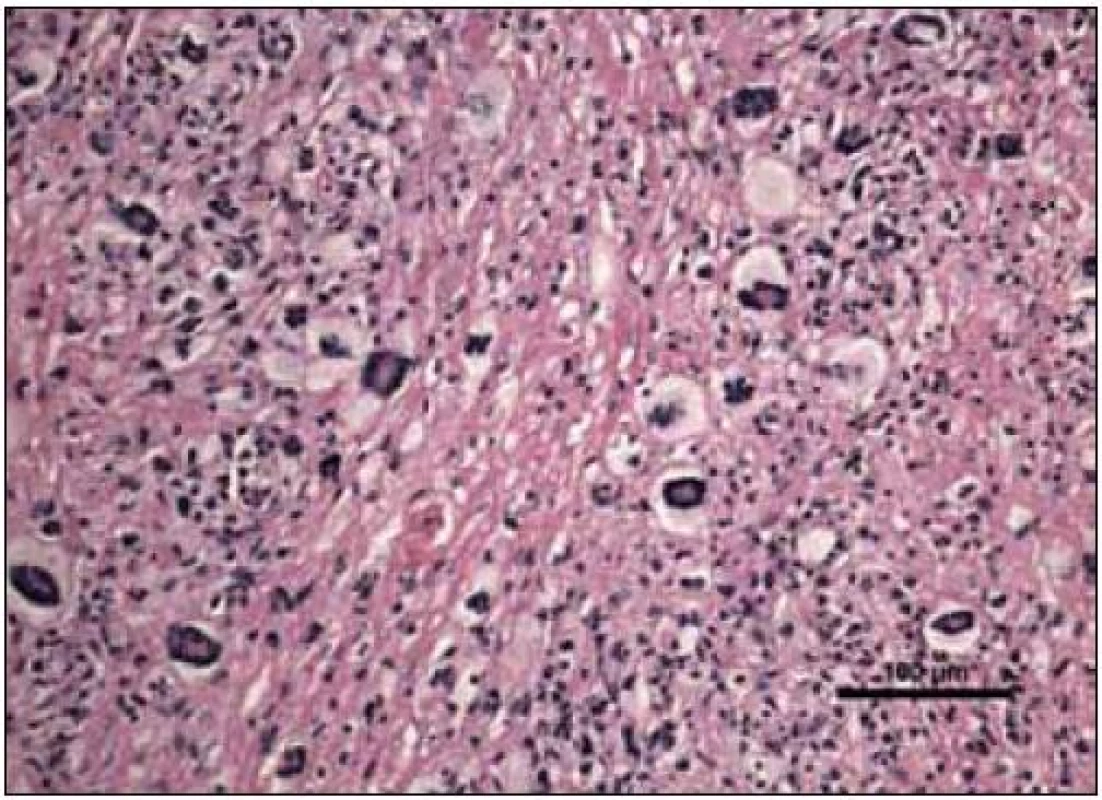
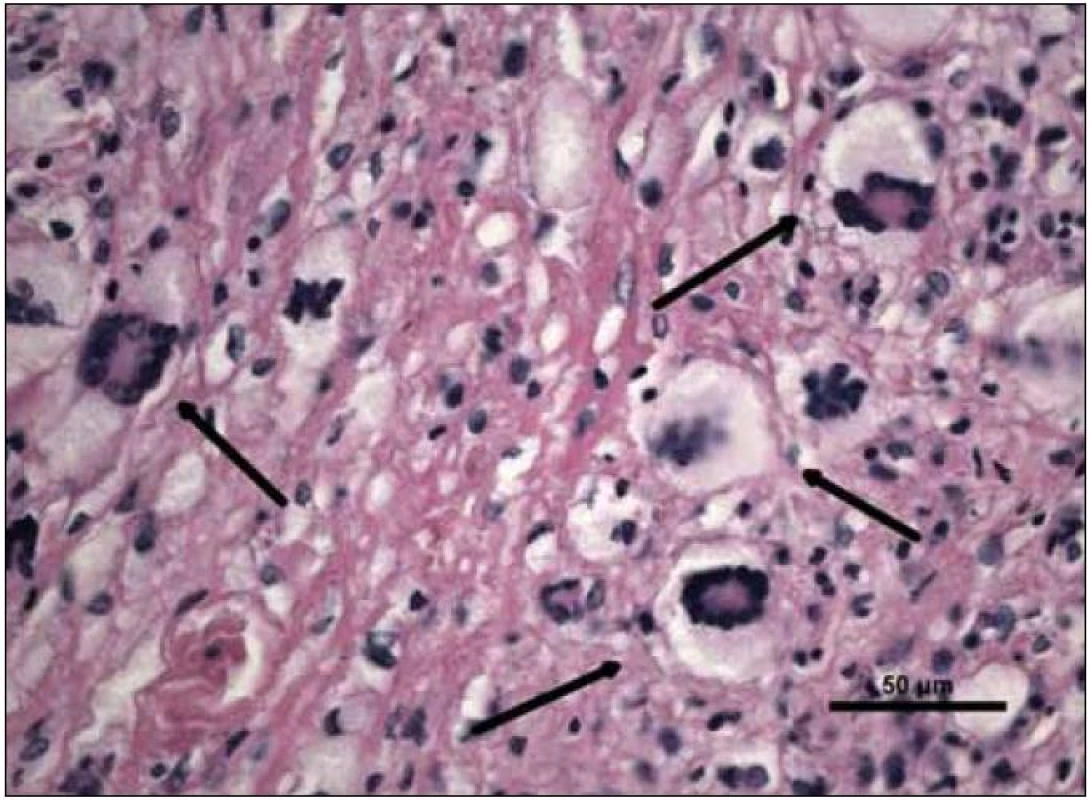
„Byla zachycena část kosterního svalu a fibroadipózní tkáň, s denzní zánětlivou celulizací, zahrnující malé lymfocyty, fokálně s tvorbou folikulárních lymfoidních agregátů, někdy s tvorbou germinálních center. Ve vzorku byly přítomny četné histiocytární elementy často pěnité a prominentní příměs obrovských mnohojaderných buněk Toutonova typu, s cirkulárně uspořádanými jádry, separovaných od buněčné membrány lemem jasné jemně vakuolizované cytoplazmy. Fokálně jsou drobné nepravidelné oblasti vaziva s hypereozinofilní barvitelností a paucitou buněk, morfologicky odpovídající nekrobióze vaziva. Disperzně je příměs eozinofilních a neutrofilních granulocytů. Imunohistologie: S-100 fokálně pozitivní, CD1a negativní (obr. 10–14). Závěr patologa: Adultní orbitální xantogranulomatózní choroba.“ Patolog upozornil, že diferenciálně diagnosticky je nutné zvážit 4 klinické jednotky, které patří do kategorie adultní xantogranulomatózní choroby a které nejsou histopatologicky spolehlivě odlišitelné:
- adultní xantogranulom,
- nekrobiotický xantogranulom,
- periokulární xantogranulom asociovaný s astmatem,
- Erdheimovu-Chesterovu chorobu.
Další vyšetření
Funkční plicní vyšetření prokázalo recentní astma bronchiale, tč. lehkou obstrukční ventilační poruchu bez respirační insuficience a bez poruchy plicní difuze.
Laboratorní vyšetření neprokázalo přítomnost kompletní molekuly monoklonálního imunoglobulinu ani klonálních lehkých řetězců. Kvantitativní vyšetření imunoglobulinu prokázalo fyziologické hodnoty. Krevní obraz, základní biochemie včetně triglyceridů a cholesterolu byly v normě.
Terapie
Pacientka byla odeslána k nám na konziliární vyšetření v době probíhající léčby prednisonem, kterou podali oční lékaři. Při opakované kontrole došlo k oploštění nálezu na víčkách a ústupu indurace podkoží pravé tváře a oblasti pravé parotidy a ustoupila porucha zraku způsobená infiltrací okohybného svalu.
U pacientky byla před podáním kortikoidů normální zraková ostrost s částečným omezením zorného pole vlevo vlivem zduření víček.
Ultrazvukové vyšetření orbit potvrzuje PET nález infiltrace a zesílení m. rectus internus vpravo na 7 mm, vlevo na 5,6 mm, ostatní svaly nevykazují odchylky od fyziologických tvarů a velikosti.
Nyní i při infiltraci očních svalů nemá pacientka diplopii. U pacientky proto oční lékaři plánují časté ultrazvukové zobrazovací kontroly. Při kontrole v září roku 2011 bylo postavení bulbů symetrické. Proto jsme se domluvili zatím ponechat pacientku na kortikoterapii. Teprve při nedostatečném efektu bychom zahájili léčbu cytostatiky.
Zda kortikoidy budou opravu přínosem, není jasné, protože použité dávky prednisonu mohou zmenšit intenzitu zánětlivé reakce v granulomu, tedy aktivitu lymfocytů a granulocytů, ale nemusí ovlivnit histiocytární proliferaci. Proto budeme pacientku pravidelně monitorovat klinicky i zobrazovacími vyšetřeními. V případně progrese infiltrace očních svalů či progrese exoftalmu by se mělo přikročit k cytostatické léčbě. Otázkou je, k jaké. Pro takové vzácné případy neexistuje žádné léčebné doporučení založené na klinických studiích. Existují pouze publikované popisy případů a ty je třeba přečíst a z nich vyvodit optimální postup. Proto v diskuzi uvádíme přehled všech zkušeností s léčbou této nemoci.
Diskuze
Přehled terminologie neoplazií tvořených z pěnitých histiocytů
Přehled maligních histiocytárních chorob přináší tab. 1.

Do tab. 1 jsme převzali všechny základní nosologické jednotky uváděné WHO klasifikací z roku 2008. Juvenilní xantogranulom je dle této WHO klasifikace jedna morfologická jednotka, definovaná přítomností pěnitých histiocytů. Do kategorie juvenilního xantogranulomu patří neoplazie z pěnitých histiocytů, které se vyskytují jak u dětí, tak u dospělých. Pěnité histiocyty obsahující lipidové inkluze žlutavé barvy, z čehož je odvozen název xantogranulom neboli žlutý granulom (xanthos je řecky žlutý). Nicméně neoplazie z pěnitých histiocytů mohou nabývat z pohledu klinické manifestace hodně divergentních forem a ze samotného histologického obrazu pěnitého histiocytu či celého xantogranulomu není patolog schopen specifikovat klinickou formu [1]. Současné poznání neoplazií z pěnitých histiocytů totiž neobjasňuje, proč pěnité histiocyty tvoří jednotlivé klinické formy onemocnění.
Histiocytární maligní choroby jsou vzácné a poznání jejich etiologie, patofyziologie, a tím i histopatologická diagnostika jsou méně pokročilé než u lymfomů. V případě maligních lymfomů jsou již známy různé chromozomální a genové abnormality, spojené s jednotlivými typy lymfomů. V případně neoplazií z pěnitých histiocytů tomu tak není.
Stanovení přesné klinické diagnózy neoplazie z pěnitých histiocytů vychází z popisu patologa, který obvykle ve zvýšené míře nalézá pěnité histiocyty, často i další buňky, lymfocyty, eozinofily, neutrofily, ale také obrovské mnohojaderné Toutonovy buňky. V některých místech pak nekrobiózu. V některých vzorcích xantogranulomů byla prokazatelná klonalita histiocytů [5,6].
Tato základní informace již musí klinickému lékaři říci, že se bude asi jednat o některou z četných forem xantomatózních či xantogranulomatózních onemocnění, a je na klinikovi, aby porovnal klinické a zobrazovací nálezy u svého pacienta s informacemi z odborné literatury o těchto chorobách a stanovil pak ve spolupráci s patologem specifickou diagnózu.
Pro choroby obsahující pěnité histiocytární buňky lze v literatuře nalézt podstatně více popisných názvů, než uvádí tab. 1. Terminologie dermatologické odborné literatury je velmi divergentní (xantogranulom, eruptivní xantogranulom, nekrobiotický xantogranulom, xanthoma disseminatum, papulární xantom, generalizovaný eruptivní histiocytom, progresivní nodulární histiocytom). Jejich diferenciální diagnostiku popisují četní autoři [5–10], ačkoli tyto termíny nejsou obsaženy ve WHO klasifikaci krevních chorob z roku 2008. Generalizovanou formou postižení celého člověka je tzv. Erdheimova-Chesterova nemoc, která může mít také periorbitální xantelasmata či xantogranulomy.
Formy proliferace a akumulace pěnitých histiocytů v oblasti periorbitální se v současnosti člení dle Sivak-Callcotta na následující formy [2,3]:
-
Lokalizované periorbitální formy:
- periokulární xantogranulom dospělých (adult onset periocular xanthogranuloma – AOX) bez vazby na monoklonální imunoglobulin,
- periokulární xantogranulomu dospělých spojený s astmatem (adult onset asthma and periocular xantogranulomula – AAPOX),
- nekrobiotický xantogranulom (necrobiotic xanthogranuloma – NBX) často asociovaný s monoklonální gamapatií,
- normolipemická plošná xantomatóza, často asociovaná s monoklonální gamapatií.
- Generalizované choroby z pěnitých histiocytů s možným postižením periorbitální krajiny:
- Erdheimova-Chesterova nemoc – postihující generalizovaně dospělé osoby,
- juvenilní diseminovaný xantogranulom – postihující děti.
Charakteristika forem postižení periorbitální krajiny pěnitými histiocyty
Periokulární xantogranulom dospělých
Xantogranulom dospělých představuje obvykle jedno izolované ložisko xantogranulomu, bez dalšího systémového postižení. Bývá diagnostikován u dospělých osob ve věku od 30 do 80 let. Xantogranulom je choroba, pro niž jsou charakteristické žluté až žlutooranžové kožní morfy charakteru plak, papul a nodulů, které se postupně slévají do větších ploch, průměru 0,5–2 cm a více. V těchto ložiscích jsou někdy přítomny teleangiektazie. Nemoc může mít pozvolný průběh se spontánními remisemi. To, zda potřebuje léčbu, záleží na lokalizaci. Pokud způsobuje poruchu zraku (keratitidu, exoftalmus), tak obvykle léčbu potřebuje [2,3,11,12].
Xantogranulom dospělých spojený s astmatem
Tato kombinace je velmi vzácná, Guo et al v roce 2009 našli v literatuře 22 popsaných případů [2]. Tato forma obvykle mívá bilaterální žlutooranžové elevované, indurované granulomy na víčkách, ale bez ulcerací. Choroba se může šířit do nitra orbity a postihovat okohybné svaly a tuk v očnici, jak ukazují obr. 1–3. Postižení se může rozšířit na slznou žlázu, případně po tváři dolů na příušní žlázu. Astma u postižených osob obvykle vzniká až po diagnóze periokulárního xantogranulomatózního postižení. Patofyziologická podstata tohoto onemocnění není jasná. Ale vznik astmatu byl pozorován i u některých dalších histiocytárních chorob, např. u Rosai-Dorfmanovy nemoci.
U xantogranulomatózní choroby spojené s astmatem u dospělých byly popsány současně i další abnormality, u 8 z 20 případů byla přítomna lymfadenopatie, u 5 ze 14 monoklonální gamapatie, u 1 z 21 maligní lymfoproliferace [2].
Pokud choroba nepostihuje zevní oční svaly, tak nemusí poškozovat zrak, infiltrace svalů však celý problém zásadně změní. Cornea byla postižena jen zcela výjimečně. Pokud byla poškozena slzná žláza, tak si pacienti stěžují na suchost oka [13–17].
Nekrobiotický xantogranulom
Pokud v xantogranulomu dochází k ulceracím, tak se používá termínu nekrobiotický xantogranulomu [18]. Pozor, kožní ložiska nemusí povinně vždy postihnout jenom periorbitální oblasti, mohou postihnout jak trup, tak i končetiny, jak ukazuje snímek bérce u pacienta s mnohočetným myelomem, u něhož byla histologicky potvrzena diagnóza nekrobiotického xantogranulomu na bérci (obr. 15). Periorbitální krajina je postižena v 80–85 % případů [19]. Proto se s očními komplikacemi obrací na oční specialisty 50–80 % všech pacientů s nekrobiotickým xantogranulomem. Infiltráty způsobují pokles víčka a omezují oční hybnost, někdy způsobují také diplopii, skleritidu, snížený vizus, keratitidu, exoftalmus. Infiltrace víček může způsobit ptózu a omezit mobilitu oka. Nekrobiotický xantogranulom byl poprvé popsán v roce 1980 Kossardem et al [19–22].
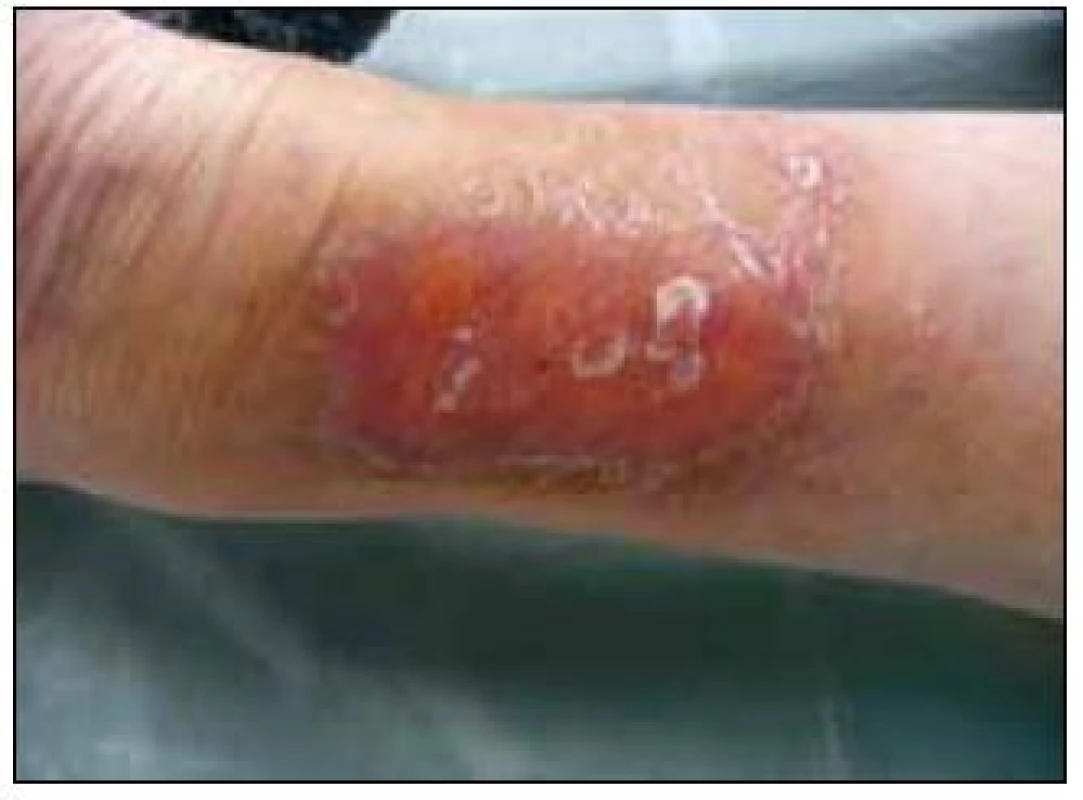
Nekrobiotický xantogranulom bývá také velmi často asociován s monoklonální gamapatií nejistého významu či s mnohočetným myelomem. Monoklonální imunoglobulin bývá obvykle typu IgG κ [23–26]. Výjimečně byl nekrobiotický xantogranulom popsán ve spojitosti s chronickou lymfatickou leukemií či nehodgkinským lymfomem [27]. V literatuře bylo publikováno přibližně 100 případů [11]. Nekrobiotické xantogranulomy jsou tvořeny pěnitými buňkami (histiocyty s tukovými inkluzemi, lymfocyty a obrovskými Toutonovými buňkami), které se jinak běžně nacházejí kolem cizích těles. Místy bývá přítomna kolagenní nekrobióza [28–31].
Xanthoma planum
Nejbenignější je zřejmě xantoma planum neboli ploché žluté plochy na kůži, obsahující velmi četné pěnité histiocyty. U této formy postihují pěnité buňky pouze kožní povrch, nedochází k ulceracím a nedochází ani k jejich expanzi do hlubších podkožních struktur. Tato normolipemická plochá xantomatóza může být asociována s monoklonální gamapatií.
Typickými klinickými projevy jsou žluté až oranžové plošné plaky s palpačně i vizuálně zřetelnými okraji. Typicky se xantomy objevují v obličeji v oblasti očí, na laterální straně krku a laterálních plochách trupu a dále na končetinách v oblastech flexorů (obr. 16). Ložiska obvykle bývají symetricky uložená a většinou nejsou symptomatická [10]. Histologickým podkladem jsou agregáty pěnitých histiocytů, ale může být přítomna i zánětlivá a granulomatózní komponenta. Parametry metabolizmu tuků jsou obvykle v normě.
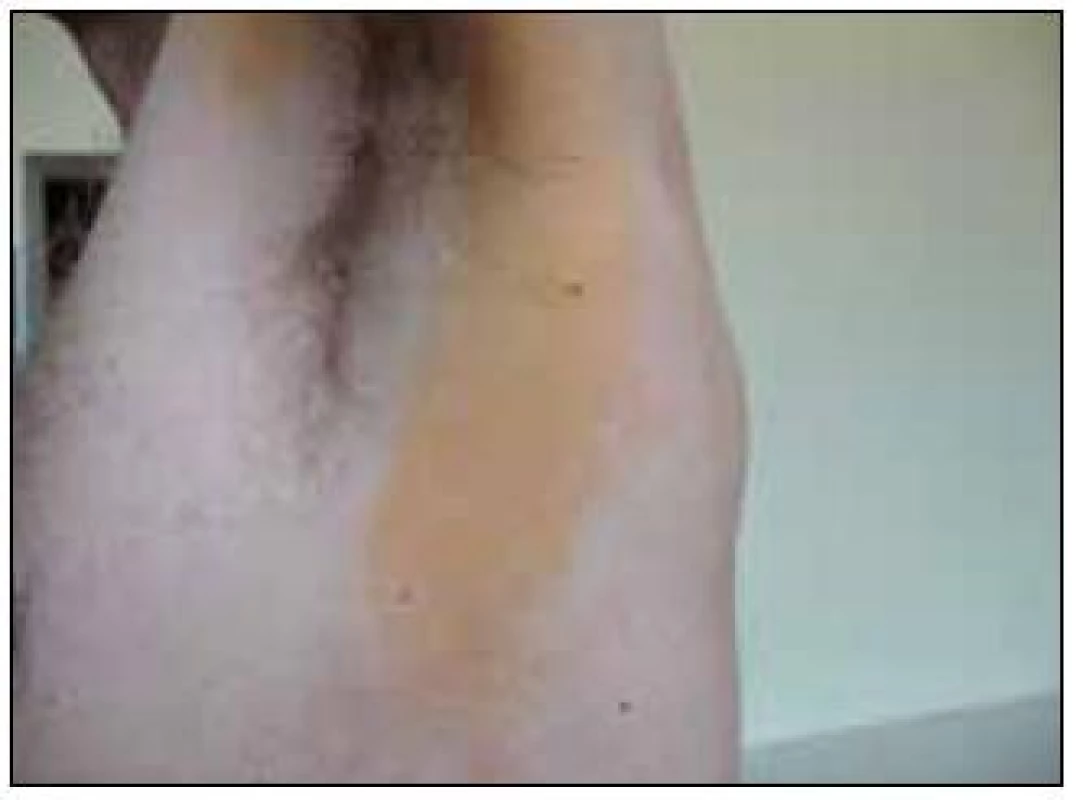
Již v roce 1966 si povšimli Lynch et al souvislosti normolipemické ploché xantomatózy s monoklonální gamapatií, což potvrdily i další zprávy [32,33]. Dle přehledu publikovaných případů provází difuzní normolipemickou xantomatózu obvykle monoklonální imunoglobulin obsahující λ řetězce [34–36].
Mimokožní projevy xantogranulomu
Xantogranulom může postihnout i mimokožní oblasti. Nejčastější byly makroskopicky a mikroskopicky podobné morfy nalezeny v respiračním traktu, laryngu, faryngu, bronších a v plicích. Další, často popisovanou lokalizací nemoci bylo srdce. Výjimečně byly masy xantogranulomu popsány v slzné žláze, slezině, kostní dřeni, ve frontální kosti lebeční, v příčně pruhovaných svalech a dále v okolí ledvin, ovarií a ve střevě [37–59]. Citovaná literatura dokládá, že nekrobiotický xantogranulom se může vyskytovat i jinde než na kůži obličeje, ta nemusí být vůbec postižena. Nekrobiotický xantogranulom může překvapit i v mimokožních lokalizacích.
Generalizované postižení organizmu
U dětí byl popsán případ žlutých kožních morf bez vazby na paraproteinemii jako xanthoma disseminatum a tato jednotka byla u popsaného dítěte považována za histiocytární proliferaci ze skupiny non-Langerhans cell histiocytóz. Šlo o 5letého chlapce, u něhož byly přítomny kožní xantomatózní projevy, byl však také přítomen diabetes insipidus a poškození kostí kalvy. Diabetes insipidus byl u těchto dětských forem popsán ve 40 % případů [60,61]. Těmto pediatrickým případům juvenilního diseminovaného xantogranulomu se může podobat v dospělosti průběh Erdheimovy--Chesterovy nemoci. Odpovídá tomu popis 49letého muže, který si stěžoval na patologickou únavu, vyšetření prokázalo patologické masy v oblasti retroperitonea. Histologie prokázala mezenterickou panikulitidu, se zánětlivou infiltrací tvořenou lymfocyty a makrofágy, nebyly však v této retroperitoneální mase popsány typické pěnité buňky, takže histologie odpovídala nespecifickému zánětu. Teprve později byly prokázány pěnité buňky retrobulbárně a diagnóza byla uzavřena jako Erdheimova-Chesterova nemoc [62].
Erdheimova-Chesterova nemoc postihuje diafýzy dlouhých kostí končetin, způsobuje v nich hyperostózu. V oblasti dutiny břišní dochází při této nemoci k fibrotizaci, fibrotizace a ztluštění stěny postihuje aortu a nemoc může mít infiltráty v CNS. Viděli jsme však u takového pacienta i periorbitální xantomy až xantogranulomy, jak dokládají obr. 17–19, kterými chceme čtenáři připomenout základní rysy Erdheimovy-Chesterovy nemoci. Proto při diferenciální diagnóze periorbitálního xantogranulomu je nutné vyloučit tuto chorobu postihující více orgánů a systémů.
Tímto chceme poukázat na to, že hranice mezi xantogranulomem, plochými normolipemickými xantomy a Erdheimovou-Chesterovou nemocí není nikterak ostrá. Všechny tyto nemoci obsahují pěnité histiocyty.
Patofyziologie je neznámá
Již před více lety byla vyslovena hypotéza, že monoklonální imunoglobulin (M-Ig) formuluje komplexy s cirkulujícími lipoproteiny a že tyto komplexy M-IgG – low-density lipoproteiny se deponují v kůži, kde jsou fagocytovány makrofágy, které nakonec vytvářejí ložiska pěnitých bu-něk [59,63,64].
Mastuura et al popsali hypotézu, že makrofágy jsou stimulovány (makrofágy stimulujícím faktorem nebo C3b částí komplementu) a to vede ke zvýšené fagocytóze lipidů makrofágy. Tuky napěchované makrofágy se pak ukládají v určitých typických „odpadních skládkách“, takže výsledkem jsou depozita makrofágů napěchovaných lipidovými partikulemi v určitých oblastech organizmu. Na vytvořené depozitum reaguje organizmus zánětlivou reakcí se vznikem obrovských Toutonových buněk [65].
Nejčastěji uváděná hypotéza vychází ze skutečnosti, že analýza ložisek xanto-granulomů prokázala monoklonální imunoglobulin vázaný na low-density lipoproteiny [66]. Tato hypotéza předpokládá, že monoklonální protein u těchto pacientů je funkčně podobný lipoproteinům, váže se svým Fc fragmentem na lipoproteinové receptory monocytů a indukuje formování xantomů či xantogranulomu [65,67].
Zcela ojedinělá byla zpráva Zenglera, který u 6 ze 7 studovaných pacientů našel přítomné borrelie [49]. V literatuře jsou popisovány i případně bez paraproteinu a jejich počet se odhaduje na 20 % [69].
Stanovení rozsahu choroby
Standardním postupem u onkologických chorob je po zjištění histologické podstaty nemoci stanovení rozsahu nemoci. Laboratorní vyšetření zde nepomáhají, ale základní je vždy provedení zobrazovacího vyšetření, nejlépe magnetické rezonance a PET-CT vyšetření [36,70–73]. Současně se stanovením rozsahu choroby je třeba pátrat po hematologických abnormalitách, jejich výskyt je u pacientů s výše popsanými chorobami vyšší než u průměrné populace [74].
Léčba
V literatuře lze nalézt četné léčebné postupy, které však byly jen výjimečně úspěšné. Nekrobiotický xantogranulom i difuzní ploché xantomy představují chronické, pomalu progredující onemocnění. Operační léčba nebyla nikdy dlouhodobě úspěšná. Tento literární údaj můžeme potvrdit jedním případem: setkali jsme se s pacientkou, která měla stejnou chorobu. Operatéři se ji snažili exkochleovat infiltráty z víček. Paní podstoupila dvě operace víček s cílem zmenšit rozsah infiltrátu. Pacientka nebyla po operacích schopna dovřít víčka a docházelo k vysychání rohovky – k lagoftalmu, takže je nyní úplně slepá. V současnosti se u ni zvažuje transplantace rohovky. Pokud však nedovře víčka, tak ani transplantace nemusí přinést trvalé zlepšení zraku a vše se může opakovat. Oko této pacientky s lagoftalmem – po dvou operačních zákrocích na víčkách znázorňuje obr. 20. V popisu skupiny nemocných, publikovaném Mehreganem a Winkelmannem v roce 1992, byla nejčastěji léčebná odpověď popisována po chlorambucilu, léčebné odpovědi po melfalanu nebyly tak časté. Po nitroložiskové aplikaci kortikoidů nedocházelo ke zlepšení. Zdravotní stav jednoho pacienta se zlepšil po plazmaferéze [24].
V popisech případů, které byly zveřejněny po roce 1992, byly pro léčbu použity kortikosteroidy, alkylační cytostatika, antimetabolity, antimikrobiální léky a jiné postupy s variabilními výsledky. Pokud je po některém léčebném postupu popsáno zlepšení, tak velmi často není uvedena délka trvání léčebné odpovědi. Výsledky některých léčebných postupů se pokusíme stručně sumarizovat.
Kortikosteroidy
Zevní aplikace kortikosteroidů (masti, krémy) na plochy xantogranulomu nevedla k léčebnému úspěchu [27,63,75]. Několik pacientů odpovědělo na nitroložiskovou aplikaci kortikosteroidů [76,77] a na systémovou aplikaci kortikosteroidů [69,79–82], ale po této léčbě v některých případech došlo k recidivě nemoci [83].
Alkylační cytostatika
Alkylační cytostatika jsou nejčastěji testované léčebné postupy. Obvykle jsou podávána v monoterapii nebo v kombinaci s glukokortikosteroidy.
Po léčbě cyklofosfamidem bylo u 4 léčených popsáno zlepšení, zatímco u dalších 4 nebyl pozorován žádný přínos této léčby. Cyklofosfamid byl přínosem také u podob-né nemoci, xanthoma dissemina-tum [76,84–91].
Z pacientů, kteří byli léčeni chlorambucilem, došlo u 6 ke zlepšení [18,19,41,86,90,92] a u 3 se nedostavil žádný léčebný efekt [79,85].
Melfalan byl snad používán již proto, že se používá u mnohočetného myelomu. Uvádí se, že asi 10 ze 12 pacientů se po léčbě melfalanem zlepšilo [95–100], ačkoli v 1 případě došlo k recidivě nemoci.
Ve 4 případech nekrobiotického xantogranulomu byla podána kombinovaná chemoterapie pro jinou přítomnou hematologickou nemoc, zpočátku došlo k regresi xantogranulomu, ale po ukončení léčby kožní morfy recidivovaly [76,101].
Antimetabolity
Po metotrexátu nebyla popsána léčebná odpověď, zatímco po azathioprinu s kortikosteroidy bylo popsáno zlepšení [41,102]. Pro zhodnocení účinku antimetabolitů je však málo údajů.
Vinblastin
U dětských forem xanthoma disseminatum bez monoklonálního Ig se používá kortikoterapie a dále léčba vinblastinem jako u histiocytózy z LCH buněk [60].
Interferon α
Byl použit a v 1 případě se uvádí zlepšení [81,103].
Operační léčba
Plazmaferéza také nepřinesla očekávaný užitek [104]. Mechanická abraze nebo ablativní laserová léčba je jednou z mála forem, jak léčit normolipemickou xantomatózu [105,106].
Léky ze skupiny IMIDS – thalidomid a lenalidomid
Thalidomid byl použit v kombinaci se steroidy a uvádí se, že došlo ke zlepšení očních příznaků [108]. Značný efekt v této indikaci prokázal lenalidomid, s jehož léčbou byla zvládnuta generalizovaná forma nekrobiotického xantogranulomu [109].
2-chlorodeoxyadenosin (kladribin)
Kladribin, synonymem 2-chlorodeoxyadenosin, je derivát adenosinu, u něhož byl na 2. uhlíku purinového kruhu vodík substituován chlórem. Tato změna je dostatečná k tomu, aby zabránila deaminaci 2-chlorodeoxyadenosinu. Kladribin je v buňce metabolizován a fosforylován až na 2-chloroadenosintrifosfát, který je vlastní účinnou formou léku. Akumulace deoxyadenosintrifosfátu je největší v buňkách, jejichž aktivační (fosforylační) enzym, deoxycytidinkináza, má největší aktivitu, zatímco inaktivační (defosforylační) enzym, cytoplazmatická 5-nukleotidáza, má nejmenší aktivitu. Velmi příznivý poměr uvedených 2 enzymů pro účinnost kladribinu je v klidových a proliferujících lymfocytech, v monocytech, v histiocytech a také v Langerhansových buňkách. V nich dosahují nitrobuněčné koncentrace 2-chloroadenosintrifosfátů několiksetkrát vyšší hladiny, než je jeho plazmatická koncentrace. Díky této vlastnosti je kladribin vysoce selektivním cytostatikem, má intenzivní cytotoxický účinek na pomalu progredující maligní lymfatické a histiocytární buňky, tedy i na fagocytující makrofágy. V buňkách ostatních tkání je akumulace 2-deoxyadenosintrifosfátu malá, takže na ně cytotoxicky nepůsobí. Kladribin proniká v účinné dávce do CNS, intratékální koncentrace kladribinu dosahuje 25 % plazmatické koncentrace, což je dostačující hladina pro tumoricidní efekt na granulomy z lymfoidních či histiocytárních buněk. Biologická dostupnost podkožní aplikace je 100 %, takže je možné jak nitrožilní, tak podkožní podání. Farmakologické vlastnosti kladribinu (100% resorpce z podkoží, několikasetnásobná akumulace v cílových senzitivních buňkách a 15–30hodinový intracelulární poločas) umožňují aplikaci formou podkožních injekcí.
Kladribin se osvědčil u dětí s juvenilním xantogranulomem a u 2 případů s Erdheimovou-Chesterovou nemocí. První popsal podání kladribinu v této indikaci Sheidow v roce 2000 [109]. Na tuto zkušenost navázali Myra et al, kteří v rámci iniciální léčby svého pacienta podali etoposid, při absenci léčebné odpovědi pak cyklofosfamid a cyklosporin. Když uvedené 3 testované léčebné alternativy nebyly dostatečně účinné, tak jako 4. léčebnou linii podávali pacientovi kladribin v dávce 0,14 mg/kg/den 5 dní po sobě kontinuální infuzí Hickmanovým katetrem. Po 2 cyklech byla zřetelná léčebná odpověď. Celkem aplikovali 6 cyklů a uvádí, že při hodnocení po 2 letech stále trvala léčebná odpověď [110]. Pozitivní zkušeností s kladribinem v této indikaci uvádí také Aouba [111].
Blouin et al popisují podání 2-chlorodeoxyadenosinu a cytosin-arabinosidu po selhání předchozí léčby kombinací etoposidu, kortikoidu a vinblastinu. Tato léčba vedla u pacienta s juvenilním xantogranulomem ke kompletní remisi [112].
Podobně u dalšího dítěte s postižením CNS juvenilním xantogranulomem byla léčba zahájena prednisonem a vinblastinem, byla bez efektu a teprve až aplikace kladribinu v monoterapii navodila léčebnou odpověď [113,114]. Popsán je ale i případ, kdy buňky juvenilního xantogranulomu byly na tuto léčbu zcela rezistentní [115]. Velmi dobrý efekt 2-chlorodeoxyadenosinu u dospělého muže trpícího generalizovanou formou juvenilního xantogranulomu jsme doložili na opakovaném PET-CT vyšetření [116].
V roce 2011 se objevila první zpráva o úspěšné léčbě normolipemického xanthoma planum kladribinem [117].
Vysokodávkovaná chemoterapie
Vysokodávkovaná chemoterapie s autologní transplantací krvetvorných buněk byla zatím použita zcela výjimečně a z první pozitivní výsledek nelze zevšeobecňovat [118].
Nitrožilní podávání gamaglobulinů
Pacient dostával nitrožilní imunoglobuliny v dávce 0,5 g/kg/den po 4 dny po sobě v měsíčních intervalech. Po 4 cyklech této léčby došlo ke kompletní regresi [119].
Závěry pro praxi
- Proliferace a akumulace pěnitých histiocytů, naplněných tukovými inkluzemi, může způsobit jak lokalizované onemocnění typu žluté plochy či granulomu (xantomu, xantogranulomu či nekrobiotického xantogranulomu), tak systémové onemocnění. Systémové onemocnění z pěnitých histiocytů se u dětí nazývá diseminovaný juvenilní xantogranulom a u dospělých Erdheimova--Chesterova nemoc.
- Při nálezu lokalizovaného xantogranulomu je nutné zobrazovacím vyšetření vyloučit další ložiska v organizmu. Protože byla zjištěna častější asociace s monoklonálními gamapatiemi či jinými krevními chorobami, je nutné provést vyšetření s cílem odhalení těchto možných komplikaci.
- Jakmile lokalizovaná forma xantogranulomu začne dělat klinické problémy, je indikována léčba. Lze použít kortikoidy, dávky bychom odvodili od lymfoproliferativních onemocnění, u nichž se preferuje podávat opakovaně v krátkých intervalech vysoké dávky před podáváním nižších dávek v dlouhých intervalech.
- Z cytostatik lze otestovat alkylační cytostatika, ale ne vždy přinesou žádoucí účinek. Dle posledních publikovaných zpráv se zdá, že 2-chlorodeoxyadenosin je účinnější při léčbě těchto chorob než alkylační cytostatika. Dalšími novými léky pro tyto nemoci jsou léky ze skupiny IMIDS (immunoregulatory drugs) thalidomid a lenalidomid.
Práce byla vypracována v rámci aktivity následujících grantů: výzkumného záměru MZ ČR: FUNDIN MZ0MOU2005, výzkumného záměru MŠMT MSM0021622434, specifického výzkumu MUNI/A/0784/2011 a grantů IGA MZd NT11154, NT12130 a NT12215.
prof. MUDr. Zdeněk Adam, CSc.
www.fnbrno.cz
e-mail: z.adam@fnbrno.cz
Doručeno do redakce: 1. 8. 2011
Přijato po recenzi: 24. 10. 2011
Sources
1. Plank L. Diagnostická patológia non-Langerhans cell histiocytóz. Vnitř Lék 2010; 56: (Suppl 2): 2S39–2S63.
2. Guo J, Wang J. Adult ortbital xantogranulomatous disease: review of the literature. Arch Pathol Lab Med 2009; 133 : 1994–1997.
3. Sivak-Callcott JA, Tootman J, Rasmussen SL et al. Adult xantogranulomatous diseaase of the orbit and ocular adnexa: new imunohistochemical findings and clinical review. Brit J Ophthalmol 2006; 90 : 602–608.
4. Vick VL, Wilson MV, Fleming JC et al. Orbital and eyelid manifestation of xanthogranulomatous disease. Orbit 2006; 25 : 221–225.
5. Janssen D, Fölster-Holst R, Harms D et al. Clonality in juvenile xanthogranuloma. Am J Surg Pathol 2007; 31 : 812–813.
6. Decaux O, Laurat E, Perlat A et al. Systemic manifestations of monoclonal gammopathy. Eur J Intern Med 2009; 20 : 457–461.
7. Alexander AS, Turner R, Uniate L et al. Xanthoma diseminatum, a case report and literature review. Br J Radiology 2005; 78 : 153–157.
8. Vick VL, Wilson MW, Fleming JC et al. Orbital and eyelid manifestations of xanthogranulomatous diseases. Orbit 2006; 25 : 221–225.
9. Asarch A, Thiele JJ, Ashby-Richardson H et al. Cutaneous disseminated xantogranulomu in adult. A case report and review of the literature. Cuits 2009; 83 : 243–249.
10. Altman J, Winkelmann RK. Difuse normolipemic planae xanthoma: Generalized xanthelasma. Arch Dermatol 1962; 85 : 633–640.
11. Mencía-Gutiérrez E, Gutiérrez-Diaz E, Madero-García S. Juvenile xanthogranuloma of the orbit in an adult. Ophthalmologica 2000; 214 : 437–440.
12. Rouhiainen H, Nerdrum K, Puustjärvi T et al. Xanthogranuloma juvenile – a rare cause of orbital swelling in adulthood. Ophthalmologica 1992; 204 : 162–165.
13. Cavallazzi R, Hirani A, Vasu TS et al. Clinical manifestations and treatment of adult-onset asthma and periocular xanthogranuloma. Can Respir J 2009; 16 : 159–162.
14. Jakobiec FA, Mills MD, Hidayat AA et al. Periocular xanthogranulomas associated with severe adult-onset asthma. Trans Am Ophthalmol Soc 1993; 91 : 99–129.
15. Hammond MD, Niemi EW, Ward TP et al. Adult orbital xanthogranuloma with associated adult-onset asthma. Ophthal Plast Reconstr Surg 2004; 20 : 329–332.
16. Jakobiec FA, Mills MD, Hidayat AA et al. Periocular xantogranulomas associated with severe adult-onset asthma. Trans Am Ophthalmol Soc 1993; 91 : 99–125.
17. Sivak-Callcott JA, Lim WK, Seah LL et al. Xantogranulomatous disease in the lacrimal gland. Br J Ophthalmol 2005; 89 : 1375–1377.
18. Wood AJ, Wagner MV, Abbott JJ et al. Necrobiotic xanthogranuloma: a review of 17 cases with emphasis on clinical and pathologic correlation. Arch Dermatol 2009; 145 : 279–284.
19. Kossard S, Winkelmann RK. Netrobiotic xanthogranuloma with paraproteinemia. J Amer Acad Dermatol 1980; 3 : 257–270.
20. Rayner SA, Duncombe AS, Keefe M et al. Necrobiotic xanthogranuloma occurring in an eyelid scar. Orbit 2008; 27 : 191–194.
21. Karcioglu ZA, Sharara N, Boles TL et al. Orbital xanthogranuloma: clinical and morphologic features in eight patients. Ophthal Plast Reconstr Surg 2003; 19 : 372–381.
22. Cornblath WT, Dotan SA, Trobe JD et al. Varied clinical spectrum of necrobiotic xanthogranuloma. Ophthalmology 1992; 99 : 103–107.
23. Ugurlu S, Bartley GB, Gibbon LE. Necrobiotic xanthogranbuloma, long-term outcome of ocular and systemic involvement. Am J Ophthalmol 2000; 129 : 651–657.
24. Mehregan DA, Winkelmann RK. Necrobiotic xanthogranuloma. Arch Dermatol 1992; 128 : 94–100.
25. Finan MC, Winkelmann RK. Necrobiotic xanthogranuloma with paraproteinemia. A review of 22 cases. Medicine (Baltimore) 1986; 65 : 376–388.
26. Martínez Fernández M, Rodríguez Prieto MA, Ruiz Gonzalez I. Necrobiotic xanthogranloma associated with myeloma. J Eur Acad Dermatol Venereol 2004; 18 : 328–331.
27. Oumeish OY, Oumeish I, Tarawneh M et al. Necrobiotic xanthogranuloma associated with paraproteinemia and non-Hodgkin’s lymphoma developing into chronic lymphocytic leukemia: the first case reported in the literature and review of the literature. Int J Dermatol 2006; 45 : 306–310.
28. Winkelmann RK, Dahl PR, Perniciaro C. Asteroid bodies and other cytoplasmic inclusions in necrobiotic xanthogranuloma with paraproteinemia. J Am Acad Dermatol 1998; 38 : 967–970.
29. Randell PL, Heenan PJ. Necrobiotic xanthogranuloma with paraproteinaemia. Australas J Dermatol 1999; 40 : 114–115.
30. Robertson DM, Winkelmann RK. Ophthalmic features of necrobiotic xanthogranuloma with paraproteinemia. Am J Ophthalmol 1984; 97 : 173–183.
31. Martínez Fernandez M, Rodríguez Prieto MA, Ruíz Gonzáles I et al. Necrobiotic xanhtogranuloma associated with myeloma. J Eur Acad Dermatol Venereol 2004; 18 : 328–331.
32. Lynch PJ, Winkelmann RK. Generalised plane xanthoma and systemic disease. Arch Dermatol 1966; 93 : 639–640.
33. Williford PM, White WL, Jurizzo JL et al. The spektrum of normolipemic plane xanthomas. Amer J Dermatopahol 1993; 15 : 572–575.
34. Taylor JS, Lewis LA, Battle JD et al. Plane xanthoma and multiple myeloma with lipoprotein-paraprotein complexing. Arch Dermatol 1978; 114 : 425–431.
35. Marcoval J, Moreno A, Bordas X et al. Diffuse plane xanthoma: clinicopathologic study of 8 cases. J Am Acad Dermatol 1998; 39 : 439–442.
36. Adam Z, Zahradová L, Krejčí M et al. Difuzní plošná normolipemická xantomatóza a nekrobiotický xantogranulom, asociované s monoklonální gamapatií – přínos PET-CT pro stanovení rozsahu nemoci a zkušenosti s léčbou. Popis dvou případ a přehled literatury. Vnitř Lék 2010; 56 : 1159–1168.
37. Boström J, Janssen G, Messing-Jünger M et al. Multiple intracranial juvenilie xanthogranulomas. Case report. J Neurosurg 2000; 93 : 335–341.
38. Fernández-Herrera J, Pedraz J. Necrobiotic xanthogranuloma. Semin Cutan Med Surg 2007; 26 : 108–113.
39. Machado S, Alves R, Lima M et al. Cutaneous necrobiotic xanthogranuloma (NXG): succesfully treated with low dose chlorambucil. Eur J Dermatol 2001; 11 : 458–462.
40. Hunter L, Burry AF. Necrobiotic xantothogranuloma. A systemic disease with paraproteinemia. Patology 1985; 17 : 533–536.
41. Fortson JS, Schroeter AL. Necrobiotic xanthogranuloma with IgA paraproteinemia and extracutaneous involvement. Amer J Dermatopathol 1990; 12 : 579–584.
42. Bara C, Barbarot S, Hamitou M et al. Systemic necrobiotic xanthogranuloma with initial pericaridal and pulmonary involvement. Ann Dermatol Venereol 2003; 130 : 341–344.
43. Novak PM, Robins TO, Winkelmann RK. Necrobiotic xanthogranuloma with myocardial lesions and nodular transformation of the liver. Hum Pathol 1992; 23 : 195–196.
44. Shah KC, Poonnoose SI, Georgie R et al. Necrobiotix xanthogranuloma with cutaneous and cerebral manifestaion. Case report and review of the literature. J Neurosurg 2004; 100 : 1111–1114.
45. Umbert I, Winkelmann RK. Necrobiotic xanthogranuloma with cardiac involvement. Br J Dermatol 1995; 133 : 438–443.
46. Yasukawa K, Kato N, Hamasaka A et al. Necrobiotic xanthogranuloma: isolated skleletal and muscle involvement and unusual changes J Am Acad Dermatol 2005; 52 : 729–731.
47. Winkelmann RK, Litzow, MR, Umbert IJ et al. Giant cell granulomatous pulmonary and myocardial lesions in necrobiotic xanthogranuloma with paraproteinemia. Mayo Clin Proc 1997; 72 : 1028–1033.
48. Bakir B, Unuvar E, Terzibasioglu E et al. Atypical lung involvement in a patient with systemic juvenile xanthogranuloma. Pediatr Radiol 2007; 37 : 325–327.
49. Amer R, Peer J, Pappo O et al. Necrobiotic xanthogranuloma associated with chorioidal infiltration and syncytial gian cell hepatitis. J Neuroophthalmol 2005; 25 : 189–192.
50. Betts CM, Pasguinelli G, Costa AM et al. Necrobiotic xanthogranuloma without periorbital involvement: an ultrastructural investigation. Ultrastruct Pathol 2001; 25 : 437–444.
51. Orsey A, Paessler M, Lange BJ et al. Central nervous system juvenile xanthogranuloma with malignant transformation. Pediatr Blood Cancer 2008; 50 : 927–930.
52. Ozçelik U, Doğru D, Akçören Z et al. Xanthoma disseminatum a child with respiratory system involvement and bronchiectasias. Pediatr Pulmonol 2005; 39 : 84–87.
53. Smith HC, Sargent LD, Lundin DB. Necrobiotic xanthogranuloma of the chest wall. Dermatol Online 2006; 12 : 12–16.
54. Stockman A, Delanghe J, Geerts ML et al. Diffuse plane normolipaemic xanthomatosis in a patient with chronic lymphatic leukaemia and monoclonal gammopathy. Dermatology 2002; 204 : 351–354.
55. Stork J, Kodetová D, Vosmík E et al. Necrobiotic xanthogranuloma presenting as a solitary tumor. Am J Dermatopathol 2000; 22 : 453–456.
56. Spicknall KE, Mehregan DA. Necrobiotic xanthogranuloma. A rewiev. Int J Dermatol 2009; 48 : 1–10.
57. Tucker NA, Discepola MJ, Blanco G et al. Necrobiotic xanthogranuloma without dermatologic involvement. Can J Ophthalmol 1997; 32 : 396–399.
58. Ferrara G, Palombi N, Lipizzi A et al. Nonnecrobiotic necrobiotic xanthogranuloma. Am J Dermatopathol 2007; 29 : 306–308.
59. Bullock JD, Bartley GB, Campbell RJ et al. Necrobiotic xantogranuloma with paraproteinemia. Case report and pathogenetic study. Trans Am Ophthalmol Soc 1986; 84 : 342–354.
60. Yağci B, Varan A, Altmock G et al. Xanthoma disseminatum in a child with cranial involvement. J Pediatr Hematol Oncol 2008; 30 : 310–312.
61. Weitzman S, Jaffe R. Uncommon histiocytic disorders: the non-Langerhans cell histiocytoses. Pediatr Blood Cancer 2005; 45 : 256–264.
62. Moore FO, Berne JD, Fox AD. Mesenteric panniculitis and Erdheim-Chester disease: xanthogranulomatous diseases confused with malignancy. J Am Coll Surg 2007; 204 : 326–327.
63. Nestle FO, Hofbauer G, Burg G. Necrobiotic xanthogranuloma with monoclonal gammopathy of the IgG λ type. Dermatology 1999; 198 : 434–435.
64. Hafner O, Witte T, Schmidt RE et al. Necrobiotic xanthogranuloma in IgG κ plasmacytoma and Quincke edema. Hautarzt 1994; 45 : 339–343.
65. Matsuura F, Yamashita S, Hirano K et al. Activation of monocytes in vivo couses intracellular accumulation of lipoprotein derived lipids and marked hypocholesterolemia. A possible pathogenesis of necrobiotic xanthogranuloma. Atheroslerosis 1999; 142 : 355–365.
66. Jeziorska M, Hassan A, Mackness MI et al. Clinical, biochemical, and immunohistochemical features of necrobiotic xanthogranulomatosis. J Clin Pathol 2003; 56 : 64–68.
67. Langlois S, Brochot P, Reguiai Z et al. Necrobiotic xanthogranuloma with multiple myeloma. Case report and pathogenic hypotheses. Joint Bone Spine 2006; 73 : 120–122.
68. Zelger B, Eisendle K, Mensing C et al. Detection of spirochetal microorganism by focus bloating microscopy in necrobiotic xanthogranuloma. J Amer Acad Dermatol 2007; 57 : 1026–1030.
69. Chang SE, Lee WS, Lee MW et al. A case of necrobiotic xanthogranuloma without paraproteinemia presenting as a solitary tumor on the thigh. Int J Dermatol 2003; 42 : 470–472.
70. Jung WS, Ahn KJ, Park MR et al. The radiological spectrum of orbital pathologies that involve the lacrimal gland and the lacrimal fossa. Korean J Radiol 2007; 8 : 336–342.
71. Miszkiel KA, Sohaib SA, Rose GE et al. Radiological and clinicopathological features of orbital xanthogranuloma. Br J Ophthalmol 2000; 84 : 251–258.
72. Malhotra R, Porter RG, Selva D. Adult orbital xanthogranuloma with periosteal infiltration. Br J Ophthalmol 2003; 87 : 120–121.
73. Hidayat AA, Mafee MF, Laver NV et al. Langerhans’ cell histiocytosis and juvenile xanthogranuloma of the orbit. Clinicopathologic, CT, and MR imaging features. Radiol Clin North Am 1998; 36 : 1229–1240.
74. Tang WK, Lee KC, Chong LY. Three patients with orbital xanthogranuloma and non-progressive haematological abnormalities. Australas J Dermatol 2003; 44 : 185–189.
75. Wee SA, Shupack JL. Necrobiotic xanthogranuloma. Dermatol Online J 2005; 11 : 24–25.
76. Cornblath WT, Dotan SA, Trobe JD et al. Varied clinical spectrum of necrobiotic xanthogranuloma. Ophthalmology 1992; 99 : 103–107.
77. Elner VM, Mintz R, Demirci H et al. Local corticosteroid treatment of eyelid and orbital xanthogranuloma. Trans Am Ophthalmol Soc 2005; 103 : 69–73.
78. Sabet LM, Wexler D, Salama S et al. An unuusual cause of refractive chronic bilateral leg ulceration. J Cutan Med Surg 2004; 8 : 432–437.
79. Chave TA, Chowdhury MM, Holt PJ. Recalcintrant necrobiotic xantohogranuloma responding do pulsed high dose dexametasone plus maintenance therapy with oral prednisolone. Br J Dermatol 2001; 144 : 158–161.
80. Valentine EA, Friedman HD, Zamkoff KW et al. Necrobiotic xanthogranuloma with IgA multiple myeloma: a case report and literature review. Am J Hematol 1990; 35 : 283–285.
81. Venencie PY, Le Bras P, Toan ND et al. Recombinant interferon α-2b treatment of necrobiotic xanthogranuloma with paraproteinemia. J Am Acad Dermatol 1995; 32 : 666–667.
82. Scupham RK, Fretzin DF. Necrobiotic xanthogranuloma with paraproteinemia. Arch Pathol Lab Med 1989; 113 : 1389–1391.
83. Plotnick H, Taniguchi Y, Hashimoto K et al. Periorbital necrobiotic xanthogranuloma and stage I multiple myeloma. Ultrastructure and response to pulsed dexamethasone documented by magnetic resonance imaging. J Am Acad Dermatol 1991; 25 : 373–377.
84. Kossard S, Chow E, Wilkinson B et al. Lipid and giant cell in nercobiotic xanthogranuloma. J Cutan Pathol 2000; 27 : 374–378.
85. Wells J, Gillespie R, Zardawi I. A case ofr recaltitrant necrobiotic xanthogranuloma. Australas J Dermarol 2004; 45 : 213–215.
86. Meyer S, Szeimies RM, Landthaler M et al. Cyclophosphamide-dexamethasone pulsed therapy for treatment of recalcitrant necrobiotic xanthogranuloma with paraproteinemia and ocular involvement. Br J Dermatol 2005; 153 : 443–445.
87. Stover DG, Alapati S, Regueira O et al. Treatment of juvenile xanthogranuloma. Pediatr Blood Cancer 2008; 51 : 130–133.
88. Seaton ED, Pillai GJ, Chu AC. Treatment of xanthoma diseminatum with cylophosphamide. Br J Dermatol 2004; 150 : 346–349.
89. Flann S, Wain EM, Halpern S et al. Necrobiotic xanthogranuloma with paraproteinaemia. Clin Exp Dermatol 2006; 31 : 248–251.
90. Chave TA, Hutchinson PE. Necrobiotic xanthogranuloma with two monoclonal paraproteins and no periorbital involvement at presentation. Clin Exp Dermatol 2001; 26 : 493–466.
91. Khan IJ, Azam NA, Sullivan SC et al. Necrobiotic xanthogranuloma successfully treated with combination of dexamethasone and oral cyclophosphamide. Can J Ophthalmol 2009; 44 : 335–336.
92. Hauser C, Schifferli J, Saurath JH. Complement consumption in a patient with necorbiotic xanthogranuloma and paraproteinemia. J Am Acad Dermatol 1991; 24 : 908–911.
93. Torabian SM, Fazel N, Knuttle R. Necrobiotic xanthogranuloma treated with chlorambucil. Dermatol Online J 2006; 12 : 11–12.
94. Luck J, Layton A, Noble BA. Necrobiotix xanthogranuloma with orbital involvement. J R Soc Med 1992; 85 : 357–358.
95. Criado PR, Vasconcellos C, Pegas JR et al. Necrobiotic xanthogranuloma with λ paraproteinemia: case report of successful treatment with melphalan and prednisone. J Dermatolog Treat 2002; 13 : 87–89.
96. Ito Y, Nishimura K, Yamanaka K et al. Necrobiotic xanthogranuloma with paraproteinemia; an atypical case. J Dtsch Dermatol Ges 2008; 6 : 40–43.
97. Russo CG. Necrobiotic xanthogranuloma with scleroderma. Cutis 2002; 70 : 311–316.
98. Saeki H, Tomita M, Kai H et al. Necrobiotic xanthogranuloma with paraproteinemia successfully treated with melphalan, prednisolone and skin graft. J Dermatol 2007; 34 : 795–797.
99. Wilhelmus KR, Yen MT, Rice L et al. Necrobiotic xanthogranuloma with posterior scleritis. Arch Ophthalmol 2006; 124 : 748–749.
100. Ziemer M, Wedding U, Sander CS et al. Necrobiotic xanthogranuloma-rapid progression under treatment with melphalan. Eur J Dermatol 2005; 15 : 363–365.
101. Rose GE, Patel BC, Gerner A et al. Orbita xanthogranuloma in adults. Br J Ophthalmol 1991; 75 : 680–684.
102. Hayden A, Wilson DJ, Rosenbaum JT. Management of orbital xanthogranuloma with methotrexate. Br J Ophthalmol 2007; 91 : 434–436.
103. Georgiou S, Monastirli A, Kapramos N et al. Interferon α-2a monothherapy for necrobiotic xanthogranuloma. Acta Derm Venereol 1999; 79 : 484–485.
104. Finelli LG, Ratz JL. Plasmapheresis, a treatment modality for necrobiotic xanthogranuloma. J Am Acad Dermatol 1987; 17 : 351–354.
105. Lorenz S, Hohenleutner S, Hohenleutner U et al. Treatment of difuse plane xantohomas of the face with the erbium: YAG Laser. Arch Dermatol 1978; 114 : 425–431.
106. Vieira V, Del Pozo J, Martínez W et al. Necrobiotic xanthogranuloma associated with lymphoplasmacytic lymphoma. Palliative treatment with carbon dioxide laser. Eur J Dermatol 2005; 15 : 182–185.
107. Efebera Y, Blanchard E, Allam C et al. Complete response to thalidomide and dexamethasone in a patient with necrobiotic xanthogranuloma associated with monoclonal gammopathy: a case report and review of the literature. Clin Lymphoma Myeloma Leuk 2011; 11 : 298–302.
108. Silapunt S, Chon SY. Generalized necrobiotic xanthogranuloma successfully treated with lenalidomide. J Drugs Dermatol 2010; 9 : 273–276.
109. Sheidow TG, Nicolle DA, Heathcote JG. Erdheim-Chester disease: two cases of orbital involvement. Eye (Lond) 2000; 14 : 606–612.
110. Myra C, Sloper L, Tighe PJ et al. Treatment of Erdheim-Chester disease with cladribine: a rational approach. Br J Ophthalmol 2004; 88 : 844–847.
111. Aouba A, Larousserie F, Le Guern V et al. Spumous histiocytic oligoarthritis coexisting with systemic Langerhans’ cell histiocytosis: case report and literature review. Joint Bone Spine 2009; 76 : 701–704.
112. Blouin P, Yvert M, Arbion F et al. Juvenile xanthogranuloma with hematological dysfunction treated with 2CDA-AraC. Pediatr Blood Cancer 2010; 55 : 757–760.
113. Khezri F, Gibson LE, Tefferi A. Xanthoma disseminatum: effective therapy with 2-chlorodeoxyadenosine in a case series. Arch Dermatol 2011; 147 : 459–464.
114. Rajendra B, Duncan A, Parslew R et al. Successful treatment of central nervous system juvenile xanthogranulomatosis with cladribine. Pediatr Blood Cancer 2009; 52 : 413–415.
115. Orsey A, Paessler M, Lange BJ et al. Central nervous system juvenile xanthogranuloma with malignant transformation. Pediatr Blood Cancer 2008; 50 : 927–930.
116. Adam Z, Koukalová R, Šprláková A et al. Úspěšná léčba Erdheimovy-Chesterovy nemoci chemoterapií obsahující 2-chlorodeoxyadenosine. Popis dvou případů a přehled literatury. Vnitř Lék 2011; 57 : 576–589.
117. Khezri F, Gibson LE, Tefferi A. Xanthoma disseminatum: effective therapy with 2-chlorodeoxyadenosine in a case series. Arch Dermatol 2011; 147 : 459–464.
118. Goede JS, Misselwitz B, Taverna C et al. Necrobiotic xanthogranuloma successfully treated with autologous stem cell transplantation. Ann Hematol 2007; 86 : 303–306.
119. Hallermann C, Tittelbach J, Norgauer J et al. Succesfull treatment of necrobiotic xanthogranuloma with intravenous immunoglobulin. Arch Dermatol 2010; 146 : 957–960.
Labels
Diabetology Endocrinology Internal medicineArticle was published in
Internal Medicine

2012 Issue 5
-
All articles in this issue
- Endoskopická retrográdní cholangiografie pomocí jednobalónkového enteroskopu u pacientů s Roux-Y hepatikojejunoanastomózou
- Interakce glukokortikoidů s warfarinem u chronických zánětlivých (autoimunitních) chorob
- Skórovací systémy hodnotící prognózu komunitních pneumonií
- Oční víčka se žlutými granulomy a kašel – periokulární xantogranulom dospělých spojený s astmatem. Popis případu a přehled klinických forem juvenilního xantogranulomu a terapie
- Význam vitaminu D – nové poznatky, které svědčí o jeho úloze v medicíně
- Polymorfizmus genu pro receptor vitaminu D
- Vitamin D a riziko kardiovaskulárních chorob
- Vitamin D a aortální stenóza
- Vitamin D a neurologická onemocnění
- Endokrinní mikrosystémy kalcitriolu – vývojové aspekty a předpoklady jejich celoživotní funkčnosti
- Metabolizmus vitaminu D
- D vitamin a imunita
- Stane se vitamin D novým antidiabetikem?
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue
- Metabolizmus vitaminu D
- Vitamin D a neurologická onemocnění
- Oční víčka se žlutými granulomy a kašel – periokulární xantogranulom dospělých spojený s astmatem. Popis případu a přehled klinických forem juvenilního xantogranulomu a terapie
- Skórovací systémy hodnotící prognózu komunitních pneumonií
