Morbus Weil – kazuistika a princípy
Morbus Weil – a case study and principles
We present a case of a 66 years old man without significant medical history who was admitted to a geriatric department of a local hospital for a critical clinical state with severe icterus (billirubin 368 µmol/l), acute renal failure (urea 48 mmol/l, creatinine 714 µmol/l) and severe thrombocytopaenia. When the patient’s son completed his personal history on the 4th day of hospitalization reporting that the patient had worked in a pub flooded during local floods, we also considered leptospirosis as a potential cause of his current state. Parenteral penicillin antibiotics (amoxicillin + clavulanate) were prescribed and comprehensive infusion rehydration, corrective and haemostyptic treatments were continued. Despite transient worsening of thrombocytopaenia to 8 × 103/µl, we did not observe any severe bleeding, thrombocytopaenia gradually improved and thrombocyte levels were in the reference range from the 7th day of hospitalization. Acute renal failure (ARF) did not involve oliguria and an intensive conservative treatment provided gradual improvement of the clinical status as well as laboratory parameters with creatinine levels at discharge of 121.3 µmol/l. Heamodialysis was not used. Billirubin levels also gradually declined to 25 µmol/l at discharge. Leptospiral antibodies in the urine and serum were suggestive of leptospirosis. The diagnosis was confirmed with follow up investigations 13 days after discharge. The condition was caused by Leptospira icterohaemorrhagiae. The patient’s condition was complicated with deterioration of pre-existing hearing impairment. We also expect a contribution of leptospirosis to its anamnesis. Antibiotic treatment continued for 16 day, 7 of which with parenteral administration. Haemodynamically stable, normotensive, afebrile, self-sufficient patient was discharged on 37th day of hospitalization to primary care.
Key words:
leptospirosis – Weil’s disease – renal failure – icterus – thrombocytopaenia
Authors:
P. Majdák 1; I. Drexlerová 1; M. Staňáková 1; P. Malinjak 2; J. Melicherík 3
Authors‘ workplace:
Geriatrické oddelenie NsP Bojnice, Slovenská republika, prednosta prim. MUDr. Pavol Majdák
1; Infektologická ambulancia NsP Bojnice, Slovenská republika, vedúci lekár MUDr. Peter Malinjak
2; Neurologické oddelenie NsP Bojnice, Slovenská republika, prednosta prim. MUDr. Andrej Mihál
3
Published in:
Vnitř Lék 2012; 58(9): 668-673
Category:
Case Reports
Overview
Uvádzame prípad 66-ročného muža bez vážnejšieho predchorobia, ktorý bol prijatý na geriatrické oddelenie miestnej nemocnice v závažnom klinickom stave pre ťažký ikterus (bilirubin 368 µmol/l), akútne zlyhanie obličiek (urea 48 mmol/l, kreatinín 714 µmol/l) a ťažkú trombocytopéniu (12 × 103/µl). Až na 4. deň hospitalizácie po doplnení anamnézy synom pacienta o údaj práce v zaplavenej pivnici po miestnych záplavách sme zamerali svoju pozornosť aj na možnú leptospírovú infekciu. Indikovali sme parenterálne antibiotikum penicilínového radu (amoxicilin + klavulanát), pokračovali v komplexnej infúznej rehydratačnej, korekčnej a hemostyptickej liečbe. Napriek prechodnému prehĺbeniu trombocytopénie až na 8 × 103/µl sme nezaznamenali závažné krvácanie, trombocytopénia sa v priebehu nasledujúcich dní upravovala a od 7. dňa hospitalizácie boli hodnoty trombocytov v referenčných medziach. Akútne zlyhanie obličiek prebiehalo bez oligúrie, intenzívnou konzervatívnou liečbou sme zaznamenali postupné zlepšovanie klinického stavu, ako aj laboratórnych parametrov, s výstupnou hodnotou kreatinínu 121,3 µmol/l. Hemodialyzačná liečba indikovaná nebola. Postupne sa upravovali aj hodnoty bilirubínu až na 25 µmol/l v čase prepustenia. Výsledky protilátok proti leptospíre v moči aj sére svedčili pre leptospírovú infekciu. Definitívne ju potvrdili kontrolné vyšetrenia realizované s odstupom 13 dní. Vyvolávateľom bola Leptospira icterohaemorrhagiae. Stav pacienta bol komplikovaný zhoršením preexistujúcej poruchy sluchu. Aj v jej etiológii predpokladáme podiel leptospírovej infekcie. Antibiotická liečba pokračovala 16 dní, z toho 7 parenterálne. Hemodynamicky stabilizovaný, normotenzný, afebrilný, samoobslužný pacient bol prepustený na 37. deň hospitalizácie do ambulantnej starostlivosti.
Kľúčové slová:
leptospiróza – Weilova choroba – zlyhanie obličiek – ikterus – trombocytopénia
Úvod
Leptospiróza je typická zoonóza. Ide o infekčné ochorenie spôsobené leptospírami. Leptospira (L.) je rod patogénnych a saprofytických baktérií, ktorý sa zaraďuje do čeľade Leptospiraceae a do rádu Spirochaetales. Patogénne druhy vyvolávajú u človeka a zvierat ochorenie nazývané leptospiróza. Rod Leptospira sa skladá z dvoch druhov. Leptospira interrogans (má 25 sérologických skupín a 209 sérovarov), ktorý je patogénny, a Leptospira biflexa – druh obsahujúci nepatogénne saprofytické kmene. Leptospíry patria medzi aeróbne vláknité baktérie schopné vlastného pohybu. Ich rezervoárom sú hlavne hlodavce a iné zvieratá, ktoré dlhodobo vylučujú leptospíry močom. Človek sa rýchlo infikuje, lebo leptospíry dobre prenikajú cez kožu a epitel [1]. Prenos z človeka na človeka je extrémne zriedkavý [2].
V USA je hlásených asi 100 prípadov leptospirózy ročne, avšak hlásenie o výskyte ochorenia je v mnohých štátoch nedôsledné [2]. Incidencia leptospirózy v Českej republike sa pohybuje okolo 0,3 prípadov na 100 000 obyvateľov [3]. Na Slovensku je hlásený výskyt asi 15–45 prípadov ročne (graf 1).

Inkubačná doba leptospirózy varíruje od 2 do 26 dní, s mediánom 10 dní [4].
Priebeh ochorenia môže byť variabilný – od asymptomatického až po letálny [5]. Väčšina nákaz prebieha zrejme subklinicky alebo pod obrazom ľahkého vírusového ochorenia. Asi 90–95 % leptospiróz prebieha klinicky ľahkou anikterickou formou. Túto benígnu formu leptospirózy vyvoláva v našich podmienkach najčastejšie Leptospira grippotyphosa, ktorá je pôvodcom tzv. poľnej horúčky [5]. Ťažká, ikterická forma je označovaná ako Weilova choroba. Jej pôvodcom sú najčastejšie Leptospira icterohaemorrhagiae a Leptospira copenhagi, u ktorých je hlavným nositeľom potkan [1,5]. Je charakterizovaná horúčkou, krvácavými komplikáciami, žltačkou, hepatosplenomegáliou a obličkovým zlyhaním. Leptospiróza začína charakteristicky náhlymi bolesťami hlavy, myalgiami, horúčkou a konjunktivitídou. Môžu byť prítomné aj petechie. V prípadoch ľahkého postihnutia trvajú symptómy asi 3–10 dní a spontánne odoznievajú. Závažnými prejavmi ochorenia môže byť akútna bolesť brucha, akútna cholecystitída či pankreatitída, meningizmus a hemiparéza. Neskorou komplikáciou býva aseptická meningitída, ktorá ale zvykne vo väčšine prípadov odoznieť v priebehu 3–6 týždňov. V prípade ťažkej leptospirózy sú aj úvodné symptómy závažnejšie. Na 1–2 dni dočasne ustupujú, ale sú nasledované akútnym zlyhaním obličiek, ikterom a hemoragickými komplikáciami. Závažnou komplikáciou sú pľúcne hemorágie, rozvoj ARDS (adult respiratory distress syndrome), krvácanie do viscerálnych orgánov vrátane nadobličiek, myokarditída a uveitída. Najčastejšou príčinou smrti je obličkové a hepatálne zlyhanie [2], prípadne krvácanie, väčšinou do tráviaceho traktu [5].
Popis prípadu
Popisujeme prípad 66-ročného muža s BMI 26,2. V jeho osobnej anamnéze bola prítomná retinopathia pigmentosa a cataracta senilis matura oboch očí s významným zrakovým hendikepom. Pacient bol bez chronickej ambulantnej medikácie a bez uvádzaných iných liečených ochorení. Na centrálnu príjmovú ambulanciu nemocnice bol privezený 30. 8. 2010. Udával, že asi od 24. 8. 2010 mal vysoké teploty. Pociťoval slabosť, boleli ho svaly, neskôr ho rozbolelo brucho. Mal dráždivý kašeľ, vykašliaval hlieny. 26. 8. 2010 bol na pohotovosti, stav bol hodnotený ako infekt dýchacích ciest, indikovaný bol amoxicilín potencovaný klavulanátom 3krát 625 mg p.o., paracetamol 3krát 500 mg tbl p.o. a ibuprofen 3krát 400 mg p.o. Iné lieky neužíval. Teploty pominuli, ale jeho stav sa ešte zhoršil, veľmi zoslabol, nevládal jesť, bolelo ho brucho a príbuzní si všimli, že ožltol. Pri prijatí bol pacient apatický, s výrazne obmedzenou mobilitou, prakticky nevidiaci, ale orientovaný a snažiaci sa o spoluprácu. Krvný tlak 130/80 mm Hg. Na EKG bola prítomná sínusová tachykardia s frekvenciou 102/min, bez ložiskových zmien. V klinickom obraze dominoval ťažký ikterus, palpačná citlivosť v epigastriu, hmatný hepar presahoval rebrový oblúk o 3 cm. Prítomné boli tiež drobné petechie a lineárne sufúzie na hrudníku a bruchu a drobné hematómy na predkoleniach. Sliznica ústnej dutiny bola bez petechií, v ľavom ústnom kútiku bola prítomná zaschnutá krv. Z laboratórnych vyšetrení vyberáme: krvný obraz – leukocyty 9,3 × 103/µl, hemoglobín 13,3 g/dl, trombocyty 12 × 103/µl, koagulácia – INR 0,99, fibrinogén 6,56 g/l. Z biochemických vyšetrení: urea 48 mmol/l, kreatinín 714 µmol/l, kyselina močová 916,7 µmol/l, celkové bielkoviny 54,3 g/l, albumín 30,6 g/l, bilirubín celkový 368 µmol/l, bilirubín konjugovaný 223 µmol/l, AST (aspartátaminotransferáza) 0,84 µkat/l, ALT (alanínaminotransferáza) 0,81 µkat/l, GMT (gamaglutamyltransferáza) 1,91 µkat/l, ALP (alkalická fosfatáza) 2,24 µkat/l, AMS (amyláza) 5,96 µkat/l, cholesterol 3,5 mmol/l, natrium 130 mmol/l, kalium 4,2 mmol/l, chloridy 91 mmol/l, CRP (C-reaktívny proteín) 99,3 mg/l. V kapilárnom Astrupe bola prítomná mierna acidóza s pH 7,258, BE –6,5 mmol/l, BB 41,2 mmol/l, HCO3 19,3 mmol/l, pCO2 5,94 kPa, pO2 5,52 kPa, D-diméry 0,5 mg/l. Ultrasonograficky bol objektivizovaný zväčšený hepar s difúzne zvýšenou echogenitou, obličky bez známok stázy, bez redukcie parenchýmu. Pacienta sme hospitalizovali na geriatrickom oddelení. V rámci diferenciálnej diagnostiky sme zvažovali kumulatívny hepatotoxický účinok užívaných liekov, infekčnú či parainfekčnú etiológiu, vyšetrili sme markery infekčných hepatitíd, onkomarkery, zvažovali hemolyticko-uremický syndróm, podiel dehydratácie. Ukončili sme ambulantnú medikáciu, zaviedli permanentný močový katéter, monitorovali bilanciu tekutín. Bola indikovaná infúzna rehydratačná, korekčná liečba, hemostyptikum (etamsylatum 4krát 250 mg i.v.), rutosid s acidum ascorbicum, symptomaticky infúzne spazmolytikum (butylscopolaminii bromidum), nutričná enterálna podpora a laktulóza. Diuréza zostala zachovaná (1. deň 500 ml za 12 hod, 2. deň 2 900 ml a 3. deň 3 200 ml) a zaznamenali sme aj mierny pokles kreatinémie. Na druhý deň hospitalizácie bol konzultovaný nefrológ, ktorý konštatoval akútne zlyhanie obličiek nejasnej etiológie. Hemodialyzačnú liečbu zatiaľ neindikoval. Tiež bol konzultovaný hematológ, ktorý odporúčal symptomatické podanie trombocytárneho koncentrátu a kortikoidov. Vzhľadom na neprítomnosť závažných krvácavých komplikácií, nejasnú etiológiu trombocytopénie a jej tendenciu ku včasnej úprave neboli kortikoidy ani trombocytárny koncentrát podané. Na 4. deň hospitalizácie prišiel na návštevu syn pacienta a upresnil anamnézu. Otec napriek ťažkému zrakovému deficitu ešte počas nedávnych záplav (14. 8. 2010) pracoval v zaplavenej pivnici rodinného domu, odčerpával špinavú vodu, čistil kanalizáciu. Nové údaje z epidemiologickej anamnézy nás viedli ku podozreniu z leptospírovej infekcie. Vyšetrili sme protilátky proti leptospíre a do liečby empiricky vrátili antibiotikum (ATB) penicilínového radu (amoxicilin + klavulanát) v parenterálnej forme. Pozorovali sme postupné zlepšovanie parametrov vnútorného prostredia, pokles bilirubinémie aj dusíkatých metabolitov (obr. 1–4).

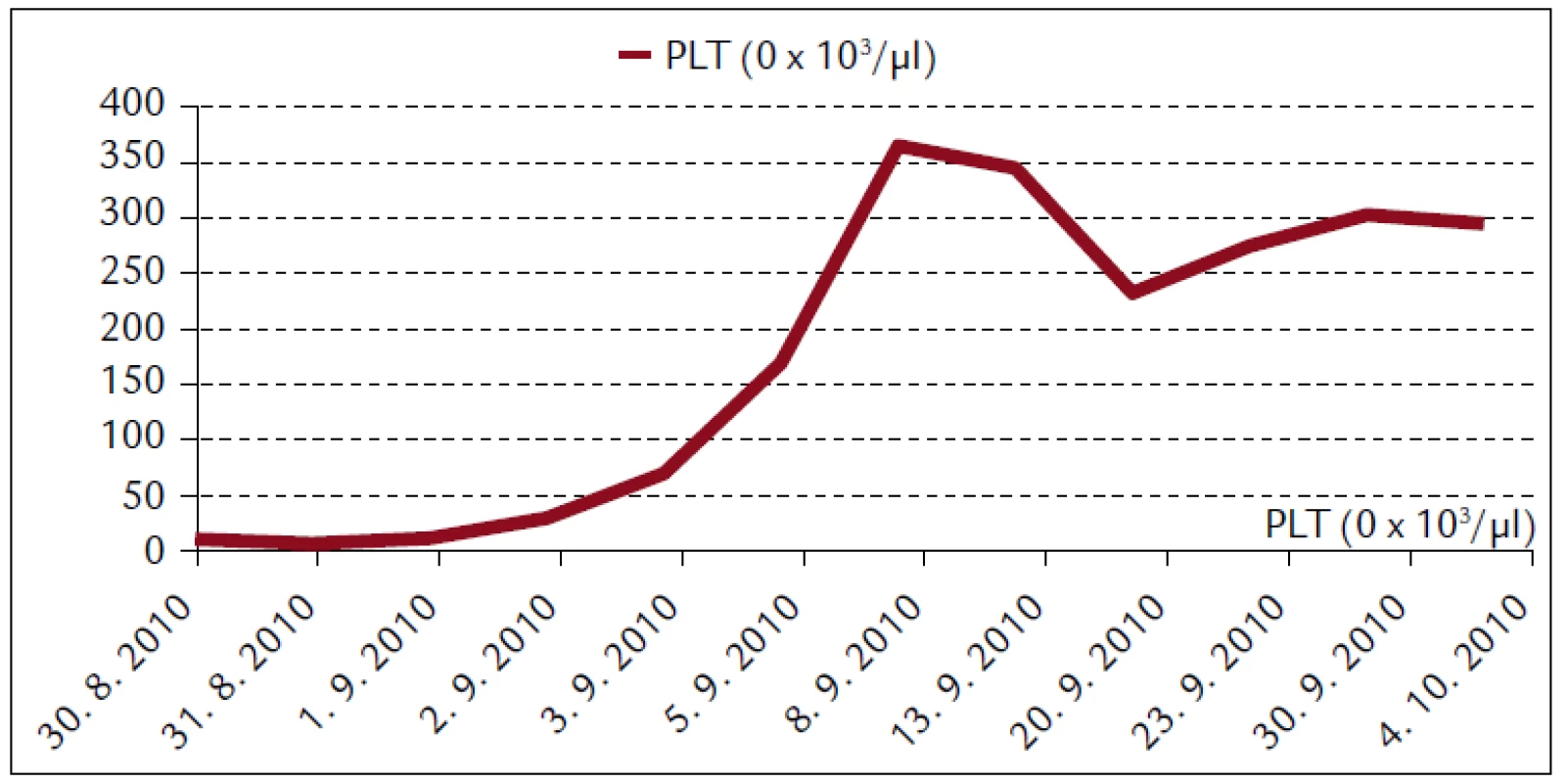
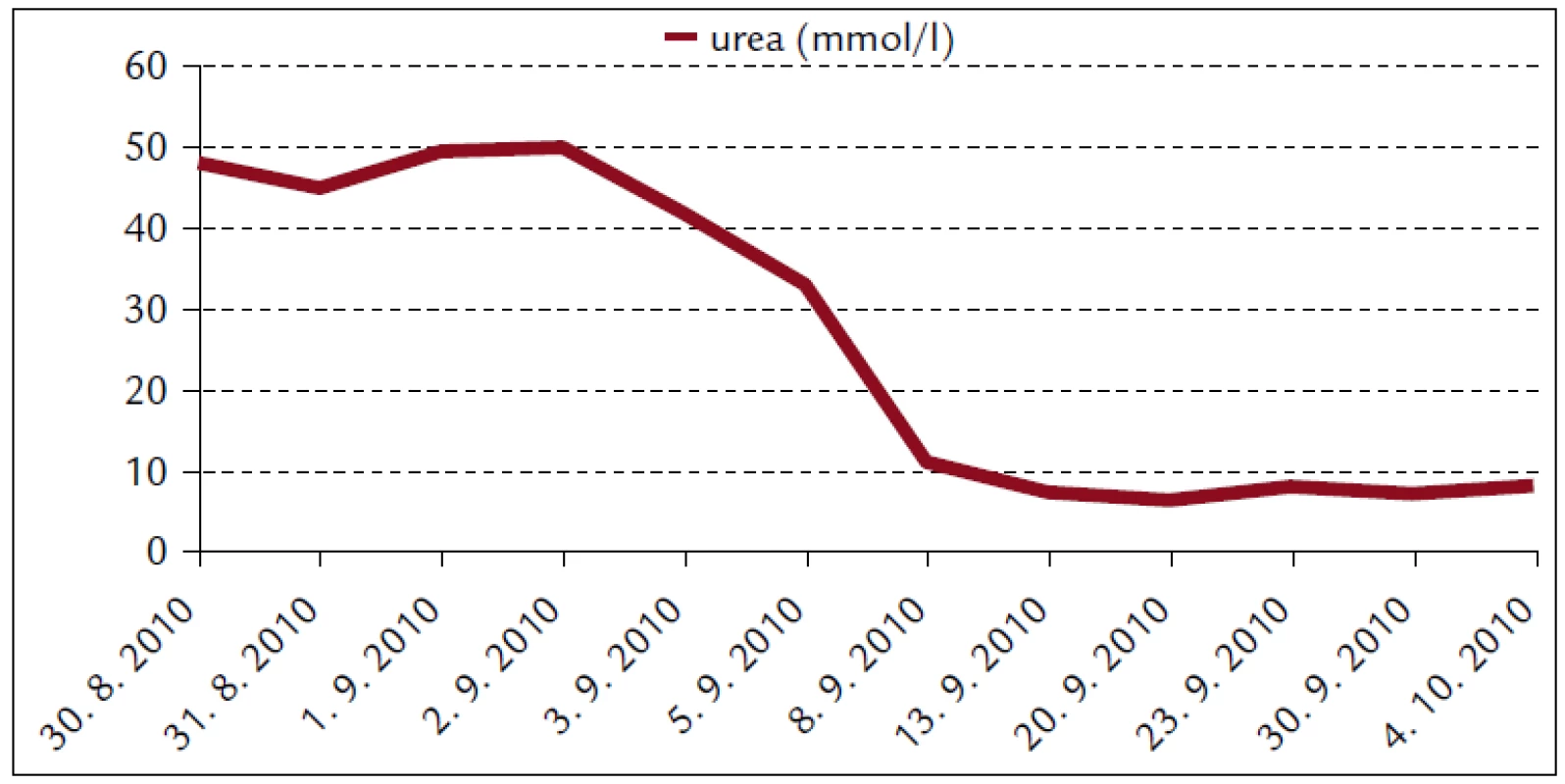
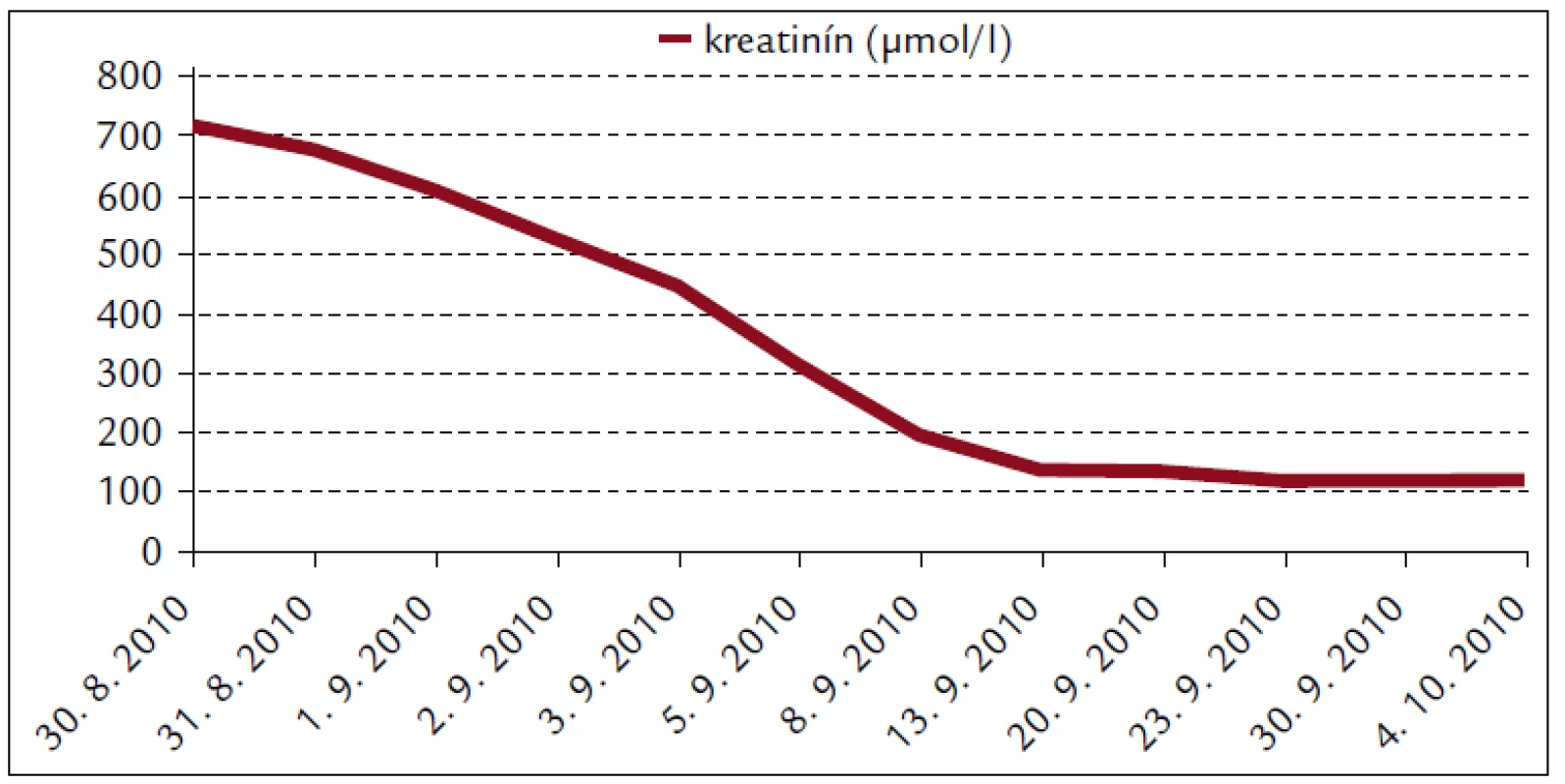
Postupne sa normalizovala ťažká trombocytopénia, bez krvácavých komplikácií, bez potreby podania trombocytárneho koncentrátu. Naopak, došlo ku prehĺbeniu ťažkej anémie (hemoglobín z 6. 9. 2010 6,8 g/dl), na čo sme reagovali podaním troch T.U. erymasy s úpravou hemoglobínu na 10,3 g/dl. V ďalšom priebehu hospitalizácie už pacient neanemizoval. 10. 9. 2010 sme obdržali sérologické výsledky protilátok proti leptospíre. Pozitívne boli titre pre sérovar Sejroe 1 : 6 400, Andamana 1 : 3 200 a Semeranga 1 : 1 600. Sérum dávalo v mikroagultinačnom teste (MAT) tzv. paradoxnú reakciu príznačnú pre včasnú fázu leptospirózy. V moči dávalo vyšetrenie MAT s leptospirami pozitívnu reakciu pre sérovar Icterohaemorhagiae 1 : 2, Sejroe 1 : 4 a Javanica 1 : 4. Pokračovali sme v antibiotickej liečbe až do 17. 9. 2010, celkovo 16 dní, z toho prvých 7 dní parenterálne. Klinický stav pacienta sa stabilizoval, reštaurovali sa renálne funkcie, prešiel polyurickou fázou ARI s dennou diurézou 4 000–6 300 ml v dňoch 2. 9. 2010 až 8. 9. 2010. Perorálny príjem tekutín bol dopĺňaný infúziami kryštaloidov (celkovo 40 litrov). Pacient bol postupne vertikalizovaný, rehabilitoval chôdzu. So zlepšením celkového stavu začal upriamovať pozornosť na zhoršenie reziduálneho vizu a poruchu sluchu. Oftalmológ nepredpokladal súvis s leptospírovou infekciou. Otorynolaryngológ suponoval náhlu perceptívnu poruchu sluchu pri prekonanom infekčnom ochorení. Bola indikovaná séria vazodilatačných infúzií (vinpocetinum, magnesium sulfuricum, trimecainum), celkovo 10 dní. V kontrolnom audiograme nedošlo ku podstatnej zmene. Pre podozrenie z centrálnych príčin deficitu sluchu a zraku, mitigovanej meningitídy bol pacient vyšetrený aj neurológom. Ten konštatoval klinicky ameningeálnosť. Na MR (magnetická rezonancia) mozgu boli prítomné len nešpecifické vaskulárne a degeneratívne zmeny. Stav hodnotil ako možnú periférnu leptospírovú labyrintitídu, léziu n. VIII, kupírovanú ATB medikáciou. 16. 9. 2010 sme vyšetrili kontrolnú sériu protilátok. V sére boli pozitívne sérovary Icterohaemorrhagiae 1 : 1 600, Sejroe 1 : 6 400, Andamana 1 : 1 600, Semeranga 1 : 1 600. V moči bolo vyšetrenie MAT s leptospírami pozitívne pre sérovar Icterohaemorrhagiae 1 : 2, Sejroe 1 : 4 a Javanica 1 : 4. Záchyt leptospirózy sme hlásili na miestne hygienické oddelenie.
Diskusia
Leptospiróza je akútne generalizované infekčné ochorenie charakterizované extenzívnou vaskulitídou [6]. Typicky prebieha v 2 štádiách: septickom a imunitnom. Septická fáza trvá asi 3–7 dní a je sprevádzaná náhlymi teplotami, bolesťami hlavy a svalov, dehydratáciou a často aj kardiovaskulárnou instabilitou [7]. Tieto nešpecifické príznaky sa objavili aj v našom prípade predhospitalizačne a boli mylne pripísané vírusovej infekcii, infektu dýchacích ciest. Prvé príznaky ochorenia boli prítomné na 8.–10. deň od práce v zaplavenej pivnici rodinného domu, čo koreluje s udávanou inkubačnou dobou ochorenia. Po krátkodobom klinickom zlepšení sa objavujú IgM protilátky a nastupuje imunitné štádium často sprevádzané aseptickou meningitídou. V asi 5–10 % prípadov ochorenia sa rozvíja m. Weil s odhadovanou mortalitou 5–10 % napriek antibiotickej a komplexnej podpornej liečbe [7]. Tá je závislá aj od veku pacienta. U geriatrických pacientov sa mortalita odhaduje až na 30 % [2].
Diagnostika leptospirózy je sérologická a (alebo) pomocou PCR (polymerase chain reaction). Nevýhodou sérologického vyšetrenia je odber protilátok v čase tzv. diagnostického okna, kedy ešte nie sú protilátky vytvorené [8]. Špecifické protilátky bývajú detekovateľné cestou MAT až na 8.–10. deň od začiatku klinických príznakov ochorenia [9]. Preto je nutné sérologické vyšetrenie opakovať s odstupom času. Dôkaz leptospír v moči, likvore a krvi je možný pomocou PCR od 1. dňa klinických príznakov [8]. Protilátky v priebehu ochorenia dosahujú tisícových titrov (pre akútne ochorenie svedčí väčšinou titer minimálne 1 : 1 600). Vrchol dosahujú v 3.–5. týždni. Hodnoty potom pomaly klesajú a vo väčšine prípadov nachádzame nízke titre aj po rokoch [5]. Protilátky proti leptospíre v sére a moči boli vyšetrené na 4. deň hospitalizácie a 11. deň od začiatku ochorenia. Ich výsledok dával tzv. paradoxnú reakciu s pozitivitou pre viaceré sérovary. Kontrolný odber realizovaný o 13 dní potvrdil diagnózu leptospirózy. Dôkaz prostredníctvom protilátok konkrétneho sérovaru leptospíry môže byť náročný. Najskôr sú diagnostikovateľné IgM protilátky, neskôr aj IgG. Sérokonverzia trvá často dlhšie ako 30 dní. Informácie o type leptospíry z prvých vyšetrení sú často nespoľahlivé. Vyplýva to z neznámej predchádzajúcej expozície leptospírami a taktiež zo skríženej reakcie, ktorú dávajú príbuzné, ale aj nepríbuzné sérovary najmä vo včasných fázach infekcie. Hovoríme o tzv. paradoxnej reakcii [2]. Aj v našom prípade bola prítomná tzv. paradoxná reakcia medzi viacerými sérovarmi leptospíry. Až opakované vyšetrenia v plazme aj moči dominantne selektovali sérovar Icterohaemorrhagiae.
Hepatálna lézia sa spája s centrilobulárnou nekrózou a proliferáciou Kupfferových buniek, hepatocelulárnou dysfunkciou [10]. Pre Weilovu chorobu je typická hyperbilirubinémia, ale jej hodnota len zriedka presahuje 340 µmol/l. Vysoká hodnota bilirubinémie sa spája s ťažším priebehom ochorenia ako aj vyššou incidencou ARI. Hepatomegália sa popisuje v asi 25 % prípadov, ale hladiny transamináz len zriedka prekračujú trojnásobne normu [7]. Len zriedkavo sú popisované aj prípady anikterickej formy m. Weil spojené s ťažkým zlyhaním obličiek vyžadujúcim hemodialyzačnú liečbu [11]. V našom prípade bola maximálna hodnota bilirubínu 368 µmol/l v deň prijatia do nemocnice. Hodnoty transamináz boli zvýšené len ľahko, nepresiahli dvojnásobok normy. Špecifická liečba hepatálnej insuficiencie neexistuje [2].
Renálne zlyhanie spôsobené leptospirovou infekciou sa častejšie spája s nonoligúriou či až polyúriou a hypokaliémiou. Bežným klinicko-patologickým nálezom pri leptospiróze je tubulointersticiálna nefritída. Za jej hlavný znak sa pokladá primárne poškodenie proximálneho tubulu [12]. Niektorí autori priamo poukazujú na hypokaliémiu pri ARI a febrilitách ako na alarmujúci znak, ktorý by mal viesť ku diferenciálno-diagnostickej úvahe o leptospiróze [13]. Zriedkavejšia, oligurická forma ARI sa častejšie spája s vekom vyšším ako 40 rokov, hyponatriémiou, nízkym arteriálnym pH, vysokými hodnotami AST a bilirubínu. Oligurická forma ARI má signifikantne vyššiu mortalitu ako neoligurická [11,14]. Zriedkavá hyperkaliémia sa častejšie spája s ťažkým katabolizmom a rabdomyolýzou [11]. V našom prípade bola vstupná kaliémia normálna – 4,2 mmol/l. Obličkové zlyhanie malo neoligurickú formu.
Trombocytopénia je najčastejšou hematologickou komplikáciou ochorenia [6]. Vyskytuje sa v asi 50 % prípadov [7]. Je úzko spojená s renálnym zlyhaním, s ktorým sa asociuje až v 80 % [15]. Nezvykne sa spájať s diseminovanou intravaskulárnou koaguláciou. Etiologicky sa na nej podieľa znížená produkcia trombocytov, ich zvýšená periférna deštrukcia a konzumpcia pri generalizovanej mikrovaskulitíde [6]. Býva komplikovaná hemoragickou diatézou. Úzko sa spája s obličkovým zlyhaním a zlou prognózou pacienta [7]. V našom prípade bola trombocytopénia ťažkého stupňa (8 × 103/µl), ale nebola sprevádzaná závažnými krvácavými prejavmi. Prítomné boli len kožné petechie a hematómy. V priebehu liečby sa trombocytopénia reštaurovala a nevyžadovala prevody trombocytárneho koncentrátu. Od 7. dňa hospitalizácie boli hodnoty trombocytov v referenčnom pásme.
Liečba leptospirózy zahŕňa komplexnú intenzívnu starostlivosť. V antibiotickej liečbe je odporúčaný penicilínový rad (penicilín G, event. ampicilín), prípadne erytromycin u alergických pacientov. Dôležité je začať liečbu čo najskôr. Účinné sú ale aj doxycyklín a cefalosporíny 3. generácie [2,16]. Antibiotickú liečbu je často potrebné zahájiť len na základe klinického predpokladu, pred získaním laboratórneho dôkazu [8]. Tak sme ju indikovali aj my.
V prípade Weilovej choroby je nevyhnutná podporná rehydratačná a korekčná liečba, infúzie kryštaloidov, starostlivosť o vnútorné prostredie. Akútne obličkové zlyhanie je často liečené dialyzačne. Andrade et al na základe vlastných skúseností s ARI pri leptospiróze považujú včasný začiatok hemodialyzačnej liečby s následnými dennými dialýzami za veľmi dôležitý a vedúci ku zníženiu hospitalizačnej mortality. Dialyzačnú liečbu vedúcu ku striktnej kontrole azotémie a cirkulujúceho volumu považujú za najprínosnejšiu pre skupinu pacientov s ťažkým priebehom a potenciálnymi pľúcnymi hemorágiami [17]. Niektorí autori odporúčajú v liečbe ľahkej formy ARI dopamín a furosemid [18]. V našom prípade sme k dialyzačnej liečbe nepristúpili. Primeraná diuréza, normokaliémia, stabilizovaná acidobáza, ako aj dynamická reštitúcia obličkových funkcií nám umožnili pokračovať v konzervatívnej infúznej a antibiotickej liečbe. Nezaznamenali sme prejavy kardiálnej insuficiencie ani pľúcne komplikácie.
Záver
Leptospiróza je pomerne zriedkavé, resp. zriedkavo diagnostikované infekčné ochorenie. Vzhľadom na charakter prenosu a jej prírodný rezervoár je v súčasnosti jeho výskyt čoraz častejšie viazaný na záplavové oblasti. Keďže výskyt záplav v našich podmienkach je čoraz častejší, je predpoklad aj častejšieho výskytu tejto zoonózy. Jej zavzatie do diferenciálno-diagnostickej úvahy u pacientov s nešpecifickými chrípkovými prejavmi, ikterom, trombocytopéniou a zlyhaním obličiek zvyšuje šancu na včasnú liečbu a kurabilitu tohto potenciálne fatálneho ochorenia.
MUDr. Pavol Majdák
www.hospital-bojnice.sk
e-mail: pavol.majdak@hospital-bojnice.sk
Doručeno do redakce: 30. 12. 2011
Přijato po recenzi: 27. 4. 2012
Sources
1. Štefanovič J. Lexikón lekárskej bakteriológie. Bratislava: SLK 2008 : 42–43.
2. Lewet PN, Edwards CN. Leptospirosis. In: Brachman PS, Abrutyn E (eds). Bacterial Infections of Humans. 4th ed. New York: Springier Science + Business Media LLC 2009 : 439–460.
3. Zitek K, Beneš Č. Dlhouhodobá epidemiologie a diagnostika leptospirózy (1963–2003) v České republice. Praha: Národní referenční laboratoř pro leptospiry: SZÚ Praha 2003.
4. Guron G, Holmdahl J, Dotevall L. Acute renal failure after a holiday in the tropics. Clin Nephrol 2006; 66 : 468–471.
5. Souček M, Charvát J, Večeř J et al. Infekční onemocnění zpúsobené leptospirou s následným akutním selháním ledvin. Klin Mikrobiol 2000; 4 : 128–129.
6. Erdinc FS, Koruk ST, Hatipoglu CA. Three cases of anicteric leptospirosis from Turkey: Mild to severe complications. J Infect 2006; 52: e45–e48.
7. Coursin DB, Updike SG, Mai DG. Massive rhabdomyolysis and multiple organ dysfunction syndrome caused by leptospirosis. Intensive Care Med 2000; 26 : 808–812.
8. Frančíková K, Hamplová V, Petrú K et al. Akutní selhání ledvin při leptospiróze. Postgrad Med 2007; 9 : 395–396.
9. Čermáková Z, Plíšková L, Ryšková O. Laboratory Diagnosis of Leptospirosis. Folia Microbiol 2005; 50 : 345–347.
10. Gompf SG, Velez APV. Leptospirosis. MedScape.com. Emedicine.medscape.com/article/220563-overview. Updated: Aug 11, 2008.
11. Da Silva PS, Lipinski RW, Magalhães RP et al. Severe acute renal failure in a child: a rare complication of anicteric leptospirosis. Pediatr Nephrol 2007; 22 : 1971–1974.
12. Araujo ER, Seguro AC, Spichler A et al. Acute kidney injury in human leptospirosis: an immunohistochemical study with pathophysiological correlation. Virchows Archiv 2010; 456 : 367–375.
13. Nakou N, Liamis G, Elisaf MS et al. Low Normal Potassium Levels in Acute Renal Failure: Evidence of Leptospirosis. Infection 2000; 28 : 196.
14. Daher EF, Silva GB Jr, Karbage NN et al. Predictors of oliguric acute kidney injury in leptospirosis. A retrospective study on 196 consecutive patients. Nephron Clin Pract 2009; 112: c25–c30.
15. Covic A, Goldsmith DJ, Gusbeth-Tatamir P et al. A retrospective 5-year study in Moldova of acute renal failure due to leptospirosis: 58 cases and a review of the literature. Nephrol Dial Transplant 2003; 18 : 1128–1134.
16. De Souza AL, Sztajnbok J, Marques SR et al. Leptospirosis-induced meningitis and acute renal failure in a 19-month-old male child. J Med Microbiol 2006; 55 : 795–797.
17. Andrade L, Cleto S, Seguro AC. Door-to-dialysis time and daily hemodialysis in patients with leptospirosis: impact on mortality. Clin J Am Soc Nephrol 2007; 2 : 739–744.
18. Niwattayakul K, Sitprija V. Leptospiral Acute Renal Failure: Effects of Dopamine and Furosemide. Ren Fail 2007; 29 : 159–162.
Labels
Diabetology Endocrinology Internal medicineArticle was published in
Internal Medicine

2012 Issue 9
-
All articles in this issue
- Srovnání dvou metod dlouhodobého externího telemonitorování EKG po ablaci fibrilace síní
- Časný pohybový režim snižuje asymetrický dimetylarginin po transplantaci ledviny
- Povrchová tromboflebitida, neprávem podceňovaná choroba – je čas změnit názor?
- Léková compliance – úskalí terapie revmatoidní artritidy?
- Peripartální život ohrožující krvácení – mezioborové konsenzuální stanovisko
- Upozornění na nebezpečí invazivních infekcí u splenektomovaných pacientů. Zkušenosti z FN Brno 2011
- Morbus Weil – kazuistika a princípy
- Nádor srdce manifestující se náhlou srdeční smrtí
- Naše zkušenosti s léčbou multicentrické plazmocelulární Castlemanovy choroby s projevy vaskulitidy – popis případu a přehled literatury
- Hyperventilační echokardiografie v diagnostice vazospastické anginy pectoris
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue
- Povrchová tromboflebitida, neprávem podceňovaná choroba – je čas změnit názor?
- Upozornění na nebezpečí invazivních infekcí u splenektomovaných pacientů. Zkušenosti z FN Brno 2011
- Morbus Weil – kazuistika a princípy
- Hyperventilační echokardiografie v diagnostice vazospastické anginy pectoris
