Časný pohybový režim snižuje asymetrický dimetylarginin po transplantaci ledviny
Regular exercise training decreases asymmetric dimethylarginine after kidney transplantation
Background:
Levels of the endogenous nitric oxide synthase inhibitor asymmetric dimethylarginine are elevated in patients undergoing kidney transplantation and may contribute to vascular complications. In this study we tested the hypothesis that elevated asymmetric dimethylarginine can be reduced in patients after kidney transplantation by early regular physical exercise. Selected cytokines and metabolic parameters were also analysed.
Methods:
Plasma samples for analysis of asymmetric dimethylarginine, adiponectin, leptin, soluble leptin receptor, resistin, visfatin, CRP, TNFα and selected metabolic parameters were obtained from randomly selected sixty eight patients after kidney transplantation who agreed to participate in a supervised aerobic exercise program for six months. Samples were collected before the training began (one month after surgery with stabilized graft function) and at six months after initiation. Sixty transplant patients matched for age, sex, HLA typing, duration of previous dialysis, history of cardiovascular disease and immunosupression regimen who did not exercise regularly and did not participate in the training program were examined as controls.
Results:
There were no differences in elevated asymmetric dimethylarginine levels between both groups before the training program began. After six months of exercise, asymmetric dimethylarginine concentration in the exercising group I significantly decreased (3.5 ± 0.45 vs 2.11 ± 0.35 µmol/L, P < 0.01) and was also significantly lower comparing to non-exercising group II (2.11 ± 0.23 vs 3.25 ± 0.34 µmol/L, P < 0.01). We found significant changes in exercising group I: adiponectin (15.4 ± 6.6 vs 22.3 ± 6.2 mg/mL, P < 0.01), leptin (51.3 ± 11.2 vs 20.3 ± 9.2 ng/L, P < 0.01), soluble leptin receptor (24.6 ± 8.4 vs 46.1 ± 11.4 U/mL, P < 0.01), resistin (20.8 ± 10.1 vs 14.6 ± 6.4 mg/mL, P < 0.025) and visfatin (1.8 ± 0.2 vs 1.2 ± 0.01 ng/mL, P < 0.05). Blood lipids, HbA1c, CRP and TNFα were also affected by the training program.
Conclusions:
Elevated asymmetric dimethylarginine level, selected adipocytokines and proinflammatory cytokines in patients after kidney transplantation were significantly influenced by early regular exercise. This regimen may decrease cardiovascular risk in patients after kidney transplantation.
Key words:
renal transplantation – physical exercise – ADMA – adiponectin – leptin – resistin – visfatin
Authors:
V. Teplan 1,2; A. Mahrová 3; K. Švagrová 3; J. Racek 4; R. Gürlich 5; V. Teplan Jr 5; L. Šenolt 6; M. Štollová 1
Authors‘ workplace:
Klinika nefrologie Transplantcentra IKEM Praha, přednosta prof. MUDr. Ondřej Viklický, CSc.
1; Subkatedra nefrologie IPVZ Praha, vedoucí prof. MUDr. Vladimír Teplan, DrSc.
2; Laboratoř sportovní motoriky Fakulty tělesné výchovy a sportu UK Praha, přednosta prof. Ing. Václav Bunc, CSc.
3; Ústav klinické biochemie a hematologie Lékařské fakulty UK a FN Plzeň, přednosta prof. MUDr. Jaroslav Racek, DrSc.
4; Chirurgická klinika 3. lékařské fakulty UK a FN Královské Vinohrady Praha, přednosta prof. MUDr. Robert Gürlich, CSc.
5; Revmatologický ústav Praha, ředitel prof. MUDr. Karel Pavelka, DrSc.
6
Published in:
Vnitř Lék 2012; 58(9): 640-646
Category:
Original Contributions
Overview
Úvod a cíl studie:
Hladiny endogenního inhibitoru NO syntázy asymetrického dimetylargininu jsou zvýšeny u pacientů po transplantaci ledvin a mohou významně přispět k cévním komplikacím. V této studii jsme testovali hypotézu, zda pravidelné fyzické cvičení započaté po transplantaci ledviny může snížit zvýšené hladiny asymetrického dimetylargininu. Současně jsme vyšetřili vybrané cytokiny a metabolické parametry.
Metody:
Plazmatické vzorky pro analýzu asymetrického dimetylargininu, adiponektinu, leptinu, rozpustného receptoru pro leptin, rezistinu, visfatinu, CRP, TNFα a další vybrané parametry lipidového a sacharidového metabolizmu byly vyšetřeny v prospektivní randomizované studii u 68 pacientů po 1. kadaverózní transplantaci ledviny, kteří souhlasili s účastí v kontrolovaném aerobním cvičebním programu po dobu 6 měsíců (skupina I). Vzorky byly odebrány před zahájením cvičení v 1. měsíci po transplantaci při již stabilní funkci transplantované ledviny a kontrolní odběry za 6 měsíců od zahájení. Kontrolní skupinu tvořilo 60 transplantovaných pacientů srovnatelných dle věku, pohlaví, HLA typizace, délky předchozí dialýzy, anamnézy kardiovaskulárních onemocnění a imunosupresivního režimu, kteří nepodstoupili pravidelný cvičební režim (skupina II).
Výsledky:
Na začátku sledovaného údobí nebyly mezi oběma skupinami zjištěny signifikantní rozdíly v hladinách asymetrického dimetylargininu. Po 6měsíčním pravidelném cvičebním programu hladiny asymetrického dimetylargininu ve skupině I významně poklesly (z 3,5 ± 0,45 na 2,11 ± 0,35 µmol/l, p < 0,01) a byly také signifikantně nižší ve srovnání s kontrolní skupinou II (2,11 ± 0,23 vs 3,25 ± 0,34 µmol/l,p < 0,01). Byly zjištěny i další signifikantní změny ve skupině I v následujících sledovaných parametrech: adiponektin (z 14,6 ± 6,6 na 22,3 ± 6,2 mg/ml, p < 0,01), leptin (z 51,3 ± 11,2 na 20,3 ± ± 9,2 ng/l, p < 0,01), rozpustný/solubilní receptor pro leptin (z 24,6 ± 8,4 na 46,1 ± 11,4 U/ml, p < 0,01), rezistin (z 20,8 ± 10,1 na 14,6 ± ± 6,4 mg/ml, p < 0,025) a visfatin (z 1,8 ± 0,2 na 1,2 ± 0,01 ng/ml, p < 0,05). Současně byly ovlivněny i parametry lipidového a sacharidového metabolizmu (celkový a LDL-cholesterol, triacylglyceroly, HbA1c, hladina inzulinu), jakož i hladiny prozánětlivých cytokinů (CRP a TNFα).
Závěr:
Zvýšená hladina asymetrického dimetylargininu a vybrané adipocytokiny byly u pacientů po transplantaci ledviny signifikantně ovlivněny časným pravidelným pohybovým režimem. Cvičební režim může významně snížit i riziko kardiovaskulárních onemocnění po transplantaci ledviny.
Klíčová slova:
transplantace ledviny – tělesné cvičení – ADMA – adiponektin – leptin – rezistin – visfatin
Úvod
Pacienti po transplantaci ledvin mají zvýšené riziko kardiovaskulárních onemocnění a úmrtí. Cévní změny mohou být spojeny s omezenou biologickou aktivitou oxidu dusnatého (NO) a zvýšením koncentrací cirkulujícího endogenního inhibitoru NO syntázy asymetrického dimetylargininu (ADMA), markeru endoteliální dysfunkce u onemocnění ledvin [1].
Zvýšení hladiny ADMA souvisí se sníženou funkcí ledvin. Z přibližně 300 mmol (60 mg) ADMA za den je kolem 50 mmol vylučováno močí, a proto se hladina ADMA zvyšuje u pacientů se selháním ledvin [2]. Transplantace ledvin normalizuje hladinu symetrického dimetylargininu (SDMA), zatímco hodnota ADMA zůstává zvýšena. Důvodem může být snížené odbourávání ADMA v ledvinách [alterovaná činnost enzymu dimetylarginin dimetylaminohydrolázy (DDAH)] a/nebo jeho zvýšená tvorba. Zatím je málo dokladů o dalším ovlivnění ADMA farmakoterapií. Údaje o účinku inhibitorů angiotenzin-konvertujícího enzymu či blokátorů receptorů pro angiotenzin II jsou protichůdné, nicméně o perorálních antidiabetikách (např. metforminu či glitazonu) se předpokládá, že by prostřednictvím zlepšení inzulinové rezistence mohly snížit hladiny ADMA. Tento účinek pravděpodobně vyplývá ze zvýšení DDAH [3].
U netransplantovaných pacientů jsou plazmatické koncentrace ADMA vyšší u obézních inzulin-rezistentních jedinců a hubnutí bylo spojeno se snížením plazmatických koncentrací ADMA. Vysoce zvýšené koncentrace ADMA u morbidně obézních pacientů [body mass index (BMI) > 35 kg/m2] se významně snížily po bariatrické gastroplastice, jež vedla ke snížení tělesné hmotnosti [4].
Vyšší koncentrace ADMA byly opakovaně popsány v situacích zvýšeného kardiovaskulárního rizika [5,6]. Dle zvýšení hladiny ADMA lze předpovědět riziko kardiovaskulárních příhod u pacientů se selháním ledvin, především u mužů s již přítomnou ischemickou chorobou srdeční [7]. Pacienti po transplantaci ledviny mají známky významné endoteliální dysfunkce [8] a také významně vyšší hladiny ADMA, než je tomu u zdravých osob se srovnatelnou renální funkcí [9]. Tento nález by mohl výrazně přispět k vysoké kardiovaskulární morbiditě a mortalitě [10]. Po úspěšné transplantaci ledviny s rozvojem renální funkce sice ADMA klesá ve srovnání s hodnotami u dialyzovaných nemocných, ale zůstává trvale významně vyšší. Na tom se mohou podílet i další faktory, z nichž velmi důležitou roli hraje přírůstek tukové tkáně – především viscerálního tuku – po transplantaci. Tuková tkáň vylučuje řadu hormonů a cytokinů, které jsou považovány za klíčové při vzniku inzulinové rezistence a endoteliální dysfunkce [11,12]. Mění se i hladina adiponektinu (ADPN), jenž má naopak předpokládané účinky antiaterosklerotické a protizánětlivé [13,14]. U neobézních pacientů po úspěšné transplantaci ledviny jeho zvýšená hladina může částečně snížit riziko endoteliální dysfunkce [15].
Bylo prokázáno, že pravidelné aerobní cvičení významně zlepšuje vazodilataci závislou na funkci endotelu u kardiologických nemocných [16].
Pravidelná tělesná aktivita ovlivňuje pozitivně endoteliální dysfunkci i u nemocných s chronickým onemocněním ledvin a u pacientů na dialýze se zvýšeným kardiovaskulárním rizikem [17]. Lze proto předpokládat pozitivní vliv i u transplantovaných pacientů. Dosud však nebyly publikovány žádné relevantní údaje podporující tuto hypotézu.
Cílem naší práce bylo proto charakterizovat a zhodnotit plazmatické hladiny ADMA ve vztahu k ostatním rizikovým faktorům u příjemců transplantované ledviny před pravidelným fyzickým cvičením a po jeho ukončení. Současně jsme vyšetřili vybrané adipocytokiny (ADPN, leptin, rezistin a visfatin), cytokiny tumor nekrotizujícího faktoru α (TNFα) a C-reaktivní protein (CRP), které by mohly být cvičením ovlivněny. Dále vybrané parametry metabolizmu lipidů a sacharidů spolu s hodnocením renální funkce clearancovými metodami.
Materiál a metody
Studie byla schválena etickou komisí Institutu klinické a experimentální medicíny Praha a je v souladu s Helsinskou deklarací, včetně aktuální verze správné klinické praxe. Postupy respektují institucionální předpisy. Všichni nemocní byli podrobně informování a dali písemný informovaný souhlas před zařazením do studie.
Soubor nemocných
Do prospektivní randomizované studie bylo zařazeno celkem 128 nemocných po 1. transplantaci kadaverózní ledviny, která byla provedena v Transplantcentru Institutu klinické a experimentální medicíny Praha od 1. 9. 2009, z toho 68 randomizovaně vybraných pacientů (skupina I, 36 mužů a 32 žen, průměrný věk 58 ± 7,2 let, rozmezí 25 až 71 let, střední věk 54,0 let) souhlasilo s účastí v kontrolovaném aerobním cvičebním programu s nutriční edukací po dobu 6 měsíců od transplantace ledviny. Randomizace byla provedena standardní metodou výběru dle data narození.
Kontrolní skupinu tvořilo 60 nemocných (skupina II, 30 mužů a 30 žen) po transplantaci ledviny, srovnatelných z hlediska věku, pohlaví, HLA typizace, délky předchozí dialýzy, anamnézy kardiovaskulárních onemocnění a imunosupresivního režimu, kteří nepodstoupili pravidelný cvičební režim spojený s nutriční edukací. Sběr dat pacientů byl dokončen 31. 10. 2011. Pacienti byli vyšetřeni a sledováni na metabolickém oddělení a v clearancové laboratoři Kliniky nefrologie IKEM Praha se zahájením v 1. měsících po transplantaci při stabilizaci funkce transplantované ledviny po dobu 6 měsíců. Vzorky krve a moči byly vyšetřeny při zahájení studie a za 6 měsíců sledování. Funkce ledvin byla hodnocena clearancí inulinu a kreatininu.
Dlouhodobý imunosupresivní protokol zahrnoval podávání cyklosporinu (Sandimmun Neoral, Novartis, Basilej, Švýcarsko) nebo takrolimu (Prograf, Astellas, Praha, Česká republika) v dávkách odpovídajících doporučeným léčebným hladinám, dále mykofenolát mofetilu (Cellcept, Hoffmann-La Roche, Basilej, Švýcarsko), 1–2 g/den a steroidů 5–10 mg/den (Prednison, Zentiva, Praha, Česká republika). Nemocní s epizodami rejekce štěpu byli vyřazeni ze studie.
Z hlediska komplikujících onemocnění 4 z 68 cvičících pacientů a 3 z 60 necvičících pacientů měli již před transplantací cukrovku a byli léčeni inzulinem. V době 4 týdnů před odběrem krevních a močových vzorků žádný pacient neměl projevy akutní infekce.
Všichni zařazení nemocní měli hodnotu funkce transplantované ledviny měřenou korigovanou clearancí kreatinu větší než 60 ml/min (1 ml/s). Pacienti s pozitivní anamnézou již proběhlých závažných kardiovaskulárních příhod (IM, MCP) byli z této studie vyřazeni a všichni sledovaní nemocní byli nekuřáci. Přítomná hypertenze byla léčena dle standardních postupů u nemocných po transplantaci ledviny včetně podávání ACE inhibitorů a blokátorů receptoru pro angiotenzin II. Při prokázané hyperlipidemii byly použity ve standardním postupu statiny. Nutriční a dietologickou intervenci provedla zkušená nutriční terapeutka standardním dotazníkem a opakovaným nutričním pohovorem u všech intervenovaných nemocných s užitím počítačového programu DIETA (IKEM Praha). Pacienti byli poučeni o doporučeném složení diety během své první návštěvy tak, aby příjem proteinů nepřesáhl hodnotu 1,2 g/kg/den a energie 30 kcal/kg/den během sledovaného údobí. Kontroly byly prováděny měsíčně v prvních 3 měsících po transplantaci a na konci sledování za 6 měsíců.
Hodnocení tělesné kondice a pravidelného cvičebního programu
Fyzická kondice byla hodnocena pomocí baterie motorických testů „Senior Fitness Tests – SFT“ (Rikli, Jones) spolu s kvalitou života hodnocenou standardizovaným dotazníkem HRQOL SF36-Bref. Výsledky na začátku a konci sledování byly srovnávány jak se zdravou populací (populační normy), tak v obou časových periodách v intervenovaném souboru a kontrolní skupině (pre-post testy). Výkonnostní cvičení sestávalo z fáze kontrolní a testové (1. měsíc), kontrolně edukační (kontrolované cvičení po dobu 3 měsíců) a pokračující individuální pohybové aktivitě (další 3 měsíce), a to převážně formou cyklických opakovaných cviků (stationary cycling). Každá cvičební aktivita trvala 1 hod a zátěž byla postupně individuálně zvyšována k dosažení požadovaného rozmezí cvičební zátěže. Po 3–5 min úvodního rozcvičení (warm-up) byla tak cvičební zátěž zvýšena až do srdeční frekvence 60–70 % dříve zjištěné hodnoty rozdílu mezi klidovým režimem a maximální individuální tolerovanou srdeční frekvencí. Tato zátěž trvala minimálně 40 min s následujícím 5minutovým uvolněním (cool-down). Frekvence cvičebního režimu s edukací byla během prvních 2 týdnů od zahájení cvičebně-edukačního programu 2krát týdně, v následujícím údobí 3krát týdně. Celý výcvik byl veden zkušenou fyzioterapeutkou pod dohledem lékaře. Pacienti byli po poučení a kontrole oprávněni provádět další tréninkový program doma, ale dodržování garantovaných školení muselo mít při kontrole více než 60% complianci.
Antropometrické vyšetření, odběry vzorků a clearancové metody
Antropometrické vyšetření pacientů byla provedena za bazálního stavu na začátku a na konci studie. Všichni pacienti byli standardně změřeni a zváženi s výpočtem BMI. Krevní vzorky pro stanovená měření byly odebrány v 1. měsíci po transplantaci při obnově funkce transplantované ledviny a za 6 měsíců po transplantaci. Funkce ledvin byla vyšetřena v clearancové laboratoři metabolického oddělení Kliniky nefrologie IKEM Praha za použití metodiky clearance inulinu/polyfruktosanu (Cin) a současně i korigované clearance kreatininu (Ckr) technikou se sběrem moči. Přesné měření Cin vyžaduje stabilní plazmatickou koncentraci inulinu pro odběry vzorků krve a moči během vyšetření. K zajištění adekvátní diurézy je nutné předchozí zavodnění 0,5–1,0 l vody 1 hod před začátkem vyšetření. Renální clearance inulinu byla měřena s plazmatickou hladinou inulinu mezi 20–30 mg/100 ml. Té bylo dosaženo počátečním podáním inulinu/polyfruktosanu i.v. v dávce vypočítané dle hmotnosti nemocného a jeho renální korigované clearance kreatininu s následující udržovací infuzí inulinu/polyfruktosanu. Po ekvilibrační periodě 60 min se vzorky krve a moči odebírají nai začátku, uprostřed a na konci dalšího 60minutového údobí. Korigovaná clearance kreatininu vyžaduje přesný sběr moči za 24 hod a 2 vzorky žilní krve na začátku a na konci sběrného období.
Biochemické analýzy
Pro stanovení ADMA byly krevní vzorky odebrány do vakuet s etylendiamintetraoctovou kyselinou a krev byla okamžitě centrifugována při 3 600 otáčkách a 3 G po dobu 5 min při 20 °C. Všichni pacienti byli na lačno po dobu nejméně 10 hod před odběrem vzorků, aby se zabránilo vlivu metioninu z potravy na koncentraci ADMA. ADMA byla stanovena metodou ELISA (Kit ADMA, ELISA, DLD Diagnostika GmbH, Hamburk, Německo) a AUTO--EIA II readeru (Labsystems Oy, Espoo, Finsko). Tato kompetitivní metoda používá mikrotitrační desky. ADMA je vázána na pevnou fázi a acetylovaná ADMA ve vzorcích kompetuje s navázanou ADMA s užitím králičího antiséra proti ADMA. Poté je vázaná protilátka detekována anti-králičí peroxidázou. Výsledný produkt této reakce je sledován při 450 nm. Množství protilátek je nepřímo úměrné koncentraci ADMA vzorku.
Stanovení adiponektinu (ADPN) bylo provedeno radioimunoesejí ze 2 vzorků krve po předchozím 12hodinovém lačnění (Human adiponektin RIA Kit, Dinco Research, Inc, St. Charles, MO, USA). Pro zhodnocení výsledků u obou skupin (cvičící a necvičící) bylo nutné měřit vzorky ve stejnou dobu. Sérový leptin a rozpustný/solubilní leptinový receptor (ObRe) byly měřeny komerční imunoesejí (Bio-Vendor, Praha, Česká republika).
Sérové koncentrace TNFα byly stanoveny s užitím adipokine LINCOplex kitu s Luminexem 200 (Linco Research). Sérová koncentrace C reaktivního proteinu (CRP) byla měřena vysoce senzitivním CRP ELISA kit (DSL, Oxon, UK). Sérový visfatin metodou ELISA (Bio Vision Research Products, Mountain View, USA).
Inulin (polyfruktosan S) byl analyzován metodou s antronem na spektrofotometru při vlnové délce 580 nm (Antelie Light Secoman, Domond Cedex, Francie). Celkový cholesterol, HDL-cholesterol a triglyceridy byly stanoveny pomocí enzymatické kolorimetrické metody na přístroji Olympus AU 600 (Olympus Diagnostics, GmbH, Hamburk, Německo). Hladina LDL-cholesterolu byla vypočtena z Friedewaldova vzorce. Sérové koncentrace inzulinu byly měřeny pomocí RIA (CisBio International, Lyon, Francie), glykovaného hemoglobinu (HbA1c) byly analyzovány pomocí kapalinové chromatografie na Tosoh HLC-723 G7 (Shiba, Minato-ku, Tokio, Japonsko) a proteinurie na 24 hod fotometricky s pyrogallolovou červení pomocí systému Olympus 800 (Hamburk, Německo).
Statistická analýza
Pro statistickou analýzu byl použit software SigmaStat (SPSS Inc, Chicago, IL, USA). Párový t-test a dvouvýběrový t-test byly použity pro porovnání výsledků u obou skupin pacientů. Výsledky byly považovány za statisticky významné při p < 0,05.
Výsledky
Základní klinické charakteristiky obou skupin pacientů po transplantaci ledviny jsou uvedeny v tab. 1.
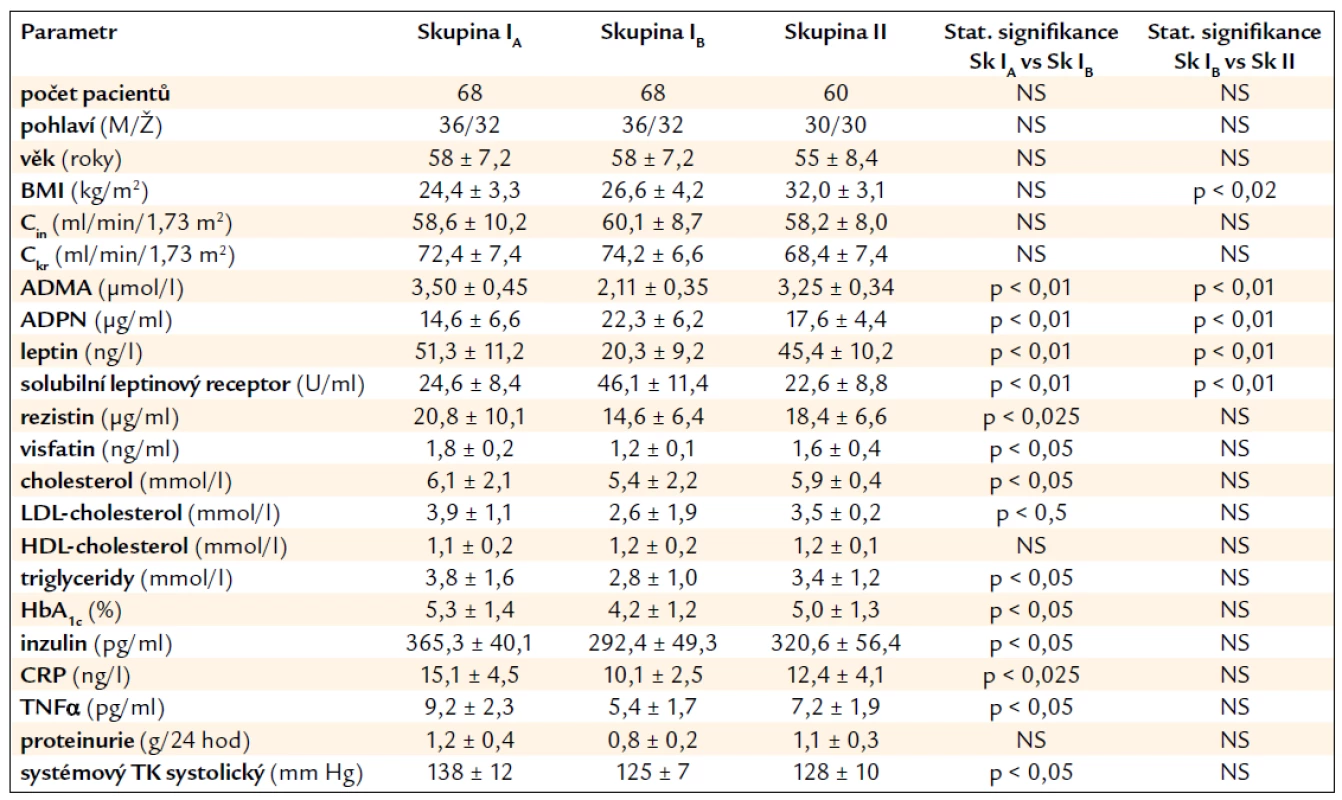
Skupiny se významně nelišily s ohledem na věk, pohlaví, HLA typizaci či imunosupresivní léčbu. V porovnání s kontrolní skupinou II měli pacienti ve skupině I po 6 měsících pravidelného cvičebního tréninku významně nižší sérové hladiny ADMA a leptinu. Naopak hladiny ADPN a rozpustného/solubilního leptinového receptoru byly zvýšeny (vše p < 0,01). Cvičební režim byl spojen s mírným, leč signifikantním snížením sérové hladiny rezistinu (p < 0,025) a visfatinu (p < 0,05). Snížily se i parametry prozánětlivých cytokinů (CRP p < 0,025 a TNFα p < 0,05). Současně bylo zaznamenáno i snížení některých parametrů lipidového a sacharidového metabolizmu (celkový cholesterol, LDL-cholesterol, triacylglyceroly, HbA1c a inzulinu, p < 0,05), zatímco hladiny HDL-cholesterolu zůstaly nezměněny. Cvičební režim neovlivnil proteinurii, ale systémový TK se mírně snížil (p < 0,05). Pohybový režim ovlivnil též snížení BMI (p < 0,02). Během 6 měsíců sledování se funkce ledvin měřená inulinovou a kreatininovou clearancí signifikantně nezměnila.
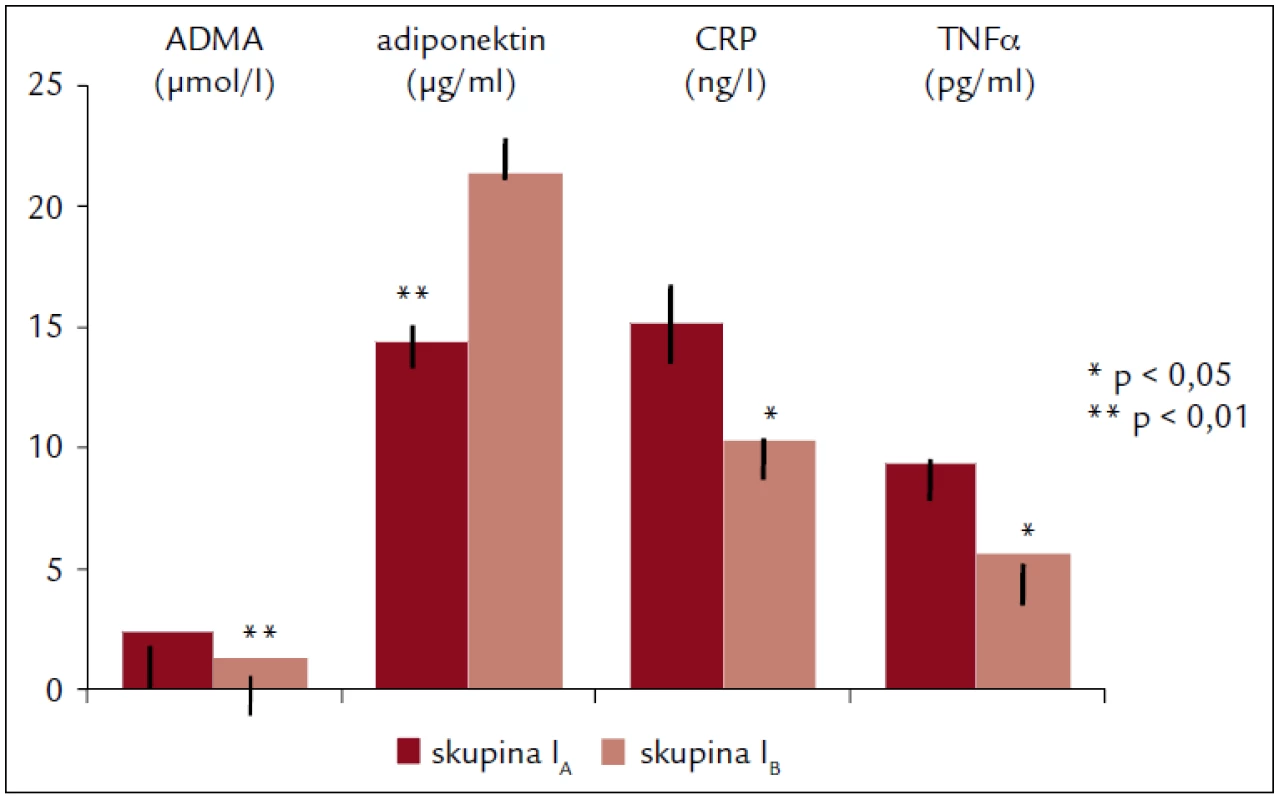
Obr. 1 zachycuje významné rozdíly v hladinách markerů endoteliální dysfunkce ve skupině I před (IA) a po 6 měsících (IB) pravidelného cvičení: pokles ADMA (p < 0,01), CRP (p < 0,025) a TNFα (p < 0,05) a zvýšení ADPN (p < 0,01).
Diskuze
V předchozích studiích bylo prokázáno, že pravidelná aerobní fyzická aktivita vede u nemocných s ICHS a diabetem ke zlepšení na endotelu dependentní vazodilataci, a tím ke snížení kardiovaskulárního rizika nemocných. Vliv programu aerobního cvičení ale může být přechodný a jeho účinek zmizí s ukončením pravidelné fyzické aktivity [17]. Pravidelná tělesná aktivita pozitivně ovlivňuje přítomnou endoteliální dysfunkci i u nemocných s chronickým onemocněním ledvin a v dialyzačním programu [18–20]. Zvýšené kardiovaskulární riziko spojené se zvýšenou koncentrací ADMA zůstává i po úspěšné transplantaci ledviny. Nejčastější příčinou úmrtí po transplantaci ledviny jsou kardiovaskulární příhody a jejich riziko je mnohonásobně vyšší ve srovnání se zdravými osobami. Časná pohybová rehabilitace však toto riziko významně snižuje [21–24]. Bazální produkce NO je snížena u těchto pacientů stejně jako u nemocných s diabetem a na endotelu závislá vazodilatace v reakci na acetylcholin je podobná jako u zdravých kontrol [25]. Nedávná studie u nemocných s chronickou renální insuficiencí (CHRI) ukázala, že ADMA souvisí s bazální produkcí NO, ale není závislá na acetylcholinem indukované vazodilataci. Zvýšené hladiny ADMA v naší studii představují marker či mediátor snížené bazální produkce NO, kterou lze zlepšit aerobním cvičením. Zvýšení ADMA souvisí s vyšším rizikem vzniku akutních koronárních příhod u pacientů s ischemickou chorobou srdeční [26] a kardiovaskulárních příhod po perkutánní koronární intervenci [27]. U pacientů s diabetickou nefropatií je zvýšená ADMA spojena se zvýšenou prevalencí kardiovaskulárních příhod [28]. Naopak snížení ADMA pravidelným aerobním cvičením tak může přispět ke snižování kardiovaskulárního rizika u pacientů po transplantaci ledvin. Je zajímavé, že snížení hladiny ADMA bylo spojeno i se změnami v klasických rizikových faktorech metabolizmu lipidů a sacharidů. Navíc opětné zvýšení hladiny ADMA po ukončení cvičebního programu naznačuje, že je třeba dlouhodobé fyzické aktivity pro udržení nižšího kardiovaskulárního rizikového profilu [17]. Potvrzení předpokladu, že snížená koncentrace ADMA je spojena se sníženou kardiovaskulární morbiditou, vyžaduje proto delší sledování s klinickou kontrolou.
Na rozdíl od našich nálezů studie u pacientů s chronickým srdečním selháním ukazují, že hladina ADMA u těchto nemocných nemusí být vždy ovlivněna aerobním cvičením [29]. V této studii ale hladiny ADMA u pacientů i kontrol byly podobné před zahájením cvičebního programu, a tedy normální koncentrace ADMA již nebyla cvičením dále snižována. V lidském těle ADMA vzniká především metylací L-argininu metyltransferázami. Celková degradace ADMA dimetylaminohydrolázou (DDAH) významně determinuje zvýšení koncentrace ADMA, zatímco podíl degradace ledvinami je považován za méně důležitou cestu eliminace [30]. SDMA není metabolizován DDAH a je vylučován pouze ledvinami [31,32].
Mechanizmy účinku cvičení vedoucí ke snížení ADMA však nelze přímo uzavřít z výsledků naší studie. Není pravděpodobné, že změny ve funkci ledvin, které se rovněž týkaly ovlivnění endoteliální funkce [33], rozhodujícím způsobem vedly ke snížení ADMA v plazmě, protože inulinová a kreatininová clearance zůstaly v normálním rozmezí u pacientů po transplantaci a nelišily se na konci sledovaného údobí. Je pravděpodobné, že pravidelné aerobní cvičení může mít vliv i na antioxidační stav organizmu prostřednictvím zvýšené exprese superoxid dismutázy [34] a zlepšení antioxidačního statusu souvisí s redukcí ADMA. Studie in vitro prokázala, že glukóza může snížit činnost DDAH [35]. Nicméně, změny v metabolizmu sacharidů v naší studii byly jen na hranici statistické signifikance.
Pouze mírné zlepšení kompenzace diabetu je v souladu s předchozími výsledky ukazujícími, že tělesná aktivita neznamená automaticky zlepšení kompenzace diabetu u pacientů po transplantaci ledvin bez upravené diety [36]. Krevní lipidy se mírně zlepšily po 6měsíčním tréninku a také jejich spojení se změnami ADMA nelze vyloučit. Změny v ADMA však mohou být zcela nezávislé, jak bylo zjištěno v několika dalších studiích [36,37].
Studie u nemocných po transplantaci ledviny prokázaly, že s rozvojem funkce ledvin se původně vysoká koncentrace ADMA snižuje, ale tyto hodnoty zůstávají 2–3krát vyšší ve srovnání se netransplantovanými jedinci se stejnou úrovní glomerulární filtrace. U pacientů po transplantaci užívajících dlouhodobě imunosupresi můžeme uvažovat o vlivu těchto léků především s ohledem na jejich vedlejší metabolický účinek (inzulinová rezistence se sníženou aktivitou DDAH po podání steroidů) [38].
Protokol studie nedovolil srovnat účinky cyklosporinu A a takrolimu. Dřívější údaje naznačují, že inhibitory kalcineurinu mohou vyvolat endoteliální dysfunkce u pacientů po transplantaci ledvin, pravděpodobně potlačením syntézy NO [38]. Podle našich výsledků hladiny ADMA byly signifikantně vyšší u obézních pacientů po transplantaci ledvin, ačkoli imunosupresivní režimy byly srovnatelné v obou skupinách. Pravděpodobné vysvětlení souvisí s významnými rozdíly v tukové hmotě spojené se zvýšenou tvorbou adipocytokinů [39]. Vývoj proteinurie po transplantaci ledvin také částečně souvisí s endoteliální dysfunkcí pří zvýšené úrovni ADMA. Obezita a redukce hmotnosti byly spojeny se změnami funkce endotelu [40]. Klinické studie prokázaly snížení NO-dependentní vazodilatace u obézních osob ve srovnání s osobami neobézními. Je proto možné, že zvýšené koncentrace ADMA by mohly přispět k rozvoji endoteliální dysfunkce u obezity [38]. Vliv předepsané diety nelze zcela vyloučit jako důvod pro zvýšení ADMA. Nicméně zvýšený příjem sacharidů je spojen se snížením koncentrace ADMA, zatímco vliv příjmu bílkovin a tuků na ADMA nebyl prokázán [41].
Vliv antihypertenzivní léčby na hladiny ADMA není dosud zcela objasněn. Dlouhodobá léčba s užitím ACE inhibitorů vedla ke snížení plazmatické koncentrace ADMA. Vyloučení pacientů s antihypertenzní léčbou ze statistického hodnocení však nezměnilo výsledky, a nemělo tak významný vliv na ovlivnění hladiny ADMA [42]. Vliv na zvýšené riziko kardiovaskulárního onemocnění u nemocných v CHRI a po transplantaci ledviny mohou mít i další faktory. CHRI je často spojeno s vyšší plazmatickou hladiny adiponektinu. Důvody pro toto zvýšení nejsou zcela jasné, lze však předpokládat roli porušené metabolické degradace. Po úspěšné transplantaci ledvin hladina adiponektinu může mírně klesat, což podporuje představu o podílu ledvin na jeho biodegradaci a eliminaci [15,43]. Jasná korelace mezi změnou funkce ledviny a snížení plazmatického adiponektinu nebyla v naší studii prokázána. Tyto údaje podporují názor, že hladinu adiponektinu ovlivňují další faktory, především obsah tukové tkáně a přítomnost chronického zánětu [44]. Snížení zánětlivých parametrů po transplantaci i v souvislosti s cvičebním režimem by tak mohlo ovlivnit hladinu ADPN [45].
U leptinu jsme zjistili jeho pokles po cvičebním režimu se současným zvýšením hladin solubilního leptinového receptoru.
Rezistin byl původně objeven v tukových buňkách a jeho hladina byla zvýšena při obezitě. Jeho významná role však může být v jeho prozánětlivých účincích [46]. Jeho pokles v naší studii mohl souviset s poklesem prozánětlivých markerů po pravidelném cvičení.
Visfatin je novým adipocytokinem, který je zvýšen ve viscerálních tukových buňkách. Visfatin má kromě energetického metabolizmu svoji roli v přirozené imunitě a zánětu. V poslední několika letech byl objeven jeho prozánětlivý až tkáň destruktivní účinek [47]. Jeho pokles by mohl souviset se snížením celkové prozánětlivé aktivity po pravidelném cvičení.
Limitem naší studie je nemožnost srovnání výsledků cvičení u nemocných s CHRI a u transplantovaných nemocných bez imunosupresivní léčby. Také role obezity ve skupině necvičících nemocných nebyla podrobněji analyzována. Soubor nemocných po transplantaci ledviny byl heterogenní z hlediska základní diagnózy ledvinového selhání (diabetes mellitus v 7 případech). Naši pacienti neměli klinické projevy závažné aterosklerózy a vztahy mezi ADMA a kardiovaskulární morbiditou byly popsány především u pacientů s manifestním cévním onemocněním. Je tedy zřejmé, že cvičení může snížit ADMA po transplantaci ledvin především u kardiovaskulárních pacientů. Kromě toho není v současné době známo, zda ADMA může být dále snížena u jinak zdravých osob nebo je-li snížení pod normální hodnoty výhodné pro endoteliální funkci.
Závěr
Závěry studie lze shrnout tak, že u pacientů po transplantaci ledviny pravidelná fyzická aktivita po dobu 6 měsíců snížila zvýšené koncentrace ADMA a dalších rizikových faktorů pro rozvoj kardiovaskulárního onemocnění. Snížení hladiny ADMA by tak mohlo snížit kardiovaskulární riziko těchto pacientů. Získané výsledky však musí být ještě potvrzeny v dlouhodobých studiích kardiovaskulárních komplikací po transplantaci ledviny.
Studie byla podpořena grantem NS/10518-3//2009 uděleným Interní grantovou agenturou České republiky.
Autoři jsou zavázáni paní V. Kuncové za technickou pomoc.
prof. MUDr. Vladimír Teplan, DrSc.
www.ikem.cz
e-mail: vladimir.teplan@ikem.cz
Doručeno do redakce: 30. 3. 2012
Přijato po recenzi: 9. 5. 2012
Sources
1. Kielstein JT, Böger RH, Bode-Böger SM et al. Marked increase of asymmetric dimethylarginine in patients with incipient primary chronic renal disease. J Am Soc Nephrol 2002; 13 : 170–176.
2. Cooke JP. Asymmetrical dimethylarginine: the Uber marker? Circulation 2004; 109 : 1813–1818.
3. Zoccali C, Kielstein J. Asymmetric dimethylarginine: a new player in the pathogenesis of renal disease? Curr Opin Nephrol Hypertens 2006; 15 : 314–320.
4. Krzyzanowska K, Mittermayer F, Kopp HP et al. Weight loss reduces circulating asymmetrical dimethylarginine concentrations in morbidity obese women. J Clin Endocrinol Metab 2004; 89 : 6277–6281.
5. Meier-Kriesche HV, Arndorfer JA, Kaplan B. The impact of body mass index on renal transplant outcomes: a significant independent risk factor for graft failure and patient death. Transplantation 2002; 73 : 70–74.
6. Boots JM, Christiaans MH, van Hooff JP. Effect of immunosuppressive agents on long-term survival of renal transplant recipients: focus on the cardiovascular risk. Drugs 2004; 64 : 2047–2073.
7. Axelsson J, Heimbürger O, Lindholm B et al. Adipose tissue and its relation to inflammation: the role of adipokines. J Ren Nutr 2005; 15 : 131–136.
8. Zoccali C, Mallamaci F, Tripepi G. Adipose tissue as a source of inflammatory cytokines in health and disease: focus on end-stage renal disease. Kidney Int 2003; 63 (Suppl 84): S65–S68.
9. de Mattos AM, Prather J, Olyaei AJ et al. Cardiovascular events following renal transplantation: role of traditional and transplant-specific risk factors. Kidney Int 2006; 70 : 757–764.
10. Fazelzadeh A, Mehdizadeh A, Ostovan MA et al. Incidence of cardiovascular risk factors and complications before and after kidney transplantation. Transplant Proc 2006; 38 : 506–508.
11. Yilmaz MI, Saglam M, Caglar K et al. Endothelial functions improve with decrease in asymmetric dimethylarginine (ADMA) levels after renal transplantation. Transplantation 2005; 80 : 1660–1666.
12. el-Agroudy AE, Wafa EW, Gheith OE et al. Weight gain after renal transplantation is a risk factor for patients and graft outcome. Transplantation 2004; 77 : 1381–1385.
13. Weisberg SP, McCann D, Desai M et al. Obesity is associated with macrophage accumulation in adipose tissue. J Clin Invest 2003; 112 : 1796–1808.
14. Haluzik M, Parizkova J, Haluzik MM. Adiponectin and its role in the obesity-induced insulin resistance and related complications. Physiol Res 2004; 53 : 123–129.
15. Chudek J, Adamczak M, Karkoszka H et al. Plasma adiponectin concentration before and after successful kidney transplantation. Transplant Proc 2003; 35 : 2186–2189.
16. Armstrong KA, Campbell SB, Hawley CM et al. Obesity is associated with worsening cardiovascular risk factor profiles and proteinuria progression in renal transplant recipients. Am J Transplant 2005; 5 : 2710–2718.
17. Mittermayer F, Pleiner J, Krzyzanowska K et al. Regular physical exercise normalizes elevated asymmetrical dimethylarginine concentrations in patients with type 1 diabetes mellitus. Wien Klin Wochenschr 2005; 117 : 816–820.
18. Fuhrmann I, Krause R. Principles of exercising in patients with chronic kidney disease, on dialysis and for kidney transplant recipients. Clin Nephrol 2004; 61 (Suppl 1): S14–S25.
19. Painter P, Carlson L, Carey S et al. Physical functioning and health-related quality of life changes with exercise training in hemodialysis patients. Am J Kidney Dis 2000; 35 : 482–492.
20. Mahrova A, Švagrová K, Bunc V et al. Fyzická a psychická kondice u jedinců po transplantaci ledviny – význam časné pohybové intervence. Aktual Nefrol 2011; 17 : 30–40.
21. Painter PL, Tomlanovich SL, Hector LA et al. A randomized trial of exercise training after renal transplantation. Transplantation 2002; 74 : 42–48.
22. Korabiewska L, Lewandowska M, Juskowa J et al. Need for rehabilitation in renal replacement therapy involving allogenetic kidney transplantation. Transplant Proc 2007; 39 : 2776–2777.
23. Mahrová A, Bunc V, Panáček V et al. Exercise rehabilitation during haemodialysis – clinical experience. Aktual Nefrol 2009; 15 : 16–24.
24. McLaughlin T, Stühlinger M, Lamendola C et al. Plasma asymmetric dimethylarginine concentrations are elevated in obese insulin-resistant women and fall with weight loss. J Clin Endocrinol Metab 2006; 91 : 1896–1900.
25. Wiecek A, Kokot F, Chudek J et al. The adipose tissue: a novel endocrine organ of interest to the nephrologist. Nephrol Dial Transplant 2002; 17 : 191–195.
26. Valkonen VP, Päivä H, Salonen JT et al. Risk of acute coronary events and serum concentration of asymmetrical dimethylarginine. Lancet 2001; 358 : 2127–2128.
27. Lu TM, Ding YA, Lin SJ et al. Plasma levels of asymmetrical dimethylarginine and adverse cardiovascular events after percutaneous coronary intervention. Eur Heart J 2003; 24 : 1912–1919.
28. Tarnow L, Hovind P, Teerlink T et al. Elevated plasma asymmetric dimethylarginine as a marker of cardiovascular morbidity in early diabetic nephropathy in type 1 diabetes. Diabetes Care 2004; 27 : 765–769.
29. Niebauer J, Clark AL, Webb-Peploe KM et al. Home-based exercise training modulates pro--oxidant substrates in patients with chronic heart failure. Eur J Heart Fail 2005; 7 : 183–188.
30. Achan V, Broadhead M, Malaki M et al. Asymmetric dimethylarginine causes hypertension and cardiac dysfunction in humus and is actively metabolized by dimethylarginine dimethylaminohydrolase. Arterioscler Thromb Vasc Biol 2003; 23 : 1455–1459.
31. Ogawa T, Kimoto M, Sasaoka K. Purification and properties of a new enzyme, NG, NG-dimethylarginine dimethylaminohydrolase, from rat kidney. J Biol Chem 1989; 264 : 10205–10209.
32. Kimoto M, Tsuji H, Ogawa T et al. Detection of NG, NG-dimethylarginine dimethylaminohydrolase in the nitric oxide-generating systems of rats using monoclonal antibody. Arch Biochem Biophys 1993; 300 : 657–662.
33. Zaletel J, Cerne D, Lenart K et al. Renal functional reserve in patients with Type 1 diabetes mellitus. Wien Klin Wochenschr 2004; 116 : 246–251.
34. Fukai T, Siegfried MR, Ushio-Fukai M et al. Regulation of the vascular extracellular superoxide dismutase by nitric oxide and exercise training. J Clin Invest 2000; 105 : 1631–1639.
35. Lin KY, Ito A, Asagami T et al. Impaired nitric oxide synthase pathway in diabetes mellitus: role of asymmetric dimethylarginine and dimethylarginine dimethylaminohydrolase. Circulation 2002; 106 : 987–992.
36. Mittermayer F, Mayer BX, Meyer A et al. Circulating concentrations of asymmetrical dimethyl-L-arginine are increased in women with previous gestational diabetes. Diabetologia 2002; 45 : 1372–1378.
37. Päivä H, Lehtimäki T, Laakso J et al. Plasma concentrations of asymmetric-dimethyl-arginine in type 2 diabetes associate with glycemic control and glomerular filtration rate but not with risk factors of vasculopathy. Metabolism 2003; 52 : 303–307.
38. Valkonen VP, Laakso J, Päivä H et al. Asymmetrical dimethylarginine (ADMA) and risk of acute coronary events. Does statin treatment influence plasma ADMA levels? Atheroscler 2003; 4 : 19–22.
39. Teplan V, Malý J, Gürlich R et al. Muscle and fat metabolism in obesity after kidney transplantation: no effect of peritoneal dialysis or hemodialysis. J Ren Nutr 2012; 22 : 166–170.
40. Oflaz H, Turkmen A, Kazancioglu R et al. The effects of calcineurin inhibitors on endothelial function in renal transplant recipients. Clin Transplant 2003; 17 : 212–216.
41. Sciacqua A, Candigliota M, Ceravolo R et al. Weight loss in combination with physical activity improves endothelial dysfunction in human obesity. Diabetes Care 2003; 26 : 1673–1678.
42. Päivä H, Lehtimäki T, Laakso J et al. Dietary composition as a determinant of plasma asymmetric dimethylarginine in subject with mild hypercholesterolemia. Metabolism 2004; 53 : 1072–1075.
43. Ito A, Egashira K, Narishige T et al. Renin--angiotensin system is involved in the mechanism of increased serum asymmetric dimethylarginine in essential hypertension. Jpn Circ J 2001; 65 : 775–778.
44. Havel PJ. Control of energy homeostasis and insulin action by adipocyte hormones: leptin, acylation stimulating protein and adiponectin. Curr Opin Lipidol 2002; 13 : 51–59.
45. Stenvienkel P, Marchlewska A, Pecoits-Filho R et al. Adiponectin in renal disease: relationship to phenotype and genetic variation of the gene encoding adiponectin. Kidney Int 2004; 65 : 274–281.
46. Sharma AM, Chettey VT. Obesity, hypertension and insulin resistance. Acta Diabetol 2005; 42 (Suppl 1): S3–S8.
47. Senolt L, Krystufkova O, Hulejova H. The level of serum visfatin (PBEF) is associated with total number of B cells in patients with rheumatoid arthritis and decreases following B cell depletion therapy. Cytokine 2011; 55 : 116–121.
Labels
Diabetology Endocrinology Internal medicineArticle was published in
Internal Medicine

2012 Issue 9
-
All articles in this issue
- Srovnání dvou metod dlouhodobého externího telemonitorování EKG po ablaci fibrilace síní
- Časný pohybový režim snižuje asymetrický dimetylarginin po transplantaci ledviny
- Povrchová tromboflebitida, neprávem podceňovaná choroba – je čas změnit názor?
- Léková compliance – úskalí terapie revmatoidní artritidy?
- Peripartální život ohrožující krvácení – mezioborové konsenzuální stanovisko
- Upozornění na nebezpečí invazivních infekcí u splenektomovaných pacientů. Zkušenosti z FN Brno 2011
- Morbus Weil – kazuistika a princípy
- Nádor srdce manifestující se náhlou srdeční smrtí
- Naše zkušenosti s léčbou multicentrické plazmocelulární Castlemanovy choroby s projevy vaskulitidy – popis případu a přehled literatury
- Hyperventilační echokardiografie v diagnostice vazospastické anginy pectoris
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue
- Povrchová tromboflebitida, neprávem podceňovaná choroba – je čas změnit názor?
- Upozornění na nebezpečí invazivních infekcí u splenektomovaných pacientů. Zkušenosti z FN Brno 2011
- Morbus Weil – kazuistika a princípy
- Hyperventilační echokardiografie v diagnostice vazospastické anginy pectoris
