Současný přístup k léčbě pacientů s metastatickým kolorektálním karcinomem
The current approach to the treatment of the patients with metastatic colorectal cancer
Colorectal cancer is one of the most common malignant tumors. Despite the constant promotion of prevention remains around 20 – 30% of cases diagnosed in the metastatic stage and approximately 50 – 60% of patients developed the late dissemination. In 80 – 90% of them we can find already unresectable metastases. Although surgical treatment is basic modality of therapy, with using modern targeted therapy in combination with chemotherapy we can achieve long‑term complete remission in the cases of advanced tumor and we can significantly prolonged the life of patients with this disease now. About 40 – 50% patients in advanced stages who underwent metastasectomy survives 5-years and 10‑year survival rate is up to 25%. When administered systemic treatment median overall survival in these cases reaches around 24 months.
Key words:
colorectal cancer – liver metastases – conversion therapy – targeted treatment
:
J. Halámková 1,2; J. Tomášek 1
; S. Rybníčková 3; D. Adámková Krákorová 1; B. Bencsiková 1; I. Kiss 1
:
Klinika komplexní onkologické péče Lékařské fakulty MU a MOÚ Brno, přednosta prof. MU Dr. Rostislav Vyzula, CSc.
1; Ústav lékařské etiky Lékařské fakulty MU Brno, přednosta doc. Mgr. Josef Kuře, Dr. phil.
2; Oddělení radiologie Masarykova onkologického ústavu Brno, přednostka prim. MU Dr. Helena Bartoňková
3
:
Vnitř Lék 2013; 59(10): 903-908
:
Review
Kolorektální karcinom je jedním z nejčastějších zhoubných nádorů. I přes stálou propagaci prevence přetrvává kolem 20 – 30 % onemocnění diagnostikovaných v metastatickém stadiu a přibližně u 50 – 60 % nemocných dojde k pozdní diseminaci. U 80 – 90 % z nich jsou metastázy již neresekabilní. I když je chirurgická léčba základní léčebnou modalitou, lze nyní využitím moderní biologické léčby v kombinaci s chemoterapií dosáhnout dlouhodobé kompletní remise i v případě pokročilého nádoru a tak významně prodloužit život pacientů s tímto onemocněním, 5 let se tak u pacientů v pokročilých stadiích onemocnění, kteří podstoupili metastazektomii, dožívá 40 – 50 % z nich a 10 let až 25 % těchto nemocných, u kterých medián celkového přežití v případě podání pouze systémové léčby dosahuje kolem 24 měsíců.
Klíčová slova:
kolorektální karcinom – jaterní metastázy – konverzní léčba – cílená terapie
Úvod
Kolorektální karcinom patří v České republice k nejčastějším zhoubným novotvarům, představuje kolem 15 % všech onkologických onemocnění. Jedná se o nejčastější nádorové onemocnění trávicího traktu. V roce 2009 jeho incidence dosáhla 93/ 100 000 u mužů a 62/ 100 000 u žen [1]. I přes stálou propagaci prevence kolorektálního karcinomu přetrvává kolem 20 – 30 % onemocnění diagnostikovaných v metastatickém stadiu (mCRC) v podobě synchronních metastáz nejčastěji v játrech [2] a přibližně u 50 – 60 % nemocných s kolorektálním karcinomem dojde k pozdní diseminaci a vzniku metachronních metastáz, z nichž kolem 80 – 90 % má metastázy v játrech již neresekabilní [3]. Jedinou reálnou nadějí na víceleté prodloužení života v dobré kvalitě nebo úplné vyléčení poskytuje chirurgická léčba v kombinaci se systémovou protinádorovou terapií [4]. Celkové 5leté přežití je u pacientů, kteří podstoupili metastazektomii, 40 – 50 % a 10 let se tak dožívá až 25 % těchto nemocných [5,6]. K chirurgické léčbě jsou indikováni všichni nemocní, u nichž lze podle předoperačních nálezů očekávat radikální (kurativní) výkon odstraňující veškerou nádorovou tkáň (R0 resekce). Vždy však musíme zhodnotit dlouhodobou prognózu pacienta a na základě negativních prognostických kritérií vyloučit ty pacienty, kteří by z chirurgické léčby neměli prospěch.
Po zhodnocení prognózy je pacient zařazen do jedné z následujících skupin:
- pacient inoperabilní s nepředpokládanou konverzí metastáz v operabilní,
- pacient primárně inoperabilní s předpokládanou konverzí metastáz v operabilní a
- pacient primárně operabilní.
V minulosti bylo podání neoadjuvantní systémové terapie v první řadě indikováno u pacientů s neresekabilními jaterními metastázami s cílem zmenšení ložisek a konverze těchto metastáz v resekabilní [7]. V posledních letech se však dostává do popředí i u pacientů s primárně resekabilními ložisky, kdy je cílem eliminovat okultní ložiska nádoru a zhodnotit léčebnou odpověď na podávanou chemoterapii, která je pak podávána i v adjuvantní indikaci po resekci jaterních ložisek. Rychlá progrese nádoru v případě agresivního průběhu většinou kontraindikuje chirurgické řešení, z kterého by pravděpodobně pacient neměl žádný prospěch.
Před rokem 2000 byla farmakologická léčba kolorektálního karcinomu omezena na režimy na bázi 5 - fluorouracilu a leukovorinu (kombinace FUFA). Zavedení nových cytostatik (oxaliplatina, irinotekan, kapecitabin) a jejich kombinací do praxe výrazným způsobem rozšířilo léčebné možnosti. Kombinační režimy oxaliplatina v kombinaci s fluorouracilem a leukovorinem (FOLFOX) a irinotekan ve stejné kombinaci (FOLFIRI) mají vyšší účinnost vyjádřenou prodlouženým přežitím než samotná kombinace FUFA, navíc lze oba režimy podat navzájem sekvenčně (FOLFOX/ FOLFIRI nebo FOLFIRI/ FOLFOX). Těmito cytostatiky lze dosáhnout až 50 % objektivních léčebných odpovědí s mediánem přežití kolem 24 měsíců [8 – 11]. Režimy FOLFOX a FOLFIRI jsou tzv. kontinuální. 5 - fluorouracil je v těchto režimech podáván kontinuální infuzí 48 hod. Fluorouracil lze plně nahradit perorálním kapecitabinem, což pozitivně ovlivní kvalitu života pacienta (např. režim XELOX). Případně lze využít kombinace všech výše uvedených cytostatik v režimu FOLFOXIRI, u kterého bylo dosaženo resekability o 9 % více oproti samotné kombinaci FOLFIRI s mediánem celkového přežití 23,4 měsíce vs 16,7 měsíce (p = 0,026). Zásadní nevýhodou tohoto režimu je však poměrně významná toxicita [12].
Obecně patří kolorektální karcinom mezi onemocnění se střední senzitivitou k chemoterapii, a proto se právě zde dostává stále více do popředí biologická (cílená) léčba, která se stala výrazným zlomem v léčbě pokročilého kolorektálního karcinomu. Kromě již v praxi běžně užívaných preparátů, jako jsou bevacizumab, cetuximab či panitumumab, se objevují zcela nové léky, jako aflibercept či regorafenib.
Bevacizumab (Avastin®) je rekombinantní humanizovaná monoklonální protilátka antiVEGF (vaskulární endoteliální růstový faktor), která zabraňuje interakci mezi VEGF a tyrozinkinázovými receptory VEGFR1 a VEGFR2, které hrají významnou roli při regulaci angiogeneze. Z nežádoucích účinků se mohou vyskytnout např. hypertenze, arteriální tromboembolie, krvácení, zhoršené hojení ran, proteinurie či velmi vzácně perforace střeva. Je třeba být obezřetní u pacientů, kteří jsou léčení antikoagulancií. Bevacizumab se aplikuje obvykle v intravenózní infuzi v dávce 5 mg/ kg, ve 2. linii 10 mg/kg každé 2 týdny či 7,5 mg/ kg každé 3 týdny. Účinnost bevacizumabu trvá u pacientů s metastatickým kolorektálním karcinomem také po první progresi, kdy je změněna chemoterapie a bevacizumab ponechán. Tento postup vede oproti samotné chemoterapii 2. linie k prodloužení jak celkového přežití (OS), tak přežití bez progrese (PFS) [13].
Na rozdíl od některých dalších biologických preparátů bevacizumab nemá prediktor odpovědi na léčbu.
Toto však není případ inhibitorů EGFR, jejichž efekt lze predikovat na základě vyšetření stavu onkogenů rodiny RAS v nádoru či metastáze. Patří sem onkogeny KRAS a NRAS. V nádorech s mutovanou verzí je RAS trvale aktivován, v nádorech s nemutovanou verzí RAS (wild type – wt ‑ RAS) je protein kódovaný RAS onkogeny pouze přechodně aktivován přes EGFR. Navázáním antiEGFR protilátky tak dojde k inaktivaci této signální dráhy. Průkaz wild typu RAS je podmínkou pro indikaci léčby panitumumabem, význam NRAS u cetuximabu doposud nebyl prokázán a pro jeho indikaci stačí průkaz wt-KRAS.
Cetuximab (Erbitux®) je chimerická monoklonální antiEGFR protilátka IgG1. Kompetitivně se váže na extracelulární doménu EGFR. Z nežádoucích účinků jde především o akneiformní exantém, jehož výskyt bývá spojen s lepší léčebnou odpovědí. Závažným nežádoucím účinkem je však anafylaktoidní reakce při aplikaci, která může být až život ohrožující. Cetuximab se podává v nasycovací dávce 400 mg/ m2 a v další dávce se pokračuje obvykle 250 mg/ m2 1krát týdně.
Panitumumab (Vectibix®) je rekombinantní plně humánní monoklonální protilátka IgG2 - k s afinitou k EGFR. Z nežádoucích účinků se mohou objevit průjem, hypokalemie, hypokalcemie či hypomagnezemie, proto je nutné monitorovat hladiny iontů. Nejčastější jsou však kožní příznaky v podobě vyrážky, může se vyskytnout také intersticiální pneumonitida či plicní fibróza. Alergická reakce na podání bývá výjimečná vzhledem k tomu, že se jedná o monoklonální protilátku humánního typu. Panitumumab je aplikován v dávce 6 mg/ kg každé 2 týdny.
Aflibercept (Zaltrap®), označovaný též jako VEGF Trap (doslova „past na VEGF“), je rekombinantní fúzní protein, který se skládá z VEGF ‑ vazebných částí tvořených extracelulárními doménami lidských VEGF receptorů 1 a 2, fúzovaných k Fc části lidského IgG1. Tato protilátka váže veškerý cirkulující VEGF. Mechanizmus účinku je tedy obdobný bevacizumabu, stejně tak jako nežádoucí účinky. Podává se v dávce 4 mg/ kg 1krát za 14 dní. Ve studii VELOUR byl testován ve 2. linii v kombinaci s FOLFIRI u pacientů po selhání léčby založené na oxaliplatině zahrnující i pacienty léčené bevacizumabem, prodloužení celkového přežití však bylo v porovnání s placebem 1,4 měsíce (13,5 měsíce vs 12,1 měsíce; HR 0,82; CI 95% 0,71 – 0,94; p = 0,003), čas do progrese byl 6,90 vs 4,67 měsíce (p = 0,00007) a celková odpověď 19,8 % vs 11,1 % (p = 0,0001) [14].
Regorafenib (Stivarga®) je multikinázový inhibitor VEGFR, FGFR, PDGFR, BRAF, KIT a RET – receptorů a proteinů zahrnutých do procesů nádorového růstu, tvorby mikroprostředí nádoru a angiogeneze. Ve studii CORRECT prodloužil ve srovnání s placebem celkové přežití taktéž o 1,4 měsíce (6,4 měsíce vs 5,0 měsíců; HR 0,77; CI 95% 0,64 – 0,94; p = 0,005) [15]. Podává se perorálně v dávce 160 mg denně 3 týdny s následnou týdenní pauzou ve 4týdenních cyklech. Nejčastějšími nežádoucími účinky jsou únava, průjem, hypertenze a syndrom palmoplantární dysestezie.
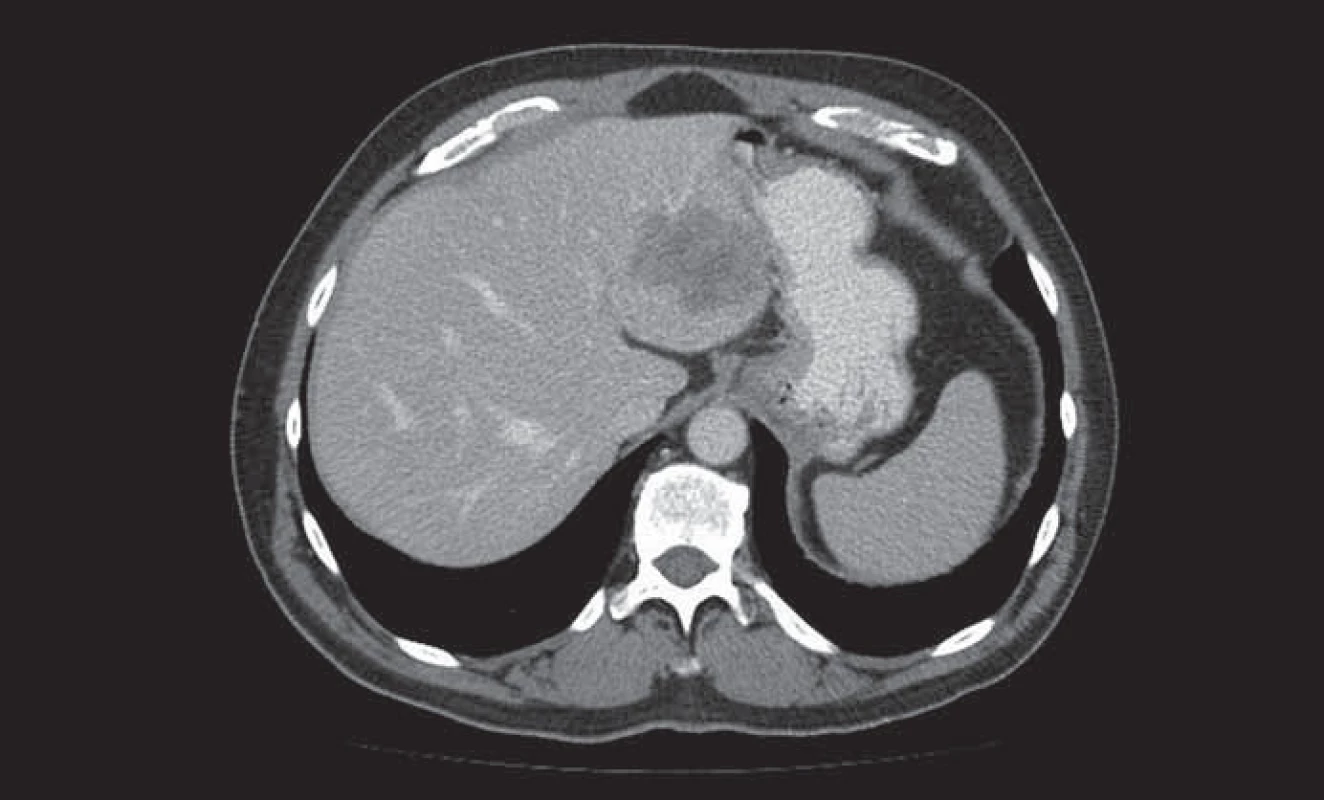
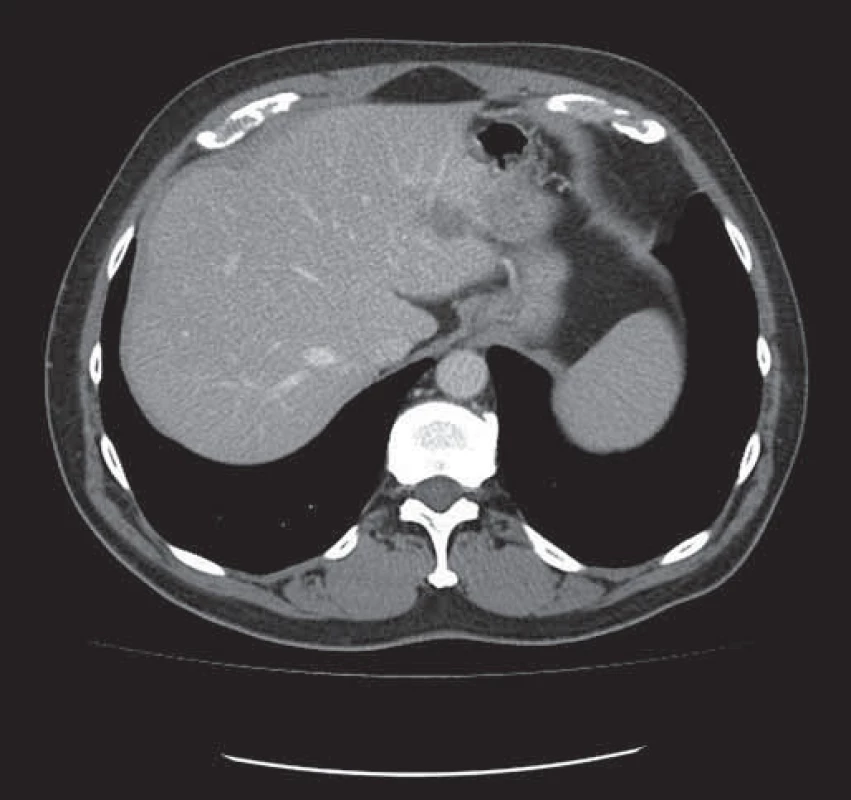
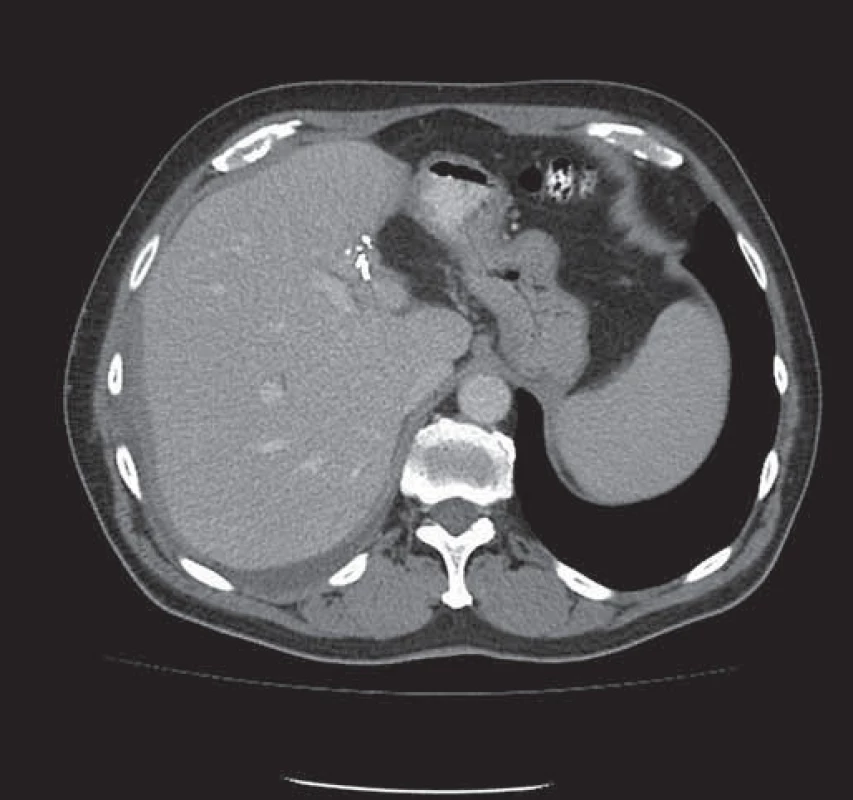
Konverzní léčba primárně neresekabilních jaterních metastáz
Asi u 10 – 25 % nemocných jsou jaterní metastázy primárně resekabilní nebo hraničně resekabilní, 3/ 4 případů jsou pak hodnoceny jako neresekabilní. Tam, kde je radikální resekce možná, je 5leté přežití dosaženo ve 40 – 50 % [16,17]. U těch pacientů, kde potenciální konverze na resekabilní onemocnění není očekávatelná, je hlavním cílem léčby založené především na chemoterapii/ chemobioterapii prodloužení života v jeho dostatečné kvalitě. Pro ty, u kterých je plánován do budoucna chirurgický výkon, je základní myšlenkou jeho dobré načasování. Nepřiměřeně dlouhé čekání na nejvhodnější léčebnou odpověď systémové terapie může v konečném důsledku potenciálně resekabilní onemocnění proměnit v navždy neresekabilní. Proto je žádoucí pravidelné hodnocení efektu léčby nejlépe ve 2měsíčních intervalech, prolongovaná cytotoxická léčba vede ke zvýšení morbidity resekcí a může vyústit i ve vymizení metastáz na zobrazovacích metodách (tzv. missing metastases) s velkým rizikem vitálního rezidua.
Recentně byla konverze v resekabilní onemocnění studována ve srovnání režimů FOLFIRI a FOLFOX v kombinaci s antiEGFR inhibitorem (cetuximab) ve studii II. fáze CELIM. Retrospektivně bylo zjištěno, že v léčebném rameni s cetuximabem se možnost resekability zvyšuje z 32 % až na 60 % (p < 0,0001). Zásadním prognostickým faktorem je však počet metastáz. V této studii byl medián přežití bez známek onemocnění ve skupině pacientů s 1 – 4 metastázami 16,8 měsíce, u 5 – 10 metastáz byl DFS 8,2 měsíce a v případech s více než 10 metastázami byl DFS jen 2 měsíce. Dalším signifikantním prognostickým faktorem je dosažená léčebná odpověď. Pacienti s metastatickým postižením pouze v oblasti jater mají lepší prognózu než pacienti s postižením dalších orgánů [18]. Zdá se, že cetuximab v kombinaci s chemoterapií nezvyšuje toxicitu vyvolanou cytostatickou léčbou samotnou. Jeho výhodou je, že nemá na rozdíl od bevacizumabu vliv na hojení ran, a proto není třeba přerušovat léčbu před chirurgickým výkonem, ani nezvyšuje riziko krvácivých komplikací.
Na kongresu ASCO (Americká společnost pro klinickou onkologii) byla v letošním roce prezentována studie FIRE ‑ 3, která byla zaměřena na 1. linii léčby mCRC s wt ‑ KRAS. Ve studii byl zkoumán efekt cetuximabu v kombinaci s FOLFIRI a srovnávacím ramenem byl režim FOLFIRI s bevacizumabem. Primárním cílem studie bylo dokázat, že v rameni s cetuximabem bude dosaženo vyšší léčebné odpovědi, tohoto cíle však dosaženo nebylo, léčebná odpověď byla v obou ramenech obdobná (FOLFIRI + cetuximab 62,0 % vs FOLFIRI + bevacizumab 58,0 %; p = 0,183), také doba přežití bez progrese (PFS) se významně nelišila (10,0 vs 10,3 měsíce). Vzhledem k těmto výsledkům byl poněkud překvapivý statisticky významný rozdíl v celkovém přežití ve prospěch režimu s cetuximabem (28,7 vs 25,0 měsíce; p = 0,017). Křivky přežití se od sebe oddělují po 24 měsících, přičemž medián doby léčby 1. linií nedosáhl ani v jednom rameni půl roku (4,8 vs 5,3 měsíce). Co bylo příčinou lepšího výsledku při podání cetuximabu v 1. linii bylo a ještě bude předmětem diskuzí. Mohla to být jak léčba 1. linií, tak rozdílná léčba v dalších liniích již mimo studii [19]. Studie testující kombinace FOLFOX + cetuximab a FOLFOX + bevacizumab v současné době probíhají.
Chirurgickou léčbu mohou doplnit metody intervenční radiologie. Jedná se jednak o předoperační embolizaci větve portální žíly jaterního laloku postiženého metastázami s cílem hypertrofie zdravého jaterního parenchymu druhého laloku, která je indikována v případech, kdy budoucí zbývající jaterní parenchym ( future liver remnant – FLR) tvoří 30 % u pacientů s normální jaterní funkcí a méně než 40 % u pacientů po předchozí extenzivní chemoterapii či jiném onemocnění ovlivňujícím jaterní funkci [20,21]. Kromě toho však mají význam v přísně indikovaných případech i lokální ablační metody v podobě radiofrekvenční ablace (RFA) či méně častější chemoembolizace (TACE). Provedení RFA však nemůže být doporučeno místo chirurgické léčby, kromě pacientů, kteří z nějakých důvodů nemohou chirurgickou léčbu absolvovat. RFA může být kombinována s resekčním výkonem s cílem eradikace nádoru. Vždy by však měly být ošetřeny všechny metastázy. Ablace pouze některých ložisek průběh onemocnění podstatně neovlivní.
Neoadjuvantní léčba primárně resekabilních jaterních metastáz
Pacienti v dobrém klinickém stavu s jednou metastázou pod 2 cm velikosti by měli být indikováni k primární metastazektomii [22]. U pacientů s větším postižením, byť primárně operabilních, se však zdá, že neoadjuvantní systémová léčba má své využití. V těchto případech je indikována z důvodu usnadnění operačního výkonu, a tím i zvýšení počtu pooperačních kompletních remisí, zkrácení doby rekonvalescence, k léčbě mikrometastáz a jako test chemorezistence nádoru.
Tento postup u primárně resekabilních metastáz je podpořen výsledky studie EORTC 40983 a navíc nerandomizovanou studií XELOX (oxaliplatina/ kapecitabin)/ FOLFOX [23].
Ve studii EORTC 40983, ve které byl testován efekt perioperačního podání chemoterapie FOLFOX 4 (6 cyklů před a 6 cyklů po chirurgickém výkonu) v porovnání s chirurgickým výkonem samotným, bylo zařazeno celkem 364 pacientů a u celkového počtu 303 pacientů, kteří absolvovali resekci jater, se čas do progrese ve 3 letech zvýšil o 9,2 %, z 33,2 % pacientů, kteří absolvovali pouze chirurgickou léčbu, na 42,4 % těch, kteří byli léčeni navíc i chemoterapií [17].
V červnu tohoto roku (2013) byla taktéž na konferenci ASCO prezentována studie New EPOC, která se věnovala neoadjuvantní léčbě resekabilních jaterních metastáz pacientů s mCRC wt ‑ KRAS. Šlo o akademickou studii III. fáze britských autorů. Zařazeni byli pacienti s technicky resekabilními metastázami, resekabilita mohla být hodnocena i jako hraniční. Pacienti byli randomizováni do ramene s chemoterapií samotnou (obvyklé režimy na bázi oxaliplatiny nebo irinotekanu, u malého procenta byl použit kapecitabin) nebo chemoterapií s cetuximabem. Do studie bylo zařazeno jen 272 pacientů a pak byla studie zastavena pro inferioritu ramene s cetuximabem [24]. Výsledky studie zatím nebyly publikovány in extenso, interpretace výsledků je tak obtížná. Pro praxi lze učinit závěr, že k neoadjuvantní léčbě technicky resekabilních metastáz CRC je lépe podat chemoterapii samotnou. V současnosti probíhá studie fáze III, která má ověřit přínos preoperační chemoterapie oproti pooperační chemoterapii samotné, výsledky však zatím nebyly publikovány.
U pacientů s resekabilními metastázami je však třeba rozlišit, zda se jedná o synchronní, tedy současný výskyt společně s primárním tumorem. V těchto případech jsou následující možnosti postupu:
- Resekce primárního nádoru a synchronní, případně následná metastazektomie následovaná adjuvantní léčbou, kdy synchronní operační zákrok je spojen s vyšší pooperační morbiditou [17,25 – 27].
- Neoadjuvantní léčba v délce 2 – 3 měsíce samostatně či v kombinaci s cílenou léčbou následovaná synchronní nebo postupnou kolektomií s metastazektomií. Současná resekce prima a metastáz se však nedoporučuje u předpokládaných velkých jaterních resekcí. Celková doba systémové léčby by neměla přesáhnout 6 měsíců. Resekce jater jako 1. krok je indikována v případě, že postižení jater je významnější než primární tumor, který je současně asymptomatický, a to zvláště pokud se jedná o karcinom rekta, který vyžaduje předoperační kombinační léčbu s radioterapií a následně provedení resekce rekta s anastomózou a zachováním svěrače [26,27].
V případě zahájení léčby neoadjuvantní terapií můžeme otestovat senzitivitu nádoru na podávanou kombinaci. V případě regrese bude mít pacient pravděpodobně velký prospěch z pokračování stejné léčby pooperačně, tedy adjuvantně. Menší část pacientů nemá z neoadjuvantní léčby benefit a dochází u nich k progresi onemocnění. Jedná se o pacienty s agresivním biologickým chováním tumoru, který je rezistentní k chemoterapii, případně biologické léčbě, a je otázkou, zda by tito pacienti měli benefit z okamžité chirurgické léčby.
Resekční výkony na játrech bývají spojeny s častou pooperační morbiditou, nejvhodnějším kandidátem je tedy pacient s nenarušenou funkcí nepostižené části jaterního parenchymu. Měli bychom tedy myslet na možné hepatální nežádoucí účinky systémové léčby, která primárně neresekabilnímu onemocnění často předchází, a to zvláště venookluzivní onemocnění jater při léčbě oxaliplatinou či vyšší riziko vzniku steatózy či steatohepatitidy u pacientů léčených irinotekanem [28]. Paradoxně přidání bevacizumabu do kombinace s režimem na bázi oxaliplatiny může riziko hepatopatie snížit [29]. Při podávání kombinací s bevacizumabem však nelze opomenout riziko krvácení či zhoršení hojení a regenerace jaterního parenchymu. V současné době se doporučuje odstup nejméně 4 týdny před chirurgickým výkonem obecně a až 8 týdnů od poslední aplikace bevacizumabu při elektivním výkonu na játrech [30].
Adjuvantní léčba po resekci metastáz jater
Po kurativní resekci by ve většině případů měla následovat adjuvantní léčba, konkrétní režim však není standardizován. Použití cílené léčby v adjuvanci je opodstatněné pouze v případech, kdy v předoperačním podání došlo při stejné léčbě k regresi metastáz. Jsou zkoušeny nejrůznější kombinace jak systémové, tak lokoregionální intraarteriální léčby. Portier et al v randomizované studii fáze III prokázali prodloužení času bez známek onemocnění u pacientů léčených adjuvantní kombinací FUFA po chirurgické resekci oproti chirurgické léčbě samotné [31], což svědčí ve prospěch podání adjuvantní léčby po resekci metastáz. Volba režimu však závisí na klinickém stavu pacienta, celkové předléčenosti a na odpovědi na případnou předoperační terapii.
Byly publikovány i studie sledující efekt intraarteriální lokoregionální chemoterapie, která může být podána cestou a. hepatica, obvykle v kombinaci se systémovou aplikací chemoterapie, jedná se však zatím o experimentální postup.
Závěr
Každý pacient s metastatickým kolorektálním karcinomem, u nějž lze předpokládat následnou léčbu, by měl být odeslán do onkologického centra, které má zkušenosti s podáním biologické léčby a ve kterém pracuje multidisciplinární onkologický tým za přítomnosti klinického onkologa, radioterapeuta, chirurga, gastroenterologa a radiologa s možností přizvání i dalších specialistů. Na základě posouzení rizikových faktorů a zhodnocení možnosti konvertability inoperabilního onemocnění v operabilní je pak zváženo podání systémové chemoterapie v kombinaci s biologickou léčbou. Díky multioborovému přístupu při využití nových možností společného působení chemoterapie a cílené biologické léčby lze v současnosti významně prodloužit život pacientům s kolorektálním karcinomem v dobré kvalitě i u pokročilých stadií onemocnění.
Tato práce byla financována z institucionální podpory výzkumné organizace poskytnuté Ministerstvem zdravotnictví ČR Masarykovu onkologickému ústavu v roce 2013.
MU Dr. Jana Halámková, Ph.D.
www.mou.cz
e‑mail: jana.halamkova@mou.cz
Doručeno do redakce: 15. 4. 2013
Přijato po recenzi: 6. 6. 2013, aktualizováno 5. 9. 2013
Sources
1. Ústav zdravotnických informací a statistiky ČR, Národní zdravotnický informační systém (NZIS), Národní onkologický registr (NOR), [online, citace 24. 3. 2013]. Dostupné z: http:/ / www.uzis.cz/ publikace/ novotvary ‑ 2009.
2. Muratore A, Zorzi D, Bouzari H et al. Asymptomatic colorectal cancer with un ‑ resectable liver metastases: immediate colorectal resection or up ‑ front systemic chemotherapy? Ann Surg Oncol 2007; 14 : 766 – 770.
3. Alberts SR, Horvath WL, Sternfeld WC et al. Oxaliplatin, fluorouracil, and leucovorin for patients with unresectable liver ‑ only metastases from colorectal cancer: a North Central Cancer Treatment Group phase II study. J Clin Oncol 2005; 23 : 9243 – 9249.
4. Vyzula R, Žaloudík J. Rakovina tlustého střeva a konečníku, vybrané kapitoly. Praha: Maxdorf 2007.
5. Rees M, Tekkis PP, Welsh FK et al. Evaluation of long‑term survival after hepatic resection for metastatic colorectal cancer: a multifactorial model of 929 patients. Ann Surg 2008; 247 : 125 – 135.
6. Fong Y, Fortner J, Sun RL et al. Clinical score for predicting recurrence after hepatic resection for metastatic colorectal cancer: analysis of 1,001 consecutive cases. Ann Surg 1999; 230 : 309 – 321.
7. Leonard GD, Brenner B, Kemeny NE. Neoadjuvant chemotherapy before liver resection for patients with unresectable liver metastases from colorectal carcinoma. J Clin Oncol 2005; 23 : 2038 – 2048.
8. Rothenberg M, Oza A, Bigelow R et al. Superiority of oxaliplatin and fluorouracil ‑ leucovorin compared with either therapy alone in patients with progressive colorectal cancer after irinotecan and fluorouracil ‑ leucovorin: Interim results of a phase III trial. J Clin Oncol 2003; 21 : 2059 – 2069.
9. Saltz L, Cox JV, Blanke C et al. Irinotecan plus fluorouracil and leucovorin for metastatic colorectal cancer. Irinotecan Study Group. N Engl J Med 2000; 343 : 905 – 914.
10. Van Cutsem E, Hoff PM, Harper P et al. Oral capecitabine vs intravenous 5 – flourouracil and leucovorin: Integrated efficacy data and novel analyses from two large, randomised phase III trials. Br J Cancer 2004; 90 : 1190 – 1197.
11. Van den Eynde M, Hendlisz A. Treatment of colorectal liver metastases: a review. Rev Recent Clin Trials 2009; 4 : 56 – 62.
12. Falcone A, Ricci S, Brunetti I et al. Phase III trial of infusional fluorouracil, leucovorin, oxaliplatin, and irinotecan (FOLFOXIRI) compared with infusional fluorouracil, leucovorin, and irinotecan (FOLFIRI) as first‑line treatment for metastatic colorectal cancer: the Gruppo Oncologico Nord Ovest. J Clin Oncol 2007; 25 : 1670 – 1676.
13. Bennouna J, Sastre J, Arnold D et al. ML18147 Study Investigators. Continuation of bevacizumab after first progression in metastatic colorectal cancer (ML18147): a randomised phase 3 tril. Lancet Oncology 2013; 14 : 29 – 37.
14. Van Cutsem E, Tabernero J, Lakomy R et al. Addition of aflibercept to fluorouracil, leucovorin, and irinotecan improves survival in a phase III randomized trial in patients with metastatic colorectal cancer previously treated with an oxaliplatin‑based regimen. J Clin Oncol 2012; 30 : 3499 – 3506.
15. Grothey A, Van Cutsem E, Sobrero A et al. Regorafenib monotherapy for previously treated metastatic colorectal cancer (CORRECT): an international, multicentre, randomised, placebo ‑ controlled, phase 3 trial. Lancet 2013; 381 : 303 – 312.
16. Masi G, Cupini S, Marcucci L et al. Treatment with 5 - fluorouracil/ folinic acid, oxaliplatin, and irinotecan enables surgical resection of metastases in patients with initially unresectable metastatic colorectal cancer. Ann Surg Oncol 2006; 13 : 58 – 65.
17. Nordlinger B, Sorbye H, Glimelius B et al. Perioperative chemotherapy with FOLFOX4 and surgery versus surgery alone for resectable liver metastases from colorectal cancer (EORTC Intergroup trial 40983): a randomised controlled trial. Lancet 2008; 371 : 1007 – 1016.
18. Folprecht G, Gruenberger T, Bechstein WO et al. Tumour response and secondary resectability of colorectal liver metastases following neoadjuvant chemotherapy with cetuximab: the CELIM randomised phase 2 trial. Lancet Oncol 2010; 11 : 38 – 47.
19. Heinemann V, Fischer von Weikersthal L, Decker T et al. Randomized comparison of FOLFIRI plus cetuximab versus FOLFIRI plus bevacizumab as first‑line treatment of KRAS ‑ wild type metastatic colorectal cancer: German AIO study KRK ‑ 0306 (FIRE ‑ 3). J Clin Oncol 2013; 31 (Suppl): abstract LBA3506.
20. Zorzi D, Laurent A, Pawlik TM et al. Chemotherapy‑associated hepatotoxicity and surgery for colorectal liver metastases. Br J Surg 2007; 94 : 274 – 286.
21. Wicherts DA, De Haas RJ, Andreani P et al. Impact of portal vein embolization on long‑term survival of patients with primarily unresectable colorectal liver metastases. Br J Surg 2010; 97 : 240 – 250.
22. Schmoll HJ, Van Cutsem E, Stein A et al. ESMO Consensus Guidelines for management of patients with colon and rectal cancer. A personalised approach to clinical decision making. Ann Oncol 2012; 23 : 2479 – 2516.
23. Nordlinger B, Van Cutsem E, Gruenberger T et al. Combination of surgery and chemotherapy and the role of targeted agents in the treatment of patients with colorectal liver metastases: recommendations from an expert panel. Ann Oncol 2009; 20 : 985 – 992.
24. Primrose JN, Falk S, Finch ‑ Jones M et al. A randomized clinical trial of chemotherapy compared to chemotherapy in combination with cetuximab in k ‑ RAS wild‑type patients with operable metastases from colorectal cancer: The new EPOC study. J Clin Oncol 2013; 31 (Suppl): abstract 3504.
25. Reddy SK, Pawlik TM, Zorzi D et al. Simultaneous resections of colorectal cancer and synchronous liver metastases: a multi‑institutional analysis. Ann Surg Oncol 2007; 14 : 3481 – 3491.
26. De Jong MC, Van Dam RM, Maas M et al. The liver ‑ first approach for synchronous colorectal liver metastasis: a 5‑year single‑centre experience. HPB (Oxford) 2011; 13 : 745 – 752.
27. Šubrt Z, Ferko A, Čečka F et al. Současné možnosti chirurgické léčby ložiskového postižení jater a pankreatu. Vnitř Lék 2011; 57 : 356 – 363.
28. Fernandez FG, Ritter J, Goodwin JW et al. Effect of steatohepatitis associated with irinotecan or oxaliplatin pretreatment on resectability of hepatic colorectal metastases. J Am Coll Surg 2005; 200 : 845 – 853.
29. Ribero D, Wang H, Donadon M et al. Bevacizumab improves pathologic response and protects against hepatic injury in patients treated with oxaliplatin‑based chemotherapy for colorectal liver metastases. Cancer 2007; 110 : 2761 – 2767.
30. Gruenberger B, Tamandl D, Schueller J et al. Bevacizumab, Capecitabine, and Oxaliplatin as Neoadjuvant Therapy for Patients With Potentially Curable Metastatic Colorectal Cancer. J Clin Oncol 2008; 26 : 1830 – 1835.
31. Portier G, Elias D, Bouche O et al. Multicenter randomized trial of adjuvant fluorouracil and folinic acid compared with surgery alone after resection of colorectal liver metastases: FFCD ACHBTH AURC 9002 trial. J Clin Oncol 2006; 24 : 4976 – 4982.
Labels
Diabetology Endocrinology Internal medicineArticle was published in
Internal Medicine

2013 Issue 10
-
All articles in this issue
- Prevalence of hyponatremia in patients on department of internal medicine
- The impact of a 14- day regular physical exercise regime on the concentration of the classes and sub‑classes of lipoprotein particles in young subjects with a sedentary lifestyle
- Ultra‑ high‑risk chronic lymphocytic leukemia – characteristics and treatment options
- Methods of skin microcirculation assessment
- The current approach to the treatment of the patients with metastatic colorectal cancer
- Management of dyslipidaemias – present and future. Guidelines of the Angiology Section of the Slovak Medical Chamber (2013)
- Tricuspid valve infective endocarditis in intravenous drug abuser
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue
- Methods of skin microcirculation assessment
- Tricuspid valve infective endocarditis in intravenous drug abuser
- The current approach to the treatment of the patients with metastatic colorectal cancer
- Management of dyslipidaemias – present and future. Guidelines of the Angiology Section of the Slovak Medical Chamber (2013)
