Crush syndróm súčasnosti – rabdomyolýza intoxikovaných
Crush syndrome of today – rhabdomyolysis of intoxicateds
Crush syndrome is a major issue in war-afflicted countries and in times of peace also in case of a mining accident. This syndrome is characterized by a number of symptoms originating from muscle damage – rhabdomyolysis – resulting from long-lasting entrapment of the body/extremities. Nowadays, crush syndrome seems to be a scarce condition. However, the rare incidence may rather be the result of poor diagnostic recognition. Although the war conflicts and mining accidents became seldom, increased incidence of rhabdomyolysis is progressively associated with world-wide drug consumption. Long-term immobilisation of intoxicated drug addicts frequently leads to muscle damage, mediated by a local pressure exerted on the extremities. Rhabdomyolysis may become clinically manifest in a form of an acute muscular compartment syndrome.
Key words:
acute intoxication – acute muscular compartment syndrome – compartment pressure – dermofasciotomy – rhabdomyolysis
Authors:
Angela Molčányiová 1; Theodoz Molčányi 2; Miroslav Mydlík 3
Authors‘ workplace:
Laboratóriá Labmed, a. s., Košice, Slovenská republika, výkonný riaditeľ Ing. Vladimír Nestor
1; Klinika úrazovej chirurgie LF UPJŠ a UN L. Pasteura Košice, Slovenská republika, prednosta prof. MUDr. Miroslav Kitka, PhD.
2; IV. interná klinika LF UPJŠ a UN L. Pasteura Košice, Slovenská republika, prednosta prof. MUDr. Ivan Tkáč, PhD.
3
Published in:
Vnitř Lék 2014; 60(3): 249-254
Category:
Case Report
Overview
V oblastiach vojenských konfliktov a v čase mieru najmä v baniach je známy crush syndróm. Charakterizuje ho súbor symptómov, ktorý vzniká na podklade svalového poškodenia – rabdomyolýzy pri dlhšie trvajúcom zasypaní tela, hlavne končatín. V súčasnej dobe je v našich krajinách crush syndróm diagnostikovaný veľmi zriedka. Niekedy sa však menej časté ochorenia vyskytujú zriedka najmä preto, že sa na ich výskyt nemyslí. Aj keď zasypania, či už vojnové, alebo v mieri sú v našej oblasti zriedkavejšou diagnózou, rabdomyolýzy pribúdajú z iných príčin, v poslednej dobe najmä v súvislosti s celosvetovým vzostupom užívania drog. Rabdomyolýza sa môže manifestovať klinickým obrazom akútneho svalového kompartmentového syndrómu.
Kľúčové slová:
akútna intoxikácia – akútny svalový kompartment syndróm – dermofasciotómia – kompartmentový tlak – rabdomyolýza
Úvod
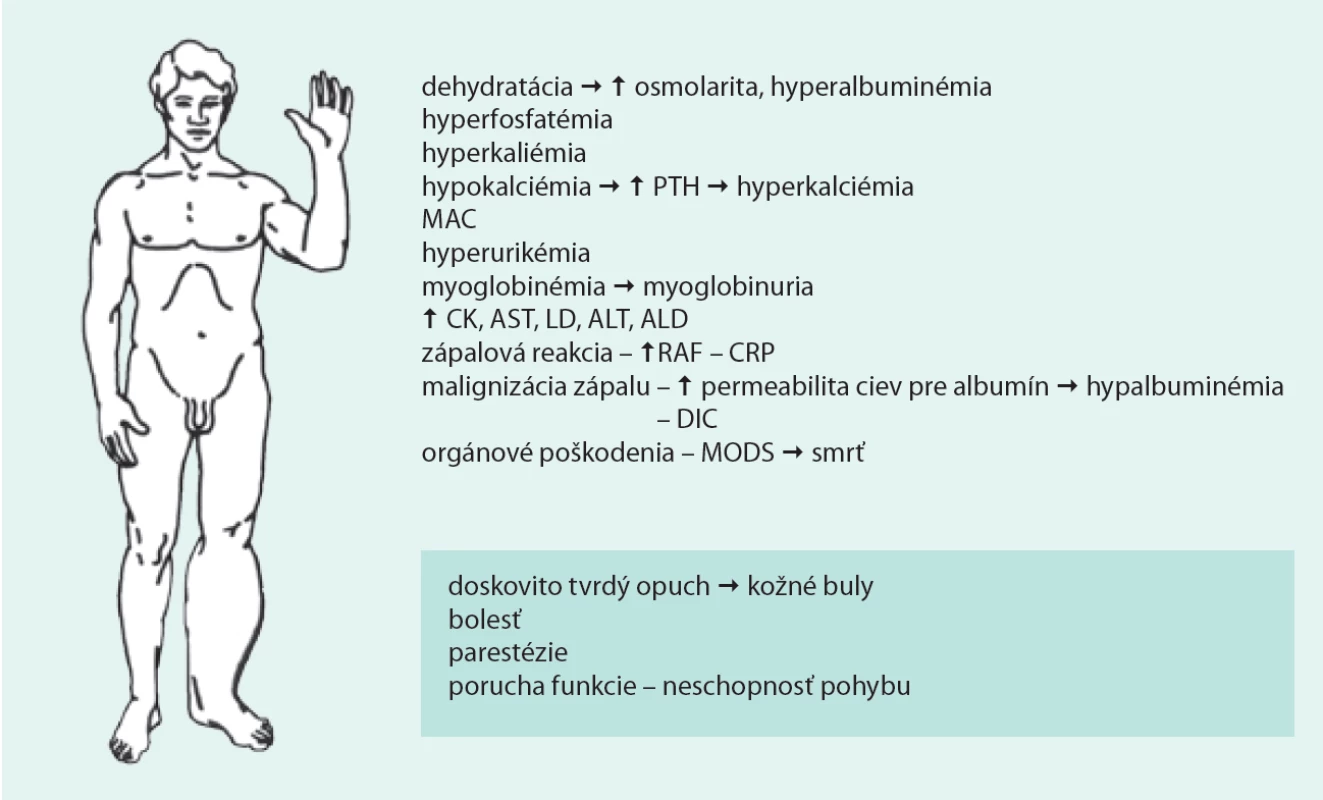
Traumatická rabdomyolýza pri crush syndróme je len jednou príčinou z mnohých, fyzikálnych aj metabolických, ktoré vedú ku ireverzibilnému poškodeniu svalových buniek (tab. 3). V súčasnosti sa crush syndróm v dôsledku zasypania svalstva vyskytuje v oblastiach postihnutých zemetrasením, pri práci v podzemí, prípadne pri zasypaní iným sypkým materiálom, napr. obilím.
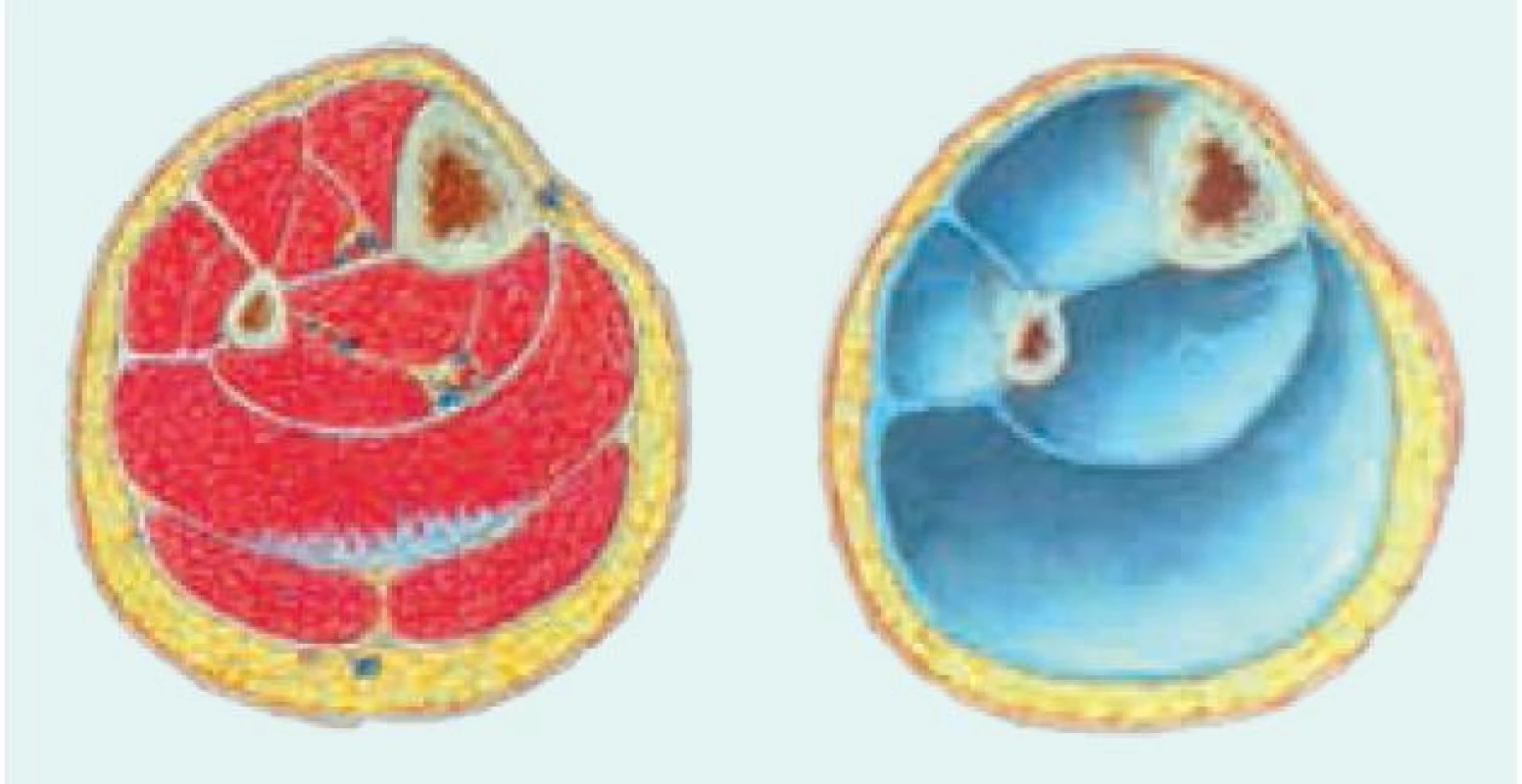
Rabdomyolýza pri akútnom svalovom kompartment syndróme (ASKS) vzniká akútnym zvýšením tlaku v anatomickom priestore, ktorý je ohraničený málo poddajným obalom (fascia, kosť), obr. 1. Obsah svalového kompartmentu tvoria okrem svalových buniek, myocytov, tiež krvné cievy, nervy a interstícium. Pri dlhodobom zotrvaní človeka s poruchou vedomia v nezmenenej polohe sú nižšie položené svalové skupiny komprimované hmotnosťou vlastného tela. Poruchy prietoku krvi v komprimovaných svaloch spôsobujú ich ischémiu. Po zmene polohy tela a obnovení prietoku krvi dochádza k reperfúzii, ktorá síce ukončí hypoxiu z hypoperfúzie, ale vedie k postischemickému edému poškodeného tkaniva. Zmnoženie obsahu kompartmentu (edém) pri relatívne nepoddajnom osteofibróznom obale má za následok stúpanie intrakompartmentového tkanivového tlaku a klesanie perfúzneho tlaku. Ischemické poškodenie tkanív zhoršuje v štádiu reperfúzie vznikajúci edém a explózia tvorby voľných kyslíkových radikálov (VKR) a iných reaktívnych foriem kyslíka a dusíka. Vyvíja sa ischemicko-reperfúzna trauma s charakteristickým lokálnym nálezom. Obnovením krvného prietoku sa látky z ischemického ložiska dostávajú do cirkulácie a pôvodne lokálny dej sa generalizuje.
Kazuistika
41–ročný muž, po konzumácii alkoholu v priebehu dňa, zaspal v aute s idúcim motorom.
Na 2. deň ráno po zobudení nevedel vystúpiť z auta pre slabosť pravej dolnej končatiny. Prvé vyšetrenie na neurologickej ambulancii vylúčilo ako príčinu stavu cievnu mozgovú príhodu. Pre pretrvávajúcu slabosť dolnej končatiny, lokálny nález na nej a zvýšené „pečeňové“ a obličkové testy bol pacient prijatý na interné oddelenie spádovej NsP. Vzhľadom na anamnézu bola krv pacienta odoslaná na Oddelenie klinickej biochémie FN v Košiciach na toxikologické vyšetrenie. Odber bol zrealizovaný 24 hod po konzumácii alkoholu a v tejto dobe sme už alkohol v krvi nedokázali. Kysličník uhoľnatý, drogy a základný skríning liekov boli taktiež negatívne.
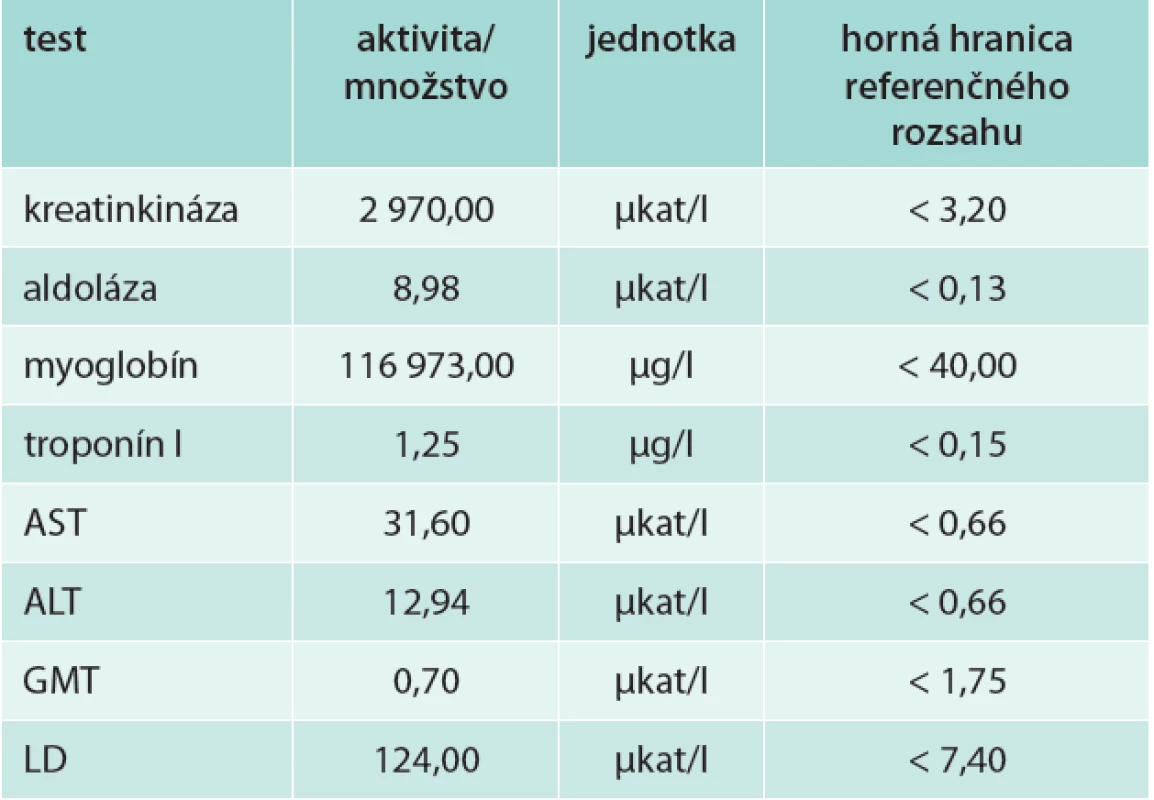
Na 3. deň pre stále nejasnú diagnózu, rozvoj renálnej insuficiencie a stúpajúce „pečeňové testy“ požiadal ošetrujúci lekár vyšetrenie izoenzýmov GMT a ALP na Oddelení klinickej biochémie FN v Košiciach. V zdôvodnení požadovaného vyšetrenia uviedol okrem anamnézy nasledujúce diagnózy: akútne obličkové zlyhanie s oliguriou, akútne poškodenie parenchýmu pečene, akútnu nekrózu kostrového svalstva, sekundárnu hyperurikémiu, hyperamylazémiu a flebotrombózu dolnej končatiny. Z klinickej praxe je známe, že za diagnózou flebotrombózy sa môže skrývať ASKS [4,15]. Za účelom vylúčenia/potvrdenia ASKS bola paleta vyšetrení rozšírená o markery svalového poškodenia (tab. 1).
Žiadaný izoenzýmový obraz ALP a GMT nevykazoval patologické odchýlky od normy. Ale aktivita CK, hladina myoglobínu, typická anamnéza a lokálny nález na predkolení poukazovali na masívnu rabdomyolýzu s rozvinutým ASKS (tab. 1). Po konzultácii s Klinikou úrazovej chirurgie FN v Košiciach bol nález telefonicky oznámený ošetrujúcemu lekárovi so zdôraznením závažnosti stavu a nutnosti urgentnej chirurgickej intervencie. Zároveň pribudla informácia o zahájení dialyzačnej liečby. Lokálny nález na predkolení popísal lekár ako „doskovito“ tvrdý opuch s prítomnými periférnymi pulzáciami.
Po čas 4. a 5. dňa (víkend) pokračovala hemodialyzačná liečba, pacient nebol chirurgicky ošetrený.
Na 6. deň po úraze bola v spádovej nemocnici zrealizovaná dermofasciotómia (DFT).
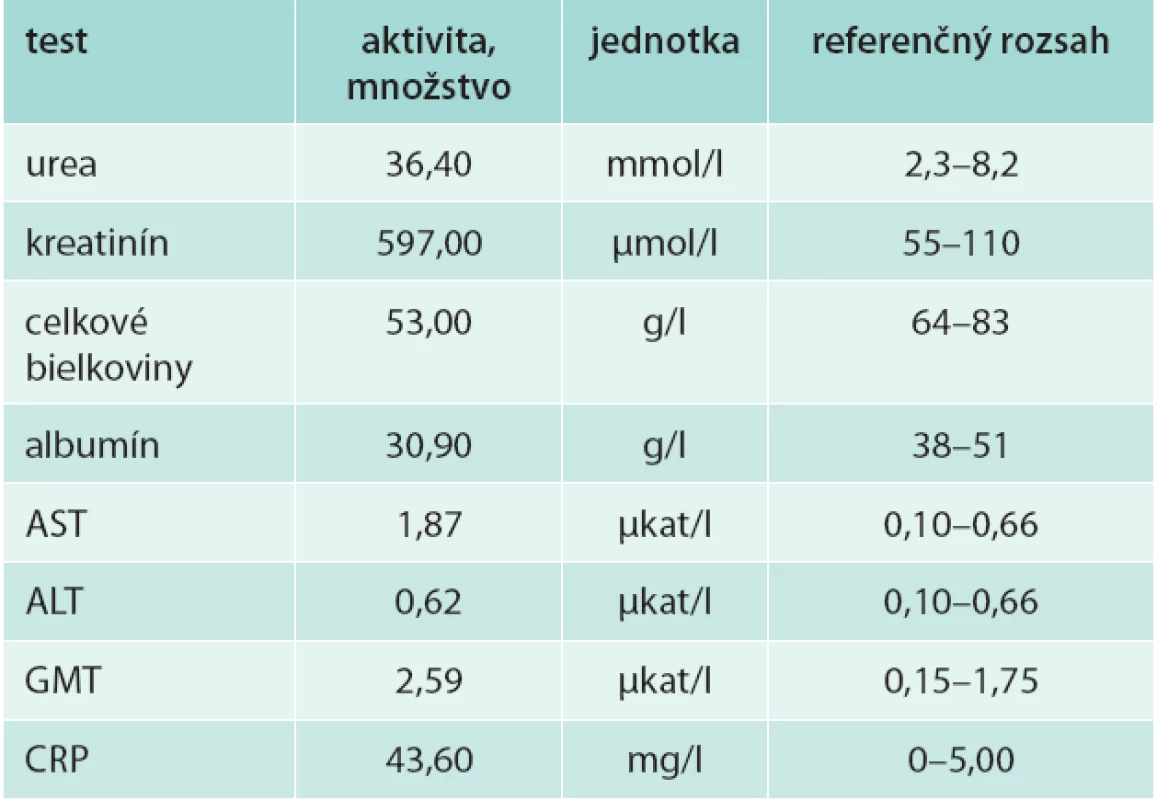
Na 9. deň po úraze, 4. deň po DFT bol pacient preložený na Kliniku úrazovej chirurgie FN v Košiciach. Biochemický obraz po preklade je uvedený v tab. 2.
Na klinike bol pacient hospitalizovaný 40 dní, na 20. deň po úraze bola vykonaná posledná hemodialýza. Lokálna liečba spočívala v ošetrovaní dermofasciotomickej rany, odstraňovaní nekrotických svalov a konečnom prekrytí voľným kožným transplantátom. Hospitalizácia bola ukončená 50. deň po úraze. Pri prepustení nevykazoval pacientov biochemický obraz žiadne patologické odchýlky od normy, neboli prítomné známky poškodenia funkcie žiadneho orgánu. Ireverzibilná nekróza svalstva predkolenia viedla k trvalému obmedzeniu pohyblivosti členkového zhybu (redukcia flexií o dve tretiny).
Diskusia
Ischémia vzniká vtedy, keď potreba kyslíka v tkanivách je vyššia ako jeho ponuka. Jednou z jej príčin je nedostatočné prekrvenie. Kompresia svalu, s poruchou krvného prietoku, môže byť spôsobená tlakom štruktúr vonkajšieho prostredia na sval (napr. crush syndróm), alebo tiež dlhodobým pôsobením váhy vlastného tela na svalové partie najbližšie k podložke. Človek s neporušeným vedomím mení polohu tela počas bdenia aj fyziologického spánku. Pri poruche vedomia nereaguje nervový systém na signály vznikajúcej lokálnej ischémie a človek zotrváva v nezmenenej polohe. Tento stav sa v súčasnosti najčastejšie vyskytuje u intoxikovaných, ale je popísaný aj pri dlhotrvajúcich operáciách [2,16]. V súbore pacientov s rabdomyolýzou Sulowicz et al ako najčastejšiu príčinu uvádzajú intoxikáciu alkoholom, často spolu s hypotermiou, prípadne traumou [19]. Myopatia pri chronickom abúze alkoholu vzniká v dôsledku etanolom navodenej zvýšenej permeability sarkolémy pre sodík. V snahe zbaviť bunku nadbytočného sodíka zvyšuje sa aktivita transmembránového prenosového systému pre sodík a vápnik (Ca2+/Na+ exchanger). Výmena sodíka za vápnik vedie ku akumulácii intracelulárneho vápnika a zvýšenej vulnerabilite svalov alkoholikov [11].
Muž zaspal v aute v polohe, ktorá obmedzovala prekrvenie pravého predkolenia. Vzhľadom na účinok alkoholu neregistroval lokálne príznaky hypoperfúzie a nezmenil polohu. Po niekoľkých hodinách po odoznení účinku alkoholu, dochádza k reperfúzii ischémiou poškodených svalových kompartmentov.
Lokálny nález spadal časove už do fázy reperfúzie. Bol prítomný bolestivý, „doskovito“ tvrdý opuch predkolenia so zachovanými pulzáciami na periférnych artériách.
Hypoxia s anaeróbnou glykolýzou pri nedostatočnej perfúzii svalov znamená pre myocyty nízku produkciu energie a hromadenie laktátu. Po vyčerpaní energetických rezerv sa nedostatok energie v bunkách prejaví neschopnosťou udržať koncentračný gradient minerálov medzi intracelulárnym a extracelulárnym prostredím. Minerály sa spolu s vodou presúvajú v smere koncentračných gradientov, myocyty sú edematózne s porušeným minerálovým zložením. Zmeny sú dočasne reverzibilné a po odoznení ischémie sa bunka môže upraviť ad integrum. Progredujúca ischémia s prehlbujúcim sa deficitom energie atakuje činnosť ATP-dependentných transmembránových prenášačov. Presuny vápnika cez sarkoplazmatické retikulum reguluje Ca2+-ATPáza, ďalšou reguláciou je protismerný transmembránový pohyb vápnika a sodíka (Ca2+/Na+ exchanger), ktorý je spriahnutý so sodíkovou pumpou (Na+ -K+-ATPáza) [14,24]. Pri nedostatku energie sa bunka nevie adekvátne brániť vtoku vápnika. Zvýšená hladina vápnika v myocyte aktivuje kalcium-dependentné proteázy a fosfolipázy. Aktivovaná fosfolipáza A atakuje fosfolipidy v sarkoléme, zmena viskozity membrány je prvým stupňom k jej úplnej dezintegrácii a prechodu do ireverzibilného štádia. Proteolýzou vznikajúce peptidy sa insuficientnou membránou dostávajú do intersticiálneho priestoru, kde pôsobia ako osmotická nálož a výrazne zhoršujú edém v kompartmente [1,6,18,22]. Edém buniek spolu s edémom interstícia je príčinou „doskovitej“ tvrdosti postihnutého kompartmentu. Môže sa manifestovať až tvorbou subkutánnych vesikúl splývajúcich do búl.
Vplyv stúpajúceho intrakompartmentového tkanivového tlaku (TT) na štruktúry kompartmentu modifikuje systémový TK – čím je vyšší, tým je perfúzia tkaniva postihnutého kompartmenu pri narastajúcom TT lepšia. Stúpajúci intrakompartmentový tlak alteruje najprv žilový systém, prítok krvi do postihnutého kompartmentu nemusí byť prerušený a pulzy na periférnych artériách sú vtedy hmatné. Venostáza pri zachovanom artériovom prítoku zvyšuje intrakompartmentový TT a zhoršuje edém postihnutého kompartmentu. Úplná venostáza môže spôsobiť absenciu markerov myonekrózy v periférnej krvi napriek masívnej rabdomyolýze.
Známky rabdomyolýzy v krvi
Na vznik rabdomyolýzy má vplyv aj látka, ktorá spôsobila intoxikáciu s následnou poruchou vnímania. Myopatia je popísaná nielen po alkohole, ale aj kokaíne [17] a ďalších drogách. Podľa Vanholdera et al dysfunkcia svalstva u pacientov intoxikovaných alkoholom je výsledkom spolupôsobenia imobilizácie a porúch elektrolytovej rovnováhy [19,21].
V štádiu postischemickej reperfúzie svalu sa do obehu uvoľňujú produkty myonekrózy a látky vznikajúce v dôsledku oxidačného stresu. V mieste lézie aktivované endotelové bunky a monocyty produkujú cytokíny. Cytokíny ovplyvňujú zápalovú reakciu a to ako lokálnu, tak celkovú pôsobením na hypotalamus. Okrem priameho vplyvu na intenzitu prozápalových a protizápalových reakcií a ich funkčnú interakciu v mieste lézie sú aj prenášačmi informácií v imunitnom systéme. V mieste lézie aktivované monocyty sa v štádiu reperfúzie dostávajú do celého obehu, pôvodne lokálna reakcia nadobúda systémový charakter – systémová zápalová reakcia (SIRS – systemic iflammatory response syndrome). Regulačnú úlohu zohráva kompenzačná protizápalová odpoveď (CARS – compensatory anti–inflammatory response syndrome). Zápalová reakcia, ktorej úlohou je zlikvidovať lokálnu patologickú noxu, môže, za určitých okolností, nadobúdať malígny charakter a viesť k syndrómu multiorgánového zlyhávania (MODS – multiple organ dysfunction syndrome), prípadne až zlyhania (MOFS – multiple organ failure syndrome) a smrti. Zlyhanie imunitného systému pri mohutnejšej CARS môže vyústiť do rovnakých komplikácií.
Vysoké aktivity/koncentrácie produktov rabdomyolýzy v krvi sú dôkazom reperfúzie postihnutého kompartmentu. Kreatinkináza (CK) a myoglobín sú špecifické pre bunky kostrových svalov. Obidve sa v sére zdravých nachádzajú v nízkej koncentrácii, ktorá po svalovej námahe môže mierne stúpať. Vzostup závisí od viacerých faktorov, niekoľkonásobné zvýšenie aktivity nájdeme po výrazných športových výkonoch aj u zdravých ľudí. U nášho pacienta bola aktivita CK takmer 1 000-krát vyššia ako horná hranica referenčného rozsahu, koncentrácia myoglobínu takmer 3 000-krát vyššia, tieto hodnoty sú už charakteristické pre výraznú rabdomyolýzu. Vzostup aktivity CK je úmerný rozsahu svalového poškodenia [12]. Aminotransferázy (AST, ALT) sa vo všeobecnosti interpretujú ako pečeňové enzýmy. Nie sú však pre pečeň špecifické, nachádzajú sa vo viacerých tkanivách, vysokú aktivitu vykazujú vo svaloch (najmä AST). Vzhľadom na množstvo svalovej hmoty, ktoré môže byť pri myolýze zdrojom aminotransferáz, sú extrémne vysoké vzostupy ich aktivity častejšie svalového, ako pečeňového pôvodu. Jasne to vidno aj u nášho pacienta – výrazne zvýšené aktivity aminotransferáz na 3. deň (rabdomyolýza na podklade zvýšeného TT pred DFT) sa po operačnom odstránení zvýšeného intrakompartmentového tlaku takmer znormalizovali. Tkanivovo nešpecifické, ale špecifické pre nekrózu buniek, sú aj zvýšené aktivity aldolázy (vysoká aktivita v myocytoch, ale prítomná aj v hepatocytoch) a laktátdehydrogenázy (multiorgánový výskyt) v prvom odbere, na 3. deň po úraze, pred DFT. Vysoké aktivity CK, aminotransferáz, LD, stúpanie kyseliny močovej a kalémie, spolu s nízkou hladinou ionizovaného vápnika sú pre rabdomyolýzu typickým biochemickým obrazom [15,21].
Na 9. deň po úraze a 3. deň po DFT bola u nášho pacienta výrazná hypoproteinémia a hypalbuminémia. Jej príčina je u ASKS multifaktoriálna. Predpokladáme, že najväčší podiel mali straty bielkovín dermofasciotomickou ranou a katabolizmus v rámci systémovej zápalovej reakcie. Ústup edému a návrat tkanív končatiny do pôvodného objemu s možnosťou rekonštrukcie kožného krytu je vždy dlhodobý. Obnažené tkanivá secernujú tekutinu bohatú na bielkoviny, najmä albumín. Jej množstvo varíruje v závislosti od veľkosti obnaženej plochy a štádia hojenia. Miernejší pokles proteinémie ale najmä albuminémie ešte pred DFT je markerom generalizovanej aktivácie endotelu pri systémovej zápalovej reakcii spojenej so zvýšenou permeabilitou ciev nielen voči vode ale aj voči bielkovinám. Do interstícia unikajú najmä malé, ale pre udržanie onkotického tlaku krvi kľúčové molekuly albumínu. Poklesom onkotického tlaku v cievach s presunom tekutiny bohatej na bielkoviny do interstícia vzniká v krvnom obehu hypovolémia s hypoproteinémiou, najmä hypalbuminémiou, v interstíciu edém, alterujúci metabolizmus postihnutých tkanív. U nášho pacienta predpokladáme minimálne lokálny únik albumínu do tkanív postihnutej končatiny.
Proteosyntetickú funkciu pečene ovplyvňujú viaceré faktory prítomné pri ASKS. Pre zápalovú reakciu je charakteristická zvýšená hepatálna syntéza reaktantov akútnej fázy na úkor bielkovín fyziologického spektra. Albumín, tvoriaci približne polovicu všetkých plazmatických bielkovín, má polčas rozpadu 20 dní, preto pokles jeho syntézy je klinicky zrejmý relatívne neskoro, približne po 10–14 dňoch trvania výrazne zníženej proteosyntézy. Ďalším faktorom, modifikujúcim funkciu pečene, je protrahovaný katabolický stav, ktorý je súčasťou generalizovanej zápalovej reakcie. Pacient prišiel do našej nemocnice až po DFT, v čase, v ktorom už jasne dominuje ako príčina hypoproteinémie chirurgická liečba. Spolupôsobenie ďalších faktorov nemožno vylúčiť.
Reakcia vzdialených orgánov na rabdomyolýzu
Obličky
Myoglobín je v obličkách filtrabilná bielkovina. Udávané tmavé sfarbenie moča je podľa rôznych autorov viditeľné od koncentrácie myoglobínu 0,25–1 mg/ml moču (norma pod 5 ng/ml), čo predpokladá deštrukciu viac ako 100 g svalového tkaniva [6,7,10,13,18,20,23], resp. ak jeho plazmatická koncentrácia je viac ako 15 mg/l [10]. Takéto množstvo filtrovaného myoglobínu v tubulárnom systéme precipituje s Tammovým-Horsfallovým mukoproteínom. Hyperstenuria pri hypovolémii, zvýšená urikozúria a kyslá reakcia moču (v katabolizme je predpoklad oboch posledne menovaných) precipitáciu potencujú [8]. Sekundárna hyperurikémia figuruje aj v pracovných diagnózach pri príjme pacienta do nemocnice. Ďalším účinkom myoglobínu je jeho priama toxicita na bunky proximálneho tubulu. Rozvoj oxidačného stresu v štádiu reperfúzie spôsobuje v myoglobíne oxidáciu dvojmocného železa na trojmocné, vzniká hydroxylový radikál s toxickým účinkom na biomolekuly. Lipoperoxidácia s následnou propagáciou voľnoradikálových reakcií má pravdepodobne najväčší vplyv na poškodenie obličiek a rozvoj akútneho zlyhávanie obličiek [8,9]. Okrem priameho organického poškodenia obličiek účinkom myoglobínu sa na rozvoji obličkovej nedostatočnosti podieľa aj ich hypoperfúzia. Jednou z jej príčin je hypovolémia. Vazokonstrikcia v obličkách je multifaktoriálna, podieľa sa na nej zvýšený tonus sympatika, aktivácia renin–angiotenzínového systému, pokles produkcie vazodilatačne pôsobiacich prostaglandínov a väzba hémového proteínu na oxid dusíka s jeho inaktiváciou [3,12]. Perfúziu obličiek môže zhoršovať aj ich intersticiálny edém a rozvoj koagulopatie s tvorbou mikrotrombov. Za koagulopatiu je zodpovedný tkanivový faktor vznikajúci lokálne v mieste lézie a po generalizácii infekcie sa na jeho produkcii podieľajú ďalšie bunky – najmä monocyty a aktivované endotelové bunky. Koagulopatia u nášho pacienta nie je zdokumentovaná, aspoň miernejší stupeň sa dá predpokladať. Hypoperfúziu obličiek zhoršuje aj negatívny vplyv prozápalových cytokínov na funkciu vitálnych orgánov – pľúc a srdca.
U nášho pacienta boli obličkové testy (urea a kreatinín) zvýšené už od 2. dňa po úraze, od 3. dňa prebiehala hemodialýza, ktorá trvala takmer 3 týždne. Funkčný obličkový nález bol bez známok patológie 2 mesiace po úraze. Priebeh akútnej renálnej insuficiencie, počet potrebných hemodialýz, ako aj čas do úplnej normalizácie obličkových funkcií u nášho pacienta zodpovedá literárnym údajom u pacientov s rabdomyolýzou pri intoxikácii alkoholom [4,5].
Srdce
Troponin I (TnI) je nízkomolekulárna, v obličkách filtrabilná bielkovina špecifická pre myokard, do séra sa dostáva pri myolýze. Renálna insuficiencia môže jeho koncentráciu v sére zvyšovať, ale zdrojom je srdce. Aj keď je srdce vitálnym orgánom a je prednostne saturované krvou, systémová zápalová reakcia ovplyvňuje jeho funkciu. Intersticiálny edém, vznikajúci v dôsledku všeobecnej aktivácie endotelu a jeho zvýšenej permeability nielen pre vodu a minerály, ale aj pre bielkoviny, sa v srdci prejaví menšou elasticitou komôr a teda ich horším plnením s poklesom rázového objemu. Prozápalové cytokíny majú aj priamy kardiodepresívny účinok na kontraktilitu myokardu.
Pankreas
Medzi pracovnými diagnózami je hyperamylazémia. Amyláza je malá, filtrabilná bielkovina, jej množstvo v sére pri oligoanúrii stúpa. Zvýšená aktivita amylázy u nášho pacienta môže byť dôsledkom rozvoja renálnej insuficiencie, alebo je súčasťou multiorgánového poškodenia. Hyperamylazémiu spôsobuje v tomto prípade hypoperfúzia pankreasu, jeho intersticiálny edém a zníženie koncentrácie antiproteáz.
Pečeň
Zvýšené aktivity aminotransferáz pred dermofasciotómiou boli svalového pôvodu. V sére boli výrazne zvýšené aj ďalšie pre sval špecifické bielkoviny (myoglobín, CK) svedčiace pre rabdomyolýzu.
Záver
U pacienta s primárne prehliadnutým akútnym končatinovým kompartment syndrómom a oneskorenou dermofasciotómiou sa rozvinula renálna insuficiencia, vyžadujúca dialyzačnú liečbu. Pri svalovom hypoxicko–reperfúznom syndróme sa produkty rabdomyolýzy dostávajú do obehu a sú podkladom orgánových komplikácií pôvodne lokálneho poškodenia. Včasná DFT je pri masívnej nekróze tkanív nevyhnutným, život zachraňujúcim výkonom, lokálne je prevenciou poškodenia lokomočného systému. Náš pacient bol po 2-mesačnej liečbe prepustený z nemocnice bez známok orgánového poškodenia, ale s dvojtretinovým obmedzením pohyblivosti v členkovom zhybe spôsobeným oneskoreným chirurgickým riešením. Skorá a adekvátna DFT je často život zachraňujúcim výkonom a je najlepšou prevenciou ireverzibilných následkov poranenia svalov.
MUDr. Angela Molčányiová, Ph.D.
molcanyia@unlp.sk
Labmed, a.s, Košice, Slovenská republika
www.unlp.sk
Doručeno do redakce dne 19. 9. 2013
Přijato po recenzi dne 12. 12. 2013
Sources
1. Barnard M. Rhabdomyolysis. Update in Anaesthesia 2012; 28 : 130–132.
2. Bocca G, van Moorselaar JA, Feitz WFJ et al. Compartment syndrome, rhabdomyolysis and risk of acute renal failure as complications of the lithotomy position. J Nephrol 2002; 15(2): 183–185.
3. Daher E de F, Cordeiro NF. Acute renal failure due to rhabdomyolysis. Rev Bras Med 1998; 55(7): 526–533.
4. Daher E de F, Silva Júnior GB, Brunetta DM et al. Rhabdomyolysis and acute renal failure after strenuous exercise and alcohol abuse: case report and literature review. Sao Paolo Med J 2005; 123(1): 33–37.
5. Daher E de F, Lima NA, Lima RSA et al. Acute Kidney Injury due to Rhabdomyolysis Followed by Alcohol Intake and Physical Aggression: case Report and Literature Review. J Medicine 2012; 13(2): 212–215.
6. David WS. Myoglobinuria. Neurol Clin 2000; 18(1): 215–243.
7. Gabow PA, Kaehny WD, Kelleher SP. The spectrum of rhabdomyolysis. Medicine 1982; 61(3): 141–152.
8. Haas CE, Magram Y, Mishra A. Rhabdomyolysis and Acute Renal Failure Following an Ethanol and Diphenhydramine Overdose. Ann Pharmacother 2003; 37(4): 538–542.
9. Holt SG, Moore KP. Pathogenesis and treatment of renal dysfunction in rhabdomyolysis. Int Care Med 2001; 27(5): 803–811.
10. Huerta-Alardín AL, Varon J, Marik PE. Bench-to-bedside review: Rhabdomyolysis – an overview for clinicians. Crit Care 2005; 9(2): 158–169.
11. Hunter JD, Gregg K, Damani Z. Rhabdomyolysis. Continuing Education in Anaesthesia, Critical Care & Pain 2006; 6(4): 141–143. Available at: http://ceaccp.oxfordjournals.org/content/6/4/141.full.pdf+html.
12. Kroužecký A, Matějovič M, Rokyta jr. R et al. Rabdomyolýza – mechanismy vzniku, příčiny, důsledky a léčba. Vnitr Lek 2003; 49(8): 668–672.
13. Lane R, Phillips M. Rhabdomyolysis. BMJ 2003; 327 (7407): 115–116.
14. Lopez JR, Rojas B, Gonzalez MA et al. Myoplasmic Ca2+ concentration during exertional rhabdomyolysis. Lancet 1995; 345 (8947): 424–425.
15. Mallinson RH, Goldsmith DJ, Higgins RM et al. Acute swollen legs due to rhabdomyolysis: initial management as deep vein thrombosis may lead to acute renal failure. BMJ 1994; 309(6965): 1361–1362.
16. Radovanović MR, Milovanović DR, Ignjatović-Ristić D et al. Heroin addict with gangrene of the extremities, rhabdomyolysis and severe hyperkalemia. Vojnosanit Pregl 2012; 69(10): 908–912.
17. Singhal P, Rubin B, Peters A et al. Rhabdomyolysis and acute renal failure associated with cocaine abuse. J Toxicol Clin Toxicol 1990; 28(3):321–330.
18. Slater MS, Mullins RJ. Rhabdomyolysis and myoglobinuric renal failure in trauma and surgical patients: a review. J Am Coll Surg 1998; 186(6): 693–716.
19. Sułowicz W, Walatek B, Sydor A et al. Acute renal failure in patients with rhabdomyolysis. Med Sci Monit 2002; 8(1): CR24-CR27.
20. Tein I, Di Mauro S, Rowland LP. Myoglobinuria. In: Rowland LP, DiMauro S (eds). Handbook of clinical neurology. Amsterdam: North Holland 1992; 62(18): 553–593.
21. Vanholder R, Sever MS, Erek E et al. Rhabdomyolysis. J Am Soc Nephrol 2000; 11(8): 1553–1561.
22. Walter LA, Catenacci MH. Rhabdomyolysis. Hospital physician 2008; 44(1): 25–31.
23. Warren JD, Blumbergs PC, Thompson PD. Rhabdomyolysis: a review. Muscle Nerve 2002; 25(3): 332–347.
24. Wrogemann K, Pena SDJ. Mitochondrial calcium overload: a general mechanism for cell-necrosis in muscle diseases. Lancet 1976; 1(7961):672–674.
Labels
Diabetology Endocrinology Internal medicineArticle was published in
Internal Medicine

2014 Issue 3
-
All articles in this issue
- Metabolický syndrom po transplantaci ledviny – editorial
- Rabdomyolýza intoxikovaných a akutní poškození ledvin – editorial
- Rabdomyolýza – editorial
- Lymfomatoidní granulomatóza – minulost a současnost – editorial
- Metabolický syndrom po transplantaci ledviny
- Bolest u chronické pankreatitidy a karcinomu pankreatu – možnosti léčby
- Metody ekonomického hodnocení screeningových programů. Situace v České republice
- Patogenéza zmien vnútorného prostredia pri akútnom svalovom kompartment syndróme
- Lymfomatoidní granulomatóza – minulost a současnost
-
Mezentériointestinokolonovaskulárna artériová ischemická choroba
Odporúčania Sekcie angiológov Slovenskej lekárskej komory (2013) - Crush syndróm súčasnosti – rabdomyolýza intoxikovaných
- Iva Příhodová. Poruchy spánku u dětí a dospívajících
- Jaromír Astl. Chirurgická léčba nemocí štítné žlázy
- Jiří Hoch, Jan Leffler et al. Textbook of Surgery. Current Surgical Diagnosis and Treatment.
- Profesor Aleš Linhart slaví padesátiny
- Profesor MUDr. Rastislav Dzúrik, DrSc. (*24. augusta 1929 – †27. februára 2014)
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue
- Crush syndróm súčasnosti – rabdomyolýza intoxikovaných
- Bolest u chronické pankreatitidy a karcinomu pankreatu – možnosti léčby
- Lymfomatoidní granulomatóza – minulost a současnost
- Patogenéza zmien vnútorného prostredia pri akútnom svalovom kompartment syndróme

