Metabolický syndrom po transplantaci ledviny
Metabolic syndrome after kidney transplantation
Introduction:
Metabolic syndrome is a risk factor for cardiovascular diseases. Higher risk of the metabolic syndrome and its components in patients after kidney transplantation is caused by immunosuppressive therapy. The aim of our study was to evaluate the prevalence of the metabolic syndrome and its components in kidney transplant recipients and to analyse their influence on allograft function and albuminuria.
Patients, method and results:
In the study we monitored 69 patients after cadaveric kidney transplantation. The prevalence of the metabolic syndrome was 61.3 % 3 years after kidney transplantation. The prevalence of new onset diabetes mellitus after transplantation was 27 % and that of abdominal obesity 59.7 % of patients. The age of kidney transplant recipients with the metabolic syndrome was higher than of these without it, but not statistically significant. The age of kidney transplant recipients with new onset diabetes mellitus after transplantation was significantly higher, 54.0 (35.0; 69.0) years, than in patients without it, 45.5 (27.0; 60.0) years, OR (95% IS) 1.116 (1.031; 1.207), p = 0.006.The number of components of the metabolic syndrome was negatively correlated with the graft function (rs -0,275, p = 0,031). In patients with impaired renal function with estimated glomerular filtration (using MDRD equation) < 1 ml/s 3 years after kidney transplantation the prevalence of the metabolic syndrome and hypertriglyceridaemia was significantly higher. Chronic allograft dysfunction was predicted by donor age, delayed allograft function, rejection, low level of HDL-cholesterol, hypertriglyceridaemia and hyperuricaemia. Hyperuricaemia was the only significant predictor of allograft dysfunction independently of the presence of delayed allograft function, rejection episodes and donor age. The metabolic syndrome, elevation of apolipoprotein B and nonHDL-cholesterol and increased systolic blood pressure were associated with albuminuria. Higher levels of apolipoprotein B and total cholesterol were independent predictors of increased albumin-creatinine ratio. Obesity had no impact on graft function nor on albuminuria, the influence of the new onset diabetes mellitus after transplantation was not significant independently on other factors. We confirmed the correlation of the presence of the metabolic syndrome with increased levels of AFABP (adipocyte fatty acid-binding protein) and leptin. Increased level of AFABP predicted allograft dysfunction 3 years after kidney transplantation.
Conclusion:
The influence of imunosuppressive treatment on new onset diabetes mellitus after transplantation is well documented. However, we conclude that age is an important additional risk factor for the development of diabetes mellitus in kidney transplant recipients group and it is recommended to follow mainly older patients. Early detection of metabolic abnormalities and dietary and therapeutic intervention in kidney transplant recipients may help to prevent chronic allograft dysfunction.
Key words:
abdominal obesity – albuminuria – allograft dysfunction – dyslipidaemia – kidney transplantation – metabolic syndrome – new-onset diabetes mellitus after transplantation
Authors:
Marta Nedbálková 1; Jan Svojanovský 1; Karel Trnavský 1; Milan Kuman 2; Jiří Jarkovský 3; Michal Karpíšek 4; Miroslav Souček 1
Authors‘ workplace:
II. interní klinika LF MU a FN u sv. Anny Brno, přednosta prof. MUDr. Miroslav Souček, CSc.
1; Centrum kardiovaskulární a transplantační chirurgie Brno, ředitel doc. MUDr. Petr Němec, CSc., MBA, FETCS
2; Institut biostatistiky a analýz LF MU Brno, ředitel doc. RNDr. Ladislav Dušek, Ph. D.
3; BioVendor – Laboratorní medicína a. s., Brno, obchodní ředitel RNDr. Pavel Koupil, CSc.
4
Published in:
Vnitř Lék 2014; 60(3): 196-204
Category:
Original Contributions
Overview
Úvod:
Metabolický syndrom je rizikovým faktorem pro vznik kardiovaskulárních chorob. Pacienti po transplantaci ledviny mají vlivem imunosupresivní léčby vyšší riziko vzniku metabolického syndromu. Cílem práce bylo hodnocení prevalence metabolického syndromu a jeho komponent u pacientů po transplantaci ledviny a analýza jejich vlivu na funkci štěpu a albuminurii.
Pacienti, metodika a výsledky:
Sledovali jsme 69 pacientů po transplantaci kadaverózní ledviny. Prevalence metabolického syndromu 3 roky po transplantaci byla 61,3 %. Prevalence potransplantačního diabetes mellitus byla 27 % a abdominální obezity 59,7 %. Věk příjemců ledviny s metabolickým syndromem 3 roky po transplantaci byl nesignifikantně vyšší. Věk příjemců ledviny s potransplantačním diabetes mellitus byl statisticky významně vyšší: 54,0 (35,0; 69,0) let vs 45,5 (27,0; 60,0) let u nediabetiků, odds ratio – OR (95% IS) 1,116 (1,031; 1,207), p = 0,006. Počet komponent metabolického syndromu negativně koreloval s funkcí štěpu (rs -0,275; p = 0,031). U pacientů s poklesem renální funkce s eGF MDRD < 1 ml/s 3 roky po transplantaci ledviny byl signifikantně vyšší výskyt metabolického syndromu a hypertriglyceridemie. Chronickou dysfunkci štěpu predikovaly vyšší věk dárce, opožděná funkce štěpu, rejekce, dyslipidemie a hyperurikemie. Pouze hyperurikemie byla prediktorem dysfunkce štěpu nezávisle na věku dárce, opožděné funkci štěpu a rejekci. Metabolický syndrom, elevace apolipoproteinu B a nonHDL-cholesterolu a zvýšený systolický tlak krve byly asociovány s albuminurií. Zvýšené hladiny celkového cholesterolu a apolipoproteinu B byly nezávislými prediktory albuminurie. Obezita ve sledovaném období nebyla spojena se snížením funkce štěpu ani s albuminurií, vliv potransplantačního diabetes mellitus nebyl signifikantní nezávisle na dalších faktorech. Prokázali jsme korelaci přítomnosti metabolického syndromu se zvýšenými hladinami AFABP (adipocyte fatty acid-binding protein) a leptinu. Zvýšená hladina AFABP (p = 0,013) predikovala dysfunkci štěpu 3 roky po transplantaci ledviny.
Závěr:
Přestože je dokumentován vliv imunosupresivní léčby na vznik potransplantačního diabetes mellitus, ukazuje se jako rizikový faktor pro poruchy metabolizmu glukózy vyšší věk pacientů, a proto je třeba se zaměřit zejména na tyto nemocné. Časná detekce metabolických poruch a dietní a terapeutická intervence u pacientů po transplantaci ledviny jsou důležité v prevenci chronické dysfunkce štěpu.
Klíčová slova:
abdominální obezita – albuminurie – dysfunkce štěpu – dyslipidemie – metabolický syndrom – potransplantační diabetes mellitus – transplantace ledviny
Úvod
Metabolický syndrom (MS) je prozánětlivý, prokoagulační a proaterogenní stav, který je definován jako kombinace vzájemně provázaných rizikových faktorů kardiovaskulárních chorob: abdominální obezity, zvýšené lačné glykemie nebo diabetes mellitus 2. typu (DM2T), dyslipidemie a hypertenze. MS je spojen se signifikantně vyšší kardiovaskulární mortalitou [1]. Předpokládá se, že primární příčinou vzniku metabolického syndromu je inzulinová rezistence, významný je vliv obezity s poruchou produkce adipocytokinů. Inzulinová rezistence vede k aktivaci sympatického nervového systému. Zkoumají se přídatná rizika MS vlivem změn sekrece cytokinů, hormonů tukové tkáně, regulačních látek i produktů pokročilé glykace. Byl popsán nárůst hladin asymetrického dimetylargininu a pentosidinu u pacientů s chronickým onemocněním ledvin a obezitou s potenciálem akcelerovat cévní změny [2], zkoumají se vlivy dalších látek s vazbou na MS (fibroblast growth factor 21, allograft inflammatory factor-1, adipocyte fatty acid-binding protein, prostaglandin D synthase, fetuin A).
Na vzniku metabolického syndromu se podílejí genetická predispozice a nevhodný životní styl s nadměrným příjmem energie a sníženou fyzickou aktivitou, proto jeho výskyt poslední desetiletí progresivně narůstá.
Prevalence metabolického syndromu se udává 24 % u severoamerické populace s nárůstem s věkem (u osob starších 60 let 40 %) [3], v České republice byla prevalence 32 % u mužů a 24 % u žen ve věku 24–65 let [4]. U pacientů po orgánových transplantacích je zvýšený výskyt MS vlivem imunosupresivní medikace. Prevalence MS po transplantaci ledviny se pohybuje mezi 15–64 % s rozdíly podle etnika a použité definice [5,6].
Definice metabolického syndromu
Definice metabolického syndromu vychází z definice National Cholesterol Education Program – Adult Treatment Panel III (NCEP-ATP III) z roku 2001 [7], která definovala 5 rizikových faktorů pro kardiovaskulární onemocnění a vznik diabetes mellitus 2. typu: abdominální obezita, hypertriglyceridemie, pokles HDL-cholesterolu, zvýšená hladina glykemie na lačno a hypertenze. Současná definice MS z roku 2009, akceptovaná Českým institutem metabolického syndromu, vychází z definice NCEP-ATP III a je výsledkem konsenzu odborných společností [8].
Definice dle konsenzu odborných společností
(International Diabetes Federation Task Force on Epidemiology and Prevention; National Heart, Lung, and Blood Institute; American Heart Association; World Heart Federation; International Atherosclerosis Society; and International Association for the Study of Obesity) [8]:
Splnění 3 a více z 5 rizikových faktorů:
- abdominální obezita: obvod pasu ≥ 102 cm u mužů a ≥ 88 cm u žen
- triglyceridy v séru ≥ 1,7 mmol/l (nebo hypolipidemická léčba pro hypertriglyceridemii*)
- HDL-cholesterol (HDL-C) < 1,0 mmol/l u mužů a < 1,3 mmol/l u žen (nebo hypolipidemická léčba pro pokles HDL-cholesterolu*)
- TK ≥ 130/≥ 85 mm Hg nebo antihypertenzní léčba
- glykemie nalačno ≥ 5,6 mmol/l nebo porucha tolerance glukózy nebo DM2T
* Nejčastěji používanými léky v terapii hypertriglyceridemie a snížené hladiny HDL-C jsou fibráty a kyselina nikotinová, u pacientů užívajících tyto léky se předpokládá přítomnost hypertriglyceridemie a pokles HDL-C.
MS je spojen s prozánětlivým a protrombotickým stavem [9,10]. K dalším rizikovým faktorům aterosklerózy s asociací s MS patří hyperurikemie, mikroalbuminurie, zvýšená hladina inhibitoru 1 plazminogenového aktivátoru (PAI1) a hypomagnezemie [11]. Mikroalbuminurie odráží subklinické cévní poškození a endoteliální dysfunkci a je považována za časný marker aterosklerózy [12].
Etiopatogeneze
Patogeneze metabolického syndromu je komplexní, jako příčinné faktory se jeví inzulinová rezistence a centrální obezita. Na rozvoji MS se podílejí genetická dispozice, fyzická inaktivita, nadměrný příjem energie, věk, prozánětlivý stav a hormonální dysregulace [13,14]. Mechanizmus vzniku MS se u všeobecné populace vysvětluje tak, že akumulace viscerálního tuku vede k poruše sekrece adipocytokinů, důsledkem je inzulinová rezistence a porucha metabolizmu lipidů. Inzulinová rezistence stimuluje sympatický nervový systém a vlivem vazokonstrikce a inzulinem stimulované zvýšené renální reabsopce natria vzniká hypertenze [15,16].
Metabolický syndrom po transplantaci ledviny
Transplantace ledviny jako metoda náhrady renální funkce je spojena s nižší mortalitou, s lepší kvalitou života a ekonomickou úsporou oproti dialyzační léčbě. Nejčastějšími příčinami úmrtí příjemců jsou kardiovaskulární choroby (více než 40 % případů), infekce a malignity. Incidence a prevalence kardiovaskulárních onemocnění jsou u pacientů po transplantaci ledviny 4–6násobně zvýšené oproti běžné populaci [17,18]. U pacientů s transplantovanou ledvinou indukuje vznik metabolického syndromu imunosupresivní terapie: kortikosteroidy, kalcineurinové inhibitory a inhibitory mTOR (mammalian target of rapamycin) [5,19]. K vedlejším účinkům kortikosteroidů patří vznik potransplantačního diabetes mellitus (PTDM), dyslipidemie, zvýšená chuť k jídlu, obezita a hypertenze, proto se v udržovací léčbě podávají malé dávky nebo se kortikosteroidy vysazují. Kalcineurinové inhibitory (cyklosporin A, takrolimus) mají diabetogenní efekt (výraznější po takrolimu) i nepříznivý vliv na lipidové spektrum [20]. Inhibitory mTOR zvyšují riziko hyperlipidemie a proteinurie [21]. Obezita, dyslipidemie, hypertenze a PTDM jako komponenty metabolickému syndromu patří k důležitým neimunologickým faktorům ovlivňujícím funkci štěpu. Metabolický syndrom a PTDM jsou asociovány s chronickou dysfunkcí transplantované ledviny a horším přežíváním štěpů i pacientů [5,22,23]. Naopak podle subanalýzy studie ALERT nebyl MS nezávislým rizikovým faktorem ztráty štěpu [24].
Obezita viscerálního typu u pacientů po transplantaci ledviny má vliv na míru proteinurie a tíži hypertenze a nepříznivě ovlivňuje mortalitu z kardiovaskulárních příčin [25]. K rozvoji obezity přispívají kortikosteroidy.
Potransplantační diabetes mellitus je spojován s imunosupresivní terapií (kortikosteroidy, cyklosporin, takrolimus) a je provázen zvýšeným rizikem kardiovaskulárních a infekčních komplikací, sníženým přežíváním pacientů, vyšším výskytem rejekcí a ztráty štěpu [20]. Kortikosteroidy působí inzulinovou rezistenci snížením vazby inzulinu na inzulinové receptory a poklesem utilizace glukózy. Diabetogenní účinek mají kalcineurinové inhibitory [20], takrolimus je spojen s vyšším výskytem poruch glukózového metabolizmu a PTDM oproti cyklosporinu [26]. Takrolimus snižuje sekreci inzulinu inhibicí přepisu mRNA pro inzulin a působí periferní inzulinovou rezistenci.
Pro MS jsou typické pokles HDL-cholesterolu a hypertriglyceridemie, časté jsou další lipidové abnormality (zvýšená hladina apolipoproteinu B, vyšší počet malých denzních LDL částic) [27]. Experimentální práce ukázaly vliv hyperlipidemie na vznik glomerulosklerózy, cévních komplikací a intersticiální fibrózy v transplantované ledvině. Hyperlipidemie zvyšuje riziko ztráty štěpu vlivem vaskulárních lézí a chronické transplantační nefropatie [28]. Dlouhodobé užívání kortikosteroidů bývá provázeno kombinovanou hyperlipidemií, předpokládá se jejich vliv na zvýšenou lipolýzu, nárůst produkce VLDL v játrech a na inzulinovou rezistenci. Z kalcineurinových inhibitorů má vyšší nepříznivý účinek na lipidové spektrum cyklosporin (zvyšuje celkový a LDL-cholesterol a triglyceridy) [29]. Takrolimus snižuje koncentraci lipoproteinové lipázy a zvyšuje hladinu triglyceridů [30]. Inhibitory mTOR jsou spojeny s dyslipidemií s převahou hypertriglyceridemie.
Výskyt hypertenze u pacientů s transplantovanou ledvinou je 70–90 % [31]. Hypertenze je nezávislým rizikovým faktorem chronické dysfunkce štěpu a kardiovaskulárních komplikací [32]. K nárůstu výskytu hypertenze u pacientů po transplantaci ledviny došlo po zavedení kalcineurinových inhibitorů, prohypertenzní efekt mají i kortikosteroidy [33].
Zvýšený výskyt MS u pacientů po transplantaci ledviny byl opakovaně dokumentován.
DeVries [5] na souboru 606 pacientů popsal výskyt MS 63 % v mediánu 6 let po transplantaci ledviny. MS byl asociován se sníženou funkcí štěpu: 2,6 ml/min/1,73 m2; 95% CI (-4,5, -0,8); p = 0,007 podle odhadované glomerulární filtrace dle vzorce MDRD (eGF MDRD). Hypertenze a hypertriglyceridemie byly nezávisle asociovány se zhoršenou funkcí transplantované ledviny.
Luan [34] sledoval 591 nediabetiků po transplantaci ledviny, metabolický syndrom byl u 53,1 %. MS byl spojen s poklesem funkce štěpu a se zvýšenou hladinou kyseliny močové v séru. MS syndrom byl asociován s poklesem eGF MDRD (-2,1 ml/min; p = 0,064). Hypertriglyceridemie byla spojena se snížením eGF MDRD o 3,5 ml/min (p = 0,003).
Porrini [22] hodnotil 573 pacientů po transplantaci ledviny, MS mělo 37,7 % nemocných. Přežívání štěpu i pacientů bylo signifikantně nižší ve skupině s MS.
Studie ALERT [24] sledovala vliv MS na výskyt kardiovaskulárních příhod a efekt léčby statinem u 1 706 nediabetiků po transplantaci ledviny. MS mělo 32 % pacientů. Riziko úmrtí na srdeční onemocnění bylo o 74 % vyšší při MS (p = 0,012) a léčba statinem toto riziko redukovala (p = 0,03).
Cíle práce
Cílem naší práce bylo sledovat výskyt metabolického syndromu a jeho komponent po transplantaci ledviny a hodnotit jejich vliv na parametry transplantované ledviny: na renální funkci a albuminurii. Součástí vyšetření byla analýza vybraných laboratorních parametrů spojených s inzulinovou rezistencí, obezitou a metabolickým syndromem ve snaze nalézt pro klinickou praxi využitelný marker určující rizikové pacienty.
Soubor pacientů
Do sledování jsme zařadili 69 pacientů, kteří v letech 2006–2008 podstoupili transplantaci ledviny od zemřelého dárce a byli sledováni na transplantačních ambulancích II. interní kliniky FN u sv. Anny v Brně a Centra kardiovaskulární a transplantační chirurgie Brno. Pacienti byli vyšetřeni v časových intervalech 6 měsíců, 1, 2 a 3 roky po transplantaci ledviny.
Charakteristika souboru
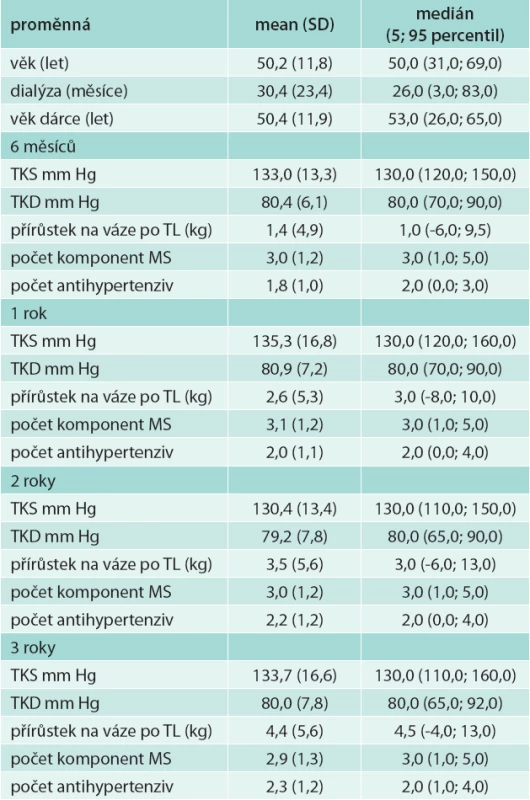
V souboru bylo 52 mužů (75,4 %) a 17 žen (24,6 %), z nich 6 podstoupilo 2. transplantaci (8,7 %), ostatní podstoupili 1 transplantaci ledviny. Peritoneální dialýzou bylo před transplantací léčeno 17 pacientů (24,6 %), 52 pacientů bylo léčeno hemodialýzou (75,4 %). Biopticky ověřená rejekce transplantované ledviny byla u 12 pacientů (17,4 %). U 19 pacientů (27,5 %) byla opožděná funkce štěpu (tab. 1). Průměrný věk příjemce byl 50,2 (SD 11,8) let, průměrný věk dárce byl 50,4 (SD 11,9) let (tab. 2).
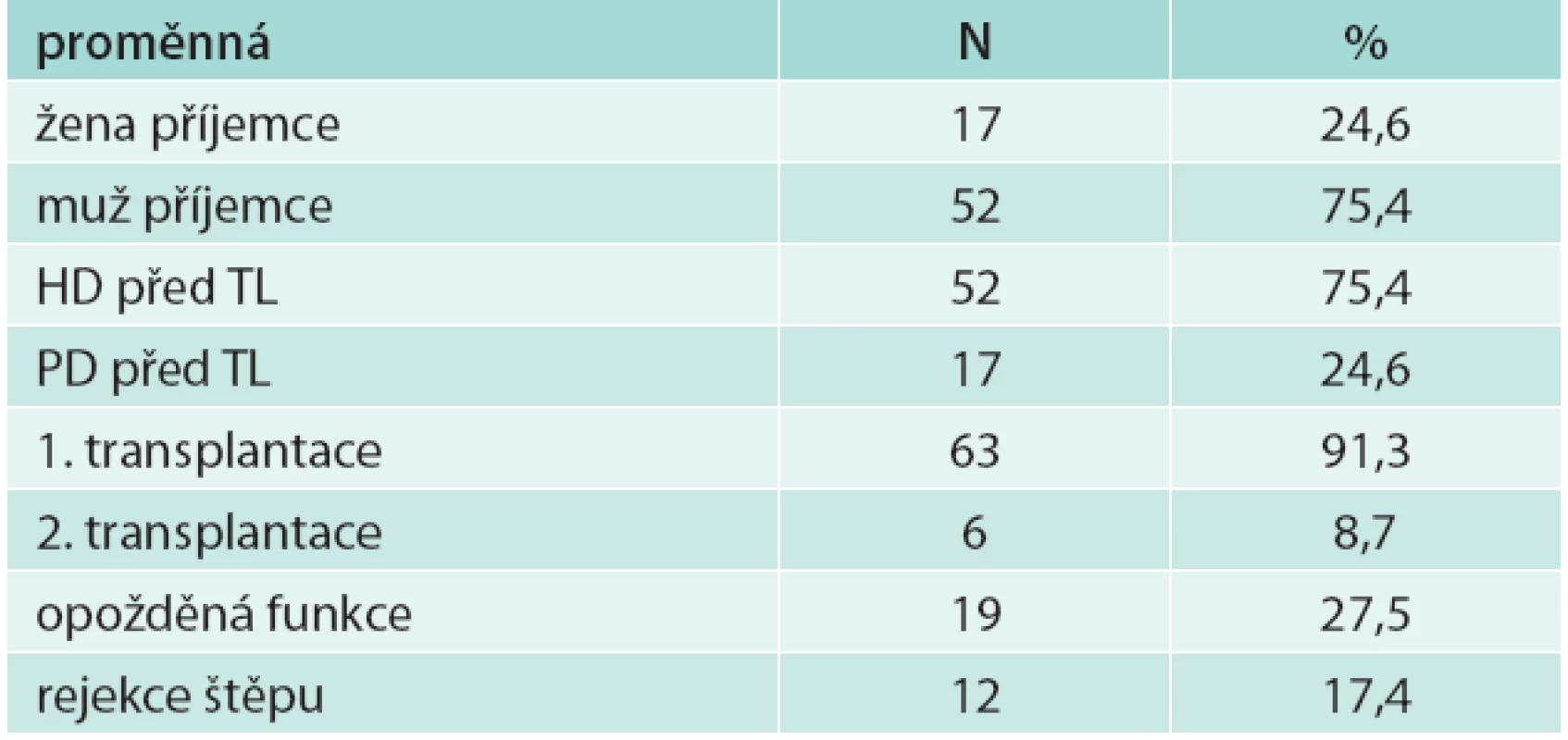
U pacientů byla použita následující indukční imunosupresivní léčba: před transplantací byl podán takrolimus v dávce 0,1–0,15 mg/kg tělesné hmotnosti perorálně a 1 g mykofenolátu mofetilu per os, metylprednison 500 mg i.v. se aplikoval při obnovení průtoku graftem. V pooperačním průběhu se pacientům podával metylprednison 125 mg i.v. 1. pooperační den, 40 mg i.v. 2. pooperační den a následně prednison 20 mg denně p.o. do konce 1. měsíce, 15 mg denně 2. měsíc, 10 mg denně 3. měsíc a 5 mg denně 7.–12. měsíc. Takrolimus se dávkoval k udržení hladin 10–15 µg/l 1. měsíc a 5–10 µg/l od 2. měsíce dále. Mykofenolát mofetil byl podáván v dávkách 2krát 1 g 1. měsíc po transplantaci a 2krát 0,5 g od 2. měsíce po transplantaci.
Metody a vyšetření
Sledovali jsme parametry komponent MS.
Renální funkce byla hodnocena výpočtem ze sérového kreatininu (Skr).
Výpočet odhadované glomerulární filtrace (estimated glomerular filtration – eGF) byl proveden dle vzorce eGF MDRD (Modification of diet in Renal Disease):
Albuminurii jsme hodnotili poměrem albumin/kreatinin v moči (ACR – albumin creatinine ratio) v mg/mmol.
Výpočet eGF MDRD a hodnocení ACR byly hodnoceny dle aktuálních doporučení České nefrologické společnosti.
Analýzu jsme doplnili o vybrané adipokiny a další potenciální laboratorní markery metabolického syndromu: fibroblast growth factor 21 (FGF21), allograft inflammatory factor 1 (AIF1), adipocyte fatty acid-binding protein (aFABP), prostaglandin D synthase, fetuin A, adiponektin a leptin.
AIF1 je cytokin s expresí v makrofázích, je markerem aktivace makrofágů při obezitě [35]. AFABP exprimovaný v adipocytech reguluje funkci adipocytů při obezitě [36]. FGF21 je metabolický faktor produkovaný zejména v játrech, exprimovaný také v adipocytech a v pankreatu, reguluje metabolizmus glukózy a lipidů pleiotropním efektem v těchto tkáních a v mozku [37]. Prostaglandin D synthase je mediátorem transportu glukózy ve svalové i tukové tkáni s regulačním účinkem na inzulinovou senzitivitu u diabetiků 2. typu [38]. Fetuin A je inhibitor patologických kalcifikací s asociací k inzulinové rezistenci, MS a aterogenezi [39].
Statistická metodika
Pro popis dat byla použita standardní statistická metodika, v případě spojitých dat šlo o průměr doplněný o směrodatnou odchylku a medián doplněný 5–95percentilovým rozsahem, kategoriální data byla popsána absolutní a relativní četností kategorií. Pro srovnání rozdílů mezi skupinami a výpočtu jeho statistické významnosti byl u spojitých dat použit Mannův-Whitneyův U-test, u dat kategoriálních χ2 test maximální věrohodnosti. Korelace spojitých proměnných byly počítány pomocí Spearmanova korelačního koeficientu. Za statisticky významný rozdíl byla považována hodnota p < 0,05. Modelování závislosti hladiny biochemických ukazatelů funkce ledvin na dalších proměnných bylo provedeno pomocí jednorozměrné a vícerozměrné lineární regrese, v případě porušení předpokladů o rozložení dat byla aplikována logaritmická transformace. Výskyt binárních jevů (např. výskyt potransplantačního DM) byl modelován logistickou regresí, pro popis výsledků bylo použito poměru šancí (odds ratio).
Výsledky
Výskyt metabolického syndromu v našem souboru byl 3 roky po transplantaci 61,3 %, potransplantační diabetes mellitus (DM) mělo 27 % a zvýšenou hladinu glykemie na lačno ≥ 5,6 mmol/l bez přítomnosti DM 19 % pacientů, snížený HDL-cholesterol 35,5 %, hypertriglyceridemii 45,2 %, abdominální obezitu 59,7 % a BMI ≥ 30 kg/m2 mělo 33,9 % sledovaných nemocných (tab. 3). Výskyt potransplantačního diabetes mellitus ve sledovaném období klesal (z 34,8 % na 27 % v 6 měsících a 3 letech po transplantaci). Naopak výskyt abdominální obezity i obezity dle BMI s časem po transplantaci narůstal. Průměrný přírůstek na váze 3 roky po transplantaci byl 4,4 kg (SD 5,6), tab. 2. Výskyt metabolického syndromu se v čase významně neměnil.
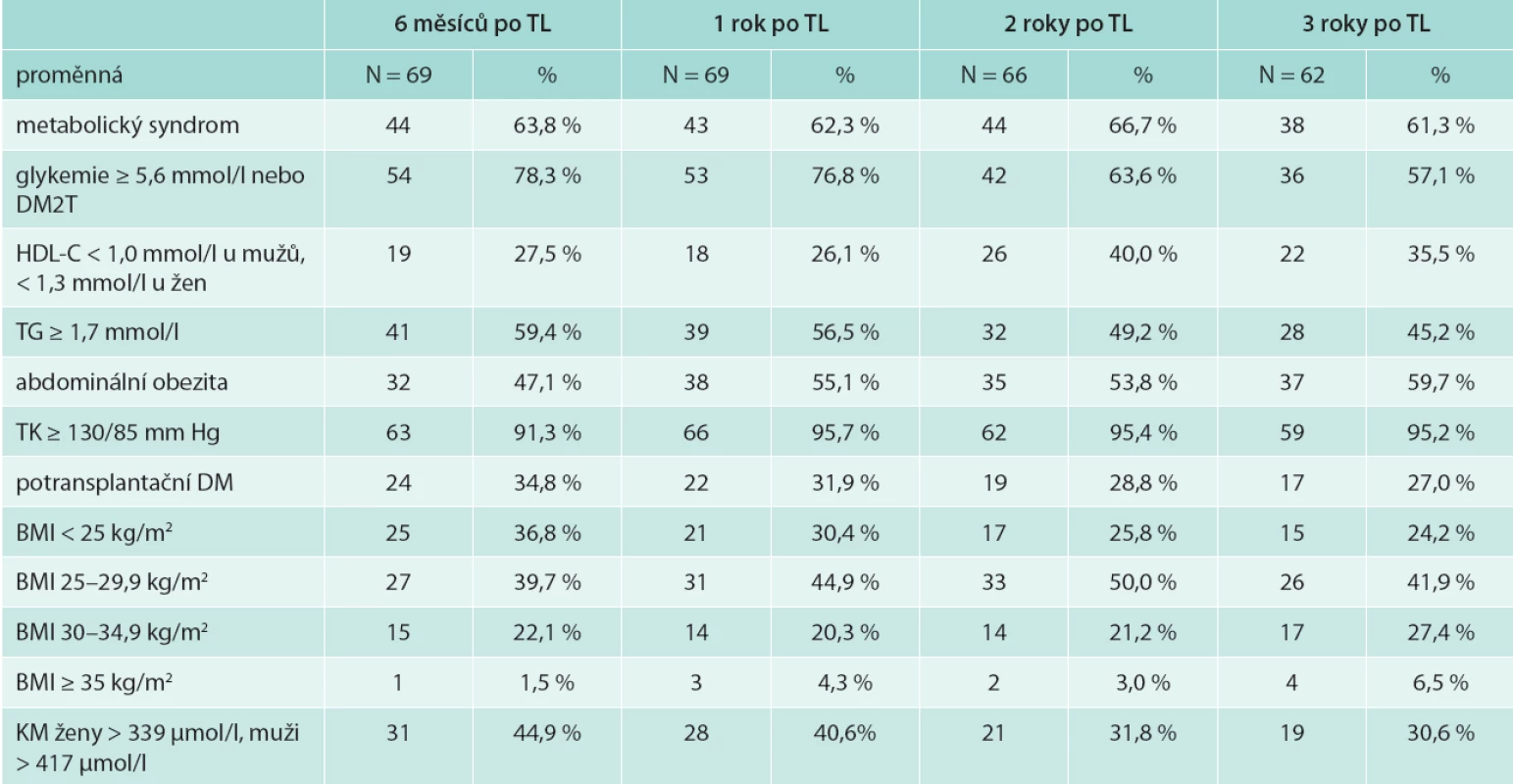
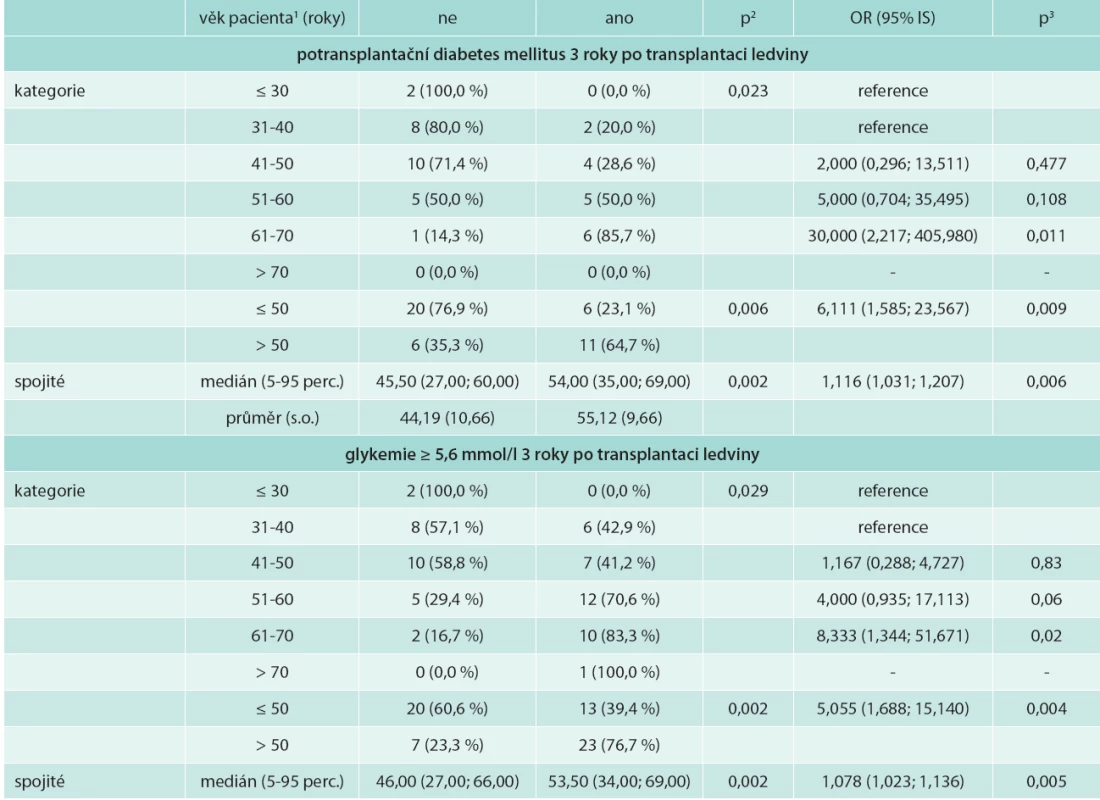
Věk příjemců ledviny s MS 3 roky po transplantaci byl nesignifikantně vyšší. Věk pacientů s potransplantačním diabetes mellitus byl signifikantně vyšší: 54,0 (35,0; 69,0) let vs 45,5 (27,0; 60,0) let u nediabetiků; OR (95% IS) 1,116 (1,031; 1,207); p = 0,006 (tab. 4).
Pacienti léčení peritoneální dialýzou před transplantací neměli vyšší výskyt metabolického syndromu po transplantaci ledviny oproti hemodialyzovaným.
U pacientů s poklesem renální funkce s eGF MDRD < 1 ml/s 3 roky po transplantaci ledviny byl signifikantně vyšší výskyt metabolického syndromu (p = 0,041) a hypertriglyceridemie (p = 0,044). eGF MDRD u pacientů s MS byla 3 roky po transplantaci nesignifikantně nižší (tab. 5). Vyšší počet komponent metabolického syndromu byl asociován s poklesem funkce štěpu (rs -0,275; p = 0,031). Pacienti s poklesem apolipoproteinu AI měli 3 roky po transplantaci signifikantně nižší glomerulární filtraci (p = 0,031).
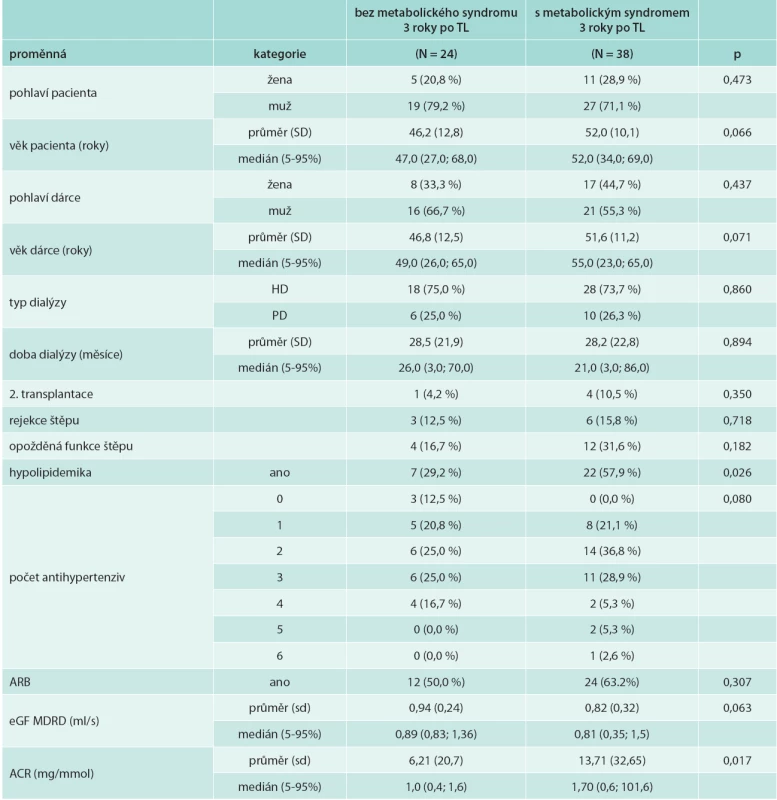
Signifikantní byl vliv věku dárce (rs -0,515, p = 0,001) na dysfunkci štěpu 3 roky po transplantaci. Věk příjemce, doba na dialýze, tlak krve, počet antihypertenziv ani obezita či přírůstek na váze nebyly spojeny se signifikantním poklesem glomerulární filtrace. Diabetes mellitus nebyl nezávislým faktorem poklesu funkce štěpu.
Významnými prediktory snížené funkce transplantované ledviny se dále ukázaly opožděná funkce štěpu (p = 0,014), rejekce (p = 0,001), hypertriglyceridemie (p = 0,022), snížená hladina HDL-cholesterolu (p = 0,025), hypolipidemická léčba (p = 0,030), hyperurikemie (p =0,001) a zvýšení hladiny AFABP (p = 0,013).
Metabolický syndrom signifikantně koreloval s albuminurií hodnocenou poměrem albumin/kreatinin v moči (p = 0,017), tab. 5. Zvýšení hladiny apolipoproteinu B (p = 0,001), celkového cholesterolu (p = 0,016), non HDL-cholesterolu (p = 0,020), BNP (p = 0,049) a FGF21 (p = 0,046) pozitivně korelovalo s albuminurií. Albuminurie byla statisticky významně asociována s vyšším počtem antihypertenziv (p = 0,018) a zvýšeným systolickým TK (p = 0,048). Zvýšení apolipoproteinu B a celkového cholesterolu v séru byly nezávislými prediktory albuminurie.
Pouze hyperurikemie byla v našem souboru signifikantním prediktorem dysfunkce štěpu 3 roky po transplantaci nezávisle na rejekci, opožděné funkci štěpu a věku dárce.
Přítomnost metabolického syndromu signifikantně korelovala se zvýšenými hladinami leptinu (p = 0,027) a AFABP (p = 0,006).
Diskuse
Prevalence metabolického syndromu byla 3 roky po transplantaci ledviny v našem souboru 61,3 %, podobně jako v práci de Vriese [5], který popsal MS u 64 % sledovaných v mediánu 6 let po transplantaci. Další práce popisují výskyt MS 14,9–53,1 % 4–7 let po transplantaci [6,22,24,34]. Nižší výskyt MS v ostatních pozorováních může být dán rozdílnými definicemi MS, odlišnými imunosupresivními režimy, rozdílnou dobou od transplantace ledviny, jinou populací a stravovacími návyky.
Abdominální obezita byla v našem souboru na konci sledování u 59,7 % pacientů oproti 51 % u de Vriese [5]. Prevalence abdominální obezity v našem souboru narůstala s časem, což lze vysvětlit populací pacientů v České republice s nevhodným životním stylem, stravovacími návyky i rostoucí prevalencí obezity celosvětově.
Nižší prevalenci dyslipidemie v našem souboru (hypertriglyceridemie u 45,2 % a pokles HDL-cholesterolu u 35,5 % pacientů v našem souboru oproti 60 % a 62 % v souboru de Vriese) vysvětlujeme rozdílnou imunosupresí – v minulosti převažovala léčba cyklosporinem, oproti tomu 95 % našich pacientů se léčilo takrolimem. Efekt cyklosporinu na dyslipidemii je méně příznivý [29].
Hypertenze se vyskytla u 95,2 % nemocných v našem souboru, u 88 % v souboru deVriese [5]. Potvrzuje se, že většina pacientů s transplantovanou ledvinou se léčí s hypertenzí. Je známo, že léčba kalcineurinovými inhibitory zvyšuje výskyt hypertenze, navíc u pacientů se selháním ledvin je běžná preexistující hypertenze renoparenchymatózní [33].
Vyšší byl v našem souboru výskyt PTDM 27 % oproti 11,7–17 % [5,6,34]. Tento fakt je ovlivněn skutečností, že v práci de Vriese [5] z roku 2004 byla převaha pacientů léčených cyklosporinem (68 % pacientů s MS a 58 % bez MS) a menší procento užívalo takrolimus (12 % pacientů s MS a 17 % bez MS). V našem souboru bylo 95 % pacientů léčeno takrolimem. Takrolimus je spojen s vyšším výskytem poruch glukózového metabolizmu oproti cyklosporinu [26], předpokládá se jeho efekt na dysfunkci B buněk pankreatu, snižuje sekreci inzulinu inhibicí přepisu mRNA pro inzulin a vede k periferní inzulinové rezistenci. Věk příjemce se ukázal jako rizikový faktor výskytu PTDM a zvýšené glykemie na lačno, proto by v léčbě starších pacientů měla být zohledněna zvýšená míra rizika těchto komplikací. Vyšší věk byl i ve skupině pacientů s MS, ale rozdíl nebyl signifikantní.
Metabolický syndrom v našem souboru nebyl asociován s předchozí léčbou peritoneální dialýzou. Naše data jsou v souladu s prací de Vriese [5], přestože některé práce ukazují na asociaci metabolického syndromu s peritoneální dialýzou (PD) vlivem podávání glukózových dialyzačních roztoků při této metodě. PD je asociována se zvýšeným rizikem hyperglykemie, obezity a dyslipidemie [40].
V našem souboru byl 3 roky po transplantaci signifikantně vyšší výskyt metabolického syndromu u pacientů s poklesem renální funkce, ale snížení funkce štěpu při MS nebylo statisticky významné. Vysvětlujeme to krátkou dobou po transplantaci, kdy převažovaly tyto vlivy: vyšší věk dárce, opožděný nástup funkce štěpu a rejekční epizody. Signifikantní byl vliv počtu komponent metabolického syndromu na dysfunkci štěpu a pozitivní korelace mezi MS a albuminurií 3 roky po transplantaci. Přítomnost MS byla v některých souborech asociována se zhoršenou funkcí transplantované ledviny [5,22], jiné práce neprokázaly signifikantní vliv MS na dysfunkci štěpu [6,34].
Statisticky významný vliv hypertriglyceridemie na dysfunkci štěpu koresponduje s výsledky jiných prací [5,34], zvýšená hladina triglyceridů byla popsána jako nezávislý prediktor ztráty funkce štěpu [41]. Signifikantní byla pozitivní korelace mezi glomerulární filtrací a hladinou apolipoproteinu AI (apoAI). HDL-cholesterol a jeho majoritní protein apoAI mají protektivní účinek proti ateroskleróze, podílejí se na reverzním transportu cholesterolu [42]. Zvýšené hladiny apoB a pokles apoAI jsou markery MS. Zvýšený poměr ApoB/apoAI byl korelován s MS a jeho komponentami a je spojen se zvýšeným kardiovaskulárním rizikem [43].
U pacientů s potransplantačním diabetes mellitus byla nižší funkce štěpu oproti nediabetikům (p = 0,024), ale v regresní analýze se neprokázal nezávislý vliv PTDM na dysfunkci štěpu. Doba sledování byla příliš krátká na ovlivnění renální funkce diabetem, vliv DM na albuminurii byl nesignifikantní. Obezita ve sledovaném období nebyla spojena se snížením funkce štěpu ani s albuminurií.
Rejekce a věk dárce se ukázaly nejvýznamnějšími prediktory chronické dysfunkce transplantované ledviny ve shodě s řadou pozorování [5,22].
Pouze hyperurikemie byla v naší práci signifikantním prediktorem dysfunkce štěpu 3 roky po transplantaci nezávisle na rejekci, opožděné funkci štěpu a věku dárce. Příčinou hyperurikemie může být snížená renální funkce, léčba kalcineurinovými inhibitory či diuretiky [44]. Není jasné, zda byla její příčinou snížená renální funkce nebo naopak hyperurikemie měla vliv na dysfunkci ledviny. Byl popsán vliv hyperurikemie na poruchy renální hemodynamiky, glomerulosklerózu a tubulointersticiální poškození.
Korelace MS, celkového a nonHDL-cholesterolu, apolipoproteinu B, hypertenze a BNP s albuminurií potvrzuje, že mikroalbuminurie je markerem časného poškození cév aterosklerózou u pacientů s dyslipidemií a MS [45]. FGF21 jako potenciální marker časné detekce kardiometabolických poruch byl asociován s albuminurií [37].
Přítomnost metabolického syndromu korelovala se zvýšenými hladinami leptinu a AFABP (adipocyte fatty acid-binding protein). AFABP se podílí na rozvoji většiny komponent MS prostřednictvím regulace adipocytů a makrofágů [36]. Vyšetření AFABP by mohlo být v predikci MS výtěžné.
Naše práce měla několik limitací. Neměli jsme data o přítomnosti MS a jeho komponent u pacientů před transplantací a do souboru jsme zařadili i pacienty s pretransplantačním DM2T (8 pacientů). U pacientů se zvýšenou hladinou glykemie na lačno jsme neprováděli zátěžový test glukózou z organizačních důvodů. Vstupní vyšetření jsme prováděli 6 měsíců po transplantaci, v té době vyšší dávky imunosupresiv a opožděná funkce štěpu mohly ovlivnit renální parametry a je riziko, že dávky imunosupresiv ještě nebyly stabilizované.
Závěr
Z ovlivnitelných faktorů jsme prokázali jako rizikové pro chronickou dysfunkci štěpu hypertriglyceridemii, nízký HDL-cholesterol, pokles apolipoproteinu AI, hyperurikemii a počet komponent metabolického syndromu, albuminurie byla asociována s metabolickým syndromem, s elevací apolipoproteinu B, celkového a nonHDLcholesterolu, zvýšeným systolickým TK a počtem antihypertenziv.
MUDr. Marta Nedbálková
marta.nedbalkova@fnusa.cz
II. interní klinika LF MU a FN u sv. Anny v Brně
www.fnusa.cz
Doručeno do redakce dne 10. 4. 2013
Přijato po recenzi dne 28. 11. 2013
Sources
1. Isomaa B, Almgren P, Tuomi T et al. Cardiovascular morbidity and mortality associated with the metabolic syndrome. Diabetes Care 2001; 24(4): 683–689.
2. Teplan V, Marečková O, Vyhnánková I et al. Asymetrický dimethylarginin a pentosidin u nemocných s chronickým onemocněním ledvin a obezitou: randomizovaná kontrolovaná studie. Aktuality v nefrologii 2008; 14(4): 185–190.
3. Ford ES, Giles WH, Dietz WH. Prevalence of the metabolic syndrome among US adults: findings from the third National Health and Nutrition Examination Survey. JAMA 2002; 287(3): 356–359.
4. Cífková R. Epidemiologie metabolického syndromu ve světě a v České republice. Ústní sdělení. Symposium o syndromu inzulinové rezistence. Praha 26.-27. února 2003.
5. De Vries AP, Bakker SJ, Van Son WJ et al. Metabolic syndrome is associated with impaired long-term renal allograft function; not all component criteria contribute equally. Am J Transplant 2004; 4(10): 1675–1683.
6. Kishikawa H, Nishimura K, Kato T et al. Prevalence of the metabolic syndrome in kidney transplantation. Transplant Proc 2009; 41(1): 181–183.
7. Expert Panel on Detection, Evaluation, and Treatment of High Blood Cholesterol in Adults. Executive Summary of The Third Report of The National Cholesterol Education Program (NCEP) Expert Panel on Detection, Evaluation, And Treatment of High Blood Cholesterol In Adults (Adult Treatment Panel III). JAMA 2001; 285(19): 2486–2497.
8. Alberti KG , Eckel RH, Grundy SM et al. Harmonizing the metabolic syndrome: a joint interim statement of the International Diabetes Federation Task Force on Epidemiology and Prevention; National Heart, Lung, and Blood Institute; American Heart Association; World Heart Federation; International Atherosclerosis Society; and International Association for the Study of Obesity. Circulation 2009; 120(16): 1640–1645.
9. Svačina Š. Chronický zánět a metabolický syndrom. Vnitř Lék 2012; 58(7–8): 205–207.
10. Devaraj S, Rosenson RS, Jialal I. Metabolic syndrome: an appraisal of the proinflammatory and procoagulant status. Endocrinol Metab Clin North Am 2004; 33(2): 431–453.
11. Rosolová H, Mayer jr. O, Reaven GM. Insulin-mediated glucose disposal is decreased in normal volunteers with relatively low plasma mangesium concentrations. Metabolism 2000; 49(3): 418–420.
12. Weir MR. Microalbuminuria and cardiovascular disease. Clin J Am Soc Nephrol 2007; 2(3): 581–590.
13. Anderson PJ, Critchley JA, Chan JC et al. Factor analysis of the metabolic syndrome: obesity vs insulin resistance as the central abnormality. Int J Obes Relat Metab Disord 2001; 25(12): 1782–1788.
14. Souček M. Metabolický syndrom. Vnitř Lék 2009; 55(7–8): 618–621.
15. Reaven GM, Lithell H, Landsberg L. Hypertension and associated metabolic abnormalities – the role of insulin resistance and the sympathoadrenal system. N Engl J Med 1996; 334(6): 374–381.
16. Souček M. Metabolický syndrom. Vnitř Lék 2005; 51(S3): S61-S66.
17. Oterdoom LH, de Vries AP, van Ree RM et al. N-terminal pro-B-type natriuretic peptide and mortality in renal transplant recipients versus the general population. Transplantation 2009; 87(10): 1562–1570.
18. Aakhus S, Dahl K, Wideroe TE. Cardiovascular disease in stable renal transplant patients in Norway: Morbidity and mortality during a 5-yr follow-up. Clin Transplant 2004; 18(5): 596–604.
19. Teplan V. Metabolický syndrom a poškození ledvin u nefrologických nemocných. Postgraduální medicína 2010; 12(8): 877–884.
20. Kasiske BL, Snyder JJ, Gilbertson D et al. Diabetes mellitus after kidney transplantation in the United States. Am J Transplant 2003; 3(2): 178–185.
21. Diekmann F, Budde K, Slowinski T et al. Conversion to sirolimus for chronic allograft dysfunction: long-term results confirm predictive value of proteinuria. Transpl Int 2008; 21(2): 152–155.
22. Porrini E, Delgado P, Bigo C et al. Impact of metabolic syndrome on graft function and survival after cadaveric renal transplantation. Am J Kidney Dis 2006; 48(1): 134.
23. Hjelmesaeth J, Hartmann A, Leivestad T et al. The impact of early-diagnosed new-onset post-trasplantation diabetes mellitus on survival and major cardiac events. Kidney Int 2006; 69(3): 588–595.
24. Soveri I, Abedini S, Holdaas H et al. Graft loss risk in renal transplant recipients with metabolic syndrome: subgroup analyses of the ALERT trial. J Nephrol 2012; 25(2): 245–254.
25. Kasiske BL, Chakkera H, Roel J. Explained and unexplained ischemic heart disease risk after renal transplantation. J Am Soc Nephrol 2000; 11(9): 1735–1743.
26. Ghisdal L, Bouchta NB, Broeders N et al. Conversion from tacrolimus to cyclosporine A for new-onset diabetes after transplantation: a single-centre experience in renal transplanted patients and review of the literature. Transpl Int 2008; 21(2): 146–151.
27. Češka R. Diabetes mellitus jako rizikový faktor. Metabolický syndrom. In: Češka R. Cholesterol a ateroskleróza, léčba dyslipidémií. Triton: Praha 2005 : 148–151. ISBN 80–7254–738–0.
28. Del Castillo D, Cruzado JM, Manel Díaz J et al. The effects of hyperlipidaemia on graft and patient outcome in renal transplantation. Nephrol Dial Transplant 2004; 19(Suppl. 3): iii67-iii71.
29. Mihatsch MJ, Kyo M, Morozumi K et al. The side-effects of ciclosporine-A and tacrolimus. Clin Nephrol 1998; 49(6): 356–363.
30. Tory R, Sachs-Barrable K, Goshko CB et al. Tacrolimus-induced elevation in plasma triglyceride concentrations after administration to renal transplant patients is partially due to a decrease in lipoprotein lipase activity and plasma concentrations. Transplantation 2009; 88(1): 62–68.
31. Curtis JJ. Hypertension following kidney transplantation. Am J Kidney Dis 1994; 23(3): 471–475.
32. Opelz G, Wujciak T, Ritz E. Association of chronic kidney graft failure with recipient blood pressure. Collaborative Transplant Study. Kidney Int 1998; 53(1): 217–222.
33. Monhart V. Hypertenze po transplantaci ledviny. In: Monhart V. Hypertenze a ledviny. 2nd ed.Triton: Praha 2007 : 131–133. ISBN: 978–80–7387–002–7.
34. Luan FL, Langewisch E, Ojo A. Metabolic syndrome and new onset diabetes after transplantation in kidney transplant recipients. Clin Transplant 2010; 24(6): 778–783.
35. Fukui M, Tanaka M, Toda H et al. The serum concentration of allograft inflammatory factor-1 is correlated with metabolic parameters in healthy subjects. Metabolism 2012; 61(7): 1021–1025.
36. Horakova D, Pastucha D, Stejskal D et al. Adipocyte fatty acid binding protein and C-reactive protein levels as indicators of insulin resistance development. Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub 2011; 155(4): 355–359.
37. Woo YC, Xu A, Wang Y. Fibroblast growth factor 21 as an emerging metabolic regulator: clinical perspectives. Clin Endocrinol (Oxf) 2013; 78(4): 489–496.
38. Ragolia L, Hall CE, Palaia T. Lipocalin-type prostaglandin D(2) synthase stimulates glucose transport via enhanced GLUT4 translocation. Prostaglandins Other Lipid Mediat 2008; 87(1–4): 34–41.
39. Kaess BM, Enserro DM, McManus DD et al. Cardiometabolic correlates and heritability of fetuin-A, retinol-binding protein 4, and fatty-acid binding protein 4 in the Framingham Heart Study. J Clin Endocrinol Metab 2012; 97(10): E1943-E1947.
40. Johnson DW, Armstrong K, Campbell SB et al. Metabolic syndrome in severe chronic kidney disease: Prevalence, predictors, prognostic significance and effects of risk factor modification. Nephrology (Carlton) 2007; 12(4): 391–398.
41. Guijarro C, Massy ZA, Kasiske BL. Clinical correlation between renal allograft failure and hyperlipidemia. Kidney Int Suppl 1995; 52(S): S56-S59.
42. Sierra-Johnson J, Somers VK, Kuniyoshi FH et al. Comparison of apolipoprotein-B/apolipoprotein-AI in subjects with versus without the metabolic syndrome. Am J Cardiol 2006; 98(10): 1369–1373.
43. Sniderman AD, Faraj M. Apolipoprotein B, apolipoprotein A-I, insulin resistance and the metabolic syndrome. Curr Opin Lipidol 2007; 18(6): 633–637.
44. Sánchez-Lozada LG, Tapia E, Rodríguez-Iturbe B at al. Hemodynamics of hyperuricemia. Semin Nephrol 2005; 25(1): 19–24.
45. Bonnet F, Marre M, Halimi JM et al. Waist circumference and the metabolic syndrome predict the development of elevated albuminuria in non-diabetic subjects: the DESIR Study. J Hypertens 2006; 24(6): 1157–1163.
Labels
Diabetology Endocrinology Internal medicineArticle was published in
Internal Medicine

2014 Issue 3
-
All articles in this issue
- Metabolický syndrom po transplantaci ledviny – editorial
- Rabdomyolýza intoxikovaných a akutní poškození ledvin – editorial
- Rabdomyolýza – editorial
- Lymfomatoidní granulomatóza – minulost a současnost – editorial
- Metabolický syndrom po transplantaci ledviny
- Bolest u chronické pankreatitidy a karcinomu pankreatu – možnosti léčby
- Metody ekonomického hodnocení screeningových programů. Situace v České republice
- Patogenéza zmien vnútorného prostredia pri akútnom svalovom kompartment syndróme
- Lymfomatoidní granulomatóza – minulost a současnost
-
Mezentériointestinokolonovaskulárna artériová ischemická choroba
Odporúčania Sekcie angiológov Slovenskej lekárskej komory (2013) - Crush syndróm súčasnosti – rabdomyolýza intoxikovaných
- Iva Příhodová. Poruchy spánku u dětí a dospívajících
- Jaromír Astl. Chirurgická léčba nemocí štítné žlázy
- Jiří Hoch, Jan Leffler et al. Textbook of Surgery. Current Surgical Diagnosis and Treatment.
- Profesor Aleš Linhart slaví padesátiny
- Profesor MUDr. Rastislav Dzúrik, DrSc. (*24. augusta 1929 – †27. februára 2014)
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue
- Crush syndróm súčasnosti – rabdomyolýza intoxikovaných
- Bolest u chronické pankreatitidy a karcinomu pankreatu – možnosti léčby
- Lymfomatoidní granulomatóza – minulost a současnost
- Patogenéza zmien vnútorného prostredia pri akútnom svalovom kompartment syndróme

