Neobvyklá intervence na nativní tepně u pacienta po aortokoronárním bypassu
Unusual intervention of native vessel in patient with coronary artery bypass
Coronary artery bypass grafting (CABG) is older method of revascluarization treatment of coronary artery disease (CAD) then percutaneous coronary intervention (PCI), but in some cases, especially in multivessel disease or chronic total occlusions, still used. Extending survival of patients with CAD increases number of recathetrizations and interventions namely in post-CABG subjects. Due to degenerative and atherosclerotic changes of bypasses, especially venous grafts, intervential cardiologists are forced to solve often complicated findings. In other cases patients are reoperated with increased risk. Our task describes unusual, technically challenging and somewhat risk PCI of native vessel through arterial bypass in post-PCI patient with significant angina.
Key words:
coronary artery bypass – coronary artery disease – percutaneous coronary intervention
Authors:
Zdeněk Coufal; Martin Gřiva; Robert Náplava
Authors‘ workplace:
Kardiovaskulární centrum pro dospělé, vedoucí lékař prim. MUDr. Zdeněk Coufal, a Interní klinika IPVZ Praha a Krajské nemocnice T. Bati, a. s. Zlín, přednosta MUDr. Jiří Latta
Published in:
Vnitř Lék 2014; 60(4): 289-292
Category:
60th Birthday - prof. MUDr. Petr Widimský, DrSc., FESC, FACC
Overview
Aortokoronární bypass (CABG) je starší metodou revaskularizační léčby ischemické choroby srdeční (ICHS) nežli perkutánní koronární intervence (PCI), i když stále využívaná, především u vícetepennéno postižení nebo u chronických uzávěrů. S prodlužující se délkou přežívání nemocných s ICHS přibývá opakovaných katetrizací a intervencí, a to i u nemocných po CABG. Vzhledem k tomu, že i bypassy, zvláště žilní štěpy, podléhají degenerativním a aterosklerotickým změnám, jsou intervenční kardiologové mnohdy nuceni řešit i značně komplikované nálezy. V jiných případech podstupují nemocní reoperace, které jsou zatíženy mnohem vyšším rizikem než operace původní. V našem sdělení popisujeme neobvyklou, technicky náročnou a poněkud rizikovou PCI na nativní tepně cestou tepenného bypassu u nemocného po CABG s významnou anginou pectoris.
Klíčová slova:
aortokonární bypass – ischemická choroba srdeční – perkutánní koronární intervence
Úvod
Počátky chirurgické léčby koronární aterosklerotické nemoci (coronary artery disease – CAD) jako příčiny ICHS sahají do roku 1953, kdy Murray použil první experimentální aortokoronární bypass (coronary artery bypass grafting – CABG) bez mimotělního oběhu v podobě našití a. mammaria interna (IMA). Téhož roku byl prvně použit mimotělní oběh, který umožnil v průběhu 60. let 20. století rozvoj chirurgické revaskularizace, ať již za pomoci žilních štěpů (Sabinston, Garrett, Kahn, Favloro) nebo IMA (Kolesov 1964) [1]. První CABG na našem území byl našit v IKEM Praha v říjnu roku 1970 prof. Lichtenbergem [2]. Naproti tomu katetrizační léčba začíná psát svou historii až v roce 1977, kdy Andreas Gruentzig poprvé u člověka použil balonkovou angioplastiku k rekanalizaci koronární tepny [3]. Od roku 1986 se začínají používat koronární stenty, které snížily výskyt restenóz po balonkových angioplastikách, od roku 2003 máme k dispozici lékové stenty významně redukující výskyt restenóz ve stentech a od roku 2012 pro běžné použití vstřebatelné stenty (bioabsorbovatelné scaffoldy).
Pokrok v chirurgické i intervenční léčbě CAD vede k prodloužení života kardiaků a ve svém důsledku také k návratu těchto nemocných do katetrizačních laboratoří. Mnoho z nich tvoří nemocní po CABG. Tepenné, ale obzvláště žilní bypassy podléhají degenerativním a aterosklerotickým změnám a difuzní či lokalizované intimální hyperplazii. Starší práce z 80. let 20. století uvádějí 10–12letou průchodnost štěpů v 63,3 % [4]. Ani po 30 letech nedošlo k zásadním změnám v dlouhodobé průchodnosti žilních štěpů, avšak je patrné významně delší přežívání funkčních tepenných štěpů, především IMA. Např. v práci Goldmanna et al z roku 2004 se uvádí 10letá průchodnost žilních štěpů 61 % ve srovnání s 81 % průchodnými IMA bypassy (p < 0,001) [5].
Počet provedených aortokoronárních bypassů včetně kombinovaných výkonů má sestupnou tendenci (7 140 v roce 2005 až 5 606 v roce 2010) [6], zatímco počet koronárních intervencí se meziročně zásadně nemění a pohybuje okolo 21 000–22 000 (21 180 intervencí v roce 2011), z toho okolo 600 intervencí je provedeno na žilních nebo tepenných štěpech [7]. Počet intervencí na nativních tepnách vynucených postižením bypassů registry neuvádějí.
Na našem pracovišti pozorujeme mírný klesající trend počtu nemocných indikovaných ke kardiochirurgickému výkonu (ať již CABG nebo výkonu na chlopních či kombinovanému výkonu) ze 17 % v roce 2009 na 14 % v roce 2013 ze všech katetrizovaných osob.
Počet nemocných po CABG katetrizovaných na našem pracovišti činí okolo 6,5 %, počet intervencí u těchto nemocných postupně narůstá, až na současných 7,8 % všech prováděných intervencí, resp. 42,5 % katetrizovaných nemocných po předchozím CABG. Přibližně 30 % z těchto intervencí činí zákroky na bypassech. Jen velmi málo nemocných je indikováno k reoperacím (nejsou zahrnuty případy, v nichž je indikací k reoperaci postižení chlopně) (tab).
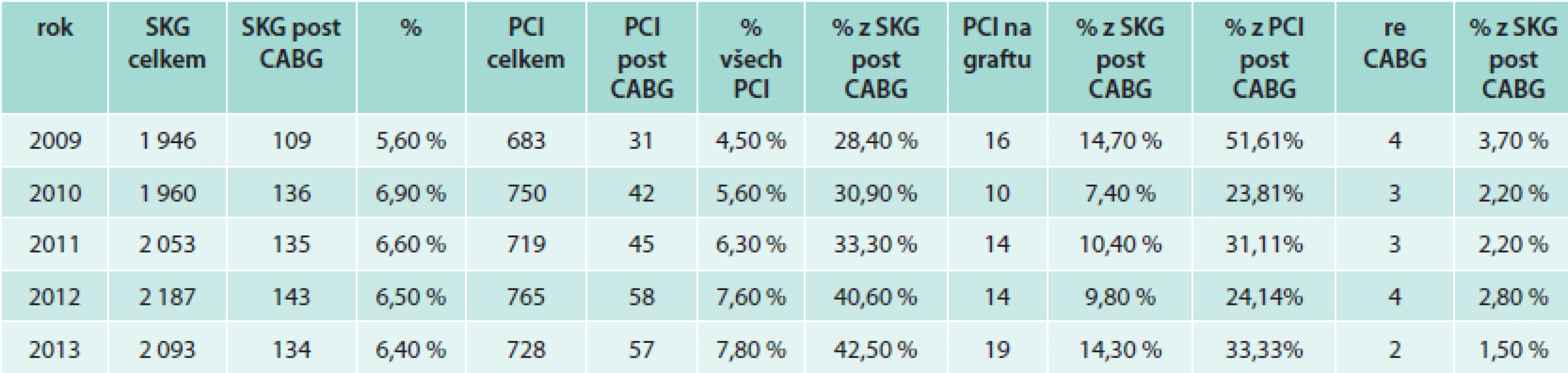
Z uvedeného přehledu vyplývá, že častěji se intervenční kardiolog pouští do revaskularizace postižené nativní tepny než do výkonu na zdegenerovaném bypassu. Mnohdy však nezbývá, než se pokusit o krkolomné výkony.
Kazuistika
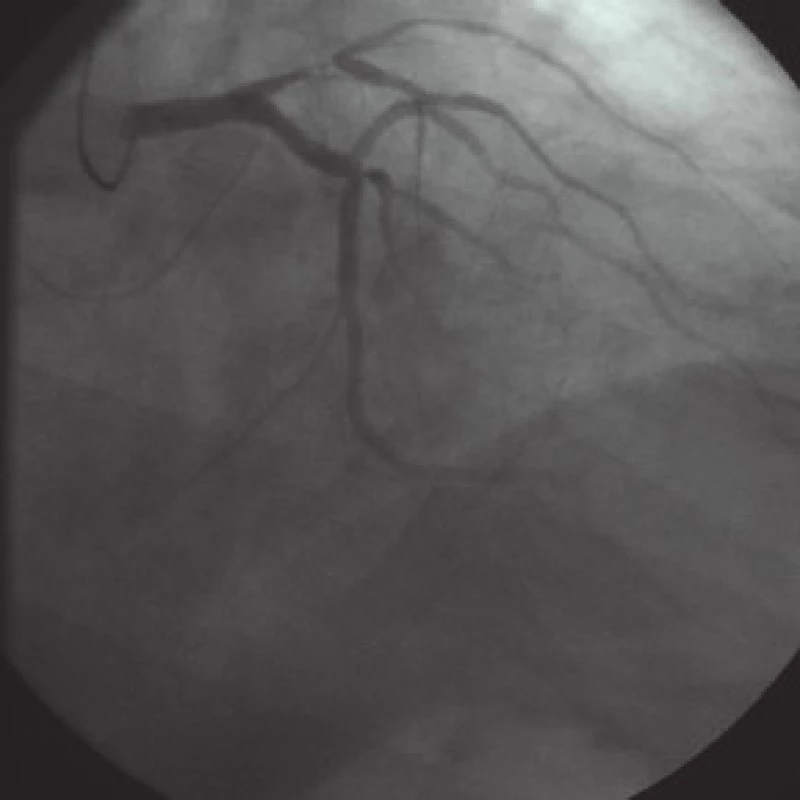
V únoru roku 2009 je na naše pracoviště referován ke koronarografii tehdy 73letý muž z indikace angina pectoris II.–III. st. dle CCS klasifikace. Z rizikových faktorů je přítomna dobře kontrolovaná hypertenzní nemoc a hypercholesterolemie, nemocný má v anamnéze chronickou autoimunitní hepatitidu bez zásadních alterací aminotransferáz. Při koronarografii byla zjištěna nemoc 3 tepen: subtotální stenóza proximálního segmentu r. interventricularis anterior (RIA) až k bifurkaci s první diagonální větví (RD1), 90% odstupová stenóza druhé marginální větve (RMS2), excentrický až 80% plát v proximální části pravé koronární tepny (ACD) a 40% stenóza střední části ACD. Funkce levé komory byla dobrá (EF LK 65 %). Nemocný byl se závěrem „nemoc 3 tepen“ indikován k chirurgické revaskularizaci a na společném indikačním semináři akceptován s návrhem 3–4násobného bypassu (RIA, RD, RMS2, ACD) (obr. 1).
V březnu roku 2009 pacient podstoupil operaci, při níž byly revaskularizovány pouze RIA pomocí a. mammaria interna sin. (LIMA) a ACD žilním štěpem (SVG). RD1 i RMS2 zůstaly bez bypassu. Operace proběhla bez komplikací a nemocný se vrátil do normálního života.
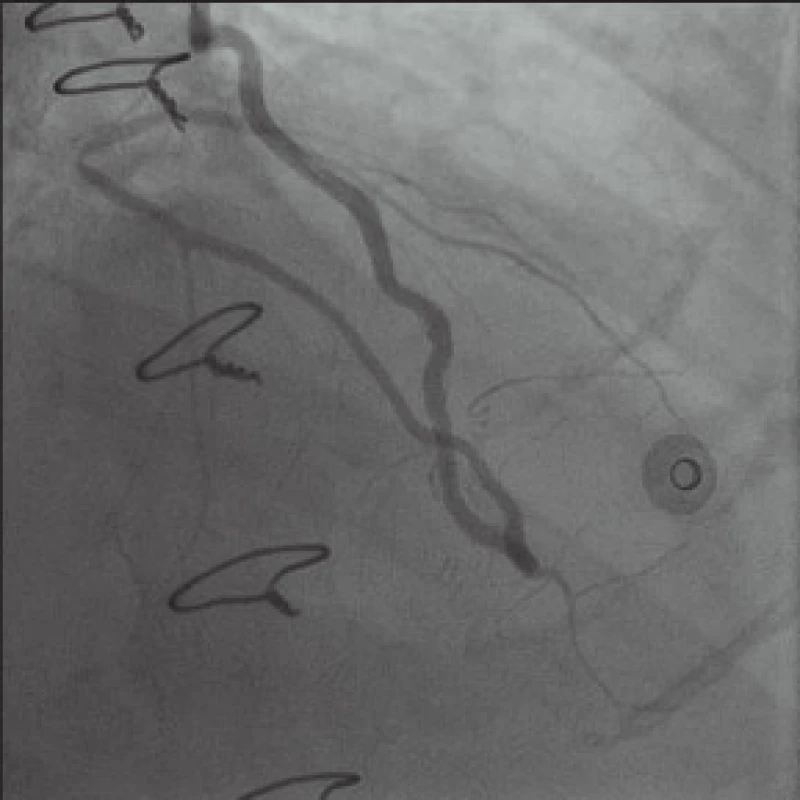
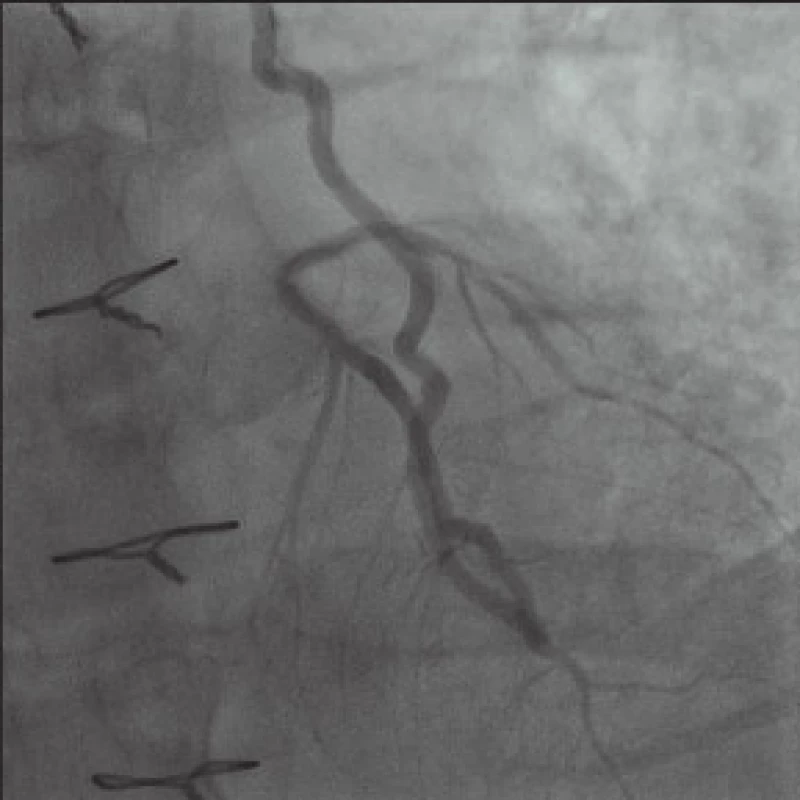
Téměř 4 roky žil muž poměrně výrazně aktivním životem se spoustou koníčků bez výraznějších problémů. V polovině prosince roku 2012 byl odeslán k hospitalizaci do spádové nemocnice pro nově vzniklé námahové bolesti a dušnost. S diagnózou „nestabilní angina pectoris“ byl 21. prosince 2012 katetrizován cestou levé a. radialis (v té době naše pracoviště rutinně katetrizovalo transradiálním přístupem – více než 90 % katetrizací; levá radiální tepna byla zvolna z důvodu přítomnosti tepenného bypassu pomocí LIMA). Zjistili jsme kompletní uzávěr RIA již v odstupu kmene, RIA se plní cestou LIMA prográdně i retrográdně a přes 80–90% stenózu bifurkace RIA-RD1 se retrográdní cestou přes RIA plní i poměrně velký nerevaskularizovaný RD. Nález na odstupu RMS2 je stacionární, hodnotíme jej jako 80% stenózu, nález na proximální části ACD je méně významný než před operací (hodnotíme jej jako 50% stenózu), přičemž periferie ACD se dobře plní průchozím žilním bypassem našitým na r. interventricularis posterior (RIVP). Vzhledem k progresi nálezu na RIA-RD1, stacionárním nálezům na ostatních tepnách i bezvadně fungujícím bypassům jsme usoudili, že příčinou potíží nemocného je stenóza na bifurkaci RIA-RD1 (obr. 2).
Vzhledem k tomu, že prográdní rekanalizace uzávěru proximální RIA nebyla možná, indikovali jsme v prvním kroku konzervativní postup s maximalizací antianginózní léčby. Avšak sami jsme příliš nevěřili v její účinnost. Proto jsme zvažovali i jiné alternativy. Jednou z nich byla reoperace, jejíž přínos (jediný bypass na RD) by významně zaostával za rizikem (reoperace jako taková, riziko poškození LIMA při resternotomii). Druhou variantou byl pokus o PCI na bifurkaci retrográdní cestou přes LIMA a RIA. Vzhledem k délce LIMA a retrográdního úseku RIA zde však byl zjevný nepoměr v délce standardního vodícího (guiding) katétru (100 cm) ať již z levého radiálního nebo transfemorálního přístupu a standardní délkou shaftu balonkového katétru (130–140 cm). Bylo potřeba zajistit takový materiál, aby rozdíl délek byl větší.
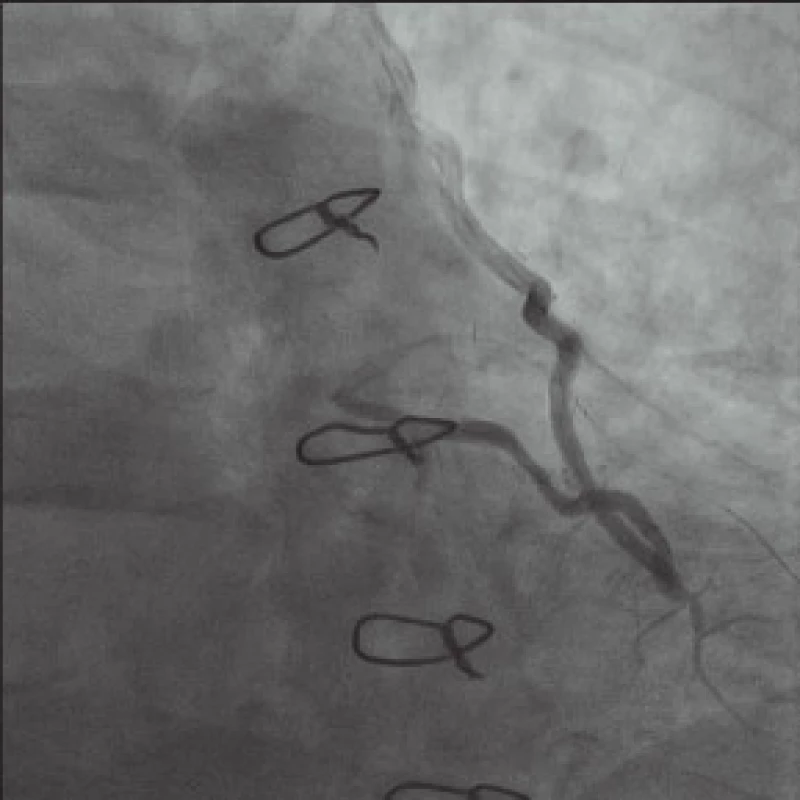
Čas dal za pravdu našim obavám. Ani ne za 2 měsíce, 12. února 2013, téměř na den přesně 4 roky po své první koronarografii, přichází nemocný k další koronarografii s tím, že potíže nepolevují, naopak mají tendenci se zhoršovat. Tato koronarografie je provedena plánovaně s dostatečným časovým prostorem pro předpokládaný relativně obtížný výkon. Máme k dispozici o 10 cm kratší, 90 cm vodící katétr Cordis Vista IM, 6 F (Johnson&Johnson), pomocí kterého opět cestou levé a. radialis sondujeme ústí LIMA z levé a. subclavia a cestou LIMA opatrně zavádíme 300 cm dlouhý hydrofilní velmi flexibilní, lehký 0,014“ koronární vodič HI-TORQUE WHISPER LS (Abbott Vascular). V distální anastomóze se daří po poměrně krátkém úsilí nasměrovat vodič do RIA retrográdním směrem. S minimálním tlakem na koronární vodič využívajíce spíše rotace doprava a doleva a pulzních pohybů srdce postupujeme až ke kritické bifurkaci RIA-RD1. I zde se daří proniknout vodičem do RD1, opět dochází k úhlové změně potřebného vektoru dopředné síly, takže stejným postupem jako před chvílí zavádíme vodič až do periferie RD1 (obr. 3).
Opatrně s vědomím rizika poškození LIMA s potenciálně vážnými následky zavádíme do místa stenózy velmi flexibilní balon s velmi dobrým entry profilem a hydrofilním krytím (zlepšení pushability) a 140 cm dlouhým shaftem Sapphire II 2,5 × 12 mm (Orbus Neich). Průnik balónu do místa stenózy je překvapivě snadný. Opakovaná prolongovaná dilatace bifurkace RIA-RD1 má velmi dobrý efekt (obr. 4 a 5).
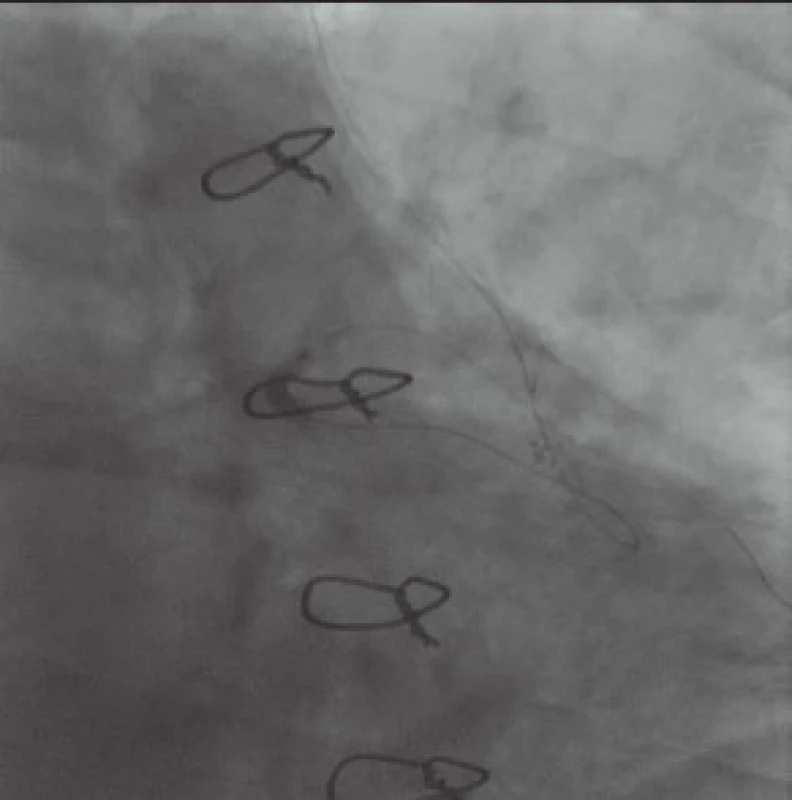
Pokoušíme se i o zavedení koronárního stentu. Nedostatečná dopředná síla (není k dispozici koronární stent s OTW delivery systémem) neumožňuje zavedení stentu dále než do střední části RIA (obr. 6). Z obavy před poškozením LIMA nepřiměřeným násilím na shaft stentu od dalšího snažení ustupujeme a stent opatrně stahujeme zpět. Přes všechnu opatrnost se drobné disekce krátce za odstupem LIMA z levé a. subclavia nevyhneme, avšak rozhodujeme se ji neintervenovat a ponechat ke spontánnímu zhojení při duální antiagregační léčbě. Tato strategie se ukázala jako správná a při plánované kontrole za měsíc, 13. března 2013, je tato zcela zhojena a dilatovaná bifurkace RIA-RD má setrvalý optimální efekt.
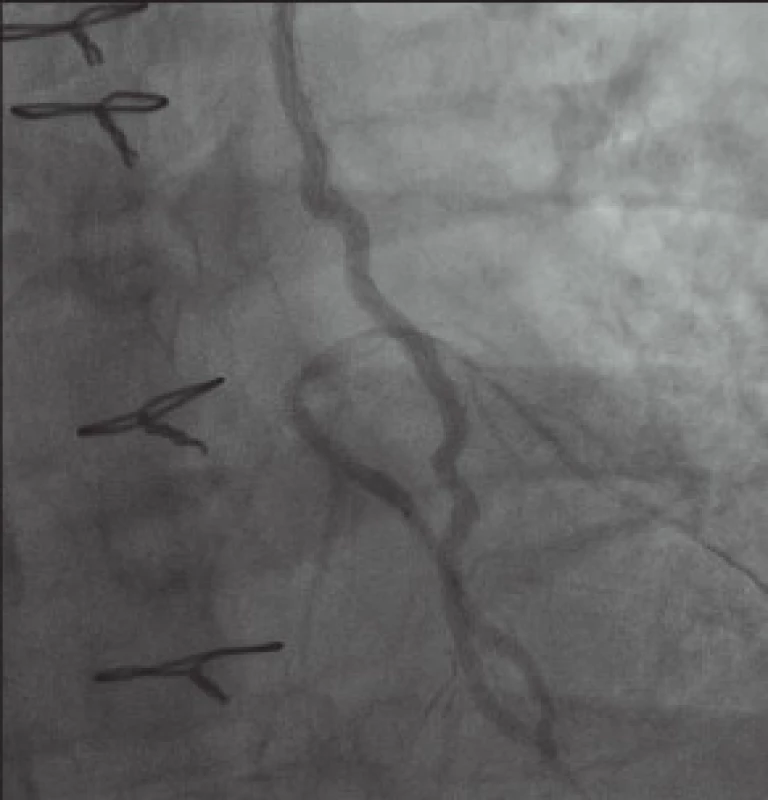
Po provedené intervenci potíže nemocného ustoupily a v současné době udává anginózní potíže jen při výraznější fyzické zátěži.
Závěr
Zvyšující se počet přežívajících pacientů po provedeném CABG vede k nárůstu počtu těchto nemocných i v katetrizačních laboratořích. V důsledku prodlouženého života operovaných kardiaků se setkáváme s větším množstvím postižených nebo zcela uzavřených bypassů. Ve většině případů přistupujeme ke katetrizační intervenci než k indikaci reoperace. Převážnou část intervencí tvoří PCI na nativních tepnách. Někdy je však nutné využít jako přístupové cesty právě funkčního bypassu, jako tomu bylo v popisovaném případu.
Popisovaný případ byl prezentován jako kazuistika na 2nd Advanced International Masterclass AimRADIAL2013 konaném v září roku 2013 v New Yorku, USA.
prim. MUDr. Zdeněk Coufal
coufal@bnzlin.cz
Kardiovaskulární centrum pro dospělé, Interní klinika IPVZ Praha a Krajské nemocnice T. Bati, a.s., Zlín
www.kntb.cz
Doručeno do redakce: 3. 2. 2014
Sources
1. Endo M. The history and evolution of coronary artery bypass grafting. Nihon Geka Gakkai Zasshi 2000; 101(12): 827–832.
2. Tošovský J. První aortokoronární bypass v Československu. Medical Tribune CZ 2010; 24: NS1. Dostupné z WWW: <http://www.tribune.cz/clanek/19702-prvni-aortokoronarni-bypass-v-ceskoslovensku>.
3. King SB. Angioplasty From Bench to Bedside to Bench. Circulation 1996; 93(9): 1621–1629.
4. Campeau L, Enjalbert M, Lespérance J et al. Atherosclerosis and late closure of aortocoronary saphenous vein grafts: sequential angiographic studies at 2 weeks, 1 year, 5 to 7 years, and 10 to 12 years after surgery. Circulation 1983; 68(3 Pt 2): II1-II7.
5. Goldman S, Zadina K, Moritz T et al. Long-term patency of saphenous vein and left internal mammary artery grafts after coronary artery bypass surgery: results from a Department of Veterans Affairs Cooperative Study. J Am Coll Cardiol 2004; 44(11): 2149–2156.
6. Šetina M, Pirk J, Holub J et al. Přehled vybraných kardiochirurgických operací v České republice 2010. ÚZIS ČR, NKCHR: Praha 2012. ISBN 978–80–7280–976–9.
7. Želízko M, Vojáček J, Kala P et al. Přehled vybraných kardiovaskulárních intervencí v České republice 2011. ÚZIS ČR, NRKI: Praha 2013. ISBN 978–80–7472–033–8.
Labels
Diabetology Endocrinology Internal medicineArticle was published in
Internal Medicine

2014 Issue 4
-
All articles in this issue
- Prof. MUDr. Petr Widimský, DrSc., FESC, FACC šedesátiletý
- Vývoj klinického zájmu o plicní hypertenzi v České republice
- 30 let programu transplantace srdce v Institutu klinické a experimentální medicíny v Praze
- Medikamentózní léčba plicní arteriální hypertenze v roce 2014
- Neobvyklá intervence na nativní tepně u pacienta po aortokoronárním bypassu
- Optická koherentní tomografie, oddálená implantace stentu a přímá perkutánní koronární intervence u nemocných s infarktem myokardu a elevací ST segmentu
- Pečeň pri srdcovom zlyhávaní
- Mitrální stenóza
- Léčba srdečního selhání u diabetiků
- Vliv zkušenosti na výsledky katetrové implantace aortální chlopně v léčbě významné aortální stenózy
- Plně vstřebatelný lékový koronární stent: kde jsme v roce 2014?
- Význam stanovení galektinu 3 jako ukazatele myokardiální fibrózy v klinické kardiologii
- Místo chirurgické revaskularizace v léčbě akutního infarktu myokardu
- Operace Ebsteinovy anomálie v dospělém věku – naše zkušenosti
- Predklinické kardiovaskulárne ochorenia a tuhosť aorty
- Acute heart failure and cardiogenic shock – trends at the beginning of 21st century
- Může léčba hypertenze ovlivnit výskyt demence?
- Pravá komora pri ťažkej pľúcnej hypertenzii pri vrodených chybách srdca – odlišná a špecifická
- Srovnání amerických a evropských (českých) doporučení pro diagnostiku a léčbu chronického srdečního selhání
- Význam vulnerabilních aterosklerotických plátů a možnosti jejich detekce pomocí intravaskulární spektroskopie
- Katetrizační renální denervace v léčbě rezistentní hypertenze: realita nebo fikce?
- Praktické otázky léčby novými antitrombotiky
- Kombinační léčba hypertenze
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue
- Pečeň pri srdcovom zlyhávaní
- Pravá komora pri ťažkej pľúcnej hypertenzii pri vrodených chybách srdca – odlišná a špecifická
- Operace Ebsteinovy anomálie v dospělém věku – naše zkušenosti
- Mitrální stenóza
