Pohybová aktivita u pacientů s mikrovaskulárními komplikacemi diabetu
Physical activity in patients with microvascular complications of diabetes
Physical activity is often underestimated and little used in the treatment of diabetes. The fear of damage, especially in patients with diabetes complications is one of the reasons why it occurs. Physical activity plays an important role in prevention of the progression of peripheral neuropathy and its impact is primarily on the development of muscle strength and the ability to replace the function of nerve fibers damaged disabilities. Demonstrable effect on neuropathy is already recorded a few weeks of regular exercise, long-term programs then demonstrate the safety of occurrence of ulcers in compliance with basic foot care. Present autonomic neuropathy cannot predict response to cardiac respectively, heart rate and blood pressure. Due to other risks (silent ischemia, arrhythmia etc.), it is appropriate to stress test before a prescription of exercise programs. Monitoring of blood pressure, heart rate and blood glucose during the first hours of physical activity is necessary. In patients with autonomic neuropathy of the gastrointestinal tract may significantly affect the composition of the diet not only the ability of physical activity, but can also affect hypoglycaemia due to a slow carbohydrate absorption in these patients. Another risk in patients with autonomic neuropathy is orthostatic hypotension, which may potentiate antihypertensive drugs in „white coat“ hypertension. Prescription of patients with retinopathy depends on the form and degree of retinopathy. Only proliferative retinopathy can significantly reduce exercise prescription, and it is always necessary to consult with ophthalmologist. In patients with nephropathy is an important stage of renal insufficiency for prescription of physical activity. Prescription is then influenced by the degree of renal insufficiency in addition to the presence of other associated diseases (anemia, hypertension, osteopathy etc.). Physical activity is essential in patients on dialysis respectively. After renal transplantation as maintaining peripheral muscle and its functions not only improves the prognosis, but also improves the quality of life and self-sufficiency is maintained.
Keywords:
diabetes complications – dialysis – physical activity – nephropathy – neuropathy – retinopathy
Authors:
Martin Matoulek
Authors‘ workplace:
III. interní klinika 1. LF UK a VFN Praha, přednosta prof. MUDr. Štěpán Svačina, DrSc., MBA
Published in:
Vnitř Lék 2015; 61(4): 340-345
Category:
Reviews
Overview
Pohybová aktivita je v léčbě diabetu neprávem často podceňována a málo využívána. Jedním z důvodů, proč není v praxi často využívána, je obava z poškození, zvláště u pacientů s komplikacemi diabetu. Pohybová aktivita hraje důležitou roli v prevenci progrese periferní neuropatie a vliv má především na rozvoj svalové síly a schopností nahradit funkci poškozenou postižením nervových vláken. Prokazatelný efekt na neuropatii je zaznamenáván již po několika týdnech pravidelného cvičení, dlouhodobé programy pak prokazují bezpečnost z hlediska výskytů ulcerací při dodržování základní péči o dolní končetiny. Při přítomné autonomní neuropatii nelze předvídat reakci srdeční resp. tepové frekvence ani krevního tlaku. Vzhledem k dalším rizikům (němé ischemie apod) je vhodné provést před plánovanou preskripcí pohybové aktivity zátěžový test. Monitorování krevního tlaku, srdeční frekvence a glykemie v průběhu prvních hodin pohybové aktivity je samozřejmostí. U pacientů s autonomní neuropatií gastrointestinálního traktu může významně ovlivnit složení stravy nejen schopnost pohybové aktivity, ale může ovlivnit i vznik hypoglykemií vzhledem ke zpomalenému vstřebávání sacharidů u těchto pacientů. Dalším rizikem u pacientů s autonomní neuropatií je ortostatická hypotenze, která může být potencována antihypertenzivy při hypertenzi bílého pláště. Preskripce u pacientů s retinopatií záleží na formě a stupni retinopatie. Pouze proliferativní retinopatie může významně omezit preskripci pohybové aktivity a vždy je třeba konzultovat s očním lékařem. U pacientů s nefropatií je pro preskripci rozhodující stadium renální insuficience. Preskripce je pak ovlivněna kromě stupně renální insuficience přítomností dalších komorbidit. Pohybová aktivita je zásadní i u pacientů v dialyzačním programu resp. po transplantaci ledvin, protože zachování periferních svalů a jejích funkcí nejen, že zlepšuje prognózu, ale především zlepšuje kvalitu života a udržuje soběstačnost.
Klíčová slova:
dialýza – komplikace diabetu – nefropatie – neuropatie – pohybová aktivita – retinopatie
Úvod
Fyzická resp. pohybová aktivita je nejen u pacientů s diabetem pravděpodobně nejpodceňovanějším terapeutickým postupem. Přestože existuje nespočet důkazů o efektu pohybové aktivity na kompenzaci diabetu a o dalších efektech na přidružená onemocnění jako hypertenze, dyslipidemie apod, je stále v praxi relativně málo využívaná. Pouze asi 10–15 % dospělé populace tráví čas pohybovou aktivitou minimálně 2krát týdně, u populace nad 60 let je to hluboko pod 10 % [1]. U pacientů s diabetes mellitus (DM) bude číslo ještě o něco nižší a u pacientů s komplikacemi diabetu je velmi vzácné, když vykonávají řízenou pravidelnou fyzickou aktivitu. Jedním z důvodů je to, že existují obavy z poškození při nevhodně zvoleném typu pohybové aktivity a v přítomnosti specifických diabetických komplikací. Mnoho lékařů také nepředpokládá, že by pacienti s DM, nadváhou resp. obezitou a specifickými komplikacemi byli ochotni se pohybu ve svém volném čase věnovat s odkazem na jejich velmi nízkou komplianci k režimovým opatřením. Neuvědomují si však, že přestože pohybová aktivita bude mít sice jen malý vliv např. na snížení hmotnosti, na kompenzaci diabetu může mít vliv poměrně zásadní. Navíc především zlepšením zdatnosti nejvíce ovlivní svojí kardiovaskulární mortalitu. Pohybová aktivita je pro nás přirozená a často jen obava z následků pacienty od pohybu odrazuje, ačkoliv často připouštějí, že by ji rádi vyzkoušeli.
Na druhou stranu doporučení stran pohybové aktivity může být úspěšné pouze tehdy, bude-li se shodovat očekávání lékaře diabetologa resp. edukační sestry a pacienta, a zároveň budou-li doporučení podpořena daty evidence based medicine tak, aby jim pacient porozuměl. Jenom tak bude mít šanci si správně vybrat, zda naše doporučení dodrží.
Pohybová aktivita je často srovnávána s efekty různých antidiabetik, což je ale velkou chybou. Není pochyb, že cost/effective je pravděpodobně výhodnější v populaci podávání metforminu než nákladná modifikace životního stylu, ale pohybová aktivita má jednoznačně aditivní efekt k moderní antidiabetické léčbě. Navíc je zřejmé, že pohybová aktivita svými účinky zasahuje na více místech aterogeneze než většina dosud známých léků. V poslední době jsou zkoumány jako velmi nadějné myokiny, produkty svalové tkáně. Je třeba si i uvědomit, že pohybová aktivita kromě efektu na jednotlivé metabolické děje má nepochybně i vliv sociální a pravidelná pohybová aktivita je v mnoha studiích srovnatelná s moderními antidepresivy [2]. Nezanedbatelný efekt má i na zlepšení kompliance s dietou při pravidelné pohybové aktivitě.
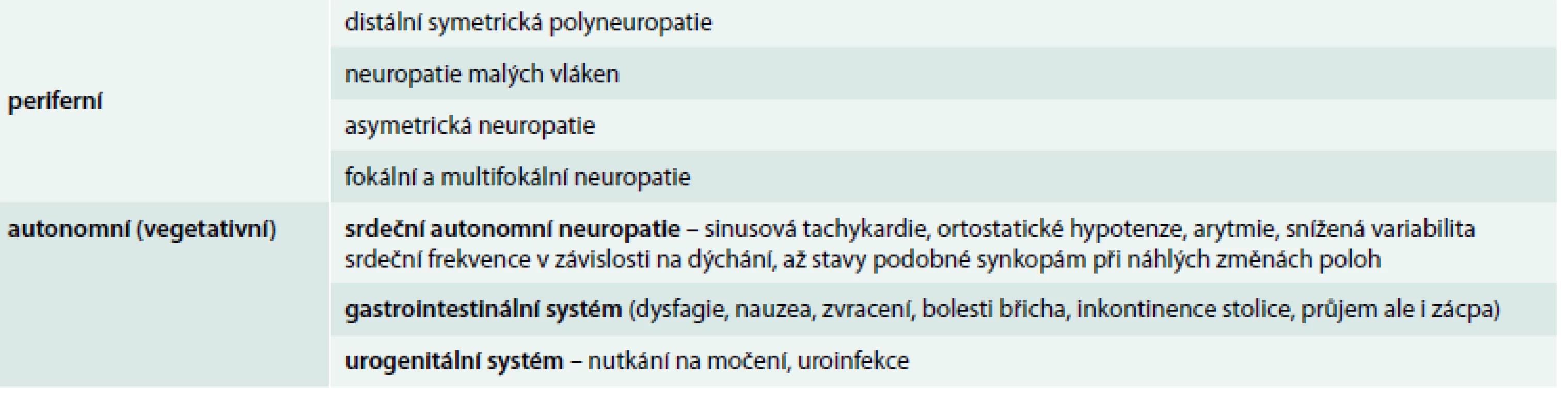
Periferní neuropatie
Diabetická neuropatie je charakterizována postupnou ztrátou funkcí nervových vláken především na dolních končetinách, ale může být přítomna i na horních končetinách. Hyperglykemie působí toxicky na nervová vlákna, dochází k jejich poškození a postupnému zániku a s tím související symptomatologií. Mezi hlavní projevy neuropatie patří bolestivost, ztráta senzorického čití a posléze i ztráta funkce. Diagnostika diabetické neuropatie je často založena na přítomnosti symptomů při diabetu a vyloučení jiných příčin. Až 50 % diabetiků má nějaké projevy resp. příznaky diabetické neuropatie. Zatímco u diabetiků 1. typu se např. distální neuropatie projevuje až po mnoha letech trvání diabetu, u diabetiků 2. typu se může neuropatie projevit již v prvních letech po stanovení diagnózy [3]. Velmi zjednodušeně můžeme neuropatii rozdělit na periferní a autonomní (tab. 1). Obecně lze konstatovat, že samotná fyzická aktivita nedokáže významně zlepšit projevy neuropatie, ale její role je především v prevenci a zpomalení její progrese. Mírná až středně intenzivní pohybová aktivita hraje zásadní roli v prevenci právě periferní neuropatie [4]. Na druhou stranu, např. poměrně krátká studie s kombinovanou pohybovou aktivitou (aerobní + posilovací, resp. odporový trénink) prokázala již po 10 týdnech zlepšení diabetické neuropatie a kožní citlivosti u diabetiků 2. typu s periferní diabetickou neuropatií [5]. Velmi důležité pro život je zachování svalové síly, pružnosti, což je nejlepší prevencí zranění z pádů. Periferní neuropatie se sníženou citlivostí je spojena se zvýšeným rizikem zranění v průběhu provozování pohybové aktivity. Největším rizikem a obavou u pacientů s diabetickou neuropatií je vznik defektů a ulcerací na dolních končetinách. Komplexní denní péče o nohy včetně každodenní prohlídky s detekcí bolestivých míst, otlaků event. drobných oděrek je nejlepší prevencí těchto závažných komplikací [6]. Kvalitní obuv, ale i ponožky jsou pro snížení rizika poškození při aktivním pohybu u diabetiků s neuropatií zcela zásadní. Riziko ulcerací je zvýšené při tzv. „weight-bearing“ cvičení, které je často doporučováno v prevenci osteoporózy. Je spojeno s působením hmotnosti těla ve směru gravitace, což je velmi prospěšné záště u seniorů, ale může být také rizikové při vzniku otlaků event. ulcerací při nevhodné obuvi. 12měsíční program založený na „weight-bearing“ aktivitách – kombinace chůze na běhátku, balančních cvičení a posilování dolních končetin s vlastní váhou (nikoliv se zátěží) u pacientů s diabetem 2. typu nevedl ke zvýšenému počtu ulcerací a cvičení. Program byl dobře tolerován prakticky bez nežádoucích efektů [7].
Pacienti bez ulcerací a otlaků mohou cvičit středně zatížení na rozdíl u těch, kteří mají otevřené defekty na dolních končetinách. V těchto případech by mělo být cvičení zcela bez zatížení postižených končetin, a to ani gravitační silou (cvičení ve stoje). Pacienti s těžkou periferní neuropatií by měli vyloučit všechna cvičení se zatížením (weight-bearing aktivity) včetně chůze – tím sníží riziko vzniku diabetických ulcerací [8]. Periferní neuropatie je často spojena s poruchou stability, sníženou svalovou silou a schopnosti chůze, zvláště u těch, kteří mají nějaké ortopedické vady. Pacienti z obavy z pádů často pohybovou aktivitu vylučují zcela ze svého života. Je tedy zcela nezbytné vyloučit aktivity, při kterých hrozí riziko pádů nebo zranění. U těchto pacientů může být i chůze či stoj velmi obtížný, a proto zvláště zpočátku je třeba zahájit cvičení vsedě s nácvikem jednouchých, zpočátku spíše rehabilitačních cvičení.
Specifickou skupinou diabetiků jsou pacienti po amputaci dolních končetin. Cílená pohybová aktivita je spojena s významným efektem nejen na kardiovaskulární systém, ale i na psychiku, sociální reintegraci. S pravidelným tréninkem především na horních končetinách je třeba začít co nejdříve, ještě před vlastním provedením amputace, není-li dekompenzovaný diabetes resp. zánětlivý stav. Zvýšená svalová síla vlivem tréninku horních končetin usnadní následně rehabilitaci v prvních týdnech po amputaci. Zcela nezbytné pro provozování pohybové aktivity je dokonalé zhojení pahýlu. Preskripce pohybové aktivity u těchto pacientů patří do rukou zkušených rehabilitačních lékařů.
Autonomní neuropatie
Přítomnost závažnější srdeční autonomní neuropatie je spojena s nedobrou prognózou a předčasnou mortalitou [9]. Abnormality sympatického a parasympatického nervového systému jsou přítomny již mnohem dříve, než lze registrovat jejich projevy. Neuropatie je spojena s častějším výskytem němých infarktů myokardu, zvýšenou klidovou srdeční frekvencí, sníženou tepovou rezervou, ale i např. ortostatickou hypotenzí. Přítomnost autonomní resp. vegetativní neuropatie je důvodem intenzifikovat léčbu diabetu a maximálně udržovat dobrou kompenzaci. Pro podezření na vegetativní neuropatii může svědčit špatná kompenzace diabetu, hypertenze, periferní neuropatie, retinopatie – tyto nálezy mohou predikovat riziko srdeční autonomní neuropatie [10].
Přítomnost srdeční autonomní neuropatie zhoršuje toleranci zátěže resp. pohybové aktivity a současně i snižuje maximální srdeční, resp. tepovou frekvenci [11]. Typicky nižší návrat resp. pokles srdeční frekvence v tzv. recovery fázi po ukončení cvičení je spojen s vyšším rizikem kardiovaskulární mortality [12]. Středně intenzivní aerobní pohybové aktivity mohou zlepšit autonomní funkce a posunout rovnováhu zpět mezi sympatický a parasympatický systém u pacientů s i bez závažnější srdeční autonomní neuropatie [13]. Pravidelná pohybová aktivita obnovuje srdeční variabilitu.
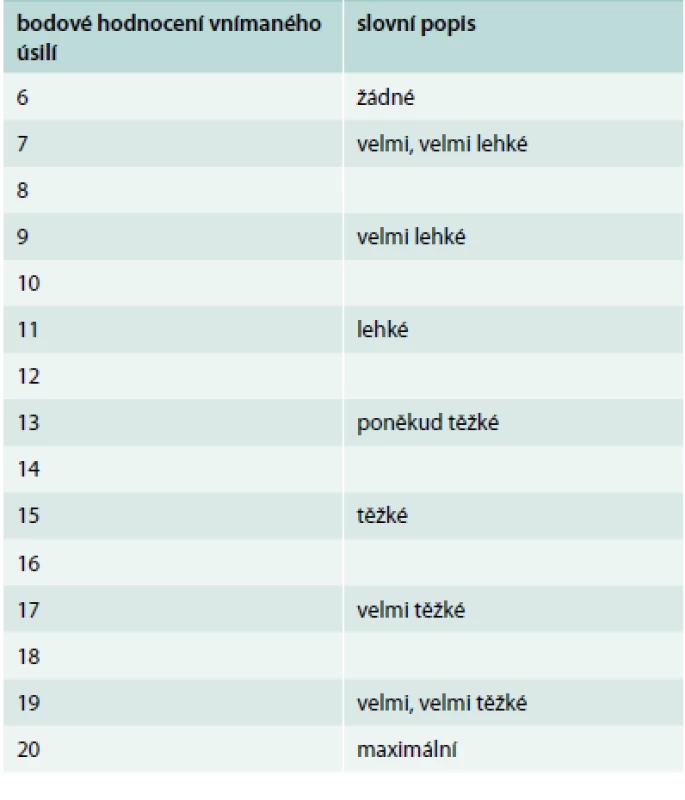
Pravidelná pohybová aktivita je doporučována tedy i v přítomnosti autonomní neuropatie. Zvýšené riziko němých ischemií, poruch srdečního rytmu, resp. nefyziologické zvýšení srdeční frekvence a neadekvátní zvýšení krevního tlaku by měly vést k doporučení provedení zátěžového testu – nejspíše bicykloergometrie před započetím pravidelné pohybové aktivity s určením bezpečné intenzity zátěže a následným doporučením nejen intenzity, ale i typu pohybové aktivity. Z hlediska typu zátěže je možný jak aerobní, tak odporový resp. silový trénink – nicméně spíše nižší intenzity, při kterém nedochází k významnému zvýšení krevního tlaku. Jsou-li přítomny projevy autonomní dysfunkce, je třeba se vyhnout náhlým změnám při pohybu, a to nejen poloh, ale i tempa, resp. intenzity. Je nezbytné klást důraz na delší dobu zahřívací fáze, stejně tak neukončovat cvičení náhle, ale pozvolna snižovat tempo a zátěž do úplného klidu. Zvláště po jízdě na stacionárním rotopedu po ukončení a pokusu o stoj může dojít k náhlému poklesu tlaku resp. ortostatické hypotenzi, která může být dána nejen autonomní neuropatií, ale často i příliš vysokým počtem antihypertenziv při zvýrazněné složce fenoménu bílého pláště u pacientů, u kterých jsou často cílové hodnoty krevního tlaku velmi nízké. U pacientů s autonomní neuropatií je lepší monitorovat intenzitu podle subjektivního vnímání než podle srdeční frekvence, neboť sledování srdeční, resp. tepové frekvence nemusí odpovídat zatížení a reakce není většinou fyziologická a predikovatelná. Borgova škála subjektivního vnímání zátěže (tab. 2) je pro sledování intenzity zátěže v praxi daleko lepší nejen u diabetiků, ale i např. u kardiaků či u pacientů užívajících léky ovlivňující srdeční frekvenci. Pro přesnější doporučení podle tepové frekvence bychom pak museli provádět zátěžový test se spotřebou kyslíku a určit maximální srdeční, resp. tepovou frekvenci, což je v praxi velmi nákladné a vzhledem k různým provozovaným aktivitám stejně dosti nepřesné pro preskripci. Užívání škály subjektivního vnímání je tedy považováno za vhodné [14]. Pohybová aktivita u pacientů s přítomnými projevy ortostatické hypotenze jako projevu autonomní neuropatie by měla být zpočátku doprovázena monitorováním odezvy na různé podněty včetně např. změn poloh, dlouhodobějšího stání apod. Přítomnost symptomů a projevů při řízených činnostech na počátku pohybových programů určuje další možnosti typu pohybové aktivity [15]. Dehydratace, která je u starších diabetiků častější, může zhoršit symptomatologii ortostatické hypotenze, proto je zvláště v letních měsících třeba dbát na dostatek tekutin nejen před, ale event. i v průběhu pohybových aktivit.
Přítomnost symptomatologie neuropatie v oblasti gastrointestinálního traktu, od poruchy evakuace žaludku až po gastroparézu, může velmi ztěžovat provozování pohybové aktivity. Ukazuje se, že až 40 % diabetiků 1. typu a asi 30 % diabetiků 2. typu má manifestní projevy neuropatie GIT. Symptomatologie může být velmi nespecifická, od nauzey, zvracení, přes rychlý pocit nasycení, nadýmání, bolest střev, diskomfort či nespecifické bolesti břicha. Jak farmakoterapie, tak především výběr potravin v průběhu pohybové aktivity mohou symptomatologii snižovat [16]. Zásadní je vyvarovat se před cvičením větších jídel a velmi pozvolna zvyšovat intenzitu zátěže. Posilování může symptomatologii zhoršovat, nicméně většinou je třeba různé aktivity vyzkoušet. V přítomnosti těžších poruch autonomního nervového systému je třeba myslet na to, že vstřebávání sacharidů je zhoršené a pacient je ohrožen těžšími hypoglykemiemi, proto je zcela nezbytné mít u sebe rychle vstřebatelné sacharidy (glukózu) a použít ji raději dříve. Důsledná prevence hypoglykemií je zcela na místě, protože zvláště u pacientů s diabetem 1. typu je autonomní neuropatií snížena i katecholaminová odezva na hypoglykemii způsobenou cvičením [17].
Retinopatie
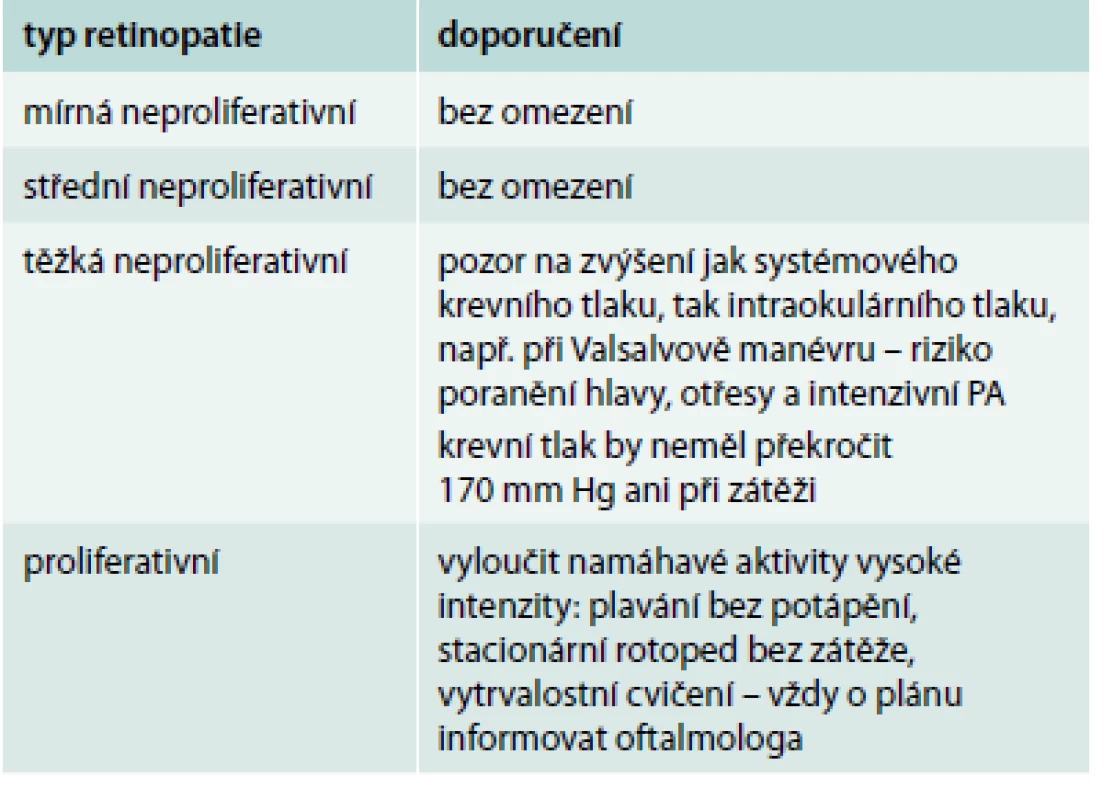
Retinopatie je nejčastější příčinou slepoty u pacientů s diabetem 1. i 2. typu. Proliferativní retinopatie kromě slepoty je spojena s vyšším rizikem kardiovaskulární mortality [18]. Přítomnost očních komplikací může, ale nemusí znamenat významnější omezení pohybové aktivity. Velmi záleží na typu a stupni retinopatie. Prevencí rozvoje retinopatie je těsná kompenzace diabetu, ale i minimální zvyšování krevního tlaku během cvičení. Zvláště na začátku je během pohybové aktivity nezbytné monitorování nejen glykemie, ale i krevního tlaku. U proliferativní retinopatie, která je v některých doporučeních uváděna jako absolutní kontraindikace cvičení, resp. pohybové aktivity, by se k plánovaným pohybovým aktivitám měl vždy vyjádřit oční lékař. Základní rozdělení retinopatií s doporučením pohybové aktivity uvádí přehledně tab. 3.
Nefropatie
Nefropatie je jednou z nejčastějších komplikací přítomných u diabetiků 1. i 2. typu. Odhaduje se, že přibližně u 30 % diabetiků jsou nefropatie a s ní spojené komplikace hlavní příčinou úmrtí [19]. Postižení ledvin, středně těžkou až těžkou renální insuficienci lze nalézt u 20–30 % diabetiků 2. typu [20]. Mikroalbuminurie je nejčasnější nález počínajícího postižení ledvin. Ačkoliv je známé, že akutní zátěž vede u pacientů s diabetem k přechodnému zvýšení mikroalbuminurie, resp. ke zvýšené koncentraci albuminu v moči a fyziologickým hodnotám albuminu v moči, neexistují žádné důkazy, že by fyzická aktivita zhoršovala renální funkce [21]. Přítomnost mikroalbuminurie tak nemusí znamenat nutně omezení fyzické aktivity. Přítomnost mikroalbuminurie však může předznamenat postižení malých cév, a proto je zcela nezbytné před plánovanou pohybovou aktivitu provést zátěžový test k vyloučení přítomnosti ischemické choroby srdeční, která se dosud nemusela projevit. Protože většina diabetiků má současně i hypertenzi a dyslipidemii, je zátěžový test jistě plně indikován nejen vzhledem k potenciální přítomnosti ischemické choroby srdeční, ale i k posouzení odezvy srdeční resp. tepové frekvence a krevního tlaku na zátěž, což může modifikovat naše další doporučení [22]. Doporučované aktivity jsou jednak aerobního charakteru, jednak kombinace aerobního a silového či odporového tréninku zlepšují nejen funkční stav, ale především kvalitu života těchto pacientů. Odporový trénink je zvláště efektivní u pacientů s těžší renální insuficiencí, u nichž zvýšení svalové síly pomáhá udržovat soběstačnost v denních činnostech, což bývá velmi zhoršené v konečných stadiích renální insuficience [23]. Intenzita pohybové aktivity je velmi důležitá u pacientů s postižením ledvin, protože zvyšování krevního tlaku jako odpověď na zátěž bývá zvláště na začátku nelineární. Prevence dalšího postižení ledvin je dobrá kontrola krevního tlaku bez výrazného zvýšení v průběhu pohybové aktivity.
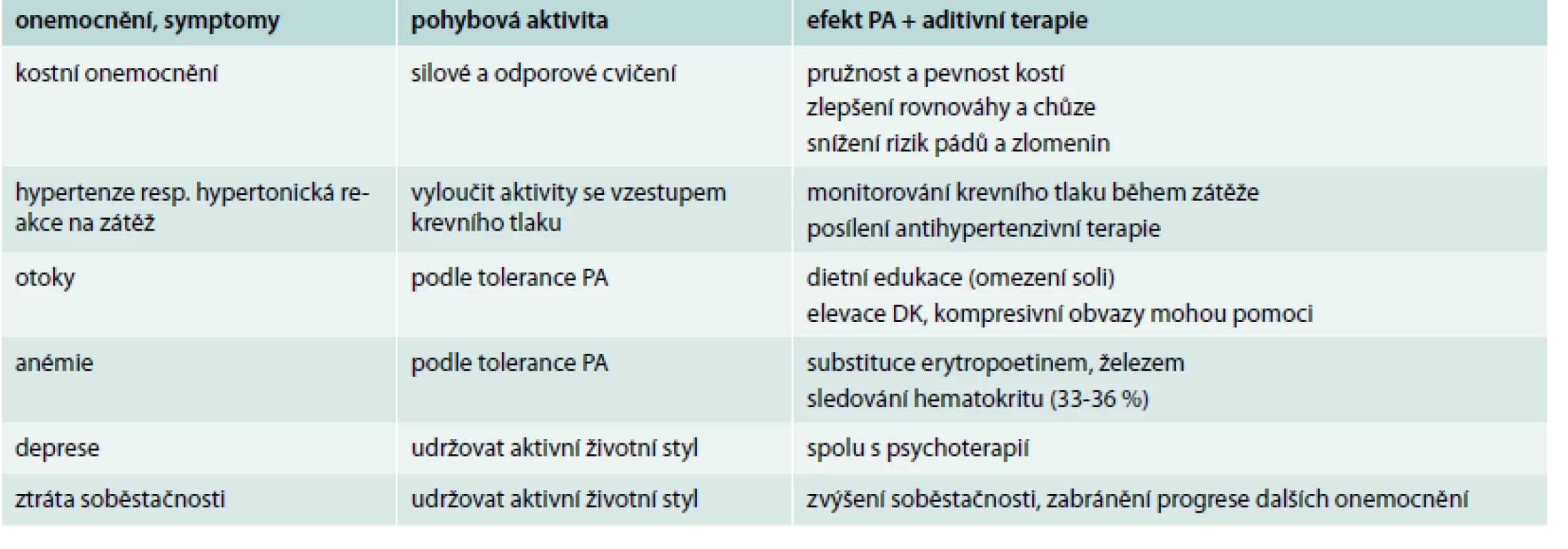
Při přítomnosti závažnější nefropatie (těžší formy renální insuficience) je třeba brát v potaz i další asociovaná onemocnění a symptomy, které ovlivňují preskripci provozování pohybové aktivity. Podrobnější orientační přehled poskytuje tab. 4. Velký důraz u počínajících stadií renální insuficience je třeba klást na prevenci dehydratace, která může zvláště v letních měsících zhoršit renální insuficienci až progredovat do renálního selhání. Časté poruchy koncentrační schopnosti ledvin mohou při nedostatečné substituci minerály vést až k minerálovému rozvratu s hyponatremií, hypochloremií, hypokalemií a hypotenzí. Stává se to hlavně v letních měsících, kdy je velmi často doporučováno pití čisté vody, a zákaz minerálek může k tomuto rozvoji přispět. U těžších forem renální insuficience v predialyzačním období činí největší problém nutnost restrikce bílkovin, protože k obnově svalové tkáně je kvalitní bílkovina potřeba. Preskripce diet u pacientů s pokročilou renální insuficiencí, zvláště je-li přítomna obezita a dyslipidemie, patří do rukou zkušených nutričních terapeutů. Vždy je třeba si uvědomit, že tito pacienti jsou ohroženi vysokým rizikem hypoglykemie z mnoha důvodů. Inzulin i inkretinová analoga jsou při těžších renálních insuficiencích eliminovány pomaleji než u pacientů s normální funkcí ledvin [24]. Nejen tedy automatická úprava antidiabetik, ale především monitorování odezvy glykemie na pohybovou aktivitu je nezbytné. Tato skupina pacientů je asi pro preskripci pohybu a diet nejsložitější.
Naopak pokud jsou pacienti již v dialyzačním programu, již není potřeba tak významná restrikce bílkovin, ale zůstává poměrně velký problém s pitným režimem. Existují pracoviště, na nichž probíhá pohybová aktivita dolních končetin v průběhu dialýzy, ale většinou zvláště zpočátku bývá 1. den po dialýze díky velkým změnám v kompartmentech tekutin poměrně náročný. Naopak 2. den po dialýze se jeví jako optimální pro pohybový program, ve 3. dnu, kdy dochází k vzestupu uremie, kreatinemie a kalemie, již bývá pohybová aktivita náročnější a není již příliš vhodná. Doporučení pohybové aktivity začíná u aerobního tréninku, ale vhodný je i silový nebo odporový trénink s extrémním důrazem na ochranu dialyzačního portu.
Samostatnou skupinu tvoří pacienti po transplantaci ledvin. S pohybovou aktivitou mohou obvykle začít až 8 týdnů po transplantaci, pokud nejsou přítomny známky rejekce nebo jiné komplikace. Je třeba si uvědomit, že zvláště zpočátku je nezbytné vyhnout se velké námaze a zátěž plánovat velmi postupně. Velmi důležitá je dostatečná hydratace, a pokud vše probíhá bez komplikací, nemusí být plánovaná pohybová aktivita omezována. Mírně nevhodné a rizikové jsou kontaktní sporty, které se vesměs nedoporučují.
Preskripce pohybové aktivity u pacientů s těžší formou renálního selhání je ovlivňována i dalšími onemocněními, která jsou přítomna. Nicméně zachování periferních svalů velkých svalových skupin je základním předpokladem nejen pro zlepšení prognózy nemocného, ale především pro kvalitu životu, soběstačnost a jeho psychiku. Je velmi složité postupně vybudovat sval, který byl ztracen pohybovou inaktivitou, ale je poměrně nenáročné ho udržet v činnosti, dokud je funkční. Důraz na pohybovou aktivitu je tedy třeba klást hned od počátku stanovení diagnózy diabetu, protože pohybová aktivita má nesčetně důkazů efektu nejen v léčbě, ale především v prevenci komplikací a při dodržení základních zásad preskripce má jen minimální nebo žádné nežádoucí účinky.
Doporučené pohybové aktivity u pacientů s pokročilou formou renální insuficience, v dialyzačním programu a po transplantaci:
- zpočátku aerobní aktivita o nízké intenzitě a kratším trvání, např. 5–10 min s postupným prodlužováním času
- zvyšování intenzity – např. rychlosti chůze, plavání, jízdy na kole nebo lépe na stacionárním rotopedu, ale i odporový trénink ke zvýšení svalové síly
- v průběhu dialýzy může být zařazován mírně nebo středně intenzivní trénink podle schopnosti spolupráce a tolerance
- po transplantaci ledvin lze zahájit po 6–8 týdnech, pokud nejsou přítomny známky rejekce ledvin nebo jiné komplikace
MUDr. Martin Matoulek, Ph.D.
mmato@vstj.cz
III. interní klinika 1. LF UK a VFN, Praha
www.vfn.cz
Doručeno do redakce 26. 2. 2015
Přijato po recenzi 13. 3. 2015
Sources
1. Matoulek M, Svačina Š, Lajka J. Výskyt obezity a jejích komplikací v České republice. Vnitř Lék 2010; 56(10): 1019–1027.
2. Chalder M, Wiles NJ, Campbell J et al. Facilitated physical activity as a treatment for depressed adults: randomised controlled trial. BMJ 2012; 344: e2758. Dostupné z DOI: <http://doi: 10.1136/bmj.e2758>.
3. Caselini CM, Vinik AI. Clinical manifestation and current treatment options for diabetic neuropathies. Endocr Pract 2007; 13(5): 550–566.
4. Balducci S, Iacobellis G, Parisi L et al. Exercise training can midify the natural history of diabetic peripheral neuropathy. J Diabetes Complications 2006; 20(4): 216–223.
5. Kludding PM, Pasnoor M, Singh R et al. The effect of exercise on neuropathic symptoms, nerve function, and cutaneous innervation in people with diabetic peripheral neuropathy. J Diabetes Complications 2012; 26(5): 424–429.
6. Singh N, Armstrong DG, Lipsky BA. Preventing foot ulcers in patients with diabetes. JAMA 2005; 293(2): 217–228.
7. Tuttle LJ, HastingsMK, Mueller MJ. A moderate-intensity weight-bearing exercise program for a person with type 2 diabetes and peripheral neuropathy. Phys Ther 2012; 92(1); 133–141.
8. Lemaster JW, Muller MJ, Reiber GE et al. Effect of weight-bearing activity on foot ulcer incidence in people with diabetic peripheral neuropathy: feet first randomized controlled trial. Phys Ther 2008; 88(11): 1385–1398.
9. Vinik AI, Ziegler D. Diabetic cardiovascular autonomic neuropathy. Circulation 2007; 115(3): 387–397.
10. Witte D, Tesfaye S, Chaturvedi N et al. Eurodiab Prospective Complications Study Group: Risk Factors for cardiac autonomic neuropathy in type 1 diabetes mellitus. Diabetologia 2005; 48(1): 164–171.
11. Kahn JK, Zola B, Juni J et al. Decreased exercise heart rate and blood pressure response in diabetic subjects with cardiac autonomic neuropathy. Diabetes Care 1986; 9(4): 389–394.
12. Cheng YJ, Lauer MS, Earnest CP et al. Heart rate recovery following maximal exercise intensity in diabetic autonomic neruopathy. Diabetes Care 2003; 26(7): 2052–2057.
13. Loimaala A, Huikuri HV, Koobi T et al. Exercise training amproves baroreflex sensitivity in type 2 diabetes. Diabetes 2003; 52(7): 1837–1842.
14. Colberg SR, Swain DP, Vinik AI. Use of heart rate reserve and rating of perceived exertion to prescribe exercise intensity in diabetic autonomic neuropathy. Diabetes Care 2003; 26(4): 986–990.
15. Figuoeroa A, Basford JR, Low PA. Preventing and treating orthostatic hypotension: as easy as A, B, C. Cleve Clin J Med 2010; 77(5): 298–306.
16. Parkman HP, Fass R, Foxx-Orenstein AE. Treatment of patients with diabetic gastroparesis. Gastroenterol Hepatol (NY) 2010; 6(6): 1–16.
17. Meyer C, Grossman R, MItrakou A et al. Effects of autonomic neuropathy on counterregulation an awarness of hypoglycemia in type 1 diabetic patients. Diabetes Care 1998; 21(11): 1960–1966.
18. Juutilainen A, Lehto S, Ronnemaa T et al. Retinopathy predicts cardiovasular mortality in type 2 diabetic men and women. Diabetes Care 2007; 30(2): 292–297.
19. Coccheri S. Approaches to prevention of cardiovascular complications and events in diabetes mellitus. Drugs 2007; 67(7): 917–1026.
20. Koro CE, Lee BH, Bowlin SJ. Antidiabetic medication use and prevalence of chronic kidney disease among patients with type 2 diabetes mellitus in the United States. Clin Ther 2009; 31(11): 2608–2617.
21. Koh KH, Dayanath B, Doery JC et al. Effect of exercise on albuminuria in people with diabetes. Nephrology (Carlton) 2011; 16(8): 704–711.
22. Colberg SR, Sigal RJ, Fernhall B et al. The American College of Sports Medicine and the American Diabetes Association: joint position statement executive summary. Diabetes Care 2010; 33(12): 2692–2696.
23. Johansen KL. Exercise and chronic kidney disease: current recommendations. Sports Med 2005; 35(6): 485–499.
24. Inzucchi SE, Bergenstal RM, Buse JB et al. Management of hypergylcaemia in type 2 diabetes : a patient-centered approach. Position statement of the American Diabetes Association (ADA) and European association for the Study od Diabetes (EASD). Diabetologia 2012; 55(6): 1577–1596.
Labels
Diabetology Endocrinology Internal medicineArticle was published in
Internal Medicine

2015 Issue 4
-
All articles in this issue
- Biosimilární inzuliny – nové možnosti v léčbě diabetu
- Léčba diabetu u pacientů s onemocněním jater a ledvin
- Možnosti terapie agonisty receptoru pro GLP1 u diabetiků s nefropatií
- Léčba agonisty receptoru pro GLP1 a kontrola hmotnosti
- Léčba diabetu u osob vyššího věku
- Problematika infekce při syndromu diabetické nohy
- Léčba hypertenze u diabetes mellitus
- Pohybová aktivita u pacientů s mikrovaskulárními komplikacemi diabetu
- Glykace proteinů oční čočky u diabetiků a její neinvazivní měření – první zkušenosti v České republice
- miRNA-192, miRNA-21 a miRNA-200: nové markery karcinomu pankreatu u diabetiků?
- Pokroky ve vývoji inzulinových pump a jejich pokročilých automatických funkcí
- Mikrobiální flóra trávicího traktu a diabetes
- Myokiny – hormony svalové tkáně
- Postavení nových antidiabetik v klinické praxi: SGLT2 vs DPP4 inhibitory
-
Volí diabetologové terapii racionálně?
Základní výsledky projektu PROROK (Prospektivní observační projekt významu diference glykemie nalačno a postprandiální glykemie pro odhad úspěšnosti terapie diabetu 2. typu)
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue
- Myokiny – hormony svalové tkáně
- Léčba diabetu u pacientů s onemocněním jater a ledvin
- Léčba agonisty receptoru pro GLP1 a kontrola hmotnosti
- Léčba hypertenze u diabetes mellitus
