Hemokoagulace – nové pohledy na starou kaskádu
Hemocoagulation – New views on the old cascade
The process of hemocoagulation can be generally divided into the following stages: initiation, amplification, propagation and stabilization of thrombus. The most important changes of the hemocoagulation scheme accepted so far concern the position and generally the existence of the coagulation system external and internal branches, the central role of a tissue factor in initiation of hemocoagulation and the newly understood roles of factors XI and XII. Newly an active role of monocytes, leukocytes, erythrocytes and endothelial cells and their receptors in hemocoagulation has been identified, as well as the role of circulating microparticles which transfer some agents and information. The changed scheme of hemocoagulation also reflects the emerging possibilities of anticoagulation with a more favourable proportion of anticoagulation properties to the risk of bleeding and thrombotic events. Over the long term it is increasingly evident that both the internal and external branches of the coagulation system are initially launched through release of an active tissue factor, formation of a complex of a tissue factor with factor VIIa and ensuing activation of factor X on Xa. At the same time the role of factor XII in the intrinsic coagulation system is questioned, its role has now been experimentally proven together with factor XI in propagation and with factor XIII in the final strengthening of thrombus and when seeking new antithrombotic drugs it might be just its blocking which could meet the requirement on high effectiveness with minimum bleeding complications.
Key words:
hemocoagulation – hemocoagulation cascade – microparticles – new antithrombotic drugs – tissue factor – internal branch of coagulation system – external branch of coagulation system
Authors:
Jan F. Vojáček
Authors‘ workplace:
I. interní kardioangiologická klinika LF UK a FN Hradec Králové, přednosta doc. MUDr. Josef Šťásek, CSc.
Published in:
Vnitř Lék 2015; 61(5): 475-479
Category:
Reviews
Overview
Průběh hemokoagulace můžeme všeobecně rozdělit do následujících fází: iniciace, amplifikace, propagace a stabilizace trombu. Nejzásadnější změny dosud akceptovaného schématu hemokoagulace se týkají postavení a vůbec existence zevní a vnitřní větve koagulačního sytému, centrální úlohy tkáňového faktoru v iniciaci hemokoagulaci a nově chápané úlohy faktorů XI a XII. Nově byla i rozpoznána aktivní úloha monocytů, leukocytů, erytrocytů a endoteliálních buněk a jejich receptorů v hemokoagulaci, stejně jako úloha cirkulujících mikropartikulí sloužících k přenosu některých působků a informací. Změněné schéma hemokoagulace reflektují i nově se objevující možnosti antikoagulace s výhodnějším poměrem antikoagulačních vlastností k riziku krvácení a trombotické příhody. Dlouhodobě je stále více zřetelné, že jak vnitřní, tak zevní větev koagulačního systému je prvotně spouštěna uvolněním aktivního tkáňového faktoru, vznikem komplexu tkáňového faktoru s faktorem VIIa a následnou aktivací faktoru X na Xa. Současně je zpochybňována úloha faktoru XII v iniciaci tzv. vnitřního koagulačního systému, jeho role byla nově experimentálně prokázána společně s faktorem XI při propagaci a s faktorem XIII při konečném zpevňování trombu a při hledání nových antitrombotik by právě jeho blokáda mohla splňovat požadavek vysoké účinnosti s minimem krvácivých komplikací.
Klíčová slova:
hemokoagulace – hemokagulační kaskáda – mikropartikule – nová antitrombotika – tkáňový faktor – vnitřní větev koagulačního systému – zevní větev koagulačního systému
Úvod
Poslední doba posunula významně naše chápání složitého a velmi komplexního pochodu koagulace, a to jak u kardiovaskulárních onemocnění, tak v širším kontextu hemokoagulace vůbec. Experimentální práce, vývoj nových antitrombotik a nový pohled na starší dogmata v poslední době postupně, ale poměrně zásadně měnil naše chápání základních pochodů hemokoagulace.
Trombóza v arteriálním či žilním řečišti je zodpovědná za více než polovinu všech úmrtí celosvětově a v poslední době jsme svědky produkce a klinického využití nových účinných antitrombotik a vývoj dále pokračuje. Firmám produkujícím nová antitrombotika nelze upřít zásluhu za nebývalou propagaci znalostí o trombóze a antitrombotické léčbě. Tato osvěta propagovaná řadou významných odborníků však zůstala omezena na základy nezbytné k racionálnímu použití nových antitrombotik. Vývoj základních patofyziologických a klinických poznatků však šel v poslední době mnohem dále a jejich přesné pochopení a uplatnění je nezbytné pro správné vedení antitrombotické léčby, které je náročné na teoretické znalosti i klinické zkušenosti a neodpouští chyby.
Izolace krve od ostatních tkání a zajištění její laminární cirkulace udržuje řada vzájemně propojených mechanizmů a dynamická rovnováha mezi cirkulací krve a zajištěním reparačních pochodů je přesně a křehce vybalancována ve velmi komplexním systému krevní koagulace a spontánních antikoagulačních a fibrinolytických mechanizmů.
Tyto pochody jsou postupně po mnoho desetiletí studovány pomocí klinického popisu a laboratorního zkoumání nemocných s deficiencí prokoagulačních a antikoagulačních faktorů (enzymů, proteinů), na pokusech na zvířeti, prostřednictvím in vitro stanovení, a v poslední době i na matematických počítačových modelech a s využitím specifických protilátek blokujících buďto jednotlivé faktory, nebo i s využitím reverzních blokátorů samotných těchto protilátek.
Nové pojetí hemokoagulační kaskády
Průběh hemokoagulace můžeme všeobecně rozdělit do následujících fází (obr. 1):
- iniciace
- amplifikace
- propagace
- stabilizace trombu

Nejzásadnější změny dosud akceptovaného schématu hemokoagulace se týkají postavení a vůbec existence zevní a vnitřní větve koagulačního sytému, úlohy tkáňového faktoru či úlohy faktorů XI, XII a XIII. Nově byla i rozpoznána aktivní úloha monocytů, leukocytů, erytrocytů a endoteliálních buněk a jejich receptorů v hemokoagulaci, stejně jako úloha cirkulujících mikropartikulí sloužících k přenosu některých působků a informací. Změněné schéma hemokoagulace reflektují i nově se objevující možnosti antikoagulace s výhodnějším poměrem antikoagulačních vlastností k riziku krvácení a trombotické příhody.
Dlouhodobě je stále zřetelnější, že jak vnitřní, tak zevní větev koagulačního systému je prvotně spouštěna uvolněním aktivního tkáňového faktoru, vznikem komplexu tkáňového faktoru s faktorem VIIa a následnou aktivací buď přímo faktoru X na Xa nebo cestou faktoru IXa. Současně je zpochybňována úloha faktoru XII v iniciaci tzv. vnitřního koagulačního systému, jeho role byla nově experimentálně prokázána při propagaci a konečném zpevňování trombu a při hledání nových antitrombotik by právě jeho blokáda mohla splňovat požadavek vysoké účinnosti s minimem krvácivých komplikací [1].
Centrální úloha tkáňového faktoru
Tkáňový faktor (nesprávně nazývaný někdy tromboplastin – ten je kombinací fosfolipidů a tkáňového faktoru; synonymum – koagulační faktor III) má 3 domény: extracelulární, která váže interakcí protein-protein faktor VIIa, transmembranózní a intracelulární, která zprostředkuje signální funkce tkáňového faktoru. Na rozdíl od jiných koagulačních faktorů, cirkulujících v inaktivní formě, je tkáňový faktor jakožto silný iniciátor koagulace plně funkční po expresi na povrchu buněk. Kromě formy vázané na povrch buněčných membrán byl nalezen tkáňový faktor i v cirkulujících mikropartikulích a volně cirkulující v rozpustné formě, která vzniká z alternativně spojené transkripce mRNA pro tkáňový faktor s chybějícím exonem 5, a tudíž s exonem 4 napojeným přímo na exon 6. Alternativně spojený tkáňový faktor obsahuje většinu extracelulární domény a zachovává prokoagulační vlastnosti [2]. Není znám vrozený deficit tkáňového faktoru.
Tkáňový faktor se uvolňuje z prasklého plátu nebo z poškozené tkáně, může být exprimován monocyty, endoteliálními buňkami [3], makrofágy, fibroblasty, a jako odezva na určité patologické podněty i jinými typy buněk [4], je vysoce exprimován v mozku, plicích, buňkách cév a v nádorech. Zvýšená hladina tkáňového faktoru může být přítomna u nemocných s nádory nebo s akutním koronárním syndromem [5–8]. Alternativně spojený lidský tkáňový faktor cirkuluje v solubilní formě v krvi, vykazuje prokoagulační aktivitu po styku s fosfolipidy a je inkorporován do trombů a rovněž může přispívat i k jejich propagaci a stabilizaci [2].
Tkáňový faktor je i hlavním aktivátorem koagulační kaskády během virových infekcí [9].
Tkáňový faktor se kromě zahájení koagulace účastní na signalizaci v řadě důležitých biologických pochodů a je považován za důležitý článek spojující zánět a trombózu. Rovněž je nyní zřejmé, že i proteázy koagulačního systému se účastní cestou proteázami aktivovaných receptorů (PAR) nejen aktivace koagulačního systému, ale hrají roli i v mnoha dalších buněčných odpovědích [10].
Mikropartikule
Aktivní tkáňový faktor cirkuluje i v mikropartikulích, úloha mikropartikulí je však podstatně širší. Mikropartikule jsou vezikuly oddělené od buněk, které nemají nukleus, obsahují membránový skeleton a jsou považovány za ektosomy vznikající z destiček, leukocytů, erytrocytů, endoteliálních buněk, buněk hladkého svalu cév a nádorových buněk, jejich tvorba je fyziologickým fenoménem, obsahují zásobu buněčných receptorů, proteinů, mRNA, mikroRNA, jsou vektorem pro výměnu signálů mezi buňkami. Zvýšená hladina mikropartikulí byla nalezena u aterosklerózy, trombózy, zánětu, metabolických chorob a nádorů [11].
Primární fyziologický inhibitor tkáňového faktoru a regulátor koagulační cesty faktor VIIa/tkáňový faktor je inhibitor cesty tkáňového faktoru (TFPI – tissue factor pathway inhibitor) (obr. 2).
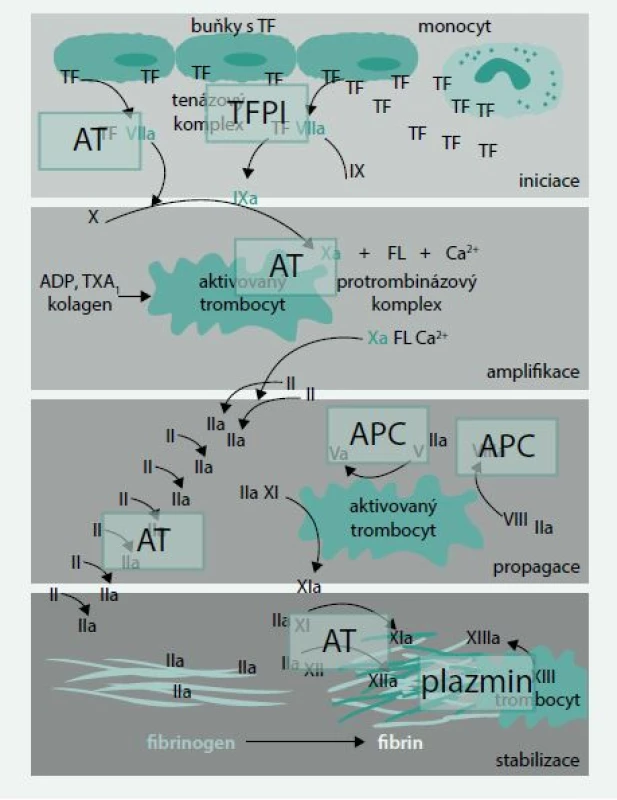
V poslední době se ukazuje, že i antitrombin (AT) může působit jako významný fyziologický regulátor faktoru VIIa. Studie in vitro ukázaly, že antitrombin inhibuje faktor VIIa efektivně, pouze je-li faktor VIIa vázán na tkáňový faktor. V tomto směru by mohla hrát roli vazba faktoru VII na endoteliální receptory pro protein C [12].
Kontaktní systém
Tzv. kontaktní systém aktivuje laboratorně koagulaci in vitro, v humánním prostředí spíše slouží v konečných fázích tvorby trombu k jeho propagaci a zpevnění.
Vnitřní i zevní koagulační systém jsou in vivo stejně aktivovány uvolněním tkáňového faktoru, jakožto kofaktoru VIIa.
Dosud chyběly důkazy o roli faktoru XII ve fyziologické hemokoagulaci. Samotná aktivace faktoru XII a XI nevede ke vzniku trombózy a jejich vrozený deficit není spojen s hemoragickou diatézou. Je prokázáno, že ani faktor XIIa ani faktor XIa se in vivo nepodílejí na iniciaci hemokoagulace. Experimenty provedené v poslední době na zvířeti s blokádou kontaktního systému (faktor XII a XI) prokázaly, že uvedený kontaktní systém se účastní na propagaci a stabilizaci trombu a jeho blokáda zmenšuje výslednou velikost trombu u myší, králíků a paviánů [10,13].
Původní koncepce předpokládala, že spouštěcím mechanizmem tzv. vnitřní větve koagulačního systému je autoaktivace faktoru XII na polyanionickém povrchu. Vysokomolekulární kininogen (HMWK – high-molecular-weight kininogen – Fitzgeraldův faktor) je zachycen na specifických receptorech endoteliálních buněk a aktivuje prekalikrein (Fletcherův faktor). Faktor XII je aktivován druhotně vytvořeným prekalikreinem, a dále je tento proces amplifikován reciproční aktivací prekalikreinu a faktoru XII [14]. Faktor XI může být aktivován stejným mechanizmem jako prekalikrein. Kalikrein současně štěpí vysokomolekulární kininogen za vzniku bradykininu, který stimuluje uvolňování tkáňového aktivátoru plazminogenu. Novější teorie předpokládají, že opožděná aktivace faktoru XII je pravděpodobně zprostředkována komponenty aterosklerotického plátu, jako jsou kolagen, nukleové kyseliny a polyfosfáty [1].
Další prokoagulační a antikoagulační faktory
Faktor V byl původně studován u nemocných s jeho deficiencí a bylo zjištěno, že tito nemocní měli destičky neschopné vázat další koagulační faktor Xa (Majerus PW et al 1970). Faktor Va tedy zvyšuje vazbu faktoru Xa na destičky, a tím přeměnu protrombinu na trombin [15]. Faktor V byl purifikován a biochemicky charakterizován v roce 1981 [16]. Faktor V ve své aktivní formě (v původní nomenklatuře byl faktor Va označován jako faktor VI) je kofaktorem faktoru Xa v protrombinázovém komplexu nutném pro štěpení protrombinu na trombin. Faktor V je vázán na aktivované destičky a je aktivován trombinem, těžký a lehký řetězec jsou nekovalentně spojeny kalciem. Podobně jako faktor VIIIa není faktor Va enzymatické povahy. V protrombinázovém komplexu tedy aktivovaný faktor Xa potřebuje přítomnost vápníku a aktivovaného faktoru Va k přeměně protrombinu na trombin na buněčné membráně.
Faktor Va je štěpen aktivovaným proteinem C. Aktivace proteinu C je důležitá pro negativní, zpětnovazebnou regulaci hemokoagulace vzhledem k tomu, že APC inaktivuje faktor VIIIa a faktor Va, dva hlavní kofaktory zodpovědné za amplifikaci koagulace vedoucí k tvorbě trombinu. Tady se projevuje důležitá role endotelu, protože endoteliální receptor pro protein C (EPCR – endothelial cell protein C receptor) je nezbytný pro podporu aktivace proteinu C [17,18].
Endoteliální receptor pro protein C (EPCR) byl původně identifikován a klonován jako specifický transmembranózní glykoprotein schopný vázat protein C a aktivovaný protein C (APC). EPCR váže protein C a potencuje jeho aktivaci prostřednictvím komplexu trombin/trombomodulin, a tím hraje i významnou regulační roli i v aktivaci celé antikoagulační větve proteinu C. Vytvořený aktivovaný protein C down-reguluje tvorbu trombinu tím, že inaktivuje faktor Va a VIIIa, ale navíc současně působí i cytoprotektivně právě prostřednictvím aktivace endoteliálního receptoru pro protein C. Dostatečná produkce aktivovaného proteinu C závisí na současné přítomnosti trombinu, trombomodulinu, proteinu C a receptoru pro protein C na povrchu endoteliálních buněk. Jakákoliv změna v uvedeném složení může vést ke změně produkce aktivovaného proteinu C, a tím výrazně ovlivnit riziko vzniku trombózy [18]. Za přítomnosti trombomodulinu tak trombin zpětněvazebním mechanizmem limituje vlastní aktivaci.
Vedle toho aktivovaný protein C indukuje i cytoprotektivní účinky, jako je antiapoptotický a protizánětlivý prostřednictvím aktivace proteázami aktivovaného receptoru-1 (PAR1).
Ligandy pro EPCR jsou mimo jiné i faktor VIIa a specifická varianta T buněčného receptoru.
Zjištění, že EPCR působí i jako receptor pro faktor VIIa, ukazuje, že EPCR může ovlivňovat hemokoagulaci i jiným mechanizmem než jen cestou APC. Bylo zjištěno, že vazba faktoru VIIa na EPCR zmenšuje jeho prokoagulační aktivitu tak, že dochází ke snížení tvorby faktoru Xa cestou komplexu TF/f VIIa [17,19].
Faktor VIII (antihemofilický faktor) je esenciálním koagulačním faktorem, podobně jako u faktoru V jde o neenzymatickou plazmatickou bílkovinu, jeho aktivovaná forma působí jako kofaktor enzymatickému faktoru IXa a spolu v přítomnosti Ca2+ a fosfolipidů tvoří tenázový komplex, který přeměňuje faktor X na aktivovaný Xa. Faktor VIIIa zvyšuje o několik řádů aktivitu komplexu. Účinnost tenázového komplexu je regulována disociací podjednotky A1 faktoru VIIIa nebo proteolýzou aktivovaným proteinem C spolu s proteinem S a s membránovými fosfolipidy.
Klinické projevy hemofilie popsal již v 11. století arabský lékař Albukasis ve španělské Córdobě, název hemofilie použil poprvé v roce 1828 Friedrich Hopff na curyšské univerzitě [20], harvardští lékaři Arthur J. Patek jr a F. H. L. Taylor v roce 1936 [21] zjistili, že příčinou je chybění antihemofilického globulinu a v roce 1947 v Buenos Aires Alfredo Pavlovsky rozlišil faktor VIII a IX [22].
V plazmě je faktor VIII ve vazbě na von Willebrandův faktor. Játra totiž uvolňují faktor VIII pouze do plazmy, která obsahuje von Willebrandův faktor. Z této vazby je faktor VIII uvolněn při kontaktu s negativně nabitými fosfolipidovými povrchy, a tím se uvolní vazebné místo, které je v komplexu s von Willebrandovým faktorem skryté. Volný faktor VIII je aktivován působením trombinu nebo faktoru Xa.
Hladina faktoru VIII je závislá mimo jiné na krevní skupině systému AB0, který tím ovlivňuje hodnoty některých používaných koagulačních testů: aktivovaného parciálního tromboplastinového času (aPTT) a TGA (thrombin generation assay) [23].
Na druhé straně byl v nedávné době kazuisticky popsán recidivující infarkt myokardu u mladého nemocného se zvýšenou aktivitou faktoru VIII [24].
Dalším důležitým faktorem, který se podílí na zpevnění vzniklého trombu, je faktor XIII. Jedná se o fibrin stabilizující faktor, který je nezbytný pro tvorbu sítě vláken fibrinu. Může být aktivován několika cestami, hlavní je odštěpení N-terminálního aktivačního peptidu na A subjednotce působením trombinu [25]. Wolberg et al ve své laboratoři prokázali, že fibrinem či fibrinogenem zprostředkovaný transport faktoru XIII do trombů je nezbytný pro retenci erytrocytů v trombu [26]. Faktor XIII stabilizuje tromby proti spontánní fibrinolýze vzájemným provázáním α2-antiplazminu s fibrinem. Buněčný faktor XIII je přítomen ve velkém množství v krevních destičkách a účinným se stává po expozici na povrchu aktivovaných destiček v důsledku stimulace trombinem nebo kolagenem [27]. K vychytávání cirkulujících destiček na rostoucí trombus je potřeba několik destičkových receptorů, komponent endoteliální matrix a koagulačních faktorů. Transglutaminázovou reakcí aktivovaný faktor XIII (XIIIa) kovalentně propojuje von Willebrandův faktor s polymerizujícím fibrinem. Vázaný von Willebrandův faktor dále rekrutuje a aktivuje destičky interakcí s destičkovým glykoproteinovým receptorem GP Ib [28].
Vrozená deficience faktoru XIII je spojená s život ohrožujícím krvácením a je možné jej nahradit lidským plazmatickým koncentrátem nebo rekombinantní formou faktoru XIII [29–31].
Vztah nových názorů na koagulační kaskádu a vývoj nových antitrombotik
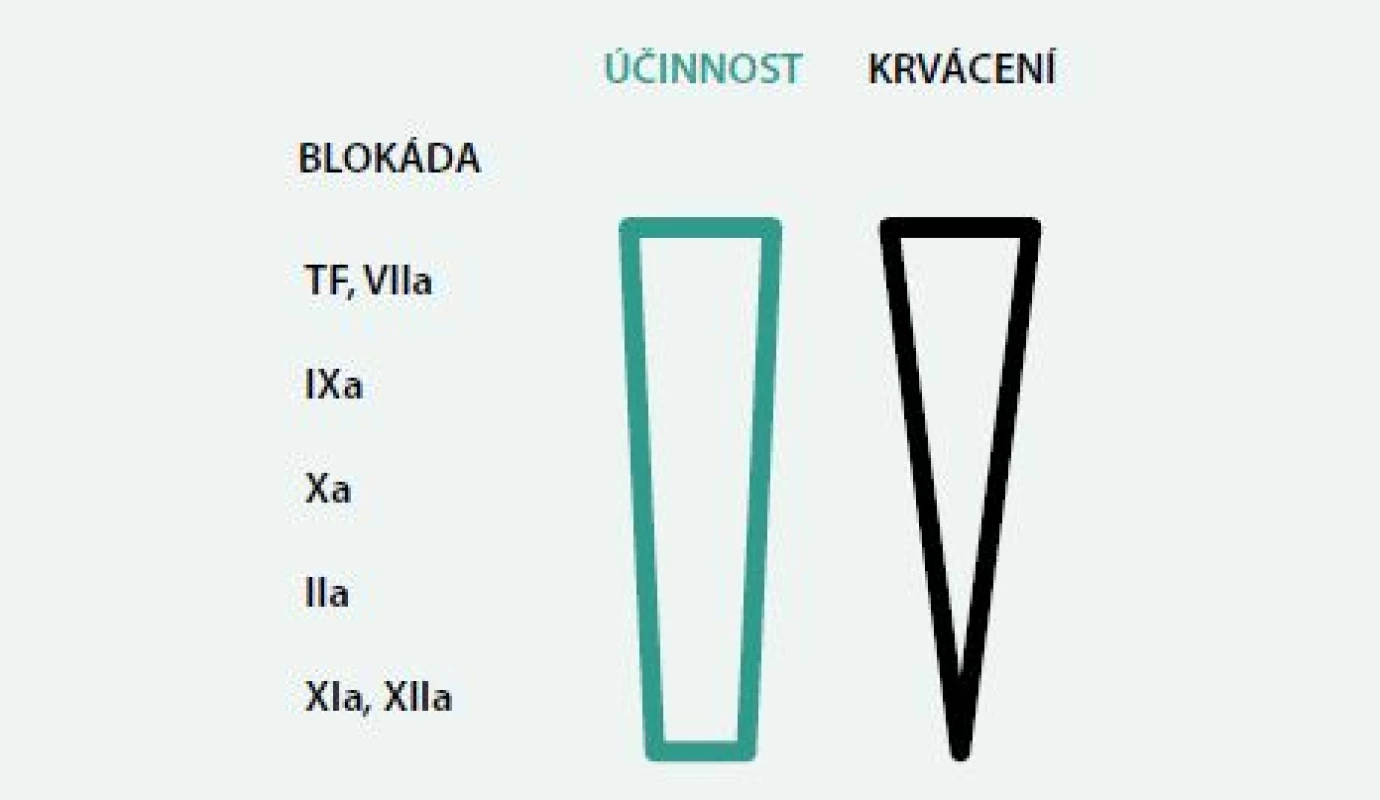
V poslední době jsme byli svědky výzkumu a rychle se rozšiřujícího zavedení nových antitrombotik. Tato zkušenost s novými antitrombotiky potvrdila, že klinický efekt ve smyslu poměru antitrombotického účinku a rizika krvácivých komplikací záleží na tom, který stupeň koagulační kaskády je ovlivněn. Zvláště se nabízí pozorování týkající se role faktorů XI a XII ve zpevňování trombů. Jejich blokáda má předpokládaný vysoký léčebný potenciál pro účinnou a bezpečnou redukci trombózy a jejích komplikací [13,33]. Výhodou blokády uvedených faktorů by mohlo být to, že tyto složky amplifikují koagulační kaskádu, ale nejsou nezbytné pro hemostázu. Teoreticky by tedy na rozdíl od blokády faktorů IIa nebo Xa (obr. 3) měla mít blokáda faktorů XIa a XIIa při dobré účinnosti minimum krvácivých komplikací. Na druhé straně tohoto schématu je potom tkáňový faktor a faktor VIIa. Inhibice faktoru XIIa nebo redukce faktoru XI snížila výskyt trombózy na prasklém aterosklerotickém plátu v experimentu na myších [1,13,32].
prof. MUDr. Jan F. Vojáček, DrSc., FESC, FACC
vojacjan@fnhk.cz
I. interní kardioangiologická klinika LF UK a FN Hradec Králové
www.fnkh.cz
Doručeno do redakce 1. 2. 2015
Přijato po recenzi 8. 4. 2015
Sources
1. Mackman N. New Targets for Atherothrombosis. Arterioscler Thromb Vasc Biol 2014; 34(8): 1607–1608.
2. Bogdanov VY, Balasubramanian V, Hathcock J et al. Alternatively spliced human tissue factor: a circulating, soluble, thrombogenic protein. Nat Med 2003; 9(4): 458–462.
3. Bode M, Mackman N. Regulation of tissue factor gene expression in monocytes and endothelial cells: Thromboxane A2 as a new player. Vascul Pharmacol 2014; 62(2): 57–62.
4. Vojacek J, Dusek J, Bis J et al. Plasma tissue factor in coronary artery disease: further step to the understanding of the basic mechanisms of coronary artery thrombosis. Physiol Res 2008; 57(1): 1–5.
5. Vojacek J, Sevcikova H, Sevcik R et al. Increased platelet residual activity in patients treated with acetosalicylic acid is associated with increased tissue factor and decreased tissue factor pathway inhibitor plasma levels. Int J Cardiol 2011; 146(3): 479–481.
6. Bis J, Vojacek J, Dusek J et al. Time-course of tissue factor plasma level in patients with acute coronary syndrome. Physiol Res 2009; 58(5): 661–667.
7. Maly M, Vojacek J, Hrabos V et al. Tissue factor, tissue factor pathway inhibitor and cytoadhesive molecules in patients with an acute coronary syndrome. Physiol Res 2003; 52(6): 719–728.
8. Mallat Z, Hugel B, Ohan J et al. Shed membrane microparticles with procoagulant potential in human atherosclerotic plaques: a role for apoptosis in plaque thrombogenicity. Circulation 1999; 99(3): 348–353.
9. Pryzdial EL, Sutherland MR, Ruf W. The Procoagulant Envelope Virus Surface: Contribution to Enhanced Infection. Thromb Res 2014; 133(Suppl 1): S15-S17.
10. Hoffman M, Pawlinski R. Hemostasis: Old System, New Players, New Directions. Thromb Res 2014; 133(Suppl 1): S1-S2.
11. Tilley RE, Holscher T, Belani R et al. Tissue factor activity is increased in a combined platelet and microparticle sample from cancer patients. Thromb Res 2008; 122(5): 604–609.
12. Vatsyayan R, Kothari H, Mackman N et al. Inactivation of Factor VIIa by Antithrombin In Vitro, Ex Vivo and In Vivo: Role of Tissue Factor and Endothelial Cell Protein C Receptor. PLoS ONE 2014; 9(8): e103505. Dostupné z DOI: <http://doi: 10.1371/journal.pone.0103505>.
13. Kuijpers MJE, van der Meijden PEJ, Feijge MAH et al. Factor XII regulates the pathological process of thrombus formation on ruptured plaques. Arterioscler Thromb Vasc Biol 2014; 34(8): 1674–1680.
14. Yarovaya GA, Blokhina TB, Neshkova EA. Contact System. New Concepts on Activation Mechanisms and Bioregulatory Functions. Biochemistry (Mosc) 2002; 67(1): 13–24.
15. Kane WH, Lindhout MJ, Jackson CM et al. Factor Va-dependent binding of factor Xa to human platelets. J Biol Chem 1980; 255(3): 1170–1174.
16. LaBonte ML. Anticoagulant factor V: Factors affecting the integration of novel scientific discoveries into the broader Framework. Stud Hist Philos Biol Biomed Sci 2014; 47(Pt A): 23–34.
17. Rao LVM, Esmon CT, Pendurthi UR. Endothelial cell protein C receptor: a multiliganded and multifunctional receptor. Blood 2014; 124(10): 1553–1562.
18. Navarro S, Bonet E, Estellés A et al. The endothelial cell protein C receptor: Its role in thrombosis. Thromb Res 2011; 128(5): 410–416.
19. López-Sagaseta J, Montes R, Puy C et al. Binding of factor VIIa to the endothelial cell protein C receptor reduces its coagulant activity. J Thromb Haemost 2007; 5(9): 1817–1824.
20. Hopff F. Über die Hämophilie oder die Erbliche Anlage zu Tödlichen Blutungen (Inaugural - Abhandlung). Carl Wilhelm Becker: Würzburg: 1928.
21. Patek AJ, Taylor FH. Hemophilia: Some properties of a substance obtained from normal human plasma effective in accelerating the coagulation of hemophilic blood. J Clin Invest 1937; 16(1): 113–124.
22. Pavlovsky A. Contribution to the pathogenesis of hemophilia. Blood 1947; 2(2): 185–191.
23. Choi Q, Kim JE, Kim SY et al. Influence of ABO type on global coagulation assay results: effect of coagulation factor VIII. Clin Chem Lab Med. 2014; pii: /j/cclm.ahead-of-print/cclm-2014–0909/cclm-2014–0909.xml. Dostupné z DOI: <http://dx.doi.org/10.1515/cclm-2014–0909>.
24. Vacek TP, Yu S, Rehman S et al. Recurrent myocardial infarctions in a young football player secondary to thrombophilia, associated with elevated factor VIII activity. Int Med Case Rep J 2014; 7 : 147–154.
25. Hoppe B. Fibrinogen and factor XIII at the intersection of coagulation, fibrinolysis and inflammation. Thromb Haemost 2014; 112(4): 649–658.
26. Aleman MM, Byrnes JR, Wang JG et al. Factor XIII activity mediates red blood cell retention in venous thrombi. J Clin Invest 2014; 124(8): 3590–3600.
27. Mitchell JL, Lionikiene AS, Fraser SR et al. Functional factor XIII-A is exposed on the stimulated platelet surface. Blood 2014; 124(26): 3982–3990.
28. Miszta A, Pelkmans L, Lindhout T et al. Thrombin-dependent Incorporation of von Willebrand Factor into a Fibrin Network. J Biol Chem 2014; 289(52): 35979–3586.
29. Árokszállási A, Kerényi A, Katona É et al. The use of recombinant factor XIII in a major bleeding episode of a patient with congenital factor XIII deficiency – the first experience. Haemophilia 2015; 21(1): e118-e121.
30. Nugent DJ, Ashley C, García-Talavera J et al. Pharmacokinetics and safety of plasma-derived factor XIII concentrate (human) in patients with congenital factor XIII deficiency. Haemophilia 2015; 21(1): 95–101.
31. Ashley C, Chang E, Davis J et al. Efficacy and safety of prophylactic treatment with plasma-derived factor XIII concentrate (human) in patients with congenital factor XIII deficiency. Haemophilia 2015; 21(1): 102–108.
32. van Montfoort ML, Kuijpers MJE, Knaup VL et al. Factor XI Regulates Pathological Thrombus Formation on Acutely Ruptured Atherosclerotic Plaques. Arterioscler Thromb Vasc Biol 2014; 34(8): 1668–1673.
Labels
Diabetology Endocrinology Internal medicineArticle was published in
Internal Medicine

2015 Issue 5
-
All articles in this issue
- Vliv spironolaktonu u pacientů se srdečním selháním a zachovalou funkcí levé komory – studie TOPCAT
- Nová verze klasifikace plicní hypertenze
- Hypertenze u žen
- Vplyv pridania fytosterolu ku hypolipidemickej liečbe statínom na veľkosť lipoproteínových partikúl u pacientov s veľmi vysokým kardiovaskulárnym rizikom
- Hypertenze bílého pláště a maskovaná hypertenze
- Personalizovaná farmakoterapie digoxinem
- Kontroverze kolem betablokátorů
- Je potřeba léčit agresivně fibrilaci síní?
- Význam kyseliny močové a terapie alopurinolem v ovlivnění kardiovaskulárních onemocnění
- Ambulantní léčba žilní plicní embolie
- Současný stav a budoucnost péče o nemocné s vrozeným srdečními vadami
- Inhibice systému renin-angiotenzin-aldosteron u srdečního selhání aneb od obecného souhlasu (CONSENSUS) po vzorec myšlení (PARADIGM-HF)
- Hemokoagulace – nové pohledy na starou kaskádu
- Primární hyperaldosteronizmus: problémy diagnostických přístupů
- Neurokardiologie nebo kardioneurologie – nová specializace budoucnosti?
- Feochromocytom – proč je jeho časná diagnóza pro pacienta důležitá?
- Nakolik jsme schopni dosáhnout současně platných cílových hodnot LDL-cholesterolu v sekundární prevenci ischemické choroby srdeční
- Čo môže zapríčiniť diabetes
- Hyperosmolární hyperglykemický stav
- Kombinační léčba hypertenze 2015
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue
- Hyperosmolární hyperglykemický stav
- Hemokoagulace – nové pohledy na starou kaskádu
- Význam kyseliny močové a terapie alopurinolem v ovlivnění kardiovaskulárních onemocnění
- Hypertenze u žen
