Přístup k pacientům s jaterními chorobami
Approach to patients with liver diseases
In recent years the most frequent cause of chronic liver diseases in western countries has become Non-alcoholic hepatic steatosis/steatohepatitis (NAFLD/NASH). It is part or immediate manifestation of metabolic syndrome. A crucial task for the future is to diagnose this hepatic injury to a greater extent and cooperate with other internal medicine physicians in the care of patients with NAFLD. It has been clearly proven that it is not a benign disease, as assumed in the past. Non-alcoholic steatohepatitis can have serious consequences for the patient and it needs to be actively searched for. The still prevalent notion that normal liver tests in patients with hepatic steatosis eliminate a more serious liver injury has also been disproved. On the contrary, this condition is common in patients with NAFLD. Also the patients with normal liver test results can have advanced fibrosis/cirrhosis. It is needed to target identification of a liver injury in a patient with the detected metabolic syndrome with the same intensity as the other diabetes complications are searched for today. All patients with type 2 diabetes mellitus (DM2T) should undergo ultrasound examination of the liver and it is further recommended to check the liver tests in annual intervals at least. The cause of liver lesions should be found in all diabetics who had higher liver test values established even once. The liver injury needs to be further regularly followed in these patients. Regarding the patients without the metabolic syndrome anamnesis with the NAFLD signs, it is needed to actively search for the components of the metabolic syndrome (hypertension, dyslipidemia, impaired glucose tolerance, diabetes).
Key words:
alcoholic liver injury – cirrhosis – liver fibrosis – metabolic syndrome – NAFLD – non-alcoholic hepatic steatosis.
:
Radan Brůha
:
IV. interní klinika 1. LF UK a VFN Praha, přednosta prof. MUDr. Aleš Žák, DrSc.
:
Vnitř Lék 2015; 61(Suppl 4): 6-12
:
Reviews
Nejčastější příčinou chronických jaterních chorob v západních zemích se v posledních letech stala nealkoholová steatóza/steatohepatitida (NAFLD/NASH). Jedná se o součást či přímo manifestaci metabolického syndromu. Zásadním úkolem do budoucna je toto jaterní postižení ve větší míře diagnostikovat a v péči o pacienty s NAFLD spolupracovat s ostatními specialisty z oboru vnitřního lékařství. Je jasně prokázáno, že se nejedná o benigní onemocnění, jak se v minulosti předpokládalo. Nealkoholová steatohepatitida může mít pro pacienta závažné důsledky a je po ní potřeba aktivně pátrat. Dosud panující názor, že normální jaterní testy u pacientů s jaterní steatózou vylučují závažnější jaterní postižení, se také ukázal jako nesprávný. Tento stav je u pacientů s NAFLD naopak běžný. I pacienti s normálními jaterními testy mohou mít pokročilou fibrózu/cirhózu. U pacienta se známým metabolickým syndromem je potřeba pátrat cíleně po jaterním postižení ve stejné míře, jako se dnes pátrá po ostatních komplikacích diabetu. Všichni pacienti s diabetes mellitus 2. typu by měli podstoupit ultrasonografické vyšetření jater a dále se doporučuje kontrolovat jaterní testy v intervalu minimálně 1krát ročně. U všech diabetiků s jednou zjištěnými vyššími jaterními testy by měla být stanovena příčina jaterní léze. Jaterní postižení je u těchto pacientů potřeba dále pravidelně sledovat. U pacientů bez anamnézy metabolického syndromu se známkami NAFLD je třeba po ostatních komponentech metabolického syndromu aktivně pátrat (hypertenze, dyslipidemie, porušená glukózová tolerance, diabetes).
Klíčová slova:
alkoholové jaterní poškození – cirhóza – jaterní fibróza – metabolický syndrom – NAFLD – nealkoholová jaterní steatóza
Úvod
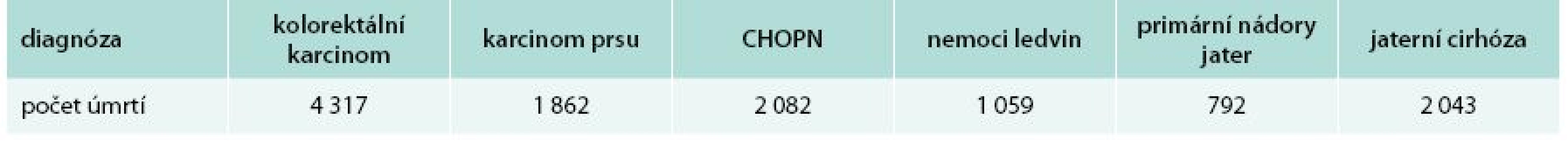
V průběhu několika posledních desetiletí došlo k rychlému vývoji oboru hepatologie, která dnes nabízí stále většímu počtu nemocných kompletní vyléčení jejich choroby či významné prodloužení života. Před několika desetiletími se diagnostika jaterních chorob opírala o klinické vyšetření, byly známy pouze jednoduché (a mnohdy zbytečně invazivní) zobrazovací metody či nejzákladnější diagnostické testy. Léčebné postupy se spoléhaly na dietní opatření a nejjednodušší symptomatické postupy. V dnešní době máme k dispozici neinvazivní zobrazovací vyšetření, která mnohdy již nahradí jaterní biopsii či jiné invazivní vyšetření, metody molekulární biologie k přesné diagnostice virových hepatitid i vrozených jaterních chorob; většinu jaterních chorob jsme schopni diagnostikovat během hodin či několika málo dnů. Stejného pokroku dosáhly léčebné postupy – umíme vyléčit podstatnou část nemocných s virovými hepatitidami, umíme účinně léčit různé komplikace jaterní cirhózy a díky transplantaci jater i samotnou jaterní cirhózu a se životem neslučitelné těžké akutní jaterní selhání. Známe postupy, které významně prodlouží život pacientů s nádory jater. I přes tyto skutečnosti představují jaterní choroby významnou zdravotní zátěž současné populace. Předpokládá se, že v současnosti jen v Evropě trpí až 29 milionů jedinců některou z chronických jaterních chorob [1]. Většina chronických jaterních chorob souvisí s nadměrným příjmem alkoholu, nealkoholovou jaterní steatózou – NAFLD/non-alcoholic fatty liver disease (v souvislosti s nadváhou, diabetem a metabolickým syndromem), nebo virovými hepatitidami B a C. Pomyslnou „špičkou ledovce“ ve vývoji jaterních chorob je jaterní cirhóza – většina úmrtí, která se vztahují k jaterním chorobám, je dána právě přítomností jaterní cirhózy a jejích komplikací. Z tohoto pohledu zemře v ČR více obyvatel na jaterní choroby, než např. na chronickou plicní nemoc nebo karcinom prsu (tab. 1). Dnes je také jasně prokázáno, že přítomnost nejčastější chronické jaterní choroby NAFLD znamená pro daného jedince zvýšené kardiovaskulární riziko i zvýšené riziko onkologických onemocnění.
Hodnocení jaterního postižení
Parametrem jaterního poškození je v běžné praxi zvýšení tzv. jaterních testů. V užším slova smyslu se takto označují parametry ukazující na jaterní poškození (ALT, AST, ALP, GGT), v širším pohledu pak i jednoduché parametry jaterních funkcí (bilirubin, albumin, Quickův test). ALT se nachází v cytoplazmě hepatocytů, AST pak v cytoplazmě i v mitochondriích. Ani jeden z enzymů není specifický čistě pro játra, nicméně oba se v játrech nacházejí ve vysokých koncentracích a jejich zvýšení v séru je obecným parametrem hepatocelulárního poškození. Izolované zvýšení AST by však mělo vést k podezření na mimojaterní původ enzymu.
Podobně jako u mnoha laboratorních hodnot, normální hodnoty AST a ALT byly získány vyšetřením určitého počtu „zdravých“ osob. Mnoho těchto jedinců však mohlo mít nepoznanou nealkoholovou jaterní steatózu či v dřívější době nevyšetřovanou hepatitidu C a je otázkou, zda naše současné limity jsou skutečně „normální“. Je např. známo, že jedinci s hodnotami ALT a AST blížící se k horní hranici normy mají vyšší mortalitu na jaterní choroby, než jedinci hodnotami transamináz na dolní hranici normy [2]. Dalším méně známým faktem je skutečnost, že velké procento pacientů se steatózou, pokročilou fibrózou, či dokonce cirhózou má „jaterní testy“ trvale v mezích normy. Dalším nezbytným vyšetřením ve screeningu jaterních chorob je tedy sonografie, která odhalí biochemicky „němou“ jaterní steatózu.
Parametrem cholestázy je enzym alkalická fosfatáza (ALP), není to však enzym specifický pro játra či biliární strom, nachází se i ve střevě, ledvinách, kostech a placentě. Gamaglutamyltransferáza (GGT) je mikrozomální enzym velmi citlivý i k minimálnímu jaternímu poškození. Izolovaná elevace GGT není cholestázou, bývá přítomna u alkoholového poškození, NAFLD či při polékovém poškození. Při současné elevaci ALP odpovídá cholestáze.
Klinická manifestace a diferenciální diagnostika
Klinické projevy jaterních chorob se mohou pohybovat od zcela bezpříznakových stavů, přes nespecifické symptomy jako je únava, nauzea, nechutenství, pruritus, až k projevům pokročilé jaterní choroby, jako je ascites, ikterus, pavoučkové névy apod.
Zásadní rozvahou u pacienta s elevací jaterních enzymů je rozhodnutí, zda se jedná o parenchymatózní (hepatocelulární) poškození nebo cholestatickou jaterní lézi. K parenchymatózní lézi patří elevace ALT a AST, pro cholestázu je typická elevace ALP (schéma 1). 10násobné zvýšení AST a ALT většinou odpovídá probíhající nekróze hepatocytů. Nižší hodnoty ALT již tak dobře s histologickým obrazem nekrózy nekorelují. Výrazně vysoké hodnoty ALT (> 10násobek normy) jsou typické pro virové hepatitidy, polékové či toxické postižení, ischemii, autoimunní hepatitidu, Wilsonovu chorobu či přechodnou akutní biliární obstrukci při průchodu konkrementu. Poměr AST/ALT je důležitý k posouzení etiologie jaterní léze – hodnoty AST vyšší než ALT jsou typické a téměř specifické pro alkoholové poškození. U čisté cholestázy je vždy nezbytné vyloučit mechanickou biliární obstrukci; až poté můžeme mluvit o intrahepatální cholestáze. Smíšená léze je nejčastěji způsobena polékovým poškozením (v literatuře se nyní uvádí jako DILI – drug induced liver injury).

Dalším zásadním rozhodnutím je určení, zda se jedná a akutní (a přechodné) zvýšení jaterních testů, či zda se jedná o chronické onemocnění (trvale vyšší hodnoty jaterních testů).
Přechodné (lehké) zvýšení jaterních testů může mít po různých inzultech v průběhu života téměř každý jedinec, naopak je známo, že přibližně 5–8 % populace má trvale vyšší hodnoty transamináz. Akutní jaterní léze se u naprosté většiny pacientů upraví do plné normy, chronická jaterní léze může vést k jaterní cirhóze. Jednoduchý základní postup v diferenciální diagnostice jaterní léze ukazuje schéma 2 a schéma 3.


Jaterní cirhóza se naštěstí vyvine jen u malé části pacientů s chronickými jaterními chorobami; jedním z důležitých aspektů péče o pacienty s chronickými jaterními chorobami by měla být snaha nalézt právě pacienty s potenciálním rizikem vývoje choroby do stadia jaterní cirhózy. Pokročilost jaterní fibrózy je jednou z nejpodstatnějších informací týkajících se prognózy konkrétního pacienta a často rozhoduje o léčebné strategii [3]. Zlatým standardem v hodnocení jaterní fibrózy bývala jaterní biopsie, která je však spojena s určitými riziky pro pacienta, jako jsou bolestivost, krvácení a výjimečně i fatální komplikace [4]. V poslední době se hledají neinvazivní vyšetření, která by přinesla podobou informaci o jaterní fibróze jako biopsie. V této souvislosti byly hodnoceny sérové hodnoty mnoha látek, které se podílejí na procesu fibrotizace [5]. Jedná se např. o hyaluronovou kyselinu a další látky; často se využívá různých indexů, které někdy zahrnují kromě výše uvedených metabolitů i klinické parametry (např. ELF, NAFLD Fibrosis score, Fibrotest® aj). Dalšími neinvazivními vyšetřeními jsou zobrazovací metody, které měří nepřímo „elasticitu“ jaterní tkáně. Jedná se buď o tzv. tranzientní elastografii – Fibroscan® [6], metodu ARFI (acoustic radiation force imaging) [7] či SWE (shear wave elastography). Všechny výše uvedené metody jsou poměrně spolehlivé v detekci těžké fibrózy nebo cirhózy a v této indikaci mohou již plně nahradit jaterní biopsii. Nejsou však už tak přesné v hodnocení fibrózy lehkého stupně. Nedávná studie na „zdravé“ populaci ve Francii, využívající vyšetření pomocí jaterní elastografie (Fibroscan®), ukázala, že 8,7 % jedinců v běžné populaci nad 45 let, kteří se dostavili k preventivní lékařské prohlídce, mělo známky pokročilé jaterní fibrózy [8]. Příčinami jaterní fibrózy bylo u 58 % jedinců NAFLD, u 22 % alkoholové postižení, u 8 % kombinace alkoholu a NAFLD a jen u 12 % byla zvažována jiná etiologie (virové hepatitidy aj). K podobným výsledkům dospěli i autoři jiné studie [9] využívající ve screeningu jaterní fibrózy vyšetření sérových biomarkerů (FibroTest®) – ve skupině téměř 7 500 obyvatel ve věku přes 40 let byla jaterní fibróza zjištěna téměř u 3 % „zdravých“ osob; 3/4 těchto pacientů měly přitom zcela normální hodnoty ALT (!). Příčinou fibrózy bylo NAFLD (47 %), alkoholové postižení (7 %) či kombinace obou příčin (29 %). Ostatní příčiny včetně virových hepatitid se podílely na vzniku této „němé“ jaterní fibrózy jen 17 %.
Epidemiologie a vývoj nejčastějších jaterních chorob
Hlavní příčinou jaterních chorob byl v Evropě do nedávné doby nadměrný příjem alkoholu a úmrtnost na jaterní cirhózu zůstává i dnes jasným parametrem spotřeby alkoholu v daném regionu nebo státu [10] – nejvyšší je ve Francii a Španělsku (více než 30 úmrtí na 100 000 obyvatel), nejnižší v severských zemích (do 5 úmrtí na 100 000 obyvatel). V Čechách je to 15–20 úmrtí na jaterní cirhózu na 100 000 obyvatel. Nejvyšší mortalita je u mužů ve věku 35–64 let, nižší u žen. V uplynulých 2–3 desetiletích došlo ke stabilizaci či dokonce ke snížení příjmu alkoholu v západních zemích, velmi nepříznivý trend je však pozorován ve východní Evropě a rozvojových zemích [11]. U alkoholové jaterní choroby nesouvisí poškození jater příliš s druhem alkoholického nápoje, záleží především na množství „čistého alkoholu“ v něm obsaženém. Zvýšené riziko jaterního poškození existuje při konzumaci více než 30 g čistého alkoholu za den bez ohledu na pohlaví [12]. To by měla být také hranice, při níž lze ještě připustit příznivý účinek alkoholu na kardiovaskulární onemocnění [13]. Při dlouhodobé a pravidelné konzumaci více než 80 g alkoholu/den vznikne jaterní poškození téměř jistě.
Z praktického hlediska hodnotíme příjem alkoholu množstvím zkonzumovaných „drinků“, což je množství nápoje obsahující 12 g alkoholu (přibližně 1/3 l piva, 1 dcl vína, 0,4 dcl destilátu). „Bezpečný“ denní příjem alkoholu by tak neměl přesáhnout 2 „drinky“. Každý organizmus může však být individuálně vnímavý, navíc jakékoli jiné jaterní postižení jako např. virová hepatitida [14] či metabolická onemocnění znásobují riziko postižení alkoholem. Dalším vysoce rizikovým faktorem je obezita [15]. Vznik jaterní choroby též závisí na způsobu pití alkoholu – nárazové pití s přestávkami je pro játra šetrnější než trvalý přísun alkoholu, pití alkoholu k jídlu je příznivější než konzumace mimo hlavní jídla [12].
Alkoholové jaterní poškození vzniká následkem biochemických, genetických, buněčných, imunologických a humorálních poruch souvisejících s přeměnou nadměrného množství alkoholu [19]. Velkou roli hraje oxidační stres daný především indukcí CYP2E1 alkoholem a současný nedostatek antioxidantů v hepatocytech, dále poškození samotným acetaldehydem a změny rovnováhy mnoha cytokinů – především TNFα. K oxidačnímu stresu dále přispívají změny metabolizmu lipidů a změny v tukové tkáni [8]. Zdá se, že mechanizmus poškození jaterních buněk následkem nadměrného přísunu alkoholu se podobá změnám při nealkoholové steatóze/steatohepatitidě, s tím rozdílem, že prvotní inzult je odlišný [17].
Nejčastějším chronickým jaterním onemocněním v západním světě jsou však v současnosti choroby spjaté s nealkoholovou jaterní steatózou (NAFLD). NAFLD zahrnuje široké spektrum jaterních onemocnění od prosté steatózy, přes nealkoholovou steatohepatitidu (NASH – nonalcoholic steatohepatitis) se zánětlivým postižením jaterního parenchymu a ukládáním vaziva (fibrózou) až k jaterní cirhóze se všemi jejími komplikacemi včetně hepatocelulárního karcinomu [16]. NAFLD se dnes považuje za součást či jaterní manifestaci metabolického syndromu [17] spojenou s inzulinovou rezistencí [18] a dalšími klinickými komponentami, jako je centrální obezita, diabetes mellitus 2. typu (DM2T), dyslipidemie a arteriální hypertenze [19]. Podmínkou diagnózy NAFLD není plná abstinence, denní přísun alkoholu by však neměl přesáhnout 20 g u mužů a 10 g u žen. Studie založené na ultrasonografickém vyšetření jater nebo MR spektroskopii (což jsou senzitivnější metody než zvýšené jaterní testy) ukazují prevalenci NAFLD mezi 20 a 30 % v západních zemích, na Blízkém i Dálném východě [20]. Autoptické studie obětí dopravních nehod a jiných tragických úmrtí udávají prevalenci NAFLD 16–64 % [21]. U rizikových skupin, jako jsou např. obézní nebo diabetici 2. typu, jsou tato čísla mnohem vyšší. Prevalence NAFLD u pacientů s DM2T je v ČR téměř 80 % [22]. To při prevalenci DM2T asi 8 % představuje v ČR více než půl milionu pacientů s NAFLD jen mezi diabetiky. Epidemiologické studie ukázaly, že pacienti s NAFLD mají vyšší mortalitu než běžná populace [23]; ta je dána nejen samotnou cirhózou, ale především kardiovaskulárními chorobami a mimojaterními malignitami [24]. NAFLD představuje již nyní významnou ekonomickou zátěž pro zdravotnický systém. Ve studii na německé populaci bylo zjištěno, že jedinci se sonografickými známkami jaterní steatózy a zvýšenou hodnotou ALT čerpali v průběhu 5letého sledování o 26 % více prostředků ze zdravotního pojištění než ti, co známky steatózy a jaterní léze neměli [25].
Přestože histologické nálezy jaterní biopsie u pacientů s alkoholovým postižením a NAFLD mohou být podobné [26], mají tyto stavy rozdílnou prognózu. Ve studii srovnávající osud pacientů v průběhu více než 25letého sledování bylo zjištěno, že při stejných vstupních podmínkách (histologicky prokázaná steatóza) pacienti s alkoholovým jaterním postižením měli ve srovnání s pacienty s NAFLD kratší přežití (20 vs 24 roků), větší procento z nich dospělo do fáze jaterní cirhózy (20 % vs 7 %) a větší procento z nich zemřelo v souvislosti s jaterní chorobou (36 % vs 7 %). Nejčastější příčinou úmrtí u skupiny pacientů s NAFLD byly naopak kardiovaskulární nemoci. Jen pro srovnání, v běžné věkově srovnatelné populaci bylo jen 0,1 % všech úmrtí dáváno do souvislosti s jaterními chorobami. Přítomnost jaterní steatózy tedy znamená výrazně vyšší riziko úmrtí z jaterních příčin [27].
Klinické a laboratorní nálezy a léčebná opatření u nejčastějších jaterních chorob
Při chronickém abúzu alkoholu je nejčastější prvotní změnou steatóza jaterních buněk. Následné změny mohou vést k zánětlivé reakci, která může vyústit v akutní alkoholovou hepatitidu či chronické jaterní poškození. Těžká akutní alkoholová hepatitida je zatížena až 50% úmrtností, je však poměrně vzácná. Častěji se poškození projevuje chronickými změnami (steatohepatitidou a fibrózou), které vedou po mnoha letech k rozvoji jaterní cirhózy. Toto spektrum histologických nálezů lze popsat jako dynamický proces. Prostá steatóza je reverzibilní v průběhu několika týdnů abstinence; steatohepatitida, která se vyvíjí jen u menší části alkoholiků, je fibrogenní proces, který může indukovat změny vedoucí k jaterní cirhóze. Steatohepatitida je též reverzibilní, nicméně určitý stupeň fibrózy může přetrvávat.
U těžkých alkoholiků se objevuje jaterní poškození téměř ve 100 % případů. V podrobné studii týkající se alkoholiků přijatých do nemocnice pro jinou než jaterní problematiku byla v jaterní biopsii nalezena steatóza ve 45 %, steatohepatitida ve 34 %, steatohepatitida s cirhózou v 10 % a samotná cirhóza také v 10 % případů [28]. Právě steatohepatitida často koinciduje s jaterní cirhózou u aktivních alkoholiků a je častou příčinou dekompenzace cirhózy. Prostá steatóza je považována za benigní onemocnění; je však známo, že i tento stav může při pokračujícím abúzu indukovat fibrogenezu [29] a až u 20 % pacientů s prostou steatózou se v průběhu 10 let vyvine fibróza či cirhóza [30].
Ve stadiu steatózy nemají pacienti většinou žádné příznaky, mohou mít lehce zvýšeny jaterní testy (GGT, AST, případně i ALT) a zvětšená játra (oboje se často zjistí často náhodně při vyšetření z jiných důvodů). Ve stadiu alkoholové hepatitidy mohou mít pacienti nevolnost, nechutenství, hubnutí, objeví se ikterus. Jaterní testy testy vykazují vyšší hodnoty včetně GGT, vyšší hladinu gamaglobulinů a většinou zvětšená játra. Základním zobrazovacím vyšetřením jater je sonografie. Jaterní biopsie není vždy nutná, může však odlišit prostou steatózu od steatohepatitidy a posoudí stupeň fibrózy.
Zásadní podmínkou úspěšné léčby alkoholového jaterního poškození je absolutní abstinence. I těžké změny, včetně cirhotické přestavby, mohou při abstinenci částečně ustoupit. Léky (vitaminy) i kvalitní výživa mají pouze podpůrný význam. Účinek tzv. hepatoprotektiv nebyl nikdy prokázán a blíží se účinkům placeba. Při těžké akutní alkoholické hepatitidě se používají kortikoidy.
NAFLD/NASH je histologicky charakterizována steatotickým postižením jater (většinou makrovezikulární steatózou) [31]. Nacházíme řadu změn od prosté steatózy až po steatohepatitidu (včetně Malloryho hyalinu a pericelulární fibrózy). Histologicky nelze NAFLD odlišit od postižení při abúzu alkoholu. Rozlišení mezi prostou steatózou a steatohepatitidou u NAFLD je zásadní, steatohepatitida (NASH) přechází až u 20 % nemocných do stadia jaterní cirhózy. Situací, která mění prostou steatózu do závažného onemocnění, je zánětlivá reakce vedoucí k ukládání vaziva (fibróze).
Klinicky se NAFLD může projevit únavou, malátností, břišním diskomfortem a vzácně i známkami jaterní insuficience nebo portální hypertenze při cirhóze. Většinou je však klinicky němý a diagnostikuje se na základně náhodně zjištěné elevace transamináz či abnormálního nálezu při sonografickém vyšetření [32]. Normální hodnoty jaterních enzymů nevylučují přítomnost chronické jaterní choroby – z dřívějších studií je známo, že i jinak asymptomatičtí jedinci s mírnou elevací jaterních enzymů mají současně jaterní lézi (steatózu, případně se zánětlivou reakcí – stetaohepatitidu) [33].
Na základě histologického a vyšetření nelze odlišit NAFLD od alkoholového jaterního postižení, diagnóza je založena na vyloučení jiných příčin jaterní choroby (především vyloučení požívání nadměrného množství alkoholu, chronických virových hepatitid B a C, autoimunního postižení, polékového poškození a některých metabolických chorob – Wilsonova choroba, hemochromatóza). V laboratorním obraze se nachází nejčastěji elevace ALT a GGT. Je třeba zdůraznit, že elevace GGT není specifická jen pro poškození alkoholem, ale je typická také pro NAFLD [34]. Toto zvýšení GGT může dosahovat i 10násobku normy. Pro alkoholové postižení je naopak typické zvýšení AST a poměr AST/ALT větší než 2 a výrazně kolísající hodnoty GGT. Sonograficky většinou nalezneme typická „steatotická” játra, někdy i známky fibrózy či cirhotické přestavby.
Jaterní biopsie není nutnou podmínkou diagnózy NAFLD (schéma 4), poslouží však k odlišení prosté steatózy od steatohepatitidy a posoudí přesně stupeň fibrózy. Biopsie by měla být provedena v těchto případech:

- pokud si nejsme diagnózou jisti
- u pacientů, kteří nemají metabolický syndrom a diagnózu NAFLD zvažujeme
- u pacientů, u kterých nález těžké steatohepatitidy změní léčebný postup – např. agresivní léčba obezity (bariatrická chirurgie)
- pokud máme podezření na těžkou steatohepatitidu nebo počínající cirhózu a výsledky neinvazivních vyšetření nejsou přesvědčivé
Léčba NAFLD je založena spíše na empirických zkušenostech než na výsledcích klinických studií. Spočívá v:
- důsledné léčbě přítomných rizikových faktorů – tj. diabetu, hypertriglyceridemie (fibráty či statiny) a především obezity (snížení energetického příjmu spolu se zvýšením energetického výdeje, při těžší obezitě farmakologická eventuálně chirurgická léčba)
- odstranění faktorů, které se mohou spolupodílet na poškození jater, tj. především minimalizace příjmu alkoholu a odstranění potenciálně hepatotoxických léků
Dále se zkouší antioxidanty (vitamin E), hepatoprotektiva (urzodeoxycholová kyselina), látky působící proti TNF (pentoxyfylin). Dostatečný účinek těchto léků podávaných s cílem přímého působení na játra nebyl dosud žádnou klinickou studií jednoznačně prokázán.
Závěr
- Nejčastější příčinou chronických jaterních chorob v západních zemích je v současnosti NAFLD; i pacienti s normálními jaterními testy mohou mít pokročilou fibrózu/cirhózu.
- Jaterní fibrózu lze v dnešní době diagnostikovat neinvazivními postupy bez použití jaterní biopsie.
- Pacienti s NAFLD mají velmi často zvýšené sérové hodnoty GGT; není to projevem abúzu alkoholu či cholestázy; téměř specifickým parametrem pro alkoholové postižení je hodnota AST vyšší než ALT.
- Velmi častou příčinou přechodné elevace jaterních testů je polékové poškození jater; opomíjenou příčinou jaterní léze jsou v této souvislosti „přírodní“ preparáty z kategorie potravních doplňků.
doc. MUDr. Radan Brůha, CSc.
bruha@cesnet.cz
IV. interní klinika 1. LF UK a VFN, Praha
www.vfn.cz
Doručeno do redakce 9. 11. 2015
Sources
1. Blachier M, Leleu H, Peck-Radosavljevic M et al. The burden of liver disease in Europe: a review of available epidemiological data. J Hepatol 2013; 58(3): 593–608.
2. Kim HC, Nam CM, Jee SH et al. Normal serum aminotransferase concentration and risk of mortality from liver diseases: prospective cohort study. BMJ 2004; 328(7446): 983.
3. Ehrmann J, Hůlek P (eds) et al. Hepatologie. Grada Publishing: Praha 2010. 616 s. ISBN 978–80–247–3118–6. 4.
4. Gilmore IT, Burroughs A, Murray-Lyon IM et al. Indications, methods, and outcomes of percutaneous liver biopsy in England and Wales: an audit by the British Society of Gastroenterology and the Royal College of Physicians of London. Gut 1995; 36(3): 437–441.
5. Wieckowska A, Mc Cullough AJ, Feldstein AE. Noninvasive diagnosis and monitoring of nonalcoholic steatohepatitis: present and future. Hepatology 2007; 46(2): 582–589.
6. Sandrin L, Fourquet B, Hasquenoph JM et al. Transient elastography: a new noninvasive method for assessment of hepatic fibrosis. Ultrasound Med Biol 2003; 29(12): 1705–1713.
7. Rifai K, Cornberg J, Mederacke I et al. Clinical feasibility of liver elastography by acoustic radiation force impulse imaging (ARFI). Dig Liver Dis 2011; 43(6): 491–497.
8. Roulot D, Costes JL, Buyck JF et al. Transient elastography as a screening tool for liver fibrosis and cirrhosis in a community-based population aged over 45 years. Gut 2011; 60(7): 977–984.
9. Poynard T, Lebray P, Ingiliz P et al. Prevalence of liver fibrosis and risk factors in a general population using non-invasive biomarkers (FibroTest). BMC Gastroenterol 2010; 10 : 40. Dostupné z DOI: <http://doi: 10.1186/1471–230X-10–40>.
10. Zatonski WA, Sulkowska U, Manczuk M et al. Liver cirrhosis mortality in Europe, with special attention to Central and Eastern Europe. Eur Addict Res 2010; 16(4): 193–201.
11. Bosetti C, Levi F, Lucchini F et al. Worldwide mortality from cirrhosis: an update to 2002. J Hepatol 2007; 46(5): 827–839.
12. Bellentani S, Saccoccio G, Costa G et al. Drinking habits as cofactors of risk for alcohol induced liver damage. The Dionysos Study Group. Gut 1997; 41(6): 845–850.
13. Snow WM, Murray R, Ekuma O et al. Alcohol use and cardiovascular health outcomes: a comparison across age and gender in the Winnipeg Health and Drinking Survey Cohort. Age Ageing 2009; 38(2): 206–212.
14. Bhattacharya R, Shuhart MC. Hepatitis C and alcohol: interactions, outcomes, and implications. J Clin Gastroenterol 2003; 36(3): 242–252.
15. Raynard B, Balian A, Fallik D et al. Risk factors of fibrosis in alcohol-induced liver disease. Hepatology 2002; 35(3): 635–638.
16. Angulo P. Nonalcoholic fatty liver disease. N Engl J Med 2002; 346(16): 1221–1231.
17. Marchesini G, Bugianesi E, Forlani G et al. Nonalcoholic fatty liver, steatohepatitis, and the metabolic syndrome. Hepatology 2003; 37(3): 917–923.
18. Chitturi S, Abeygunasekera S, Farrell GC et al. NASH and insulin resistance: Insulin hypersecretion and specific association with the insulin resistance syndrome. Hepatology 2002; 35(2): 373–379.
19. Tuyama AC, Chang CY. Non-alcoholic fatty liver disease. J Diabetes 2012; 4(3): 266–280.
20. Bellentani S, Bedogni G, Miglioli L et al. The epidemiology of fatty liver. Eur J Gastroenterol Hepatol 2004; 16(11): 1087–1093.
21. Hilden M, Christoffersen P, Juhl E et al. Liver histology in a „normal“ population – examinations of 503 consecutive fatal traffic casualties. Scand J Gastroenterol 1977; 12(5): 593–597.
22. Dvorak K, Hainer R, Petrtyl J et al. The prevalence of nonalcoholic liver steatosis in patients with type 2 diabetes mellitus in the Czech Republic. Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub 2015; 159(3): 442–448.
23. Adams LA, Lymp JF, St Sauver J et al. The natural history of nonalcoholic fatty liver disease: a population-based cohort study. Gastroenterology 2005; 129(1): 113–121.
24. Caldwell S, Argo C. The natural history of non-alcoholic fatty liver disease. Dig Dis 2010; 28(1): 162–168.
25. Baumeister SE, Völzke H, Marschall P et al. Impact of fatty liver disease on health care utilization and costs in a general population: a 5-year observation. Gastroenterology 2008; 134(1): 85–94.
26. Yeh MM, Brunt EM. Pathological features of fatty liver disease. Gastroenterology 2014; 147(4): 754–764.
27. Haflidadottir S, Jonasson JG, Norland H et al. Long-term follow-up and liver-related death rate in patients with non-alcoholic and alcoholic related fatty liver disease. BMC Gastroenterol 2014; 14 : 166. Dostupné z DOI: <http://doi: 10.1186/1471–230X-14–166>.
28. Barrio E, Tome S, Rodriguez I et al. Liver disease in heavy drinkers with and without alcohol withdrawal syndrome. Alcohol Clin Exp Res 2004; 28(1): 131–136.
29. Reeves HL, Burt AD, Wood S et al. Hepatic stellate cell activation occurs in the absence of hepatitis in alcoholic liver disease and correlates with the severity of steatosis. J Hepatol 1996; 25(6): 677–683.
30. Teli MR, Day CP, Burt AD et al. Determinants of progression to cirrhosis or fibrosis in pure alcoholic fatty liver. Lancet 1995; 346(8981): 987–990.
31. Ludwig J, Viggiano TR, Mc Gill DB et al. Nonalcoholic steatohepatitis: Mayo Clinic experiences with a hitherto unnamed disease. Mayo Clin Proc 1980; 55(7): 434–438.
32. Matteoni CA, Younossi ZM, Gramlich T et al. Nonalcoholic fatty liver disease: a spectrum of clinical and pathological severity. Gastroenterology 1999; 116(16): 1413–1419.
33. Hultcrantz R, Glaumann H, Lindberg G et al. Liver investigation in 149 asymptomatic patients with moderately elevated activities of serum aminotransferases. Scand J Gastroenterol 1986; 21(1): 109–113.
34. Pinto HC, Baptista A, Camilo ME et al. Nonalcoholic steatohepatitis. Clinicopathological comparison with alcoholic hepatitis in ambulatory and hospitalized patients. Dig Dis Sci 1996; 41(1): 172–179.
Labels
Diabetology Endocrinology Internal medicineArticle was published in
Internal Medicine

2015 Issue Suppl 4
Most read in this issue
- Cirrhosis of the liver and HCV
- Approach to patients with liver diseases
- Possibilities of IFN-free therapy of hepatitis C
