Trombofília
Thrombophilia
Thrombophilia is a risk factor for thrombosis. The hematologists have come under pressure to initiate thrombophilia testing on an increasing number of patients. This article summarized practical aspects, with focus on whom to test, why to test, what to test, what not to test and clinical management consequences for individuals having been identified with a thrombophilia.
Key words:
thrombophilia – thrombosis
Authors:
Ladislava Čingerová; Marta Kučeráková
Authors‘ workplace:
Hematologické oddelenie FNsP, Žilina, Slovenská republika
Published in:
Vnitř Lék 2016; 62(12): 985-989
Category:
Reviews
Overview
Trombofília je rizikovým faktorom trombózy. Hematológovia sa preto v poslednom období dostali pod tlak zvyšujúceho sa počtu testovaných pacientov na trombofíliu. Tento článok sumarizuje praktické dôsledky zamerané na: koho testovať, prečo testovať, aký použiť test, čo netestovať a na vyplývajúce dôsledky pre jednotlivca, v prípade pozitívneho testu na trombofilný stav.
Kľúčové slova:
trombofílila – trombóza
Úvod
V roku 1965 bol opísaný opakovaný výskyt venóznej tromboembólie (VTE) v príbuzenstve nórskej rodiny. To bol začiatok systematického pátrania a výskumu s cieľom odhaliť prítomnosť genetických defektov spojených s familiárnou trombózou. Odhalenie heterozygotov pre mutáciu v géne pre antitrombín (AT), medzi členmi spomenutej rodiny, umožnilo po prvýkrát dokázať spojenie génových defektov so zvýšeným rizikom trombózy [1]. Nasledovalo obdobie, ktoré charakterizovalo objavenie génových defektov pre tri endogénne antikoagulačné proteíny: AT, proteín C (PC) a proteín S (PS) [2–9]. No, v 85 % rodín, v ktorých sa vyskytla predispozícia k trombóze sa prítomnosť žiadnej mutácie nenašla. Stav sa zmenil zavedením vyšetrovania rezistencie na aktivovaný PC a objavením mutácie FV Leiden (G→A 1691; FVL), čím bol daný molekulový základ pre existenciu fenotypu rezistencie na aktivovaný PC [6,7]. Postupne dochádza i k ďalším odhaleniam genetických abnormalít. Termín vrodená trombofília uznáva prítomnosť určitého dedičného faktoru, ktorý sám o sebe je len predispozíciou k trombóze a k manifestácii trombózy vyžaduje interakciu s inými vrodenými alebo získanými rizikovými faktormi. Pojem vrodenej trombofílie je pojem funkčný. Pôvodne vychádzal z včasnej prítomnosti odchýlky, obyčajne spojenej s dedičnou fenotypovou abnormalitou jedného z inhibičných proteínov koagulácie. Trombofilný stav môže byť vyvolaný rôznymi príčinami. V tab. 1 uvádzame ich prehľad [10–14]. Na Slovensku v posledných rokoch prebieha intenzívny výskum predovšetkým 2 trombofilných stavov, a to syndrómu lepivých doštičiek a geneticky podmienenej zvýšenej aktivite faktora XI. Dôkazom toho je rad publikovaných prác v karentovaných, resp. impaktovaných časopisoch [15–19]. Treba však zdôrazniť, že trombóza je multifaktoriálnym ochorením. Medzi významné rizikové faktory patrí napr. vek, dlhodobá imobilizácia, nádorové ochorenie, užívanie hormonálnej substitučnej liečby, antikoncepcia a iné.

Praktické aspekty
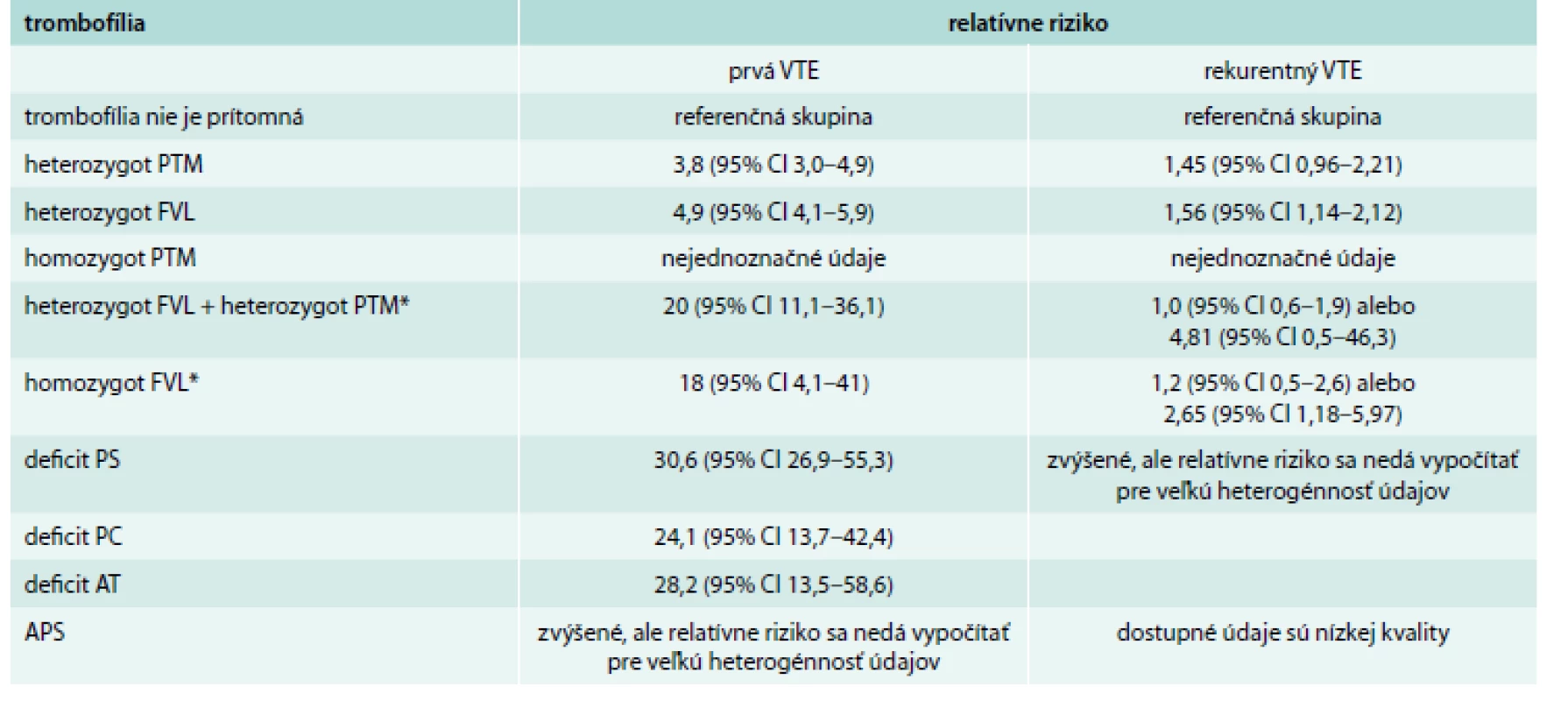
Trombofilné stavy sa vyznačujú rôznym stupňom rizika VTE. Trombofilný stav detekovaný u pacienta s VTE je považovaný za jeden z rizikových faktorov vzniku VTE. Relatívne riziko rozvoja prvej epizódy VTE je uvedené v tab. 2. Prítomnosť pomerne častých trombofilných stavov (napr. heterozygotná forma mutácia G20210A protrombínového génu – PTM a FVL) je spojená len s malým rizikom recidívy. Jedným z cieľov vyšetrenia prítomnosti trombofilného stavu je snaha odhaliť stavy spojené s vysokým stupňom recidívy. Medzi tzv. ,,závažné“ trombofilné stavy zaraďujeme: homozygotnú formu FVL, homozygotnú formu PTM, súčasné nosičstvo heterozygotných foriem FVL a PTM, deficit PC, deficit PS, deficit AT a antifosfolipodový syndróm (APS) [20–27].
Koho vyšetrovať a dĺžka antikoagulačnej liečby
Neexistuje jednoznačné odporúčanie, kto by mal byť vyšetrený na trombofilný stav. Je jednoduchšie určiť podmienky, kto by nemal byť vyšetrený. Väčšina odborníkov sa zhodne v tom, že vyšetrovať neselektovanú skupinu pacientov s trombózou nemá klinický význam. Tab. 3 sumarizuje skupiny pacientov, u ktorých by podľa súčasných odporúčaní malo byť zvážené vyšetrenie prítomnosti trombofilneho stavu [20,21].

Venózna trombóza
U pacientov s VTE rozhodujú o dĺžke antikoagulačnej liečby (3-mesačnej alebo prolongovanej) 3 faktory [20]:
- riziko rekurencie VTE
- riziko veľkého krvácania
- preferencie pacienta
Pacient s anamnézou VTE, ktorý bol spojený so závažnou vyvolávajúcou príčinou (veľká operácia, imobilita alebo trauma) má nízke riziko rekurencie VTE. Preto 3-mesačná antikoagulačná liečba je adekvátna a odporúčaná [28]. Vyšetrenie trombofilneho stavu, u takéhoto pacienta sa neodporúča. Riziko rekurencie je aj v prípade dokázanej trombofílie nízke [20,28].
Pacienti s idiopatickou VTE majú vysoké riziko rekurencie. Preto sa u týchto pacientov, v prípade dobrej tolerancie a akceptovania zo strany pacienta, odporúča dlhodobá antikoagulačná liečba [20]. Prítomnosť alebo neprítomnosť trombofilneho stavu nezmení toto odporúčanie. Vyšetrenie na prítomnosť trombofilneho stavu sa preto neodporúča [20]. V prípade, že má pacient nevyprovokovanú venóznu trombózu a zároveň má zvýšené riziko možných krvácavých komplikácií alebo dlhodobá antikoagulačná liečba je pre pacienta neakceptovateľná, je vyšetrenie trombofilneho stavu vhodné [20].
Pacienti, u ktorých je dokázaná nízkoriziková a/alebo prechodná príčina VTE (antikoncepcia obsahujúca estrogén, substitučná liečba estrogénom, malý chirurgický zákrok, krátkodobá imobilita), majú stredne vysoké riziko rekurencie trombózy [29,30]. Preto sa u týchto pacientov odporúča vyšetrenie na prítomnosť trombofilneho stavu [20].
Artériová trombóza
Trombofilné stavy hrajú v prípade artériovej trombózy len malú úlohu. Prevládajúcou príčinou je ateroskleróza. Heterozygotné formy FVL a PTM prispievajú k riziku artériovej trombózy len minimálne [31]. Z doterajších realizovaných štúdií nie je jasné, či homozygotné formy mutácií FVL a PMT, resp. spoločné nosičstvo heterozygotných foriem FVL + PMT, zvyšujú riziko artériovej trombózy [20].
Veľké rodinné štúdie neukázali súvis medzi artériovou trombózou a deficitom AT. Zároveň, ale demonštrovali jasnú asociáciu medzi artériovou trombózou a deficitom PC alebo PS [32]. Antifosfolipidové protilátky sú rovnako významným rizikovým faktorom rozvoja artériovej trombózy.
Preto vyšetrenie trombofilného stavu u mladého pacienta s artériovou trombózou sa má zamerať na vyhľadanie ,,závažnejších“ trombofilných stavov. Avšak nie je jasné, či pacienti s non-aterosklerotickou artériovou trombózou a ,,závažnejšou“ formou trombofílie majú byť liečení dlhodobo. Dá sa predpokladať, že antiagregačná terapia by mohla byť účinnou terapiou artériovej trombózy, keďže doštičky hrajú významnú úlohu v patogenéze artériovej trombózy. Je tiež rozumné predpokladať, že kombinácia antiagregačnej a antikoagulačnej liečby by mohla byť najúčinnejšou terapeutickou kombináciou. Samozrejme je potrebné zvážiť aj riziko krvácania [20].
Kedy vyšetrovať a čo ovplyvňuje výsledok?
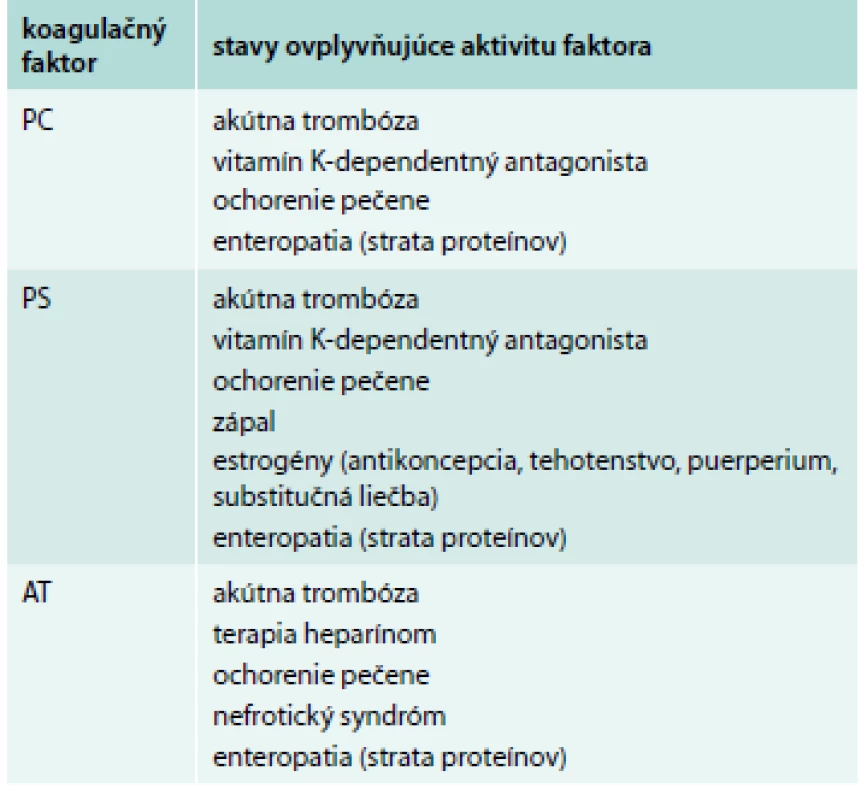
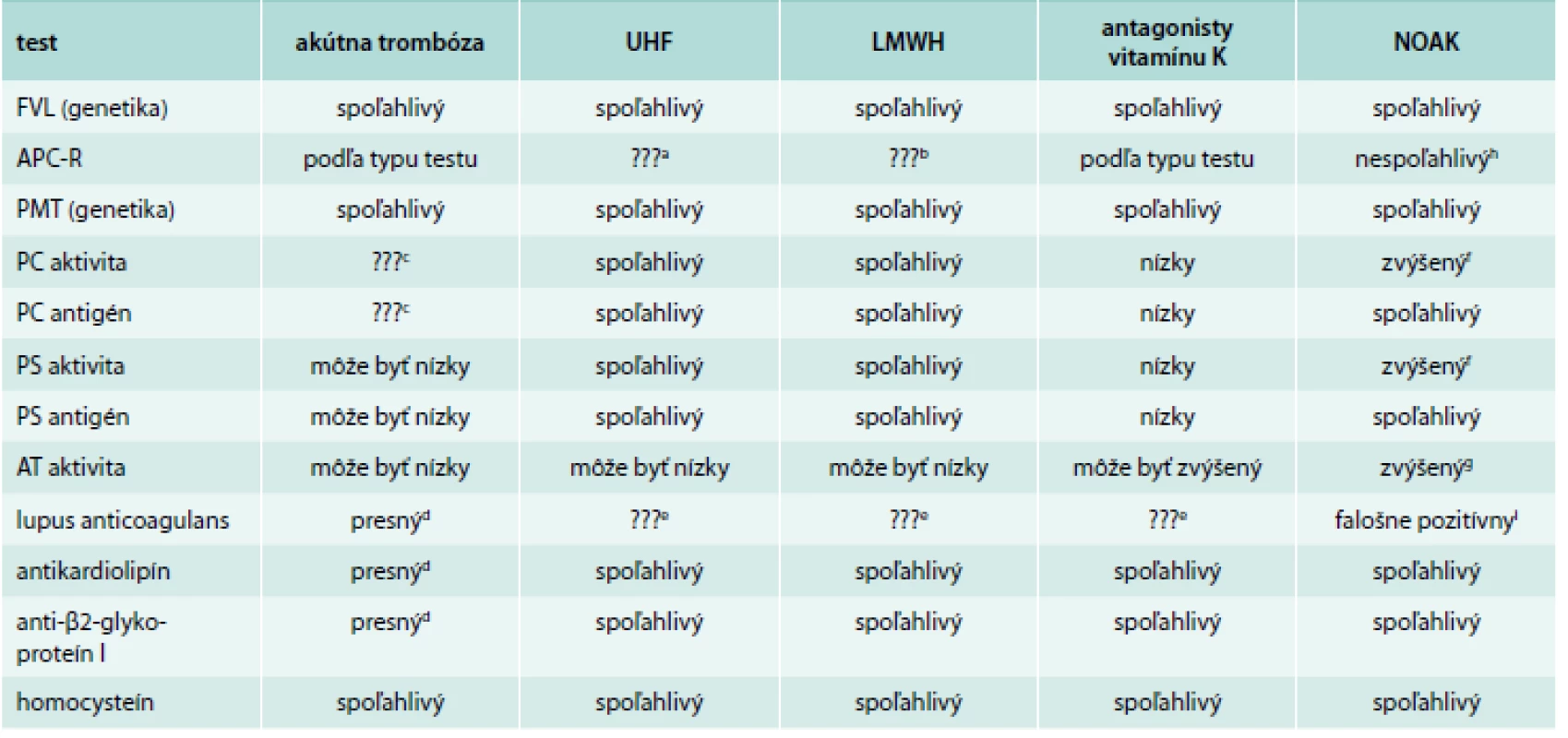
Zdá sa byť správne, aby všetci pacienti s VTE boli liečení po dobu minimálne 3 mesiacov. Tesne pred uplynutím tohto obdobia sa môžeme rozhodnúť, či má význam vyšetriť pacienta na trombofíliu. Hlavná otázka, ktorú si lekár musí klásť, je to, či ovplyvní výsledok dĺžku antikoagulačnej liečby. Medzi prvé vyšetrenia na trombofíliu patrí FVL, PTM, antikardiolipín a anti-β2-glykoproteín I. Neskôr môžeme vyšetriť aj ostatné trombofilné stavy (lupus anticoagulans, aktivitu PC, PS a AT). Tab. 4 sumarizuje vplyvy rôznych stavov na aktivitu PS, PC a AT [20]. V tab. 5 je sumár vplyvu akútnej trombózy a rôznych antikoagulancií na výsledok testovaného trombofilného stavu [20,33,34].
Záver
Vrodené alebo získané trombofilné stavy zvyšujú riziko VTE, ako aj riziko opakovaných strát plodu, ťažkej preeklampsie a zvyšujú riziko intrauterínneho úmrtia plodu. Napriek narastajúcim vedomostiam o etiológii trombózy, vyšetrenie trombofílie vo všeobecnosti nezmenilo liečebné postupy. Testovanie by sa preto nemalo vykonávať rutinne, ale vždy až po dohovore s hematológom.
MUDr. Ladislava Čingerová
ladislava.cingerova@gmail.com
Hematologické oddelenie FNsP,
Žilina,
Slovenská republika
www.fnspza.sk
Doručeno do redakce 12. 2. 2016
Přijato po recenzi 6. 9. 2016
Sources
1. Egeberg O. Inherited antithrombin III deficiency causing thrombophilia. Thromb Diath Haemorrh 1965; 13 : 516–530.
2. Lane DA, Olds RJ, Boisclair M et al. Antithrombin III mutation database: first update. Thromb Haemost 1993; 70(2): 361–369.
3. Reitsma PH, Bernadi F, Doig RG et al. Protein C deficiency: A database of mutations 1995 update. Thromb Haemost 1995; 73(5): 876–889.
4. Aiach M, Gandrille S, Emmerich J. A review of mutations causing deficiencies of antithrombin, protein C and protein S. Thromb Haemost 1995; 74(1): 81–89.
5. Borgel D, Duchemin J, Matheron C et al. Molecular defects responsible for type I and IIa protein-S (PS) deficiencies in a panel of 120 French families. Thromb Haemost 1995; 73(6): 1256.
6. Dahlbäck B, Carlsson M, Svensson PJ. Familial thrombophilia due to a previously unrecognized mechanism characterized by poor anticoagulant response to activated protein C: prediction of a cofactor to activated protein C. Proc Nat Acad Sc USA 1993; 90(3): 1004–1008.
7. Bertina RM, Koeleman BP, Koster T et al. Mutation in blood coagulation factor V associated with resistance to activated protein C. Nature 1994; 369(6475): 64–67.
8. Rosendaal FR, Koster T, Vandebroucke JP et al. High risk of thrombosis in patients homozygous for factor V Leiden (activated protein C resistance). Blood 1995; 85(6): 1504–1508.
9. Vooberg J, Roelse J, Koopman R et al. Association of idiopathic venous thrombembolism with single point-mutation at Arg506 of factor V. Lancet 1994; 343(8912): 1535–1536.
10. Kubisz P, Staško J, Dobrotová M et al. Hematológia a transfuziológia. Grada: Praha 2006. ISBN 80–247–1779–4. ISBN 80–8090–000–0.
11. Kvasnička J. Doporučený postup pro indikaci molekulárně genetických vyšetření v rámci diagnostiky trombofilních stavů v žilním systému. Vnitř Lék 2010; 56(12): 1251.
12. Dulíček P. Trombofilní stavy. Vnitř Lék 2005; 51(7–8): 819–825.
13. Piťha J, Auzký O, Roztočil K. Co mají společného žilní a tepenná onemocnění? Vnitř Lék 2014; 60(11): 985–989.
14. Dulíček P, Vodičková L, Malý J et al. ,,Nejasná” příčina vzniku a recidivy venózního tromboembolizmu. Vnitř Lék 2006; 52(1): 87–88.
15. Sokol J, Biringer K, Skerenova M et al. Platelet aggregation abnormalities in patients with fetal losses: the GP6 gene polymorphism. Fertil Steril 2012; 98(5): 1170–1174. Dostupné z DOI: <http://dx.doi.org/10.1016/j.fertnstert.2012.07.1108>.
16. Sokol J, Biringer K, Skerenova M et al. Different models of inheritance in selected genes in patients with sticky platelet syndrome and fetal loss. Semin Thromb Hemost 2015; 41(3): 330–335. Dostupné z DOI: <http://dx.doi.org/10.1055/s-0034–1395351>.
17. Sokol J, Biringer K, Skerenova M et al. Activity of coagulation factor XI in patients with spontaneous miscarriage: The presence of risk alleles. J Obstet Gynaecol 2015; 35(6): 621–624. Dostupné z DOI: <http://dx.doi.org/10.3109/01443615.2014.991284>.
18. Simonova R, Bartosova L, Chudy P et al. Nine kindreds of familial sticky platelet syndrome phenotype. Clin Appl Thromb Hemost 2013; 19(4): 395–401. Dostupné z DOI: <http://dx.doi.org/10.1177/1076029612439340>.
19. Sokol J, Skerenova M, Biringer K et al. Genetic variations of the GP6 regulatory region in patients with sticky platelet syndrome and miscarriage. Expert Rev Hematol 2015; 8(6): 863–868. Dostupné z DOI: <http://dx.doi.org/10.1586/17474086.2015.1083417>.
20. Moll S. Thrombophilia: a clinical-practical aspects. J Thromb Thrombolysis 2015; 39(3): 367–378. Dostupné z DOI: <http://dx.doi.org/10.1007/s11239–015–1197–3>.
21. Lijfering WM, Brouwer JL, Veeger NJ et al. Selectivetesting for thrombophilia in patients with first venous thrombosis: results from a retrospective family cohort study on absolute thrombotic risk for currently known thrombophilic defects in 2479 relatives. Blood 2009; 113(21): 5314–5322. Dostupné z DOI: <http://dx.doi.org/10.1182/blood-2008–10–184879>.
22. Lijfering WM, Middeldorp S, Veeger NJ et al. Risk of recurrent venous thrombosis in homozygous carriers and double heterozygous carriers of factor V Leiden and prothrombin G20210A. Circulation 2010; 121(15): 1706–1712. Dostupné z DOI: <http://dx.doi.org/10.1161/CIRCULATIONAHA.109.906347>.
23. Segal JB, Brotman DJ, Necochea AJ et al. Predictive value of factor V Leiden and prothrombin G20210A in adults with venous thromboembolism and in family members of those with a mutation: a systematic review. JAMA 2009; 301(23): 2472–2485. Dostupné z DOI: <http://dx.doi.org/10.1001/jama.2009.853>.
24. Juul K, Tybjaerg-Hansen A, Schnohr P et al. Factor V Leiden and the risk for venous thromboembolism in the adult Danish population. Ann Intern Med 2004; 140(5): 330–337.
25. Emmerich J, Rosendaal FR, Cattaneo M et al. Combined effect of factor V Leiden and prothrombin 20210A on the risk of venous thromboembolism – pooled analysis of 8 case-control studies including 2310 cases and 3204 controls. Study Group for Pooled-Analysis in Venous Thromboembolism. Thromb Haemost 2001; 86(3): 809–816. Erratum inThromb Haemost 2001; 86(6): 1598.
26. Garcia D, Akl EA, Carr R et al. Antiphospholipid antibodies and the risk of recurrence after a first episode of venous thromboembolism: a systematic review. Blood 2013; 122(5): 817–824. Dostupné z DOI: <http://dx.doi.org/10.1182/blood-2013–04–496257>.
27. Buliková A, Penka M. Antifosfolipidový syndróm – diagnostika a léčba. Vnitř Lék 2005; 51(7–8): 809–817.
28. Hicks LK, Bering H, Carson KR et al. Five hematologic tests and treatments to question. Blood 2014; 124(24): 3524–3528. Dostupné z DOI: <http://dx.doi.org/10.1182/blood-2014–09–599399>.
29. Le Gal G, Kovacs MJ, Carrier M et al. Risk of recurrent venous thromboembolism after a first oestrogen-associated episode. Data from the REVERSE cohort study. Thromb Haemost 2010; 104(3): 498–503. Dostupné z DOI: <http://dx.doi.org/10.1160/TH09–10–0685>.
30. Iorio A, Kearon C, Filippucci E et al. Risk of recurrence after a first episode of symptomatic venous thromboembolism provoked by a transient risk factor: a systematic review. Arch Intern Med 2010; 170 : 1710–1716.
31. Kim RJ, Becker RC. Association between factor V Leiden, prothrombin G20210A, and methylenetetrahydrofolate reductase C677T mutations and events of the arterial circulatory system: a meta-analysis of published studies. Am Heart J 2003; 146(6): 948–957.
32. Mahmoodi BK, Brouwer JLP, Veeger NJ et al. Hereditary deficiency of protein C or protein S confer increased riskof arterial thromboembolic events at a young age. Results from alarge family cohort study. Circulation 2008; 118(16): 1659–1667. Dostupné z DOI: <http://dx.doi.org/10.1161/CIRCULATIONAHA.108.780759>.
33. Adcock DM, Gosselin R, Kitchen S et al. The effect of dabigatran on select specialty coagulation assays. Am J Clin Pathol 2013; 139(1): 102–109. Dostupné z DOI: <http://dx.doi.org/10.1309/AJCPY6G6ZITVKPVH>.
34. Johnson NV, Khor B, Van Cott EM. Advances in laboratory testing for thrombophilia. Am J Hematol 2012; 87(Suppl 1): S108-S112. Dostupné z DOI: <http://dx.doi.org/10.1002/ajh.23186>.
Labels
Diabetology Endocrinology Internal medicineArticle was published in
Internal Medicine

2016 Issue 12
-
All articles in this issue
- Přínos magnetické rezonance pro diagnostiku kardiomyopatií a myokarditidy (2. část)
- Trombofília
- Káva ako hepatoprotektívny faktor
- Perorální antidiabetika v léčbě diabetes mellitus 1. typu
- Von Hippelov-Lindauov syndróm – dve strany jednej mince
- Nová fixní kombinace tiotropium a olodaterol – její role v léčbě chronické obstrukční plicní nemoci v České republice
- Takotsubo syndrom: incidence, etiologie, komplikace, léčba a prognóza
- Letální případy krvácení do horní části gastrointestinálního traktu
- Společné stanovisko českých odborných společností ke konsenzu European Atherosclerosis Society a European Federation of Clinical Chemistry and Laboratory Medicine k vyšetřování krevních lipidů a k interpretaci jejich hodnot
- Pomalidomid v léčbě mnohočetného myelomu – vlastní zkušenosti a přehled literatury
- Došlo v posledním desetiletí ke změně počtu a charakteristik pacientů se syndromem diabetické nohy hospitalizovaných k vysoké amputaci na specializovaném podiatrickém pracovišti?
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue
- Trombofília
- Káva ako hepatoprotektívny faktor
- Perorální antidiabetika v léčbě diabetes mellitus 1. typu
- Takotsubo syndrom: incidence, etiologie, komplikace, léčba a prognóza
