Blízká budoucnost léčby dyslipidemie u diabetiků 2. typu
A near future of treatment of dyslipidemia in type 2 diabetics
Dyslipidemia in type 2 diabetics represents a complex change of lipoprotein metabolism that is highly proatherogenic. It originates on a genetic background in the context of insulin resistance and affects lipoprotein metabolism at multiple levels (e.g. hepatocyte, enterocyte, intravascular processing) mainly in the postprandial phase. The treatment of diabetic (atherogenic) dyslipidemia is an effective option to lower the risk of both macro - and microvascular complications of diabetes. Lifestyle changes effectively impact on dyslipidemia in diabetics, however, it is impossible to reach treatment goals and achieve necessary risk reduction without lipid lowering medications. Statins remain the corner stone of pharmacological therapy and they should be combined with ezetimibe (or a resin) in case of insufficient LDL-cholesterol lowering or with fenofibrate when triglyceride levels remain elevated. In near future these drugs will be available in new fixed-dose combination formulas. Moreover, very soon PCSK9 inhibitors will get to clinical practice offering patients with diabetes additional LDL-cholesterol lowering by more than 50 %. Selective modulators of PPARα receptors are under development and these shall offer better efficacy and tolerability compared with fibrates. Other future options for the management of diabetic dyslipidemia will be drugs utilizing the anti-sense technology interfering with translation of genes coding for metabolic pathways of lipoprotein species typically perturbed in type 2 diabetes (e.g. anti-sense oligonucleotides against mRNA of apolipoprotein CIII).
Key words:
anti-sense therapy – diabetic dyslipidemia – ezetimibe – fibrates – PCSK9 inhibitors – resins – statins
Authors:
Michal Vrablík
Authors‘ workplace:
Centrum preventivní kardiologie III. interní kliniky – kliniky endokrinologie a metabolizmu 1. LF UK a VFN v Praze
Published in:
Vnitř Lék 2016; 62(7-8): 652-660
Category:
Reviews
Overview
Dyslipidemie u diabetiků 2. typu představuje komplexní změnu lipoproteinového metabolizmu s výrazně proaterogenním potenciálem. Vzniká na základě genetické predispozice v souvislosti s inzulinovou rezistencí a postihuje lipoproteinový metabolizmus na úrovni hepatocytu, střevní mukózy a intravaskulární přeměny, a to zejména postprandiální. Léčba diabetické (aterogenní) dyslipidemie je účinnou možností ovlivnění rizika rozvoje makrovaskulárních i mikrovaskulárních komplikací diabetu. Nefarmakologická opatření indikovaná u diabetiků účinně ovlivňují i dyslipidemii. Bez farmakoterapie však nemůžeme dostatečně ovlivnit lipidový metabolizmus ani snížit riziko cévních komplikací spojených s dyslipidemií. Základem farmakologické léčby zůstávají statiny, které kombinujeme v případě nedostatečného efektu na LDL-cholesterol s ezetimibem (nebo vhodnou pryskyřicí) anebo s fenofibrátem v případě trvající elevace triglyceridů. V blízké budoucnosti se rozroste spektrum fixních kombinací těchto osvědčených hypolipidemik. K nim přibydou inhibitory PCSK9, které u diabetiků snižují hladiny LDL-cholesterolu i o více než 50 %. V delším časovém horizontu lze očekávat výsledky testů s novými selektivními modulátory receptorů pro PPARα, které překonávají nevýhody fibrátů, pokud se jedná o účinnosti i toleranci léčby. Zajímavé jsou i další možnosti využívající technologii anti-sense, které zasahují do transkripce genů kódujících proteiny důležité pro metabolizmus lipoproteinů zmnožených typicky u diabetiků (např. anti-sense oligonukleotidy proti mRNA pro apolipoprotein CIII).
Klíčová slova:
anti-sense terapie – diabetická dyslipidemie – ezetimib – fibráty – PCSK9 inhibitory – pryskyřice – statiny
Úvod
Postupný rozvoj poruchy glukózové homeostázy od inzulinové rezistence (kompenzované hyperinzulinemií) až po manifestní diabetes mellitus 2. typu (DM2T) jde ruku v ruce se změnami metabolizmu sérových lipidů a lipoproteinů. Tyto komplexní změny metabolizmu charakterizované odlišnou kvalitou i kvantitou sérových lipoproteinů se rozvíjejí již od vzniku inzulinové rezistence a prohlubují se spolu se snižováním inzulinové senzitivity a nárůstem inzulinové deficience. Z hlediska metabolizmu lipoproteinových částic se jako nejvýznamnější jeví porušení správné funkce inzulinu na úrovni jaterní buňky a enterocytu, tedy v místech rozhodujících o vzniku a degradaci lipoproteinových částic. Kromě těchto dvou hlavních tkáňových úrovní se na negativním vývoji lipidového metabolizmu podílí změny ve svalové a tukové tkáni. Kvalitativní změny lipoproteinů jsou dnes považovány za stejně důležité (ne-li důležitější) jako změny koncentrací jednotlivých lipidových součástí krevní plazmy [1]. O významu dyslipidemie (DLP) nepřímo svědčí i fakt, že ve všech v současnosti používaných definicích metabolického syndromu najdeme dvě „lipidová“ kritéria – zvýšení triglyceridů a pokles koncentrací HDL-cholesterolu [2,3]. Narušení metabolické přeměny lipoproteinů hraje velmi důležitou roli při vzniku a udržování inzulinové rezistence a představuje jeden z hlavních mechanizmů vzniku cévních komplikací inzulinové rezistence/diabetu 2. typu.
Několik poznámek k patofyziologii dyslipidemie u diabetiků 2. typu
Porucha metabolizmu lipidů u diabetiků 2. typu má komplexní etiopatogenezi. Vzniká na základě genetické predispozice a postiženo je více úrovní vzniku i metabolické přeměny lipoproteinů na úrovni jater, střevní mukózy i intravaskulárního metabolizmu. Pro volbu léčebných strategií představují tyto úvahy nezbytný základ, a proto se stručně zmíníme o posledních poznatcích v této oblasti.
Dědičnost dyslipidemie u diabetika
Je pravděpodobné, že genetické základy samotné inzulinové rezistence a poruchy metabolizmu lipidů spolu souvisí a dědí se nejčastěji společně [4]. Porucha glukózové homeostázy a dyslipidemie se často vyvíjejí společně už od genetického základu a tento průběh je zachován i v dalších fázích, v nichž se začnou uplatňovat vlivy vnějšího prostředí, v zásadě stejné pro rozvoj dyslipidemie jako pro zhoršování glukózové homeostázy.
Játra a diabetická dyslipidemie
Pro vznik dyslipidemie provázející inzulinovou rezistenci jsou zásadní volné mastné kyseliny excesivně uvolňované ze zmnožené tukové tkáně při viscerální/abdominální adipozitě. Jejich zvýšená koncentrace v portální krvi je signálem (i substrátem) pro zvýšení produkce na triglyceridy bohatých lipoproteinových částic VLDL v hepatocytu. Spolu s VLDL se do cirkulace dostává i větší množství hlavního lipoproteinu této částice – apolipoproteinu (Apo) B-100 – citlivého markeru aterogenního rizika dyslipidemie. Velké, triglyceridy přeplněné částice VLDL vstupují do cirkulace, v níž setrvávají déle a pomocí cholesterol-ester transferázového proteinu (CETP) předávají triglyceridy částicím LDL a HDL. Triglyceridy z těchto částic jsou odštěpovány lipázami (lipoproteinovou a jaterní), a vznikají tak zbytkové částice VLDL a částice intermediární denzity. Konečným výsledkem přeměny velkých VLDL jsou malé denzní LDL a HDL částice [5,6]. První snadno podléhají oxidační modifikaci, pronikají do subendoteliálního prostoru a jsou vychytávány makrofágy prostřednictvím scavengerových receptorů. Malé částice HDL jsou z cirkulace odstraňovány ledvinami, a tak dochází ke snížení koncentrace HDL-cholesterolu (HDL-C). Navíc však tyto malé husté (denzní) HDL částice nejsou schopny přijímat nadbytek cholesterolu z periferních tkání, a tak dochází ke zpomalení reverzního transportu cholesterolu. Současně bývají poškozeny i další z mnoha antiaterogenních funkcí HDL částic.
Uvedené změny probíhají odlišně u mužů a žen. Zatímco inzulinorezistentní muži mají zvýšenou sekreci VLDL z jater, u žen je dominantním důvodem zvýšení koncentrace triglyceridů v plazmě snížení katabolizmu (v důsledku snížení aktivity zejména lipoproteinové lipázy) [7].
Střevo a diabetická dyslipidemie
Druhým místem produkce lipoproteinů po hepatocytech je střevní stěna. Spouštěcím mechanizmem změn produkce intestinálních lipoproteinů je také zvýšený přísun volných mastných kyselin, které slouží jako intracelulární signály. U inzulinorezistentních jedinců byla popsána zvýšená aktivita hydroxymethylglutaryl-CoA-reduktázy, což je enzym, jehož aktivita limituje endogenní syntézu cholesterolu jak v hepatocytu, tak i v enterocytu. Současně je zvýšena exprese Niemannova-Pickova C1-like proteinu 1 – bílkovinného přenašeče regulujícího absorpci cholesterolu přijímaného v potravě. Regulace absorpce cholesterolu je také snížena poklesem exprese tzv. kazetových proteinů – ABCG 5 a 8, jejichž fyziologickou funkcí je „pumpování“ absorbovaného cholesterolu z enterocytu zpět do střevního lumen a z hepatocytu do žluči. Další odchylkou v procesu absorpce a syntézy lipoproteinů ve střevě osoby s inzulinovou rezistencí je zvýšená aktivita mikrosomálního transfer proteinu pro triglyceridy (MTP). MTP urychluje tvorbu chylomikronů v enterocytu a vznik VLDL částic v jaterní buňce. Všechny tyto změny podmiňují odlišnosti vstřebávání látek lipidové povahy z potravy a současně množství, složení a funkce intestinálních lipoproteinových částic (chylomikronů).
Za fyziologických okolností (a ještě více v případě hyperinzulinemie provázející inzulinovou rezistenci) stimuluje inzulin produkci apolipoproteinu B48 ve střevní stěně a spolu s ním i syntézu triglyceridů z mastných kyselin a glycerolu, a zvyšuje tak postprandiální lipidemii. Navíc absence normální schopnosti transportních systémů buněk střevní mukózy snížit resorpci cholesterolu a triglyceridů (TG) ze střevního obsahu přispívá k protrahované postprandiální (hyper)lipidemii [7]. Lipoproteinové částice, které již nejsou substrátem pro hlavní enzym zprostředkovávající hydrolýzu triglyceridů – lipoproteinovou lipázu (LPL) – se označují jako remnantní lipoproteiny. Patří sem remnanty chylomikronů a VLDL, částice IDL a všechny další lipoproteiny na cestě směrem k přeměně v LDL partikule [8]. Koncentrace remnantů často koreluje s elevací TG nalačno, ale u inzulinorezistentních jedinců nebo diabetiků byla dokumentována jejich vyšší koncentrace i při nízké lačné triglyceridemii a optimální glykemické kontrole [7]. Je prokázáno, že postprandiální akumulace remnantů je asociována s porušenou vazodilatační schopností endotelu, produkcí zánětlivých cytokinů, aktivací monocytů a zvýšením náchylnosti aterosklerotického plátu k ruptuře. Přitom za aterogenicitu těchto částic neodpovídají samotné triglyceridy, ale spíše množství cholesterolu, které transportují. Relativní proporce cholesterolu transportovaného remnantními lipoproteiny stoupá s hladinou triglyceridů měřených postprandiálně [9]. To také vysvětluje zjištění velkých metaanalýz z poslední doby, které demonstrovaly velmi nízký potenciál triglyceridemie měřené nalačno pro predikci rizika při zohlednění (adjustaci k) non-HDL-cholesterolu, HDL-cholesterolemie a dalších parametrů [10]. Naopak postprandiální triglyceridemie koreluje s rizikem mnohem těsněji a zcela nedávno panel evropských expertů poprvé představil doporučení k zavedení standardizace hodnocení postprandiální lipemie [11].
Cíle léčby diabetické dyslipidemie
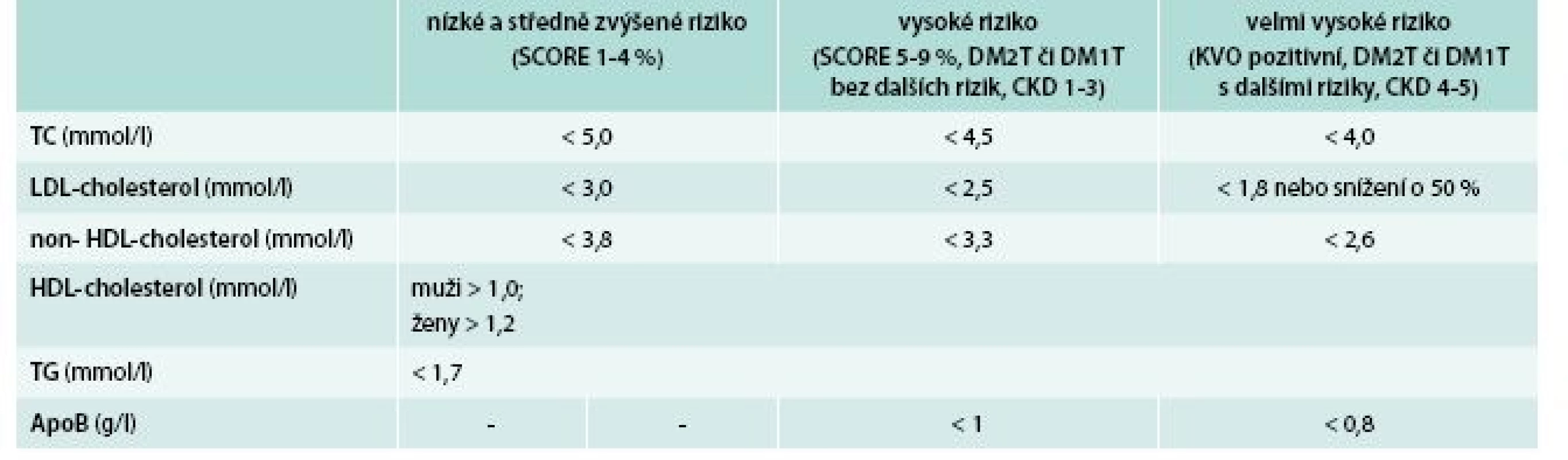
Jak připomněly předchozí odstavce, změny metabolizmu plazmatických lipoproteinů u diabetiků jsou velmi komplexní a víme, že jejich léčbou účinně naplňujeme základní cíl: snížení rizika makrovaskulárních i mikrovaskulárních komplikací diabetu. O tom, že na cestě k jeho naplnění postupujeme správně, svědčí dosažení cílových hodnot, které přes svůj sugestivní název nejsou konečným cílem léčby. Zatím platí ty z posledních doporučení pro diagnostiku a léčbu DLP v dospělosti publikovaných evropskými odbornými společnostmi v roce 2011 (tab. 1) [12]. V blízké době se dočkáme revize, která nebude méně ambiciózní. Nezapomínejme, že odhad rizika diabetické DLP a monitoraci úspěchu léčby významně zpřesňují parametry non-HDL-cholesterolu a apolipoproteinu B, které u diabetika vždy stojí za pozornost.
Léčba diabetické dyslipidemie
Jako u ostatních skupin nemocných máme i u diabetiků k dispozici opatření režimová a v případech, v nichž není jejich výsledek dostatečný, farmakologickou léčbu. Kardiovaskulární riziko osob s DM2T je vždy vysoké nebo velmi vysoké a zejména v nejvyšší rizikové kategorii se bez farmakologické léčby neobejdeme.
Nefarmakologická opatření v léčbě diabetické dyslipidemie
Principy nefarmakologické intervence u diabetiků jsou komplexní a zahrnují celou řadu doporučení změn pohybové aktivity a diety, které nemocní mají respektovat už z důvodu samotného diabetu. Jejich dodržováním se také zlepšuje kontrola dyslipidemie. V oblasti dietních a režimových opatření probíhá neustále diskuse nad některými detaily (např. doporučené množství maximální denní konzumace cholesterolu, kontroverze v otázce pití alkoholu, sledování konzumace mikronutrientů apod), ale v zásadě nemáme v poslední době novinky, které by měnily strategii nefarmakologické léčby. Základem zůstává důraz na snížení kalorického příjmu, redukci množství jednoduchých sacharidů a záměnu tuků s nevhodným složením mastných kyselin za tuky vhodnější [12,13].
Farmakologická léčba diabetické dyslipidemie
Naprostá většina diabetiků bude kandidáty hypolipidemické farmakologické léčby a úkolem ošetřujícího lékaře je vybrat vhodný postup léčby hypolipidemiky. Ve stručnosti se zmíníme o možnostech, které máme k dispozici v současnosti s důrazem na nová zjištění z poslední doby.
Statiny
Statiny představují základ léčby diabetické DLP i intervence KV rizika u diabetiků. Kromě snížení hladiny celkového a zejména LDL-cholesterolu v plazmě, snižují triglyceridy a zvyšují mírně hladinu HDL-cholesterolu, ovlivňují složení, a tím aterogenicitu lipoproteinů. Navíc disponují škálou takzvaných pleiotropních účinků. Všechny tyto mechanizmy účinku se promítají do výsledného efektu výrazného snížení relativního rizika u diabetiků léčených statinem, které bylo odhadnuto na přibližně 30% [14].
Přestože statiny v roce 2016 oslavily 30 let klinického použití, stále máme co připomínat, byť nelze hovořit o novinkách. Podobně jako u nediabetiků představuje stále důležité téma otázka titrace dávky statinu k dosažení cílové hodnoty LDL-cholesterolu a non-HDL-cholesterolu. Většina nemocných bude uspokojivě kontrolována dávkami do 40 mg atorvastatinu či 20 mg rosuvastatinu. Nejvyšší dávky statinů použijeme bez rozpaků u diabetika s manifestní ICHS nebo s anamnézou jiné aterotrombotické komplikace. Jak doložila jedna z recentních metaanalýz, při použití intenzivní terapie statinem (dávky 40 mg a více mg atorvastatinu anebo 20 mg a více mg rosuvastatinu denně) se pokles kardiovaskulárního (KV) rizika prohlubuje o dalších 9 % [15]. Je třeba se vyhnout dávkám simvastatinu nad 40 mg denně, u nichž se významně zvyšuje riziko svalové toxicity. Maximální dávka rosuvastatinu je kontraindikována u osob s chronickým renálním onemocněním 3. a vyššího stupně.
Relativní novinku mezi statiny představuje poslední „přírůstek do rodiny“ pitavastatin. Ten zatím v Česku není k dispozici. Výsledky výzkumu i klinická zkušenost z oblastí, v nichž je již několik používán, naznačují, že právě u diabetiků by tento statin mohl mít své uplatnění. Zdá se, že příznivěji ovlivňuje parametry glukózové homeostázy, vhodně modifikuje metabolizmus HDL částic (ovlivněním cholesterol ester transferázového proteinu – CETP), má uspokojivý profil nežádoucích účinků i relativně nižší potenciál k lékovým interakcím [16]. Pitavastatin má evropskou registraci od roku 2010, avšak zatím s jeho uvedením na český trh nemůžeme počítat.
Ezetimib
Selektivní blokátor intestinální absorpce cholesterolu ezetimib je lékem 2. volby k dosažení cílové hladiny LDL-cholesterolu vhodný pro použití i u diabetiků. Jeho hlavním mechanizmem účinku je blokáda specifického transportního proteinu (Niemann-Pick C1 like 1 protein), který je zodpovědný za přenos cholesterolu ze střevního lumen do enterocytu. Příznivě pro ezetimib vyzněly výsledky studie SHARP (Study of Heart And Renal Protection) provedené u pacientů s renální insuficiencí, ve které kombinace simvastatinu s ezetimibem snížila významně riziko vaskulárních příhod [17]. V nedávné době byla také publikována zajímavá sdělení o příznivém vlivu ezetimibu na metabolizmus tukové tkáně, produkci adipocytárních působků i na inzulinovou senzitivitu.
Zásadní informace ale přinesla publikace studie IMPROVE-IT (IMProved Reduction of. Outcomes: Vytorin Efficacy. International Trial), a zejména pak následné, předem specifikované analýzy diabetické subpopulace [18,19]. Do studie bylo zařazeno 18 144 pacientů s anamnézou akutního koronárního syndromu (AKS). Pacienti byli zařazeni do 2 větví, v první byl použit simvastatin 40 mg v monoterapii, ve druhé byla použita kombinace simvastatinu s ezetimibem 40/10 mg.
Primárním cílovým ukazatelem studie IMPROVE-IT je složený ukazatel zahrnující úmrtí z KV příčin, IM nevedoucí k úmrtí, nefatální CMP a hospitalizaci pro nestabilní AP či koronární revaskularizaci vyskytující se nejméně 30 dní po randomizaci. Během 7 let trvání studie došlo u 32,7 % pacientů užívajících kombinační léčbu k manifestaci primárního cíle ve srovnání s 34,7 % pacientů užívajících monoterapii simvastatinem (hazard ratio 0,936, P = 0,016). Tento statisticky významný rozdíl tedy prokazuje, že přidání ezetimibu k terapii statinem vede k dalšímu snížení KV rizika, resp. KV příhod. Pokud srovnáme hladiny LDL-cholesterolu v obou léčených ramenech (střední hladina LDL-cholesterolu 1,4 mmol/l v případě kombinační léčby vs 1,8 mmol/l u monoterapie), snížila kombinační léčba o 6,4 % relativní riziko, a tím IMPROVE-IT potvrdila léčebný efekt, který již dříve ukázaly studie se statiny. Jedná se tedy o potvrzení „LDL hypotézy“ rozvoje aterosklerózy a rovněž hypotézy, že pro LDL-cholesterol platí „čím níže, tím lépe“.
Ve studii IMPROVE-IT bylo zařazeno celkem 4 933 pacientů s diabetes mellitus, diagnóza diabetu byla stanovena již před vstupem do studie. Zbývajících 13 202 zařazených pacientů diabetes nemělo. Skupiny diabetiků a nediabetiků se od sebe lišily již při vstupu do studie v základní charakteristice (věk, BMI, kouření, zastoupení mužů a žen) i z hlediska anamnézy předchozích onemocnění (předchozí infarkt myokardu, angioplastika či bypass, hypertenze) a z hlediska předchozí léčby (aspirin, statiny, betablokátory, RAA inhibitory). Diabetici byli starší, měli vyšší BMI, bylo mezi nimi více žen a osob s hypertenzí, ale méně kuřáků. Více diabetiků bylo také léčeno aspirinem, statiny, betablokátory a inhibitory systému renin-angiotenzin-aldosteron a více diabetiků také před vstupem do studie prodělalo IM, angioplastiku či bypass. Co se týká krevních lipidů, ve skupině diabetiků byla nižší výchozí hladina LDL-cholesterolu a HDL-cholesterolu, vyšší byla hladina triglyceridů (tab. 2).
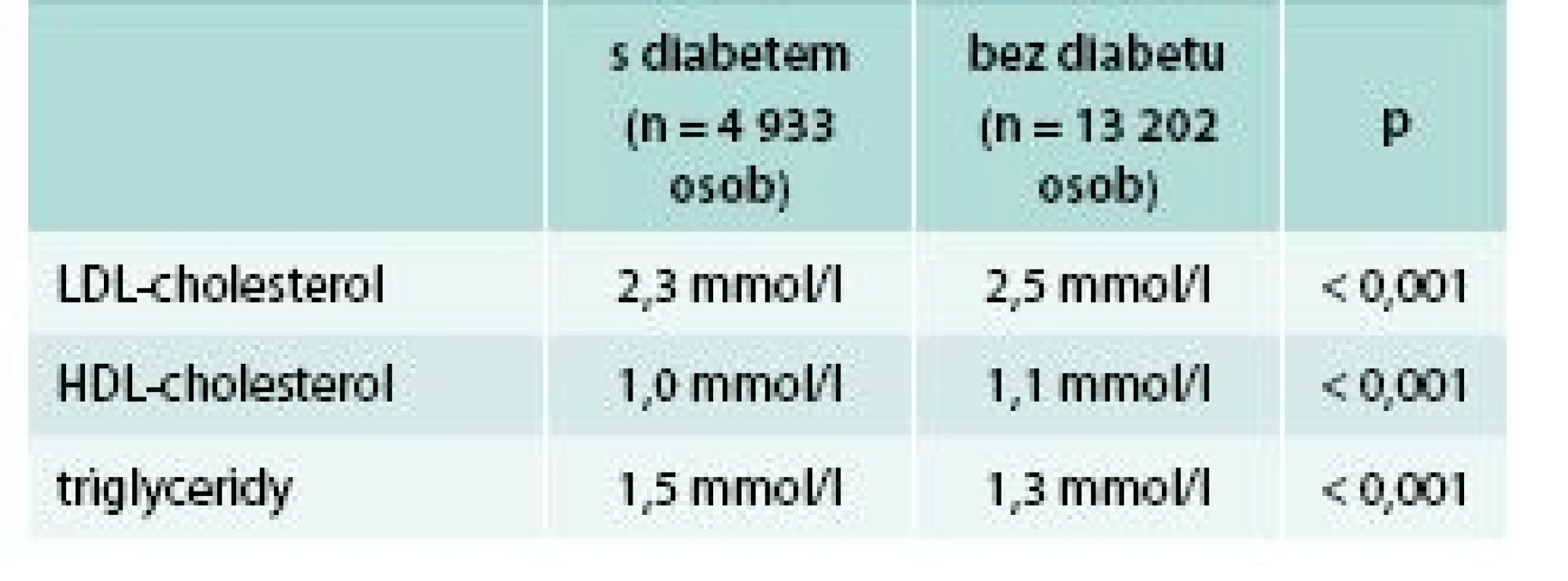
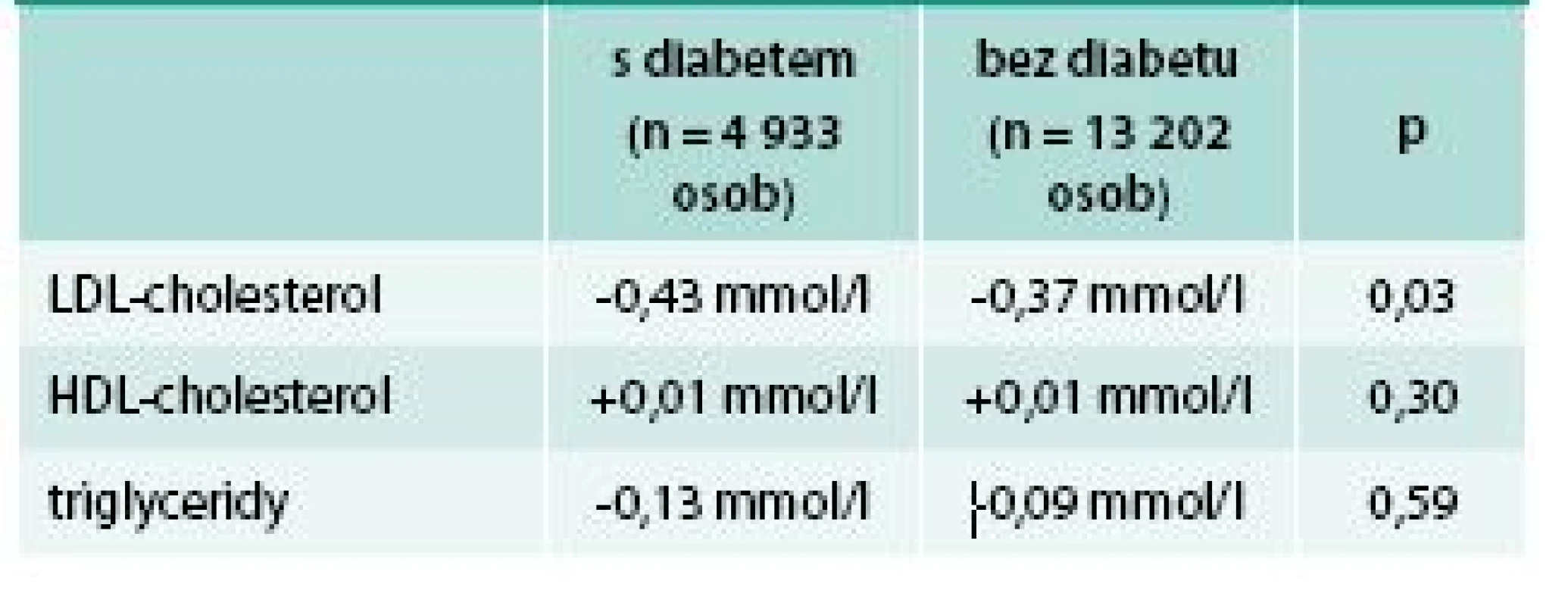
U diabetiků byl vyšší i C-reaktivní protein (5,6 vs 5,0 mg/l). Léčba kombinací simvastatin + ezetimib vedla k většímu poklesu LDL-cholesterolu u diabetiků než u nediabetiků, rozdíl byly statisticky významný, zatímco další lipidové parametry významně ovlivněny nebyly (tab. 3).
Zásadní rozdíl mezi diabetiky a nediabetiky byl ale v primárním cíli celé studie: u diabetiků došlo k signifikantnímu (p < 0,023) snížení počtu příhod o 14 % (HR 0,86; CI 0,87–0,94), zatímco u nediabetiků nebyl pokles kardiovaskulárních příhod statisticky významný – snížení o 2 % (HR 0,98; CI 0,91–1,04). Snížení počtu kardiovaskulárních příhod u diabetiků bylo dáno především poklesem výskytu infarktů myokardu a ischemických CMP. Z hlediska bezpečnosti léčby nebyl rozdíl ve výskytu nežádoucích účinků mezi diabetiky a nediabetiky. Z této subanalýzy vyplývá, že z přidání ezetimibu ke statinu profitovali podstatně více (resp. pouze) nemocní s DM2T. Vysvětlením může být výraznější snížení LDL-cholesterolu u diabetiků, příznivý vliv na glukózovou homeostázu i další efekty [19].
Data z IMPROVE-IT potvrdila správnost zachování postavení ezetimibu v léčbě diabetiků. Většinou to bude v kombinaci se statiny u těch, u nichž ani maximální tolerovaná dávka statinů nepovede k dosažení cílové hodnoty LDL-cholesterolu. Právě u diabetiků bychom benefit spojený s podáváním ezetimibu neměli opomíjet a „sáhnout“ k jeho použití významně častěji než v minulosti.
Pryskyřice
Pryskyřice jsou nejstaršími užívanými hypolipidemiky. Jejich účinnost je relativně malá a snášenlivost neuspokojivá – většina pacientů pro gastrointestinální nežádoucí účinky (obstipace, meteorizmus) léčbu není schopna dlouhodobě tolerovat. Přesto mají zajímavé výhody zejména v kontextu DM2T, a i proto si zaslouží objevit se v přehledu o budoucnosti léčby diabetické dyslipidemie.
Pryskyřice lze totiž považovat nejen za hypolipidemika, ale svým způsobem i za antidiabetika. Teprve v poslední době byly vysvětleny dříve známé vztahy mezi podáváním pryskyřic a zlepšováním glukózové homeostázy. Snížení přísunu žlučových kyselin do hepatocytu vede ke kaskádě pochodů, v jejichž centru stojí nitrojaderný receptor označovaný LXR. Jeho aktivací klesá glukoneogeneze v hepatocytu, zvyšuje se exprese glukózového transportéru GLUT4 v membráně tukových buněk a roste sekrece inzulinu z B-buněk pankreatu. Tak lze vysvětlit klinicky významné zlepšení kompenzace diabetu zjištěné v klinických studiích s pryskyřicemi [20].
Bohužel aktuálně máme k dispozici pouze preparát cholestyraminu, který nevyniká snášenlivostí ani v rámci skupiny pryskyřic. Ideální pro použití (nejen u diabetiků) se jeví vysoce polymerní přípravky pryskyřic (např. kolesevelam), které mají zachovanou účinnost, ale užívají se v množstvích přibližně 10krát nižších, než standardní přípravky. Tomu odpovídá i významně lepší tolerance nemocnými, ale také významně vyšší cena.
Fibráty
Fibráty jsou agonisté nitrojaderných receptorů PPARα, a proto mají komplexní působení. Zvyšují lipolýzu prostřednictvím aktivace lipoproteinové lipázy, snižují produkci na triglyceridy bohatých částic v hepatocytu, indukují β-oxidaci mastných kyselin a jejich zvýšenou utilizaci v jaterní buňce, zvýšení syntézy apoproteinů AI a AII. Těmito mechanizmy je vysvětlitelná fibráty navozená změna v kvantitě, ale i kvalitě lipoproteinových částic krevní plazmy.
Dnes je nejrozšířenějším fenofibrát. Jak dokumentovaly provedené studie, podávání fenofibrátu je spojeno s poklesem rizika KV onemocnění u osob s typickou smíšenou DLP provázející diabetes (někdy označovanou aterogenní DLP). Tato zjištění potvrzují logický předpoklad – léčba fibrátem je efektivní pouze u osob, které mají hypertriglyceridemii a sníženou hladinu HDL-cholesterolu. Fenofibrát prošel i dosud jedinou klinickou studií hodnotící kombinaci statinu s fibrátem. Diabetici 2. typu v ní byli randomizováni k podávání kombinace statin + placebo nebo statin + fenofibrát. Kombinační léčba snižovala riziko makrovaskulárních komplikací opět pouze u osob s typickou „diabetickou“ dyslipidemií (vysoké TG a nízká hladina HDL-cholesterolu). Byl potvrzen příznivý vliv fibrátu na vznik a rozvoj mikrovaskulárních komplikací. Studie ACCORD také prokázala, že bezpečnost kombinace statinu s fenofibrátem byla srovnatelná s monoterapií statinem a léčba byla provázena minimem nežádoucích účinků [21,22].
Fibráty jsou indikovány jako iniciální terapie u všech diabetiků s hypertriglyceridemií nad 4 mmol/l nalačno. U ostatních se fibrát uplatní v kombinaci se statinem nebo ezetimibem při snaze o ovlivnění všech složek diabetické dyslipidemie. Jak bylo uvedeno v předchozím odstavci, přidání fibrátu ke statinu prohloubí LDL snižující účinek o 10–15 %, což je nesporně dalším významným „pro“ časné zahájení kombinační léčby. V souladu s výsledky klinických studií a na jejich základě formulovaných doporučení odborných společností přidáme k zavedené terapii statinem fibrát u těch diabetiků, u nichž přetrvává zvýšení hladin TG > 2,3 mmol/l a/nebo koncentrace HDL-cholesterolu < 1,0 mmol/l [12].
S ohledem na příznivé působení terapie fenofibrátem na mikrovaskulární komplikace diabetu bychom uvítali samostatnou indikaci fenofibrátu jako prostředku pro léčbu diabetické retinopatie, která již byla přijata v některých mimoevropských zemích [22]. Dokumentace je jistě dostatečná, ale administrativní bariéry zatím v evropském prostoru tuto indikaci oddalují.
I skupina fibrátů se vyvíjí a modernizuje. Zatím posledním přírůstkem v tomto směru byl fenofibrát ve formě nanočástic. Dalším zmenšením částic fenofibrátu se zlepšuje biologická dostupnost, a tím i účinnost léčiva, což umožňuje při zachování účinku snížit množství podávané účinné látky. Nezanedbatelný může být také fakt, že nano-fenofibrát lze užívat bez souvislosti s jídlem, a tím se zjednodušuje schéma podávání [23].
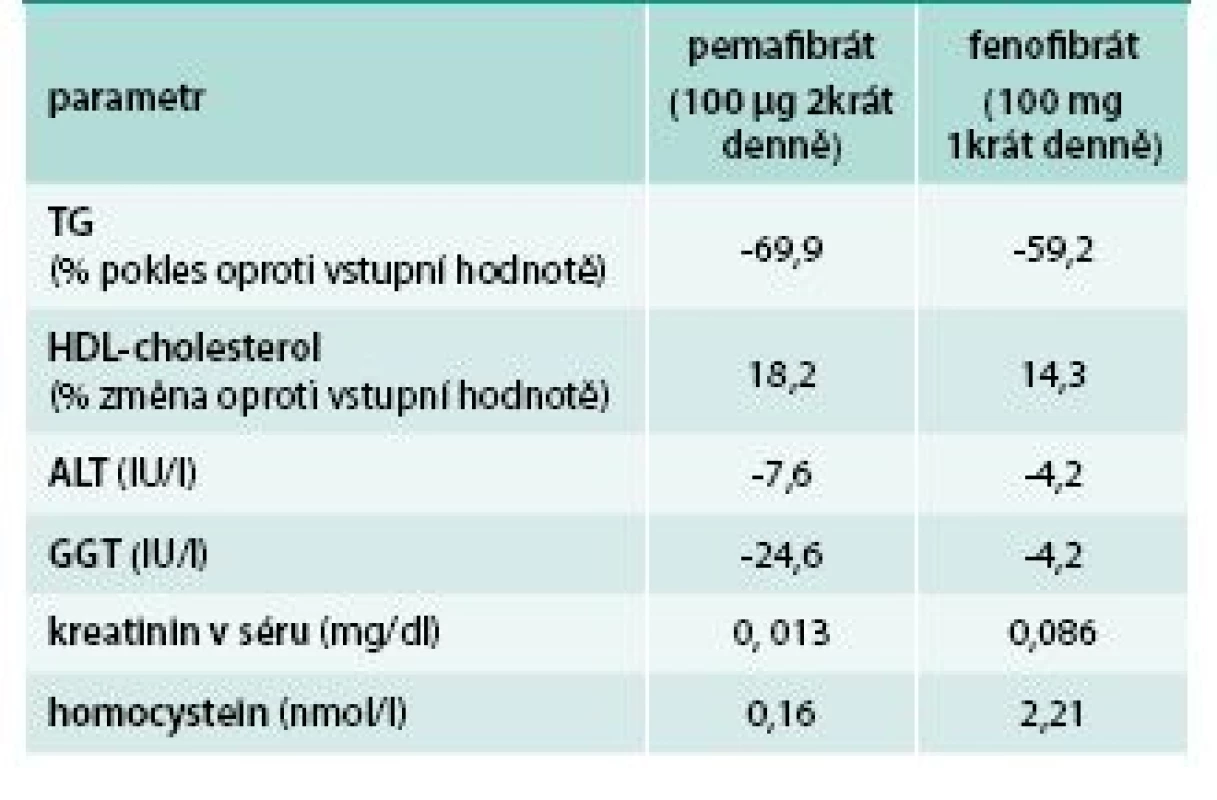
Zásadnější inovací možností ovlivnění lipidového metabolizmu prostřednictvím regulace funkce peroxismal proliferator-activated receptorů (PPAR) jsou takzvané selektivní modulátory PPAR (SPPARM). Cílem vývoje těchto látek je zvýšení žádoucí efektivity agonizace PPARα receptorů za současného potlačení nežádoucích reakcí agonizace ostatních subtypů PPAR (γ, δ). Navíc by SPPARM měly mít lepší tkáňovou specificitu. První selektivní modulátor PPARα – pemafibrát (K-877) postoupil do 3. fáze klinických zkoušek [24]. První výsledky srovnávající fenofibrát a pemafibrát ukazují na rozdíly v účinnosti i spektru dalších efektů, které naznačují možné budoucí využití třídy SPPARMα modulátorů u pacientů s inzulinovou rezistencí a nealkoholickým steatotickým jaterním onemocněním (NAFLD), tab. 4.
Fixní kombinace hypolipidemik v léčbě dyslipidemie u diabetiků
Logickým trendem farmakoterapie, a to nejen v kardiovaskulární oblasti, tento trend se nevyhýbá ani hypolipidemické léčbě, jsou v poslední době fixní kombinace. Fixní kombinace zavedených léčiv patří do pojednání o nových možnostech léčby i v kontextu diabetické dyslipidemie.
Delší dobu máme k dispozici fixní kombinaci simvastatinu (v dávce 20 nebo 40 mg) s ezetimibem. Ta získala díky výše komentované studii IMPROVE-IT také doklady o pozitivním vlivu na prognózu pacientů diabetiků v sekundární prevenci. V současnosti je připravena fixní kombinace ezetimibu s atorvastatinem i rosuvastatinem, které sice ještě nebyly uvedeny na český trh, ale jejich příchod lze očekávat v krátkém časovém horizontu. Kombinace ezetimibu s těmito modernějšími a účinnějšími statiny je již delší dobu používána ve volné kombinaci léčiv, máme s ní dobrou vlastní zkušenost a disponuje i doklady z menších klinických studií. S ohledem na vyšší hypolipidemickou účinnost atorvastatinu a rosuvastatinu lze počítat s tím, že použití těchto fixních kombinací přivede větší procento pacientů k cílovým hodnotám LDL-cholesterolu a klinické využití těchto fixních kombinací se ještě rozšíří.
Do klinické praxe se také dostala první fixní kombinace statinu s fenofibrátem. Obsahuje simvastatin v dávce 20 nebo 40 mg spolu s uniformní dávkou fenofibrátu ve formě nanočástic v množství 145 mg. Tato poslední léková forma fenofibrátu zlepšila dále biologickou dostupnost léčiva po perorálním podání, a umožnila tak snížení celkového množství podávané látky při zachování efektu odpovídajícímu přibližně 215 mg mikronizovaného fenofibrátu. Navíc byla odbourána závislost na podávání s jídlem, kterou předchozí lékové formy fenofibrátu měly [25]. S ohledem na simvastatin obsažený v tabletě fixní kombinace je nutné lék užívat večer (simvastatin má krátký biologický poločas a je žádoucí, aby maximum účinku pokrylo noční maximum produkce cholesterolu v játrech).
Kromě fixních kombinací dvou léčiv ovlivňujících hladiny aterogenních lipoproteinů máme k dispozici i tablety kombinující statin s antihypertenzivem. Několik let využíváme fixní kombinaci atorvastatinu s amlodpinem. Tato kombinace hypolipidemika a antihypertenziva má ověřenou synergickou účinnost v rozsáhlé studii ASCOT (Anglo-Scandinavian Cardiac Outcomes Trial), jež dokumentovala pokles relativního rizika KV příhody o více než jednu třetinu právě při použití léčby založené na této (byť ne fixní) kombinaci léčiv případně „obohacené“ perindoprilem. Kombinací dvou léčiv s dlouhým biologickým poločasem, klinicky ověřenou dobrou snášenlivostí a účinností, která je v kombinaci dokonce lepší než v monoterapii, představuje fixní kombinace atorvastatinu s amlodipinem vhodnou volbu pro široké spektrum nemocných. Navíc víme, že současné zahájení antihypertenzivní a hypolipidemické terapie zvyšuje šanci na dosažení dobré adherence o jednu třetinu [26].
Dobré zprávy v oblasti vývoje fixních kombinací nekončí. V nejbližší době se dočkáme fixní trojkombinace vycházející ze zkušeností studie ASCOT: tedy kombinace dvou antihypertenziv (amlodipin + perindopril) a hypolipidemika (atorvastatin). S ohledem na velmi širokou indikaci použitých antihypertenziv i statinu zvoleného pro tuto fixní kombinaci jde o trojkombinaci vhodnou pro řadu pacientů v úvodu léčby i jako její pokračování. Zásadní argument představuje synergie působení zvolených účinných látek z hlediska ovlivnění progrese aterosklerózy doložená poklesem rizika koronárních příhod ve výše zmíněné studii ASCOT o více než 50 % [27].
Dávkování první fixní trojkombinace bude v širokém rozmezí atorvastatinu 10–40 mg, perindoprilu i amlodipinu ve shodných gramážích 5–10 mg. Budeme tedy mít vhodné dávkování pro pacienty zahajující terapii i pro případnou titraci v rámci 5 dostupných dávkovacích schémat.
Výhody fixních kombinací oceňujeme my i naši pacienti. Je jich zřejmě více nežli nevýhod, mezi které počítáme menší flexibilitu dávkování a nejistotu při vzniku nežádoucích účinků. Někdy může pro nemocné být obtížnější orientovat se ve spektru léčiv a vzniká riziko souběžného užívání téže účinné látky (nebo lékové skupiny) ve fixní kombinaci a ještě jako samostatně podávaného léčiva. Tomu lze předejít pečlivou edukací a spoluprací s lékárnou, která má zásadní roli při udržování správné farmakoterapie v dobách možnosti generické substituce.
Budoucnost léčby diabetické dyslipidemie
Poslední část tohoto přehledu věnujeme skutečným novinkám – farmakoterapiím, které se nacházejí v různé fázi klinického testování a s nimiž zatím běžně nemáme možnost pracovat.
Monoklonální protilátky proti PCSK9: PCSK9 inhibitory
Monoklonální protilátky proti proprotein konvertáze subtilisin/kexin 9 (PCSK9), dnes označované za PCSK9 inhibitory, představují nejnadějnější a nejpokročilejší zcela novou lékovou skupinu v léčbě hypercholesterolemie a snižování kardiovaskulárního rizika. Dva zástupci PCSK9 inhibitorů – alirokumab (Praluent®, výrobce SANOFI/REGENERON) a evolokumab (Repatha®, výrobce AMGEN) již byly schváleny pro léčbu hypercholesterolemie nedostatečně kontrolované v současnosti dostupnými léčebnými možnostmi.
Dat a výsledků klinických studií s PCSK9 inhibitory přibývá geometrickou řadou a i přehledů v našem písemnictví máme k dispozici hned několik [28,29]. Můžeme tedy shrnout současné zkušenosti a pokusit se najít společné vlastnosti PCKS9 inhibitorů.
Všechny PCSK9 inhibitory jsou podávány ve formě subkutánních injekcí 1krát za 2–4 týdny. Dávkování alirokumabu je 75–150 mg/2 týdny a evolokumab je podáván v dávce 140 mg/2 týdny nebo 420 mg/4 týdny.
Rychlá kumulace dat z klinických studií dala vzniknout i prvním metaanalýzám [30]. Ty shrnuly výsledky 24 studií s více než 10 000 účastníky studií s PCSK9 inhibitory. Lipidové efekty byly pozoruhodně konzistentní a jako vždy jim dominovalo výrazné snížení LDL-cholesterolu, které bylo pozorováno uniformně ve všech studiích a pohybovalo se mezi 56–62 % ve srovnání se vstupními hodnotami ve studiích srovnávajících aktivní léčbu proti terapii placebem v kontextu monoterapie statinem. Ilustraci změn lipidových hladin při podávání PCSK9 inhibitorů uvádí graf 1 [31,32].

PSCK9 inhibitory mají i další společné vlastnosti. Především jsou obecně velmi dobře tolerovány a výskyt nežádoucích účinků se zatím zdá být podobný jako v placebových větvích výše citovaných studií. Problémem není ani subkutánní forma podání, naopak zdá se, že řada pacientů by dokonce preferovala možnost aplikace v intervalu 1krát za 14–30 dnů před každodenním podáváním tablet.
O PCSK9 inhibitorech právě rozhodují české regulační úřady a probíhá jednání o úhradách i způsobu preskripce. Prioritou bude léčba nemocných, kteří nedosahují cílových hodnot LDL-cholesterolu při maximální tolerované dávce dostupných hypolipidemik v kontextu [33]:
- familiární hypercholesterolemie (FH)
- statinové intolerance (vymezené podle současných doporučení)
- sekundární prevence KVO s dalšími rizikovými faktory nebo primární prevence KVO s velmi vysokým rizikem při kombinaci více závažných rizikových faktorů KVO
Dnes máme k dispozici i první data týkající se specificky léčby PCSK9 i u diabetiků 2. typu [34]. V nedávné době byla publikována souhrnná data o účinnosti a bezpečnosti evolokumabu u této populace, která doložila očekávatelný výsledek: diabetici reagují na podávání terapie blokující PCSK9 stejně jako nediabetici (tab. 5).
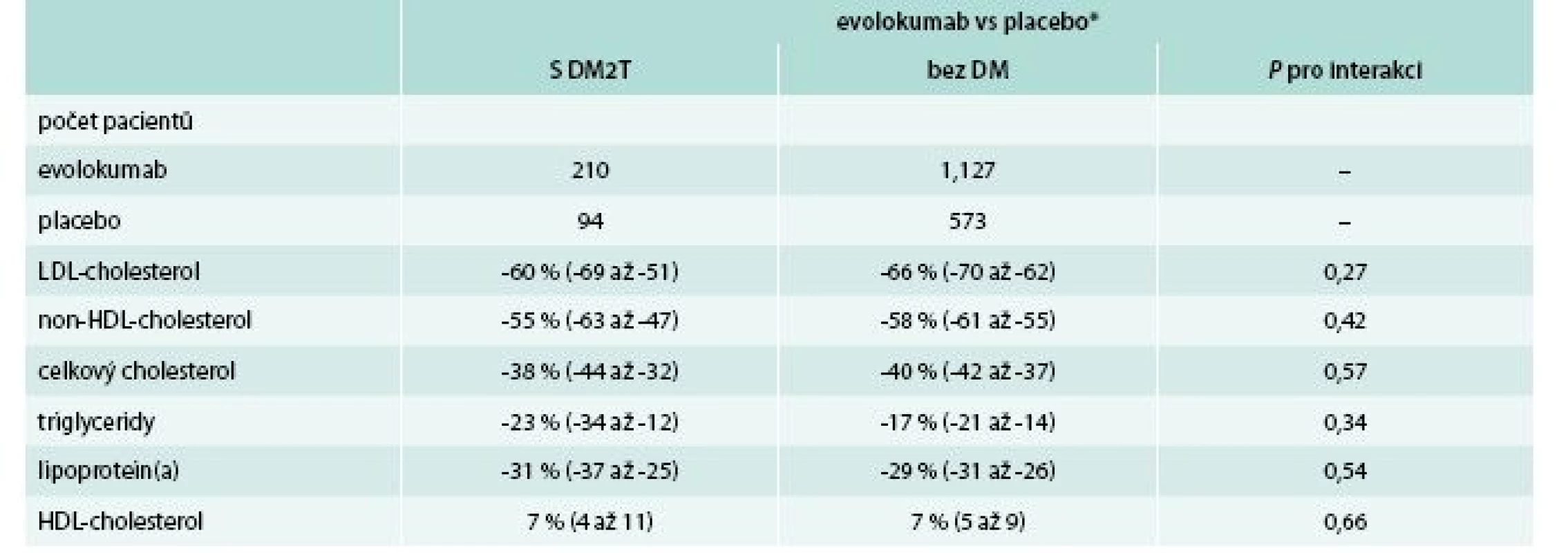
Lze tedy předpokládat, že i u diabetiků najdou PCSK9 inhibitory své uplatnění a diabetická populace bude jednou z priorit použití PCSK9 inhibitorů v rámci (nebo v těsné návaznosti za) výše uvedených populačních skupin.
Nová hypolipidemika v klinickém testování
Zatímco výše komentované novinky již byly uznány a registrovány, v různých fázích klinického zkoušení se nachází další terapie cílící na metabolizmus plazmatických lipoproteinů.
Anti-sense terapie
Anti-sense terapie používá princip blokády translace proteinu interferencí s messengerovou RNA (mRNA), na kterou se váže komplementární oligonukleotid zamezující přepisu genetické informace. Nejblíže klinické praxi se přiblížil mipomersen, antisense mRNA oligonukleotid 2. generace, blokující translaci mRNA pro apolipoprotein B100. Nefunkční mRNA pro apolipoprotein B100 podléhá rozkladu endoribonukleázou. Tímto mechanizmem mipomersen komplexně ovlivňuje produkci všech lipoproteinů obsahujících apolipoprotein B100 (VLDL, IDL i LDL). V klinické praxi to znamená, že se snižuje koncentrace apolipoproteinu B a hladina LDL-cholesterolu o 25–60 % [35]. Tento lék lze použít u heterozygotů, ale i homozygotů familiární hypercholesterolemie. Podobně jako většina nově testovaných hypolipidemik se přípravek obvykle užívá jako přídatná terapie k maximální tolerovatelné dávce statinů. Zatímco americká léková agentura FDA (Food and Drug Administration) schválila použití mipomersenu u nemocných s homozygotní FH, evropská EMA (European Medicine Agency) si vyžádala další výsledky klinických studií a zatím mipomersen v Evropě k použití neschválila.
Princip blokády translace komplementárními oligonukleotidy se ale v lipidologii testuje mnohem šířeji. V různých fázích klinických zkoušení se nacházejí anti-sense mRNA proti lipoproteinu(a), apolipoproteinu CIII, PCSK9, nebo ANGPTL3 [36]. Slibné výsledky ukázaly první práce s anti-sense proti apolipoproteinu CIII, které redukují hladiny zejména na triglyceridy bohatých aterogenních lipoproteinů a působí komplementárně s agonisty PPARα receptorů – fibráty (graf. 2).

S ohledem na charakteristiky posledně jmenovaného zástupce nových biologických terapií opět můžeme očekávat, že jeho uplatnění u diabetiků 2. typu by mohlo být širší než v nediabetické populaci. Jisté je, že do klinického užití zbývá tomuto přípravku ještě delší cesta výzkumným programem.
Shrnutí
Ovlivnění lipoproteinového metabolizmu u diabetika představuje zásadní možnost ovlivnění prognózy a rizika mikrovaskulárních a makrovaskulárních komplikací diabetu. V poslední době klademe důraz na správné použití zavedených léčebných možností, dostáváme do rukou nové kombinace „tradičních“ hypolipidemik. Dyslipidemie se opět dostaly do centra pozornosti nejen výzkumníků, ale také farmaceutických a zejména biotechnologických společností. Jsme svědky neuvěřitelně rychlého přechodu od objevu nových mechanizmů a faktorů ovlivňujících metabolizmus lipoproteinů po vývoj látek, které jejich funkci modulují. Typický příklad představují monoklonální protilátky proti PCSK9. Role PCSK9 v katabolizmu LDL receptoru popsali Cohen s Hobbsovou v roce 2006 a dnes již probíhají klinické studie fáze 3 se specifickými protilátkami blokujícími funkci tohoto proteinu, které navíc byly schváleny pro léčbu dyslipidemií v Evropě i zámoří. Lze tedy předpokládat, že i další možnosti testovaných cílených terapií založených na biotechnologických postupech projdou rychle preklinickými zkouškami a slibné směry se dostanou až k testování v kohortách nemocných. Naplní-li se očekávání založená na dosavadních výsledcích zkoušek i patofyziologických představách o roli lipoproteinů v aterogenezi, věřme, že se díky novým terapiím otevře nemocným další možnost snížení reziduálního kardiovaskulárního rizika. Jak víme, právě u diabetiků je reziduální kardiovaskulární riziko pravidelně významně zvýšeno. I proto nové možnosti lipidy modifikující terapie představují u těchto pacientů další způsob zlepšení prognózy a snížení rizika aterotrombotických komplikací.
Podpořeno granty AZV č. 15–28277A a 15–28876A.
doc. MUDr. Michal Vrablík, Ph.D.
vrablikm@seznam.cz
Centrum preventivní kardiologie, III. interní klinika – klinika endokrinologie a metabolizmu 1. LF UK a VFN v Praze
www.vfn.cz
Doručeno do redakce 11. 8. 2016
Přijato po recenzi 15. 8. 2016
Sources
1. Češka R. Cholesterol a ateroskleróza, léčba dyslipidémií. Triton: Praha 2005. ISBN 80–7254–738–0.
2. Alberti KGMM, Zimmet P, Shaw J. The metabolic syndrome – new worldwide definition. Lancet 2005; 366(9491): 1059–1062.
3. Grundy SM, Cleeman JI, Merz CN et al. [Coordinating Committee of the National Cholesterol Education Program]. Implications of recent clinical trials for the National Cholesterol Education Program Adult Treatment Panel III guidelines. Arterioscler Thromb Vasc Biol 2004; 24(8): e149-e161.
4. Lusis AJ, Mar R, Pajukanta P. Genetics of atherosclerosis. Annu Rev Genomics Hum Genet 2004; 5 : 189–218.
5. Adiels M, Olofsson SO, Taskinen MR et al. Overproduction of very low-density lipoproteins is the hallmark of the dyslipidemia in the metabolic syndrome. Atheroscler Thromb Vasc Biol 2008; 28(7): 1225–1236.
6. Hsieh J, Hayashi AA, Webb J et al. Postprandial dyslipidemia in insulin resistence: Mechanisms and role of intestinal insulin sensitivity. Atheroscler Suppl 2008; 9(2): 7–13. Dostupné z DOI: <http://dx.doi.org/10.1016/j.atherosclerosissup.2008.05.011>.
7. Rivellese AA, De Natale C, Di Marino L et al. Exogenous and endogenous postprandial lipid abnormalities in type 2 diabetic patients with optimal blood glucose control and optimal fasting triglyceride levels. J Clin Endocrinol Metab 2004; 89(5): 2153–2159.
8. Varbo A, Benn M, Nordestgaard BG. Remnant cholesterol as a cause of ischemic heart disease: evidence, definition, measurement, atherogenicity, high risk patients, and present and future treatment. Pharmacol Ther 2014; 141(3): 358–367.
9. Jorgensen AB, Frikke-Schmidt R, West AS et al. Genetically elevated non-fasting triglycerides and calculated remnant cholesterol as causal risk factors for myocardial infarction. Eur Heart J 2013; 34(24): 1826–1833.
10. Nordestgaard BG, Varbo A. Triglycerides and cardiovascular disease. Lancet 2014; 384(9943): 626–635.
11. Nordestgaard BG, Langsted A, Mora S et al. Fasting is not routinely required for determination of a lipid profile: clinical and laboratory implications including flagging at desirable concentration cut-points-a joint consensus statement from the European Atherosclerosis Society and European Federation of Clinical Chemistry and Laboratory Medicine. Eur Heart J 2016; 37(35): 1944–1958.
12. Catapano AL, Reiner Z, De Backer G et al. ESC/EAS Guidelines for the management of dyslipidaemias The Task Force for the management of dyslipidaemias of the European Society of Cardiology (ESC) and the European Atherosclerosis Society (EAS). Atherosclerosis 2011; 217(1): 3–46.
13. Soška V. Léčba dyslipidemie u diabetiků. Interní Med 2007; 9(4): 163–166.
14. Kearney PM, Blackwell L, Collins R et al. [Cholesterol Treatment Trialists’ (CTT) Collaborators]. Efficacy of cholesterol-lowering therapy in 18686 people with diabetes in 14 randomised trials of statins: a meta-analysis. Lancet 2008; 371(9607): 117–125.
15. de Vries FM, Kolthof J, Postma MJ et al. Efficacy of Standard and Intensive Statin Treatment for the Secondary Prevention of Cardiovascular and Cerebrovascular Events in Diabetes Patients: A Meta-Analysis. PLoS ONE 2014; 9(11): e111247. Dostupné z DOI: <http://dx.doi.org/10.1371/journal.pone.0111247>.
16. Huang CH, Huang YY, Hsu BR. Pitavastatin improves glycated hemoglobin in patients with poorly controlled type 2 diabetes. J Diabet Invest 2016; Jan 18. Dostupné z DOI: <http://dx.doi.org/10.1111/jdi.12483>.
17. Baigent C, Landray MJ, Reith C et al. [SHARP Investigators]. The effects of lowering LDL cholesterol with simvastatin plus ezetimibe in patients with chronic kidney disease (Study of Heart and Renal Protection): a randomised placebo-controlled trial. Lancet 2011; 377 (9784): 2181–2192.
18. Cannon CP, Blazing MA, Giugliano RP et al. [IMPROVE-IT Investigators]. Ezetimibe added to statin therapy after acute coronary syndromes. N Engl J Med 2015; 372(25): 2387–2397.
19. Špinar J, Špinarová L, Vítovec J. Studie IMPROVE-IT u pacientů s diabetes mellitus. Kardiol Rev Int Med 2015; 17(3): 253–256.
20. Handelsman Y. Role of bile acid sequestrants in the treatment of type 2 diabetes. Diabetes Care 2011; 34(Suppl 2): S244-S250.
21. Ginsberg HN, Elam MB, Lovato LC et al. [ACCORD Study Group]. Effects of combination lipid therapy in type 2 diabetes mellitus. N Engl J Med 2010; 362(17): 1563–1574.
22. Wright AD, Dodson PM. Medical management of diabetic retinopathy: fenofibrate and ACCORD Eye studies. Eye (Lond) 2011; 25(7): 843–849.
23. Cha KH, Cho KJ, Kim MS et al. Enhancement of the dissolution rate and bioavailability of fenofibrate by a melt-adsorption method using supercritical carbon dioxide. Int J Nanomedicine 2012; 7 : 5565–5575. Dostupné z DOI: <http://dx.doi.org/10.2147/IJN.S36939>.
24. Fruchart JC. Selective peroxisome proliferator-activated receptorα modulators (SPPARMα): The next generation of peroxisome proliferator-activated receptor α-agonists. Cardiovasc Diabetol 2013; 12 : 82. Dostupné z DOI: <http://dx.doi.org/10.1186/1475–2840–12–82>.
25. Foucher C, Aubonnet P, Reichert P et al. [Cholib study Investigators]. New Fixed-Dose Combinations of Fenofibrate/Simvastatin Therapy Significantly Improve the Lipid Profile of High-Risk Patients with Mixed Dyslipidemia Versus Monotherapies. Cardiovasc Ther 2015; 33(6): 329–337.
26. Hatala R, Pella D, Hatalová K et al. Optimization of blood pressure treatment with fixed-combination perindopril/amlodipine in patients with arterial hypertension. Clin Drug Investig 2012; 32(9): 603–612.
27. Sever P, Dahlof B, Poulter N et al. [ASCOT Steering Committee Members]. Potential synergy between lipid-lowering and blood-pressure lowering in the Anglo-Scandinavian Cardiac Outcomes Trial. Eur Heart J 2006; 27(24): 2982–2988. Erratum in Eur Heart J 2007; 28(1): 142.
28. Vrablík M. Biologická léčba v kardiologii: nové studie s protilátkami proti PCSK9. Acta Medicinae 2015; 4(1): 15–18.
29. Češka R. Inhibice PCKS9 jako nová naděje pro nemocné s familiární hypercholesterolemií, statinovou intolerancí a posléze pro všechny pacienty v nejvyšším kardiovaskulárním riziku? Zaměřeno na alirocumab – Praluent. Vnitř Lék 2015; 61(11): 946–951.
30. Lipinski MJ, Escarcega RO, Lhermusier T et al. The impact of PCSK9 Inhibitors on lipid levels and outcomes in patients with primary hypercholesterolemia: a network meta-analysis. Eur Heart J 2016; 37(6): 536–545.
31. Blom DJ, Hala T, Bolognese M et al. [DESCARTES Investigators]. A 52-week placebo-controlled trial of evolocumab in hyperlipidemia. N Engl J Med 2014; 370(19): 1809–1819.
32. Robinson JG, Farnier M, Krempf M et al. [ODYSSEY LONG TERM Investigators]. Efficacy and safety of alirocumab in reducing lipids and cardiovascular events. N Engl J Med 2015; 372(16): 1489–1499.
33. Češka R, Táborský M, Vrablík M. Stanovisko k nové moderní hypolipidemické léčbě. Vnitř Lék 2015; 61(11): 933–935.
34. Sattar N, Preiss D, Robinson JG et al. Lipid-Lowering Efficacy of the PCSK9 Inhibitor Evolocumab (AMG 145) in Patients with Type 2 Diabetes: a Meta-analysis of Individual Patient Data. Lancet Diabetes Endocrinol 2016; 4(5): 403–410. Dostupné z DOI: <http://dx.doi.org/10.1016/S2213–8587(16)00003–6>.
35. Kastelein JJ, Wedel MK, Baker BF et al. Potent reduction of apolipoprotein B and low-density lipoprotein cholesterol by short-term administration of an antisense inhibitor of apolipoprotein B. Circulation 2006; 114(16): 1729–1735.
36. Kramer W. Antilipidemic drug therapy of today and in the future. Handb Exp Pharmacol 2016; 233 : 373–435. Dostupné z DOI: <http://dx.doi.org/10.1007/164_2015_15>.
Labels
Diabetology Endocrinology Internal medicineArticle was published in
Internal Medicine

2016 Issue 7-8
-
All articles in this issue
- Určení prevalence potenciálních lékových interakcí u pacientů léčených 5 a více léčivými přípravky v České a Slovenské republice
-
Autoimunitná inzulítída u pacientov s diabetes mellitus 2. typu.
Randomizovaný klinický prieskum u hospitalizovaných pacientov. - Klinický přínos nových bazálních analog inzulinu
- Posuny v nutričních doporučeních pro zdravé obyvatelstvo a jejich dopad pro diabetickou dietu
- Syndrom porušeného vnímání hypoglykemie u diabetes mellitus
- Hypoglykemie jako symptom maligního onemocnění v dospělém věku
- Sepse – jak ji poznat, na co se zaměřit aneb zpět k základům ve světle nové definice
- Kůže – zrcadlo vnitřních nemocí
- Vliv antidiabetické léčby na skelet nemocných s diabetes mellitus 2. typu
- Přínos urgentně provedené endoskopické retrográdní cholangiopankreatografie pro terapii akutní pankreatitidy
- Diabetes mellitus 2. typu a srdeční selhání
- Diferenciální diagnostika pleurálních výpotků
- Nežádoucí účinky biologické léčby v revmatologii
-
Možnosti ovlivnění kardiovaskulárního rizika u diabetes mellitus 2. typu antidiabetickou léčbou
Snížení kardiovaskulárního rizika při léčbě liraglutidem – výsledky studie LEADER - Metanol: hrozba intoxikace je stále aktuální
- Diabetická retinopatie: patogeneze a terapeutické implikace
- Diference a poměr sérových koncentrací natria a chloridů u pacientů s hyponatremií
- Cílové hodnoty systolického krevního tlaku
- Klinický význam natriuretických peptidů v diferenciální diagnostice dušnosti
- Srdeční selhání se zachovanou ejekční frakcí
- Blízká budoucnost léčby dyslipidemie u diabetiků 2. typu
- Antagonisté glukagonu otevírají novou cestu v léčbě diabetu 2. typu
- Breviár edukácie diabetika pre internistu
- Prevence a terapie sarkopenie ve stáří
- Granulomatóza s polyangiitidou manifestující se jako diabetes insipidus
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue
- Sepse – jak ji poznat, na co se zaměřit aneb zpět k základům ve světle nové definice
- Kůže – zrcadlo vnitřních nemocí
- Prevence a terapie sarkopenie ve stáří
- Hypoglykemie jako symptom maligního onemocnění v dospělém věku
