Nežádoucí účinky biologické léčby v revmatologii
Adverse effects of biological therapy in rheumatology
The biological treatment which is the most effective type of therapy for inflammatory rheumatic diseases, has become part of a standard clinical rheumatology practice in recent years. Thousands of patients in the Czech Republic with rheumatoid arthritis, different forms of spondyloarthritides and with psoriatic arthritis are now successfully treated in this way. The following medications are registered in the Czech Republic for the treatment of rheumatic diseases: infliximab, adalimumab, golimumab, certolizumab pegol, etanercept, abatacept, rituximab, tocilizumab and belimumab, newly also secukinumab. This effective therapy also entails a new spectrum of adverse effects, different to those of the synthetic disease modifying antirheumatic drugs. The most frequent problems include a higher incidence of infections including exacerbation of latent tuberculosis, further we can meet hematological, gastroenterological and immunological abnormalities some of which, luckily of rare occurrence, may have a very serious character. The cardiovascular risk is rather reduced during long-term therapy, however in patients with chronic heart failure the anti-TNF therapy may lead to its worsening. All physicians caring for patients with inflammatory rheumatic diseases should have the basic knowledge of the range of the adverse effects.
Key words:
abatacept – adalimumab – ankylosing spondylitis – biological treatment – certolizumab pegol – golimumab – TNFα inhibitors – infliximab – adverse effects – psoriatic arthritis – rheumatoid arthritis – rituximab – secukinumab – tocilizumab
Authors:
Marta Olejárová
Authors‘ workplace:
Revmatologický ústav a Revmatologická klinika 1. LF UK, Praha
Published in:
Vnitř Lék 2016; 62(7-8): 605-612
Category:
Reviews
Overview
Biologická léčba, jež je nejúčinnějším terapeutickým prostředkem v léčbě zánětlivých revmatických onemocnění, se v posledních desetiletích stala reálnou součástí běžné klinické revmatologické praxe. V současné době jsou v České republice takto léčeny s úspěchem tisíce pacientů s revmatoidní artritidou, spondyloartritidami a psoriatickou artritidou. V České republice jsou registrovány pro léčbu revmatických onemocnění infliximab, adalimumab, golimumab, certolizumab pegol, etanercept, abatacept, rituximab, tocilizumab a belimumab, nově je registrován též secukinumab. Tato účinná terapie s sebou přináší i nové spektrum nežádoucích účinků, odlišných od vedlejších účinků syntetických chorobu modifikujících léků revmatoidní artritidy. Mezi nejčastější problémy patří zvýšený výskyt infekcí včetně exacerbace latentní tuberkulózy, dále se můžeme setkat s hematologickými, gastroenterologickými a imunologickými abnormalitami, přičemž některé z nich, naštěstí vzácné, mohou mít velmi závažný charakter. Kardiovaskulární riziko je při dlouhodobé terapii spíše sníženo, nicméně u pacientů s chronickou kardiální insuficiencí může anti-TNF léčba vést k jejímu zhoršení. Základní znalosti spektra nežádoucích účinků by měli mít všichni lékaři, kteří o pacienta se zánětlivým revmatickým onemocněním pečují.
Klíčová slova:
abatacept – adalimumab – ankylozující spondylitida – biologická léčba – certolizumab pegol – golimumab – inhibitory TNFα – infliximab – nežádoucí účinky – psoriatická artritida – revmatoidní artritida – rituximab – secukinumab – tocilizumab
Úvod
Biologická léčba je v současné době nejúčinnějším způsobem léčby zánětlivých onemocnění. V revmatologii ji využíváme pro terapii revmatoidní artritidy, spondyloartritid, psoriatické artritidy a nově i systémového lupus erythematodes. Využívá ji však i řada dalších medicínských oborů – např. gastroenterologie, neurologie, onkologie, dermatologie. Její podstatou je blokáda působení různých aktivních molekul, např. cytokinů nebo receptorů, biologickou cestou, např. pomocí monoklonální protilátky, receptoru pro danou molekulu a jejich dalších modifikací. Z mechanizmu účinku – specifického ovlivnění funkcí imunitního systému – vyplývají i specifické nežádoucí účinky odlišné od spektra obecných vedlejších účinků syntetických imunosupresiv. Nežádoucí účinky biologik se mohou projevit u různých systémů a v běžné klinické praxi mohou představovat diferenciálně diagnostický problém.
Biologické léky v revmatologii
V revmatologii jsou nejčastěji užívány inhibitory tumor nekrotizujícího faktoru α (TNFα). Tento cytokin hraje klíčovou úlohu při rozvoji revmatoidní artritidy (RA), ale také ankylozující spondylitidy (AS), psoriázy, psoriatické artritidy (PsA), některých forem juvenilní idiopatické artritidy, idiopatických střevních zánětů a některých granulomatózních onemocnění. Jedná se o pleiotropní cytokin s velmi širokým spektrem prozánětlivých účinků [1]. Byl detekován v synoviální tkáni u revmatoidní artritidy, v sakroiliakálních skloubeních u spondyloartritid, ale také v psoriatických placích či střevní sliznici u idiopatických střevních zánětů [1]. Jeho inhibice vede velmi rychle k poklesu klinické zánětlivé aktivity, poklesu reaktantů akutní fáze, dlouhodobá léčba navíc prokazatelně zpomaluje progresi RA i dalších revmatických onemocnění. Proto jsou inhibitory TNFα v současné době nejpočetnější a nejrozšířenější skupinou biologik v revmatologii (tab. 1). U revmatoidní artritidy se podávají v kombinaci s metotrexátem (MTX), pokud není kontraindikován, u AS a PsA není kombinace s MTX nutná.
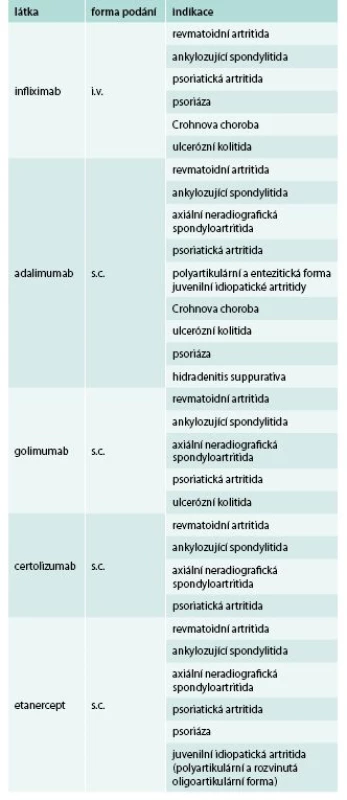
V současné době jsou dostupné i další biologické léky s odlišným mechanizmem účinku, zpravidla se užívají jako léky druhé volby po selhání anti-TNF terapie, v indikovaných případech lze však některé užít i jako prostředek první volby.
Tocilizumab je monoklonální protilátka namířená proti interleukinu 6, je velmi účinný v terapii RA, systémové formy juvenilní idiopatická artritidy (JIA) a Stillovy choroby. Není účinný u spondyloartritid. Lze jej podávat intravenózně nebo subkutánně.
Rituximab je monoklonální protilátka namířená proti molekule CD20 na B buňkách. Po jeho podání dochází k hluboké depleci B buněk v periferní krvi. Aplikuje se v sérii dvou i.v. infuzí. Snižuje aktivitu RA, lze jej užít i mimo registrované indikace u závažných forem systémového lupus. Užívá se též k terapii maligních lymfomů.
Abatacept je inhibitor kostimulace při prezentaci antigenu, jedná se o rekombinantní fúzovaný protein sestávající z extracelulární části lidského CTLA-4 a Fc části lidského IgG1. Působí tedy zejména v časných fázích rozvoje RA (tab. 2). Lze jej podávat intravenózně nebo subkutánně.
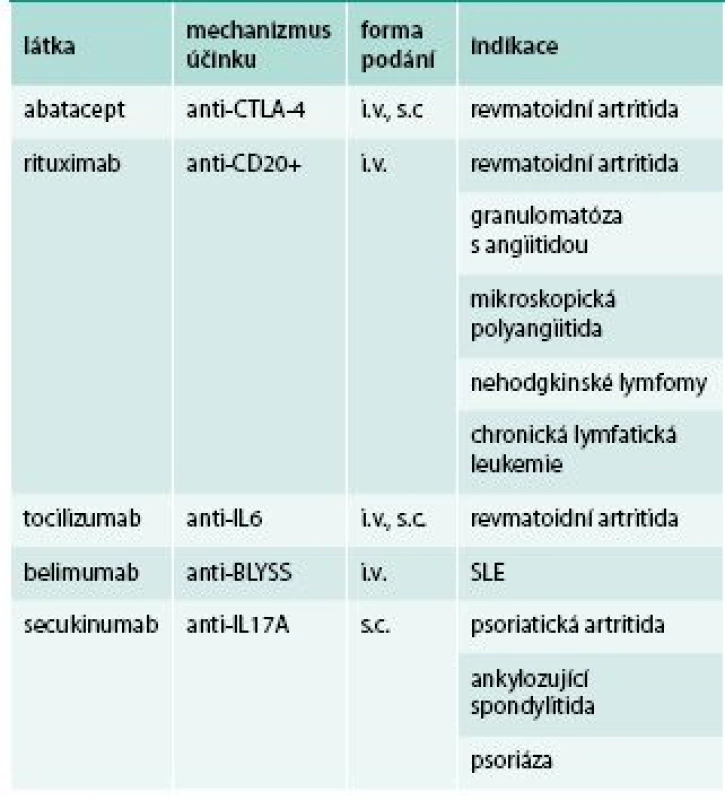
Belimumab je monoklonální protilátka proti solubilnímu aktivačnímu proteinu B-lymfocytů (BLyS). Inhibuje proliferaci, maturaci a aktivitu B buněk. Jedná se o jediný prostředek biologické léčby, určený pro léčbu SLE.
Secukinumab, plně humánní monoklonální protilátka proti IL17A, hraje důležitou roli v patogenezi spondyloartritid a psoriázy. Je nově registrován pro léčbu psoriatické artritidy, ankylozující spondylitidy a psoriázy.
Biologický zásah do cytokinové sítě a kaskády imunologických reakcí však může vyvolat mimo protizánětlivého působení téže nežádoucí reakce. Výskyt nežádoucích účinků (NÚ) je relativně nízký a jen mírně převyšuje riziko NÚ syntetických chorobu modifikujících léků. Řadě z nich se dá i účinně předcházet a jejich výskyt tak minimalizovat. Mimo infuzních a poinjekčních reakcí se mohou vyskytnout i některé závažné vedlejší účinky, jež mohou mít vážný dopad na zdraví i život pacienta. Jedná se především o zvýšené riziko infekcí, dále se mohou objevit hematologické, pneumologické, gastroenterologické, neurologické, kožní a další NÚ. Proto je třeba, aby byl lékař indikující biologickou léčbu s jejími riziky dobře obeznámen. Internisté a lékaři dalších specializací by měli být rovněž rámcově informováni o spektru nežádoucích účinků biologik; pneumologové jsou aktivně zapojení do prevence a terapie latentní tuberkulózy (viz dále), lékaři dalších specializací (hematologové, gastroenterologové, neurologové, infektologové aj) se podílejí na diferenciální diagnóze případných NÚ.
Nežádoucí účinky biologické terapie
Zvýšené riziko infekcí
Nejčastějším nežádoucím účinkem (NÚ) biologické léčby jsou infekce; jejich spektrum a riziko se však u jednotlivých biologických léků liší.
Nejlépe jsou z tohoto pohledu prostudovány inhibitory TNFα. Výskyt infekcí souvisí s blokádou TNFα a představuje tedy společný nežádoucí účinek celé třídy anti-TNF léčiv, ačkoliv jejich frekvence může být u různých preparátů odlišná. Mohou se vyskytnout různé závažné bakteriální infekce (kůže, měkkých tkání a kloubů), granulomatózní infekce (listerióza, nokardióza) a infekce oportunní, včetně mykotických či protozoárních [2–4]. Popisuje se též častější výskyt herpes zoster a reaktivace chronické hepatitidy B; u hepatitidy C riziko exacerbace pravděpodobně zvýšeno není.
Celkově je riziko závažných infekcí při srovnání s pacienty dlouhodobě léčenými syntetickými chorobu modifikujícími léky (disease-modifying antirheumatic drugs – DMARDs, např. MTX) zvýšeno mírně, podle recentní metaanalýzy dosahuje toto riziko 1,1–1,8 ve srovnání s konvenčními DMARDs [5], přičemž infekce jsou častější spíše v prvním roce léčby [2–4]. Specifickým problémem inhibitorů TNFα je zvýšené riziko tuberkulózy (TBC), tab. 3 [2–7]. TNFα se významně podílí na aktivní obraně proti mykobakteriím (tvorba a udržování granulomu), a proto je anti-TNF terapie prokazatelně spojena s vyšším rizikem TBC [5–8]. Riziko TBC je vyšší u monoklonálních protilátek než u etanerceptu, což je dáno rozdíly ve farmakokinetice i farmakodynamice jednotlivých inhibitorů TNFα (graf 1) [9]. Svědčí pro to i data z registrů, např. podle amerického registru FDA se odhaduje výskyt tuberkulózy na 9/100 000 pro etanercept a 24/100 000 pro infliximab, přičemž v obecné americké populaci se TBC vyskytuje s frekvencí přibližně 6/100 000. Prokazatelně zvýšené riziko TBC uvádí i metaanalýza EULAR [5].
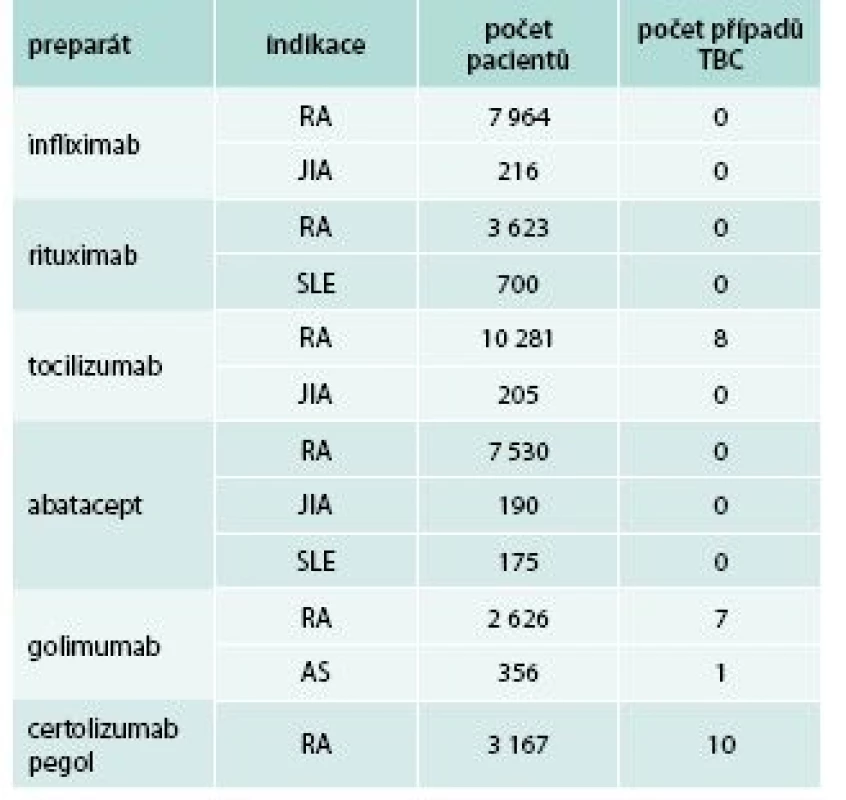

S ohledem na skutečnost, že k manifestaci TBC dochází zpravidla v prvních měsících léčby a vyskytují se převážně (50–60 %) mimoplicní manifestace (muskuloskeletální, pleura, peritoneum aj), předpokládá se, že se ve většině případů jedná o reaktivaci latentní tuberkulózní infekce [10]. U všech pacientů podstupujících anti-TNF léčbu musí být proto proveden screening latentní tuberkulózy (klinické vyšetření, RTG plic, tuberkulinový test, Quantiferon) a v případě pozitivního nálezu je třeba pneumologické vyšetření, ev. antituberkulózní léčba. Data ze španělského registru pacientů na biologické terapii (BIOBADASER) ukazují, že efektivně prováděný screening latentní TBC výrazně redukuje výskyt TBC v populaci léčené inhibitory TNFα. Před zavedením screeningu latentní TBC bylo riziko rozvoje TBC 7násobně vyšší než u pacientů, kteří prošli screeningem [11]. Avšak ani pečlivě provedený screening nedokáže vzniku, resp. reaktivaci tuberkulózy zabránit úplně, proto je třeba věnovat případným příznakům tuberkulózy při sledování nemocných patřičnou pozornost a aktivně je vyhledávat.
Výskyt infekcí při léčbě abataceptem je velmi přijatelný a v porovnání s infliximabem je spíše nižší. Nebylo prokázáno zvýšené riziko oportunních infekcí či tuberkulózy, specificky ale byl u abataceptu popsán vyšší výskyt infekcí dýchacích cest u nemocných s chronickou obstrukční plicní nemocí [12].
Při léčbě rituximabem je riziko závažných infekcí mírně zvýšeno, zejména u pacientů s nízkými hladinami imunoglobulinů. Nebyl ale pozorován zvýšený výskyt oportunních infekcí, tuberkulózy či reaktivace virových infekcí. Infekční komplikace jsou pravděpodobně častější při prolongované depleci B-lymfocytů (více než 3 roky) a při poklesu IgM a IgG. Dlouhodobé zkušenosti ukazují, že rizikovými faktory infekčních komplikací jsou chronická plicní onemocnění, chronická onemocnění srdce, extraartikulární manifestace RA a nízké hladiny IgG před léčbou. Léčba rituximabem může vést k reaktivaci hepatitidy B, u hepatitidy C riziko pravděpodobně zvýšené není [13].
Při terapii tocilizumabem se vyskytují zejména infekce respirační (pneumonie), infekce močových cest a gastroenteritidy, jejich výskyt se zvyšuje s dávkou podaného léku. Závažné infekce se popisují asi ve 4 %, výskyt oportunních infekcí zvýšen není. Recentní data z metaanalýzy klinických studií s tocilizumabem poukazují i na možné zvýšení rizika TBC, nicméně v registrech toto riziko zatím pozorováno nebylo [14].
Zvýšené riziko infekcí se popisuje i u belimumabu a secukinumabu, širší zkušenosti z registrů u těchto nových léků zatím chybí.
Rizikovými faktory infekčních komplikací jsou vyšší věk, delší trvání onemocnění, nadváha, přítomnost závažných souběžných onemocnění (diabetes, chronická obstrukční plicní nemoc) a současná léčba glukokortikoidy. Tocilizumab mimo jiné inhibuje i syntézu C-reaktivního proteinu v játrech, a proto mohou být jeho hladiny i u závažných infekcí nízké nebo zvýšené jen mírně, což může diagnózu infekcí významně komplikovat. Zde může pomoci vyšetření klasické sedimentace erytrocytů a sérová hladina prokalcitoninu.
Hematologické nežádoucí účinky
Hematologické poruchy se při biologické terapii vyskytují relativně často, většinou se jedná o nezávažné neutropenie. Neutropenie se vyskytují při terapii inhibitory TNFα až ve 14,3 %, přičemž výskyt je vyšší při terapii etanerceptem (16 %) při srovnání s adalimumabem (0,6–0,9 %) a infliximabem (1,1–5,74 %) [15,16]. Neutropenie se zpravidla objevují v prvních měsících léčby (1 týden – 26 měsíců, medián 3 měsíce). Riziko je výrazně zvýšeno u pacientů s počtem neutrofilů < 4,0 × 109/l před zahájením léčby, u nichž riziko rozvoje neutropenie vzrůstá 10násobně (OR = 10,7) [17]. Neutropenie se objevuje často i u pacientů na biologické monoterapii, tedy bez současné terapie jiným potenciálně meylotoxickým lékem, nicméně předchozí epizoda iatrogenní neutropenie v anamnéze riziko vzniku neutropenie dále zvyšuje (OR = 11,7) [15,17].
Závažné poruchy (aplastické anémie, pancytopenie) jsou vzácné, mohou se objevit u všech inhibitorů TNFα. Bylo popsáno např. granulomatózní onemocnění kostní dřeně indukované adalimumabem [18], hemolytická anémie, navozená infliximabem [19], a několik případů syndromu aktivovaných makrofágů [20].
Neutropenie jsou běžné i při terapii tocilizumabem (6 %) a rituximabem (4,2 %) [15]. U tocilizumabu se může objevit lehká přechodná neutropenie, která se upraví i přes pokračování terapie. V závažnějších případech by měla být léčba až do stanovení příčiny přerušena. Výskyt a závažnost neutropenií se zvyšují s dávkou léku, jak dokládá např. dávková studie s novým inhibitorem IL6 sarilumabem (graf 2) [21].

Trombocytopenie se obecně vyskytují vzácně a jsou nezávažné, v klinických studiích s adalimumabem byly pozorována u 0,1 % pacientů, u infliximabu v 0,5–0,9 %. U každé nově vzniklé trombocytopenie je proto nutné pátrat po dalších příčinách (virové infekce, autoimunitní původ) [15].
U pacientů s idiopatickými střevními záněty léčenými anti-TNF terapií bylo popsáno i zvýšené riziko tromboembolických příhod, přičemž častější jsou trombózy venózní (77,5 %) než arteriální (22,5 %). Příčinou je pravděpodobně interakce TNFα s koagulační kaskádou, úloha antifosfolipidových protilátek je v těchto případech minoritní [15]. U každého pacienta léčeného anti-TNF terapií a novou trombotickou příhodou je třeba provést podrobné hematologické vyšetření (protein C, protein S, anti-trombin III, faktor V, profil lipidů, hladina homocysteinu, přítomnost trombofilních mutací) [15].
Pulmonální nežádoucí účinky
U pacientů léčených inhibitory TNFα byly popsány vzácné případy paradoxní manifestace sarkoidózy, jednalo se zejména o nemocné se spondyloartritidami léčené etanerceptem. Příčina není jasná, souvisí zřejmě s nedostatečnou inhibicí cytokinové aktivity, která dostačuje pro tvorbu granulomu. Ukončení terapie inhibitory TNFα vede většinou ke zlepšení až regresi projevů [22].
U rituximabu byla popsána vzácně intersticiální plicní onemocnění [23], u abataceptu jsou častější respirační infekce, zejména u pacientů se současnou chronickou obstrukční plicní nemocí [12,24].
Problematika latentní tuberkulózy byla podrobně probrána výše.
Kardiovaskulární nežádoucí účinky
Vyšší dávky infliximabu (10 mg/kg) mohou zhoršovat chronickou městnavou kardiální insuficienci a zvyšovat mortalitu u těchto nemocných; anti-TNF léčba se proto nedoporučuje nemocným s kardiálním selháváním s NYHA III–IV a pacientům s ejekční frakcí < 50 %. Nekomplikovaná arteriální hypertenze či stabilizovaná ischemická choroba srdeční kontraindikaci terapie inhibitory TNFα nepředstavují [1].
V průběhu léčby inhibitory TNFα a tocilizumabem bylo pozorováno zvýšení hladin lipidů – LDL-cholesterolu a HDL-cholesterolu, zpravidla na začátku léčby [25]. U tocilizumabu dochází ke zvýšení o průměrně 10–20 %. Celkové kardiovaskulární riziko pravděpodobně zvýšeno není, nicméně další studie v tomto smyslu probíhají.
Dlouhodobé studie a data z registrů však ukazují, že je kardiovaskulární morbidita u pacientů se zánětlivými chorobami a anti-TNF terapií vlivem zmírnění systémového zánětu jako rizikového faktoru snížena. Zcela recentní metaanalýza dat ze 43 registrů prokázala signifikantní snížení kardiovaskulární mortality (RR = 0,60) i frekvence kardiovaskulárních příhod (RR = 0,62) u nemocných na biologické léčbě ve srovnání s pacienty léčenými pouze konvenčními DMARDs [26].
Gastroenterologické a hepatální nežádoucí účinky
U etanerceptu byly u pacientů s AS pozorovány primomanifestace Crohnovy choroby. Na rozdíl od monoklonálních protilátek (infliximabu, adalimumab) není etanercept u Crohnovy choroby účinný a s ohledem na známé odlišnosti ve farmakodynamice ve srovnání s monoklonálními protilátkami lze jeho úlohu při vzniku tohoto onemocnění připustit [27].
V průběhu léčby anti-TNF může dojít i ke zvýšení jaterních aminotransferáz, zvláště při současném podávání dalších, potenciálně hepatotoxických látek (např. imunosupresiv). K mírnému, zpravidla přechodnému zvýšení jaterních aminotransferáz dochází často i při terapii tocilizumabem; zvýšení nad 3násobek normy se pozoruje asi u 6 % pacientů léčených současně MTX [28].
Vzácně byly popsány v průběhu léčby tocilizumabem případy perforace gastrointestinálního traktu, zpravidla u pacientů s preexistující divertikulitidou léčených současně nesteroidními antirevmatiky a glukokortikoidy [28].
Neurologické nežádoucí účinky
Demyelinizační onemocnění. Vzácně byla u nemocných, léčených anti-TNF terapií popsána centrální a periferní demyelinizační onemocnění. Může se jednat o myelitidy, neuritidy optiku či roztroušenou sklerózu, velmi vzácné jsou transverzální myelitidy, leukoencefalopatie. Centrální nervový systém je postižen častěji než periferní (asi 2/3 případů) [29]. V americkém registru nežádoucích účinků biologické terapie (infliximab, etanercept, adalimumab, certolizumab pegol) bylo hlášeno celkem 771 nežádoucích neurologických poruch, přičemž polovinu z nich představovali pacienti s RA [30].
Po vysazení léčby může tato symptomatologie u části nemocných ustoupit, většinou však vyžaduje terapii. V popsaných případech byli pacienti léčeni i.v. pulzy metylprednisolonu, perorálními glukokortikoidy ve vyšších dávkách nebo i.v. imunoglobuliny [29].
Léčba inhibitory TNF by proto neměla být podávána osobám s anamnézou demyelinizačního onemocnění a neuritidy optiku. Pokud se během léčby objeví neobvyklé neurologické obtíže (parestezie, poruchy vidění, zmatenost, sfinkterové poruchy, poruchy rovnováhy, chůze apod), je třeba léčbu přerušit a pacienta odeslat k neurologickému vyšetření k vyloučení ev. demyelinizačního onemocnění, včetně MRI mozku a míchy, vyšetření evokovaných potenciálů a likvoru [29].
U pacientů léčených rituximabem byly popsány velmi vzácné případy progresivní multifokální encefalopatie (PML), zejména při současné léčbě dalšími imunosupresivy. Jedná se o subakutní, devastující infekční onemocnění CNS s fatálním průběhem. Vzniká reaktivací viru JC. Objevuje se vzácně u imunokompromitovaných nemocných, 80 % případů je sdruženo s infekcí HIV, revmatická onemocnění se podílejí pouze 2 % případů [31]. Riziko vzniku PML je 10násobně vyšší u pacientů se systémovým lupus erythematodes (SLE): 4/100 000 nemocných než u RA: 0,4/100 000 [31]. Podle kanadského registru je riziko PML u rituximabu ze všech terapeutických monoklonálních protilátek nejvyšší [32].
Jedná se sice o vzácnou, ale velmi závažnou komplikaci s mortalitou 80–100 %, proto je třeba její případné projevy (zmatenost, motorická slabost, parézy, poruchy řeči, poruchy vidění) aktivně vyhledávat a včas konzultovat s neurologem.
Kožní nežádoucí účinky
Při subkutánní injekční terapii se mohou objevovat mírné přechodné injekční kožní reakce zpravidla nevyžadující specifickou terapii ani přerušení léčby.
V průběhu terapie inhibitory TNFα se však mohou objevit i různé psoriaziformní exantémy, paradoxně se popisuje i exacerbace nebo nová manifestace psoriázy, zejména u nemocných s AS. Často (až ve 40 %) má charakter palmoplantární pustulózy. Je zde určitý rozdíl mezi oběma typy inhibitorů TNFα – zatímco monoklonální protilátky mohou indukovat novou manifestaci psoriázy, etanercept vede spíše k exacerbaci preexistujícího onemocnění [33]. Případy manifestace psoriázy byly popsány i po podání rituximabu nebo v souvislosti s léčbou abataceptem, častěji se rovněž jednalo o relaps nežli indukci psoriázy de novo [5,12].
Autoimunitní syndromy
U nemocných léčených inhibitory TNFα se často objevují autoprotilátky (antinukleární protilátky či anti-dsDNA protilátky), k vývoji klinicky manifestního systémového lupus erythematodes však zpravidla nedochází. Pokud doje k rozvoji „lupus-like“ syndromu, je třeba léčbu ukončit, což samo o sobě vede k ústupu symptomů, specifická léčba obvykle nutná není. Samotná pozitivita protilátek obvykle nepředstavuje v klinické praxi závažnější problém a po ukončení léčby se titr autoprotilátek zpravidla vrací k normálu [1]. Autoprotilátky bez výraznějších klinických konsekvencí se mohou objevit i u ostatních prostředků biologické léčby [5,12].
Nádorová onemocnění
Pacienti s RA mají obecně zvýšené riziko některých typů malignit, zejména lymfomů; toto riziko dále zvyšuje terapie některými imunosupresivy (cyklofosfamid, azatioprin). S ohledem na úlohu TNFα v protinádorové imunitě vyvstává otázka, zdali jeho blokáda nezvyšuje riziko zhoubných nádorů. Diskusi vyvolala v roce 2006 metaanalýza klinických studií u pacientů s RA léčených inhibitory TNFα, která zjistila častější výskyt nemelanomových kožních nádorů a nádorů plic u kuřáků [34]. Nicméně většina prospektivních sledování a dat z registrů nemocných na anti-TNF toto riziko neprokázala. Nová metaanalýza klinických studií i dat z registrů biologické léčby, iniciovaná EULAR však zvýšené riziko nádorových onemocnění, lymfomů ani nemelanomových kožních nádorů neprokázala, mírně zvýšené však může být riziko maligního melanomu (HR 1,5) [5].
Podstatně vyšší je riziko malignit u pacientů s Crohnovou chorobou léčených současně imunosupresivy a inhibitory TNFα. U nich byla pozorována zvýšená incidence lymfomů, leukemií, melanomů i některých solidních nádorů.
Léčba inhibitory TNFα je proto kontraindikována u nemocných, kteří mají v anamnéze v posledních 5 letech nádorové onemocnění, zejména lymfom, dále je kontraindikována u pacientů léčených cyklofosfamidem nebo azatioprinem, opatrnosti je třeba i u nemocných s delší anamnézou zhoubného nádoru a u kuřáků.
Výskyt nádorových onemocnění při léčbě rituximabem zvýšen není, rituximab je z tohoto důvodu vhodnou alternativou biologické léčby u pacientů s malignitou v anamnéze [5]. U ostatních biologických léků rovněž nebyl zvýšený výskyt malignit pozorován.
Doporučení pro sledování bezpečnosti biologické léčby
Bezpečnostní opatření při podání biologických léků začínají již před zahájením léčby při řádném respektování kontraindikací biologické léčby, která se odvíjejí od jejich nežádoucích účinků. Absolutní kontraindikací léčby je přecitlivělost na preparát či jeho části, aktivní i latentní tuberkulóza, závažné infekce, oportunní infekce, středně těžké nebo těžké srdeční selhání (NYHA III–IV), nádorová onemocnění v anamnéze před méně než 5 lety a přítomnost neurodegenerativního onemocnění [35].
Laboratorní vyšetření je vhodné provést před zahájením léčby anti-TNF a dále po 2 týdnech, dále pak v měsíčních intervalech a od 3. až 6. měsíce léčby je možné laboratorní kontroly provádět každé 3 měsíce. Z laboratorních testů provádíme krevní obraz, včetně diferenciálního rozpočtu leukocytů, jaterní aminotransferázy, kreatinin, vyšetření lipidů a moči. Pokud pacient dostává souběžnou terapii metotrexátem či jiným DMARD, řídí se kontroly podle této léčby. Vhodné jsou pravidelné kontroly v intervalech 8–12 týdnů.
Před zahájením biologické léčby se dále doporučuje provést screening na přítomnost virové hepatitidy A, B a C. U pacientů s prokázanou hepatitidou A, B nebo C je třeba provést dále kvantitativní stanovení virové DNA či RNA a konzultovat s hepatologem [35].
Screening latentní tuberkulózy. Podle mezinárodních doporučení, z nichž vycházejí také doporučení ČRS a České pneumologické společnosti, je třeba provést tuberkulinový test, test produkce interferonu γ (Quantiferon TB-Gold test), RTG hrudníku a odebrat pečlivou rodinnou a osobní anamnézu z hlediska výskytu TBC a možného kontaktu s touto chorobou. Vždy před zahájením anti-TNF terapie by měl konzultován pneumolog, s výjimkou kompletně negativních nálezů. Kontrolní vyšetření pneumologem je vhodné po 3 a 12 měsících léčby. Obecně je doporučena maximální opatrnost a na možnost TBC je třeba myslet při každé návštěvě nemocného.
Pacienta s latentní tuberkulózou je třeba nejprve léčit izoniazidem (INH) nebo jinými antituberkulotiky dle doporučení pneumologa a teprve poté je možné biologickou terapii zahájit [35]. Vhodnější jsou v těchto případech prostředky s jiným mechanizmem účinku než inhibicí TNFα.
Závěr
Biologická léčba je v současné době nejúčinnějším prostředkem terapie revmatoidní artritidy a dalších zánětlivých revmatických onemocnění – ankylozující spondylitidy, neradiografických spondyloartritid a psoriatické artritidy. Biologickou terapii využívá v současné době mimo revmatologii řada dalších interních oborů, neurologie a dermatologie. Spektrum nežádoucích účinků této léčby se na rozdíl od syntetických chorobu modifikujících léků a imunosupresiv odehrávají ve sféře imunologické. Obecně je u biologické léčby mírně zvýšeno riziko infekcí, včetně infekcí závažných, toto riziko však není u všech biologik stejné. Zvýšené riziko tuberkulózy představuje společný vedlejší efekt terapie inhibitory TNFα, přičemž riziko je vyšší u monoklonálních protilátek než u etanerceptu. Často se můžeme setkat s mírnou neutropenií, závažné hematologické nežádoucí účinky (agranulocytóza, pancytopenie) jsou vzácné, stejně tak jako neurologické vedlejší účinky. Biologická léčba dle posledních metaanalýz významně nezvyšuje riziko vzniku zhoubných nádorů u RA, situace je však horší u pacientů s idiopatickými střevními záněty. Některé léky, zejména inhibitory TNFα, mohou zhoršovat kardiální insuficienci, jsou proto u této populace pacientů kontraindikovány. Terapie tocilizumabem může ovlivňovat hladiny lipidů v séru, celkově zvýšené kardiovaskulární riziko však u tohoto typu terapie prokázáno nebylo. Prospektivní studie naopak ukazují, že je kardiovaskulární riziko vlivem snížené zánětlivé aktivity u nemocných, léčených biologickou léčbou, spíše sníženo. Frekvence nežádoucích účinků nijak nesnižuje výraznou efektivitu a obrovský přínos biologické terapie pro pacienta. Je proto třeba případné nežádoucí účinky dobře znát, aktivně je vyhledávat a léčit a, pokud je to možné, tak jim i předcházet.
Podpořeno výzkumnými záměry MZ ČR č. 00000023728.
MUDr. Marta Olejárová, CSc.
olejarova@revma.cz
Revmatologický ústav a Revmatologická klinika 1. LF UK,
Praha
www.revma.cz
Doručeno do redakce 4. 8. 2016
Přijato po recenzi 17. 8. 2016
Sources
1. Olejárová M. Biologická léčba v revmatologii. Mladá Fronta: Praha 2010. ISBN 978–80–204–2281–1.
2. Askling J, Fored CM, Brandt L et al. Time-dependent increase in risk of hospitalisation with infection among Swedish RA patients treated with TNF antagonists. Ann Rheum Dis 2007; 66(10): 1339–1344.
3. Listing J, Strangfeld A, Kary S et al. Infections in patients with rheumatoid arthritis treated with biologic agents. Arthritis Rheum 2005; 52(11): 3403–3412.
4. Curtis JR, Patkar N, Xie A et al. Risk of serious bacterial infections among rheumatoid arthritis patients exposed to tumor necrosis factor α antagonists. Arthritis Rheum 2007; 56(4): 1125–1133.
5. Ramiro S, Gaujoux-Viala C, Nam JL et al. Safety of synthetic and biological DMARDs: a systematic literature review informing the 2013 update of the EULAR recommendations for management of rheumatoid arthritis. Ann Rheum Dis 2014; 73(3): 529–535.
6. Askling J, Fored CM, Brandt L et al. Risk and case characteristics of tuberculosis in rheumatoid arthritis associated with tumor necrosis factor antagonists in Sweden. Arthritis Rheum 2005; 52(7): 1986–1992.
7. Dixon WG, Hyrich KL, Watson KD et al. [B S R B R Control Centre Consortium]. Drug-specific risk of tuberculosis in patients with rheumatoid arthritis treated with anti-TNF therapy: results from the British Society for Rheumatology Biologics Register (BSRBR). Ann Rheum Dis 2010; 69(3): 522–528.
8. Gómez-Reino JJ, Carmona L, Angel Descalzo M. [Biobadaser Group]. .Risk of tuberculosis in patients treated with tumor necrosis factor antagonists due to incomplete prevention of reactivation of latent infection. Arthritis Rheum 2007; 57(5): 756–761.
9. Tubach F, Salmon D, Ravaud P et al. Risk of tuberculosis is higher with anti-tumor necrosis factor monoclonal antibody therapy than with soluble tumor necrosis factor receptor therapy: The three-year prospective French research axed on tolerance of biotherapies registry. Arthritis Rheum 2009; 60(7): 1884–1894.
10. Gómez-Reino JJ, Carmona L, Angel Descalzo M. [Biobadaser Group]. Risk of tuberculosis in patients treated with tumor necrosis factor antagonists due to incomplete prevention of reactivation of latent infection. Arthritis Rheum 2007; 57(5): 756–761.
11. Carmona L, Gómez-Reino JJ, Rodríguez-Valverde V et al. [BIOBADASER Group]. Effectiveness of recommendations to prevent reactivation of latent tuberculosis infection in patients treated with tumor necrosis factor antagonists. Arthritis Rheum 2005; 52(6): 1766–1772.
12. Atzeni F, Sarzi-Puttini P, Mutti A et al. Long-term safety of abatacept in patients with rheumatoid arthritis. Autoimmun Rev 2013; 12(12): 1115–1117.
13. Faurschou M, Jayne DR. Anti-B cell antibody therapies for inflammatory rheumatic diseases. Annu Rev Med 2014; 65 : 263–278. Dostupné z DOI: <http://dx.doi.org/10.1146/annurev-med-070912–133235>.
14. Cantini F, Niccoli L, Goletti D. Tuberculosis risk in patients treated with non-anti-tumor necrosis factor-α (TNF-α) targeted biologics and recently licensed TNF-α inhibitors: data from clinical trials and national registries. J Rheumatol Suppl 2014; 91 : 56–64. Dostupné z DOI: <http://dx.doi.org/10.3899/jrheum.140103>.
15. Bessissow T, Renard M, Hoffman I et al. Review article: non-malignant haematological complications of anti-tumour necrosis factor alpha therapy. Aliment Pharmacol Ther 2012; 36(4): 312–323.
16. Bathon A, Martin RW, Fleischmann RM. Comparison of etanercept and methotrexate in patients with early rheumatoid arthritis. N Engl J Med 2000; 343(22): 1586–1593. Erratum in N Engl J Med 2001; 344(1): 76. N Engl J Med 2001; 344(3): 240.
17. Rajakulendran S, Gadsby K, Allen D et al. Neutropenia while receiving anti-tumour necrosis factor treatment for rheumatoid arthritis. Ann Rheum Dis 2006; 65(12): 1678–1679.
18. Metyas SK, Tadros RM, Arkfeld DG. Adalimumab-induced noncaseating granuloma in the bone marrow of a patient being treated for rheumatoid arthritis. Rheumatol Int 2009; 29(4): 437–439.
19. Tyler LN, Harville TO, Blackall DP. Multiple alloantibodies after transfusion in an infant treated with infliximab. N Engl J Med 2007; 357(20): 2092–2093.
20. Ramanan AV, Schneider R. Macrophage activation syndrome following initiation of etanercept in a child with systemic onset juvenile rheumatoid arthritis. J Rheumatol. 2003; 30(2): 401–403.
21. Huizinga TW, Fleischmann RM, Jasson M et al. Sarilumab, a fully human monoclonal antibody against IL-6Rα in patients with rheumatoid arthritis and an inadequate response to methotrexate: efficacy and safety results from the randomised SARIL-RA-MOBILITY Part A trial. Ann Rheum Dis 2014; 73(9): 1626–1634.
22. Wendling D, Prati C. Paradoxical effects of anti-TNF-α agents in inflammatory diseases. Expert Rev Clin Immunol 2014; 10(1): 159–169.
23. Lee Y, Kyung SY, Choi SJ et al. Two cases of interstitial pneumonitis caused by rituximab therapy. Korean J Intern Med 2006; 21(3): 183–186.
24. Furst DE. The risk of infections with biologic therapies for rheumatoid arthritis. Semin Arthritis Rheum 2010; 39(5): 327–346.
25. Atzeni F, Gianturco L, Talotta R et al. Investigating the potential side effects of anti-TNF therapy for rheumatoid arthritis: cause for concern? Immunotherapy 2015; 7(4): 353–361.
26. de La Forest Divonne M, Gottenberg JE, Salliot C. Safety of biologic DMARDs in RA patients in real life: A systematic literature review and meta-analyses of biologic registers. Joint Bone Spine 2016 Jun 21. pii: S1297–319X(16)30050–1. Dostupné z DOI: <http://dx.doi.org/10.1016/j.jbspin.2016.02.028>.
27. Iriarte A, Zaera C, Bachiller-Corral J et al. Inflammatory bowel disease as a paradoxical effect of anti-TNF alpha therapy. Gastroenterol Hepatol 2016 Mar 15. pii: S0210–5705(16)00088–1. Dostupné z DOI: <http://dx.doi.org/10.1016/j.gastrohep.2016.01.011>.
28. Tanaka T, Hishitani Y, Ogata A. Monoclonal antibodies in rheumatoid arthritis: comparative effectiveness of tocilizumab with tumor necrosis factor inhibitors. Biologics 2014; 8 : 141–153. Dostupné z DOI: <http://dx.doi.org/10.2147/BTT.S37509>.
29. Nanau RM, Neuman MG. Safety of anti-tumor necrosis factor therapies in arthritis patients. J Pharm Pharm Sci 2014; 17(3): 324–361.
30. Deepak P, Stobaugh DJ, Sherid M et al. Neurological events with tumour necrosis factor alpha inhibitors reported to the Food and Drug Administration Adverse Event Reporting System. Aliment Pharmacol Ther 2013; 38(4): 388–396.
31. Palazzo E, Yahia SA. Progressive multifocal leukoencephalopathy in autoimmune diseases. Joint Bone Spine 2012; 79(4): 351–355.
32. Keene DL, Legare C, Taylor E et al. Monoclonal antibodies and progressive multifocal leukoencephalopathy. Can J Neurol Sci 2011; 38(4): 565–571.
33. Nguyen K, Vleugels RA, Velez NF et al. Psoriasiform reactions to anti-tumor necrosis factor α therapy. J Clin Rheumatol 2013; 19(7): 377–381.
34. Bongartz T, Sutton AJ, Sweeting MJ et al. Anti-TNF antibody therapy in rheumatoid arthritis and the risk of serious infections and malignancies: systematic review and meta-analysis of rare harmful effects in randomized controlled trials. JAMA 2006; 295(19): 2275–2285.
35. Vencovský J et al. Bezpečnost biologické léčby – doporučení České revmatologické společnosti. Čes Revmatol 2009; 17(3): 146–160
Labels
Diabetology Endocrinology Internal medicineArticle was published in
Internal Medicine

2016 Issue 7-8
-
All articles in this issue
- Určení prevalence potenciálních lékových interakcí u pacientů léčených 5 a více léčivými přípravky v České a Slovenské republice
-
Autoimunitná inzulítída u pacientov s diabetes mellitus 2. typu.
Randomizovaný klinický prieskum u hospitalizovaných pacientov. - Klinický přínos nových bazálních analog inzulinu
- Posuny v nutričních doporučeních pro zdravé obyvatelstvo a jejich dopad pro diabetickou dietu
- Syndrom porušeného vnímání hypoglykemie u diabetes mellitus
- Hypoglykemie jako symptom maligního onemocnění v dospělém věku
- Sepse – jak ji poznat, na co se zaměřit aneb zpět k základům ve světle nové definice
- Kůže – zrcadlo vnitřních nemocí
- Vliv antidiabetické léčby na skelet nemocných s diabetes mellitus 2. typu
- Přínos urgentně provedené endoskopické retrográdní cholangiopankreatografie pro terapii akutní pankreatitidy
- Diabetes mellitus 2. typu a srdeční selhání
- Diferenciální diagnostika pleurálních výpotků
- Nežádoucí účinky biologické léčby v revmatologii
-
Možnosti ovlivnění kardiovaskulárního rizika u diabetes mellitus 2. typu antidiabetickou léčbou
Snížení kardiovaskulárního rizika při léčbě liraglutidem – výsledky studie LEADER - Metanol: hrozba intoxikace je stále aktuální
- Diabetická retinopatie: patogeneze a terapeutické implikace
- Diference a poměr sérových koncentrací natria a chloridů u pacientů s hyponatremií
- Cílové hodnoty systolického krevního tlaku
- Klinický význam natriuretických peptidů v diferenciální diagnostice dušnosti
- Srdeční selhání se zachovanou ejekční frakcí
- Blízká budoucnost léčby dyslipidemie u diabetiků 2. typu
- Antagonisté glukagonu otevírají novou cestu v léčbě diabetu 2. typu
- Breviár edukácie diabetika pre internistu
- Prevence a terapie sarkopenie ve stáří
- Granulomatóza s polyangiitidou manifestující se jako diabetes insipidus
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue
- Sepse – jak ji poznat, na co se zaměřit aneb zpět k základům ve světle nové definice
- Kůže – zrcadlo vnitřních nemocí
- Prevence a terapie sarkopenie ve stáří
- Hypoglykemie jako symptom maligního onemocnění v dospělém věku
