Granulomatóza s polyangiitidou manifestující se jako diabetes insipidus
Granulomatosis with polyangiitis manifested as diabetes insipidus
The case report shows a surprising presentation of pulmonary granulomatosis with polyangiitis (GPA) through symptoms of diabetes insipidus (DI) with granulomatous infiltration of the pituitary gland. The pituitary hormonal dysfunction as a result of granulomatosis of the pituitary gland is rare. Several studies have demonstrated that the incidence of the pituitary dysfunction reaches approx. 1 % of the patients with GPA. However it is mostly presented in patients with the disease already diagnosed. The patient described by us had no clinical expressions of GPA in the respiratory tract. He presented with polyuria and polydipsia. It was not until a more detailed examination of these symptoms was performed that a focal lung disease was detected and diagnosed as GPA.
Key words:
diabetes insipidus – granulomatosis with polyangiitis – granulomatous infiltration of the pituitary gland – pituitary hormonal dysfunction
Authors:
Ondřej Pátek 1; Miroslava Horáčková 1; Lenka Vítová 1; Rudolf Horváth 2; Jaromír Háček 3; Otto Schück 1
Authors‘ workplace:
Interní klinika 2. LF UK a FN v Motole, Praha
1; Oddělení revmatologie dětí a dospělých FN v Motole, Praha
2; Ústav patologie a molekulární medicíny 2. LF UK a FN v Motole, Praha
3
Published in:
Vnitř Lék 2016; 62(7-8): 679-683
Category:
Case Reports
Overview
Popis případu ukazuje překvapivou prezentaci plicní granulomatózy s polyangiitidou (GPA) s příznaky diabetes insipidus (DI) při granulomatózní infiltraci podvěsku mozkového. Pituitární hormonální dysfunkce podmíněná granulomatózou podvěsku mozkového je vzácná. V několika studiích bylo prokázáno, že pituitární dysfunkce se vyskytuje u přibližně 1 % pacientů s GPA. Většinou se však projeví u pacientů s již diagnostikovaným onemocněním. Námi popisovaný pacient neměl žádné klinické projevy GPA v respiračním traktu, onemocnění se manifestovalo polyurií a polydipsií. Až při podrobnějším vyšetření těchto příznaků byl zjištěn ložiskový plicní proces, který byl diagnostikován jako GPA.
Klíčová slova:
diabetes insipidus – granulomatóza s polyangiitidou – granulomatózní infiltrace podvěsku mozkového – pituitární hormonální dysfunkce
Popis případu
47letý muž byl po stížnosti na stálou žízeň a jím zpozorované větší objemy moči doporučen k nefrologickému vyšetření. Diuréza měřená za 24hodinové období se pohybovala od 10 do 12 litrů. Adekvátně této polyurii pacient přijímal větší objemy tekutiny per os. Při monitorování parametrů vnitřního prostředí za pobytu na nemocničním lůžku jsme jenom jednou zachytili hypernatremii 148 mmol/l provázenou vzestupem sérové osmolality na 313 mmol/kg. Frakční exkrece bezsolutové vody byla 4,38 % a frakční exkrece osmoticky aktivních látek byla 1,72 %.
V anamnéze pacienta jsme nezjistili údaje o jakémkoli interním onemocnění. Doposud byl zcela zdráv a nebral žádné léky. Jeho screeningová laboratoř (krevní obraz s diferenciálním rozpočtem bílých krevních elementů; sérové elektrolyty Na, K, Cl; dále Ca a P; bilirubin a jaterní testy – AST, ALT, ALP, GMT; urea, kreatinin, kyselina močová, celková bílkovina, albumin, ranní glykemie, HbA1c, cholesterol, biochemické vyšetření moči a mikroskopie močového sedimentu) nevykazovala patologické odchylky. Výjimkou byl výsledek CRP 25 mg/l spolu se zvýšenou sedimentací červených krvinek (FW 40 mm/hod, resp. 60 mm za 2 hod).
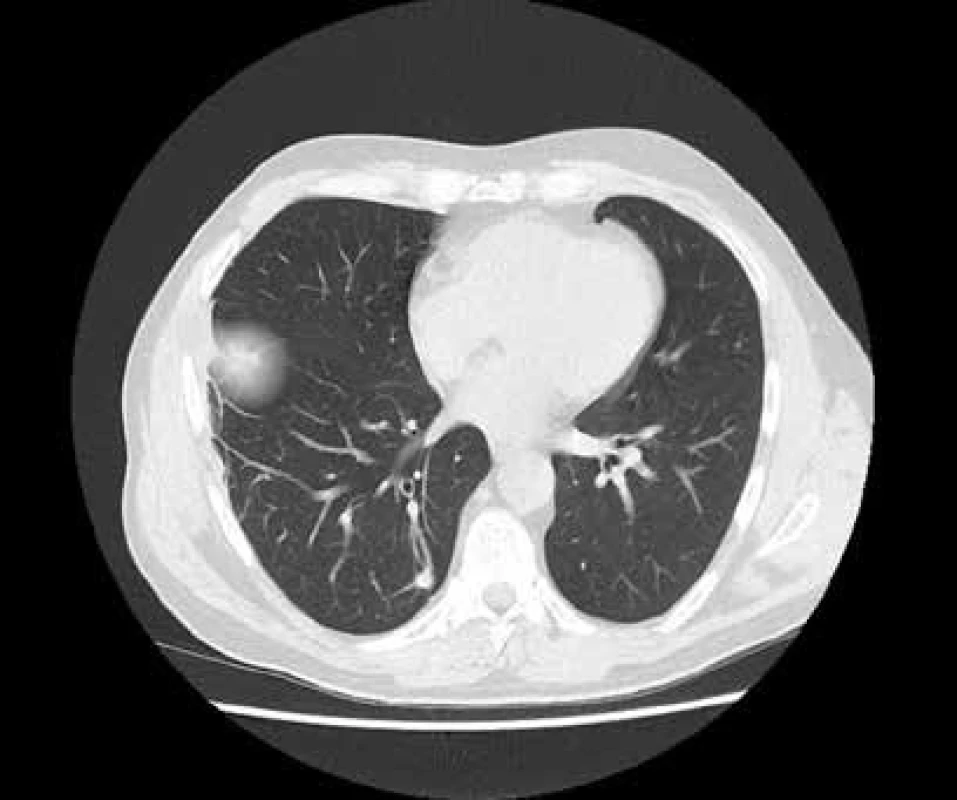
Při rutinně prováděném RTG plic bylo vysloveno podezření na vícečetný nodulární proces pravé plíce, který se potvrdil při HRCT (high resolution CT) plicního parenchymu (obr. 1). V rámci diferenciální diagnózy bylo provedeno laboratorní imunologické vyšetření a prokázána pozitivita c-ANCA (cytoplazmatická granulární fluorescence protilátek proti cytoplazmě neutrofilů) a metodou ELISA bylo prokázáno významné zvýšení ANCA PR3 44,1 U/ml (protilátky proti cytoplazmě neutrofilů se specifitou proti proteináze 3). Při videoasistované torakoskopii byla získána plicní tkáň z oblasti patologického ložiska. V centru excize byl zastižen chronický granulomatózní nekrotizující proces a v arteriích menšího a středního kalibru proliferace intimy až do obrazu obliterující endarteriitidy (obr. 2 a obr. 3).
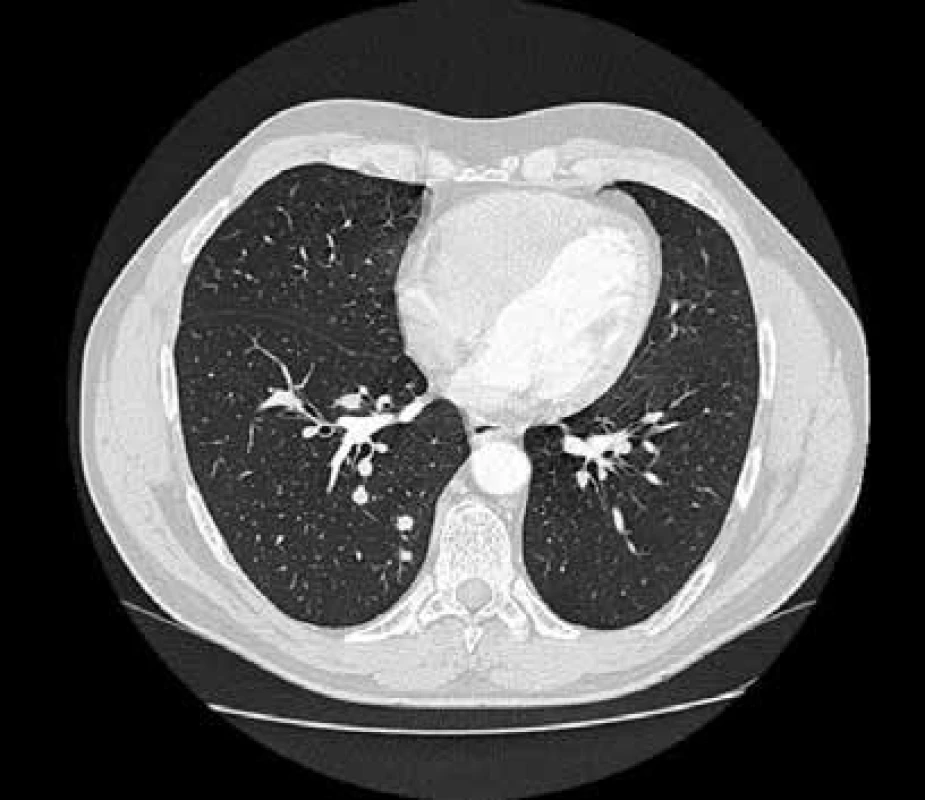
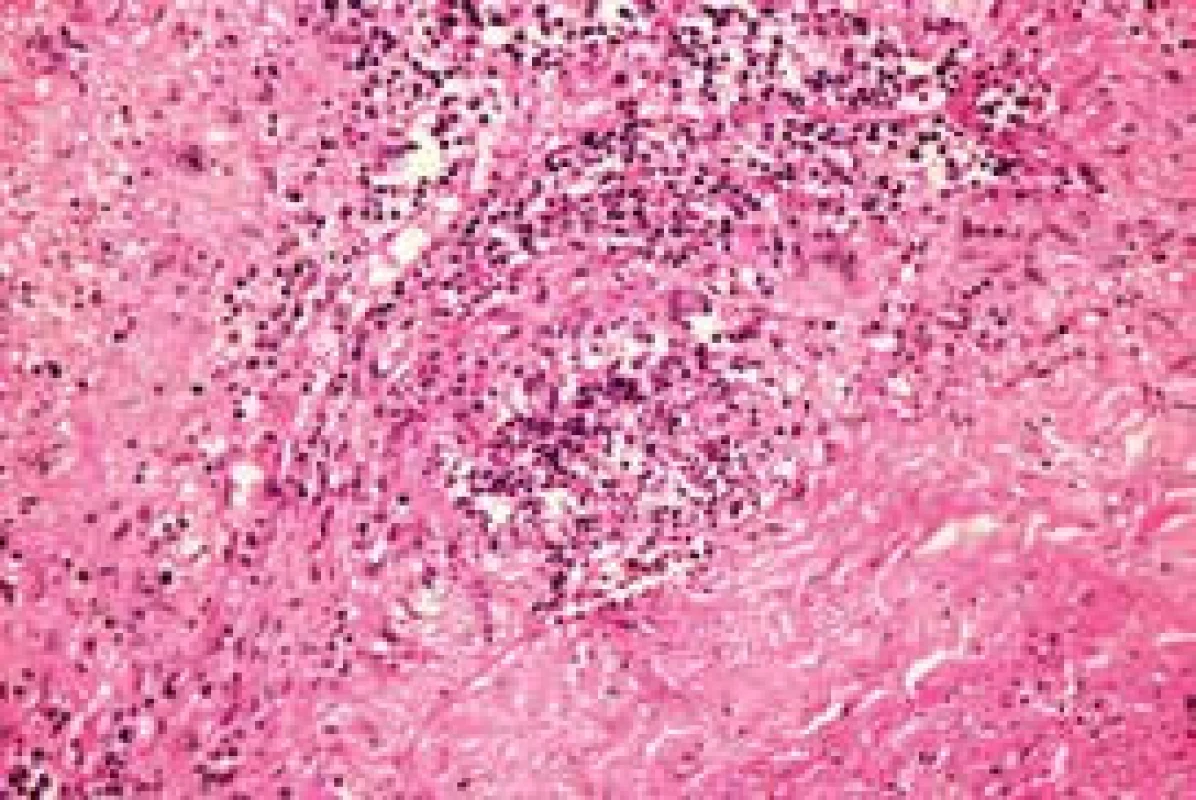
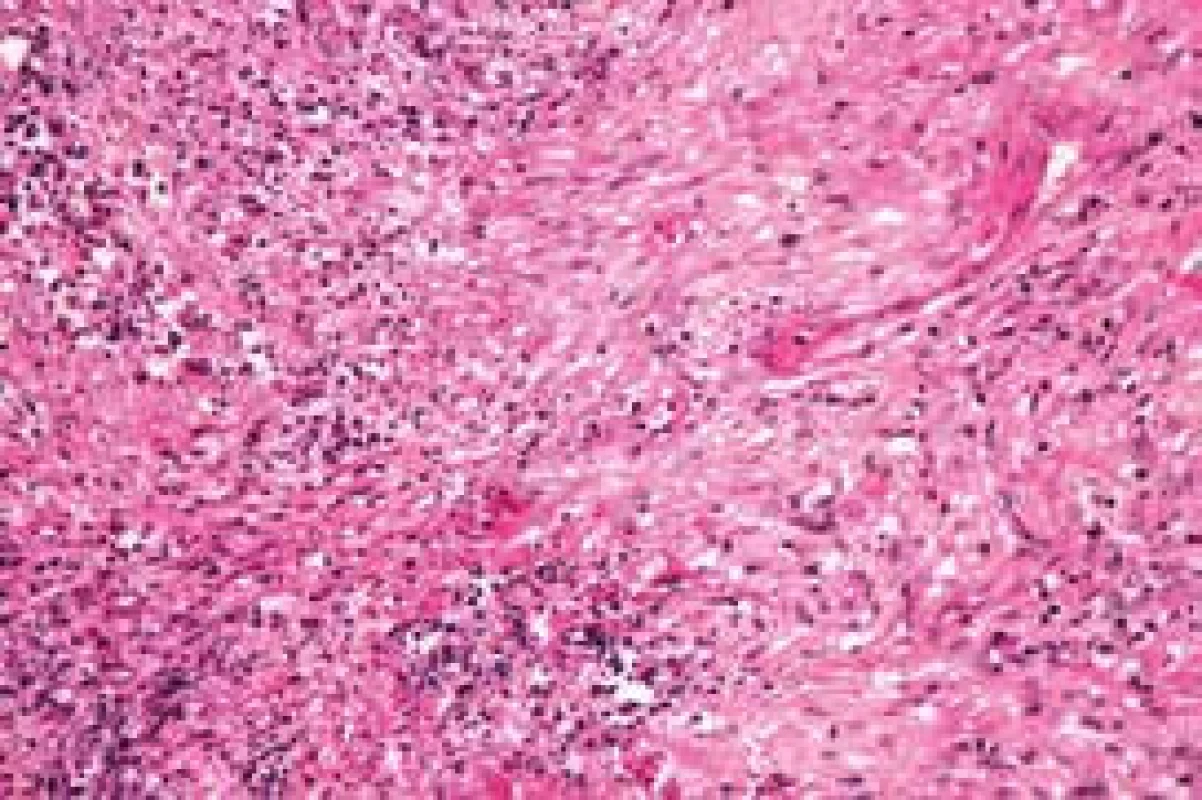
Po histologické konfirmaci diagnózy nekrotizující ANCA asociované plicní vaskulitidy jsme provedli podrobné laboratorní nefrologické vyšetření (clearance kreatininu, proteinurie a albuminurie z 24hodinového sběru moči, sériové vyšetření močového sedimentu). Toto vyšetření nesvědčilo pro postižení ledvin vaskulitidou.
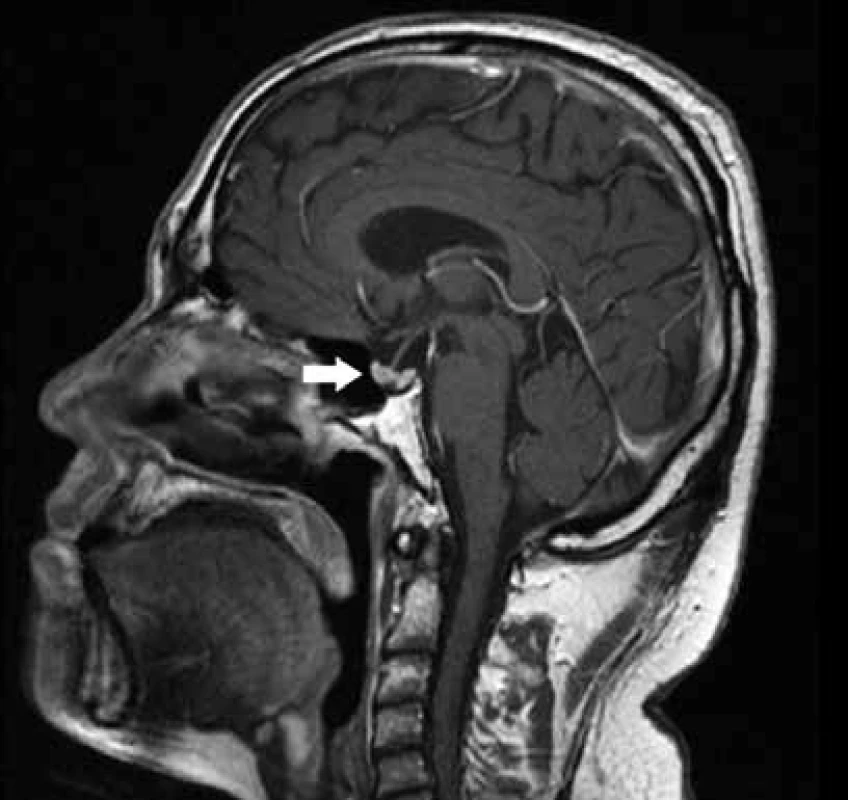
Pro podezření na postižení podvěsku mozkového granulomatózním procesem bylo provedeno zobrazení magnetickou rezonancí (magnetic resonance imaging – MRI) mozku. Zobrazila se zvětšená hypofýza 13 × 10 mm, která se vyklenovala kraniálně směrem do supraselární cisterny. Ve střední části bylo po podání kontrastní látky patrné drobné, méně se sytící ložisko velikosti 3 mm (obr. 4). Vzhledem k nálezu zvětšené hypofýzy jsme provedli vyšetření hormonů hypotalamohypofyzární osy. Laboratorně nebyla prokázaná suprese ani nadprodukce vyšetřovaných hypofyzárních hormonů (FSH, LH, prolaktin, TSH) ani porucha sekrece kortizolu.
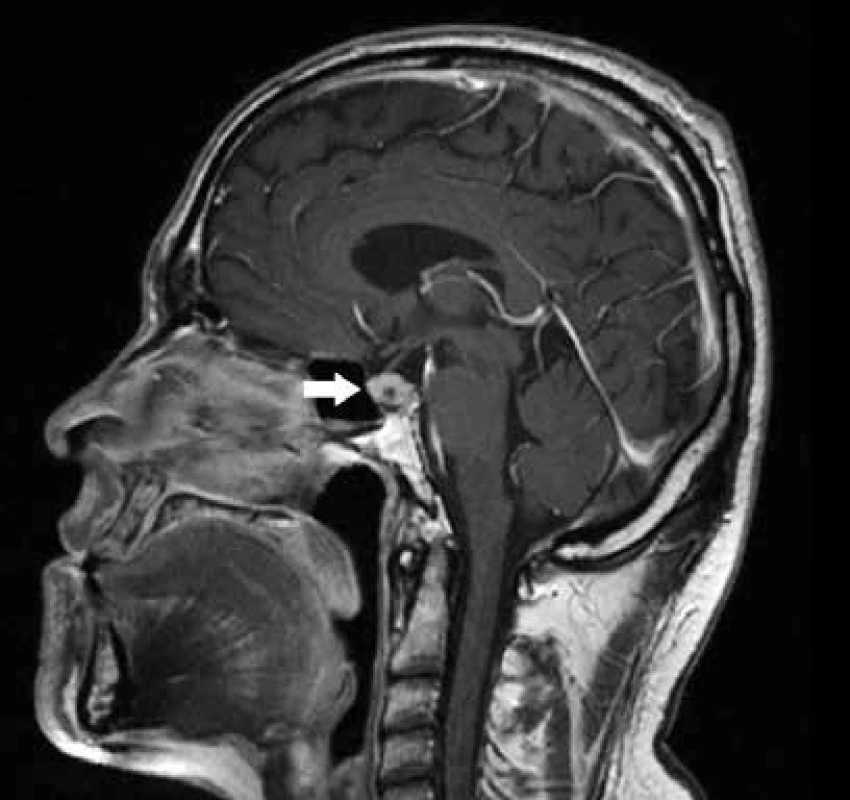
Na základě dosažených výsledků jsme provedli modifikovaný vodní deprivační test. Na začátku tohoto vyšetření jsme změřili močovou osmolalitu (UOsm), která byla 114 mmol/kg a ve chvíli, kdy pacient nebyl schopen dále žíznit, což bylo po 6 hod odnětí tekutin, jsme zjistili UOsm 268 mmol/kg.
Pro indukční imunosupresivní (IS) terapii jsme volili pulzní podání 1 g metylprednisolonu ve 3 po sobě následujících dnech, s následným podáním 6 pulzů 1 g cyklofosfamidu (CFS) s odstupem jednoho měsíce mezi jednotlivými aplikacemi. Po ukončení pulzní terapie metylprednisolonem navázala perorální terapie kortikosteroidy (prednison 60 mg za den). Po 2 měsících jsme začali snižovat dávku prednisonu. Po ukončení indukční IS terapie bylo docíleno dávky prednisonu 20 mg/den. Kromě toho dostával obden profylakticky 80 mg trimetoprimu a 400 mg sulfametoxazolu ve fixním kombinovaném přípravku (prevence infekce Pneumocystis jirovecii).
Po ukončení indukční IS terapie byl proveden restageing (HRCT plic, MRI mozku, echokardiografie, spirometrie, biochemické a imunologické laboratorní vyšetření) a při uspokojivých nálezech byl pacient převeden na pokračující terapii azatioprinem v dávce 50 mg 2krát denně a dále byla snižována dávka prednisonu až do úplného vysazení po 16 měsících kortikoterapie. Nález na HRCT plic po ukončení indukční fáze IS terapie ukazuje obr. 5.
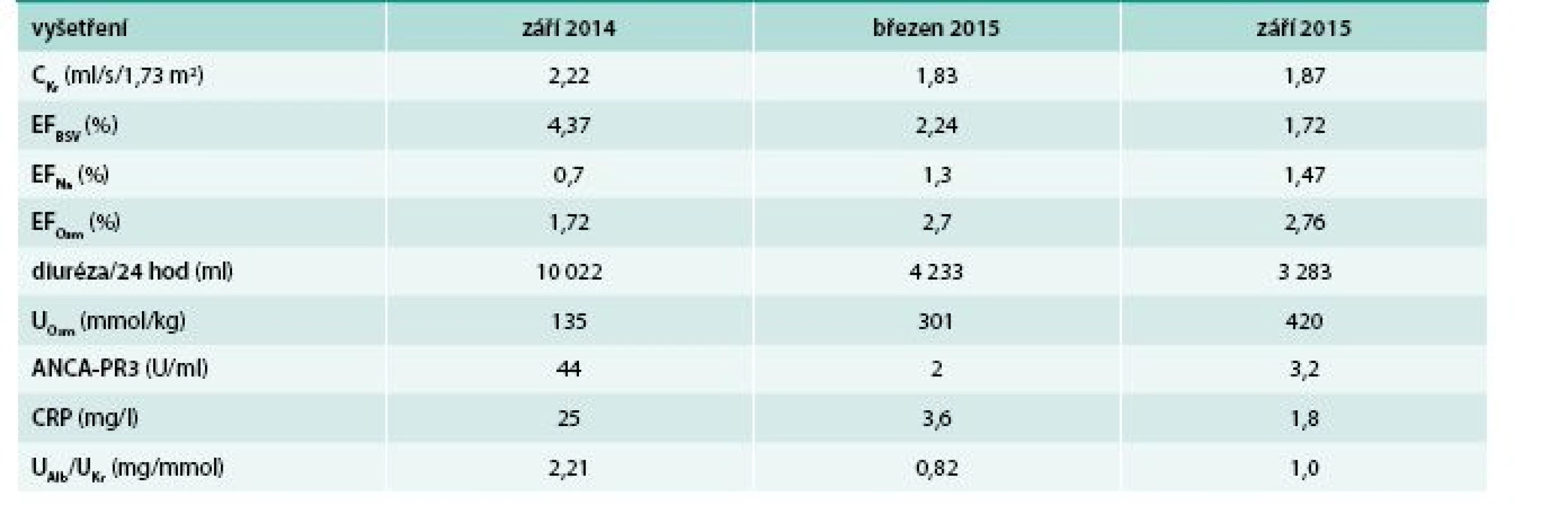
V průběhu indukční a pokračující IS terapie jsme sledovali clearance kreatininu, frakční exkreci bezsolutové vody, frakční exkreci osmoticky aktivních látek, frakční exkreci sodíku, diurézu za 24 hod, močovou osmolalitu, ANCA-PR3, CRP a albumino-kreatininový močový kvocient. Výsledky tohoto průběžného monitorování jsou uvedeny v tab.
Po dokončení indukční IS terapie bylo provedeno kontrolní MRI mozku, kde byla popsána regrese velikosti hypofýzy, která byla již normální velikosti i intenzity. Po aplikaci kontrastní látky se jevilo dříve popisované méně se sytící ložisko velikostí v regresi. Na sagitálních nativních T1 sekvencích nebyl patrný typický hypersignál v oblasti neurohypofýzy (obr. 6).
Diskuse
Onemocnění se u pacienta klinicky manifestovalo polyurií a polydipsií. Tuto polyurii jsme kvalifikovali jako vodní. Nejčastěji je vodní polyurie způsobena primární polydipsií. Jen vzácněji lze prokázat nálezy svědčící pro absenci nebo nedostatek antidiuretického hormonu (ADH) způsobené jeho nedostatečnou sekrecí z neurohypofýzy nebo ještě vzácněji poruchou jeho vazby na příslušné receptory ve sběrném kanálku ledvin. U našeho nemocného byla polyurie způsobena nadměrným ledvinovým vylučováním bezsolutové vody. Vzhledem k tomu, že při vodním deprivačním testu trvajícím 6 hod došlo ke zvýšení UOsm o 154 mmol/kg (ze 114 na 268 mmol/kg), soudíme, že nedošlo k úplnému potlačení produkce ADH. Proto se domníváme, že se jedná o parciální centrální diabetes insipidus (DI).
Granulomatóza s polyangiitidou (GPA), jakožto systémová vaskulitida, je onemocnění, které může postihovat cévy jakékoliv lokalizace, tedy i podvěsku mozkového. V dostupných studiích je popisována prevalence hypofyzárního postižení u GPA asi 1,1–1,3 % [1,2]. V literatuře je mezi lety 1966 a 2015 dokumentováno pouze 51 pacientů s postižením hypofýzy. Z nich se většina vyskytla u již známých případů GPA [1,3]. Dysfunkce hypotalamohypofyzární osy se nejčastěji prezentuje jako DI (49–71 %) [1]. Z dostupné literatury jsme dohledali pouze 6 pacientů s GPA, kteří se prezentovali iniciálně jako izolovaný DI [1,4–7]. Iniciální prezentace GPA příznaky DI je tedy velmi vzácná, postihuje pouze asi 12 % pacientů s pituitární lézí (6 z 51 případů). Pituitární postižení se nejčastěji vyskytuje u nemocných s již známou diagnózou GPA [2,4,8–14]. Studie z roku 1992, která sledovala 160 pacientů s GPA po dobu 24 let, demonstrovala v době diagnózy u 8 % pacientů různá postižení centrálního nervového systému a klinicky manifestovaný DI pouze u 1 pacienta [15]. Nejčastějšími iniciálními projevy onemocnění, se kterými nemocní vyhledali lékařskou pomoc, bylo v 90 % postižení horních nebo dolních cest dýchacích. Nejčastější bylo postižení otorinolaryngologické oblasti (73 %), dále plicní postižení (45 %), z toho bylo 34 % pacientů asymptomatických, tedy pouze s RTG nálezem. Ledvinové postižení vaskulitidou bylo přítomno pouze u 18 % nemocných a bylo v naprosté většině asymptomatické [15].
Diagnózu DI v souvislosti s histologicky prokázanou plicní GPA u našeho pacienta opíráme nejenom o patologický nález zvětšené hypofýzy s centrální lézí na MRI mozku, ale také o následně dokumentovaný efekt IS terapie na vodní polyurii, která v průběhu léčby a po jejím ukončení zcela ustoupila. Kontrolní nefrologické vyšetření vyloučilo přítomnost poruchy tubulární funkce charakteru DI. Pro souvislost DI s GPA rovněž svědčí nález na kontrolním zobrazení magnetickou rezonancí, na němž byla kromě resoluce ložiskového postižení selární krajiny zjištěna přetrvávající absence typické hyperintenzity v oblasti neurohypofýzy v T1 sekvencích. Nález hyperintenzivního signálu v zadní části hypofýzy je u zdravé populace zcela fyziologický. U osob s DI je tento signál snížen nebo chybí. Experimentální studie prokázaly, že intenzita signálu koreluje s obsahem vazopresinu (ADH) v neurohypofýze [16]. Soudíme, že tyto změny na hypofýze mohou být permanentní, nemusí mít však permanentní dopad na funkci hypotalamohypofyzárního systému.
Závěr
Granulom hypofýzy při GPA je velmi vzácný. Klinická manifestace v podobě DI je ještě vzácnější. V diferenciální diagnóze příčiny DI centrálního typu je však třeba tuto možnost brát v úvahu, zejména, je-li u pacienta již diagnostikována GPA.
doc. MUDr. Miroslava Horáčková, CSc.
miroslava.horackova@fnmotol.cz, horackov@email.cz
Interní klinika 2. LF UK a FN v Motole,
Praha
www.fnmotol.cz
Doručeno do redakce 28. 6. 2016
Přijato po recenzi 11. 7. 2016
Sources
1. Sampei S, Watanabe R, Ishii T et al. Granulomatosis with polyangiitis preceded by central diabetes insipidus. Intern Med 2014; 53(15): 1725–1726.
2. Slabu H, Arnason T. Pituitary granulomatosis with polyangiitis. BMJ Case Rep 2013; 2013. pii: bcr2013008656. Dostupné z DOI: <http://dx.doi.org/10.1136/bcr-2013–008656>.
3. Ball GV, Bridges SL. Vasculitis. Oxford University Press: Oxford 2002. ISBN 978–0192630537.
4. De Parisot A, Puéchal X, Langrand C et al. Pituitary involvement in granulomatosis with polyangiitis: report of 9 patients and review of the literature. Medicine (Baltimore) 2015; 94(16): e748. Dostupné z DOI: <http://dx.doi.org/10.1097/MD.0000000000000748>.
5. Miesen WM, Janssens EN, van Bommel EF. Diabetes insipidus as the presenting symptom of Wegener’s granulomatosis. Nephrol Dial Transplant. 1999; 14(2): 426–429.
6. Garovic VD, Clarke BL, Chilson TS et al. Diabetes insipidus and anterior pituitary insufficiency as presenting features of Wegener’s granulomatosis. Am J Kidney Dis 2001; 37(1): E5.
7. Al-Fakhouri A, Manadan A, Gan J et al. Central diabetes insipidus as the presenting symptom of granulomatosis with polyangiitis. J Clin Rheumatol. 2014; 20(3): 151–154.
8. Yong TY, Li JY, Amato L et al. Pituitary involvement in Wegener’s granulomatosis. Pituitary 2008; 11(1): 77–84.
9. Kapoor E, Cartin-Ceba R, Specks U et al. Pituitary dysfunction in granulomatosis with polyangiitis: the Mayo Clinic experience. J Clin Endocrinol Metab 2014; 99(11): 3988–3994.
10. Düzgün N, Morris Y, Güllü S et al. Diabetes insipidus presentation before renal and pulmonary features in a patient with Wegener’s granulomatosis. Rheumatol Int 2005; 26(1): 80–82.
11. Czarnecki EJ, Spickler EM. MR demonstration of Wegener granulomatosis of the infundibulum, a cause of diabetes insipidus. AJNR Am J Neuroradiol 1995; 16(4 Suppl): 4S968–4S970.
12. Tenorio Jimenez C, Montalvo Valdivieso A, López Gallardo G et al. Pituitary involvement in Wegener’s granulomatosis: unusual biochemical findings and severe malnutrition. BMJ Case Rep 2011; 2011. pii: bcr0220113850.Dostupné z DOI: <http://dx.doi.org/10.1136/bcr.02.2011.3850>.
13. Spísek R, Kolouchová E, Jensovský J et al. Combined CNS and pituitary involvement as a primary manifestation of Wegener granulomatosis. Clin Rheumatol 2006; 25(5): 739–742.
14. Tappouni R, Burns A. Pituitary involvement in Wegener’s granulomatosis. Nephrol Dial Transplant 2000; 15(12): 2057–2058.
15. Hoffman GS, Kerr GS, Leavitt RY et al. Wegener granulomatosis: an analysis of 158 patients. Ann Intern Med 1992; 116(6): 488–498.
16. Fujisawa I. Magnetic resonance imaging of the hypothalamic-neurohypophyseal system. J Neuroendocrinol 2004; 16(4): 297–302.
Labels
Diabetology Endocrinology Internal medicineArticle was published in
Internal Medicine

2016 Issue 7-8
-
All articles in this issue
- Určení prevalence potenciálních lékových interakcí u pacientů léčených 5 a více léčivými přípravky v České a Slovenské republice
-
Autoimunitná inzulítída u pacientov s diabetes mellitus 2. typu.
Randomizovaný klinický prieskum u hospitalizovaných pacientov. - Klinický přínos nových bazálních analog inzulinu
- Posuny v nutričních doporučeních pro zdravé obyvatelstvo a jejich dopad pro diabetickou dietu
- Syndrom porušeného vnímání hypoglykemie u diabetes mellitus
- Hypoglykemie jako symptom maligního onemocnění v dospělém věku
- Sepse – jak ji poznat, na co se zaměřit aneb zpět k základům ve světle nové definice
- Kůže – zrcadlo vnitřních nemocí
- Vliv antidiabetické léčby na skelet nemocných s diabetes mellitus 2. typu
- Přínos urgentně provedené endoskopické retrográdní cholangiopankreatografie pro terapii akutní pankreatitidy
- Diabetes mellitus 2. typu a srdeční selhání
- Diferenciální diagnostika pleurálních výpotků
- Nežádoucí účinky biologické léčby v revmatologii
-
Možnosti ovlivnění kardiovaskulárního rizika u diabetes mellitus 2. typu antidiabetickou léčbou
Snížení kardiovaskulárního rizika při léčbě liraglutidem – výsledky studie LEADER - Metanol: hrozba intoxikace je stále aktuální
- Diabetická retinopatie: patogeneze a terapeutické implikace
- Diference a poměr sérových koncentrací natria a chloridů u pacientů s hyponatremií
- Cílové hodnoty systolického krevního tlaku
- Klinický význam natriuretických peptidů v diferenciální diagnostice dušnosti
- Srdeční selhání se zachovanou ejekční frakcí
- Blízká budoucnost léčby dyslipidemie u diabetiků 2. typu
- Antagonisté glukagonu otevírají novou cestu v léčbě diabetu 2. typu
- Breviár edukácie diabetika pre internistu
- Prevence a terapie sarkopenie ve stáří
- Granulomatóza s polyangiitidou manifestující se jako diabetes insipidus
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue
- Sepse – jak ji poznat, na co se zaměřit aneb zpět k základům ve světle nové definice
- Kůže – zrcadlo vnitřních nemocí
- Prevence a terapie sarkopenie ve stáří
- Hypoglykemie jako symptom maligního onemocnění v dospělém věku
