Prevence a terapie sarkopenie ve stáří
Prevention and therapy of sarcopenia in the ageing
Sarcopenia is one of the severe disorders associated with nutritional imbalance. While sarcopenia is an inseparable part of the process of ageing as people get older, it plays a vital role in pathological situations such as protein-calorie and kwashiorkor malnutrition, it accompanies various diseases of rheumatic character and is an almost ever-present feature of the clinical picture of oncological patients. Sarcopenia in people under strain is fatally manifested mainly in the elderly, medically fragile patients. In view of the fact that sarcopenia is the decisive factor regarding the course of chronic as well as acute illnesses, it must be diagnosed, monitored and appropriately treated in time. Although nutrition is not the only factor involved especially in older age in the development of sarcopenia, the type of nutritional support and, in the new era, particularly nutritional pharmacology, form the underlying principles of the approach to the comprehensive care of the patient.
Key words:
ageing – lipids – malnutrition – proteosynthesis – sarcopenia
Authors:
Zdeněk Zadák
Authors‘ workplace:
Centrum pro výzkum a vývoj III. interní gerontometabolické kliniky LF UK FN Hradec Králové
Published in:
Vnitř Lék 2016; 62(7-8): 671-677
Category:
Reviews
Overview
Sarkopenie patří mezi nejzávažnější poruchy spojené s nutriční dysbalancí. Přestože je sarkopenie s postupujícím věkem neodlučitelnou složkou v procesu stárnutí, hraje samostatnou vitální roli v patologických situacích, jako je podvýživa proteino-kalorického i kwashiorkorového typu, provází řadu onemocnění revmatologického charakteru, je součástí prakticky vždy klinického obrazu u onkologických pacientů. Sarkopenie ve stresové zátěži se fatálně projevuje zejména ve stáří u tzv. křehkých pacientů. Vzhledem k tomu, že sarkopenie rozhoduje o průběhu chronických i akutních onemocnění, je nezbytné ji včas diagnostikovat, monitorovat a správně léčit. I když výživa není jediným faktorem, který zejména ve stáří se na vzniku a rozvoji sarkopenie podílí, je typ nutriční podpory a v nové době, zejména nutriční farmakologie, principiálním přístupem v komplexní léčbě pacienta.
Klíčová slova:
lipidy – malnutrice – proteosyntéza – sarkopenie – stárnutí
Úvod
Mezi nejzávažnější poruchy výživy patří malnutrice a její metabolické a orgánové důsledky. Malnutrice je patologický stav způsobený nedostatkem nebo nevyrovnaným příjmem základních živin. Pro pokročilá stadia poruch způsobených nedostatkem základních živin – bílkovin a zdrojů energie, sacharidů a tuků, je používán termín kachexie. Nejvyšší stupeň kachexie se označuje jako marazmus. Stav kachexie se podle etiologie může dělit na další podskupiny, např. nádorová kachexie, kardiální kachexie, kachexie u neurodegenerativních onemocnění a další. Součástí všech těchto typů poruch nutrice je v drtivé většině případů významný pokles hmoty kosterního svalstva označovaný termínem sarkopenie [1,2]. Pro deficit jednotlivých speciálních nutrientů, jako jsou vitaminy a stopové prvky, případně další esenciální složky výživy (esenciální fosfolipidy, nepostradatelné mastné kyseliny řady n-6 a n-3) používáme pojem karence.
Obecně rozlišujeme 2 základní typy malnutrice:
- marantický typ – proteino-kalorická malnutrice
- kwashiorkorový typ – malnutrice způsobená převážně deficitem proteinů, kdy z obecného hlediska převládá nedostatek nebo zvýšený katabolizmus proteinů (např. ve stresu) nad příjmem biologicky hodnotných proteinů a proteinovým anabolizmem
Etiopatogeneticky má k tomuto stavu blízko sarkopenická obezita, vyskytující se u metabolického syndromu, diabetu 2. typu a některých typů hyperlipoproteinemie a málo pohyblivých obézních starých pacientů.
Stav protrahovaného hladovění, zejména při vystupňovaném katabolizmu, se vyznačuje negativní dusíkovou bilancí, takže dochází k nadměrným ztrátám bílkovinných zásob organizmu. Při závažném katabolizmu přes zapojení mechanizmů šetřících protein vzniká v průměru negativní dusíková bilance se ztrátou až 75 g proteinů denně, což odpovídá přibližně ztrátě 300 g svalové hmoty denně.
Aminokyselinami získanými katabolizmem svalové tkáně je zajišťována glukoneogeneze z glukoplastických aminokyselin a současně jsou zvýšeně využívány rozvětvené aminokyseliny jako zdroj ketolátek (β-hydroxybutyrát, acetoacetát), které jsou využívány jako zdroj energie pro svalstvo a nervový systém.
Adaptace na glukóze závislých orgánů na zvýšené využití ketolátek namísto glukózy vede k úspoře svalové hmoty, pokud jsou ketolátky získávány z tukové tkáně, naopak při vystupňovaném katabolizmu se zvyšuje odbourávání svalové hmoty s cílem získat ketogenní aminokyseliny – valin, leucin, izoleucin – jako zdroj energie. Těmito mechanizmy se sarkopenie – úbytek svalové hmoty stává nedílnou součástí malnutrice, ať jde o marantický (proteino-kalorický) nebo kwashiorkorový (stresový) typ malnutrice [1]. Také při prostém hladovění při režimu získávání energie z tukové tkáně dochází vždy k úbytku svalové tkáně, které dosahuje až 50 % hrazení energie z endogenních zdrojů.
Vedle patologického úbytku svalové hmoty, jako součást některého z typů malnutrice nebo samostatně, se objevuje sarkopenie fyziologicky s pokračujícím věkem. Tento typ sarkopenie je se stárnutím neodvratně spojen, začíná již ve věku 30 let u mužů a poněkud později u žen. Průběh sarkopenie závislé na věku sice zastavit nelze, je však možné ji zřetelně zpomalit účinnou fyzickou aktivitou a cílenými nutričními opatřeními [3].
Je nutné počítat s tím, že celkový pokles svalové hmoty mezi věkem 20 let a 90 let činí prakticky 50 % celkové hmotnosti svalů. Podle stylu života a výživy se pohybuje úbytek svalstva závislý na věku v rozmezí 1–2 % za rok po 50 letech věku jedince. Pokles svalové hmoty závisí nejen na sedavém typu života a deficitní nutrici, ale také na četných patologických vlivech, které mění rovnováhu mezi syntézou a degradací svalových bílkovin. S úbytkem svalové hmoty se mění i svalová síla a svalová výkonnost. Snižuje se dynamická, statická i izokinetická svalová síla, což se odráží ve snížené spotřebě kyslíku ve svalech v rozmezí 3–8 % za dekádu života a začíná již v 30 letech věku.
Mechanizmy vzniku sarkopenie
Na vzniku sarkopenie se podobně jako při rozvoji malnutrice podílí mnoho vlivů, metabolických a energetických rovnováh:
- sedavý způsob života
- poruchy výživy – zejména nedostatečný přívod biologicky hodnotných bílkovin
- vliv trofických hormonů:
- růstový hormon
- androgeny (testosteron)
- insulin like growth factor 1 (IGF1)
- dehydroepiandrosteron sulfát (DHEAS)
- estrogeny (estron, estradiol)
- 25-hydroxyergokalciferol (vitamin D)
- stav proteinové rovnováhy
- přítomnost neurodegenerativních procesů
- degenerativní procesy svalových vláken
- stárnutí spojené s nižší syntézou svalových proteinů myofibrilárního proteinu (aktin/myozin) a mitochondriálních proteinů
- vliv inflamatorního procesu – zejména zvýšení produkce interleukinu IL1 a IL6 [4]
Role inflamatorního procesu na vznik sarkopenie
Specifické chorobné stavy jsou velmi často spojeny s kachexií. Osoby trpící rozvojem kachexie mívají pravidelně depleci svalové hmoty dosahující až 80 % jejich normální náležité hodnoty. Vedle výskytu sarkopenie u nádorů, revmatoidní artritidy, městnavého srdečního selhání, chronické respirační insuficience, jaterní cirhózy se vyskytuje sarkopenie způsobená přítomným inflamatorním procesem i u zdánlivě zdravých osob. U jedinců věkových skupin vyšších než 70 let, kteří netrpí klinicky zjevným kachektizujícím onemocněním, jsou nalézány zvýšené plazmatické hodnoty interleukinu IL6, interleukinu IL1 a TNFα (tumor necrosis factor α). Současně s tím bývají zvýšeny i hodnoty C-reaktivního proteinu, sérového amyloidu A, případně dalších bioindikátorů zánětu (fibrinogen, orosomukoid, α1-antitrypsin). Pozoruhodným nálezem je i zvýšení neopterinu, který je charakteristickým neproteinovým ukazatelem inflamatorního procesu. Často se vyskytující vzestup plazmatických hladin interleukinu IL6 se stoupajícím věkem je vysvětlován jako výsledek hypersekrece katecholaminů a snížením sekrece pohlavních hormonů. Dalším vysvětlením vzestupu inflamatorních markerů bez významnější klinické symptomatologie je spojován s výskytem viscerální obezity, subklinických infekcí chlamydiemi nebo Helicobacter pylori [5].
Často jsou nalézány chronické fokální infekce, zejména apikální zubní granulomy, případně asymptomatické bakteriurie.
Chronicky zvýšená sekrece cytokinů má negativní účinek na stabilitu svalové hmoty a obecně vede i k depleci viscerálního proteinu. Proinflamatorní cytokiny vedou nejen k stimulaci katabolizmu proteinů, ale často i k anorexii a celkově sníženému nutričnímu stavu. Cytokiny také působí přímo na supresi příjmu potravy a kachexie je téměř vždy spojena s anorexií, při níž cytokin IL1 a TNFα působí na senzitivní glukózové neurony ve ventromediálním hypotalamu (tzv. centrum sytosti) a laterální hypotalamické oblasti (tzv. centrum hladu). Tento účinek je častou příčinou anorexie pozorované u pacientů v intenzivní péči a četných chronických chorobách a febrilních stavech.
Pacienti s rozvinutou kachexií ztrácejí progresivně kosterní svalstvo s relativním uchováním proteinů ve viscerálních zásobách. Ztráta svalové hmoty je v převážné většině způsobena kombinací snížené produkce syntézy proteinů a zvýšením proteinového katabolizmu. Molekulární mechanizmus proteinového katabolizmu v procesu rozvoje sarkopenie je spojen s indukcí svalově specifické ubikvitin-ligázy stimulované katabolickými hormony, jako jsou glukokortikoidy. Ale často se uplatňuje také inhibice anabolické cesty řízené IGF1 a mTOR (mammalian target of rapamycin).
Homeostáza mezi syntézou a degradací svalového proteinu závisí z velké části na mechanizmu regulovaném lyzosomální a ubikvitinovou cestou. V procesu nádorové kachexie spojené se sarkopenií se uplatňuje klíčová role DGC (dystrophin glycoprotein complex) [6].
Význam vitaminu D při rozvoji sarkopenie
Sarkopenie jako multifaktoriální geriatrický syndrom, který se ve stáří vyskytuje v běžné populaci od 30 % až do 68 %. Vedle hormonálních změn (pokles testosteronu, růstového hormonu, rezistence stárnoucího svalu na anabolické hormony, oxidativní stres, mitochondriální dysfunkce) je v zařízeních pro dlouhodobou péči sarkopenie spojena s vysokým výskytem deficitu vitaminu D [7]. Role tohoto vitaminu se někdy jeví spíše jako hormonální mediátor, než esenciální složka výživy. Hypovitaminóza D má vysokou prevalenci u postmenopauzálních žen, u nichž je pozorována v asijských zemích až v 90 %, v Evropě 92 % a v průřezové populaci ve Spojených státech od 41 do 82 % v závislosti na etnické skupině.
Příznivý efekt udržení optimálních hladin vitaminu D je relativně nový koncept v pohledu na sarkopenii ve stáří. Při deficitu vitaminu D jsou postižena predominantně svalová vlákna typu 2 jak funkčně, tak anatomicky. Přímý účinek vitaminu D na svalový systém není dosud plně objasněn. Předpokládá se účinek na genovou transkripci v oblasti proteinové syntézy. Velmi významný je podle experimentálních i klinických studií inhibiční efekt na expresi genu pro myostatin, jehož inhibicí je dosažena zvýšená proliferace svalových buněk. Dalším prokazatelným účinkem je zvýšená exprese receptorů pro vitamin D v jádrech regenerujících svalových buněk a regulace metabolizmu kalcia a fosfátů. V oblasti energetiky svalové tkáně bylo zjištěno, že vitamin D je schopen zlepšit mastnými kyselinami indukovanou inzulinovou rezistenci ve svalu. Optimální dostupnost vitaminu D ve stáří má prokazatelně ochranný efekt před rozvojem sarkopenie.
Dále je nutné opět zdůraznit prokázaný protektivní účinek vitaminu D na svalová vlákna 2. typu. Tato rychle se stahující složka příčně pruhovaného svalu, vzhledem k rychlosti stahu, hraje významnou úlohu v předcházení pádů u starých osob. Nedostatek vitaminu D, které se vyskytuje velmi významně ve stáří, má za následek pomalou reakci svalstva starých osob při zábraně pádů, což má mnohdy pro křehkého starého jedince katastrofální důsledky.
Diagnostika sarkopenie
Klinické a antropometrické vyšetření
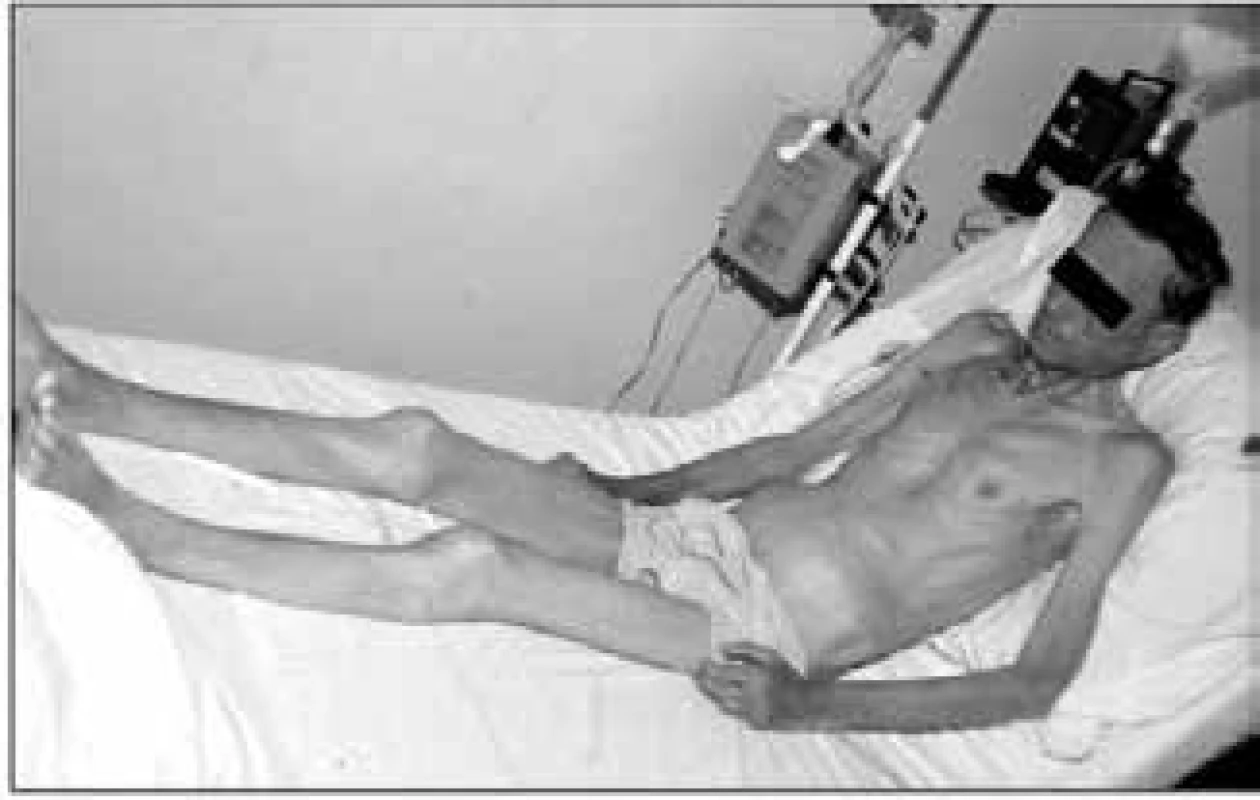
Při fyzikálním vyšetření odhadujeme svalovou hmotu inspekcí a palpací podkoží v oblasti různých svalových skupin. Jestliže prominují šlachy svalů a jsou lehce přístupné palpaci, znamená to, že pacient ztratil již nejméně 30 % tělesné bílkoviny [1]. Marantický typ malnutrice ukazuje obr. 1.
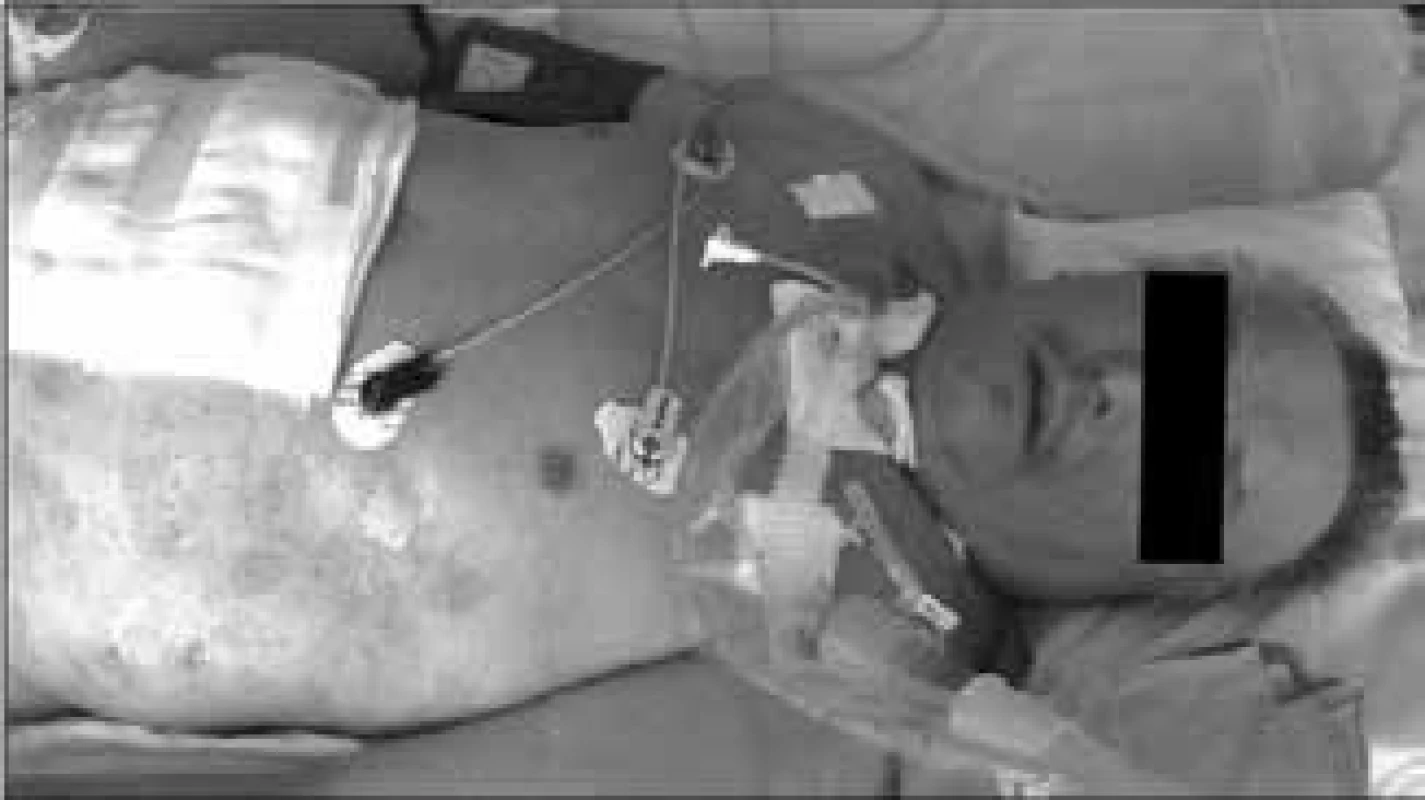
Při rozsáhlém čerpání energie z viscerálních a somatických proteinů není využívaná tuková tkáň a nemocný si při velmi rozsáhlé devastaci proteinových zásob (stresový autokanibalizmus) uchovává nezmenšenou tukovou zásobu, jejíž objem je navíc zvětšen intersticiálním prosáknutím retinovanou tekutinou, takže velmi dlouho dělá dojem dobře živeného jedince, a to i v situaci, v níž je těžkou malnutricí již vitálně ohrožen [2]. Kwashiorkorový typ malnutrice ukazuje obr. 2.
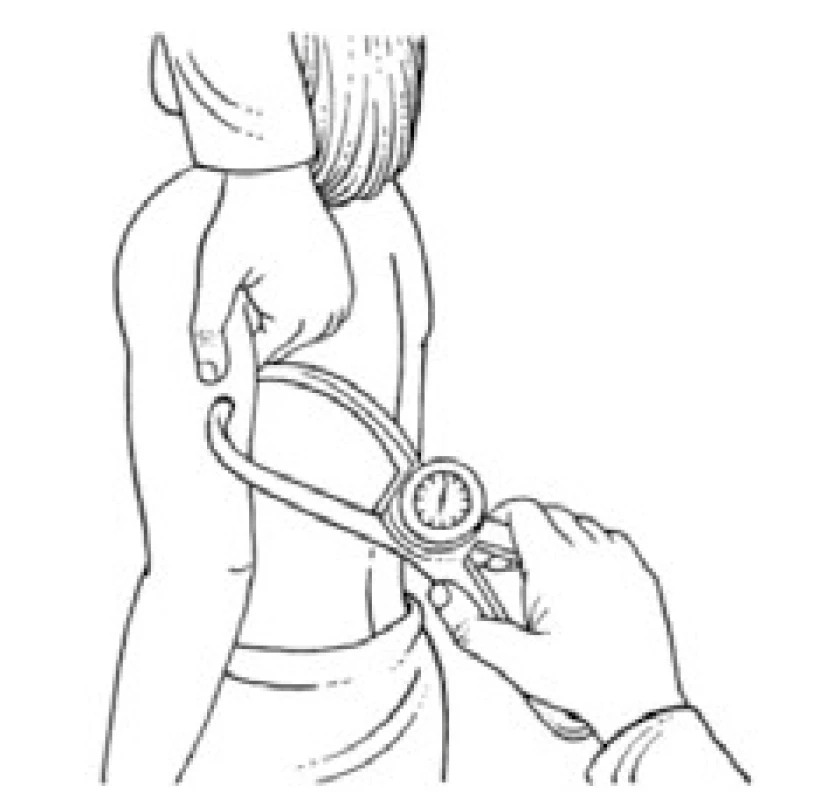
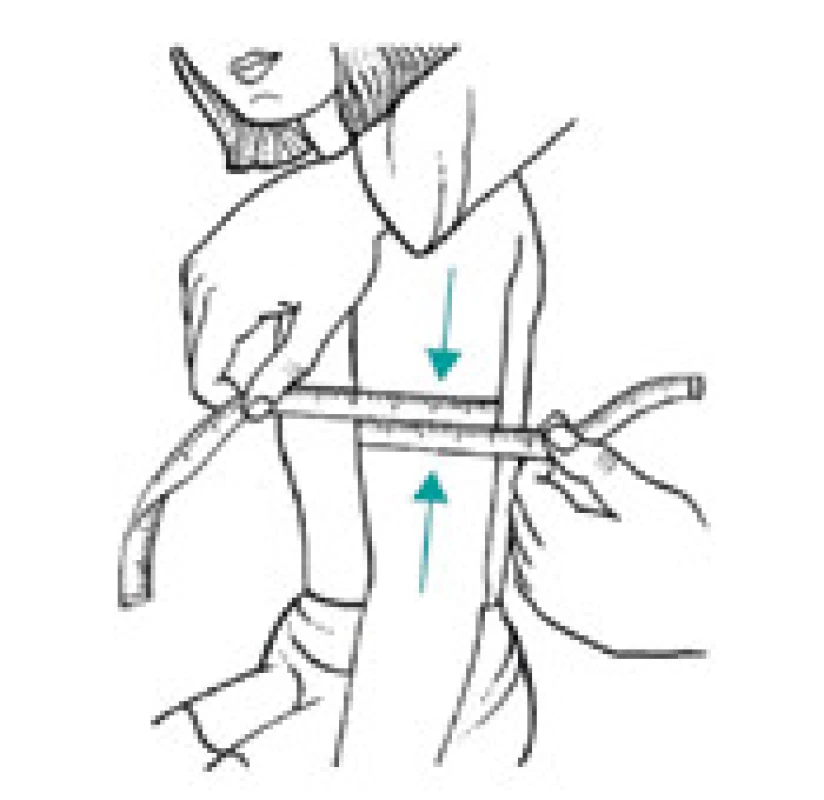
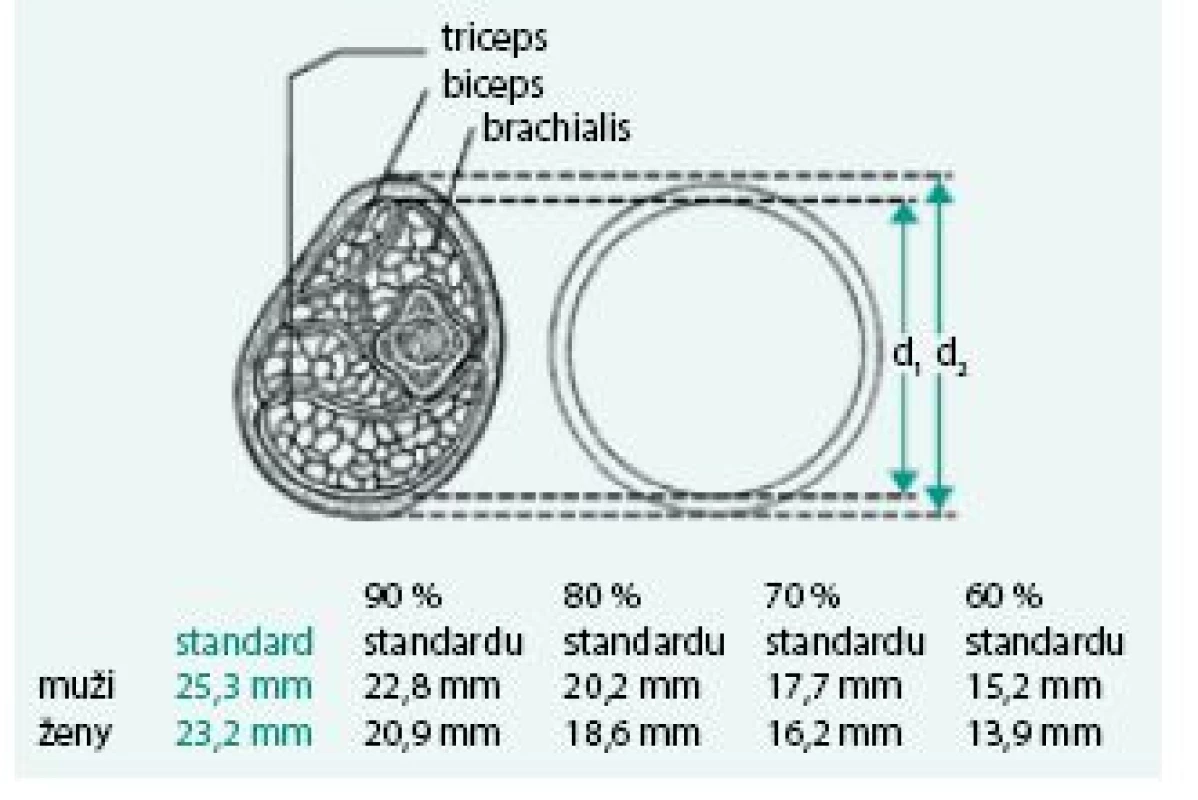
Úbytek svalstva lze s využitím antropometrických metod kvantifikovat pomocí měření obvodu paže, od kterého se odečte vrstva podkožního tuku měřená kaliperem. Tato jednoduchá klinická metoda při longitudinálním sledování dává spolehlivé klinické výsledky a je dobrým ukazatelem úbytku svalové hmoty nemocného. Metoda je založena na předpokladu, že paže je válec svalstva pokrytý vrstvou tukové podkožní tkáně a dvojitá tloušťka této vrstvy tuku je reprezentována naměřenou hodnotou kožní řasy nad tricepsem. Pak se obvod svalové hmoty paže vypočítá ze vztahu:
OSP = OP – 3,14 × TKŘ
(OSP – obvod svaloviny paže v cm OP – obvod paže měřený páskovou mírou v polovině vzdálenosti mezi akromion a olekranon v cm TKŘ – tloušťka kožní řasy v mm měřená na stejném místě jako obvod paže) [1,8].
Výpočet obvodu svalů paže schematicky demonstrují obr. 3–5.
Bioindikátory sarkopenie
Kreatinin-výškový index
Kreatinin se tvoří v konstantním množství každý den zhruba 1,7 % z celkového svalového kreatinu, který po změně v kreatinin již nemůže být zapojen zpět do kreatinfosfátového metabolizmu. Ireverzibilní změna části kreatininu z celkového kreatinu je konstantní. Kreatin je ve svalstvu rovněž v konstantním definovaném množství, a proto může být využit k vypočítání celkové svalové hmoty. Denní vylučování kreatininu tedy může být za předpokladu konstantní tvorby kreatininu ve svalu užito jako měřítko celkové svalové hmoty. Vyloučení 1 g kreatininu denně je ekvivalentní 17–20 kg svalstva. Hmota kosterního svalstva bez tuku představuje průměrně 49 % celkové tělesné hmotnosti. Pro osoby, které jsou na bezmasé dietě, představuje svalová hmota v kilogramech 2,723 mmol kreatininu vyloučeného močí za 24 hod. Tyto vztahy jsou použitelné pro zdravé osoby mladšího a středního věku, nemohou však být využity přímo pro staré jedince a pro nemocné jakékoliv věkové kategorie [1]. Abychom vyloučili v klinickém použití při stanovení svalové hmoty významnější chyby, je nutné, aby se jednak vyloučil vliv kreatininu, který se dostává do organizmu dietou, dále je nutné, aby sběr moči na stanovení kreatininu trval celých 24 hod, ještě přesnější výsledky však získáme při sběru moči následně 3 dny za sebou. Vyloučí se tak i cirkadiální kolísání. K vyjádření svalové hmoty se pro klinické podmínky používá kreatinin-výškový index, který srovnává naměřenou exkreci kreatininu za 24 hod u vyšetřovaného jedince s exkrecí kreatininu, která odpovídá jedinci stejné výšky s normální svalovou hmotností:
KVI = KN (mg/24 hod)/KT (mg/24 hod) × 100
(KVI – kreatinin-výškový index KN – naměřená hodnota odpadu kreatininu za 24 hod KT – hodnota odpadu kreatininu odečtená z tabulek pro zdravého jedince stejné výšky)
Stanovení 3-metylhistidinu
Měření 3-metylhistidinu v moči je dobře využitelná metoda pro stanovení hmoty a metabolizmu kosterního svalstva. Metylhistidin je modifikovaná aminokyselina obsažená v aktinu a myozinu svalstva. Při katabolizmu myofibril 3-metylhistidin, vzhledem ke své modifikaci, už není využitelný pro syntézu proteinů a je vylučován do moči. Množství 3-metylhistidinu vylučovaného do moči je tedy ukazatelem obratu svalových proteinů, nebo celkových zásob proteinů ve svalstvu. U zdravých jedinců je vylučování 3-metylhistidinu v rozmezí 1,3 ± 1 až 7,8 ± 0,4 μmol/kg tělesné hmotnosti a den. Vylučování 3-metylhistidinu se mění s věkem a hormonální rovnováhou. Klinické použití vylučování 3-metylhistidinu do moči jako měřítka obratu svalových bílkovin je omezeno nedostatkem standardních hodnot pro spolehlivou interpretaci výsledků. Variabilita u člověka je vysoká v průběhu dní i z hlediska diurnálních změn [8].
Myostatin a TGFβ (transformin growth factor β)
Myostatin je zodpovědný za regulaci růstu svalové hmoty a potlačení jeho exprese vede k rozvoji hypermuskulárních jedinců. Myostatin patří do skupiny TGFβ, je evolučně vysoce stabilní a jeho zdrojem jsou převážně vlákna příčně pruhovaného svalu [9].
Aktivin A a B
Aktiviny jsou další členové skupiny TGFβ a jsou definovány jako negativní regulátory tvorby hmoty příčně pruhovaného svalstva [10].
Irisin
Myokiny, adipokiny a adipomyokiny regulují růst svalové hmoty využitím autokrinních, endokrinních a parakrinních mechanizmů. Irisin je identifikován jako peptidický produkt uvolňovaný ze svalové hmoty [11].
Proteiny regulující kontraktilitu svalstva
Do této skupiny patří troponiny, které jsou klíčovými regulátory proteinů sloužících pro svalový stah. V příčně pruhovaném svalstvu je kontraktilita dosažena aktivací komplexního procesu, na kterém se podílí několik proteinů a jejich izoforem. Tento děj je regulovaný kalciovými ionty a troponinovým komplexem. Za normálních okolností se troponiny nevyskytují v měřitelném množství v krvi. Výjimkou je zvýšený obrat, štěpení a regenerace svalové tkáně zejména u svalového poškození. Nález troponinu v plazmě se vedle akutního poškození příčně pruhovaného svalstva objevuje při amyotrofické laterální skleróze, myastenia gravis a charakteristicky provází rychlý rozvoj sarkopenie a kachexie.
Testování funkce a hmoty příčně pruhovaného svalstva při monitorování rozvoje sarkopenie
Zhodnocení nutričního stavu měřením svalové síly dynamometrem
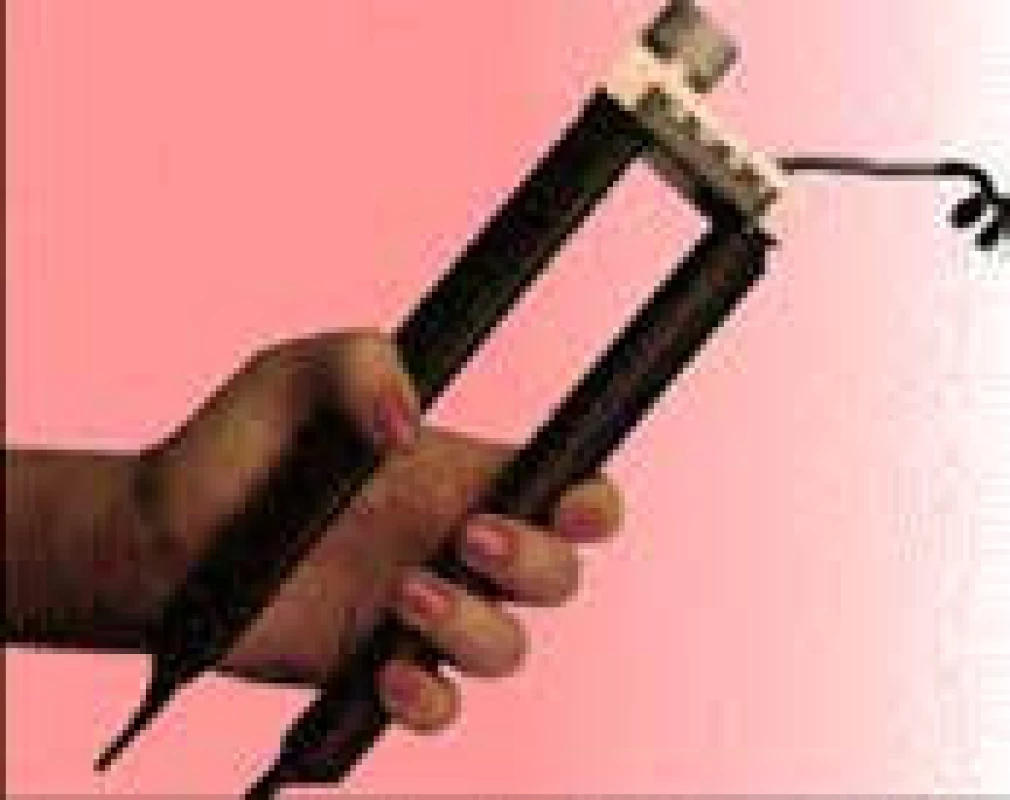
Velmi užitečné je pro zhodnocení nutričního stavu měření svalové síly dynamometrem (hand grip), zejména jako ukazatele k posouzení funkční svalové hmoty v období rekonvalescence a změn stavů výživy [8].
Nejjednodušším způsobem je hodnocení stisku ruky pomocí mechanického nebo elektronického dynamometru (obr. 6).
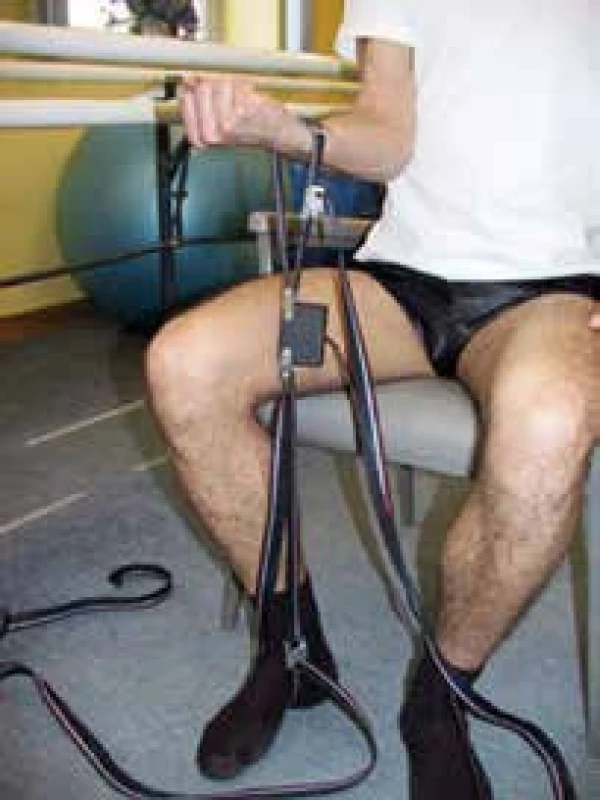
Dynamometrie může být technicky prováděna měřením svalové síly horní nebo dolní končetiny použitím víceúčelového myometru (obr. 7).
Využití zobrazovacích metod v hodnocení sarkopenie
Zobrazovací technologie využívané k detekci ztráty hmoty kosterního svalstva v procesu sarkopenie zahrnují následující metody:
Duální RTG absorpce (DEXA)
DEXA je technologie, která je velmi často používaná ke studiu kostní denzity. Metoda může být použita k měření netukové složky organizmu v rozsahu celotělovém nebo specifických anatomických oblastí (paže, trup, dolní končetiny). I když tato metoda vykazuje integrálně hodnoty nejen svalové hmoty, ale také vaziva, kůže a dalších tkáňových složek, velmi dobře koreluje s objemem svalové hmoty a může být využita k odhalení sarkopenie. Metoda je relativně levná, spojena s nízkou radiační zátěží (méně než 1 mR), takže může být v oblasti sledování sarkopenie prakticky dobře využita. Nevýhodou je, že DEXA není mobilní a hodnotitel musí mít v této oblasti zkušenosti [8].
Výpočetní tomografie
Vyšetření pomocí CT (computed tomography) poskytuje výsledky hodnotící jednak celkovou svalovou hmotu, případně vyhodnocení lokálních svalových skupin. Vzhledem k radiační zátěži a ceně vyšetření se hodí spíše pro výzkumné účely [12].
Zobrazení magnetickou rezonancí
Zobrazení magnetickou rezonancí (MRI), podobně jako CT, patří mezi doporučené metody pro spolehlivou diagnózu sarkopenie, která dobře rozliší nejen svalovou hmotu, ale také infiltraci svalů tukem. MRI je neinvazivní, není spojena s radiační zátěží a vykazuje lepší výsledky než antropometrie, bioimpedance nebo metody využívající stabilních izotopů. Nevýhodou je vysoká cena a nepohyblivost zařízení.
Ultrasonografické vyšetření svalové hmoty
Skenování svalové hmoty ultrazvukem je velmi výhodná, neinvazivní zobrazovací technika umožňující studovat úbytek svalstva a kvalitativní i kvantitativní změny svalové hmoty, zejména průběh sarkopenie. Má rovněž výhodu možnosti sledovat tukovou infiltraci svalové hmoty, která se podílí na vzniku inzulinové rezistence. Metoda je neinvazivní, relativně levná, nezatěžující pacienta radiačně, hodí se jak pro klinické, tak výzkumné použití, je možné mobilní použití (vyšetření na JIP).
Stanovení skladby těla pomocí elektrické bioimpedance
Reaktance a impedance jsou elektrické veličiny (neohmický odpor), které jsou závislé na více faktorech, z nichž rozhodující je množství elektrolytů ve vodním prostředí, kterým je elektrický proud veden (zcela čistá voda elektrický proud nevede), dále druhu iontů, teplotě roztoku a charakteristice elektrického proudu (intenzita a frekvence elektrického proudu). Stanovení tělesné skladby (netukové a tukové hmoty těla) je založeno na principu, že bioimpedance je založena na podílu vody v těle a v ní rozpuštěných iontů. Střídavý elektrický proud nízké frekvence (menší než 5 kH) neprochází přes buněčné membrány, které působí svým složením jako kapacitní odpor. Se stoupající frekvencí střídavého proudu o nízké intenzitě se zvyšuje průchod proudu přes buněčné membrány a tím přes buněčné prostředí. Použitím vyšších frekvencí elektrického proudu se uplatňuje i vodivost intracelulární vody, takže při použití vyšších frekvencí střídavého elektrického proudu dochází ke snížení elektrické impedance a je měřena celková tělesná voda současně s extracelulární vodou. Výsledky měření moderními typy přístrojů umožňujícím měření v celém spektru frekvencí, jsou schopné zobrazit celkovou tělesnou vodu, procento tělesného tuku a netukovou hmotu těla, nezjišťují tedy specificky svalovou hmotu. Chyba metody činí 4–5 % a je srovnatelná s měřením tloušťky kožní řasy kaliperem [13].
Možnosti ovlivnění sarkopenie – nutriční postupy a využití nutriční farmakologie
Tím, že sarkopenie je multifaktoriální na věku závislá porucha spojená se sedavým způsobem života, poruchami výživy, ztrátou anabolických a katabolických mechanizmů a současně zvýšením abnormální tvorby a sníženého potlačení tvorby aktivních forem kyslíku (nesprávně označovaných volné kyslíkové radikály) existuje mnoho metabolických a nutričních cest, které s rozdílnou mírou spolehlivosti mohou rozvoj sarkopenie potlačit [14]. Je známo, že řešení sarkopenie je významným prvkem, který zlepšuje kvalitu života kritických pacientů v intenzivní péči stejně tak, jako kvalitu života stárnoucí populace a vede k významnému snížení nákladů na zdravotní péči. Základem péče při potlačení sarkopenie ve stáří i jejího vzniku při závažných kritických stavech všech věkových skupin je využití ovlivnění nutričních potřeb, metabolických poruch a zlepšení pohybového režimu nemocných i stárnoucí populace.
Zajištění optimálního přívodu aminokyselin z kvalitativního i kvantitativního hlediska
Klinický výzkum prokazuje, že 80 % stimulačního efektu na syntéze proteinů se týká aminokyselinového složení [1]. Uplatňuje se zde kombinace vlivu spektra aminokyselin současně s jejich farmakologickým účinkem. Důležitý je též poměr přívodu aminokyselin ve vztahu k celkovému energetickému přívodu. Široké populační analýzy ukazují, že starší populace v rozmezí mezi 56–80 lety věku vyžaduje vyšší přívod biologicky hodnotného proteinu (1,14 g/kg tělesné hmotnosti a den) ve srovnání s mladou populací (0,8 g/kg tělesné hmotnosti a den) [4]. Výrazné zvyšování příjmu proteinů ve stáří však není vhodné (vyjma období po traumatu a v pooperační rekonvalescenci), protože vede ke glomerulární hyperfiltraci a neefektivnímu využití proteinů.
Význam proteosyntézy a její ovlivnění smíšeným přívodem nutrientů
Pro anabolické využití nutričních substrátů včetně aminokyselin je důležitá citlivost periferních tkání na inzulin [15]. Celkově inzulinová rezistence roste s věkem a tento jev může být zčásti ovlivněn redukcí svalové hmoty s pokračujícím věkem. Účinek inzulinu na proteosyntézu je zprostředkován zčásti oxidem dusnatým (NO), který významně ovlivňuje průtok krve svalovou tkání. Paradoxně u starší věkové populace krevní průtok svalstvem a proteosyntéza klesá vlivem glukózy ve srovnání s podáním samotných aminokyselin. Možnou intervencí, kterou lze zvýšit proteosyntézu u starých jedinců, je kombinace zvýšeného přívodu aminokyselin s aerobním cvičením (např. 45 min trvající střední intenzita chůze zvyšuje inzulinovou senzitivitu a proteosyntézu po podání aminokyselin) [1,3,12].
Katabolizmus proteinů ve stáří
S pokračujícím věkem se postupně lehce, ale trvale, zvyšuje proteolýza, zejména při lačnění ve srovnání s mladými jedinci. Ubikvitin-proteazom-proteolytická cesta se jeví jako zásadně důležitá pro tento typ degradace svalového proteinu. Dochází k aktivaci ubikvitonových molekul. Potlačení ubikvitin-proteazomového systému po podání jídla se v experimentu projevilo významnější u mladých jedinců.
Důležitost optimálního přívodu energie
Stimulační účinek nutričních substrátů na proteosyntézu ve stáří je snížena, a nezvyšuje se dokonce, na rozdíl od mladších jedinců, ani po fyzické zátěži. Rozhodujícím momentem pro využití aminokyselin v proteosyntéze je současná fyzická zátěž, která následuje po významném příjmu aminokyselin.
Oxidativní stres a sarkopenie ve stáří
V současné době existuje představa, že sarkopenie je částečně vysvětlitelná zvýšením oxidativního metabolizmu a abnormální tvorbou aktivních forem kyslíku [14]. Zvýšená tvorba a akumulace oxidativních produktů indukuje vyšší stupeň buněčného poškození a jejich důležitých substancí, jako je deoxyribonukleová kyselina (DNA), proteiny a oxidabilní lipidy. Mitochondrie jsou centrem aerobního metabolizmu a také hlavním zdrojem aktivních forem kyslíku. Tím se podílejí na oxidativním poškození svalových buněk a vlivem oxidativního stresu vzniká modifikace mitochondriální DNA, která potlačuje proteosyntézu a produkci ATP. Dochází tím k indukci apoptózy cestou aktivace kaspázy. Objasnění těchto metabolických stavů vede logicky k návrhu využití suplementace antioxidantů potlačením sarkopenie stárnoucího svalu. Celý antioxidační mechanizmus skládající se ze zevního a vnitřního systému se rozkládá jak v lipofilní složce (vitamin E, karotenoidy), tak v hydrofilní složce (kyselina askorbová, glutation, flavonoidy, ubichinony). Nedílnou součástí jsou stopové prvky antioxidačního systému, zejména mangan, selen a zinek. Tím se vytváří hydrofilní a lipofilní zevní a vnitřní systém bránící poškození buněčných struktur oxidačními produkty. Tato oblast je sice velmi atraktivní, zakládá se na ní velký finanční obrat nutričních suplementů, ale celý efekt zevní suplementace v antioxidační obraně je velmi pochybný. Systém pracuje sice velmi dobře na úrovni studií in vitro, zčásti i v modelech na tkáňových kulturách, ale při studiích in vivo a v aplikaci klinické selhává a je velmi dubiózní. Celá oblast ovlivnění svalového metabolizmu antioxidanty je sice nadějná, ale má málo skutečných prokazatelných výsledků.
Nutriční farmakologie leucinu v potlačení sarkopenie ve stáří
V mechanizmu snížení sarkopenie a poškození svalstva hraje velmi důležitou roli leucin. Vlastní rozvětvená aminokyselina leucin nepůsobí přímo, ale její účinek na sarkopenii je vysvětlen konverzí na hydroxymetylbutyrát (HMB) [16]. Vliv hydroxymetylbutyrátu je důležitý pro stárnoucí populaci, zejména v období involuční sarkopenie, případně sarkopenie způsobené poškozením agresivní farmakoterapií, např. opakovanými celkovými anesteziemi, agresivní léčbou statiny a některými toxickými vlivy spouštějícími poškození svalstva a následnou sarkopenii. Hydroxymetylbutyrát je metabolizován na 3-hydroxy-3-metylglutaryl-koenzym A (HMG-CoA), který zvyšuje tvorbu cholesterolu zvýšením aktivity klíčového enzymu pro tvorbu cholesterolu hydroxymetylglutaryl-koenzym A reduktázy. Hydroxymetylbutyrát prokazuje schopnost zvyšovat proteosyntézu ve svalu v průběhu stárnutí a zejména v klinickém obraze vystupňované kachexie (nádorová kachexie, kardiální kachexie). Tento proces je umožněn expresí NF-κB, který je závislý na eTOR. Tento mechanizmus je zásadní v ochraně sarkolemy svalových buněk a je schopen stimulovat anabolické děje příčně pruhovaného svalu. Tento mechanizmus ukazuje zásadní možnosti nejen v ovlivnění sarkopenie pomocí nutriční farmakologie, ale otevírá cestu k hlubšímu porozumění i prevenci statinového poškození svalstva. Základní stupeň tohoto procesu demonstruje schéma.

Podpořeno MZ ČR - RVO (FNHK, 00179906).
prof. MUDr. Zdeněk Zadák, CSc.
zdenek.zadak@fnhk.cz
Centrum pro výzkum a vývoj III. interní gerontometabolické kliniky LF UK a FN Hradec Králové
www.fnhk.cz
Doručeno do redakce 21. 7. 2016
Přijato po recenzi 2. 8. 2016
Sources
1. Zadák Z. Výživa v intenzivní péči. 2.ed. Grada: Praha 2008. ISBN 978–80–247–2844–5.
2. Zadák Z, Havel E et al. Intenzivní medicína na principech vnitřního lékařství. Grada: Praha 2007. ISBN 978–80–247–2099–9.
3. Bahat G, Ilhan B. Sarcopenia and the cardiometabolic syndrome: A narrative review. Eur Geriatr Med 2016; 7(3): 220–223.
4. Thomas DR. Loss of skeletal muscle mass in aging: Examining the relationship of starvation, sarcopenia and cachexia. Clin Nutr 2007; 26(4): 389–399.
5. Batsis JA, Mackenzie TA, Jones JD et al. Sarcopenia, sarcopenic obesity and inflammation: Results from the 1999–2004 National Health and Nutrition Examination Survey. Clin Nutr 2016; pii: S0261–5614(16)30020–6. Dostupné z DOI: <http://dx.doi.org/10.1016/j.clnu.2016.03.028>.
6. Acharyya S, Butchbach MER, Sahenk Z et al. Dystrophin glycoprotein complex dysfunction: A regulatory link between muscular dystrophy and cancer cachexia. Cancer Cell 2005; 8(5): 421–432.
7. Arik G, Ulger Z. Vitamin D in sarcopenia: Understanding its role in pathogenesis, prevention and treatment. Eur Geriatr Med 2016; 7(3): 207–213.
8. Zadák Z, Květina J. Metodologie předklinického a klinického výzkumu v metabolismu, výživě, imunologii a farmakologii. Galén: Praha 2011. ISBN 978–80–7262–748–6.
9. Kalinkovich A, Livshits G. Sarcopenia – The search for emerging biomarkers. Ageing Res Rev 2015; 22 : 58–71.
10. Chen JL, Walton KL, Winbanks CE et al. Elevated expression of activins promotes muscle wasting and cachexia. FASEB J 2014; 28(4): 1711–1723.
11. Boström PA, Fernández-Real JM, Mantzoros C. Irisin in humans: recent advances and questions for future research. Metabolism 2014; 63(2): 178–180.
12. Sergi G, Trevisan C, Veronese N et al. Imaging of sarcopenia. Eur J Radiol 2016; 85(8): 1519–1524.
13. Lardiés-Sánchez B, Sanz-Paris A, Boj-Carceller D et al. Systematic review: Prevalence of sarcopenia in ageing people using bioelectrical impedance analysis to assess muscle mass. Eur Geriatr Med 2016; 7(3): 256–261.
14. Kim JS, Wilson JM, Lee SR. Dietary implications on mechanisms of sarcopenia: roles of protein, amino acids and antioxidants. J Nutr Biochem 2010; 21(1): 1–13.
15. Song YH, Song JL, Delafontaine P et al. The therapeutic potential of IGF-I in skeletal muscle repair. Trends Endocrinol Metab 2013; 24(6): 310–319.
16. Nissen SL, Abumrad NN. Nutritional role of the leucine metabolite β-hydroxy β-methylbutyrate (HMB). J Nutr Biochem 1997; 8(6): 300–311.
Labels
Diabetology Endocrinology Internal medicineArticle was published in
Internal Medicine

2016 Issue 7-8
-
All articles in this issue
- Určení prevalence potenciálních lékových interakcí u pacientů léčených 5 a více léčivými přípravky v České a Slovenské republice
-
Autoimunitná inzulítída u pacientov s diabetes mellitus 2. typu.
Randomizovaný klinický prieskum u hospitalizovaných pacientov. - Klinický přínos nových bazálních analog inzulinu
- Posuny v nutričních doporučeních pro zdravé obyvatelstvo a jejich dopad pro diabetickou dietu
- Syndrom porušeného vnímání hypoglykemie u diabetes mellitus
- Hypoglykemie jako symptom maligního onemocnění v dospělém věku
- Sepse – jak ji poznat, na co se zaměřit aneb zpět k základům ve světle nové definice
- Kůže – zrcadlo vnitřních nemocí
- Vliv antidiabetické léčby na skelet nemocných s diabetes mellitus 2. typu
- Přínos urgentně provedené endoskopické retrográdní cholangiopankreatografie pro terapii akutní pankreatitidy
- Diabetes mellitus 2. typu a srdeční selhání
- Diferenciální diagnostika pleurálních výpotků
- Nežádoucí účinky biologické léčby v revmatologii
-
Možnosti ovlivnění kardiovaskulárního rizika u diabetes mellitus 2. typu antidiabetickou léčbou
Snížení kardiovaskulárního rizika při léčbě liraglutidem – výsledky studie LEADER - Metanol: hrozba intoxikace je stále aktuální
- Diabetická retinopatie: patogeneze a terapeutické implikace
- Diference a poměr sérových koncentrací natria a chloridů u pacientů s hyponatremií
- Cílové hodnoty systolického krevního tlaku
- Klinický význam natriuretických peptidů v diferenciální diagnostice dušnosti
- Srdeční selhání se zachovanou ejekční frakcí
- Blízká budoucnost léčby dyslipidemie u diabetiků 2. typu
- Antagonisté glukagonu otevírají novou cestu v léčbě diabetu 2. typu
- Breviár edukácie diabetika pre internistu
- Prevence a terapie sarkopenie ve stáří
- Granulomatóza s polyangiitidou manifestující se jako diabetes insipidus
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue
- Sepse – jak ji poznat, na co se zaměřit aneb zpět k základům ve světle nové definice
- Kůže – zrcadlo vnitřních nemocí
- Prevence a terapie sarkopenie ve stáří
- Hypoglykemie jako symptom maligního onemocnění v dospělém věku