Rivaroxaban u rizikových pacientů
Rivaroxaban in high-risk patients
Blockade of factor Xa becomes a routine part of clinical practice instead of vitamin K blockade with warfarin, providing a more beneficial and safer effect. The main indications are prevention of stroke and systemic embolism in adults with nonvalvular atrial fibrillation, deep vein thrombosis and pulmonary embolism. Rivaroxaban has the largest number of data across high risk patients. Rivaroxaban is an oral selective anti Xa inhibitor with well predictive pharmacokinetics and pharmacodynamics. It inhibits thrombin formation for 24 hours, is well absorbed and biological availability is 80–100 %. The excretion is mainly renal and the mean elimination time is 5–9 hours in younger and 11–13 hours in elderly. The pharmacokinetics is minimally influenced by sex and age. The ROCKET AF trial has shown in 14 246 high-risk patients a trend to lowering stroke and systemic embolization by rivaroxaban compared to warfarin without a bleeding increase. The number of events per 100 patient-years was 1.71 in group treated with rivaroxaban compared to 2.16 treated with warfarin (p < 0.001 for non inferiority). A sub-analysis of the ROCKET AF trial has shown numerically trend to higher efficacy and safety of rivaroxaban in patients with moderate renal insufficiency compared to warfarin. Mild hepatic impairment did not significantly affect the pharmacokinetics or pharmacodynamics of rivaroxaban, compared with healthy subjects. The effects by age and concomitant diseases are discussed. The X-VeRT trial shows a new indication for rivaroxaban – electric cardioversion.
Key words:
age – anticoagulation – heart failure – high risk patients – renal insufficiency – thromboembolic disease
Authors:
Jindřich Špinar 1; Lenka Špinarová 2
Authors‘ workplace:
Interní kardiologická klinika LF MU a FN Brno, pracoviště Bohunice
1; I. interní kardio-angiologická klinika LF MU a FN u sv. Anny v Brně
2
Published in:
Vnitř Lék 2017; 63(6): 424-430
Category:
Reviews
Overview
Inhibitory faktoru Xa se v posledních letech dostaly do základní klinické praxe a v mnoha indikacích nahrazují antagonisty vitaminu K (warfarin) s větší bezpečností a účinností. Je to především prevence cévní mozkové příhody a systémové embolizace u dospělých pacientů s nevalvulární fibrilací síní, hlubokou žilní trombózou a plicní embolií. Největší počet dat o podávání přímých inhibitorů faktoru Xa u rizikových pacientů má rivaroxaban. Rivaroxaban je perorálně podávaný selektivní přímý inhibitor faktoru Xa. Vyznačuje se dobře predikovatelnou farmakodynamikou i farmakokinetikou. V závislosti na výši podané dávky inhibuje tvorbu trombinu až po dobu 24 hod. Po perorálním podání je velmi dobře vstřebáván, biologická dostupnost se pohybuje mezi 80 a 100 %. Vylučován je převážně ledvinami (aktivní i neaktivní forma). Střední terminální poločas eliminace při perorálním podání je 5–9 hod u mladších osob a 11–13 hod u starších. Jeho farmakokinetika je minimálně ovlivněna věkem či pohlavím léčeného pacienta. Studie ROCKET AF prokázala u 14 246 vysoce rizikových nemocných trend ke snížení výskytu cévních mozkových příhod a systémové embolizace při léčbě rivaroxabanem oproti léčbě warfarinem, a to zvýšení rizika krvácení. Počet příhod na 100 pacientských let byl 1,71 při léčbě rivaroxabanem a 2,16 při léčbě warfarinem (p < 0,001 pro noninferioritu). Subanalýza studie ROCKET AF ukázala v porovnání s warfarinem trend k lepší účinnosti a bezpečnosti rivaroxabanu i u nemocných se středně těžkou renální insuficiencí. Mírná jaterní insuficience neovlivnila významně farmakokinetiku ani farmakodynamiku rivaroxabanu ve srovnání se zdravými dobrovolníky. Jsou rozebrány účinky rivaroxabanu podle věku a přidružených onemocnění. Výsledky studie X-VeRT otevírají novou indikaci pro rivaroxaban – elektrickou kardioverzi.
Klíčová slova:
antikoagulace – renální insuficience – rizikoví nemocní – srdeční selhání – tromboembolická nemoc – věk
Úvod
Tromboembolická onemocnění jsou jednou z hlavních příčin nemocnosti a úmrtnosti ve světě. Postihují ročně asi 6,5 milionu lidí. Terapeutické možnosti byly po celá desetiletí omezeny na nefrakcionovaný heparin a antagonisty vitaminu K. Teprve zavedení nízkomolekulárních heparinů koncem 80. let 20. století přineslo možnost zlepšit antikoagulační léčbu. Vývoj nových léků v posledním desetiletí zavedl do praxe nová antitrombotika – apixaban, dabigatran, edoxaban a rivaroxaban, působící na různé fáze koagulační kaskády. Přímá antikoagulancia mají několik zásadních výhod oproti warfarinu a o výsledcích v České republice registrovaných preparátů, jako je dabigatran, apixaban, rivaroxaban či edoxaban, jsme referovali již opakovaně [1–5]. Zajímavý je ovšem i epidemiologický průzkum mezi pacienty s fibrilací síní, jaké vlastnosti pro antikoagulační léčbu by upřednostnili. Obecně by preferovali léčbu přípravkem s jednoduchým dávkováním 1krát denně, bez interakcí s potravou nebo léčbu bez nutnosti monitorace antikoagulačního účinku a úpravy dávky [6,7].
Přednosti přímých antikoagulancií proti warfarinu u pacientů s fibrilací síní
- vyšší nebo srovnatelná účinnost a bezpečnost
- snížení rizika intrakraniálního krvácení
- rychlý nástup a odeznění účinku
- krátký plazmatický poločas
- předvídatelný, konzistentní antikoagulační účinek
- nižší výskyt lékových interakcí
- nevyžadují zvláštní dietní opatření
- fixní dávkování bez nutnosti titrace
- bez nutnosti rutinní monitorace antikoagulačního účinku
- možnost ověření účinku ve specifických případech
- antagonizace účinku antidotem (dostupné zatím u dabigatranu)
V tomto článku jsme se zaměřili na podávání rivaroxabanu u vysoce rizikových nemocných.
Rivaroxaban
Rivaroxaban je perorálně podávaný selektivní přímý inhibitor faktoru Xa. Vyznačuje se dobře predikovatelnou farmakodynamikou i farmakokinetikou. V závislosti na výši podané dávky inhibuje tvorbu trombinu až po dobu 24 hod. Neblokuje existující trombinovou aktivitu, a tím umožňuje i nadále aktivaci endogenních antikoagulačních faktorů. Po perorálním podání je velmi dobře vstřebáván, biologická dostupnost se pohybuje mezi 80 a 100 %. Tablety v dávce 15 mg a 20 mg rivaroxabanu se mají užívat s jídlem. Váže se z 92–95 % na plazmatické proteiny, distribuční objem je přibližně 50 l. Hlavními degradujícími systémy jsou cytochromy P450 3A4 a 2J2. Vylučován je převážně ledvinami, asi třetina podané dávky se vylučuje nezměněna převážně aktivní ledvinovou sekrecí. Zbylé dvě třetiny se metabolicky degradují a vylučují se zhruba stejným podílem ledvinami a stolicí. Střední terminální poločas eliminace při perorálním podání je 5–9 hod u mladších osob a 11–13 hod u starších. Jeho farmakokinetika je málo ovlivněna věkem či pohlavím léčeného pacienta a ani extrémně nízká nebo vysoká hmotnost nevedou k nutnosti upravovat dávkování, stejně jako mírná renální nebo jaterní insuficience.
Studie ROCKET AF
Studie ROCKET AF (Stroke Prevention Using the Direct Factor Xa Inhibitor Rivaroxaban Compared With Warfarin in Patients with Nonvalvular Atrial Fibrillation) byla prezentována již v roce 2010 (kongres AHA, Chicago). Do studie bylo zařazeno 14 246 pacientů s fibrilací síní, jejich demografické údaje jsou popsány v literatuře [8]. V České republice bylo zařazeno 598 nemocných. Rivaroxaban byl stejně účinný v prevenci cévní mozkové příhody (CMP) jako warfarin a nezvyšoval počet krvácení. Hlavní výsledky ukazují graf 1 a tab. 1.

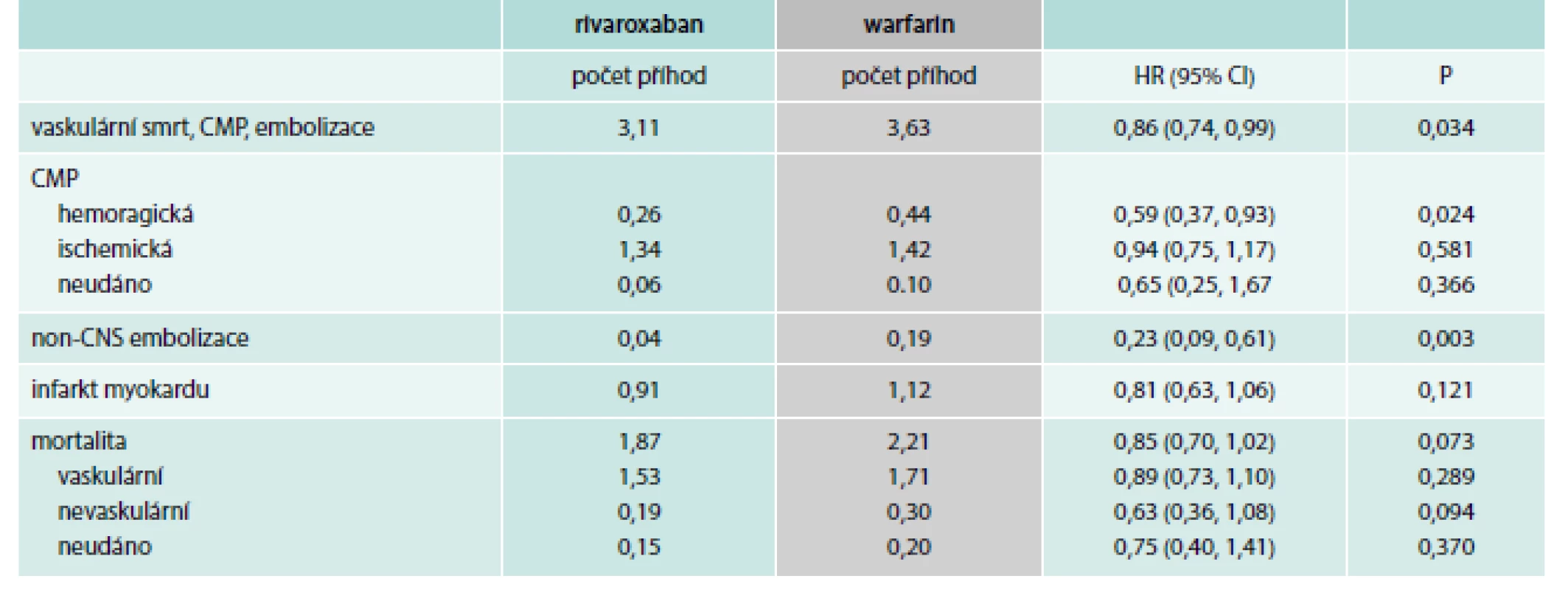
Počet CMP a embolizací byl 1,71/100 pacientských let při léčbě rivaroxabanem a 2,16/100 pacientských let při léčbě warfarinem (p < 0,001 pro non-inferioritu). Počet závažných krvácení byl 3,60/100 pacientských let (rivaroxaban) vs 3,45/100 pacientských let (warfarin; p = 0,576). Intracerebrální krvácení se vyskytlo u 55 nemocných léčených rivaroxabanem a u 84 nemocných léčených warfarinem (p = 0,019). Celkem mělo závažné a méně závažné klinicky významné krvácení 14,91 % nemocných léčených rivaroxabanem a 14,52 % nemocných léčených warfarinem.
Za nedostatek studie je považováno, že 1 691 (23,7 %) nemocných léčených rivaroxabanem a 1 584 (22,2 %) nemocných léčených warfarinem ukončilo studii předčasně.
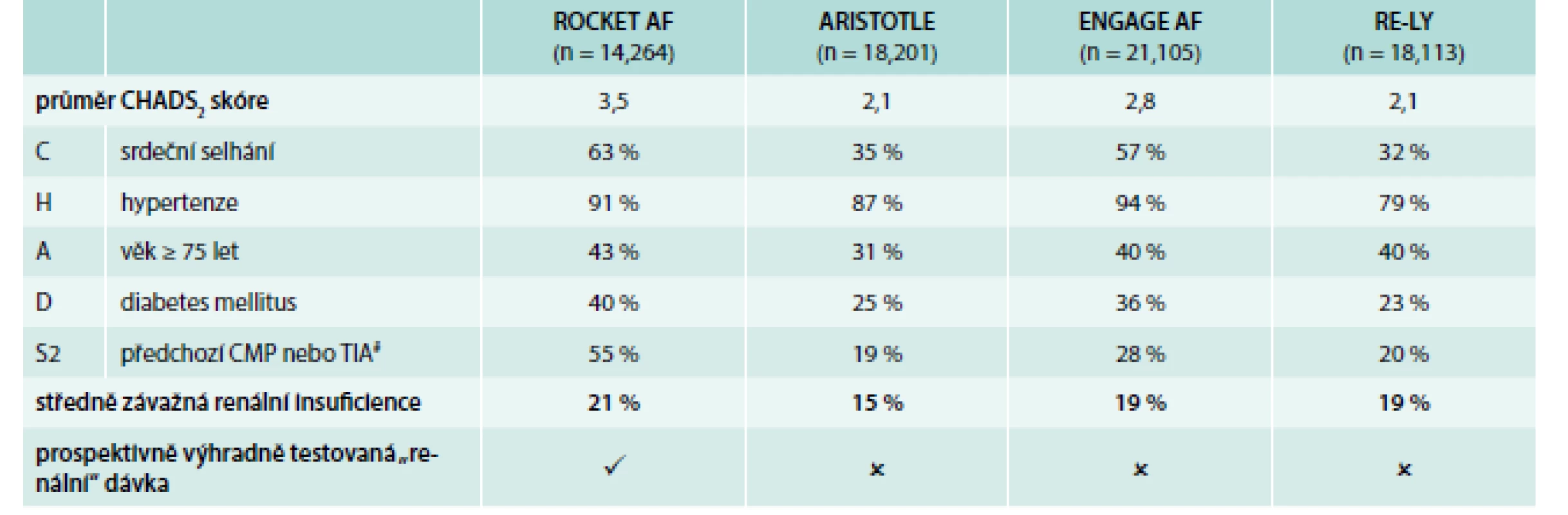
Výsledky studie ROCKET AF byly jasným potvrzením, že rivaroxaban je účinný a má příznivý bezpečnostní profil u nemocných s fibrilací síní a vysokým rizikem, poněvadž v této studii mělo 87 % pacientů CHADS2 skóre ≥ 3! Kromě celkového CHADS2 skóre je třeba zdůraznit, že 91 % mělo hypertenzi, 63 % srdeční selhání, 55 % bylo po CMP a 21 % mělo středně těžkou renální insuficienci. Srovnání rizikovosti nemocných v ukončených studiích s novými orálními antikoagulancii (NOAK) ukazují tab. 2 a graf 2.

Ve studiích fáze 3 v ortopedii a v léčbě žilního tromboembolizmu nebyla dávka upravována v závislosti na renálních funkcích. V analýze podskupin pacientů s renální insuficiencí nebyl patrný rozdíl v účinnosti v léčbě žilního tromboembolizmu ve srovnání s komparátorem. Na podkladě farmakokinetického modelu bylo později pro studii ROCKET AF rozhodnuto o redukci dávky na 15 mg při clearance kreatininu (CrCl) < 50 ml/min [8]. Po redukci dávky u této skupiny pacientů jsou farmakokinetické parametry srovnatelné se skupinou pacientů s normální renální funkcí a dávkou 20 mg. Na základě těchto dat i výsledků studií fáze 3 klinického hodnocení lze považovat podávání rivaroxabanu za relativně bezpečné u pacientů s clearance kreatininu > 30 ml/min. Podávání pacientům s renální clearance 15–29 ml/min je na podkladě omezených dat s opatrností povoleno. U všech pacientů s renálním poškozením se doporučuje opatrnost, zvláště v kombinaci s jinými faktory, které ovlivňují za jiných okolností farmakokinetické parametry pouze méně významně, jako je např. velmi nízká tělesná hmotnost nebo interakce s inhibitory CYP 3A4 a P-gp, jako je klaritromycin. U pacientů s nevalvulární fibrilací síní a se středně závažnou (clearance kreatininu 30–49 ml/min) nebo závažnou (clearance kreatininu 15–29 ml/min) renální nedostatečností je pro prevenci cévní mozkové příhody a systémové embolizace (SE) doporučené dávkování 15 mg 1krát denně.
Renální insuficience
Vliv renální insuficience na farmakokinetiku, farmakodynamiku a bezpečnost rivaroxabanu byl hodnocen ve studii publikované v roce 2010 [9]. Testovaný lék byl podán v dávce 10 mg jednorázově 32 jedincům s lehkým (50–79 ml/min), středně těžkým (30–49 ml/min) a těžkým poškozením renálních funkcí (< 30 ml/min) nebo kontrolním subjektům s clearance kreatininu ≥ 80 ml/min. Průměrné hodnoty AUC byly zvýšeny 1,44krát (90% CI 1,1–1,9), 1,52krát (90% CI 1,2–2,0) a 1,64krát (90% CI 1,2–2,2) u jednotlivých stupňů renální insuficience ve srovnání s kontrolní skupinou. Ovlivnění farmakokinetiky i farmakodynamiky renální insuficiencí bylo hodnoceno jako mírné a předvídatelné.
V roce 2011 Fox et al publikovali zajímavou subanalýzu o rivaroxabanu u nemocných s nevalvulární fibrilací a síní a renální insuficiencí ve studii ROCKET AF [10]. Nemocní s CrCl > 50 ml/min byli mladší (průměrný věk 73 let) než 2 950 nemocných (20,7 %) s CrCl 30–49 ml/min (průměrný věk 79 let) a měli větší výskyt příhod bez ohledu na studijní léčbu. Výsledky primárního cíle – účinnostního – i sekundárních bezpečnostních u nemocných se sníženou clearance kreatininu ukazuje graf 3 a ve všech případech byl ve prospěch rivaroxabanu. Smrtelné krvácení bylo 0,28 vs 0,74 na 100 pacientských let, což dosáhlo statistické významnosti p = 0,047 ve prospěch rivaroxabanu. Autoři sdělení konstatují, že nemocní s renální insuficiencí mají vyšší výskyt CMP i krvácení než nemocní s normálními renálními funkcemi a že při redukci dávky byly výsledky rivaroxabanu v porovnání s warfarinem konzistentní s výsledky celé studie. Editorial k tomuto článku udává, že se renální insuficience vyskytuje asi u 10 % rizikových nemocných s fibrilací síní [11].

Všechna NOAK se částečně vylučují ledvinami, podíl vylučovaný ledvinami se pohybuje od přibližně 80 % u dabigatranu po 27 % u apixabanu. V závislosti na clearance kreatininu je třeba upravit dávkování (viz výše).
Jaterní insuficience
Z podané dávky rivaroxabanu se přibližně dvě třetiny metabolicky degradují, z čehož je polovina vylučována ledvinami a druhá polovina stolicí. Zbývající třetina podané dávky je vylučována ledvinami přímo jako nezměněná léčivá látka, hlavně prostřednictvím aktivní ledvinové sekrece. Vliv jaterní insuficience na farmakokinetiku a farmakodynamiku rivaroxabanu byl zjišťován podáním dávky 10 mg per os po alespoň 10hodinovém lačnění cirhotickým pacientům s klasifikací Child-Pugh A nebo B (n = 8 pro každou skupinu, 16 zdravých kontrol). Mírná jaterní insuficience (Child-Pugh A) neovlivnila významně farmakokinetiku ani farmakodynamiku rivaroxabanu (v průměru 1,15krát nárůst AUC rivaroxabanu) a výsledky byly téměř srovnatelné s kontrolní skupinou zdravých dobrovolníků. U pacientů se středně závažnou jaterní nedostatečností (Child-Pugh B) průměrná hodnota AUC rivaroxabanu významně stoupla – 2,27krát v porovnání se zdravými dobrovolníky [12]. Rivaroxaban lze tedy podávat u lehké hepatopatie, za kontraindikovaný se považuje u jaterních onemocnění, která jsou spojena s koagulopatií a klinicky relevantním rizikem krvácení, včetně cirhotických pacientů s klasifikací Child-Pugh B a C [13].
Věk
Ve studii ROCKET AF bylo 6 229 (44 %) nemocných ve věku 75 let nebo starších, za celou dobu sledování to tedy činí 10 866 pacientských let. Tito starší nemocní měli častější výskyt primárního cíle (cévní mozková příhoda nebo systémová embolie) 2,57 vs 2,05/100 pacientských let (p = 0,0068) a častěji závažné krvácení 4,63 vs 2,74/100 pacientských let (p < 0,0001). CMP nebo embolizace byly častější u starších nemocných léčených warfarinem než rivaroxabanem (2,85 vs 2,29/100 pacientských let), graf 4. Hemoragická CMP měla stejný výskyt v obou léčených skupinách. Celkově je možné shrnout, že starší nemocní mají vyšší výskyt ischemických i krvácivých příhod a že efekt rivaroxabanu byl systematický jak u mladších, tak starších věkových skupin a že je tedy rivaroxaban naprosto plnohodnotnou alternativou warfarinu i u starých osob [14].

Srdeční selhání
Ve studii ROCKET AF mělo 9 033 (63,7 %) nemocných srdeční selhání. Tito nemocní na rozdíl od pacientů bez srdečního selhání byli o 2 roky mladší (72 vs 74 let), častěji měli perzistentní fibrilaci síní (83,0 % vs 77,6 %) a měli vyšší CHADS2 skóre (3,7 vs 3,1). Účinnost rivaroxabanu byla srovnatelná s warfarinem u nemocných se srdečním selháním (1,90 vs 2,09/100 pacientských let) i bez srdečního selhání (2,10 vs 2,54/100 pacientských let), graf 4. Taktéž riziko závažného nebo klinicky významného nezávažného krvácení bylo podobné u rivaroxabanu i warfarinu u nemocných se srdečním selháním (14,22 vs 14,02/100 pacientských let) i bez srdečního selhání (16,12 vs 15,35/100 pacientských let). Snížení výskytu hemoragických CMP bylo pozorováno po podávání rivaroxabanu jak v celé populaci, tak u nemocných se srdečním selháním. U nemocných se srdečním selháním byl efekt rivaroxabanu podobný bez ohledu na ejekční frakci, NYHA klasifikaci I a II vs III a IV, či celkové CHADS2 skóre 2 vs ≥ 3 [15].
V roce 2015 vyšla inovovaná Evropská doporučení pro používání antikoagulancií – non vitamin K antagonistů – u pacientů s nevalvulární fibrilací síní, která přinášejí jasné pokyny, jak podávat tuto léčbu u pacientů s ischemickou chorobou srdeční, především jak doporučit, či nedoporučit současné podávání antikoagulační a antiagregační léčby u pacientů s fibrilací síní a ischemickou chorobou srdeční [16]. Tato doporučení byla ještě upravena v roce 2016 [17].
Ischemická choroba srdeční
Kombinace fibrilace síní (FiSi) s ischemickou chorobou srdeční (ICHS) je poměrně častá a antiagregační či antikoagulační léčba by měla vést především ke zlepšení prognózy nemocných. Bohužel chybí jasná data, jak tyto pacienty léčit, a doporučení se mohou dokonce v různých dokumentech mírně lišit. Neexistuje totiž klinická studie s přímým dopadem na doporučení k použití NOAK (Souhrn údajů o přípravku – SPC), která by porovnala pacienty léčené warfarinem oproti pacientům léčeným NOAK, kteří podstoupili intervenční léčbu pro akutní koronární syndrom nebo chronickou ischemickou chorobu srdeční (případně měli indikovanou duální antiagregační léčbu). Stejně tak neexistuje klinická evidence pro kombinaci NOAK s novými antiagregačními preparáty jako tikagrelor a prasugrel. Ve studii ROCKET AF mělo ischemickou chorobu srdeční 2 468 (17 %) nemocných, respektive měli anamnézu infarktu myokardu při zařazení do studie. Tito nemocní byli častěji muži (75 % vs 57 %) a téměř polovina užívala kyselinu acetylsalicylovou (47 % vs 34 %). Měli také častěji diabetes mellitus, srdeční selhání v anamnéze a hypertenzi. Efekt rivaroxabanu u této podskupiny byl konzistentní s celkovými výsledky studie [18].
Efekt NOAK byl ve většině studií hodnocen u pacientů s nevalvulární FiSi. Pojem „nevalvulární FiSi“ není příliš vhodný, má označovat pacienty bez výraznější chlopenní vady. Na základě negativních výsledků studie s dabigatranem u pacientů s mechanickými chlopenními náhradami a absence klinické evidence jsou všechna NOAK u této skupiny pacientů kontraindikována. Nesmějí se také podávat při významnější mitrální stenóze. NOAK jsou kontraindikována také u dětí a u těhotných a kojících žen.
Katetrizační ablace a kardioverze
U pacientů se symptomatickou paroxyzmální nebo perzistující fibrilací síní je indikována katetrizační ablace, pokud nevede antiarytmická léčba k potlačení rekurencí arytmie, stejně tak je indikována katetrizační ablace u selektovaných pacientů jako léčba první volby. Riziko tromboembolických příhod je u pacientů s FiSi zvýšené a závisí na přítomnosti řady rizikových faktorů. Kromě vlastního tromboembolického rizika daného pacienta vede ablace k dalšímu zvýšení rizika tromboembolie v důsledku zavedení jednoho nebo více katétrů a dlouhých sheatů do levé síně a manipulace s nimi a také v důsledku endokardiálních lézí vznikajících během ablace. Proto bylo nesmírně záslužné zkoušet nová antikoagulancia i v této indikaci.
Analýzy podskupin ze studií s NOAK ukázaly, že provedení elektrické kardioverze bylo spojeno s velmi nízkým rizikem tromboembolie podobným jako při podávání warfarinu. To potvrdily výsledky 2 velkých prospektivních studií X-VeRT s rivaroxabanem a ENSURE AF s edoxabanem. Kardioverzi lze při pravidelném a nepřetržitém užívání rivaroxabanu minimálně v posledních 3 týdnech proto provádět. Je však třeba se výslovně zeptat pacienta na adherenci v posledních týdnech a odpověď zaznamenat do jeho zdravotní dokumentace. V případě pochybností o adherenci je nutno před kardioverzí vyloučit trombus v srdci pomocí jícnové echokardiografie. Přítomnost trombu je kontraindikací ke kardioverzi. Pokud FiSi trvá déle než 48 hod a pacient antikoagulační léčbu neužívá, má být léčba rivaroxabanem zahájena nejméně 4 hod před kardioverzí a je třeba provést jícnovou echokardiografii. Další možností je zahájit antikoagulaci rivaroxabanem a kardioverzi provést po alespoň 3 týdnech pravidelného užívání rivoraxabanu.
Studie X-VeRT
Studie byla prezentována na Evropském kardiologickém sjezdu v Barceloně v roce 2014 a současně publikována v časopise European Heart Journal [19].
Studie zařadila 1 504 nemocných užívajících rivaroxaban (20 mg 1krát denně, nebo 15 mg při clearance kreatininu 30–49 ml/min) nebo užívajících antagonistu vitaminu K (VKA) v poměru 2 : 1. Řešitelé se mohli rozhodnout pro časnou strategii kardioverze s provedenou jícnovou echokardiografií (1–5 dní léčby po randomizaci), nebo pro odloženou strategii kardioverze (3–8 týdnů léčby). Primární účinnostní cíl byl složený z výskytu CMP, tranzitorní ischemické příhody, periferní embolie, srdečního infarktu nebo kardiovaskulárního úmrtí. Hlavním bezpečnostním cílem bylo závažné krvácení. Příhoda sledovaná primárním účinnostním cílem se objevila u 5 nemocných (0,51 %; 2krát CMP) z 978 užívajících rivoraxaban a u 5 nemocných (1,02 %; 2krát CMP) ze 492, kterým byl podáván VKA (RR = 0,50). U pacientů užívajících rivaroxaban se vyskytly 4 případy při časné kardioverzi, 1 případ se vyskytl u odložené kardioverze, ve skupině, které byl podáván VKA, to bylo v poměru 3 : 2. Závažné krvácení se vyskytlo u 6 (0,6 %) nemocných užívajících rivaroxaban a u 4 (0,8 %) užívajících VKA.
Autoři konstatují, že rivaroxaban je srovnatelně účinnou a bezpečnou alternativou VKA u nemocných podstupujících kardioverzi.
Práce byla podpořena projektem (Ministerstva zdravotnictví) koncepčního rozvoje výzkumné organizace 65269705 (FN Brno).
prof. MUDr. Jindřich Špinar, CSc., FESC
jspinar@fnbrno.cz
Interní kardiologická klinika LF MU a FN Brno,
pracoviště Bohunice
www.fnbrno.cz
Doručeno do redakce 22. 5. 2017
Přijato po recenzi 23. 6. 2017
Sources
1. Špinar J, Vítovec J. Studie ROCKET AF – konec warfarinu na obzoru? Kardiol Rev Int Med 2011; 13(2): 106–108.
2. Špinar J, Vítovec J. Antikoagulační léčba u fibrilace síní. Acta medicinae 2014; 3(9): 18–23.
3. Špinar J, Vítovec J, Špinarová L et al. Rivaroxaban v léčbě fibrilace síní. Farmakoterapie 2013; 9(1): 6–12.
4. Vítovec J, Špinar J. Antikoagulační léčba u srdečního selhání a hypertenze. In: Widimský J, jr. Arteriální hypertenze – současné klinické trendy XIII. In: Triton: Praha 2016 : 157–162. ISBN 978–80–7387–883–2.
5. Špinar J, Špinarová L. Nové indikace přímých antikoagulancií v roce 2017. Remedia 2017; 27(2): 132–135.
6. Böttger B, Thate-Waschke IM, Bauersachs R et al. Preferences for anticoagulation therapy in atrial fibrillation: the patients’ view. J Thromb Thrombolysis 2015; 40(4): 406–415. Dostupné z DOI: <http://dx.doi.org/10.1007/s11239–015–1263-x>.
7. Čihák R, Haman L, Táborský M. 2016 ESC Guidelines for the management of atrial fibrillation developed in collaboration with EACTS: Summary of the document prepared by the Czech Society of Cardiology. Cor et vasa 2016; 58(6): e636-e683. Dostupné z DOI: <https://doi.org/10.1016/j.crvasa.2016.11.005>.
8. Patel MR, Mahaffey KW, Garg J et al. [ROCKET AF Investigators]. Rivaroxaban versus warfarin in nonvalvular atrial fibrillation. N Engl J Med 2011; 365(10): 883–891. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJMoa1009638>.
9. Kubitza D, Becka M, Mueck W et al. Effects of renal impairment on the pharmacokinetics, pharmacodynamics and safety of rivaroxaban, an oral, direct Factor Xa inhibitor. Br J Clin Pharmacol 2010; 70(5): 703–712. Dostupné z DOI: <http://dx.doi.org/10.1111/j.1365–2125.2010.03753.x>.
10. Fox KAA, Piccini JP, Wojdyla D et al. Prevention of stroke and systemic embolism with rivaroxaban compared with warfarin in patients with non-valvular atrial fibrillation and moderate renal impairment. Eur Heart J 2011; 32(19): 2387–2394. Dostupné z DOI: <http://dx.doi.org/10.1093/eurheartj/ehr342>.
11. Hohnloser SH, Connolly SL. Atrial fibrillation, moderate chronic kidney disease, and stroke prevention: new anticoagulants, new hope. Eur Heart J 2011; 32(19): 2347–2349. Dostupné z DOI: <http://dx.doi.org/10.1093/eurheartj/ehr344>.
12. Kubitza D, Roth A, Becka M et al. Effect of hepatic impairment on the pharmacokinetics and pharmacodynamics of a single dose of rivaroxaban, an oral, direct Factor Xa inhibitor. Br J Clin Pharmacol 2013; 76(1): 89–98. Dostupné z DOI: <http://dx.doi.org/10.1111/bcp.12054>. Erratum in Br J Clin Pharmacol 2013; 76(3): 489.
13. Urbánek K. Farmakologický profil rivaroxabanu. Kardiol Rev Int Med 2017; 19(1): 39–44.
14. Halperin JL, Hankey GJ, Wojdyla DM et al. Efficacy and safety of rivaroxaban compared with warfarin among elderly patients with nonvalvular atrial fibrillation in the rivaroxaban once daily, oral direct factor Xa inhibition compared with vitamin K antagonism for prevention of strokw and embolism trial in atrial fibrillation (ROCKET AF). Circulation 2014; 130(2): 138–146. Dostupné z DOI: <http://dx.doi.org/10.1161/CIRCULATIONAHA.113.005008>.
15. van Diepen S, Hellkamp AS, Patel MR et al. Efficacy and safety of rovaroxaban in patients with heart failure and nonvalvular atrial fibrillation. Insight from ROCKET AF. Circ Heart Failure 2013; 6(4): 740–747. Dostupné z DOI: <http://dx.doi.org/10.1161/CIRCHEARTFAILURE.113.000212>.
16. Heidbuchel H, Verhamme P, Alings M et al. Updated European Heart Rhythm Association Practical Guide on the use of non-vitamin K antagonist anticoagulants in patients with non-valvular atrial fibrillation. Europace 2015; 17(10): 1467–1507. Dostupné z DOI: <http://dx.doi.org/10.1093/europace/euv309>.
17. Kirchov P, Benussi S, Kotecha D et al. 2016 ESC Guidelines for the management of atrial fibrillation developed in collaboration with EACTS. Eur Heart J 2016; 37(38): 2893–2962. <http://dx.doi.org/10.1093/eurheartj/ehw210>.
18. Mahaffey KW, Stevens SR, White HD et al. Ischaemic cardiac outcomes in patients with atrial wibrillation treated with vitamin K antagonism or factor Xa inhibition: result from ROCKET AF trial. Eur Heart J 2014; 35(4): 233–241. Dostupné z DOI: <http://dx.doi.org/10.1093/eurheartj/eht428>.
19. Cappato R, Ezekowitz MD, Klein AL et al. [X-VeRT Investigators]. Rivaroxaban vs. vitamin K antagonists for cardioversion in atrial fibrillation. Eur Heart J 2014; 35(47): 3346–3355. Dostupné z DOI: <http://dx.doi.org/10.1093/eurheartj/ehu367>.
20. Patel MR, Mahaffey KW, Garg J et al. [ROCKET AF Investigators]. Rivaroxaban versus warfarin in nonvalvular atrial fibrillatio. N Engl J Med 2011; 365(10): 883–891. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJMoa1009638>.
21. Granger CB, Alexander JH, McMurray JJ et al. [ARISTOTLE Committees and Investigators]. Apixaban versus warfarin in patients with atrial fibrillation. N Engl J Med. 2011; 365(11): 981–992. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJMoa1107039>.
22. Giugliano RP, Ruff CT, Braunwald E et al. [ENGAGE AF-TIMI 48 Investigators]. Edoxaban versus warfarin in patients with atrial fibrillation. N Engl J Med 2013; 369(22): 2093–2104. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJMoa1310907>.
23. Connolly SJ, Ezekowitz MD, Yusuf S et al. [RE-LY Steering Committee and Investigators]. Dabigatran versus warfarin in patients with atrial fibrillation. N Engl J Med 2009; 361(12): 1139–1151. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJMoa0905561>.
24. Eikelboom JW, Wallentin L, Connolly SJ et al. Risk of bleeding with 2 doses of dabigatran compared with warfarin in older and younger patients with atrial fibrillation: an analysis of the randomized evaluation of long-term anticoagulant therapy (RE-LY) trial. Circulation 2011; 123(21): 2363–2372. Dostupné z DOI: <http://dx.doi.org/10.1161/CIRCULATIONAHA.110.004747>.
25. FDA. FDA Briefing Information for the Cardiovascular and Renal Drugs Advisory Committee. Dostupné z WWW: <https://archive-it.org/collections/7993?q=FDA+Briefing+Information+for+the+Cardiovascular+and+Renal+Drugs+Advisory+Committee&show=ArchivedPages&hitsPerDupe=0&go=Search+the+Archive>.
Labels
Diabetology Endocrinology Internal medicineArticle was published in
Internal Medicine

2017 Issue 6
-
All articles in this issue
- Rizikové faktory kardiovaskulárních onemocnění u potomků nemocných po časném infarktu myokardu
- Úskalia stanovenia vitamínu D
- Klinická štúdia FOURIER
- Primární testikulární lymfomy
- Rivaroxaban u rizikových pacientů
- Dva pohľady na venózny tromboembolizmus u onkologických pacientov
- Inzulinová pumpa u diabetu 2. typu: léčba zaměřená na B-buňku
- Prediktory kvality života u českých pacientek po léčbě karcinomu prsu se zaměřením na dovednosti zvládání zátěže
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue
- Primární testikulární lymfomy
- Inzulinová pumpa u diabetu 2. typu: léčba zaměřená na B-buňku
- Úskalia stanovenia vitamínu D
- Dva pohľady na venózny tromboembolizmus u onkologických pacientov
