Poruchy vodní a iontové rovnováhy ve stáří
Electrolyte and water disorders in old age
Changes in the volume and composition of body fluids are among the essential and limiting parameters both in health and illness. These parameters gain in importance with increasing age. Within the concept of a geriatric patient, disturbances in water and mineral metabolism are the cause of circulatory collapse, stroke, and further instability, falls and delirium. The body can, in the broad range of balance within internal environment, compensate for variations, however always for a limited length of time only, and this compensation ability decreases in particular in older age. Maintaining of water and mineral balance in the elderly is also complicated by polymorbidity. Frequent occurrence of cardiovascular diseases and decline in renal functions later in life results in reduced compensation abilities, which status must be rigorously considered. Besides polymorbidity, also polypragmasia in pharmacotherapy is very frequently encountered in relation to age-related disorders of water and electrolyte handling. Treatment with sedatives also suppresses the feeling of thirst, which results in rapid development of disturbances in water and mineral balance even after small insults, such as feverish illnesses and minor injuries. The knowledge of differences in diagnosing and treatment of water and ion imbalances in later life is becoming increasingly important, especially with regard to the increasing share of older people in society.
Key words:
ageing – dehydration – electrolyte metabolism – mineral disorders
:
Zdeněk Zadák 1; Alena Tichá 1,2; Radomír Hyšpler 1,2
:
Centrum pro výzkum a vývoj FN Hradec Králové
1; Ústav klinické biochemie a diagnostiky LF UK a FN Hradec Králové
2
:
Vnitř Lék 2018; 64(11): 1059-1066
:
Změny objemu i složení tělesných tekutin patří mezi zásadní a limitující parametry ve zdraví i v nemoci. S přibývajícím věkem význam těchto parametrů nabývá na závažnosti. V konceptu geriatrického pacienta jsou rozvraty vodního a minerálního metabolizmu příčinou oběhového selhání, centrálních mozkových příhod, dále instability, pádů, deliria. Organizmus sice umí v širokém rozmezí rovnováhy ve vnitřním prostředí odchylky kompenzovat, ale vždy jen po limitovanou dobu, a zejména ve stáří tato schopnost kompenzace klesá. Udržení vodní a minerální rovnováhy ve stáří je komplikováno i polymorbiditou. Častý výskyt kardiovaskulárních chorob a omezení renálních funkcí ve stáří má za následek omezené kompenzační schopnosti a tento stav je nutné striktně respektovat. Vedle polymorbidity se ve stáří uplatňuje při vzniku poruch vodního a elektrolytového hospodářství i velmi častá polypragmazie ve farmakoterapii. Sedativní léčba potlačuje i pocit žízně, a to má za následek neobvykle rychlý rozvoj poruch vodní a minerální rovnováhy i po malých inzultech, jako jsou horečnatá onemocnění a drobné úrazy. Znalost odlišností diagnostiky a léčby vodních a iontových dysbalancí ve stáří nabývá stále větší důležitosti, zejména při rostoucím podílu starší populace ve společnosti.
Klíčová slova:
dehydratace – elektrolytový metabolizmus – minerální rozvraty – stárnutí
Úvod
V průběhu života se mění obsah vody v těle tak, že procentuálně je podíl vody největší v mládí a s postupujícím věkem klesá. Obsah tělesné vody v dospělosti udává tab. 1.
![Obsah tělesné vody v dospělosti a ve stáří.
Upraveno podle [4]](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/f15b321e54acd86dd4b58cf9dcb68b11.png)
Za patologických stavů dochází k výrazným ztrátám vody z organizmu, a protože podíl vody u starých jedinců činí menší část tělesné hmotnosti než v mládí, jsou staří pacienti na ztrátu vody mnohem citlivější než osoby středního věku. Ztráta vody kůží a plícemi (perspirace) činí při normální tělesné a venkovní teplotě přibližně 1 l za 24 hod. V horečnatém stavu stoupá ztráta vody o 0,5–1 l za den na 1 °C nad normální tělesnou teplotu 37 °C.
Voda je univerzálním rozpustidlem pro ionty i organické látky v tělesných tekutinách a vytváří tak velmi složitou a jemně regulovanou iontovou a koloidní matrici [1].
Podstatnou roli v regulaci vnitřního prostředí hrají ledviny. Tak jako ostatní orgány, procházejí i ledviny celou řadou anatomických a fyziologických změn, které jsou závislé na věku. Mimořádný vliv věku se uplatňuje v poklesu glomerulární filtrace a ve snížené schopnosti udržovat vodní a minerální rovnováhu. Ta se týká zejména homeostázy sodíku, draslíku, chloridů, hořčíku a fosfátů. Dochází tak vlivem věku k modifikaci schopností ledvin udržet minerální a vodní rovnováhu působením různých fyziologických i patologických vlivů. Vedle základních změn ve struktuře a funkci ledvin, které jsou podmíněny stářím, dochází i k poruchám funkce ledvin, které jsou způsobeny degenerativními procesy a selháváním v oblasti kardiovaskulárního systému. Z klinického hlediska je navíc přehlížen významný vliv environmentálních faktorů, vlivu nutrice a případné farmakoterapie, zejména u polymorbidních starých jedinců. Za normálních okolností se vliv věku poměrně málo uplatňuje v iontové rovnováze u staré, avšak zdravé populace.
Pro udržování iontové rovnováhy hraje významnou roli počet funkčních nefronů. Jde zejména o redukci počtu glomerulů, který s postupujícím věkem klesá. Ve věku od 1 do 40 let obsahuje zdravá ledvina od 500 000 do 1,2 milionu glomerulů [2,3]. Avšak v 70. dekádě věku se toto množství redukuje o 30–50 %. V ledvinných arteriolách se s postupujícím věkem rozvíjí hypertrofie medie a proliferace cévní intimy. Současně s poklesem funkčních glomerulů dochází k poklesu glomerulární filtrace o 1 % za rok do 40 let a po 40. roku věku se snižuje glomerulární filtrace o 10 % na každou další věkovou dekádu. Tyto změny významně ovlivňují koncentrační a zřeďovací kapacitu ledvin. U zdravých mladých jedinců dosahuje maximální koncentrační schopnost ledvin 1 200 mOsm/kg, zatímco u zdravých starých jedinců je maximální koncentrační schopnost 700–800 mOsm/kg. Podobně zředit moč jsou staří jedinci schopni na méně než 100 mOsm/kg ve srovnání s mladými dospělými jedinci, u nichž zředění dosahuje až 50 mOsm/kg.
Metabolizmus vody
Regulace homeostázy vody v organizmu závisí primárně na 3 klíčových faktorech:
- neporušené fungování centrálně nervového mechanizmu vnímání žízně
- neporušený mechanizmu vodní a elektrolytové rovnováhy zprostředkovaném ledvinami
- neporušený mechanizmus působení systému argininu vazopresin a antidiuretického hormonu (ADH) [4]
Poruchy rovnováhy bezsolutové vody se odrážejí v největší míře ve změnách sérové koncentrace natria. Voda je dominantním prostředím lidského těla a představuje 55–65 % zdravého lidského organizmu. Přibližně 55–75 % vody je obsaženo v intracelulárním prostoru. Plazma obsahuje přibližně čtvrtinu extracelulárního prostoru a tato frakce vody je regulována převážně ADH, který je důležitým mediátorem v řízení osmolality plazmy za normálních fyziologických podmínek. Primárním determinantem osmolality plazmy, která se pohybuje v rozmezí 285 do 295 mOsm/kg, je plazmatická koncentrace sodíku. Většina starších osob má vlivem stoupajícího věku menší citlivost ke vnímání žízně, čímž jsou zvýšeně ohroženi deficitem čisté bezsolutové vody a hypernatremií. Na druhé straně ve stáří je snížená schopnost vylučovat čistou vodu především jako důsledek poklesu glomerulární filtrace, případně snížení odpovědi tubulů na ADH. Starší jedinci jsou vystaveni s vyšší pravděpodobností polypragmazii ve farmakoterapii a mnohá farmaka ovlivňují sekreci ADH, a tím ovlivňují účinně metabolizmus vody (tab. 2).
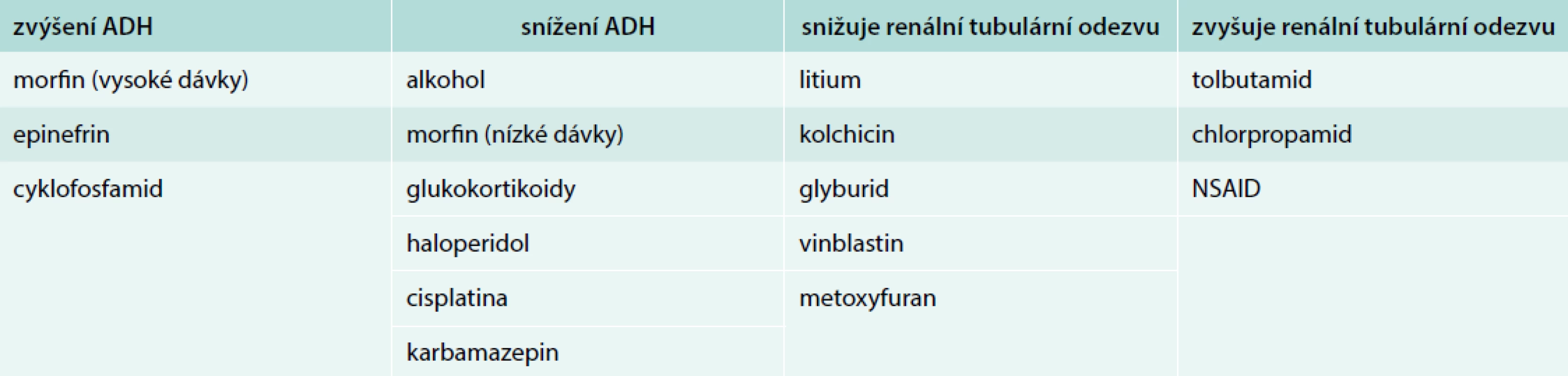
Existují i další vlivy, které vedou k deficitu sekrece ADH, potlačení žízně s důsledkem negativní bilance čisté bezsolutové vody a vznikem hypernatremie. Častou příčinou poruchy sekrece ADH, vedle farmakologických vlivů, jsou procesy, které destruují neurohypofýzu, jako jsou tumory, granulomatózní onemocnění, cévní mozkové příhody a ve stáří také často trauma [5].
Hyponatremie a hypernatremie
Se stoupajícím věkem klesá schopnost ledvin šetřit sodík v případech sodíkové deprivace, a naopak vylučovat sodík jako nezbytnou odpověď na přetížení sodíkovým iontem. Poločas pro snížení exkrece sodíku při sodíkové restrikci je u mladých jedinců 17,6 hod, zatímco ve stáří se prodlužuje na 31 hod. Tendence k omezení schopnosti šetřit sodík ve stáří je vyvolána několika mechanizmy. Jednou z příčin je redukce počtu funkčních nefronů, která vede ke zvýšení osmotické nálože na 1 funkční nefron: tím dochází k mírné osmotické diuréze a současně se projevuje na věku závislá změna citlivosti renin-aldosteronového systému. Mimo to se uplatňuje redukce v orgánové odpovědi na působení atriálního natriuretického peptidu.
Hyponatremie
Koncentrace natria je v plazmě udržována ve velmi těsném rozmezí. Pokles sérové koncentrace sodíku < 130 mmol/l je považováno za klinicky signifikantní hyponatremii. V závislosti na závažnosti hyponatremie dochází ke klinickým projevům od asymptomatického průběhu k centrálně nervové manifestaci příznaků, jako je letargie, zmatenost, křeče, kóma a smrt [6,7].
Prvním krokem ve stanovení diagnózy hyponatremie je současně s poklesem koncentrace Na v plazmě i pokles osmolality plazmy.
Diagnostické členění hyponatremií:
- hyponatremie s deplecí extracelulární tekutiny
- hyponatremie s normálním objemem extracelulární tekutiny
- hyponatremie s expanzí extracelulárnho objemu
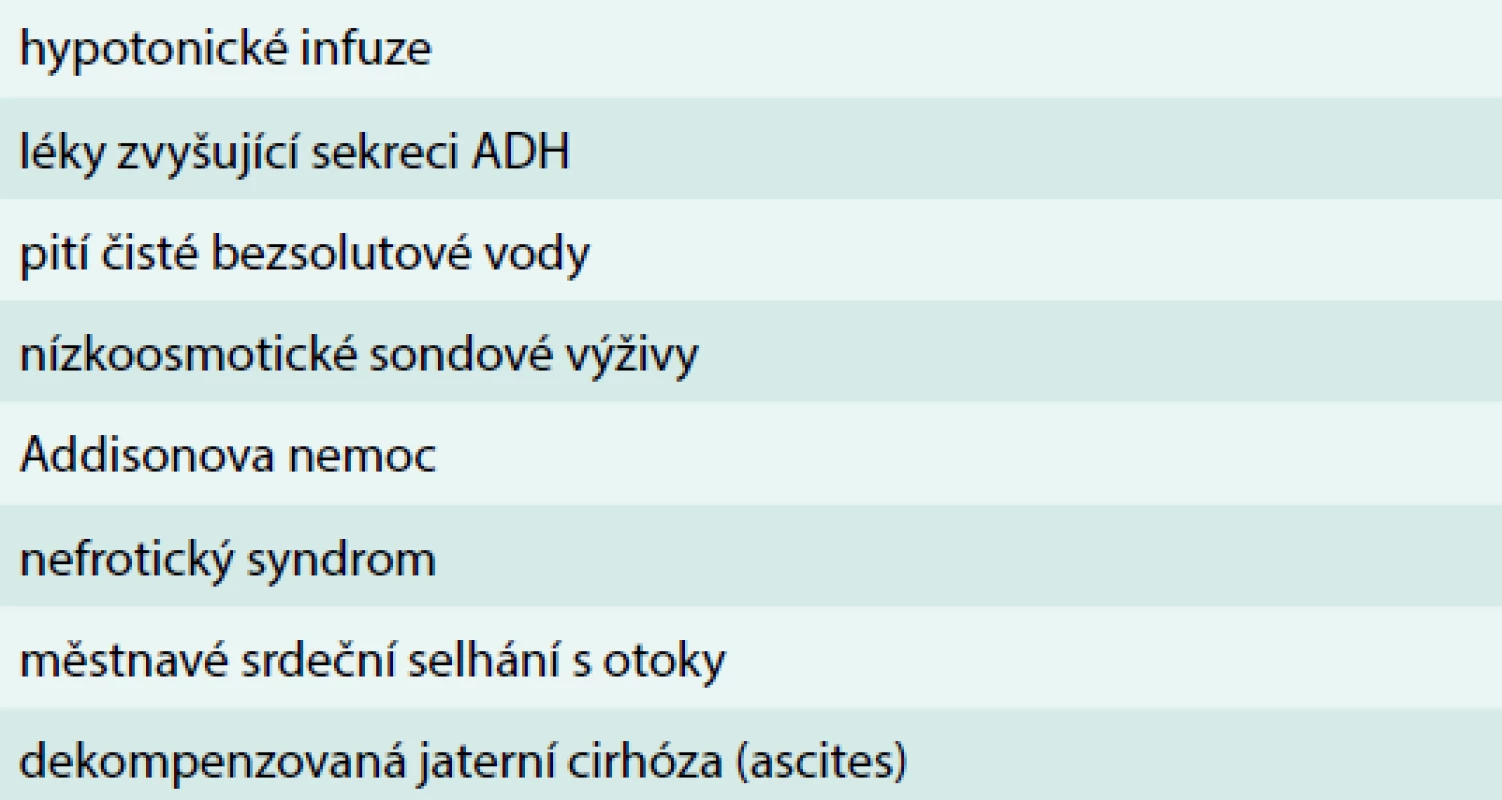
Pokud při hyponatremii deplece extracelulární tekutiny převáží nad stimulací osmoreceptorů efekt baroreceptorů, dochází k výrazné stimulaci sekrece ADH. Podobně u pacientů s hyponatremií a excesem extracelulární tekutiny (např. u jaterní cirhózy, městnavého srdečního selhání, nefrotického syndromu) dochází k poklesu systémového krevního tlaku. To má za následek potlačení baroreceptorové odpovědi. Pacienti s hyponatremií a normálním objemem extracelulární tekutiny mají často endokrinní poruchu, nebo se uplatňuje nevhodná medikace. U starších pacientů s hyponatremií a normálním objemem extracelulární tekutiny je třeba vždy pátrat po hypotyreóze nebo deficitu sekrece glukokortikoidů. Ve stáří je tento mechanizmus častý, protože hypotyreóza je častější s postupujícím věkem. Mezi další příčiny hyponatremie patří Schwartz-Barrterův syndrom, inadekvátní sekrece ADH (syndrom nepřiměřené sekrece antidiuretického hormonu/Syndrom of Inappropriate secretion of ADH – SIADH). Výskyt tohoto syndromu má rostoucí význam s pokračujícím věkem zejména proto, že je spojen s onemocněními centrálního nervového systému, malignitami, plicními chorobami. Přehled příčin hyponatremie uvádí tab. 3.
Postup při úpravě hyponatremie
Léčba této poruchy závisí na patogenezi jejího vzniku a zejména závažnosti hyponatremie. Nízké koncentrace plazmatického sodíku u pacientů trpících hypotenzí musí být korigována infuzní cestou podáním izotonického roztoku NaCl, případně u závažných hyponatremií podáním hypertonického roztoku NaCl. Nemá přestoupit 0,3–0,4 mmol za hodinu (8 mmol za 24 hod), protože rychlejší změna natremie může vyvolat závažné neurologické komplikace. Současně musí být pečlivě monitorován přívod natria s ohledem na kardiální kompenzaci pacienta, riziko oběhového přetížení a plicního městnání. Pro úpravu sérové koncentrace sodíku při hodnotách 115–125 mmol/l se doporučuje u geriatrické populace přívod izotonického roztoku rychlostí 75–100 ml/hod po dobu 24–48 hod V případech pacientů s projevy srdečních onemocnění se jeví adekvátní infuze fyziologického roztoku rychlostí 50–75 ml/hod.
U asymptomatických pacientů bez projevů deplece extracelulárního objemu se dosáhne korekce nadbytku volné bezsolutové vody snížením jejího příjmu do 1 l/den. U pacientů s klinickými projevy nadbytku celotělových zásob sodíku a nadbytku vody lze stanovit nadbytečný objem vody pomocí následující formule:

Úpravy celkového nadbytku tělesné vody a nadbytku tělesných zásob natria se často dosáhne tělesným klidem a podáním diuretika (20–40 mg furosemidu 2krát denně). Tím se dosáhne inhibice reabsorpce bezsolutové vody vytvářením hypotonické moči a vytvořením negativní vodní bilance.
Hypernatremie
Hypernatremie je ve stáří častou poruchou vnitřního prostředí. Jako klinicky signifikantní je hypernatremie ≥ 150 mmol/l. Protože obsah celkové tělesné vody s postupujícím věkem klesá, dochází ve stáří k dehydrataci mnohem snadněji než v mladém věku. Jednou z příčin je snížení intenzity vnímání a zvýšení prahu pocitu žízně. Současně s tím klesá glomerulární filtrace a schopnost koncentrovat moč a schopnosti šetřit bezsolutovou vodu. Hypernatremie ve stáří přináší vysoké riziko morbidity a mortality v rozmezí od 40 do 60 % [8,9]. Mortalita je zvláště vysoká u starších jedinců s rychlým vzestupem sérové koncentrace sodíku v plazmě > 160 mmol/l. Hypernatremie se manifestuje nespecificky spavostí, slabostí, později stuporem, kómatem a křečemi. Klinicky nalézáme nízký kožní turgor, suchost sliznic, je ortostatická hypotenze. Hyperosmolalita může vést k snížení objemu mozkové tkáně a vzniku spontánních krvácení a subdurálního hematomu. Příčiny hypernatremie jsou nejobvykleji následující:
- snížený přívod čisté bezsolutové vody – febrilie, nedostatečný přívod vody, mentální alterace s defektním vnímáním žízně, imobilita
- zvýšené ztráty vody – průjmové stavy, horečka, osmotická diuréza (glykosurie, sondová výživa s vysokým obsahem proteinů, diabetes insipidus, hyperkalcemie, hypokalemie, chronické renální choroby)
- zvýšený příjem sodíku – prolongované infuze izotonického roztoku NaCl, masivní terapie natrium bikarbonátem
Léčba hypernatremie
K úpravě hypernatremie je většinou nezbytná replece deficitu bezsolutové vody pomocí hypotonických tekutin. Pokud je pacient při vědomí a kooperativní, nastupuje nejprve náhrada bezsolutové vody perorální cestou. Pokud není perorální podání možné, připadá v úvahu infuze 5% glukózy, která je zdrojem čisté vody a zároveň vzniká metabolická voda z oxidace glukózy. Pokud však existuje arteriální hypotenze, zahajuje se infuze izotonickým roztokem NaCl s cílem nejprve upravit systémový krevní tlak a zajistit efektivní orgánovou perfuzi. Při zohlednění průběžných ztrát vody má být deficit vody nahrazen během 48–72 hod. Kalkulace potřeby čisté bezsolutové vody se provádí pomocí následujícího vztahu:

U starších osob léčených infuzí 5% roztokem glukózy je nutné dodržovat přívod 100–125 ml/hod. Obecně je nutné pro každých 10 mmol/l zvýšené koncentrace sodíku v plazmě zvýšit přívod tekutin o 50 ml za hod. Plazmatické elektrolyty musí být monitorovány u kritických pacientů 2–3krát denně, jinak stačí u stabilizovaných pacientů vyšetření plazmatických hladin minerálů 1krát denně. Nezbytné je sledování 12hodinové diurézy, kalkulace ztrát minerálů do moči a bilance Na za 24 hod.
Úprava plazmatické koncentrace natria nemá postupovat rychleji než 0,5 mmol/l/hod. Je nutné mít na paměti, že rychlejší korekce hypernatremie může vést k mozkovému otoku a je krajně riziková.
Poruchy metabolizmu draslíku
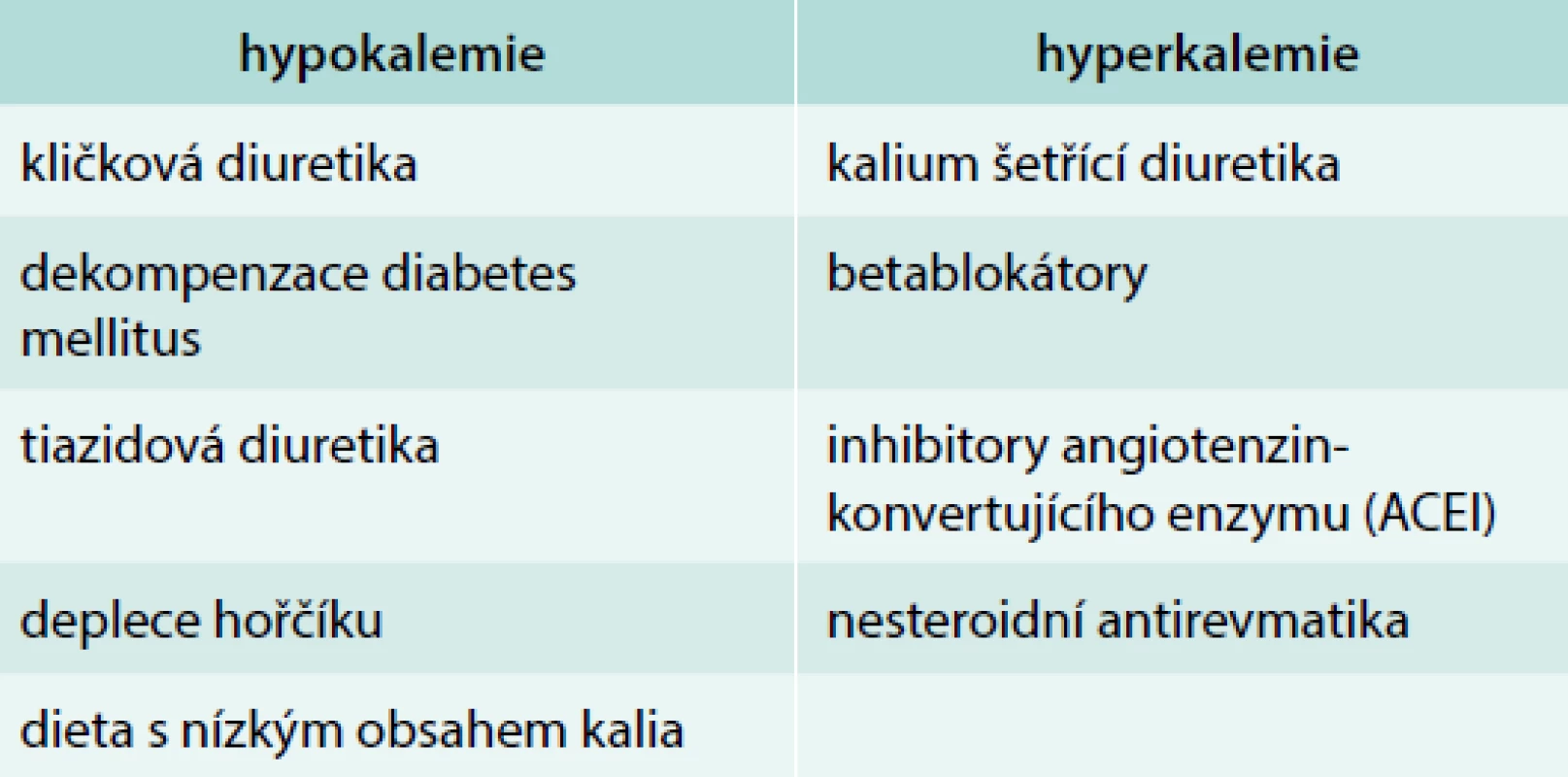
Hyperkalemie
Plazmatické hladiny draslíku jsou normálně udržovány ve velmi úzkém rozmezí 3,5–5,0 mmol/l i u starších pacientů. I když se hladina koncentrace draslíku v plazmě jeví jako normální, pokles této koncentrace ve stáří je významnější, protože závisí na zmenšování svalové hmoty a rozvoji sarkopenie ve vyšším věku. Zvýšení plazmatické koncentrace draslíku po cvičení ve stáří je pravděpodobně způsobeno fluxem draslíku ze svalových tkání. Pokles průtoku krve ledvinami a snížení glomerulární filtrace zvyšuje riziko hyperkalemie ve stáří. Současně terapie nesteroidními antiinflamatorními léky a další medikace mohou redukovat hladinu aldosteronu, a tím narušit exkreci draslíku. Pacienti trpící diabetem nebo hypertenzí, kteří mají současně tubulární acidózu, jsou vystaveni daleko většímu riziku hyperkalemie.
Hypokalemie
I když ve stáří je spíše sklon k hyperkalemii, není výskyt hypokalemie u starších jedinců vzácný, zejména u hypertoniků léčených diuretiky, případně u pacientů s poruchami výživy. Hypokalemie ve stáří je zvláště nebezpečná, protože bývá spojena s dysrytmiemi, případně náhlou smrtí. Výskyt diuretické léčby v starší populaci dosahuje u nemocných starších 60 let věku až 60 %. Hypokalemie je velmi často vyvolána léčbou tiazidovými a kličkovými diuretiky. Významným projevem dysbalance draslíku v organizmu jsou změny na EKG, k nimž patří oploštění vlny T a přítomnost U vlny u závažné hypokalemie. Dalším EKG projevem hypokalemie je prodloužení PR intervalu, snížení voltáže QRS komplexu a jeho rozšíření a konečně komorové arytmie.
Příčinou renálních ztrát kalia je buď acidóza (renální tubulární acidóza, polyurická fáze renální nedostatečnosti) nebo deficit magnezia. Dlouhodobá hypokalemie, např. iatrogenně způsobená chronickým abúzem projímadel, zejména ve stáří, může vést k hypokalemické nefróze charakterizované neschopností tubulů reabsorbovat draslík, a tím šetřit draslík pro organizmus. Následkem jsou trvale vysoké ztráty kalia močí, které mnohdy nelze kompenzovat ani zvýšeným příjmem kalia, a hypokalemická nefróza se prohlubuje. Výsledkem pak jsou chronické, těžko korigovatelné hypokalemie a hypomagnezemie.
Pečlivé zhodnocení medikace, renálních funkcí, zejména vyšetření exkrece draslíku, sodíku a magnezia do moči, zhodnocení pH arteriální krve, patří k zásadním požadavkům pro diagnózu a léčbu poruch metabolizmu kalia [10,11].
Příčiny ovlivňující bilanci kalia uvádí tab. 4.
Léčba poruch metabolizmu kalia
Hyperkalemie
Nejčastějšími příčinami hyperkalemie je léčba betablokátory, ACE inhibitory a nesteroidními antirevmatiky. Přítomnost rozšíření komplexu QRS má vést k urgentní léčbě hyperkalemie. Pro léčbu je důležité podání kalcia intravenózně (ampule calcium gluconicum, 90 mg kalcia v ampuli) během 2–3 min k úpravě depolarizace membrán buněk srdečního svalu. Jestliže je QRS komplex normální, ale je přítomna vysoká T vlna, doporučuje se podání 10% glukózy s 10 j krátkodobě působícího inzulinu intravenózně. S tímto urgentním zákrokem má být zahájena eliminační léčba, která vede ke snížení hladiny draslíku – intravenózní podání furosemidu a použití iontoměničových pryskyřic, případně hemodialýza.
Hypokalemie
Při hodnotách kalia v rozmezí 2,5–3,5 mmol/l zahajujeme léčbu perorálním podáváním draslíku. Doporučuje se 30–40 mmol draslíku v dobře vstřebatelné formě každé 2–4 hod za současného monitorování plazmatických koncentrací draslíku a jeho exkrece do moči. Pokud hladina kalemie poklesne na < 2,5 mmol/l (případně < 3 mmol/l u pacientů s kardiálním onemocněním), doporučuje se intravenózní aplikace, která však nepřesahuje 10 mmol/hod (10 mmol KCl ve 100 ml 5% glukózy rychlostí 100 ml/hod). Pečlivé monitorování EKG při této léčbě je nezbytnou podmínkou.
Poruchy metabolizmu kalcia ve stáří
Bilance a metabolizmus kalcia jsou s rostoucím věkem častější. Redukce absorpce kalcia z gastrointestinálního traktu závisí ve stáří zejména na subnormálních hladinách vitaminu D, zvýšení cirkulující koncentrace parathormonu a vlivu dietních poruch, které jsou spojeny s redukcí vhodných zdrojů vápníku ve výživě. Snížení příjmu kalcia v dietě ve stáří vede k negativní bilanci kalcia, zhoršení mineralizace kosti a často k výskytu hypokalcemie. Je důležité si uvědomit, že přes negativní bilanci kalcia, snížení zásob kalcia v organizmu a projevům onemocnění z deficitu kalcia, nemusí být zachycena hypokalcemie, protože ve stáří existuje řada chorob, které vedou k uvolňování kalcia do oběhu, a tím dochází paradoxně k hyperkalcemii, případně normokalcemii. V extracelulární tekutině se vyskytuje kalcium v následujících hlavních formách:
- kalcium vázané na plazmatický protein, které činí 40 % celkového kalcia v extracelulární tekutině
- je součástí sloučenin v kombinaci s různými anionty včetně fosfátu, sulfátu a citrátu; tato frakce obnáší přibližně 15 % kalcia v extracelulární tekutině
- forma ionizovaného kalcia, které patří k biologicky aktivní frakci kalcia důležité pro mnoho metabolických dějů a která obnáší 45 %
Hlavními regulátory kalcia jsou vitamin D a parathormon (PTH). Primárně je kalcium absorbováno do organizmu působením vitaminu D a jeho metabolitů v gastrointestinálním traktu a je ukládáno do kostí. Renální exkrece kalcia je závislá především na množství kalcia filtrovaného do moči a na hladině PTH. Koncentrace celkového kalcia v plazmě závisí na hladině albuminu, přičemž pokles albuminu o 10 g/l má za následek snížení kalcia o 8 mg/l.
Klinicko-fyziologické důsledky hyperkalcemie
Hyperkalcemie je definována jako vzestup celkového korigovaného kalcia > 2,63 mmol/l nebo ionizovaného kalcia > 1,2 mmol/l. Klinicky jsou nejčastějšími příčinami hyperkalcemie ve stáří maligní onemocnění, léčba diuretiky tiazidového charakteru, imobilizace a hypofunkce nadledvinek. S menší závislostí na věku se vyskytují další příčiny, jako je intoxikace vitaminem D, granulomatózní onemocnění a hypertyreóza. Hyperkalcemie je také častá nejen u malignit metastazujících do kostí, ale jako součást paraneoplastického syndromu, při kterém se tvoří protein podobný PTH (PTH rP – parathyreoid related protein). Vzhledem k tomu, že aktivní formy vitaminu D se s pokračujícím věkem snižují, není hyperkalcemie způsobena hyperabsorpcí kalcia ve stáří častá. Pro starší populaci je nutné při výskytu hyperkalcemie myslet i na tuberkulózu, která se v poslední době více vyskytuje u osob žijících v tísnivých sociálních podmínkách nebo u osob žijících dlouhodobě v institucích pro staré jedince.
Je nutné vzít však v úvahu i intoxikaci vitaminem D iatrogenního charakteru, pokud je používána nepřiměřeně vitaminová substituce ve stáří.
Hyperkalcemie je velmi často přehlédnuta vzhledem k tomu, že je součástí jiného závažného onemocnění. Mezi časté symptomy hyperkalcemie patří anorexie, nauzea a zvracení, zácpa, polyurie a polydipsie. K pokročilejším symptomům patří hypertenze, iritace pankreatu až pankreatitida, vznik peptických vředů, dále poruchy vědomí, zmatenost, stupor a posléze kóma. Na tomto místě je třeba připomenout, že je hyperkalcemie u některých onemocnění, která destruují kost a vedou k rychle se vyvíjející hyperkalcemii, zejména u malignit, považována za terminální stav základního onemocnění. Opakovaně jsem se s tímto stavem setkal, a pokud je hyperkalcemie odhalena a správně léčena, může se stav nemocného natolik upravit, že žije v dobré kvalitě života několik dalších měsíců i déle. Nepoznaná hyperkalcemie, která i u závažného, např. maligního onemocnění, vede k předčasné smrti pacienta, jehož základní onemocnění ve skutečnosti nedospělo k terminálnímu stavu, je závažnou medicínskou chybou [4,12].
V diferenciální diagnostice hyperkalcemie, případně hyperkalcemického kómatu, je důležité stanovení vylučování kalcia do moči, hladiny vitaminů D a metabolitů. Normální hladina PTH pomůže odlišit hyperparatyreózu od hyperkalcemie při malignitě metastazující do kostí. Zvýšení hladin 25(OH)D je známkou toxicity vitaminu D, zatímco vysoké hodnoty 1,25(OH)2D s redukovanou hodnotou 25(OH)D svědčí pro kostní destrukci granulomatózními chorobami, lymfomem, nebo pro nadměrný perorální příjem 1,25(OH)2D vitaminu.
Léčba hyperkalcemie
Prvním opatřením je podání infuze 0,9% NaCl, avšak za velmi pečlivé monitorace celkového příjmu infuzí. Obvykle se doporučuje 100 ml fyziologického roztoku za hodinu po dobu 24–48 hod. Tato dávka je bezpečná a většinou efektivní. Po doplnění objemu se doporučuje podat 20–40 mg furosemidu, nikdy však dříve, než je zajištěna dokonalá náhrada chybějícího extracelulárního objemu. V případě významné hyperkalcemie současně s dehydratací přikročíme k infuzi 0,9% NaCl rychlostí 200 ml/hod, avšak za pečlivého metabolického i neurologického sledování. Dalším účinným opatřením je podání kalcitoninu (4 j/kg každých 12 hod po dobu 48 hod).
Hypokalcemie
O hypokalcemii mluvíme, pokud hladina kalcia klesá < 2,2 mmol/l a hladina ionizovaného kalcia < 1,1 mmol/l. Ve stáří dochází k pokračující osteoporóze i v případě, že jsou hladiny sérového kalcia normální. Je to způsobeno tím, že se s postupujícím věkem mění metabolizmus vitaminu D, obvykle klesá příjem kalcia a vitaminu D, včetně jeho tvorby působením slunečního záření. Při redukci tkáně ledvin je porušená i tvorba vitaminu 1,25(OH)D a absorpce kalcia ve střevě. Vzhledem k tomu, že současně s poruchami příjmu kalcia dochází i k deficitu magnezia, prohlubuje se v organizmu s postupujícím věkem tímto mechanizmem i deplece kalcia.
Hypokalcemie může probíhat pod obrazem život ohrožujícího stavu s tetaniformními křečemi, karpopedálními spazmy, městnavým srdečním selháním a dysrytmiemi s charakteristickým prodloužením QT intervalu. Jednou ze závažných manifestací hypokalcemie jsou psychiatrické projevy. Latentní sklon ke křečím při hypokalcemii prokazuje Chvostkův příznak a Trousseaův příznak. Tuto symptomatologii objektivizujeme stanovením ionizovaného kalcia, dále fosfatemie a hladiny PTH.
Léčba hypokalcemie
Okamžitým opatřením je infuzní podání 10% calcium gluconicum v množství 10 ml za 5–10 min. Pokračuje infuze 3 ampulí 10% kalcium chloridu v 5% glukóze rychlostí 50 ml/hod. Dále se postupuje podle monitorování hladiny ionizovaného kalcia. Vždy zvážíme podání magnezia v případě, kdy je současně hypomagnezemie. Doporučuje se podání aktivní formy vitaminu D [kalcitriol nebo 1,25(OH) vitamin D3 v množství 0,5–2 µg/den].
Poruchy metabolizmu magnezia
Magnezium je mimořádně častý iont zemské kúry a mořské vody, takže je velmi významný i v biosféře. Magnezium je převážně intracelulární iont. 60 % tělesného magnezia je deponováno v kostech a většina ze zbývajícího magnezia je uložena intracelulárně. Pouze 1 % celkového množství tělesného magnezia se nachází v extracelulárních tekutinách. Koncentrace magnezia v plazmě neodráží celkové zásoby magnezia v organizmu [13]. Poměrně častý deficit magnezia v evropské populaci, a to především ve starších věkových skupinách, je způsoben dvěma mechanizmy. Jedním z mechanizmů je nedostatečný příjem způsobený deficitem magnezia v potravě, případně poruchami jeho absorpce, a na druhé straně vysokými renálními ztrátami. Pokles koncentrace magnezia v moči je z velké části důsledkem nedostatku magnezia v potravě. Absorpce magnezia z gastrointestinálního traktu klesá jednak při sníženém obsahu magnezia v dietě industriální společnosti (průmyslově vyráběné potraviny) a vysoce vyšlechtěné kultivary ovoce a zeleniny, současně se zvýšeným obsahem tuku v dietě industriální společnosti. Zvýšený obsah volného tuku ve stravovacích produktech charakteristický pro potravinové řetězce a zařízení typu „rychlé občerstvení“ vede ke zhoršené biologické dostupnosti hořčíku. Podle našich bilančních studií s hořčíkem je deficit hořčíku nejvýraznější např. u diabetiků 2. typu a konečně procento deficitu hořčíku stoupá úměrně s věkem [14]. Deficit hořčíku u diabetiků prokazatelně a velmi významně ovlivňuje rozvoj vzniku diabetických komplikací, především diabetické nefropatie a retinopatie.
Normální koncentrace magnezia v plazmě se pohybuje mezi 1,3–2,2 mmol/l.
Hypermagnezemie
Symptomy a projevy hypermagnezemie tak, jak jsou pozorovány u starší věkové populace, se manifestují většinou u plazmatických hodnot > 4 mmol/l. Hlavními projevy hypermagnezemie jsou neuromuskulární poruchy, hyporeflexie, areflexie, spavost, slabost, v závažných případech somnolence a svalová slabost. Závažnou poruchou je respirační selhání a z kardiologických symptomů hypotenze, bradykardie, prodloužený PR interval, rozšíření QRS a prodloužení QT. Vzácně při velmi těžké hypermagnezemii může vzniknout kompletní AV blok 3. stupně, případně asystolie.
Léčba hypermagnezemie
Pokud je hypermagnezemie asymptomatická, vyžaduje pouze opatření, která omezí přívod hořčíku do organizmu, a zajistíme vyšší obrat tekutin a diurézu, která vede k zvýšenému vylučování magnezia do moči. U těžké hypermagnezemie podáváme 10% calcium gluconicum (10 ml 10% calcium gluconicum během 10 min) při poruchách ventilace připojení pacienta na umělou plicní ventilaci, případně využití kardiostimulátoru při závažných dysrytmiích. Pokud není přítomna renální insuficience, zvyšujeme diurézu podáním 0,9% roztoku NaCl rychlostí 150 ml za hod s cílem zvýšit exkreci magnezia. U pacientů s projevy renální insuficience se mnohdy vyžaduje provedení hemodialýzy.
Symptomy a průběh hypomagnezemie
Klinické projevy hypomagnezemie se objevují obvykle při poklesu hladin sérového magnezia pod 0,8 mmol/l. Mezi časté symptomy patří zmatenost, třes, svalové záškuby, ataxie, nystagmus a v pokročilých stavech tetanie, generalizované křeče a dále spavost, zmatenost, případně kóma. Velmi nebezpečné jsou poruchy, které vznikají při hypomagnezemii v kardiovaskulární oblasti. Na EKG pozorujeme prodloužení PR a QT intervalů, časté jsou síňové a komorové arytmie.
Léčba hypomagnezemie
Lehká hypomagnezemie je léčena pomalou infuzí 10 ml 50% magnezium sulfátu (40 mmol) v 5% glukóze po dobu 24 hod. U závažné hypomagnezemie podáváme bolus magnezium sulfátu a pokračujeme v infuzi 50% magnezium sulfátu v infuzi 5% glukózy po dobu 6 hod. Potřebnou dávku pro suplementaci řídíme podle odpadu hořčíku do moči za 24 hod. Vzhledem k tomu, že hořčík je primárně intracelulární iont, je řízení replece hořčíku podle jeho bilance spolehlivější než využití plazmatických hladin hořčíku. Rovněž stanovení hořčíku v erytrocytech není pro klinickou aplikaci velkým přínosem.
Metabolizmus a bilance fosforu ve stáří
Hypofosfatemie
Hypofosfatemie je z klinického hlediska mnohem častější než hyperfosfatemie. Výskyt hyperfosfatemie v jiných situacích, než je renální selhání, patří k vzácnějším stavům. Hypofosfatemie vzniká jako klinicky významný fenomén několika důležitými mechanizmy:
- vlivem stáří dochází ke snižování schopnosti renální tubulární reabsorpce fosforu
- plazmatické hladiny a celotělové zásoby fosforu jsou ovlivněny vzestupem plazmatického PTH, který je závislý na věku
- nejčastější příčinou hypofosfatemie mnohdy s fatálními klinickými důsledky je nepoznaná hypofosfatemie u vyšších věkových skupin trpících malnutricí. Tuto častou a nebezpečnou situaci ve stáří, která bohužel je někdy přehlédnuta, můžeme popsat podle následujícího scénáře:
Pacient trpící chronicky malnutricí postupně snižuje svůj energetický obrat a potřebu a v důsledku tohoto stavu se snižuje i potřeba fosforu pro důležité fosforylace včetně tvorby adenozintrifosfátu (ATP). Chronické ztráty fosforu u malnutričních pacientů vedou k významné depleci tohoto minerálu, ale při snížené úrovni fosforylací se deficit významně neprojeví. Jestliže je u pacienta zahájena vitálně důležitá nutriční podpora, dochází ve stavu realimentace ke zvýšení potřeby fosforu, jehož nedostatek se projeví významnými klinickými symptomy. Dochází ke změnám dráždivosti centrálního nervového systému a vyvíjí se náhle bez varování stav agresivity pacienta, zmatenost, prchavé monoparézy, poruchy dýchání a postupně se stav prohlubuje až v sopor, případně kóma. Jedním z mechanizmů, který se vedle deficitu ve fosforylacích projeví, je i porucha přenosu kyslíku vazbou na hemoglobin. Nedostatečná tvorba 2,3difosfoglycerátu v erytrocytech vede k posunutí disociační křivky hemoglobinu. Při deficitu 2,3fosfoglycerátu je kyslík vázán na hemoglobin pevněji, a nedojde k jeho uvolnění ani při průchodu tkáněmi s nízkou tenzí kyslíku. Sníží se arteriovenózní gradient O2, takže arteriální saturace O2 je přiměřená, avšak přenos kyslíku do tkání je defektní, protože kyslík zůstává významně vázán i v žilní krvi. Kombinace poruch fosforylace a tvorby makroergních fosfátů současně s defektním přenosem kyslíku do tkání vede ke zhoršení kontraktility myokardu, pestré neurologické symptomatologii a poruchám dýchání. Tato symptomatologie často není spojována s hypofosfatemií, protože plazmatická deplece fosforu se objevuje se zpožděním, tedy v okamžiku, v němž už je jeho už deficit v tkáních velmi výrazný. Proto je hladina plazmatického fosforu mylně interpretována a pro diagnózu je důležitější následná série jeho vyšetření v průběhu intenzivní nutriční podpory a realimentace. Přehlédnutí tohoto fenoménu a špatná interpretace plazmatických koncentrací fosforu je projevem nedostatečného vzdělání.
Svalové abnormality včetně rozvoje rabdomyolýzy, svalové slabosti, respirační a srdeční selhání postupuje a zhoršuje stav tkáňové deplece fosforu velmi rychle. Mezi hematologické symptomy, jako je porucha přenosu kyslíku, patří i intravaskulární hemolýza a leukocytární a trombocytární dysfunkce.
Léčba hypofosfatemie
Pro substituci používáme buď anorganickou formu, kterou je 12,5% roztok Na2HPO4, nebo K2HPO4 (podle toho, zda pro nemocného v dané situaci je vhodnější substituovat současně sodík nebo draslík). Tento koncentrovaný roztok se podává v 5% glukóze nebo 0,45% roztoku NaCl. Při akutních projevech hypofosfatemie je vhodné podat organickou formu fosforu v tukové emulzi, která obsahuje biologicky dobře dostupný fosfatidylcholin a další fosfolipidy. Klinické důsledky těžké hypofosfatemie uvádí tab. 5.

Hyperfosfatemie
Symptomy závažné hyperfosfatemie jsou podobné jako při hypokalcemii. Vzestup fosfátů ve vztahu ke kalciu vede k riziku ektopických kalcifikací v cévách a v měkkých tkáních. U pacientů trpících renálním selháním se hyperfosfatemie podílí na renální osteodystrofii.
Léčba hyperfosfatemie
Zásadním opatřením je restrikce fosforu v dietě, podání přípravků vázajících fosfát (calcium carbonicum, calcium acetát). V případě hyperfosfatemie způsobené renálním selháním je metodou volby hemodialýza.
Závěr
Nové poznatky a také technologie výroby elektrolytových iontových roztoků umožnily nový pohled a strategii v praktickém použití metod úpravy vodního a iontového hospodářství. Zatímco v minulosti dominoval bilanční přístup úpravy poruch vodní a iontové rovnováhy, s postupem doby byly začleněny do oblasti společné s energetickými a metabolickými mechanizmy.
Přínosem je nový pohled, který je založen na skutečnosti, že všechny přesuny a metabolizmus iontů je pevně vázán k energetickému hospodářství tkání. Věk se v tomto smyslu významně uplatňuje, protože se ve stáří mění energetika a využití nutričních energetických substrátů. Z tohoto pohledu vyplývá, že úpravu vodního a iontového hospodářství, není možné zajistit racionálně bez současné úpravy metabolických a energetických procesů. Protože ve stáří je často přítomna malnutrice, je nutné při úpravě minerálních rozvratů brát v úvahu i stav energetického hospodářství, který je ve vyšších věkových skupinách významně změněn. Při energeticko-dynamické insuficienci a neschopnosti buněčných membrán transportovat ionty intracelulárně, případně opačným směrem transportovat ionty z buněk, není možné upravit vodní a iontové hospodářství, pokud není zároveň zajištěna energetická stránka těchto procesů. Proto jedním ze základních principů léčby poruch minerálního a vodního hospodářství ve tkáních je imperativní potřeba současně zajistit nemocného i z hlediska energetických potřeb.
Podpořeno MZ ČR – RVO (UHHK, 00179906)
prof. MUDr. Zdeněk Zadák, CSc.
Centrum pro výzkum a vývoj FN Hradec Králové
Doručeno do redakce 31. 5. 2018
Přijato po recenzi 14. 9. 2018
Sources
- Kaška M, Zadák Z, Živný P et al. Vliv vysokého věku na vnitřní prostředí operovaných. In: Stárnutí populace – důsledky pro současnou medicínu. Česká gerontologická a geriatrická společnost ČLS JEP: Praha 2003. ISBN: 80–239–1484–7.
- Rowe JW, Andres R, Tobin JD et al. The effect of age on creatinine clearance in men: A cross-sectional and longitudinal study. J Gerontol 1976; 31(2): 155–163.
- Davies D, Shock N. Age changes in glomerular filtration rate, effective renal plasma flow, and tubular excretory capacity in adult males. J Clin Invest 1950; 29(5): 496–507. Dostupné z DOI: <http://dx.doi.org/10.1172/JCI102286>.
- Zadák Z. Výživa v intenzivní péči. 2. ed. Grada Publishing: Praha 2008.
- Kaška M, Motyčka P, Hyšpler R et al. The laboratory characteristics of perioperative nutrition. Acta Medica (Hradec Králové) 2006; 49(2): 139.
- Asadollahi K, Beeching N, Gill G. Hyponatraemia as a risk factor for hospital mortality. QJM 2006; 99(12): 877–880. Dostupné z DOI: <http://dx.doi.org/10.1093/qjmed/hcl120>.
- Corona G, Giuliani C, Parenti G et al. Moderate hyponatremia is associated with increased risk of mortality: evidence from a meta-analysis. PLOS One 2013; 8(12): e80451. Dostupné z DOI: <http://dx.doi.org/10.1371/journal.pone.0080451>.
- Borra SI, Kleinfeld M, Beredo R. Hypernatremia in the aging: causes, manifestations, and outcome. J Natl Med Assoc 1995; 87(3): 220–224.
- Palevsky PM. Hypernatremia. Semin Nephrol 1998; 18(1): 20–30.
- Lang R. Edema. In: Gennari FJ (ed) Medical management of kidney and electrolyte disorders. Marcel Dekker: New York 2001. ISBN 978–0824788698.
- Kazda A. Vnitřní prostředí I – voda, ionty, osmolalita. In: Kazda A. Kritické stavy. Metabolická a laboratorní problematika. Galén: Praha 2012 : 1–30. ISBN 978–80–7262–763–9.
- Zadák Z. Léčba hyperkalcemie. Medicína po promoci 2005; 6(1): 42–44.
- Zadák Z, Tichá A, Hyšpler R. Suplementace hořčíku – farmakologické mechanismy, metody podání a pasti. Klin Farmakol Farm 2017; 31(3): 16–18.
- Hyspler R, Ticha A, Svobodová I et al. Evaluation of magnesium deficiency in the Czech population and the influence of supplementation by magnesium-rich mineral water. Clin Nutr Suppl 2012; 7(Supl 1): 255–256.
Labels
Diabetology Endocrinology Internal medicineArticle was published in
Internal Medicine

2018 Issue 11
Most read in this issue
- Thermoregulatory disorders and their significance in the elderly
- Sarcopenia as a severe organ failure, its diagnosing and present therapeutic possibilities
- Electrolyte and water disorders in old age
- Falls: a significant cause of morbidity and mortality in elderly people
