Interferon-alfa v léčbě myeloproliferativních onemocnění
Interferon-alpha in the treatment of myeloproliferative diseases
Despite significant progress, the treatment options for myeloproliferative neoplasms (MPN) are still limited. Interferon α (IFNα) has been recognized as a substance for the treatment of MPN for more than 30 years, but its widespread use has been limited by higher frequency of short-term adverse reactions compared to conventional treatment and until recently, by its off-label indication in BCR/ABL negative MPNs. With the development of pegylated forms of IFNα with a more favorable toxicity and pharmacokinetic profile have renewed interest in the use of IFNα in the treatment of MPN. Recent studies confirm that IFNα is important drug capable of reducing the tumor population in MPN. Thus, IFNα is currently a more frequently considered drug in the treatment of MPN and has adopted into of some expert recommendations as a first-line drug for younger patients with various subtypes of MPN.
Keywords:
pegylated interferon-α – essential thrombocythemia – interferon α – myeloproliferative neoplasm – polycythemia vera – primary myelofibrosis
Authors:
Jarmila Kissová 1,2
Authors‘ workplace:
Oddělení klinické hematologie FN Brno, pracoviště Bohunice
1; LF MU, Brno
2
Published in:
Vnitř Lék 2019; 65(11): 699-703
Category:
Overview
Navzdory významnému pokroku jsou léčebné možnosti myeloproliferativních neoplazií (MPN) stále omezené. Interferon α (IFNα) je více než 30 let považován za látku vhodnou k léčbě myeloproliferativních onemocnění. Jeho plné využití bylo však omezeno vyšší frekvencí krátkodobých nežádoucích účinků při srovnání s konvenční léčbou a tím, že se donedávna jednalo o off-label podávání u BCR/ABL negativních MPN. Vývoj pegylovaných forem IFNα s nižší toxicitou a lepším farmakokinetickým profilem obnovil zájem o využití IFNα v léčbě MPN. Nedávné studie potvrzují, že IFNα je významným lékem schopným dlouhodobě redukovat nádorovou populaci u MPN. IFNα je tak v současnosti častěji zvažovaným preparátem v léčbě MPN, a stává se tak i součástí některých expertních doporučení jako lék první volby pro mladší pacienty s různými subtypy MPN.
Klíčová slova:
esenciální trombocytemie – interferon α – myeloproliferativní neoplazie – pegylovaný interferon α – pravá polycytemie – primární myelofibróza
Úvod
Interferon (IFN) byl objeven před více než 60 lety Issacem a Lindemannem, kteří jej popsali jako látku schopnou interferovat s replikací viru [1]. Pro antiproliferativní, imunomodulační a antiangiogenní efekt interferonu α (IFNα) brzy vzrostl velký zájem o jeho potenciální využití v léčbě různých nádorových chorob. Bezpečnost a účinnost IFNα byly testovány i u hematologických malignit včetně chronické myeloidní leukemie (CML) a BCR/ABL negativních myeloproliferativních onemocnění (MPN). Bylo potvrzeno, že IFNα je první látkou s potenciálem indukce kompletní a trvalé cytogenetické remise u pacientů s CML. Tyto výsledky byly historickým milníkem IFNα v léčbě hematologických malignit. IFNα zůstal nejlepší léčebnou strategií pro CML během následujících desetiletí do objevu inhibitorů tyrozinkináz. U klasických MPN nebyl IFNα, navzdory významnému protinádorovému efektu potvrzenému v několika počátečních studiích, v léčbě těchto onemocnění dostatečně využíván, zejména pro vyšší frekvenci vedlejších účinků léčby.
Myeloproliferativní neoplazie (MPN) jsou klonální onemocnění charakterizované vysokou frekvencí genetických změn zahrnují CML a BCR/ABL negativní MPN. Translokace t(9;22), známá jako „filadelfský chromosom“, vede k vytvoření fúzního genu BCR/ABL, který je charakteristickým znakem CML. MPN bez této mutace jsou klasifikovány jako BCR/ABL negativní MPN. Mezi nejčastější onemocnění této skupiny patří pravá polycytemie (polycythaemia vera – PV), esenciální trombocytemie (ET) a primární myelofibróza (PMF). Genetickou mutací, nalezenou u pacientů s PV ve více než 95 % případů, je mutace JAK2 v exonu 14 (JAK2V617F) a u 3 % případů v exonu 12 JAK2 [2]. Mutace JAK2V617F je rovněž driver mutací pro ET a PMF s frekvencí 55 % a 65 %. Mutace MPL a CALR (calreticulin/kalretikulin) jsou detekovány ve 3–4 % a 20–25 % u ET a v 6–7 % a 20–25 % u PMF [3]. Běžná léčebná strategie u MPN je založena na riziku cévních komplikací, které jsou hlavní příčinou mortality a morbidity. Z pohledu dlouhodobého průběhu mohou být tato onemocnění provázena zvýšeným rizikem transformace do akutní leukemie. Léčba schopná změnit tento vývoj nebyla dosud jednoznačně definována. Alogenní transplantace kmenových buněk zůstává jediným kurativním přístupem, který je odůvodněn jen u omezeného počtu pacientů s PMF vysokého rizika.
Historie IFNα u MPN
Již v roce 1985 bylo popsáno, že IFNα je schopen úpravy těžké trombocytózy u MPN [4]. Několik studií během posledních 30 let následně potvrdilo, že léčba IFNα je spojena s redukcí frekvence venepunkcí u PV, s vymizením pruritu, normalizací zvýšeného počtu leukocytů a trombocytů a redukcí velikosti sleziny [5–10]. Mechanizmus působení IFNα byl intenzivně zkoumán zejména u CML [11,12]. Navzdory výsledkům studií nebyl IFNα používán jako lék první volby v léčbě BCR/ABL negativních MPN, a to zejména z důvodu relativně vysoké míry vedlejších účinků a s tím spojené nutnosti přerušení léčby tímto lékem (20–30 %) [7]. S identifikací mutace JAK2V617F se začaly objevovat data o potenciálu IFNα indukovat molekulární remisi u JAK2 pozitivních pacientů [7,10,13] a později po objevení mutace CALR zprávy i o redukci mutační nálože [14]. Zájem o léčbu IFNα u PV a ostatních MPN byl oživen v několika studiích během posledních 5–10 let. V současné době je IFNα používán především u BCR/ABL negativních MPN.
Mechanizmus působení IFNα a účinky u BCR/ABL negativních MPN
Mechanizmus působení IFNα u MPN zůstává z velké části nejasný navzdory zvyšujícím se klinickým a biologickým důkazům účinnosti. Jedna z hlavních drah, kterou IFNα působí, je JAK/STAT dráha (Janus kinase/signal transducer and activators of transcriptions). Signální dráha JAK/STAT je jednou z klíčových signálních kaskád, které zprostředkovávají přenos signálů indukovaných cytokiny a růstovými faktory z buněčného povrchu do jádra, kde zpravidla ovlivní expresi genů. Mechanizmus působení IFNα je přisuzován jeho antiproliferativnímu, proapoptotickému, antiangiogennímu a imunomodulačnímu efektu [15,16], zahrnuje přímý cytotoxický efekt na maligní buňky [8] i posílení imunitní odpovědi na přítomnost maligních buněk [6]. Mnoho účinků IFNα poskytuje odůvodnění pro jeho využití v léčbě MPN – vede ke snížení všech 3 krvetvorných řad – je popisováno vysoké procento hematologických odpovědí [5–7,10,13,14]. Působením IFNα dochází rovněž ke zmírnění celkových příznaků, redukci velikosti sleziny a snížení nálože mutovaných alel JAK2 [7,17], méně výrazně CALR [14]. Několik studií ukázalo, že dlouhodobá léčba IFNα je u části pacientů doprovázená molekulární remisí [9,10,13,18], která může přetrvávat po přerušení léčby IFNα až 3 roky [9,19,20]. Tato zjištění ukazují, že terapie IFNα je schopná indukovat minimální reziduální chorobu u podskupiny pacientů s MPN. Nebyl potvrzen leukemogenní efekt IFNα.
Preparáty IFNα
Preparáty IFNα jsou k dispozici jednak standardní, jednak pegylované. Liší se nejen subtypem IFNα, ale i farmakokinetickými vlastnostmi ovlivňujícími frekvenci podávání. Standardní preparáty IFNα-2b (IntronA®) a IFNα-2a (Roferon-A®) vyžadují vícečetné injekce týdně. Pegylované formy IFNα byly vyvinuty za účelem zlepšení tolerance. Chemické spojení IFNα s polyetylenglykolem (PEG) inhibuje jeho proteolytické odbourávání a vylučování; prodloužený biologický poločas vede k redukci frekvence podávání a lepší toleranci. Molekulární remise jsou popisovány především po pegylovaných preparátech. PEGIFNα-2b (PegIntron®) a PEGIFNα-2a (Pegasys®) jsou podávány 1krát týdně, zatímco nově registrovaný ropeginterferon α-2b (Besremi®) 1krát za 2 týdny, při udržovací léčbě 1krát za 4 týdny. Ropeginterferon α-2b je monopegylovaný IFNα-2b s jedinou izoformou díky inovativní pegylační technologii, nově registrovaný v Evropské unii pro použití při léčbě pravé polycytemie. Klinické studie ukazují velmi slibné výsledky účinnosti a bezpečnosti tohoto preparátu [13].
Obvyklé dávkování IFNα v léčbě MPN je u standardních preparátů 3 MIU (Million International Units) podkožně 3krát týdně, pro dávkování PEGIFNα-2a (Pegasys®) je obvykle 45 μg/týden, s postupným navýšením dávky o 45 μg/týden, PEGIFNα-2b (PegIntron®) je v ČR nedostupný. U ropeginterferonu je doporučováno zahájit léčbu dávkou 100 µg podkožně (nebo 50 µg u pacientů s jinou cytoredukční terapií), s navýšením dávky o 50 µg 1krát za 2 týdny. Spektrum dostupných preparátů IFNα se v současné době mění, končí výroba některých standardních preparátů a v blízké budoucnosti budou k dispozici preparáty s větším obsahem léčivého přípravku, u nichž může být titrace optimálních nižších dávek obtížná. V současné době jsou u BCR/ABL negativních MPN všechny standardní i pegylované IFNα „off-label“ indikací, vyjma ropeginterferonu.
Nežádoucí účinky IFNα
Léčba IFNα je spojena s vedlejšími účinky (tab. 1), které představují míru předčasného ukončení ve většině studií asi 20–30 % [8–10,21]. Většina nežádoucích účinků je objevuje v 1. roce léčby, mohou být značně redukovány použitím nižších dávek IFNα.
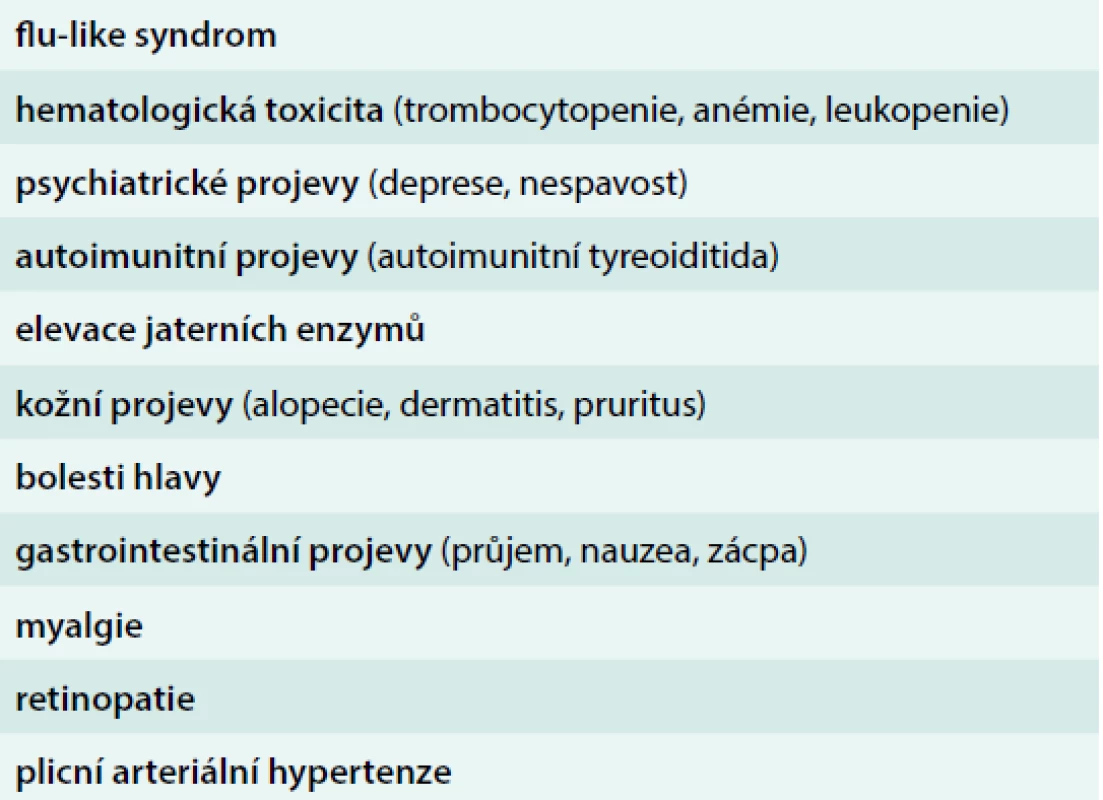
Flu-like syndrom
Nejčastějším vedlejším účinkem je počáteční flu-like syndrom, který zahrnuje bolesti hlavy, teplotu, nevolnost, zimnici, třesavku, únavu, bolesti svalů a kloubů. Tyto příznaky jsou nejvýraznější v 1. dnech aplikace a lze je zmírnit preventivním podáváním paracetamolu i aplikací IFNα ve večerních hodinách. Ke zmírnění těchto celkových příznaků dochází většinou během 1. týdne léčby, jsou závislé na dávce a lze jim předcházet použitím nižších iniciálních dávek IFNα [22]. U některých pacientů může chronická únava přetrvávat a vést k nutnosti ukončení léčby.
Hematologická toxicita
Hematologická toxicita je způsobena myelosupresivním účinkem na kostní dřeň. Nejčastější je leukopenie, méně častá trombocytopenie.
Účinky na psychiku
Během léčby IFNα se mohou objevit psychické účinky – jedná se nejčastěji o deprese, poruchy spánku, ospalost, nervozitu, podrážděnost, snížení koncentrace a pozornosti, střídání nálad. U menšiny pacientů je popisován vznik depresí, které vyžadují přerušení, nebo i ukončení léčby. U pacientů s předchozí nebo přítomnou psychiatrickou diagnózou by IFNα měl být podáván s opatrností.
Příznaky autoimunitního onemocnění
U některých pacientů se mohou vyvinout příznaky autoimunitního onemocnění. Autoimunitní tyreoiditida s následnou hypotyreózou může vzniknout v průběhu léčby u některých nemocných. Je doporučováno testovat funkci štítné žlázy před a během léčby IFNα. Jiné autoimunitní poruchy jsou vzácné.
Plicní hypertenze
U přípravků s IFNα byly hlášeny případy plicní hypertenze, zejména u pacientů s rizikovými faktory (např. portální hypertenzí, infekcí HIV nebo cirhózou), v typickém případě několik měsíců od zahájení léčby. Kauzalita tohoto vztahu však jednoznačně prokázána nebyla.
Účinky na gastrointestinální trakt
Z gastrointestinálních účinků je nejčastější nechutenství, které může být ve výjimečných případech výrazné. Je doporučováno sledovat během léčby hmotnost pacienta. Nauzea a zvracení jsou výjimečné. Laboratorní vyšetření často prokazuje změny jaterních funkcí, projevující se elevací bilirubinu a jaterních enzymů, v některých případech vyžadující úpravu dávky.
Oftalmologické komplikace
Oftalmologické komplikace se mohou projevit jako retinopatie, retinální hemoragie, retinální exsudáty, odchlípení sítnice a okluze retinální tepny nebo žíly. Během léčby je doporučováno provést vyšetřování očního pozadí. Nicméně i v tomto případě je kauzalita vztahu k léčbě IFNα nejistá.
Kontraindikace IFNα
Kontraindikace podávání IFNα jsou shrnuty a uvedeny v tab. 2.

IFNα u jednotlivých typů MPN
Indikace podávání IFNα u BCR/ABL negativních MPN je podpořena daty týkající se bezpečnosti a účinnosti u více než 1 000 pacientů zařazených do studií za posledních 30 let. IFNα je považován za léčivo první volby u pacientů s ET, PV a proliferativní fází PMF, zejména u mladších pacientů dle celé řady terapeutických doporučení [23–25].
IFNα u pacientů s polycythaemia vera
Dlouhodobá účinnost IFNα u pacientů s PV byla potvrzena výsledky několika studií, které zaznamenaly hematologickou odezvu až u 80 % nemocných [6,10,22]. Po podání standardních i pegylovaných preparátů byla signifikantně redukována četnost venepunkcí a kompletní nebo parciální hematologická remise se objevila téměř u všech pacientů [6,17]. Signifikantní redukce nálože JAK2 mutace byla zaznamenána po obou typech preparátů [6,13,26]. Ropeginterferon α vykazuje u nemocných s PV dle nedávné studie po 3 letech léčby statisticky významný rozdíl v redukci nálože JAK2 mutace při srovnání s hydroxyureou [27].
IFNα u esenciální trombocytemie
Více než 30 let se prokazuje účinnost IFNα také v léčbě ET [4,6,17]. V literatuře jsou dokumentovány dlouhodobé hematologické remise až po dobu 3 let po přerušení léčby [6,17]. Po podání pegylovaného IFNα jsou rovněž zaznamenány redukce nálože JAK2 mutace [26]. Tab. 3 uvádí možné indikace podávání IFNα u PV a ET.

IFNα u primární myelofibrózy
Neexistují přesvědčivé důkazy, že jiná terapie než transplantace kostní dřeně ovlivňuje riziko progrese nebo transformace do myelofibrózy. Pacienti v pokročilé fázi PMF nemají prospěch z podávání IFNα, ale u hyperproliferativní fáze PMF je jeho léčba velmi efektivní. Malé dávky IFNα u pacientů s PMF vedly k redukci velikosti sleziny, redukce bolesti kostí a redukci leukocytózy [26,28]. Možné indikace k léčbě IFNα u PMF uvádí tab. 4.

V ČR nemají standardní i pegylované preparáty v léčbě BCR/ABL negativních MPN standardní úhradu ze zdravotního pojištění, a je tedy nutno žádat o jeho úhradu revizního lékaře příslušné zdravotní pojišťovny.
IFNα v graviditě
Myeloproliferativní onemocnění i gravidita jsou spojeny s vysokou incidencí tromboembolických a krvácivých komplikací. Tyto komplikace mohou postihnout matku i plod. IFNα je léčbou volby u gravidních žen s MPN vyžadujících cytoredukční léčbu [29,30]. Ačkoliv gravidita je stále uvedena jako kontraindikace léčby IFNα, běžně je IFNα doporučován na základě konsenzu odborníků (tab. 5) jako nejbezpečnější cytoredukční léčba během gravidity vysokého rizika. Obvykle je doporučována léčba IFNα u gravidních pacientek s vysokým rizikem (předchozí trombóza nebo významné krvácení, reprodukční ztráty nebo jiné komplikace gravidity spojené s MPN, významná trombocytóza) [29]. Publikovaná data uvádějí, že IFNα je nezávislým prediktorem vysoké porodnosti u žen s MPN [30]. Pegylovaný IFNα by měl být upřednostňován z důvodu lepší tolerance a účinnosti. Dostupná data ale nejsou dostatečná k vyloučení obav týkajících se bezpečnosti těchto preparátů v graviditě.
![Léčebná strategie pro BCR/ABL negativní myeloproliferace v graviditě dle doporučení European
Leukemia Net [30]](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image_pdf/d1a76e8e6bcdc7171d344c96414543f3.png)
Závěr
Významným krokem z pohledu vyléčení MPN bude eradikace maligního klonu. První důkazy možné eradikace MPN po léčbě IFNα se objevují v publikovaných klinických studiích. Tzv. renesance IFNα u MPN je přisuzována zvýšenému počtu studií během posledních 5–10 let, které ukázaly trvalou kompletní hematologickou a molekulární remisi při dlouhodobé léčbě IFNα. IFNα se tak jeví být efektivním lékem v terapii BCR/ABL negativních MPN.
Podpořeno MZ ČR – RVO (FNBr, 65269705).
Doručeno do redakce 4. 9. 2019
Přijato po recenzi 7. 10. 2019
MUDr. Jarmila Kissová, Ph.D.
Oddělení klinické hematologie FN Brno, pracoviště Bohunice
Sources
- Isaacs A, Lindemann J. Virus interference. I. The interferon. Proc R Soc Lond B Biol Sci 1957; 147(927): 258–267.
- Pardanani A, Lasho TL, Finke C et al. Prevalence and clinicopathologic correlates of JAK2 exon 12 mutations in JAK2V617F-negative polycythemia vera. Leukemia 2007; 21(9): 1960–1963. Dostupné z DOI: <http://dx.doi.org/10.1038/sj.leu.2404810>.
- Tefferi A, Guglielmelli P, Larson DR et al. Long-term survival and blast transformation in molecularly annotated essential thrombocythemia, polycythemia vera, and myelofibrosis. Blood. 2014; 124(16):2507–2513; quiz 2615. Dostupné z DOI: <http://dx.doi.org/10.1182/blood-2014–05–579136>.
- Linkesch W, Gisslinger H, Ludwig H et al. Therapy with interferon (recombinant IFN-alpha-2C) in myeloproliferative diseases with severe thrombocytoses. Acta Med Austriaca 1985; 12(5): 123–127.
- Kiladjian JJ, Cassinat B, Turlure P et al. High molecular response rate of polycythemia vera patients treated with pegylated interferon alpha-2a. Blood 2006; 108(6): 2037–2040. Dostupné z DOI: <http://dx.doi.org/10.1182/blood-2006–03–009860>.
- Kiladjian JJ, Chomienne C, Fenaux P. Interferon-alpha therapy in bcr-abl-negative myeloproliferative neoplasms. Leukemia 2008; 22(11): 1990–1998. Dostupné z DOI: <http://dx.doi.org/10.1038/leu.2008.280>.
- Kiladjian JJ, Mesa RA, Hoffman R. The renaissance of interferon therapy for the treatment of myeloid malignancies. Blood 2011; 117(18): 4706–4715. Dostupné z DOI: <http://dx.doi.org/10.1182/blood-2010–08–258772>.
- Kiladjian JJ, Giraudier S, Cassinat B. Interferon-alpha for the therapy of myeloproliferative neoplasms: targeting the malignant clone. Leukemia 2016; 30(4): 776–781. Dostupné z DOI: <http://dx.doi.org/10.1038/leu.2015.326>.
- Larsen TS, Møller MB, de Stricker K et al. Minimal residual disease and normalization of the bone marrow after long-term treatment with alpha-interferon2b in polycythemia vera. A report on molecular response patterns in seven patients in sustained complete hematological remission. Hematology 2009; 14(6): 331–334. Dostupné z DOI: <http://dx.doi.org/10.1179/102453309X12473408860587>.
- Quintás-Cardama A, Abdel-Wahab O, Manshouri T et al. Molecular analysis of patients with polycythemia vera or essential thrombocythemia receiving pegylated interferon α-2a. Blood 2013; 122(6): 893–901. Dostupné z DOI: <http://dx.doi.org/10.1182/blood-2012–07–442012>.
- Kujawski LA, Talpaz M. The role of interferon-alpha in the treatment of chronic myeloid leukemia. Cytokine Growth Factor Rev 2007; 18(5–6): 459–471. Dostupné z DOI: <http://dx.doi.org/10.1016/j.cytogfr.2007.06.015>.
- Guilhot F, Roy L, Saulnier PJ et al. Immunotherapeutic approaches in chronic myelogenous leukemia. Leuk Lymphoma 2008; 49(4): 629–634. Dostupné z DOI: <http://dx.doi.org/10.1080/10428190801927510>.
- Gisslinger H, Zagrijtschuk O, Buxhofer-Ausch V et al. Ropeginterferon alfa-2b, a novel IFNα-2b, induces high response rates with low toxicity in patients with polycythemia vera. Blood 2015; 126(15): 1762–1769. Dostupné z DOI: <http://dx.doi.org/10.1182/blood-2015–04–637280>.
- Verger E, Cassinat B, Chauveau A et al. Clinical and molecular response to interferon-α therapy in essential thrombocythemia patients with CALR mutations. Blood 2015; 126(24): 2585–2591. Dostupné z DOI: <http://dx.doi.org/10.1182/blood-2015–07–659060>.
- Pestka S, Krause CD, Walter MR. Interferons, interferon-like cytokines, and their receptors. Immunol Rev 2004; 202 : 8–32. Dostupné z DOI: <http://dx.doi.org/10.1111/j.0105–2896.2004.00204.x
- Billiau A Interferon: the pathways of discovery I. Molecular and cellular aspects. Cytokine Growth Factor Rev 2006; 17(5): 381–409. Dostupné z DOI: <http://dx.doi.org/10.1016/j.cytogfr.2006.07.001
- Hasselbalch HC, Holmström MO. Perspectives on interferon-alpha in the treatment of polycythemia vera and related myeloproliferative neoplasms: minimal residual disease and cure? Semin Immunopathol 2019; 41(1): 5–19. Dostupné z DOI: <http://dx.doi.org/10.1007/s00281–018–0700–2>.
- Them NC, Bagienski K, Berg T et al. Molecular responses and chromosomal aberrations in patients with polycythemia vera treated with peg-proline-interferon alpha-2b. Am J Hematol 2015; 90(4): 288–294. Dostupné z DOI: <http://dx.doi.org/10.1002/ajh.23928>.
- Utke Rank C, Weis Bjerrum O, Larsen TS et al. Minimal residual disease after long-term interferon-alpha2 treatment: a report on hematological, molecular and histomorphological response patterns in 10 patients with essential thrombocythemia and polycythemia vera. Leuk Lymphoma 2016; 57(2): 348–354. Dostupné z DOI: <http://dx.doi.org/10.3109/10428194.2015.1049171>.
- Larsen TS, Bjerrum OW, Pallisgaard N et al. Sustained major molecular response on interferon alpha-2b in two patients with polycythemia vera. Ann Hematol 2008; 87(10): 847–850. Dostupné z DOI: <http://dx.doi.org/10.1007/s00277–008–0498–4>.
- Gowin K, Jain T, Kosiorek H et al. Pegylated interferon alpha-2a is clinically effective and tolerable in myeloproliferative neoplasm patients treated off clinical trial. Leuk Res 2017; 54 : 73–77. Dostupné z DOI: <http://dx.doi.org/10.1016/j.leukres.2017.01.006>.
- Silver RT. Long-term effects of the treatment of polycythemia vera with recombinant interferon-alpha. Cancer 2006; 107(3): 451–458. Dostupné z DOI: <http://dx.doi.org/10.1002/cncr.22026>.
- Penka M, Schwarz J, Campr V et al. Shrnutí doporučení České pracovní skupiny pro Ph-negativní myeloproliferativní onemocnění (CZEMP) České hematologické společnosti ČLS JEP pro diagnózu a terapii BCR/ABL-negativních myeloproliferací. Vnitr Lek 2012; 58(2): 163–168.
- Hatalova A, Schwarz J, Gotic M et al. Recommendations for the diagnosis and treatment of patients with polycythaemia vera. Eur J Haematol 2018; 101(5): 654–664. Dostupné z DOI: <http://dx.doi.org/10.1111/ejh.13156>.
- Barbui T, Tefferi A, Vannucchi AM et al. Philadelphia chromosome-negative classical myeloproliferative neoplasms: revised management recommendations from European Leukemia Net Leukemia 2018; 32(5): 1057–1069. Dostupné z DOI: <http://dx.doi.org/10.1038/s41375–018–0077–1>.
- Quintás-Cardama A, Abdel-Wahab O, Manshouri T et al. Molecular analysis of patients with polycythemia vera or essential thrombocythemia receiving pegylated interferon α-2a. Blood 2013; 122(6): 893–901. Dostupné z DOI: <http://dx.doi.org/10.1182/blood-2012–07–442012>.
- Ianotto JC, Chauveau A, Boyer-Perrard F et al. Benefits and pitfalls of pegylated interferon-α2a therapy in patients with myeloproliferative neoplasm-associated myelofibrosis: a French Intergroup of Myeloproliferative neoplasms (FIM) study. Haematologica 2018; 103(3): 438–446. Dostupné z DOI: <http://dx.doi.org/10.3324/haematol.2017.181297>.
- Griesshammer M, Sadjadian P, Wille K. Contemporary management of patients with BCR-ABL1-negative myeloproliferative neoplasms during pregnancy. Expert Rev Hematol 2018; 11(9): 697–706. Dostupné z DOI: <http://dx.doi.org/10.1080/17474086.2018.1506325>.
- Melillo L, Tieghi A, Candoni A et al. Outcome of 122 pregnancies in essential thrombocythemia patients: A report from the Italian registry. Am J Hematol 2009; 84(10): 636–640. Dostupné z DOI: <http://dx.doi.org/10.1002/ajh.21504>.
- Barbui T, Barosi G, Birgegard G et al. Philadelphia-Negative Classical Myeloproliferative Neoplasms: Critical Concepts and Management Recommendations From European Leukemia Net. J Clin Oncol 2011; 29(6): 761–770. Dostupné z DOI: <http://dx.doi.org/10.1200/JCO.2010.31.8436>.
Labels
Diabetology Endocrinology Internal medicineArticle was published in
Internal Medicine

2019 Issue 11
-
All articles in this issue
- Funkční onemocnění trávicího traktu a bolest
- Môže warfarín zabrániť vzniku nádorov?
- Imunodeficience v rámci diferenciální diagnostiky intersticiálních plicních procesů
- Proč je v léčbě arteriální hypertenze důležité rychle dosáhnout cílových hodnot krevního tlaku
- Interferon-alfa v léčbě myeloproliferativních onemocnění
- Pancytopenie, panhypopituitarizmus a jaterní cirhóza: rozbor složité kazuistiky
- Nedostatek vitaminu D a jeho zdravotní dopady
-
Sekundární prevence ischemické choroby srdeční a chorob periferních tepen kombinací antiagregační a antikoagulační léčby
Odborné stanovisko České kardiologické společnosti, České internistické společnosti ČLS J.E. Purkyně a České angiologické společnosti ČLS J.E. Purkyně k výsledkům studie COMPASS - Odešel profesor Ivo Dvořák
- Primář Jiří Spáčil oslavil 80. narozeniny
- Profesor Jan Petrášek slaví devadesáté narozeniny
- Mýty a fakty o liečbe artériovej hypertenzie: naozaj vieme o artériovej hypertenzii všetko?
- Epidurální absces páteře – raritní komplikace Crohnovy choroby: kazuistika
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue
- Funkční onemocnění trávicího traktu a bolest
- Interferon-alfa v léčbě myeloproliferativních onemocnění
- Nedostatek vitaminu D a jeho zdravotní dopady
- Imunodeficience v rámci diferenciální diagnostiky intersticiálních plicních procesů
