Netuberkulózní mykobakteriální onemocnění: review na podkladě kazuistiky
Nontuberculous mycobacterial disease: a case report-based review
Nontuberculous mycobacterial infections are rare diseases. However, as number of immunocompromised patients is growing and modern diagnostic tools are available, both the importance and incidence of nontuberculous mycobacterial infections are gaining clinical importance. Based on a clinical case, this article briefly summarizes the current knowledge on this issue.
Keywords:
immunosuppression – nontuberculous mycobacteria
:
Marcela Královcová 1; Thomas Karvunidis 1,2; Jaroslav Raděj 1,2; Martin Matějovič 1,2
:
I. interní klinika LF UK a FN Plzeň
1; Biomedicínské centrum LF UK v Plzni
2
:
Vnitř Lék 2019; 65(5): 369-375
:
Case reports
Netuberkulózní mykobakteriózy jsou vzácná onemocnění, jejichž incidence spolu s narůstajícím počtem imunokompromitovaných nemocných a lepšími diagnostickými možnostmi pozvolna narůstá. Článek stručně shrnuje problematiku netuberkulózních mykobakterióz na podkladě reálné kazuistiky.
Klíčová slova:
imunosuprese – netuberkulózní mykobakteria
Kazuistika
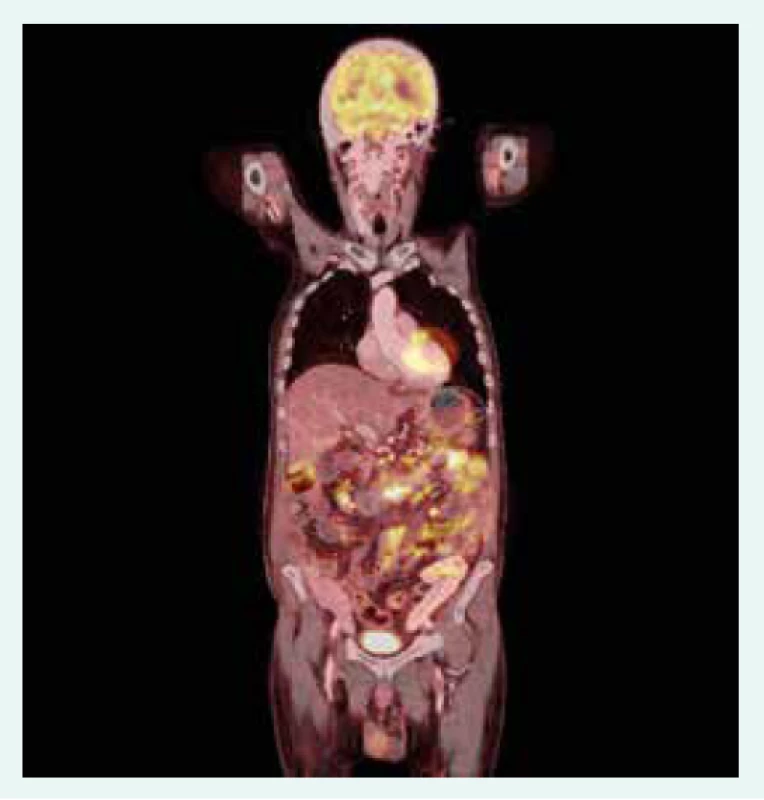
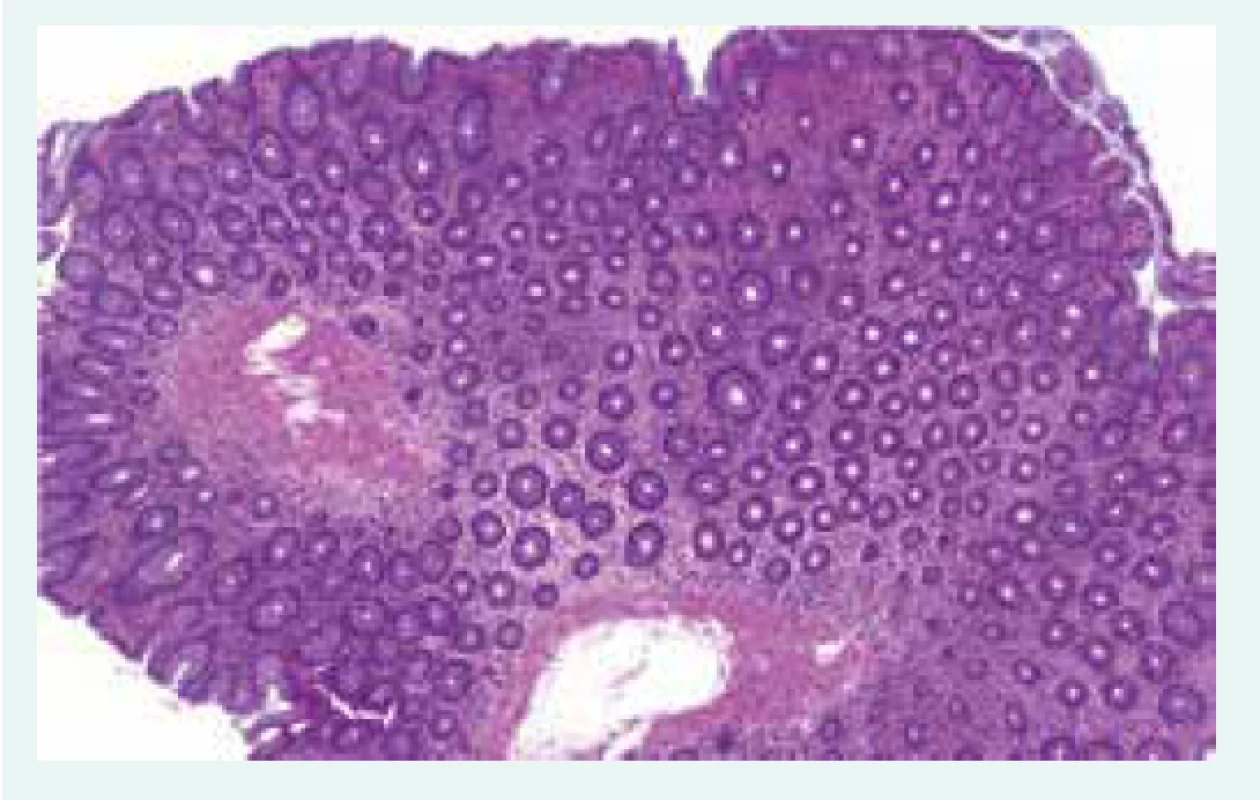
65letý nemocný s diabetem 1. typu ve stadiu mnohočetných orgánových komplikací, s terminálním selháním ledvin při diabetické nefropatii, po kombinované transplantaci ledviny a pankreatu, s dobrou funkcí obou štěpů s imunosupresivní léčbou takrolimem a sirolimem, byl přijat k hospitalizaci na standardní interní oddělení pro těžkou proteino-energetickou malnutrici. Přijetí k hospitalizaci předcházelo několik měsíců trvající neprospívání s nočními poty, abdominalgiemi, frekventními průjmy a následně i rozvojem febrilií. Hmotnostní úbytek činil 20 kg za 2 měsíce. Vstupní BMI byl 16,8 kg/m2. Na provedeném PET/CT byla patrna akumulace radiofarmaka ve stěně tenkých kliček i tračníku, stagnující obsah v žaludku a metabolicky aktivní uzliny v retroperitoneu, mezenteriu a mediastinu (obr. 1.1 a obr. 1.2). Laboratorně byla přítomna elevace parametrů zánětu, hypoalbuminemie a koagulopatie (tab. 1). Vedlejším nálezem při přijetí byl asymetrický otok pravé dolní končetiny, na které byla záhy duplexní ultrasonografií prokázána hluboká žilní trombóza zasahující proximálně do úrovně v. femoralis communis. Byla zahájena empirická antibiotická léčba (ATB) ceftriaxonem i.v. a metronidazolem p.o. a antikoagulační léčba nízkomolekulárním heparinem s adjustací dávky dle anti-Xa aktivity. Pro těžkou proteino-energetickou malnutrici a významné postižení gastrointestinálního traktu (obr. 1.1 a obr. 1.2) se stagnujícím obsahem v žaludku byla zahájena parenterální výživa. Současně byla endoskopicky zavedena i trojluminální nazojejunální sonda k adekvátní postpylorické enterální alimentaci a současné derivaci žaludečního obsahu. Imunochromatografický průkaz toxigenního kmene Clostridium difficile vedl k úpravě ATB léčby (ceftriaxon i.v. a vankomycin p.o.). Zavedená léčba však vedla k pouze parciálnímu efektu na ústup abdominálního diskomfortu a frekventních průjmů. Dalším nálezem byla cytomegalovirová (CMV) DNAemie/virová nálož (2 500 IU/ml) resp. CMV infekce detekovaná polymerázovou řetězovou reakcí (polymerase chain reaction – PCR). Byla zahájena preemptivní virostatická léčba ganciklovirem a k vyloučení CMV kolitidy byla s plánem bioptického vyšetření provedena ezofagogastroduodenofibroskopie a koloskopie. Cytomegalovirová kolitida byla záhy histologicky vyloučena a virostatická léčba následně ukončena za současného poklesu CMV DNAemie. Překvapivým histologickým nálezem však byla masivní infiltrace tenkého střeva i tračníku makrofágy (obr. 2.1 a obr. 2.2), které byly vyplněny PAS (Periodic Acid Schiff) pozitivními tyčemi (obr. 2.3), pozitivně barvenými dle Ziehlova-Neelsenova barvení jako acidorezistentní tyče. IGRA (Interferon γ Release Assay) testy (T-spot TB a quantiFERON TB) z krve byly negativní. PCR vyšetření z tracheálního aspirátu a bioptované tkáně tenkého střeva vyloučilo infekci Mycobacterium tuberculosis. Současně byla PCR z tracheálního aspirátu prokázána přítomnost Mycobacterium avium. Další PCR analýza téhož materiálu vyloučila Mycobacterium kansasii i Mycobacterium marinum a také Tropheryma whipplei. Vzhledem k podezření na střevní mykobakteriózu byla redukována imunosupresivní léčba (monoterapie takrolimem) a zahájena empirická kombinovaná antimykobakteriální léčba rifampicinem p.o., klaritromycinem a ciprofloxacinem i.v. Mycobacterium avium bylo dále kultivačně prokázáno i ve sputu a bronchoalveolární laváži (BAL). I přes zavedenou léčbu však přetrvávala dysfunkce gastrointestinálního traktu manifestující se malabsorpcí s recidivujícími průjmy při pokusech o navýšení enterální výživy, perzistujícími vysokými odpady z gastrického portu trojluminální sondy a recidivujícím singultem.



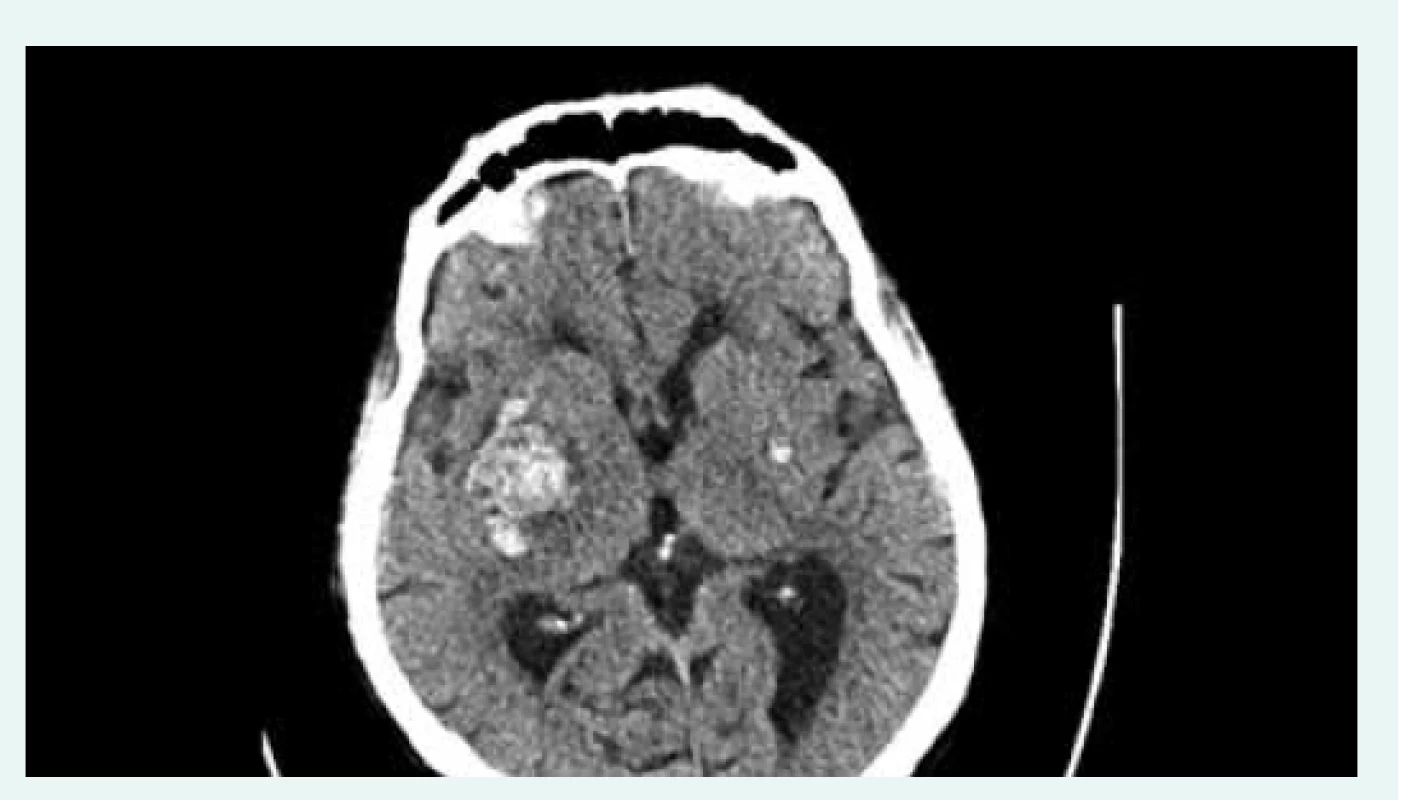
Klinický stav nemocného se 22. den hospitalizace významně zkomplikoval akutním rozvojem levostranné hemiparézy při intracerebrálním krvácení (ICH) v oblasti bazálních ganglií vpravo s útlakem postranní komory a III. komory (CT), obr. 3. Pro současně se rozvíjející poruchu vědomí byl nemocný přeložen na jednotku intenzivní péče, bylo nezbytné zajištění dýchacích cest orotracheální intubací a zahájení umělé plicní ventilace. Neurochirurgická léčba nebyla indikována.
Další průběh onemocnění byl determinován významným a nereparujícím se neurologickým postižením, které neumožnilo odpojení nemocného od umělé plicní ventilace (UPV). Přerušení antikoagulační léčby vedlo k časným trombotickým komplikacím v místech zavedených centrálních žilních katétrů s potřebou opětovného zahájení antikoagulační léčby nejprve v profylaktických a následně i účinných dávkách bez progrese stávající či rozvoje nové hemoragické komplikace. I přes kombinovanou antimikrobiální léčbu perzistovala u nemocného dysfunkce gastrointestinálního traktu s malabsorpcí a recidivujícími průjmy při pokusech o exkluzivní enterální výživu. Kultivační vyšetření tkáně tenkého střeva i tracheálního aspirátu potvrdilo infiltraci Mycobacterium avium. Určení citlivosti k antimikrobiálním látkám prokázalo dobrou citlivost patogenu k podávanému ciprofloxacinu a klaritromycinu a rezistenci na podávaný rifampicin.
S ohledem na těžké neurologické postižení s perzistující významnou poruchou vědomí, dependenci na UPV a vyčerpané fyzické rezervy při trvajícím kritickém stonání, probíhala další terapie v režimu zadržené léčby. Nemocný následně zemřel na komplikující nozokomiální plicní infekci (HAP/VAP) v podmínkách dlouhodobé intenzivní péče přibližně deset týdnů od stanovení diagnózy systémové mykobakteriózy.
Úvod
Mycobacterium avium je ubikvitárně se vyskytující grampozitivní tyč patřící do skupiny netuberkulózních mykobaktérií Mycobacterium avium complex (MAC), která je díky své odolnosti vůči nepříznivým environmentálním podmínkám schopna přežívat měsíce i roky ve vodě či půdě. Většina jedinců přirozeně vystavených MAC nevyvine manifestní onemocnění [1]. V případě alterace buněčné imunity (imunosupresivní léčba, HIV aj) však dochází ke ztrátě imunosurveillance a narůstá riziko jeho vzplanutí. Spolu s narůstajícím počtem imunosuprimovaných nemocných narůstá i incidence netuberkulózních mykobakteriálních onemocnění [2].
Základní fakta
Mycobacterium avium complex (MAC) je skupina netuberkulózních mykobaktérií (NTM) zahrnující Mycobacterium avium, Mycobacterium intracellulare a další (Mycobacterium arosiense, Mycobacterium bouchedurhonense, Mycobacterium chimaera, Mycobacterium colombiense, Mycobacterium marseillense, Mycobacterium timonense, Mycobacterium vulneris a Mycobacterium yongonense) [3]. Mycobacterium avium je aerobní, grampozitivní, acidorezistentní a extrémně pomalu rostoucí tyč, která je díky silné hydrofobní stěně bohaté na lipidy vysoce odolná vůči nepříznivým environmentálním podmínkám, dezinfekcím a antimikrobiálním látkám. I přes všeobecné rozšíření těchto organizmů jsou onemocnění jimi způsobená relativně vzácná. Data o incidenci onemocnění NTM nejsou konzistentní vzhledem k významné heterogenitě sledovaných populací, obtížnému rozlišení kolonizace NTM od aktivního onemocnění a faktu, že onemocnění NTM v některých zemích často nepodléhá povinnému hlášení. Spolu s celosvětově narůstajícím počtem imunosuprimovaných pacientů však narůstá i incidence netuberkulózních mykobakteriálních onemocnění [2]. Ve studiích byla opakovaně prokázána vyšší incidence NTM onemocnění u jedinců užívajících léčbu s vysokým imunosupresivním potenciálem [3,4]. Např. pacienti léčení anti-tumor necrosis factor-α (TNFα; infliximab, adalimumab, etanercept) měli vyšší incidenci NTM onemocnění ve srovnání s běžnou populací. Incidence NTM onemocnění byla v provedené studii vysoká při léčbě anti-TNFα bez ohledu na základní onemocnění (revmatoidní artritida aj) a narůstala s věkem [4]. Rizikové faktory pro rozvoj NTM onemocnění jsou shrnuty v tab. 2. Vliv na stoupající incidenci onemocnění má nepochybně i pokrok v užívaných diagnostických metodách, jejich široká dostupnost (CT) a rostoucí preciznost. K nákaze NTM dochází typicky inhalací infekčního aerosolu nebo ingescí mikroorganizmů. Nejběžnější cestou infekce MAC u imunokompetentních nemocných je respirační trakt. Mezilidský přenos nebyl pozorován. Preexistující chronická plicní onemocnění (chronická obstrukční plicní nemoc, cystická fibróza, pneumokonióza, deficit α1-antitrypsinu aj) je pravděpodobně základním rizikovým faktorem pro rozvoj plicního postižení v případě inhalace MAC u jinak imunokompetentních jedinců [3]. Konkrétně, chronická obstrukční plicní nemoc (CHOPN) a bronchiální astma byly v provedených studiích spojeny s 9násobně, resp. 5násobně vyšším rizikem rozvoje NTM asociovaného postižení plic [5]. Ingesce mikroorganizmů představuje primární bránu vstupu MAC u imunosuprimovaných nemocných (HIV, imunosupresivní léčba a jiné). Nejčastějším patogenem způsobujícím onemocnění v této populaci pacientů je Mycobacterium avium. Vysoká odolnost MAC, resp. Mycobacterium avium, vůči kyselým žaludečním podmínkám je zásadní pro jeho schopnost kolonizovat gastrointestinální trakt. Během dlouhé preklinické periody (2–5 let) MAC perzistuje a množí se v subepiteliálních makrofázích zažívacího traktu. Pro progresi onemocnění je charakteristické množení MAC v makrofázích a zvýšení počtu MAC infikovaných makrofágů. Tento proces je pravděpodobně silně asociován s imunitní kompetencí hostitele. Většina jedinců přirozeně vystavených MAC nevyvine manifestní onemocnění [1]. Další možnou cestou průniku MAC do organizmu hostitele může být i přímá inokulace mikroorganizmu do preexistující kožní léze (expozicí mikroorganizmu v bazénech, akváriích či přírodních vodách), při invazivním zákroku s porušením kožní či slizniční integrity (chirurgický výkon, injekce, piercing a jiné) či traumatu. Riziko rozvoje onemocnění je pravděpodobně spojeno i s náloží mykobakterií, které je nemocný exponován, a jejich virulencí. V některých případech může i u imunokompetentního jedince vést k rozvoji onemocnění vystavení neobvykle vysokému množství patogenů [3].
![Rizikové faktory pro NTM onemocnění. Upraveno podle [12]](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/e343b8a80896d6d894fccfb293bb27df.png)
Imunitní odpověď hostitele na přítomnost mykobakterií je založena na intaktní kooperaci monocytomakrofágového systému (antigen-prezentující buňky – monocyty, makrofágy a dendritické buňky) a lymfocytů (T-lymfocyty a NK buňky). Lze konstatovat, že důležité postavení v imunitní kontrole rozvoje a propagace infekce MAC mají všechny komponenty vrozené i adaptivní imunity: rozpoznání a ingesce mykobakterií monocyty-makrofágy, prezentace antigenních epitopů, centrální imunomodulační aktivita dendritických buněk i neporušená aktivace T-lymfocytů a NK buněk prostřednictvím cytokinů (IL12, INFγ aj). Imunitní deficit (vrozený, získaný) na kterékoliv z těchto úrovní může vést ke ztrátě kontroly nad replikací a invazí MAC a rozvoji orgánově specifického či diseminovaného onemocnění.
Klinická manifestace a diagnostika
Při ztrátě kontroly imunitního systému hostitele nad replikací mykobakterií může dojít k jejich nekontrolovanému množení, další imunomodulaci navozenou interakcí mykobakterií a imunitního systému, diseminaci mikroorganizmů a manifestnímu onemocnění. MAC infekce se může manifestovat lymfadenopatií, postižením kůže a měkkých tkání, plicním postižením, infiltrací zažívacího traktu a diseminovaným onemocněním.
Lymfadenitida je nejběžnějším mimoplicním onemocněním způsobeným MAC. Postihuje primárně imunokompetentní děti ve věku od 1 do 5 let a manifestuje se unilaterální krční lymfadenopatií. Bez léčby dochází často ke spontánní regresi nálezu. V některých případech však může dojít k supurativnímu postižení uzlin s kožními erozemi vedoucími k chronickým fistulizacím a jizevnatění [3].
Měkkotkáňová a kožní onemocnění NTM bývají často způsobena přímou inokulací mikroorganizmu. Kožní postižení může být i první manifestací diseminovaného NTM onemocnění u imunokompromitovaných nemocných. Mezi první příznaky může patřit pomalu progredující kožní indurace s následným rozvojem nodulárních lézí, papul, pustul, či rekurentních abscesů. Ve srovnání s jinými pyogenními kožními infekcemi je většina NTM kožních projevů nebolestivá (výjimkou je onemocnění Mycobacterium hemophillum), chybí systémové známky inflamace a lokální lymfadenopatie [6]. Jedná se o velmi pomalu progredující onemocnění. Variabilita a nespecifičnost kožních projevů může vést k opoždění ve stanovení diagnózy, a tedy i v zahájení adekvátní léčby. První příznaky často předcházejí stanovení diagnózy o 4 měsíce až 10 let [3].
Většina nemocných s NTM plicním postižením se prezentuje chronickým kašlem, často bez doprovodných příznaků v podobě horeček či hmotnostního úbytku, které jsou typické pro nemocné s pokročilým onemocněním. Stanovení diagnózy bývá také často opožděno díky nespecifickým symptomům, které vznikají v terénu preexistujícího plicního onemocnění [5]. NTM postižení plic může být zjištěno i u asymptomatických nemocných na podkladě náhodného radiologického nálezu bronchiektazií či nodularit při vyšetření z jiné indikace.
Diseminované onemocnění typické pro imunokompromitované nemocné se projevuje vysokými horečkami, nočními poty, hmotnostním úbytkem, anorexií, abdominálními bolestmi a průjmy [7]. Laboratorně bývá přítomna anémie, trombocytopenie, elevace transamináz, alkalické fosfatázy a laktátdehydrogenázy. Grafická vyšetření prokazují difuzní hrudní a abdominální lymfadenopatii, hepatosplenomegalii anebo zesílení intestinální stěny. Endoskopický obraz gastrointestinální infiltrace není patognomický a k vyloučení/potvrzení infiltrace tkáně NTM je nezbytné histologické vyšetření z biopsie postižené tkáně. Existují i kazuistické případy NTM infiltrace CNS [8].
Diagnostika NTM onemocnění je postavena na souboru korespondujících klinických, laboratorních, radiologických, histologických, molekulárně genetických a kultivačních vyšetření. Aktuální diagnostická kritéria pro NTM onemocnění vychází z doporučení odborných společností American Thoracic Society/Infectious Diseases of America (ATS/IDSA) [9] i České pneumologické a ftizeologické společnosti [10].
Základním diagnostickým testem je histologické vyšetření prokazující tkáňové poškození specifickým granulomatózním procesem s možným průkazem grampozitivních acidorezistentních tyčí pozitivně barvených dle Ziehla-Neelsena. Efektivní a rychlou diagnostickou metodou je molekulárně genetická (PCR) detekce DNA mykobakterií v tělních tekutinách, sekretech a tkáních. Přes vysokou senzitivitu i specificitu nelze pouze na základě detekce NTM-DNA spolehlivě odlišit pouhou kolonizaci/přítomnost mikroorganizmů od aktivního infekčního procesu. Velkým přínosem molekulárně genetických metod je rychlost získání výsledků a možnost spolehlivého odlišení NTM od kmenů Mycobacterium tuberculosis. Zlatým standardem a stěžejním vyšetřením v diagnostice/detekci NTM onemocnění stále zůstává kultivační vyšetření, které umožňuje další analýzu izolovaného mikroorganizmu včetně určení citlivosti k antimikrobiálním látkám. Samotný pozitivní kultivační záchyt MAC však také není dostatečný ke stanovení diagnózy MAC onemocnění. Vedle těchto mikrobiologických je k diagnóze nezbytné naplnění i kritérií klinických. Ve studiích bylo opakovaně prokázáno, že i při pozitivním kultivačním záchytu NTM ve sputu, nemusí dojít k rozvoji NTM onemocnění [3].
Z radiologických metod je při podezření na NTM plicní onemocnění indikováno provedení výpočetní tomografie (Computed Tomography – CT), nejlépe v modu vysokého rozlišení (High Resolution Computed Tomography – HRCT). Alternativami mohou být zobrazení magnetickou rezonancí (Magnetic Resonance Imaging – MRI) nebo hybridní metody jako pozitronová emisní tomografie/CT (PET/CT). Radiologický obraz plicního onemocnění NTM zahrnuje široké spektrum nálezů od solitárních nodularit přes mnohočetné noduly s bronchiektaziemi po rozsáhlé fibrokavitární onemocnění [7]. Všechny zmíněné zobrazovací metody jsou rovněž vhodné k identifikaci lymfadenopatie či jiného/dalšího tkáňového a orgánového postižení v případě diseminovaného NTM onemocnění. Všechna mikrobiologická vyšetření musí být pečlivě interpretována v kontextu klinického stavu pacienta a radiologického nálezu. Zásadní je odlišení kolonizace NTM od aktivního onemocnění.
V diferenciální diagnostice je důležité vyloučit zejména Whippleho nemoc s obdobnými gastrointestinálními klinickými příznaky a histologickým nálezem (PAS pozitivní makrofágy). Diagnostické je opět PCR vyšetření z tkáňové biopsie. Dalšími původci chronického infekčního postižení GIT imunokompromitovaných jedinců mohou být Campylobacter spp., Giardia spp., Amebae spp., Cryptosporidium spp., HIV aj.
Léčba
Léčba infekcí způsobených NTM spočívá v podávání kombinace chemoterapeutik spolu s léčbou základního imunopatologického onemocnění (např. HIV) a redukcí případné imunosupresivní léčby a v případě potřeby i v chirurgickém odstranění postižených tkání.
Pomalu rostoucí NTM bývají obvykle citlivá na následující antimikrobiální látky: isoniazid, rifampicin a rifambutin, etambutol, aminoglykosidy, makrolidy, chinolony a sulfametoxazol. Pokud nejsou známy lékové rezistence, skládá se indukční léčba většinou z trojkombinace antimykobakteriálních léčiv zahrnujících makrolid (klaritromycin ev. azitromycin), rifampicin a etambutol. Dávkování léčiv je závislé na závažnosti onemocnění, tělesné hmotnosti nemocného a případných orgánových dysfunkcích (játra, ledviny). Následuje dlouhodobá udržovací léčba v délce 12 měsíců po negativní kultivaci na NTM. Monoterapie bývá asociována s rozvojem lékových rezistencí. Konkrétní léčebné režimy jsou indikovány dle doporučení ATS a IDSA a dle recentního doporučení British Thoracic Society [9,11] i České pneumologické a ftizeologické společnosti [10]. K adekvátní léčbě NTM infekce je nezbytné vyšetření citlivosti konkrétního mikroorganizmu k antimykobakteriální léčbě, které by mělo být součástí kultivačního vyšetření již při diagnostice. Avšak in vitro určení citlivosti NTM nemusí korelovat s citlivostí in vivo a tedy s klinickou responzí na léčbu [3].
Jedním z potenciálních problémů léčby antimykobakteriologiky jsou četné lékové interakce. Tyto preparáty mohou indukovat či inhibovat funkci CYP3A a ovlivňovat tak hladiny současně užívaných imunosupresiv metabolizovaných stejným enzymatickým komplexem. Např. rifampicin je silným induktorem CYP3A vedoucím k poklesu hladiny současně podávaných kalcineurinových inhibitorů (cyklosporin A, takrolimus, sirolimus aj). Naopak zvýšenou hladinu uvedených imunosupresiv můžeme očekávat v kombinaci s léčbou makrolidy, které jsou inhibitory uvedeného cytochromu.
Vzhledem k významné orgánové toxicitě řady antimykobakteriologik, zvláště pak při jejich dlouhodobém a kombinovaném podávání, je při volbě indukčního i udržovacího léčebného režimu nezbytné opakovaně vyhodnocovat poměr benefitů a rizik této léčby, a to včetně pravidelné monitorace orgánových funkcí (hepatotoxicita, nefrotoxicita, neurotoxicita). Příkladem může být potencovaný nefrotoxický efekt současné léčby cyklosporinem A a aminoglykosidy.
Závěr
Onemocnění způsobená netuberkulózními mykobakteriemi jsou v obecné populaci raritní. Nicméně u jedinců s určitými predispozicemi a vyšším rizikem NTM infekce (chronická plicní onemocnění) je vhodné na ně pomýšlet a tuto eventualitu při dobré dostupnosti molekulárně genetické diagnostiky vždy vyloučit v případech na léčbu nereagující či netypicky probíhající infekce anebo typického morfologického nálezu bez jasného záchytu infekčního agens. Ve stále rostoucí populaci nemocných s imunodeficitem (zejména potransplantační imunosuprese, biologická léčba a HIV/AIDS) je nezbytné v suspektních klinických situacích seriózně zvažovat právě tento typ infekční komplikace, podniknout proaktivní kroky k rychlé diagnostice a časné adekvátní léčbě. Nekontrolované diseminované NTM onemocnění může vést k orgánovému postižení a zejména u zmíněné skupiny nemocných významně ovlivnit morbiditu a mortalitu. V neposlední řadě je třeba mít na paměti také významnou toxicitu antimykobakteriální léčby a její četné lékové interakce. Nejen z těchto důvodů je velmi vhodná úzká spolupráce ošetřujícího lékaře jakékoliv specializace s mikrobiology/infektology a pneumology, popřípadě také s klinickými farmaceuty.
Podpořeno Programem rozvoje vědních oborů Univerzity Karlovy (PROGRES – projekt Q39), Projektem CZ.02.1.01/0.0/0.0/16_019/0000787, Centrum výzkumu infekčních onemocnění, udělený MŠMT, financovaný EFRR a Projektem institucionálního výzkumu MZČR – FNPl 00669806.
MUDr. Marcela Královcová
I. interní klinika LF UK a FN Plzeň
Doručeno do redakce 17. 8. 2018
Přijato po recenzi: 30. 10. 2018
Sources
- Atreya R, Bülte M, Gerlach GF et al. Facts, myths and hypotheses on zoonotic nature of Mycobacterium avium subspecies paratuberculosis. Int J Med Microbiol 2014; 304(7): 858–867. Dostupné z DOI: <http://dx.doi.org/10.1016/j.ijmm.2014.07.006>.
- Yoo JW, Jo KW, Kim SH et al. Incidence, characteristics, and treatment outcomes of mycobacterial diseases in transplant recipients. Transpl Int 2016; 29(5): 549–558. <http://dx.doi.org/10.1111/tri.12752>.
- Daley CL. Mycobacterium avium Complex Disease. Microbiol Spectr 2017; 5(2): 125–130. Dostupné z DOI: <http://dx.doi.org/10.1128/microbiolspec.TNMI7–0045–2017>.
- Winthrop KL, Baxter R, Liu L et el. Mycobacterial diseases and antitumour necrosis factor therapy in USA. Ann Rheum Dis 2013; 72(1): 37–42. Dostupné z DOI: <http://dx.doi.org/10.1136/annrheumdis-2011–200690>.
- Marras TK, Campitelli MA, Kwong JC et al. Risk of nontuberculous mycobacterial pulmonary disease with obstructive lung disease. Eur Respir J 2016; 48(3): 928–931. Dostupné z DOI: <http://dx.doi.org/10.1183/13993003.00033–2016>.
- Piersimoni C, Scarparo C. Extrapulmonary infections associated with nontuberculous mycobacteria in immunocompetent persons. Emerg Infect Dis 2009; 15(9): 1351–8; quiz 1544. Dostupné z DOI: <http://dx.doi.org/10.3201/eid1509.081259>.
- Stout JE, Koh WJ, Yew WW. Update on pulmonary disease due to non-tuberculous mycobacteria. Int J Infect Dis 2016; 45 : 123–134. Dostupné z DOI: <http://dx.doi.org/10.1016/j.ijid.2016.03.006>.
- Murray R, Mallal S, Heath C et al. Cerebral mycobacterium avium infection in an HIV-infected patient following immune reconstitution and cessation of therapy for disseminated mycobacterium avium complex infection. Eur J Clin Microbiol Infect Dis 2001; 20(3): 199–201.
- Griffith DE, Aksamit T, Brown-Elliott BA et al. An official ATS/IDSA statement: diagnosis, treatment, and prevention of nontuberculous mycobacterial diseases. Am J Respir Crit Care Med 2007; 175(4): 367–416. Dostupné z DOI: <http://dx.doi.org/10.1164/rccm.200604–571ST>. Erratum in Am J Respir Crit Care Med. 2007 Apr 1; 175(7): 744–745.
- Bártů V. Doporučený postup pro diagnostiku a léčbu netuberkulózních mykobakterióz dospělých. Česká pneumologická a ftizeologická společnost ČLS JEP. 2016. Dostupné z WWW: <www.pneumologie.cz/guidelines/>.
- Haworth CS, Banks J, Capstick T et al. British Thoracic Society Guideline for the management of non-tuberculous mycobacterial pulmonary disease (NTM-PD). BMJ Open Respir Res 2017; 4(1): e000242. Dostupné z DOI: <http://dx.doi.org/10.1136/bmjresp-2017–000242>.
- Khalid Ahmed Al-Anazi et al. Infections caused by non-tuberculosis mycobacteria in recipients of hematopoetic stem cell transplantation. Front Oncol 2014; 4 : 311. Dostupné z DOI: <http://dx.doi.org/10.3389/fonc.2014.00311>.
Labels
Diabetology Endocrinology Internal medicineArticle was published in
Internal Medicine

2019 Issue 5
-
All articles in this issue
- Limited ambulatory night sleep testing in patients with a suspicion of sleep apnoea syndrome: Is its indication tenable?
- Surgical treatment of chronic thromboembolic pulmonary hypertension
- Communication with cancer patient
- Multimodal treatment of thymic carcinoid: a case report
- Nontuberculous mycobacterial disease: a case report-based review
- Use of idarucizumab in clinical practice: a case report
- Otto Kahler and his family: II. Ripening years in Prague
- Compliance with ethical rules for scientific publishing in biomedical Open Access journals indexed in Journal Citation Reports
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue
- Communication with cancer patient
- Surgical treatment of chronic thromboembolic pulmonary hypertension
- Limited ambulatory night sleep testing in patients with a suspicion of sleep apnoea syndrome: Is its indication tenable?
- Nontuberculous mycobacterial disease: a case report-based review
